2010版中国药典
2010版中国药典知识
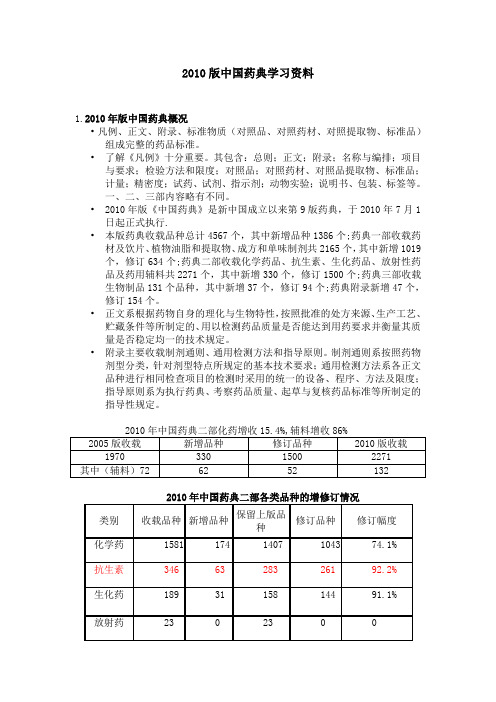
2010版中国药典学习资料1.2010年版中国药典概况•凡例、正文、附录、标准物质(对照品、对照药材、对照提取物、标准品)组成完整的药品标准。
•了解《凡例》十分重要。
其包含:总则;正文;附录;名称与编排;项目与要求;检验方法和限度;对照品;对照药材、对照品提取物、标准品;计量;精密度;试药、试剂、指示剂;动物实验;说明书、包装、标签等。
一、二、三部内容略有不同。
•2010年版《中国药典》是新中国成立以来第9版药典,于2010年7月1日起正式执行.•本版药典收载品种总计4567个,其中新增品种1386个;药典一部收载药材及饮片、植物油脂和提取物、成方和单味制剂共2165个,其中新增1019个,修订634个;药典二部收载化学药品、抗生素、生化药品、放射性药品及药用辅料共2271个,其中新增330个,修订1500个;药典三部收载生物制品131个品种,其中新增37个,修订94个;药典附录新增47个,修订154个。
•正文系根据药物自身的理化与生物特性,按照批准的处方来源、生产工艺、贮藏条件等所制定的、用以检测药品质量是否能达到用药要求并衡量其质量是否稳定均一的技术规定。
•附录主要收载制剂通则、通用检测方法和指导原则。
制剂通则系按照药物剂型分类,针对剂型特点所规定的基本技术要求;通用检测方法系各正文品种进行相同检查项目的检测时采用的统一的设备、程序、方法及限度;指导原则系为执行药典、考察药品质量、起草与复核药品标准等所制定的指导性规定。
凡例的增修订情况•新版药典凡例进行了重大修订:•1)、首次在凡例中设置总则一节。
增加了“总则”一节,将中国药典中最重要、最原则、最通用、最基础的内容集中阐明,并且做到一、二、三部之凡例的体例、结构的一致性。
内容在保留特点的基础上也基本一致。
•2)、首次明确药典制定颁布依据。
新版药典凡例总则之一明确“《中华人民共和国药典》简称《中国药典》。
《中国药典》依据《中国人民共和国药品管理法》组织制定和颁布实施”。
中国药典2010版第一部

中国药典2010版第一部摘要:一、引言二、中国药典2010版第一部的概述三、中国药典2010版第一部的主要内容1.药物的分类2.药物的命名规则3.药物的性状、鉴别与检查4.药物的炮制5.药物的制剂四、中国药典2010版第一部的应用与价值五、结论正文:一、引言中国药典是中医药行业的一部权威性法典,对药品的研究、生产、经营、使用、监督管理等方面具有重要的指导作用。
本文将重点介绍中国药典2010版第一部的相关内容。
二、中国药典2010版第一部的概述中国药典2010版第一部,简称2010版药典一部,是按照我国药品监督管理部门的要求,由中国药典委员会组织编纂的。
该书于2010年正式出版,是我国药品标准体系的重要组成部分。
三、中国药典2010版第一部的主要内容1.药物的分类2010版药典一部对药物进行了详细的分类,包括中药材、中药提取物、中药成方制剂、化学药品、生化药品、抗生素、放射性药品等。
2.药物的命名规则药典规定了药物的命名原则,包括通用名、化学名、商品名等,并对药物的命名进行了规范和统一。
3.药物的性状、鉴别与检查药典对药物的性状、鉴别与检查进行了详细的规定,包括外观性状、理化性质、鉴别方法、检查方法等,为药品的真伪鉴别提供了依据。
4.药物的炮制药典对药物的炮制进行了规范,包括炮制方法、炮制程度等,以确保药物的疗效和安全性。
5.药物的制剂药典对药物的制剂进行了详细的规定,包括制剂工艺、处方、质量要求等,以确保药品的质量和疗效。
四、中国药典2010版第一部的应用与价值2010版药典一部的出版,为药品的生产、经营、使用、监督管理等方面提供了重要的依据和指导,对提高我国药品质量、保障人民用药安全有效具有重要意义。
五、结论中国药典2010版第一部是中医药行业的一部权威性法典,对药品的研究、生产、经营、使用、监督管理等方面具有重要的指导作用。
中国药典2010年版

影响吸收的因素:
1. 眼睑缝隙损失(7~30μl,1滴药液约50~70μl) 2. pH和pKa值(分子型>离子型药物,双亲性药物更易吸收) 3. 刺激性、表面张力、粘度等 4. 外周血管消除(结膜→外周→消除)
2013-7-30
Page 19
附录ⅠG 眼用制剂增修概况与解读(一)
滴眼剂 系指由药物与适宜辅料制成的供滴入眼内的无菌液体制
3. 给药途径多(胃肠道、腔道、皮肤、粘膜等)
4. 可降低某些药物的刺激性(如碘或溴化物等) 5. 可提高某些药物AUC 6. 但不稳定(物理、化学与生物学)、携带和运输不便、可能含防腐剂等
2013-7-30
Page 22
附录ⅠC 酊剂增修概况与解读
酊剂
系指将药物用规定浓度的乙醇浸出或溶解而制成的澄清液 体制剂,也可用流浸膏稀释制成。供口服或外用。
2013-7-30
Page 20
附录ⅠG 眼用制剂增修概况与解读(二)
除另有规定外,眼用制剂应进行以下相应检查 (必检项目)
【渗透压摩尔浓度】 除另有规定外,水溶液型滴眼剂、洗眼剂和 眼内注射溶液按各品种项下的规定,照渗透压摩尔浓度测定法(附 录Ⅸ G)检查,应符合规定。 【无菌】 (眼内注射溶液、眼内插入剂及供手术、伤口、角膜穿通伤用的眼用 制剂,)照无菌检查法(附录Ⅺ H(J))检查,应符合规定。 删除【微生物限度】检查
2013-7
定义:丸剂系指药物与适宜的辅料以适当方法制成的球状或类球状
固体制剂。
基本分类:滴丸、糖丸、小丸等。
滴丸 系指固体或液体药物与适宜的基质加热熔融后溶解、乳化或混 悬于基质中,再滴入不相混溶、互不作用的冷凝(液)介质中,…。 糖丸 系指以适宜大小的糖粒或基丸为核心,用糖粉和其他辅料的混 合物作为(撒粉)材料,…。 生产与贮藏期间(一般要求): 第四点:…供口服的滴丸或小丸可包糖衣或薄膜衣。必要时,薄膜包 衣丸应检查残留溶剂(与片剂要求一致)
2010药典四部

2010年中国药典第四部指的是《中华人民共和国药典》2010年版第四部,是药品标准的权威法定文献,是药品研制、生产、经营、使用和监督管理等均应遵循的法定依据。
2010年中国药典第四部主要包括通则、制剂通则、检验方法和指导原则等内容,收载品种总计4567种,其中新增1386种,修订634种。
其中,通则包括制剂通则、检验方法、指导原则、标准物质和试液试药相关通则等,共计317个,其中制剂通则38个、检测方法240个、指导原则30个、标准物质和对照品相关通则9个。
2015年中国药典第四部收载通则,包括:制剂通则、检验方法、指导原则、标准物质和试液试药相关通则、药用辅料等。
首次将上版药典附录整合为通则,并与药用辅料单独成卷作为新版药典四部。
四部收载通则总数317个,其中制剂通则38个、检测方法240个、指导原则30个、标准物质和对照品相关通则9个;药用辅料收载270种,其中新增137种、修订97种。
中国药典(2010版)

4附录XIX C 原料药与药物制剂稳定性试验指导原则稳定性试验的目的是考察原料药或药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。
稳定性试验的基本要求是:(1)稳定性试验包括影响因素试验、加速试验与长期试验。
影响因素试验用1批原料药或1批制剂进行。
加速试验与长期试验要求用3批供试品进行。
(2)原料药供试品应是一定规模生产的,供试品量相当于制剂稳定性试验所要求的批量,原料合成工艺路线、方法、步骤应与大生产一致。
药物制剂供试品应是放大试验的产品,其处方与工艺应与大生产一致。
药物制剂如片剂、胶囊剂,每批放大试验的规模,片剂至少应为10000片,胶囊剂至少应为10000粒。
大体积包装的制剂如静脉输液等,每批放大规模的数量至少应为各项试验所需总量的10倍。
特殊品种、特殊剂型所需数量,根据情况另定。
(3)供试品的质量标准应与临床前研究及临床试验和规模生产所使用的供试品质量标准一致。
(4)加速试验与长期试验所用供试品的包装应与上市产品一致。
(5)研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检查方法,并对方法进行验证,以保证药物稳定性试验结果的可靠性。
在稳定性试验中,应重视降解产物的检查。
(6)由于放大试验比规模生产的数量要小,故申报者应承诺在获得批准后,从放大试验转入规模生产时,对最初通过生产验证的3批规模生产的产品仍需进行加速试验与长期稳定性试验。
本指导原则分两部分,第一部分为原料药,第二部分为药物制剂。
4.1一、原料药原料药要进行以下试验。
4.1.1(一)影响因素试验此项试验是在比加速试验更激烈的条件下进行。
其目的是探讨药物的固有稳定性、了解影响其稳定性的因素及可能的降解途径与降解产物,为制剂生产工艺、包装、贮存条件和建立降解产物分析方法提供科学依据。
供试品可以用1批原料药进行,将供试品置适宜的开口容器中(如称量瓶或培养皿),摊成≤5mm厚的薄层,疏松原料药摊成≤1 0mm厚的薄层,进行以下试验。
中国药典2010版第一部

中国药典2010版第一部
摘要:
1.介绍《中国药典2010 版第一部》
2.该版本的主要内容和更新
3.《中国药典》的历史和作用
4.《中国药典》对中医药发展的影响
正文:
《中国药典2010 版第一部》是我国国家级的药品标准规范,对药品的研发、生产、质量控制以及药品的流通和使用等方面具有重要的指导意义。
《中国药典》是我国药品标准的核心,它的每一次更新都受到广泛的关注。
2010 版第一部的《中国药典》是对前一版的修订和完善,主要包括了中药、化学药品、生物制品等各类药品的标准。
此次修订,对药品的收载数量、质量标准、检验方法等方面都进行了大幅度的提升和改进,以适应我国药品研发和生产的新需求。
《中国药典》的历史可以追溯到1953 年,其初衷是为了规范药品的生产和使用,保障人民的用药安全。
从那时起,《中国药典》已经经历了多次修订,每一次修订都反映出我国药品标准的进步,以及药品研发和生产技术的提升。
《中国药典》对我国中医药的发展起到了重要的推动作用。
一方面,它规范了中医药的生产和使用,保障了人民的用药安全。
另一方面,它推动了中医药的现代化进程,促进了中医药与国际接轨。
中国药典2010年版
年版截图:中国药典20102010版中国药典word版pdf版exe版电子书2010版中国药典word版pdf版exe版电子书中国药典2010年版一部正文一枝黄花(p3)YizhihuanghuaSOLIDAGINIS HERBA本品为菊科植物一枝黄花Solidago decurrens Lour.的干燥全草。
秋季花果期采挖,除去泥沙,晒干。
【性状】本品长30~lOOcm。
根茎短粗,簇生淡黄色细根。
茎圆柱形,直径0.2~0.5cm;表面黄绿色、灰棕色或暗紫红色,有棱线,上部被毛;质脆,易折断,断面纤维性,有髓。
单叶互生,多皱缩、破碎,完整叶片展平后呈卵形或披针形,长1~9cm,宽0.3~1.5cm;先端稍尖或钝,全缘或有不规则的疏锯齿,基部下延成柄。
头状花序直径约0.7cm,排成总状,偶有黄色舌状花残留,多皱缩扭曲,苞片3层,卵状披针形。
瘦果细小,冠毛黄白色。
气微香,味微苦辛。
【鉴别】 (1)叶表面观:上表皮细胞多角形,垂周壁略呈念珠状增厚。
下表皮细胞垂周壁波状弯曲,气孔不定式,略下陷。
非腺毛有两类:表皮非腺毛由3个细胞组成,壁薄,顶端1个细胞常萎缩成鼠尾状,较小;叶缘非腺毛睫毛状由3~7个细胞组成,壁稍厚,长180~500μm。
(2)取本品粉末2g,加石油醚(60~90℃)50ml,超声处理30分钟,放冷,滤过,弃去石油醚液,药渣挥干溶剂,加70%乙醇30ml,加热回流1小时,放冷,滤过,滤液蒸干,残渣加甲醇1ml使溶解,作为供试品溶液。
另取一枝黄花对照药材2 g,同法制成对照药材溶液。
再取芦丁对照品,加甲醇制成每1ml含0.5mg的溶液,作为对照品溶液。
照薄层色谱法(附录ⅥB)试验,吸取供试品溶液5~10μl、对照药材溶液和对照品溶液各5μl,分别点于同一以含4%磷酸氢二钠溶液制备的硅胶G薄层板上,以乙酸乙酯-甲醇-甲酸-水(8:1:2010版中国药典word版pdf版exe版电子书1:1)为展示剂,展开,取出,晾干,喷以3%三氯化铝乙醇溶液,晾干,置紫外光灯(365nm)下检视,供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的荧光斑点。
《中国药典》2010年版(三部)凡例、通则

附件:《中国药典》2010年版(三部)凡例、通则及附录定稿会会议纪要按照2010年版《中国药典》编制的统一安排,我委于2009年3月18-20日在京召开了2010年版《中国药典》三部凡例、通则及附录的定稿会。
来自病毒制品、细菌制品、血液制品、生物技术产品以及微生物专业委员会的相关委员、中检所和参与批签发的7个地方药检所的有关专家、我委生物制品标准处、业务综合处相关人员以及部分生物制品生产企业代表共约40人参加了会议。
会议对2010年版《中国药典》三部凡例、9个通则及16个通用性附录的增修订进行了审定,确认了下列增修订意见,会议主要内容纪要如下:一、凡例(一)、名称及编排项下,增订微生态活菌制品总论及体外诊断试剂的收载。
(二)、设施与生产质量管理项下第(2),修订为:人血液制品应使用专用设备并在专用设施内进行生产,不得与其他异种蛋白制品混用。
(三)“制造”项修订为“基本要求”,修订内容为:1、设施与生产质量管理项下增订:(4)涉及感染性材料的操作应符合国家生物安全的相关规定。
2、辅料及原料项下将“原料”修订为“原材料”,质量要求增订应符合现行《中国药典》三部的规定,“本版药典未收载者,必须制定符合药用要求的标准”修订为“本药典未收载者,必须制定符合产品生产和质量控制要求的标准”。
3、增订“七、生产过程中防腐剂使用的相关要求”项,增订内容为:1、抗生素的使用生产过程中抗生素的使用应符合以下原则:(1)除另有规定外,不得使用青霉素或其他β-内酰胺类抗生素。
(2)成品中不得使用抗生素作为防腐剂。
(3)生产过程中,应尽可能避免使用抗生素,必须使用时,应选择安全性风险相对较低的抗生素,且产品的后续纯化工艺应保证可有效去除制品中的抗生素,去除工艺应经验证;如后续工艺不能有效去除抗生素,则不得添加。
病毒性疫苗生产中应仅限于在细胞制备、细胞增殖过程中使用抗生素。
(4)生产过程中使用抗生素时,成品检定中应检测抗生素残留量,并规定残留量限值。
《中国药典》2010年版(一部)

行气止痛,活血 散瘀。用于胃 痛,风湿痹痛; (未改动) 外治牙痛,跌扑 肿痛,虫蛇咬伤 。 理气止痛,温中 助阳。用于胃寒 (未改动) 胀痛,肝胃气 痛,肾虚阳痿, 腰膝酸痛。 原功效中“消 炎”属于西医 术语,原“主 治”中的“支 气管炎,肺炎 ……晚期血吸 虫病腹水”属 于西医病名, 故而删除。参 考《广东地标 》规范为中医 习惯用病证名 。
三叉苦
苦,寒。
原标准中归 经阙如。根 据《广东地 增加“归肺 苦,寒。归肺 标》记载及 、心、肝经 、心、肝经。 功效主治特 ”。 点,补充归 经“肺、肝 ”。
三分三
苦、辛, 温;有大毒 。
苦、辛, 苦、辛,温, 温,有大毒 据《中华本 有大毒。归肝 。归肝、肾 草》主治病 、肾、脾、胃 、脾、胃、 症修订 、大肠经。 大肠经。
《中国药典》2010版中药材及饮片临床标准修订表 中国药典》2010版中药材及饮片临床标准修订表
性味归经原 性味归经修订 性味归经修 性味归经修 后 标准 订的部分 订的理由 原标准中没 将“平”性 有归经,根 改为“凉” 据《中华本 性;“微苦 微苦、辛, 辛、苦,凉。 草》及其功 ”改为“苦 平。 归肺、肝经。 效、主治特 ”。增加归 点,补充归 经“肺、肝 经内容,并 ”。 修改性味。 辛、温;有 小毒。归肝 、脾、胃经 。 辛、温;有小 毒。归肝、脾 未改动 、胃经。 功能主治修订 功能主治修订 用法用量 用法用量 用法用量修订 功能主治原标 功能主治修订后 准 的部分 的理由 原标准 修订后 的部分 疏风清热,抗 菌消炎。用于 感冒,急性咽 喉炎,扁桃体 炎,疮疖肿毒 。 祛风除湿,消 肿止痛。用于 风湿痹痛,半 身不遂,跌扑 肿痛。 温中降逆,补 肾助阳。用于 脾胃虚寒,呃 逆呕吐,食少 吐泻,心腹冷 痛,肾虚阳痿 开窍化痰,醒 脾安神。用于 热病神昏,癫 痫,神经官能 症,耳鸣耳 聋,胸闷腹 胀,食欲不 清热解毒,疏散 风热。用于喉 痹,乳蛾,咽喉 肿痛,疮疖肿 毒,风热感冒。 功效按中医术 语规范。主治 增加“喉痹, 乳蛾”,删去 西医病名 。 规范功能主治 表述,删去西 医病名,突出 9~15g。 本品外解内清 的药用特点。
中国药典2010版第一部

中国药典2010版第一部
(原创版)
目录
1.引言:介绍《中国药典》及其 2010 年版的基本信息
2.《中国药典》2010 年版的主要内容
3.第一部的特点与重要性
4.第一部的主要章节和规定
5.结论:总结《中国药典》2010 年版第一部的主要贡献和影响
正文
《中国药典》是我国药品和药用辅料、直接接触药品的包装材料和容器的法定标准,是药品研发、生产、经营、使用和监管的重要依据。
2010 年版是该药典的第五版,其第一部是其中最重要的部分,涵盖了中药的基本要求、质量标准和检验方法等内容。
第一部的主要内容包括中药的来源、性状、鉴别、检查、浸出物测定、含量测定等。
其中,来源主要规定了中药材的采收、加工、贮存等环节,以保证其质量;性状则详细描述了中药的外观、气味、味道、水试、火试等特征,以便鉴别真伪;鉴别主要通过宏观和微观特征,如形状、大小、颜色、质地、组织结构等,以及理化和生物学特性,如旋光性、折光率、硬度、黏度、PH 值、酶谱、DNA 指纹等,来判断中药的真伪和品质;检查则规定了中药的重金属、农药残留、真菌毒素、杂质等污染物的限量,以保障用药安全;浸出物测定和含量测定则是评价中药有效成分含量的重要方法。
第一部的特点在于其全面性和严谨性。
全面性体现在它对中药的全过程进行了规定,从源头到成品,从质量到安全,涵盖了中药的各个方面;严谨性则体现在它对中药的鉴别和检查等环节的规定上,采用了现代科技手段,使得中药的质量控制更加科学和准确。
第一部的主要章节有中药的来源、性状、鉴别、检查、浸出物测定、含量测定等,规定了中药的基本要求、质量标准和检验方法。
其中,鉴别章节是第一部的重点,因为它是判断中药真伪和品质的关键。
2010版中国药典-中国药典2010年版

2010版中国药典中国药典2010年版名称:《中华人民共和国药典》中国药典2010版作者:国家药典委员会出版社:中国医药科技出版社2010年10月出版开本:16开精装册数:全三卷定价:1498 元优惠价:980 元读者服务部→发行部:,内容简介:2010年版药典的鲜明特色:更新与淘汰并举、收载品种大幅增加。
药品检测项目和检测方法增加、标准提高,因而在药品安全性和质量可控性方面有更高、更多、更大提升。
二部中采用高效液相色谱法进行含量测定或用于有关物质检查的品种有近千个,系统适用性要求也更为合理,个别品种采用了分离效能更高的离子色谱法,检测器使用种类也更加多样。
中药标准有突破和创新,尤其在过去比较薄弱的中药材和中药饮片标准的新增和修订方面,如本版《中国药典》一部中动物药蛇类、植物药川贝母等,都采用了PCR检测方法。
新版药典在凡例、品种的标准要求、附录的制剂通则等方面均有较大的变化和进步。
在广泛吸取国内外先进技术和实验方法的基础上,附录内容与目前国际对药品质量控制的方法和技术力求一致,进一步发挥《中国药典》的国际影响力。
新版药典在坚持科学、实用、规范、药品安全性、质量可控性和标准先进性的原则下,力求覆盖国家基本药物目录品种和社会医疗保险报销药品目录品种。
顶尖专家扛鼎之作。
本版《中国药典》是在第九届药典委员会的精心组织下,聘请全国医药行业323位一流专家、投入巨额资金、历时两年编制而成,集中体现了当前我国药品标准工作的最新发展成果。
《中国药典》是国家监督管理药品质量的法定技术标准。
2010年版《中国药典》分为三部出版,一部为中药,二部为化学药,三部为生物制品。
各部内容主要包括凡例、标准正文和附录三部分,其中附录由制剂通则、通用检测方法、指导原则及索引等内容构成。
药典二部收载化学药品、抗生素、生化药品、放射性药品以及药用辅料等。
药典三部收载生物制品。
新版药典在凡例、品种的标准要求、附录的制剂通则和检验方法等方面均有较大的改进和发展,特别是对药品的安全性、有效性和质量可控性方面尤为重视。
中国药典2010版

中国药典2010版2010版中国药典一部word版电子书(共1026页)2010版中国药典中国药典2010年版二部word版电子书中国药典沿革1953年版(第一版) 1949年10月1日中华人民共和国成立后,党和政府十分关怀人民的医药卫生保健工作,当年11月卫生部召集在京有关医药专家研讨编纂药典问题。
1950年1月卫生部从上海抽调药学专家孟目的教授负责组建中国药典编纂委员会和处理日常工作的干事会,筹划编制新中国药典。
1950年4月在上海召开药典工作座谈会,讨论药典的收载品种原则和建议收载的品种,并根据卫生部指示,提出新中国药典要结合国情,编出一部具有民族化、科学化,大众化的药典。
随后,卫生部聘请药典委员49人,分设名词、化学药、制剂、植物药、生物制品、动物药、药理、剂量8个小组,另聘请通讯委员35人,成立了第一届中国药典编纂委员会。
卫生部部长李德全任主任委员。
1951年4月24日至28日在北京召开第一届中国药典编纂委员会第一次全体会议,会议对药典的名称、收载品种、专用名词、度量衡问题以及格式排列等作出决定。
干事会根据全会讨论的意见,对药典草案进行修订,草案于1952年底报卫生部核转政务院文教委员会批准后,第一部《中国药典》1953年版由卫生部编印发行。
本版药典共收载品种531种,其中化学药215种植物药与油脂类65种,动物药13种,抗生素2种,生物制品25种,各类制剂211种。
1957年出版《中国药典》1953年版增补本。
1963年版(第二版) 1955年卫生部组建第二届药典委员会,聘请委员49人,通讯委员68人,此届委员会因故未能开展工作。
1957年卫生部组建第三届药典委员会,聘请委员80人,药学专家汤腾汉教授为这届委员会主任委员(不设通讯委员),同年7月28日至8月5日在北京召开第一次全体委员会议,卫生部李德全部长做了药典工作报告,特别指出第2010版中国药典pdf版(共三部,400多M)2010版中国药典一部word版电子书(共1026页)一版《中国药典》未收载广大民众习用的中药的缺陷。
2010版中国药典

2010版中国药典凡例总则一、《中华人民共和国药典》简称《中国药典》,依据《中华人民共和国药品管理法》组织制定和颁布实施。
《中国药典》一经颁布实施,其同品种的上版标准或其原国家标准即同时停止使用。
《中国药典》由一部、二部、三部及其增补本组成,内容分别包括凡例、正文和附录。
除特别注明版次外,《中国药典》均指现行版《中国药典》。
本部为《中国药典》二部。
二、国家药品标准由凡例与正文及其引用的附录共同构成。
本部药典收载的凡例、附录对药典以外的其他中药国家标准具同等效力。
三、凡例是为正确使用《中国药典》进行药品质量检定的基本原则,是对《中国药典》正文、附录及与质量检定有关的共性问题的统一规定。
四、凡例和附录中采用的“除另有规定外”这一用语,表示存在与凡例或附录有关规定不一致的情况时,则在正文中另作规定,并按此规定执行。
五、正文中引用的药品系指本版药典收载的品种,其质量应符合相应的规定。
六、正文所设各项规定是针对符合《药品生产质量管理规范》(Good Manufacturing Practices, GMP)的产品而言。
任何违反GMP 或有未经批准添加物质所生产的药品,即使符合《中国药典》或按照《中国药典》没有检出其添加物质或相关杂质,亦不能认为其符合规定。
七、《中国药典》的英文名称为Pharmacopoeia of The People’s Republic of China, 英文简称Chinese Pharmacopoeia;英文缩写为Ch.P.。
正文八、正文系根据药物自身的理化与生物学特性,按照批准的处方来源、生产工艺、贮藏运输条件等所制定的、用以检测药品质量是否达到用药要求并衡量其质量是否稳定均一的技术规定。
九、正文项下根据品种和剂型不同,按顺序可分别列有:(1)品名(包括中文名称、汉语拼音与英文名);(2)有机药物的结构式;(3)分子式与分子量;(4)来源或有机药物的化学名称;(5)含量或效价规定;(6)处方;(7)制法;(8)性状;(9)鉴别;(10)检查;(11)含量或效价测定;(12)类别;(13)规格;(14)贮藏;(15)制剂等。
《中国药典》(2010年版)药品名称与原药品名称对照表

附表一: 《中国药典》(2010年版)药品名称( 中国药典》(2010年版 附表一: 《中国药典》(2010年版)药品名称(生物制品通用名 与原药品名称(生物制品通用名称) 称)与原药品名称(生物制品通用名称)对照表
2010年版药典名称 硝苯地平软胶囊 硝酸益康唑喷雾剂 硫糖铝咀嚼片 氯法齐明软胶囊 碘化油软胶囊 樟脑(天然) 樟脑(合成) 伤寒甲型副伤寒联合疫苗 ) 2005年版药典名称 硝苯地平胶丸 硝酸益康唑喷剂 硫糖铝片 氯法齐明胶丸 碘化油胶丸 樟脑 樟脑 伤寒副伤寒甲联合疫苗 伤寒副伤寒甲乙联合疫苗 重组乙型肝炎疫苗(酵母)
附表一: 《中国药典》(2010年版)药品名称( 中国药典》(2010年版 附表一: 《中国药典》(2010年版)药品名称(生物制品通用名 与原药品名称(生物制品通用名称) 称)与原药品名称(生物制品通用名称)对照表
2010年版药典名称 口服补液盐散(I) 口服补液盐散(Ⅱ) 门冬酰胺酶(埃希) 注射用门冬酰胺酶(埃希) 门冬酰胺酶(欧文) 注射用门冬酰胺酶(欧文) 甘油果糖氯化钠注射液 布洛芬混悬滴剂 甲硝唑氯化钠注射液 异维A酸软胶囊 阿米三嗪萝巴新片 苯丙醇软胶囊 复方醋酸地塞米松乳膏 盐酸萘甲唑啉 盐酸萘甲唑啉滴鼻液 辅酶Q10软胶囊 维生素A软胶囊 维生素AD软胶囊 维生素D2软胶囊 维生素E软胶囊 替硝唑氯化钠注射液 2005年版药典名称 口服补液盐I 口服补液盐Ⅱ 门冬酰胺酶 注射用门冬酰胺酶 门冬酰胺酶 注射用门冬酰胺酶 甘油果糖注射液 布洛芬滴剂 甲硝唑注射液(100ml:0.5g; 250ml:0.5g; 250ml:1.25g) 异维A酸胶丸 复方阿米三嗪片 苯丙醇胶丸 复方地塞米松乳膏 盐酸萘甲唑林 盐酸萘甲唑林滴鼻液 辅酶Q10胶丸 维生素A胶丸 维生素AD胶丸 维生素D2胶丸 维生素E胶丸 替硝唑注射液
《中国药典》2010年版附录部分内容

通用检测方法和指导原则主要增修订内容
1、一部共16项,其中新增6项:
电泳测定法
渗透压摩尔浓度测定法
等离子体发射光谱法 大孔树脂有机残留物测定法 聚合酶链式反应法 中药特征图谱指导原则
通用检测方法和指导原则主要增修订内容
2、二部共45项,新增12项:
核磁共振波谱法 离子色谱法 电导率测定法 锥入度检查法 2-乙基己酸测定法 光学显微镜法 拉曼光谱法指导原则 溶出度测定指导原则 药物多晶型研究指导原则 蛋白质含量测定法 合成多肽中醋酸测定法 氨基酸测定指导原则
通用检测方法和指导原则主要增修订内容
离子色谱法
1、有机、无机阴阳离子和低分子量亲水性 有机分子的分离测定 2、氨基酸不经衍生化直接测定 3、某些抗生素的有关物质检查 4、金属的形态与价态分析
通用检测方法和指导原则主要增修订内容
拉曼光谱法指导原则 1、与红外光谱一样,同为分子的振动光谱 ∞ Ψ IR 与偶极矩变化相关│Mnm│= ∫ n ΡΨm dτ
紫外-可见分光光度法 1、波长校正 增加了高氯酸钬溶液的校正(以10% 高氯酸为溶剂,配制含4%氧化钬的溶液) λmax nm:241.13,278.10,287.18,333.44, 345.47,361.31,416.28,451.30, 485.29,536.64,640.52nm。 2、波长允差 紫外区 ±1nm 500nm ±2nm 700nm ±4.8nm
通用检测方法和指导原则主要增修订内容
酸败度检查法 羰基值的原计算公式有误 A 羰基值= 854 ×W V ×1000 V 1、854的各种醛的2,4-二硝基苯腙的ε ,而不是mε 2、V1 供试品稀释总体积 V2 测定用供试品稀释液体积 S 25ml
中国药典2010版

中国药典2010版中国药典(Chinese Pharmacopoeia,简称CP)是指在我国境内生产或进口药品的生产、经营和使用过程中使用的标准规范文献。
而中国药典2010版是一部重要的药品标准参考书,是指导我国药品生产和使用的权威性文件。
1. 药典的作用和意义中国药典的编制和实施对于保证药品的质量、安全和有效性具有重要意义。
它提供了药品质量标准的基础,帮助药品生产企业进行药品质量控制和质量管理,保障人民群众的用药安全。
中国药典2010版作为最新的版本,对药品的质量标准进行了全面更新和修订。
它的发布完善了我国的药品法规体系,提高了整个药品行业的水平,推动了我国药品产业的发展。
2. 中国药典2010版的特点中国药典2010版相对于之前的版本,在以下几个方面有了新的特点和改进。
2.1 引入PH. Eur.和USP标准中国药典2010版大量引进了“欧洲药典”(PH. Eur.)和“美国药典”(USP)的标准。
这些国际药典在药品质量标准方面具有较高的权威性和国际认可度,引入这些标准有助于我国药典与国际接轨,提高药品质量标准的水平。
2.2 严格审定药品成分和质量标准中国药典2010版在药品成分和质量标准的审定方面更加严格和细致。
通过严格的实验研究和论证,确保药品的质量和有效性,并杜绝了劣质药品的生产和流通。
2.3 增加新药品和新疗法的标准随着医学科学的不断发展,新药品和新疗法层出不穷。
中国药典2010版增加了一批新药品和新疗法的标准,覆盖了更多的治疗领域,使得中国药典更加全面和实用。
3. 中国药典2010版的应用中国药典2010版主要应用在以下几个方面:3.1 药品注册和审批药品企业在进行药品注册和药品审批时需要参考中国药典2010版的相关标准。
只有符合药典标准的药品才能够获得批准生产和销售。
3.2 药品质量控制药品生产企业在生产过程中需要参照中国药典2010版的标准进行质量控制。
通过严格控制生产环节和检验程序,确保药品的质量符合标准要求。
2010版中国药典

(二)中药品种分别增加和完善了 安全性质控指标
• 二是在中药正文标准中增加或完善安全性检查 项目。 • 如对易霉变的桃仁、杏仁等新增黄曲霉素检测, 方法和限度与国际一致;在正文标准中全面禁 用苯作为溶剂;对工艺中使用有机溶剂的均检 查有机溶剂残留;对川乌、草乌、马钱子等剧 毒性饮片,采用高效液相色谱法(HPLC)等更 先进、更精确的方法加以限量检查。
• 2010年版《中国药典》的一个主要特点 就是,大幅增加了中药饮片标准的收载 数量,初步解决了长期困扰中药饮片产 业发展的国家标准较少、地方炮制规范 不统一等问题。对于提高中药饮片质量, 保证中医临床用药的安全有效,推动中 药饮片产业健康发展,将起到积极的作 用。
(四)大幅增加符合中药特点的专 属性鉴定
(一)中药收取物标准大幅提升,一举改 变和扭转长期以来收载品种少、基础差, 尤其是中药饮片缺乏标准的局面。在中 药资源保护及其相关标准技术创新得到 跨越式发展。
(二)中药品种分别增加和完善了 安全性质控指标
• 一是在中药附录中加强安全性检查总体要求。 • 如在附录制剂通则中,口服酊剂增订甲醇限量 检查,橡胶膏剂首次提出不得检出致病菌检查 要求等;在附录检测方法中,新增二氧化硫残 留量测定法、黄曲霉毒素测定法、渗透压摩尔 浓度测定法、异常毒性检查法、降压物质检查 法、过敏反应检查法、溶血与凝聚检查法等。
附录
新增 一部 二部 三部 14 15 18 修订 47 69 39
主要特点: 主要特点:
• 一、药品安全性得到进一步保障 • 二、中药标准整体水平全面提升
• (一)中药收载品种数量大幅度提高 • (二)中药品种分别增加和完善了安全性质控指标。 • (三)解决了中药饮片标准的问题。 • (四)大幅增加符合中药特点的专属性鉴定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1019
634
2165
1146
《中国药典》发展与展望
2010版药药典二部化药增收15.4%,辅料增收86%
2005版收载 1970
新增品种 修订品种 2010版收载
330
1500
2271
其中(辅料) 72
62
52
132
《中国药典》发展与展望
2010版药药典三部(生物制品)增收29.7%
类别
收载总数
140
新增 14 15 18
修订
2010版 收载
47
112
69
152
39
149
《中国药典》发展与展望
中国药典2010版概况
管理创新 强化系统性、规范性、基础性工作
标准验证和复核;一般检查项目的增补和完善;中药材拉丁名词序 变更;规范功能与主治等。
注重体现中药 特色,表达中药特点
重视中药材与中药材饮片标准,注重质量控制的专属性,一测多 评技术,多指标成分定量;特征和指纹图谱技术的应用。
2010版中国药典概述来自010版中国药典一、 《中国药典》发展与展望 二、 《中国药典》2010年版通用检测方法和指导原则 三、 2010年版中国药典凡例附录简介 四、 《中国药典》 2010年版一部增修订情况简介 五、 《中国药典》2010年版药用辅料概述 六、 《中国药典》2010年版无菌检查和微生物限度检查部分增修订内容
新增品种
修订品种
未收载 2010版收载
3217
1386(43%) 2237(70%) 36
4567
《中国药典》发展与展望
2010版药药典品种收载情况
内容
新增
修订 2010年版 2005年版
一部 二部 三部 总计
1019 330 37 1386
634 1500
94 2237
2165 2271 131 4567
《中国药典》发展与展望
中国自古修编药典
《新修本草》-公元659年 唐朝 《太平惠民和剂局方 》-公元1078年 宋 《中华药典》-1930年,国民党政府卫生署
参照英美药典编写 中华人民共和国成立后,1950年在卫生部成立药
典委,开始组织编制药典
《中国药典》发展与展望
中国药典发展简况
1953年版《中国药典》-仅有一部 1963年版《中国药典》-分为一、二部 1977年版《中国药典》 1985、1990、1995、2000版《中国药典》 2005版《中国药典》-分为一、二、三部 2010版《中国药典》-分为一、二、三部 《中国药典》(增补本)-基本每版一部
新增 修订
预防类 病毒 制品 细菌
27
48
10
38
21
生物技术产品
35
治疗类 血液制品
17
制品 微生态活菌制品
1
71
10
61
抗毒素
18
体内诊断类
4
4
体外诊断类
8
8
总计
131
37
94
《中国药典》发展与展望
2010版药药典附录增收12.5%
内容
一部附 录
二部附 录
三部附 录
2005版 收载 98
137
中国药典发展展望
坚持标准先进性,但必须兼顾国情、药情,不盲目追求不切合实际的 “高、精、尖”技术,引导和支持国产仪器的应用和发展; 推行规范的科研项目招标制度,加强管理与考核。多做雪中送炭,免 搞锦上添花,好钢用在刀刃上。 拟推行承担中国药典科研任务单位的资质评估、认证机制,药检所主 要承担复核验证工作; 药典科研工作进一步向高校、科研机构及有科研实力、重视标准工作 的企业开放; 加强中国药典的宣传、技术培训及执行监督,扩大社会影响力,提升 中国药典的作用和地位; 加强药品标准法规建设,规范和约束标准工作,维护法定药品标准的 权威性; 广泛加强国际间药典方面的交流与合作。
《中国药典》发展与展望
中国药典2010版概况
收载品种有大幅度增加
在坚持“科学、实用、规范”、质量可控性和标准先进性的原 则下,新版药典积极扩大收载品种,力求覆盖国家基本药物目录品 种的需要,并扩大了中药饮片和常用辅料的收载。对于多年无生产、 临床不良反应多,标准不完善的药品,加大调整力度。
2005版收载
1146 1970 101 3217
《中国药典》发展与展望
2010版药药典一部(中药): 增收89%
类别
项目
药材和 饮片标准
药材 饮片
植物油脂和提取物标准
中成药标准
小计
总计
2010年版新增 2010年版修订 2005年版
65
551
359
(其中单列的饮
439
片标准13个)
16
22
31
499
253
564
眼用制剂;按无菌制剂要求; 橡胶膏剂:首次提出卫生学检查要求; 微生物限度:增养基需作灵敏度等检查; 安全性项目检查法:二氧化硫残留量测定法、黄曲霉素测定法。 建立较完整的重金属检查控制方法检测体系:电感耦合等离子体质谱 法测定 砷、汞、铅、镉、铜的含量。 有机溶剂残留:工艺中使用有机溶剂的均检查有机溶剂残留(全面禁 用苯); 杂技控制:化学药品; 生物制品:单独两期学习班; 辅料:强化质量控制.
《中国药典》发展与展望
中国药典2010版概况
科技含量进一步提升
液-质联用技术、DNA分子鉴定技术、薄层-生物自显影技术的应用。
保护药材资源,关注医药产业的可持续发展
石斛、川贝母使用栽培品种,独一味药用部分修订为“地上部分”。
《中国药典》发展与展望
中国药典2010版概况
全面提升药品安全性质控技术
《中国药典》2010年版 通用检测方法和指导原则
主要增订项目内容
核磁共振波谱法NMR :研究原子核在磁场中吸收射频辐射能量进
而发生能级跃迁现象的一种波谱法 1、未知物的结构测定:涵盖所有信息 2、已知物的结构确证 功能团分析:元素组成、构架 异构体分析:对映异构体拆分 打假工作(肝素钠中的掺伪物在2.16ppm有特征信号) 3、含量分析(多组份抗生素,对映异构体分析) 4、适用性:大量地应用于有机结构分析,包括生物分子(如蛋白
中国药典发展展望
中国药典发展展望
坚持科学发展,以人为本理念,发展药典文化,规范标准语言; 坚持服务于资源节约型和环境友好型社会建设需要; 在确保药品安全有效、质量可控的前提下,鼓励企业技术创新和技术进 步,支持积极、合理、有意义的规范提高《中国药典》品种标准。 鼓励药品标准品研究、开发; 倡导绿色标准; 加强药典增补本编制工作,扩大品种和附录。将五年一版的总任务提 前分解、落实到以编制增补本为主。 系统考虑、整体推进、均衡发展,以药材、提取物、原料药标准化为 龙头,全面推进成药和制剂质量标准的提升; 科研为标准服务,标准为监管服务,监管为众服务,尽可能排除和杜 绝因标准缺陷而导致问题药品发生;
