第三章 电极过程概述
第三章2电极溶液界面
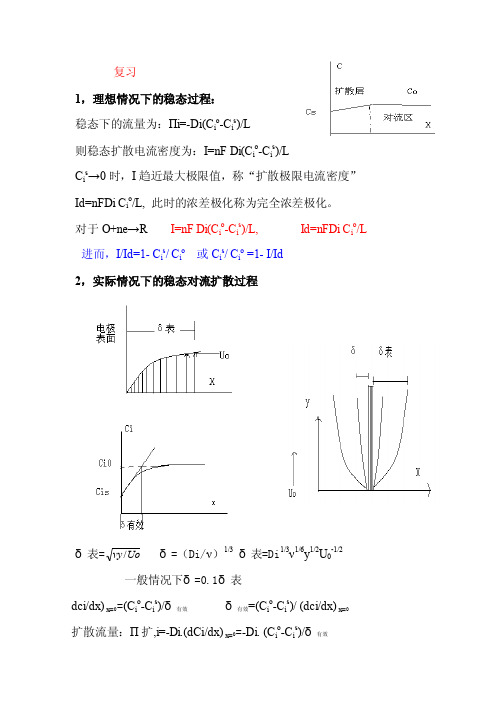
复习1,理想情况下的稳态过程:稳态下的流量为:Πi=-Di(C i o-C i s)/L则稳态扩散电流密度为:I=nF Di(C i o-C i s)/LC i s→0时,I趋近最大极限值,称“扩散极限电流密度”Id=nFDi C i o/L, 此时的浓差极化称为完全浓差极化。
对于O+ne→R I=nF Di(C i o-C i s)/L, Id=nFDi C i o/L 进而,I/Id=1- C i s/ C i o或C i s/ C i o =1- I/Id2,实际情况下的稳态对流扩散过程δ表=Uovy/δ=(Di/ν)1/3δ表=Di1/3ν1/6y1/2U0-1/2一般情况下δ=0.1δ表dci/dx) x=0=(C i o-C i s)/δ有效δ有效=(C i o-C i s)/ (dci/dx) x=0扩散流量:Π扩,i=-Di.(dCi/dx) x=0=-Di. (C i o-C i s)/δ有效I=-nF Π扩,i=nF Di. (C i o -C i s )/δ有效将δ=(Di/ν)1/3 δ表=Di 1/3ν1/6y 1/2U 0-1/2代入上两式得电极表面上各处的电流密度和极限电流密度:I=nF Di 2/3ν-1/6-y -1/2U 01/2 (C i o -C i s ) Id= nF Di 2/3ν-1/6-y -1/2U 01/2 C i o 同样:I/Id=1- C i s / C i o 或C i s / C i o =1- I/Id 旋转圆盘电极上的扩散过程δ=(C i o -C i s )/ (dci/dy) y=0=1.62 Di 1/3ν1/6y 1/2U 0-1/2=1.62 Di 1/3ν1/6ω-1/2 所以稳态对流扩散的电流密度为: I= nF Di. (C i o -C i s )/δ有效=0.62nF Di 2/3ν-1/6ω1/2(C i o -C i s )Id=0.62nF Di 2/3ν-1/6ω1/2C i o同样:I/Id=1- C i s / C i o 或C i s / C i o =1- I/Id§3.6 当电极反应速度由液相传质步骤控制时极化曲线的形成及其应用因为具体实验中,通常最容易得到的是I-Φ曲线,所以我们有必要对液相传质步骤的极化曲线的形状有所了解。
《电极过程概述》幻灯片

电极性质的变化取决于极化作用和去极化作用的 对立统一。
电子的运动速度往往是大于电极反响速度的,因 而通常是极化作用占主导地位。
有电流通过时,阴极上,由于电子流入电极的速 度大,造成负电荷的积累;阳极上,由于电子流 出电极的速度大,造成正电荷的积累,因此,阳 极电位向负移动,阳极电位向正移动,都偏离了 原来的状态,产生所谓“电极的极化〞现象。
极化度:极化曲 线上某一点的斜 率。
d d
di di
Zn在0.38M氰化镀锌 溶液中的阴极极化曲线
Zn在0.38MZnCl2溶液 中
电化学反响速度的表示方法
设电极反应为:O n eR
按异相化学反响速度表示: v 1 dc S dt
采用电流表示: inFvnF1dc S dt
当电极反响到达稳定状态时,外电流将全部 消耗于电极反响,实验测得的外电流密度值 就代表了电极反响速度。
但可以利用这种极化降低 金属的电化腐蚀速度。
不论是原电池,还是电解池,单个电极极化 的结果是相同的。即:阴极的电极电势变得更 负,阳极电极电势变得更正。 原电池的极化 原电池的极化结果是:当有电流通过原电池时,原 电池的端电压小于平衡电池电动势,即:
E原电池= E平 – η阳 是电极的极化
如果电极上有电流通过,就有净反响发生,这说 明电极失去了原有的平衡状态。这时,电极电位 将因此而偏离平衡电位。极化就是有电流流过是 引起的电势偏离其平衡值的现象。
发生极化时,阴极的电极电位总是变得比平衡电 位更负,阳极的电极电位总是变得比平衡电位更 正。因此,电极电位偏离平衡电位向负移称为阴 极极化,向正移称为阳极极化。
电极过程的基本历程和特点

电极过程的基本历程和特点电极过程是指在电化学反应中,电子从电极中流出或流入溶液的过程。
电极过程是电化学反应的关键步骤,它决定了整个电化学反应的进行方式和速率。
本文将从基本历程和特点两个方面进行解释。
一、基本历程:电极过程包括氧化过程和还原过程两个方面。
在氧化过程中,电极上的物质失去电子,形成正离子;在还原过程中,电极上的物质获得电子,形成负离子或中性物质。
氧化过程的基本历程如下:1. 电子从电极中流出:电极上的物质失去电子,形成正离子,并将电子传递给电解质溶液中的其他物质。
2. 离子在溶液中扩散:正离子在电解质溶液中自由扩散,并与其他物质发生反应。
3. 反应生成产物:正离子与电解质溶液中的其他物质发生反应,生成新的物质。
还原过程的基本历程如下:1. 电子进入电极:电解质溶液中的物质失去电子,形成负离子或中性物质,并将电子传递给电极。
2. 离子在溶液中扩散:负离子或中性物质在电解质溶液中自由扩散,并与其他物质发生反应。
3. 反应生成产物:负离子或中性物质与电解质溶液中的其他物质发生反应,生成新的物质。
二、特点:1. 电极过程是电化学反应的关键步骤:电极过程决定了电化学反应的进行方式和速率。
通过控制电极上的物质的氧化和还原过程,可以控制电化学反应的方向和速率。
2. 电极过程与电极材料的性质相关:电极过程的进行受到电极材料的性质影响。
不同的电极材料对电极过程的催化作用不同,可以加速或减缓电极过程的进行。
3. 电极过程与电解质溶液的浓度相关:电极过程的进行受到电解质溶液中物质浓度的影响。
电解质溶液中物质浓度越高,电极过程的进行越容易。
4. 电极过程与温度的变化相关:电极过程的进行受到温度的影响。
温度升高可以加快电极过程的进行速率,而温度降低则会减慢电极过程的进行速率。
5. 电极过程与电流的大小相关:电极过程的进行速率与电流的大小呈正相关关系。
电流越大,电极过程进行得越快,反之亦然。
电极过程是电化学反应中的关键步骤,它决定了反应的进行方式和速率。
电极过程概述

五、极化曲线
• 极化度(反应电阻):极化曲线上某一点 的斜率为该电流密度下的极化度。表示电 极反应进行的难易程度。
五、极化曲线
• 电极反应:有电子参与的氧化还原反应。 One R
• 电极反应速度用电流密度表示:
电极反应速度按异相化学反应表示: v
1 S
dc dt (3.2)
电极表面积
电极上有1摩尔物质还原或氧化,就需要通过nF电量。
三、浓差极化和电化学极化
浓差极化:由于液相传质步骤的迟缓,使得电极表面 反应离子的浓度低于溶液本体浓度,造成电极电位 偏离平衡电位(稳定电位)的现象。 例: Z2n2eZn电极附近液层传质过程迟缓
电化学极化:由于电极表面得、失电子的电化学反应 的迟缓,而引起的电极电位偏离平衡电位(稳定电 位)的现象。 例: N2 i2eNi 得电子过程迟缓
第三章 电极过程概述
第三章 电极过程概述
•电化学反应过程:阳极反应、阴极反应、液相传 质 •电极过程:把发生在电极/溶液界面上的电极反应、 化学转化和电极附近液层中的传质作用等一系列变 化的总和统称为电极过程。 •电极过程动力学:有关电极过程的历程、速度、 影响因素的研究称为电极过程动力学。
第三章 电极过程概述
6、过电位:在一定电位下,电极电位与平衡电位的
差值。
平
过电位取正值:
c 平 c
a a 平
7、极化值:有电流通过时的电极电位(极化电位) 和无电流通过时的电极电位(静止电位)的差值。
五、极化曲线
极化曲线:过电位或电极电 位随电流密度变化的关系 曲线。
讨论: I = 0 时,E = 静止电位。 曲线1、2的极化性能不同。 相同电流密度反应2比反 应1阴极电位负,表明反 应较难于进行。
第三章 电极过程动力学 ppt课件

当电化学反应为控制步骤时,则测得的整个电极过程的动力学参数就是 该电化学步骤的动力学参数。反之,当扩散为控制步骤时,则整个电极过程 的速度服从扩散动力学的基本规律。当控制步骤发生转化时,往往同时存在 着两个控制步骤,这时电极反应处于混合控制区,简称混合区。
第一节 不可逆的电极过程
用搅拌和升温的方法可以减少浓差极化,但也可 以利用滴汞电极上的浓差极化进行极谱分析。
极化的类型
(2)电化学极化
电极反应总是分若干步进行,若其中一步反应 速率较慢,需要较高的活化能,为了使电极反应顺 利进行所额外施加的电压称为电化学超电势(亦称 为活化超电势),这种极化现象称为电化学极化。
3.超电势(overpotential)
4.极化曲线(polarization curve)
5.氢超电势
电解质溶液通常用水作溶剂,在电解过程中,H + 在阴极会与金属离子竞争还原。
利用氢在电极上的超电势,可以使比氢活泼的金 属先在阴极析出,这在电镀工业上是很重要的。
例如,只有控制溶液的pH,利用氢气的析出有超 电势,才使得镀Zn,Sn,Ni,Cr等工艺成为现实。
ia onFa o vnFa oC KR (3-3) iconFco vnFcoC KO(3-4)
式中,W1为反应过渡态与反应始态(图中状态I)间标准自由焓之差, 即氧化反应的标准活化自由焓(活化能);W2为反应过渡态与反应终态(图 中状态II)间标准自由焓之差,即还原反应的标准活化自由焓(活化能);
离子导电过程的主要矛盾是溶液中的电场对电迁移阻力这对矛盾,主要影响 因素为溶液中的电位差、电迁移距离和离子浓度等。
第一节 不可逆的电极过程
电极总过程中上述各种基本过程的地位随具体条件而变化, 总过程的主要矛盾也随之转化。
电极过程简明教程

电极过程简明教程电极过程是化学反应中重要的一环,它使反应物受到电子的作用,从而产生电子的行为。
它是一种能够交换电子的过程,广泛应用于日常的实验,也广泛应用于医学、农业和其他行业。
本文将简要介绍电极过程的基本原理和过程。
一、电极反应的定义电极反应是指当反应物受到电子的作用时,发生的电子行为。
这种电子行为可以使反应物产生电子流动,从而使反应物之间产生联系,从而实现反应。
电极反应可分为催化电极反应、氧化还原电极反应和电极分离反应等。
二、电极反应的基本原理电极反应是电子在反应物之间传输的过程,表面上可以看到电子从一种物质到另一种物质的迁移。
这一过程是以反应物之间的能量差值为基础的,比如物质A含有低能量电子,物质B含有高能量电子,当两者之间存在能量差时,电子就会从物质A向物质B迁移,从而实现反应。
三、电极反应的基本过程电极反应的过程主要包括以下几步:1.反应物和电极连接起来,使其具有电流流过反应物的能力。
2. 使用电源提供电压,以产生电流,从而使反应物之间形成电子反应,从而进行反应。
3.过监测反应物及其产物的活性变化,确定反应是否发生,及其反应的方向和程度。
4.后断开电极连接,停止反应过程。
四、电极反应的实验步骤1.备所需设备:电源、电极、容器、反应物等。
2.电极放置在容器中,将反应物放入容器中,充分混合;3.接电极与电源,调节电压,使电极反应开始;4.测反应物及其产物的活性变化;5.整电压,使反应接近平衡;6.开连接,停止反应过程,完成实验。
五、总结电极反应是指当反应物受到电子的作用时,发生的电子行为,是一种能够交换电子的过程。
本文介绍了电极反应的基本原理、基本过程及实验步骤,希望能够给相关人员搭建一座桥梁,扩大电极反应的应用范围,促进电极反应实验的顺利进行。
第三章电极溶液界面附近液相中的传质过程

第三章电极/溶液界面附近液相中的传质过程电极反应的分部步骤:界面附近传质过程,化学转化过程,界面上转化过程,电子转移过程.对于发生在电极/溶液异相界面的电极过程,除了电子转移过程之外,还涉及传质过程及各种表面效应,后者甚至可以成为速控步骤。
一般认为总的电极反应由一系列分步骤所组成。
电极反应的速率由这一系列分步骤的一个控制或若干个混合控制。
这些步骤包括以下几种。
物质传递:反应物从溶液本体相传递到电极表面和产物从电极表面相传递到分布到本体溶液.。
电荷转移:电极/溶液界面的电子传递耦联化学反应:电子传递反应前置或后续的化学转化,这些过程可能是均相也可能是异相过程。
表面转化反应:反应物或产物的吸脱附过程及新相生成(表面沉积、沉淀形成、气体放出)等其他的表面反应。
一般电极反应的基本步骤电极反应的速率大小取决于上述系列反应中受阻最大而进行最慢的步骤,最慢的步骤称速度控制步骤,其动力学特征就反应了整个电极过程的动力学特征。
基础电化学研究的核心内容之一就是识别电极过程包括的各分步骤,确定速度控制步骤,阐明反应机理和速率方程,从而掌握该电极过程的反应规律。
§3.1 研究液相中传质动力学的意义和方法(1)液相传质步骤是整个电极过程中的一个重要环节整个电极反应的基本历程(2)液相传质步骤可能成为许多电极过程的控制步骤,由它来决定整个电极过程的动力学特征。
a 电子传递过程(法拉第过程,电化学过程)进行的很快。
(热力学上)b可以增加过电位使反应的活化能降低,从而使电子传递过程大大加快,导致液相传质过程成为决速步骤。
(动力学)(3) 了解液相中的传质动力学规律有助于寻求提高这一步骤进行速度的方法,并消除由于这一步骤进行缓慢而带来的各种限制作用。
a由于液相中传质速度的限制,致使我们无法观测一些快速分布步骤(特例是电子传递过程)的动力学特征和参数。
b电极反应处于混合区时,可以利用这些规律来校正液相传质步骤的影响。
如何研究液相传质动力学?电极过程各个分部步骤是串联进行的,要想单独研究某一分部步骤,必须首先假定其它步骤进行的速度非常快,处于准平衡态,这样才能使问题得以简化。
第三章-电极溶液界面
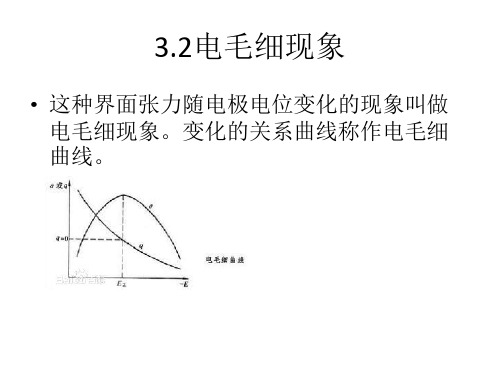
• 影响:改变电极上双电层的分布,从而影 响反应粒子在电极表面的浓度和活化能, 使反应速率发生变化
一、无机离子的吸附
• 1.大多数无机阴离子是表面活性物质,而无 机阳离子的表面活性很小,只有少数离子 才表面活性。
表面张力变化原因
• 无论双电层是带正电还是带负电,由于同 性电荷的相互排除使界面有扩大的趋势, 与表面张力使界面缩小的趋势相反。因此, 带电界面比不带电界面表面张力下。而剩 余电荷密度与电势有关,故表面张力与电 势有关。
二、电毛细曲线的微分方程
• 根据吉布斯等温吸附方程
d id i
i
电子的表面吸附量 e q / F
• 常用的方法: • 充电曲线法
• 电位扫描法
氢原子的吸附
• 氢的吸附过程伴随有氢分子的分解,分解 生成的氢原子与金属表面相互作用而形成 吸附键。吸附氢原子与吸附自由氢原子是 不同的,吸附过程放出大量吸附热,吸附 氢原子的能量低得多。
氧原子的吸附
• 在常温下,主要是氧原子和含氧粒子的吸 附。这些含氧粒子是在逐步还原或OH-逐步 氧化过程形成并吸附的。
若保持电位恒定,并保持i组分外的化学势不变
i
(
i
) ,ki
负离子可逆,正离子表面剩余电荷量
(
Ina
)
1
正离子离子可逆,负离子表面剩余电荷量
( Ina
)
1
求解表面剩余电荷量的步骤
• 1.测量不同电解质浓度的电毛细曲线 • 2.从各条电毛细曲线下取同一相对电位下的
• 值,做出 ~ Ina 关系曲线。
双电层电位由紧密层电位差和分散层电位差
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
液相传质 前置转化
一、电极过程的 基本历程(例2)
双电子反应
并联进行
二、电极过程的速度控制步骤
• 单元步骤的反应速度: v e
G 0 /( RT )
潜在的反应速度
• 速度控制步骤:当几个步骤串联时,实际反应速度
等于最慢的那个步骤,把控制整个电极过程速度的
单元步骤(既最慢的那个步骤)称之。
§3.1 电极的极化现象 §3.2 原电池和电解池的极化图 §3.3 电极过程的基本历程和速度控制步骤 §3.4 电极过程的特征
§3.1 电极的极化现象
一、电极的极化
二、电极极化的原因
三、理想极化电极和理想不极化电极
四、电极极化的有关名词
五、极化曲线
六、极化曲线的测量
一、电极的极化
• 电极的极化:有电流通过时,电极电位偏
电化学极化:由于电极表面得、失电子的电化学反应
的迟缓,而引起的电极电位偏离平衡电位(稳定电
位)的现象。 例: Ni2 2e Ni 得电子过程迟缓
四、准平衡态
• 如果电极过程的非控制步骤的反应速度比控制步骤 的速度大得多,当电极过程以控制步骤的速度进行 时,可以近似地认为电极过程的非控制步骤处于平 衡状态,即处于准平衡态。 • 准平衡态的引入是为了简化问题的研究。 (例:用能斯特公式计算电极电位)
1 dc 电极反应速度按异相化学反应表示: v S dt (3.2)
电极表面积
电极上有1摩尔物质还原或氧化,就需要通过nF电量。 电极反应速度用电流密度表示:
j nFv nF 1 dc S dt (3.3)
当电极反应达到稳定状态时,外电流全部消耗于电极反 应,即代表了电极反应速度。
六、极化曲线的测量
• 当电极反应进行的条件发生变化时,电极过程的速
度控制步骤会发生变化。
• 电极过程的速度控制步骤可能不止一个。
三、浓差极化和电化学极化
浓差极化:由于液相传质步骤的迟缓,使得电极表面 反应离子的浓度低于溶液本体浓度,造成电极电位 偏离平衡电位(稳定电位)的现象。
例:
Zn 2 2e Zn
电极附近液层传质过程迟缓
相同
正 极 负 极
V a c IR V a平 a) c平 c) IR ( ( E a c) IR (
极化后:V E
§3.3电极过程的基本历程和速度控制步骤
第三章 电极过程概述
第三章 电极过程概述
•电化学反应过程:阳极反应、阴极反应、液相传 质
•电极过程:把发生在电极/溶液界面上的电极反应、
化学转化和电极附近液层中的传质作用等一系列变
化的总和统称为电极过程。
•电极过程动力学:有关电极过程的历程、速度、
影响因素的研究称为电极过程动力学。
第三章 电极过程概述
四、准平衡态
• 对于电极反应: O ne R 假设电极过程控制步骤的绝对反应速度为j* 电极过程稳态进行时,净反应速度为j净 则: * * *
j净 j j逆 j净 j
四、准平衡态
• 其他非控制步骤的绝对反应速度为: 还原反应: j 氧化反应: j 电极反应的净速度: j净 j j 所以: j j j净 因为: j j净 j j净 则: j j 即:非控制步骤处于准平衡态。
1、恒电流法:给定电流密度,测量电极电位,得到 电极电位与电流密度的关系曲线。
(j) f
2、恒电位法:给定电极电位,测量电流密度,得到 电流密度与电极电位的关系曲线。
j () f
六、极化曲线的测量
3、稳态法:测定电极过程达到稳定状态后的
电流密度与电极电位的关系。
4、暂态法:测定电极过程未达到稳定状态的
三、电极过程的研究方法
1、弄清电极反应的历程,确定电极过程的各个单元
步骤及其动力学特征。
2、实验测量被研究体系的动力学参数,综合得出该
电极过程的动力学特征。
3、如果电极过程的动力学特征与某个单元步骤的动
力学特征相符,就可以判定该单元步骤是速度控制
步骤。
三、电极过程的研究方法
4、测定速度控制步骤的动力学参数。
1、电极过程服从一般异相催化反应的动力学规律。 反应速度影响因素:界面性质及面积、传质动力学、 新相生成动力学。 2、界面电场对电极过程进行速度有重大影响。
电极电位影响反应速度是电极过程动力学研究的核 心内容。通过控制电极电位调整电极反应速度。
3、整个电极过程的动力学规律类似于速度控制步骤的 动力学规律。 非速度控制步骤处于准平衡态。
一、电极过程的基本历程 二、电极过程的速度控制步骤 三、浓差极化和电化学极化
四、准平衡态
一、电极过程的基本历程
1、液相传质 2、前置转化:吸附、络合离子配位数改变等
3、电化学反应:得失电子、氧化还原
4、随后转化:脱附、复合、分解、歧化等 5、液相传质
一、电极过程的基本历程(例1)
生成新相
液相传质 电子转移
一、原电池的极化图
电池电动势:E c平 a平 电池端电压:
V c a IR
负 极
正 极
与电动势 方向相反
V c平 c) a平 a) IR ( ( E a c) IR (
极化后:V E
二、电解池的极化图
四、电极极化的有关名词
1、电极的极化:有电流通过电极时,电极电位偏离 平衡电位(或稳定电位)的现象。 2、阴极极化:电极电位偏离平衡电位向负移。 3、阳极极化:电极电位偏离平衡电位向正移。 4、极化电位:有电流通过时的电极电位。 5、静止电位:无电流通过时的电极电位,包括平衡 电位(可逆电极)和稳定电位(不可逆电极)。
§3.4 电极过程的特征
一、电极反应的特点 二、电极过程的动力学特征 三、电极过程的研究方法
一、电极反应的特点
1、电极反应:在电极/溶液界面进行的、有 电子参与的氧化还原反应称之。它是电极
过程的核心。
2、电极反应特点:氧化反应和还原反应可在
不同地点进行。反应界面具有催化作用。
二、电极过程的动力学特征
电流密度与电极电位的关系,包含时间因素 的影响。
六、极化曲线的测量
极化 回路 测量 回路
电 位 计
恒电流 法基 本测 量线 路图。
六、极化曲线的测量
恒电位法基本测量 线路图。
极化 回路
测量 回路
§3.2 原电池和电解池的极化图
极化图:把表征电极过程特性的阴极极化曲线 和阳极极化曲线画在同一各坐标系中。 极化的一般规律:阴极极化使电极电位变负。 阳极极化使电极电位变正。 阴极反应 阳极反应 还原反应 氧化反应
极化作用>去极化作用 电荷在界面积累
电极电位偏离平衡电位
三、理想极化电极和理想不极化电极
• 理想极化电极:电极上不发生电极反应,流入电
极的电荷全部都在电极表面积累,使电极电位发
生改变。如:滴汞电极。
• 理想不极化电极:电极反应速度很大,流入电极
的电荷全部都能通过电极反应消耗,不在电极表
面积累,电极电位不发生变化。如:饱和甘汞电 极。
5、测定非速度控制步骤的热力学平衡参数或其他
热力学参数。
曲线1、2的极化性能不同。 相同电流密度反应2比反 应1阴极电位负,表明反 应较难于进行。
五、极化曲线
• 极化度(反应电阻):极化曲线上某一点 的斜率为该电流密度下的极化度。表示电 极反应进行的难易程度。
五、极化曲线
• 电极反应:有电子参与的氧化还原反应。 O ne R • 电极反应速度用电流密度表示:
离平衡电位的现象。
二、电极极化的原因
1、平衡状态:电极反应的物质交换和电荷交换平衡,外电流
为零。
2、极化作用:外电流流过电极时,电子的流动使电极表面电 荷发生积累,电极电位偏离平衡状态。 3、去极化作用:电极表面发生电极反应,吸收电子运动传递 过来的电荷,使电极电位恢复平衡的状态。
4、电极极化的原因:
四、电极极化的有关名词
6、过电位:在一定电位下,电极电位与平衡电位的 差值。 平 过电位取正值:
c 平 c a a 平
7、极化值:有电流通过时的电极电位(极化电位) 和无电流通过时的电极电位(静止电位)的差值。
五、极化曲线
极化曲线:过电位或电极电 位随电流密度变化的关系 曲线。 讨论: I = 0 时,E = 静止电位。
