乙醇脱氢酶(ADH)检测试剂盒(乙醛比色法)
肉桂醇脱氢酶(CAD)检测试剂盒(肉桂酸比色法)

肉桂醇脱氢酶(CAD)检测试剂盒(肉桂酸比色法)简介:肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase,CAD)是催化香豆醛形成松柏醇的酶。
该酶多存在于高等植物、酵母、菌类可溶性部分物质,属于细胞木质素合成途径中间的关键酶,研究该酶可以探讨多种生物细胞发育过程中木质素沉积的代谢机理,为减少水果石细胞含量提高其品质提供依据。
Leagene 肉桂醇脱氢酶(CAD)检测试剂盒(肉桂酸比色法)检测原理是以肉桂酸、NADP 作为底物,在酶促反应的最适条件下采用每隔一定时间测定产物生成量的方法,于分光光度计检测吸光度,以吸光度变化所需酶量进行计算。
该试剂盒主要用于植物组织的裂解液或匀浆液、血清等样品中内源性的肉桂醇脱氢酶活性,尤其适用于检测水果中肉桂醇脱氢酶活性,25T 可以检测23-24个样本。
该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
组成:自备材料:1、蒸馏水2、研钵或匀浆器3、离心管或试管4、低温离心机5、水浴锅或恒温箱6、比色杯7、分光光度计操作步骤(仅供参考):1、准备样品:①植物样品:取植物组织或水果中层果肉置于液氮中迅速研磨或匀浆,加入预冷的CAD编号名称TE041925T Storage试剂(A):CAD Lysis buffer 50ml 4℃避光试剂(B):CAD Assay buffer 20ml 4℃避光试剂(C):NADP 2支-20℃使用说明书1份Lysis buffer,离心,留取上清液,冻存,用于肉桂醇脱氢酶的检测。
②血浆、血清和尿液样品:血浆、血清按照常规方法制备后可以直接用于本试剂盒的测定,冻存,用于肉桂醇脱氢酶的检测。
③细胞或组织样品:取恰当细胞或组织裂解液,如有必要用CAD Lysis buffer进行适当匀浆,,离心,取上清液,冻存,用于肉桂醇脱氢酶的检测。
④高活性样品:如果样品中含有较高活性的肉桂醇脱氢酶,可以使用CAD Lysis buffer稀释进行恰当的稀释。
乙醇脱氢酶_ADH_产酶菌株的选育_问清江

作者简介:问清江男,副研究员。
主要从事发酵技术研究。
E-mail :mujuan2008@163.com *通讯作者。
女,研究员。
主要从事酶学在医学、食品、农业及环保领域应用研究。
E-mail :mujuan2007@163.com 收稿日期:2013-03-13;修回日期:2013-05-08乙醇脱氢酶(ADH )产酶菌株的选育问清江1,慕娟1*,党永1,张烁2,景振龙2,贺聪莹3,颜阳欣2(1.陕西省微生物研究所,陕西西安710043;2.长安大学环境科学与工程学院,陕西西安710064;3.西北大学生命科学院,陕西西安710068)摘要从食醋生产企业的醋醅中采集样品,以乙醇为唯一碳源,用碳酸钙透明圈平板法分离出185株菌株,然后以产酸量和耐乙醇能力为标准,摇瓶发酵选育出20株ADH 产酶菌株;A5-2产酸量为49.85g /L ,耐乙醇能力强,A5-2的菌种形态学和16S rDNA 序列分析初步鉴定为巴斯德醋酸杆菌(Acetobacter pasteurianus );A5-2乙醇脱氢酶酶学性质研究表明:最适作用温度和pH 分别为45ħ和pH 4.0,具有一定的耐热性和良好的耐酸碱性;A5-2乙醇脱氢酶粗酶制备条件为硫酸铵饱和度70% 80%,回收率84%。
关键词乙醇脱氢酶;醋酸杆菌;选育;酶学性质中图分类号Q935文献标识码A文章编号1005-7021(2013)05-0054-06doi :10.3969/j.issn.1005-7021.2013.05.010Breeding of Alcohol Dehydrogenase Producing StrainsWEN Qing-jiang 1,MU Juan 1,DANG Yong 1,ZHANG Shuo 2,JING Zhen-long 2,HE Cong-ying 3,YAN Yang-xin 2(1.Shaanxi Inst.of Microbiol.,Xi'an 710043;2.Coll.Environ.Sci.&Engin.,Changan Uni.,Xi'an 710064;3.Coll.of Life Sci.,NW Uni.,Xi'an 710068)Abstract 185alcohol dehydrogenase (ADH )producing strains were isolated from samples collected from vinegar fermented grains in vinegar production enterprise by selective medium using ethanol as the sole carbon source ,and calcium carbonate transparent circle on plate.20high ADH producing strains were bred under shaking-flask fermenta-tion ,in which acid output and ethanol tolerance were used as standards.The acid output of A5-2achieved 49.85g /L and its capacity of ethanol tolerance was strong.A5-2was initially identified as Acetobacter pasteurianus based on its morphological characterization and 16S rDNA sequence.Study on enzyme characteristics showed that the optimal reac-tion conditions of A5-2ADH were at 45ħand pH 4.0,and it had heat tolerance and fine tolerance against acid-base.The preparation condition of crude ADH were saturated concentration of ammonium sulfate was at 70% 80%and the ADH activity recovery was at 84%.Keywordsalcohol dehydrogenase (ADH );Acetobacter ;breeding ;enzymological characteristics乙醇脱氢酶(Alcohol Dehydrogenase ,ADH )广泛存在于人和哺乳动物的肝脏、植物组织及微生物细胞中,是生物体内重要的氧化还原催化剂之一,其为具有广泛专一性的含锌金属酶,以NAD +为辅酶,能够催化乙醇氧化为乙醛,乙醛经乙醛脱氢酶(Aldehyde dehydrogenase ,ALDH )继续氧化生成乙酸,进入三羧酸循环最终生成二氧化碳和水,是人和动物体内重要的代谢酶。
探讨血液中乙醇检测方法

探讨血液中乙醇检测方法作者:莫乃梅来源:《健康科学》2018年第11期关键词:血液;乙醇;化学法;酶法;气相色谱法;气相色谱- 质谱法;近红外光谱法乙醇(分子式C2H6O)俗称酒精,是酒的主要成分,乙醇进入空胃后,可于30min~90min内在胃及肠道内被完全吸收入血,15min~90min内,血液中酒精浓度值(bloodalcoholconcentration,BAC)可达到峰值。
其代谢主要是在肝脏内被氧化分解,少部分以原形经呼吸道、尿、汗直接排出体外。
急性乙醇中毒多是暴饮、酗酒所致,也有少数把毒物投入酒中而造成中毒,需检查酒精。
乙醇的毒性主要是能严重地抑制中枢神经系统,首先是大脑功能,继而皮层下中枢和小脑活动受累,最后因延脑血管运动中枢和呼吸中枢麻痹而死亡。
随着科学的发展,血液中乙醇含量的检测方法层出不穷,大体上有化学法、酶法,气相色谱法、气相色谱-质谱法和近红外光谱法等,现就这些方法在血液中乙醇含量检测方面作一综述。
1、化学法化学法分为定性方法和定量方法。
定性方法主要是碘仿反应法,它的原理是乙醇与碘及氢氧化钾反应,首先生成次碘酸钾(KIO),然后由乙醇氧化的乙醛再与之作用,生成三碘乙醛,最后与过量的氢氧化钾反应生成黄色的碘仿沉淀。
碘仿反应法灵敏度为1:1000,但其反应并非为乙醇特异反应,乙醛、丙酮甲基酮及能被次碘酸盐氧化为乙醛或甲基酮的醇均能产生同样反应。
另外化学定性的方法还可以通过苯酰氯反应和Vitali反应来检测检样有没有乙醇。
定量方法主要有威得马克(Widmark)氏法和重铬酸钾法,威得马克(Widmark)氏法是利用Widmark乙醇定量瓶,将血液加热60℃使乙醇挥发,挥发出来的乙醇被重铬酸钾-硫酸混合液吸收,并使乙醇氧化成乙酸,用硫代硫酸钠滴定由于剩余重铬酸钾将碘化钾氧化所游离出来的碘,从而计算出乙醇含量。
重铬酸钾法的原理是醇和重铬酸钾作用,使黄红色的六价铬变为绿色的三价铬,与标准比色定量。
乙醇脱氢酶法测定血浆中乙醇

乙醇脱氢酶法测定血浆中乙醇西北国防医学杂志(MedJNDFNC)2005Oct.;26(5)345乙醇脱氢酶法测定血浆中乙醇伏建峰,史清海,路西春,高华,丁艳萍(兰州军区乌鲁木齐总医院,新疆乌鲁木齐830000)论着?摘要:目的:建立一种快速测定血浆中乙醇浓度的新方法.方法:选用三(羟甲基)氨基甲烷一盐酸(Tris—HCL)作为缓冲体系,在碱性条件下,乙醇脱氢酶(ADH)催化乙醇转化成乙醛,同时生成还原型辅酶I(NADH).在340Bill波长处检测吸光度的变化,对照标准计算乙醇的浓度.结果:ADH最适用量为753KU/L,辅酶I(NAD)最适浓度为60.0mmol/L,检测过程仅需90s,线性范围可达0~68.60mmol/L,变异系数(CV)为2.31%~3.25%,回收率为98.4%~101%,与美国DADE试剂盒比较具有良好的相关,^y:0.985,Y=0.987x+0.024.结论:本法测定血浆中乙醇无需除蛋白,具有快速,简便等优点,可用于自动生化分析仪及手工操作,适于临床常规运用.关键词:实验室诊断;乙醇;乙醇脱氢酶;检测;临床应用中图分类号:R446.1文献标识码:A文章编号:1o07—8622(2005)05—0345—03 Determinationofalcoholinplasmabyalcoholdehydrogenasemethod FUJian—feng,SHIQing—hai,LUXi—chun,eta1.(UrumchiGeneralHospitalofLanzhouCommand,PLA,830000,China)Abstract:0bjective:Toestablishanewmethodforrapidmeasuringalcohol(ALC)inplasma. Methods:(hydroxymethy1)aminomethane—hydrochloride(Tris—HCL)burwasusedinthisstudy.Intheconditionofalkalescence,alcoholdehydrogenase(ADH)catalyzedtheoxidationofALCtoacetaldehyd e,withthesimultaneous productionofdeoxidizednicotinamideadeninedinucleotide(NADH).Thevarianceofabsor bancewasdeterminedbyafilterof340nm.TheconcentrationofALCwascalculatedaccordingtothestandard.Resul ts:ThemostadaptquantityofADHwas753KU/L.andthebestconcentrationoftheNADwas60.0mmoL/L.Itco stonly90Sinthewholereaction.Therangeoflinearitywasfromzeroto68.60mmo1/L.Thecoemcientofva riationfCVindifferentconcentrationswasfrom2.31%to3.25%.Therecoveryraterangedfrom98.4%to10 1%.ComparedwithDADE(America)reagentsmethod,theregressionequationwasobtained.Conclusion: ThisADHmethodfor measuringtheconcentrationofALCinplasmaisrapidandsimplewithoutremovingprotein.I tcouldbeusedboth automaticallyandmanuallyandsuitableforclinicalapplication.Keywords:Laboratorydiagnosis;Alcohol;Alcoholdehydrogenase;Testing;Clinicalappli cation饮酒过量可引起以神经精神症状为主的疾病,称为酒精中毒(alcoholpoisoning)或乙醇中毒(etha.nolpoisoning)….一次饮用大量酒类饮料会对中枢神经系统产生先兴奋后抑制作用,重度中毒可使呼吸,心跳抑制而死亡.鉴于酒精中毒的后果严重,所以迅速测定血浆中乙醇浓度,对早期诊断和处理急性酒精中毒具有非常重要的f临床价值.作者报道一种新的酶终点法测定血浆中乙醇浓度,无需除蛋白,收稿日期:2005—06—23作者简介:伏建峰(1967一),男,副主任技师,Tel:0991—4992736, Email:****************整个检测过程仅需90S,可用于自动生化分析仪及手工操作,适于临床常规运用.1原理选用三(羟甲基)氨基甲烷一盐酸(s—HCL)作为缓冲体系,在碱性条件下,乙醇脱氢酶(ADH)催化乙醇转化成乙醛,同时生成还原型辅酶I(NADH).在340nm波长处检测吸光度的变化,对照标准计算乙醇的浓度.2材料与方法2.1试剂:ADH,辅酶I(NAD)为Sigma产品,三(羟甲基)氨基甲烷(Tris)为国产分析纯.试剂I:346西北国防医学杂志(MedJNDFNC)2005Oct.;26(5)ADH16.8mg溶于10ml重蒸水.试剂II:NAD238.8mg溶于6ml重蒸水.试剂III:Tris10.70g溶于1O0ml重蒸水,检{贝0前与0.1mol/LHCL按5:1(V/V)混合.2.2标准液:分别加入100,200,300和400Ixl无水乙醇到50ml蒸馏水中,制备出的标准液浓度分别为17.15,34.30,51.45和68.60mmol/L,储存于具塞容器中备用.2.3混合血浆制备:采集40位健康体检者肘部静脉血各2ml,NaF抗凝,离心后制备混合血浆.2.4标准血浆:分别加入20,40,60,80l无水乙醇到10ml混合血浆中,混匀.制备出的标准血浆浓度分别为17.15,34.30,51.45和68.60mmol/L,以1m1分装,一20~C储存备用.2.5仪器:XL型生化分析仪(美国杜邦).2.6自动分析参数:反应类型:终点法;反应温度:37~C;波长:340nm(主)/380nm(次);样品3l,试剂I25l,试剂II130Ixl,试剂III340Ixl;反应时间:90s.3实验与结果3.1ADH用量的选择:取ADH(单位:KU/L)活性分别为:27,54,108,215,323,430,538,645,753,860,968的酶工作液分别测定高浓度(51.45retool/ L)的乙醇标准液,图1结果表明,ADH用量在753 KU/L以上最适.3.2NAD浓度选择:在pH10.5,ADH为753KU/L条件下,观察NAD浓度(mmol/L)为10,20,30,40,5O,6O,7O,8O,9O时对反应进程的影响,NAD最适浓度为60.0retool/L.3.3缓冲体系的选择:配制pH9~11的各种缓冲液:甘氨酸一NaOH,KH2PO4一K2HPO4,Na2CO3一NaHCO和Tris—Hcl等,在相同条件下,观察其对反应进程的影响,riffs—Hcl较为适宜.3.4缓冲液浓度及pH的选择:分别配制pH为:8.0,8.5,9.0,9.5,10.0,10.5,11.0的Tris—Hcl溶液,结果显示pHlO.5时较为适宜,同时确定Tris浓度为882.9mmoL/L.3.5反应动力学曲线:选择低,中,高(17.15,34.30,68.6mmol/L)三个不同浓度标准血浆,用本法在XL上观察反应进程,图2结果表明,不同浓度的样品60s内吸光度上升最快,70~80s曲线平缓, 90s后吸光度基本一致,因此选择90s为反应终点时间图2ADH法检测三个不同乙醇浓度标准血浆反应进程曲线3.6线性范围:取浓度为0,17.15,34.30,51.45,68.60mmol/L的标准血浆用本法测定,乙醇在0~68.60rnmol/L范围内线性良好.3.7精密度试验:选择低,中,高(17.15,34.30,51.45mmol/L)三个不同浓度标准血浆,用本法重复测定20次,批内变异系数分别为3.25%,2.31%和2.40%.3.8回收试验::在已知乙醇浓度为20,0rnmol/L的标本内分别加入低,中,高三种浓度(17,15,34.30,51.45rnmol/L)的乙醇标准液,回收率分别为1O0%,101%及98.4%.3.9干扰试验:将同体积蒸馏水和同体积不同浓度的干扰物,分别加入到等体积的混合血浆中,前者为对照样品,其余为含不同浓度干扰物质的检测样品,每个样品重复测定5次,取均值.检测样品与对照样品比较,偏差<±5%,说明该浓度物质对检测无显着干扰.测定结果显示,本法至少能去除30mmol/L的乙醛.此外,胆红素<500ixmol/L,血红蛋白<5g/L,甘油三脂<10.0mmol/L时,测定结果未见明显干扰.3.1O对比试验:选取40份不同乙醇含量的血浆分别用本法与美国DADE试剂盒对比测定,结果经回归分析::0.985,Y:0.987x+0.024.3.1l临床应用:健康体检且无饮酒习惯者40例,清晨空腹采血,用本法测定血浆乙醇含量,结果0西北国防医学杂志(MedJNDFNC)2005Oct.;26(5)347 mmoL/L36例,0.5~1.5mmoL/IA例;交通管理部门送检疑有酒后驾车者27例,血浆乙醇浓度在l0.8—39.0mmol/L,平均为21.4mmol/L,其中24人最终承认饮过酒;酒后反应迟钝并呕吐者8例,血浆乙醇浓度为20.5~39.7mmol/L;酒后昏迷者3例,血浆乙醇浓度分别为55.2,59.1和62.8mmol/L.4讨论ADH法检测乙醇最早由Hadjiioanno提出并沿用至今,传统方法需除蛋白,且反应时间较长(约300s),由于乙醇极易挥发,很难确保其检测的准确性.本法选择Tris—HCL作为缓冲体系,加之选用高活力的ADH,促使样品中有限的乙醇快速转化成乙醛,整个检测过程仅需90s且不用除蛋白,经方法学评价,各项指标均较为满意:线性范围可达0~68.60mmol/L,变异系数(CV)为2.31%~3.25%,回收率为98.4%~101%,与美国DADE试剂盒比较具有良好的相关.ADH工作环境为碱性,甘氨酸一NaOH,KH2PO4一K2HPO4,Na2CO3一NaHCO3和Tris—Hcl 等缓冲体系均可选用.在我们的实验中,甘氨酸一NaOH,KH2PO一K2HPO缓冲体系不甚理想;Na2CO3一NaHCO3和Tris—Hcl缓冲体系较为理想, 由于Na2CO,一NaHCO,缓冲液容易结晶,不利于存储,作者选择Tris—Hcl作为缓冲体系,该缓冲体系含有两性离子,有利于发挥酶的活力.不同文献报道的ADH的最适pH值也有很大差别,范围大致为8.8~10.9L2"J,可能由试验条件及ADH的来源不同所致,作者所选用ADH来自酵母,在本试验条件下,ADH的最适pH值为l0.5.乙醛是乙醇的氧化产物,其产量增多可抑制ADH的活性,试验中当乙醛浓度达30.0mmol/L时,仍未见其对ADH有明显的抑制作用,推测可能是s—Hcl和乙醛结合生成一种复合物,且此反应不可逆,使乙醛迅速被移走,反应得以快速进行.酶法自动分析已经普及,血中乙醇的酶学测定法分为两种:乙醇氧化酶法和ADH法.乙醇氧化酶法的试剂组成简单,缺点是特异性差,甲醇对测定干扰很大,可出现假阳性.ADH法相对特异,受甲醇或异丙醇的干扰极小,此外ADH较乙醇氧化酶更易得到且成本较低,因此ADH法更适宜常规操作,易于推广应用.参考文献:[1]BishopML,Duben—EngelkirkJL,FodyEP.Clinical chemistry[M].FourthEdition,PhiladelphiaUSA:Lippin. cottWilliamsWilkins,2000.508—610.[2]胡建强,刘凤兰.血清乙醇脱氢酶活性测定及其临床应用[J].天津医科大学学报,2001,7(1):110—111.[3]陈金来,刘毅,郭妹,等.酶法血清乙醇测定试剂盒的初步评价及临床意义[J].天津医科大学学报,2002,8 (4):506—508.[4]1wamotoR,KubotaH,HosokiT,eta/.Completeaminoacid sequenceandcharacterizationofthereactionmechanismofa glucosamine—inducednovelalcoholdehydrogenasefrom Agrobacteriumradiobacter(tumefaciens)[J].ArchBio. chemBiophys,2002,398(2):203—212.[5]张红霞,邓振华,谢娜,等.酒后驾车血液呼气中乙醇检测方法评价[J].刑事技术,2003,5:36—39.《西北国防医学杂志》征订启事<西北国防医学杂志=》为兰州军区联勤部卫生部主办的国,内外公开发行的综合性医药卫生学术性期刊,是"中国科技论文统计源"期刊,已被<中国科学引文数据库》等国内重要数据库收录,也被美国化学文摘(CA)和俄罗斯文摘杂志(JA)收录,刊出省部级以上各类基金资助论文及获奖论文占有较高比例,多次在军内外期刊质量评比中获奖.本刊刊登军内外医务工作者有关基础医学,临床医学,军事医学,文献综述,讲座,护理,卫生科技管理等方面的学术文章.主要栏目有:述评,论着,临床研究,高原医学,经验交流,护理,综述,讲座,卫生行政等.我们希望本刊能对广大医务工作者有所裨益,并热切欢迎对我刊给予扶持和指导.<西北国防医学杂志》(前身为<兰后卫生=》),1979年创刊,2002年改为双月刊,大16开本,80页,逢双月末出版,每期定价10.0o元.<西北国防医学杂志>国内邮发代号54—101,欢迎在当地邮局订阅,也可直接向编辑部订阅,全年70.0o元(含邮费).编辑部地址:兰州市小西湖西街98号;邮政编码:730050联系电话:(0931)8975420;E—mail:************。
关于乙醇在人体中代谢速率及治疗措施

临床医药文献杂志Journal of Clinical Medical 2019 年第 6 卷第 18 期2019 Vol.6 No.18198关于乙醇在人体中代谢速率及治疗措施田炜1,胡江涛2(1.信阳市公安局刑事科学技术研究所,河南信阳 464000;2.河南圣德司法鉴定中心,河南信阳 464000)【摘要】酒精也称乙醇,乙醇是各类酒类饮料中的主要成分,过量摄入乙醇会人体造成严重的损害。
乙醇在人的身体中的代谢,可以帮助人体将乙醇排出体外或帮助酒精分解,加强对乙醇的研究,了解乙醇在人体中的代谢过程,分析乙醇对人体的损害,有利于制定合理的、科学的应对治疗措施,从而减轻乙醇对人体的损害。
【关键词】乙醇;代谢;损害;措施【中图分类号】R33 【文献标识码】A 【文章编号】ISSN.2095-8242.2019.18.198.01乙醇是一种具有挥发性的液体,无色并具有透明的特点,乙醇是酒类饮料的主要成分,存在的比例也具有特殊性,以任何比例存在与酒类饮品中。
乙醇对人体具有一定的损害,乙醇在进入人体后,可以在短短5 min的时间内,出现在血液中,并且还可以在30~60 min,让人体内血液循环的浓度达到最高。
乙醇首先通过口腔,食道等器官,然后再经胃、肠器官,最后通过生物膜进入到人体的血液循环中。
1 乙醇在人体中的代谢过程乙醇在人体中的代谢是一个较为复杂的过程,也是酶的分解过程。
人体对乙醇的排出能力较弱,只有少量(2%~10%)的乙醇可以通过汗液、尿液、呼吸道直接被人体所排除体外,但是大部分的乙醇需要经过人体的肝脏,留在肝脏中经过酶进行分解。
人体的肝脏中含有大量的乙醇脱氢酶(ADH),在乙醇脱氢酶的催化作用下,可以将人体肝脏中的乙醇转化为乙醛。
整个转化过程具有一定的特殊性,需要较强的催化能力才能完成,乙醇脱氢酶的催化分解对乙醇在人体代谢起到了重要的作用。
其中乙醇转化为乙醛的过程为:2CH3CH2OH+O2→2CH3CHO+2H2O 乙醇乙醛。
线粒体乙醛脱氢酶(ALDH2)活性检测试剂盒说明书
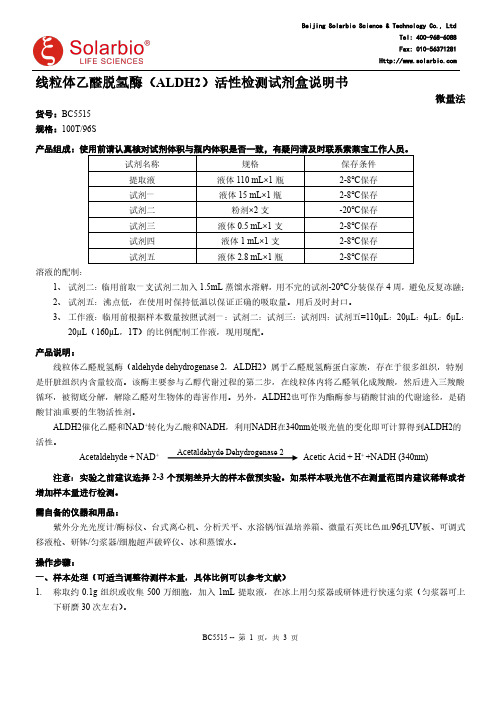
线粒体乙醛脱氢酶(ALDH2)活性检测试剂盒说明书微量法货号:BC5515 规格:100T/96S产品组成:使用前请认真核对试剂体积与瓶内体积是否一致,有疑问请及时联系索莱宝工作人员。
试剂名称 规格 保存条件 提取液 液体110 mL×1瓶 2-8℃保存 试剂一 液体15 mL×1瓶 2-8℃保存 试剂二 粉剂×2支 -20℃保存 试剂三 液体0.5 mL×1支 2-8℃保存 试剂四 液体1 mL×1支 2-8℃保存 试剂五液体2.8 mL×1瓶2-8℃保存溶液的配制:1、 试剂二:临用前取一支试剂二加入1.5mL 蒸馏水溶解,用不完的试剂-20℃分装保存4周,避免反复冻融;2、 试剂五:沸点低,在使用时保持低温以保证正确的吸取量。
用后及时封口。
3、 工作液:临用前根据样本数量按照试剂一:试剂二:试剂三:试剂四:试剂五=110µL :20µL :4µL :6µL :20µL (160µL ,1T )的比例配制工作液,现用现配。
产品说明:线粒体乙醛脱氢酶(aldehyde dehydrogenase 2,ALDH2)属于乙醛脱氢酶蛋白家族,存在于很多组织,特别是肝脏组织内含量较高。
该酶主要参与乙醇代谢过程的第二步,在线粒体内将乙醛氧化成羧酸,然后进入三羧酸循环,被彻底分解,解除乙醛对生物体的毒害作用。
另外,ALDH2也可作为酯酶参与硝酸甘油的代谢途径,是硝酸甘油重要的生物活性剂。
ALDH2催化乙醛和NAD +转化为乙酸和NADH ,利用NADH 在340nm 处吸光值的变化即可计算得到ALDH2的活性。
Acetaldehyde + NAD + Acetic Acid + H + +NADH (340nm)注意:实验之前建议选择2-3个预期差异大的样本做预实验。
如果样本吸光值不在测量范围内建议稀释或者增加样本量进行检测。
苏州科铭试剂盒总清单-5.3

咨询 800 420 2300 1200 1000 520 1100 580 1550 800 1200 620
L-半乳糖苷-1,4-内酯脱氢酶(Gal LDH)测试盒
L-半乳糖苷-1,4-内酯脱氢酶(Gal LDH)测试盒
抗坏血酸氧化酶(AAO)测试盒
抗坏血酸氧化酶(AAO)测试盒
抗坏血酸过氧化物酶(APX)测试盒
抗坏血酸过氧化物酶(APX)测试盒
单脱氢抗坏血酸还原酶(MDHAR)测试盒
单脱氢抗坏血酸还原酶(MDHAR)测试盒
微量法
紫外分光光度法
微量法
100管/48样 50管/24样 50管/48样 100管/96样 50管/48样 100管/96样 50管/48样 100管/96样 50管/48样 100管/96样 50管/48样 100管/96样 50管/48样 100管/96样 50管/48样
100管/96样
50管/48样
丙酮酸脱羧酶(PDC)测试盒
丙酮酸脱羧酶(PDC)测试盒
醇脱氢酶(ADH)测试盒
醇脱氢酶(ADH)测试盒
单脱氢抗坏血酸还原酶(MDHAR)测试盒
单脱氢抗坏血酸还原酶(MDHAR)测试盒
乙醛脱氢酶(ALDH)测试盒 乙醛脱氢酶(ALDH)测试盒
烟酸含量测试盒
微量法 可见分光光度法 高效液相色谱法
微量法 可见分光光度法
脱氢抗坏血酸还原酶(DHAR)测试盒
脱氢抗坏血酸还原酶(DHAR)测试盒
酒精代谢相关酶基因检测 项目简介

酒精代谢相关酶基因检测项目简介一个人的酒量85%是先天决定,而不是后天训练的,机体摄入的酒精90%以上在肝脏内主要靠乙醇脱氢酶(ADH)和乙醛脱氢酶(ALDH)进行代谢。
对酒精代谢相关酶基因检测:可以发现ADH1B和ALDH2基因的多态性,评估人体内乙醇脱氢酶和乙醛脱氢酶的活性高低,从而评价个体对酒精的耐受性。
检测结果的临床意义1、检测基因型为ADH1B*2/*2(有活性),ALDH2*1/*1(有活性),那么酒精在体内就可迅速变成乙酸而代谢排出,也就是真正的“酒篓子”。
2、检测基因型为ADH1B*1/*1(无活性)或ADH1B*1/*2(活性降低),ALDH2*2/*2(无活性)或ALDH2*1/*2(活性降低),那么乙醇主要靠肝脏里的P450慢慢氧化,易伤肝,经常会突然烂醉如泥。
3、检测基因型为ADH1B*2/*2(有活性);ALDH2*2/*2(无活性)或ALDH2*1/*2(活性降低),此类人群能迅速将乙醇转化成乙醛,乙醛使心率加快,外周血管扩张,心排血量增加,面部潮红,而乙醛只能依靠肝脏里的P450慢慢代谢为乙酸。
基因型与酒精耐受性关系1、基因型为ADH1B*1/*1:乙醇转化为乙醛的速度慢,容易导致酗酒。
2、个体对酒精的耐受性主要受ALDH2基因型的影响:基因型为ALDH2*1/*1:对酒精耐受性高基因型为ALDH2*1/*2:对酒精有一定的耐受性基因型为ALDH2*2/*2:对酒精敏感,没有耐受性标本采集要求1、EDTA抗凝全血3-5ml,2~8℃保存,当天送检。
2、送样时,请写清楚送检单位、姓名、性别、年龄、联系方式、科室等基本信息。
3、注意事项:该项目血液标本不得使用肝素抗凝,避免标本凝固。
临床项目收费标准。
乙醛脱氢酶测定方法

乙醛脱氢酶测定方法
需要注意的是,具体的实验步骤和条件可能因实验目的、样品类型和实验室设备而有所不 同。在进行乙醛脱氢酶测定前,应参考相关的步骤: 1. 准备一组试管,每个试管中加入以下试剂(体积可根据需要调整): - 0.1 M 磷酸盐缓冲液 1 mL - 0.1 M 乙醛溶液 0.1 mL - 待测样品 0.1 mL(如果有) 2. 在每个试管中加入适量的乙醛脱氢酶溶液,使最终体积为2 mL。 3. 在每个试管中加入适量的NAD+溶液,使最终体积为3 mL。 4. 将试管放入37°C的恒温水浴中,孵育一定时间(通常为10-30分钟)。
乙醛脱氢酶测定方法
5. 孵育结束后,使用分光光度计测量每个试管中的吸光度。乙醛脱氢酶催化乙醛氧化生 成乙酸,同时还伴随着NAD+还原为NADH。通过测量NADH的吸光度变化,可以间接测定 乙醛脱氢酶的活性。
6. 使用一个空白试管作为对照,其中不加入乙醛溶液,其他步骤相同。
3. 数据分析: - 计算每个试管的吸光度差值(样品试管减去空白试管)。 - 根据已知的标准曲线或对照样品,将吸光度差值转换为乙醛脱氢酶的活性。
乙醛脱氢酶测定方法
乙醛脱氢酶(aldehyde dehydrogenase,ALDH)是一种酶,主要参与乙醛的代谢过程 。以下是一种常用的乙醛脱氢酶测定方法:
1. 材料准备: - 0.1 M 磷酸盐缓冲液(pH 7.4) - 0.1 M 乙醛溶液 - 0.1 M NAD+(辅酶)溶液 - 待测样品
乙醛脱氢酶测定方法
小鼠乙醇脱氢酶(ADH)说明书
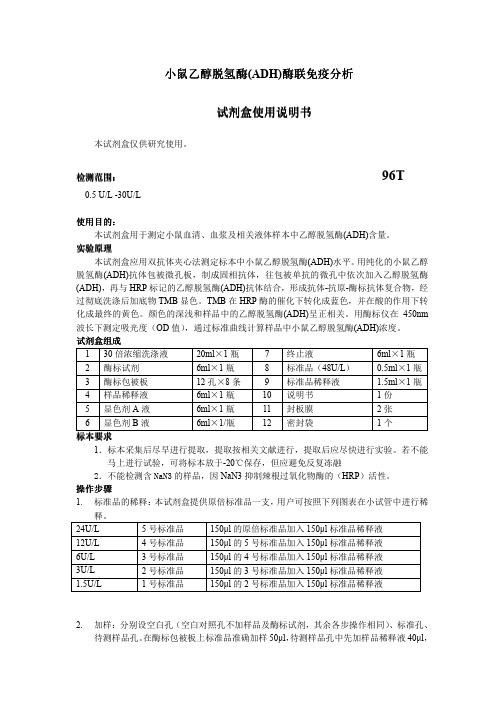
小鼠小鼠乙醇脱氢酶乙醇脱氢酶(ADH)酶联免疫酶联免疫分析分析分析试剂试剂盒使用说明书盒使用说明书盒使用说明书本试剂盒仅供研究使用。
检测范围检测范围:: 96T0.5 U/L -30U/L使用目的使用目的::本试剂盒用于测定小鼠血清、血浆及相关液体样本中乙醇脱氢酶(ADH)含量。
实验原理本试剂盒应用双抗体夹心法测定标本中小鼠乙醇脱氢酶(ADH)水平。
用纯化的小鼠乙醇脱氢酶(ADH)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入乙醇脱氢酶(ADH),再与HRP 标记的乙醇脱氢酶(ADH)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB 显色。
TMB 在HRP 酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的乙醇脱氢酶(ADH)呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中小鼠乙醇脱氢酶(ADH)浓度。
试剂盒组成 1 30倍浓缩洗涤液 20ml ×1瓶 7 终止液6ml ×1瓶 2 酶标试剂 6ml ×1瓶 8 标准品(48U/L ) 0.5ml ×1瓶 3 酶标包被板 12孔×8条 9 标准品稀释液 1.5ml ×1瓶 4 样品稀释液 6ml ×1瓶 10 说明书 1份 5 显色剂A 液 6ml ×1瓶 11 封板膜 2张 6显色剂B 液6ml ×1/瓶12密封袋1个标本标本要求要求1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3的样品,因NaN3抑制辣根过氧化物酶的(HRP )活性。
操作步骤1. 标准品的稀释:本试剂盒提供原倍标准品一支,用户可按照下列图表在小试管中进行稀释。
24U/L 5号标准品 150µl 的原倍标准品加入150µl 标准品稀释液 12U/L 4号标准品 150µl 的5号标准品加入150µl 标准品稀释液 6U/L 3号标准品 150µl 的4号标准品加入150µl 标准品稀释液 3U/L 2号标准品 150µl 的3号标准品加入150µl 标准品稀释液 1.5U/L1号标准品150µl 的2号标准品加入150µl 标准品稀释液2. 加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、待测样品孔。
IVD检验代码

FT4 总三碘甲状腺原氨酸测定试剂盒(化学发光法) TT3 甲功七项 TT4 TSH
TPO TGAB
总甲状腺素测定试剂盒(化学发光法) 超敏人促甲状腺激素测定试剂盒(化学发光法)
抗甲状腺过氧化物酶抗体测定试剂盒(化学发光法) 甲状腺球蛋白抗体测定试剂盒(化学发光法) 甲状腺球蛋白测定试剂盒(化学发光法) 甲胎蛋白测定试剂盒(化学发光法) 癌胚抗原测定试剂盒(化学发光法) 癌抗原125定量检测试剂盒(化学发光法) 癌抗原15-3定量检测试剂盒(化学发光法) 糖类抗原19-9定量检测试剂盒(化学发光法) 前列腺特异抗原测定试剂盒(化学发光法)
TG AFP 肿瘤抗原1 CEA CEA125 CEA153 肿瘤抗原2 CEA199 PSA
FPSA 免疫 FER FOL 贫血三项
游前列腺特异抗原测定试剂盒(化学发光法) 铁蛋白测定试剂盒(化学发光法) 叶酸测定试剂盒(化学发光法)
维生素B12测定试剂盒(化学发光法) VB12 LH FSH PROG E2 UE3 性激素 HGH TESTO PRL
FT4 总三碘甲状腺原氨酸校准品 TT3 TT4 TESTO 免疫校准品 PRL LH FSH PROG E2 HGH PTH COR TGAB TPO TG FER UE3 VB12 FOL 甲状腺球蛋白抗体校准品 抗甲状腺过氧化物酶抗体校准品 甲状腺球蛋白校准品 铁蛋白校准品 雌三醇校准品 维生素B12校准品 叶酸校准品 免疫球蛋白A检测试剂盒(免疫比浊法) Immunoglobulin A 免疫球蛋白G检测试剂盒(免疫比浊法) 免疫球蛋白M检测试剂盒(免疫比浊法) Immunoglobulin M 补体C3检测试剂盒(免疫比浊法) C0mplement C3 补体C4检测试剂盒(免疫比浊法) λ 轻链检测试剂盒(免疫比浊法) 特定蛋白 κ 轻链检测试剂盒(免疫比浊法) Kappa Light Chain C反应蛋白检测试剂盒(免疫比浊法) 抗链球菌溶血素O检测试剂盒(免疫比浊法) 孕酮校准品 雌二醇校准品 人生长激素校准品 甲状旁腺激素校准品 皮质醇校准品 泌乳素校准品 黄体生成素校准品 促卵泡生成激素校准品 总甲状腺素校准品 睾酮校准品
人类乙醇脱氢酶基因型鉴定实验报告

人类乙醇脱氢酶基因型鉴定实验报告人类乙醇脱氢酶基因型鉴定实验报告酒精是一种常见的神经系统抑制剂,它会让人产生感觉的放松和愉悦,并且也会增加人们对危险和冒险的倾向。
然而,在接触酒精时,每个人的反应可能会存在差异,这是因为乙醇代谢速率的遗传变异可能会影响个体对酒精的敏感性和酒精耐受能力。
因此,研究乙醇代谢的相关基因变异可以为精准的药物治疗和预防酒精滥用提供重要的指导和支持。
本实验旨在通过检测人类乙醇脱氢酶(ADH)的基因型,探索ADH基因多态性对酒精代谢能力的影响,并为相关药物治疗提供参考。
实验方法本实验选取了50名年龄在18-35岁之间的健康成年人作为研究对象,均为中国汉族人。
通过采集被试者的口腔黏膜细胞,提取DNA,然后进行基因型分析。
在此基础上,分析ADH1B*1、ADH1B*2、ADH1B*3、ADH1C*1、ADH1C*2、ADH4*1和ADH4*2这7个ADH基因突变位点的基因型分布情况,并进一步分析这些基因型与乙醇代谢速率的相关性。
结果和分析实验结果表明,ADH基因突变位点的基因型频率在被试者中存在差异。
其中,ADH1B*2位点的基因型频率最高,为36%,其次是ADH1C*1和ADH1C*2位点的基因型频率,分别为26%和22%。
而ADH1B*1、ADH1B*3、ADH4*1和ADH4*2位点的基因型频率较低,分别为6%、6%、2%和2%。
进一步分析发现,ADH1B*2位点的基因型与乙醇代谢速率之间存在很大的关联性。
具体来说,该基因型的个体乙醇代谢速率较快,一般较为耐酒,容易产生饮酒后仍然保持理智和冷静的感觉。
而ADH1C*1和ADH1C*2位点的基因型与乙醇代谢速率关联性较小,可能会导致人体对酒精的摄入量有较大的差异。
结论和建议通过本实验的研究,我们可以初步认识到酒精代谢的遗传变异对人们饮酒行为的影响。
ADH基因突变位点的分布和相应基因型的差异,可能导致不同个体对酒精的代谢能力不同,甚至在同等条件下出现酒精含量差异较大的现象。
西医综合(研究生考试)-生物化学- 第四章 生化专题题库

西医综合(研究生考试)生物化学-第四章生化专题题库[单选题] 1、下列酶中能直接影响细胞内cAMP含量的是()。
A ATP酶B 磷脂酶CC 蛋白激酶AD 磷酸二酯酶正确答案:D答案解析:能直接影响细胞内cAMP含量的酶有腺苷酸环化酶和磷酸二酯酶:①ATP在腺苷酸环化酶作用下脱去焦磷酸,环化生成cAMP,由此使cAMP含量增加;②cAMP经磷酸二酯酶催化水解酯键,则开环转变为5′-AMP,从而使cAMP含量减少。
ABC三项,3种酶与cAMP含量变化无直接关系。
[单选题] 2、蛋白质合成后的靶向输送过程中,能识别信号肽的物质是()。
A GTP酶B 酯酶C SRPD 转肽酶正确答案:C答案解析:信号肽是各种新生分泌蛋白的N端保守的氨基酸序列。
蛋白质合成后经过复杂机制,定向输送到最终发挥生物功能的目标地点的过程,称蛋白质的靶向输送。
分泌蛋白靶向进入内质网,需要多种蛋白成分的协同作用:如真核细胞胞液内存在的信号肽识别颗粒(SRP),SRP可结合GTP,具有GTP酶活性,内质网膜上有SRP受体,可结合SRP。
[单选题] 3、钙调蛋白参与多种酶作用的调控,它属于()。
A 跨膜信息转导的G蛋白家族B 钙结合蛋白家族C 免疫球蛋白家族D 蛋白质激素家族正确答案:B答案解析:钙调蛋白(CaM)为钙结合蛋白,是一条多肽链组成的单体蛋白,是细胞内重要的调节蛋白[单选题] 4、血浆清蛋白的功能不包括()。
A 营养作用B 缓冲作用C 运输作用D 免疫功能正确答案:D答案解析:血浆蛋白主要分清蛋白和球蛋白组成,清蛋白占血浆总蛋白的50%。
血浆蛋白的作用有:①维持血浆胶体渗透压,其中清蛋白所产生的胶体渗透压占75%~85%;②维持血浆正常pH,即缓冲作用;③运输作用,运输脂溶性物质;④免疫作用,主要是免疫球蛋白;⑤催化作用;⑥营养作用;⑦凝血、抗凝血和纤溶作用。
D项,具有免疫功能的是免疫球蛋白,而血浆清蛋白不具有免疫功能。
[单选题] 5、成熟红细胞获得能量的唯一途径是()。
一种测定乙醇脱氢酶活性的循环催化流动分析法

一种测定乙醇脱氢酶活性的循环催化流动分析法王恒;李永生;高秀峰;田甜;林玉莲【摘要】基于乙醇(EtOH)/乙醇脱氢酶(ADH)/氧化型辅酶I(NAD+)催化反应体系,建立了一种用于ADH活性测定的循环催化流动分析法(RCFA),并优选该测定体系的实验条件,得到如下参:Tris-HCl缓冲液浓度(pH 8.9)为0.1 mol/L.EtOH的浓度为15.6 mol/L,NAD+浓度为9.0 mmol/L,ADH用量20 μL/次,反应液流速为0.98 mL/min,反应液体积为2 mL;ADH的测定范围为0.6~50 U/L,检出限为0.14 U/L,相对标准偏差≤1.3%(n=11).RCFA法具有测定过程简便、快速、自动化特点,能对ADH催化反应过程进行连续循环检测,可对ADH活性变化实现动态研究.RCFA法使反应液循环不但节省了大量的试剂和酶量、降低了测定成本,而且循环测定时不存在人为误差,提高了测定结果的准确度.【期刊名称】《酿酒科技》【年(卷),期】2010(000)010【总页数】4页(P100-102,114)【关键词】循环催化流动分析;乙醇脱氢酶;乙醇;氧化型辅酶I;酿酒酵母菌【作者】王恒;李永生;高秀峰;田甜;林玉莲【作者单位】四川大学化学工程学院,四川,成都,610065;四川大学化学工程学院,四川,成都,610065;四川大学华西基础医学与法医学院,四川,成都,610041;四川大学化学工程学院,四川,成都,610065;四川大学化学工程学院,四川,成都,610065【正文语种】中文【中图分类】TQ920.1%Q55%O65乙醇脱氢酶(Alcohol dehydrogenase,ADH)是生物体内一种重要的代谢酶,具有广泛的底物特异性[1]。
目前ADH被广泛应用,例如,ADH用于制作测定乙醇浓度的生物电极和乙醇生物传感器[2-3],酿酒发酵中ADH与乙醛脱氢酶结合为酵母菌提供能量并使细胞免受过量乙醇的毒害 [4],ADH与乙醛脱氢酶的结合用于生产食醋[5],ADH也是人体重要的生理指标之一[6-7]。
ALDH2基因分型测试说明书

ALDH2 Morgan™ SSP分型检测试剂盒由美国TBG有限公司(TBG, Inc)生产。
ALDH2基因位于人类第12号染色体,由于ALDH2 基因存在G1510A 多态性,导致氨基酸序列第487位上的谷氨酸被赖氨酸所替换( Glu487 Lys),其中具有催化活性的野生型称为G等位基因(ALDH2*1) ,催化能力失活的变异型称为A 等位基因(ALDH2*2) 。
在亚洲的黄种人群中, ALDH2*2是频率最高且最重要的突变型.本产品每块板48个ALDH2分型测试,此试剂盒具有可靠、简便、快速、重复性高等显着特点。
实验背景ALDH2与酒精性疾病乙醛脱氢酶( aldehyde dehydrogenase, ALDH)和乙醇脱氢酶( alcohol dehydrogenase, ADH) 在人体内共同组成了人乙醇脱氢酶系, 负责催化人体的乙醇分解代谢。
ALDH2在肝和胃中具有很高的表达量, 是乙醇代谢途径中最重要的酶之一。
研究发现, 突变型基因ALDH2*2的存在能导致ALDH2活力的严重缺失, 并与过度饮酒导致的酒精依赖、酒精性中毒、酒精性肝病、消化道癌症等疾病之间存在深刻的联系。
过度的饮酒行为, 不仅使ALDH2*2 携带者对酒精产生依赖, 还可能引起肝癌等的酒精性肝病(alcoholic liver disease, ALD)。
ALD是长期、大量饮酒所引起的肝脏病变, 已成为现代社会的主要健康隐忧之一。
研究显示,携带ALDH2 变异基因型者大量饮酒将显著增加患肝癌的危险性,同时研究发现, ALDH2*2突变与饮酒人群患消化道癌的风险之间具有明显的联系。
此外,ALDH2*2显性突变与胃癌的易感性也存在一定的联系。
由此可见, ALDH2*2突变是增加区域性癌化几率的重要因素之一。
ALDH2与硝酸甘油治疗硝酸甘油是治疗心绞痛的经典药物,研究发现硝酸甘油的舒血管作用是通过释放一氧化氮(NO)所介导。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乙醇脱氢酶(ADH)检测试剂盒(乙醛比色法)
简介:
乙醇脱氢酶(Alcohol dehydrogenase,ADH)的系统名为乙醇:辅酶I氧化还原酶(alcohol:NAD+oxidoreductase),大量存在于人和动物肝脏、植物及微生物细胞之中,是一种含锌金属酶,具有广泛的底物特异性。
乙醇脱氢酶够以烟酰胺腺嘌呤二核苷酸(NAD)为辅酶,催化伯醇和醛之间的可逆反应:CH3CH2OH+NAD+→CH3CHO+NADH+ H+。
在人和哺乳动物体内,乙醇脱氢酶与乙醛脱氢酶(ALDH)构成了乙醇脱氢酶系,参乙醇脱氢酶与体内乙醇代谢,是人和动物体内重要的代谢酶。
作为生物体内主要短链醇代谢的关键酶,它在很多生理过程中起着重要作用。
丙酮酸脱羧酶(PDC)、乙醇脱氢酶(ADH)是乙醇发酵途径的关键酶,无氧呼吸途径代谢产物的过程积累对细胞产生毒性,影响线粒体结构和三羧酸循环的相关酶活性。
Leagene乙醇脱氢酶(ADH)检测试剂盒(乙醛比色法)检测原理是在弱碱条件下,以乙醛为底物,乙醛在ADH催化下被NADH还原为乙醇,ADH每催化1分子乙醛消耗1分子NADH,通过分光光度比色法(分光光度计)测定吸光度的变化,计算出NADH的消耗速率进一步推算出乙醇脱氢酶活性水平。
该试剂盒主要用于检测植物样本、血清等中乙醇脱氢酶活性。
该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
组成:
自备材料:
1、研钵或匀浆器
2、离心管或试管
3、低温离心机
4、比色杯
5、分光光度计编号
名称TE0473
50T
Storage
试剂(A):ADH Lysis buffer250ml4℃避光试剂(B):PMSF1ml-20℃
试剂(C):ADH Assay buffer100ml RT
试剂(D):NADH1支-20℃
使用说明书1份
操作步骤(仅供参考):
1、配制ADH Lysis buffer工作液:取出ADH Lysis buffer和PMSF,恢复至室温,ADH
Lysis buffer:PMSF按一定的的比例混合,混匀,即配即用,不易久置,否则蛋白酶抑制剂PMSF的效率会有所下降。
2、准备样品:
①植物样品:取植物组织(根系)清洗干净,切碎,植物组织:ADH Lysis buffer工作液按一定的比例,加入预冷的ADH Lysis buffer工作液,冰浴情况下充分匀浆或研磨。
,离心,留取上清液即为乙醇脱氢酶粗提液。
短期4℃保存待用,长期-20℃冻存待用。
②血浆、血清和尿液样品:血浆、血清按照常规方法制备后可以直接用于本试剂盒的测定,冻存,用于乙醇脱氢酶的检测。
③细胞或组织样品:取恰当细胞或组织裂解液,如有必要用ADH Lysis buffer工作液进行适当匀浆,离心,取上清液,冻存,用于乙醇脱氢酶的检测。
④高活性样品:如果样品中含有较高活性的乙醇脱氢酶,可以使用ADH Lysis buffer工作液进行恰当的稀释。
3、配制NADH工作液:取出NADH,恢复至室温,准确溶解于ddH2O,混匀,4℃预冷
备用。
-20℃保存1周有效。
注意:该NADH工作液为过量。
4、配制ADH Assay buffer工作液:取出ADH Assay buffer、NADH工作液,恢复至室
温,ADH Assay buffer:NADH工作液,混匀,即为ADH Assay buffer工作液。
最好即配即用,4℃预冷备用,-20℃保存1周有效。
5、ADH加样:按照下表设置对照管(备选,一般可以不设对照管)、测定管,溶液应按照
顺序依次加入,并注意避免产生气泡。
如果样品中的乙醇脱氢酶活性过高,可以减少样品用量或适当稀释后再进行测定,样品的检测最好能设置平行管。
加入物(ml)对照管(备选)测定管
ADH Lysis buffer0.025—
待测样品—0.025
ADH Assay buffer工作液22
6、ADH测定:加入ADH启动剂,立即以分光光度计(1cm光径比色杯)测定吸光度(记为
A0)并同时计时,每隔30s测定一次吸光度,其中至1min时吸光度记为A1,记录其变化。
Leagene建议加入ADH启动剂后立即检测,加样时间越短越好,其反应基本在1-3min内,其后反应趋于平缓。
注意:该反应系统是利用速率变化,求得相应OD的变化,进而推算出NADH的消耗速率,再进一步推算出乙醇脱氢酶的量。
因此加入ADH启动剂立即计时很重要,每次检测指标不宜过多,否则有可能由于操作时间有差异进而导致结果偏差。
计算:
乙醇脱氢酶活性定义:每分钟NADH氧化吸光度变化0.01为1个酶活力单位。
液体样品ADH(U/ml·min)=ΔA/(0.01×t×0.025)
式中:ΔA=A0−A1(如有必要,可再减去对照最初1min的吸光度变化量)
0.01=每分钟NADH氧化吸光度变化0.01为1个酶活力单位
t=1=检测时间(min)
0.025=待测样品体积(ml)
组织样品ADH(U/g·min)=ΔA/(0.01×t×W)
式中:ΔA=A0−A1(如有必要,可再减去对照最初1min的吸光度变化量)
0.01=每分钟NADH氧化吸光度变化0.01为1个酶活力单位
t=1=检测时间(min)
W=待测样品鲜重或干重(g)
组织或植物粗酶液获得率(ml)=上清液体积(ml)/组织或植物质量×100%
注意事项:
1、实验材料应尽量新鲜,如取材后不立即使用,应存于-20~-80℃。
2、待测样品中不能含有磷酸酶抑制剂,同时需避免反复冻融。
3、如果没有分光光度计,也可以使用普通的酶标仪测定,但应考虑酶标仪的最大检测体
积。
4、该反应系统是利用速率变化,求得相应OD的变化,进而推算出NADH的消耗速率,
再进一步推算出乙醇脱氢酶的量。
因此加入ADH启动剂立即计时很重要,每次检
测指标不宜过多,否则有可能由于操作时间有差异进而导致结果偏差。
5、酶液的稀释度应尽量控制在A340/min下降范围在0.1-0.2之间,以便减少实验误差。
6、ΔA为反应最初1min内340nm处吸光度变化的绝对量,如有必要可减去对照液最初
1min的吸光度变化量。
7、所测样本的浓度过高,应用ADH Lysis buffer工作液稀释样品后重新测定。
有效期:6个月有效。
