-2017年医疗器械临床试验核查项目汇总表
医疗器械临床试验结题确认表项目名称

医疗器械临床试验结题确认表
说明:1. 资料归档:资料整理完毕,已提供详细电子目录及电子版资料文档。
由机构办公室档案管理员签字。
2. 伦理审核:伦理结题审核完毕,已有批件。
由伦理委员会秘书签字。
3. 试验用医疗器械管理:相关表格填写无误,试验用医疗器械已回收处置。
由机构办项目
管理员签字。
4. 在研质控:科室和机构均已完成至少三次在研质控,上交在研质控检查表和在研质控报
告(包括机构和科室)。
由负责本项目的科室在研质控员及机构质控员签字。
5. 结题质控:已完成结题质控,问题处理完毕,已有结题质控报告。
由结题质控员签字。
6. 财务事宜:已完成财务核算,并提供由主要研究者签字的财务核算报告。
由财务管理员签字。
医疗器械临床试验形式审查记录表试验名称

医疗器械临床试验形式审查记录表
注:
1.“备注”项由审核人填写。
2、所有须注明版本号、版本日期的资料均为通过组长单位伦理审查的最新版本。
3.每一份机构立项纸质资料以黑色两孔文件夹(快劳夹)装订,递交信放首页,递交信后放《立项申请审批表》,《立项申请审批表》之后放《形式审查记录表》,此记录表双面打印1张。
《形式审查记录表》之后是形式审查材料目录条款中对
应的详细资料,按序号顺序放置,各项之间用带数字编号隔页纸隔开。
机构立项资料递交一式2份(即准备2个一样的文件夹),1份用于机构办存档,1份于获得伦理批件后换取作为研究者文件夹。
文件夹按模板式样贴好侧标签。
4.上述表格及具体材料中,申办方/CRO公司相关部分需加盖其公章、骑缝章;研究者相关部分需PI签名。
5.为存放项目过程中新增文件及资料,请另准备2个A4尺寸的55mm厚度的蓝色文件盒,递交纸质版立项资料时一并交机构办。
6、填写时不要更改此模板,没有的项保留目录序号,选择“无”;不适用的项选择“不适用”;超出此目录的项自行往下增加序号及相应信息。
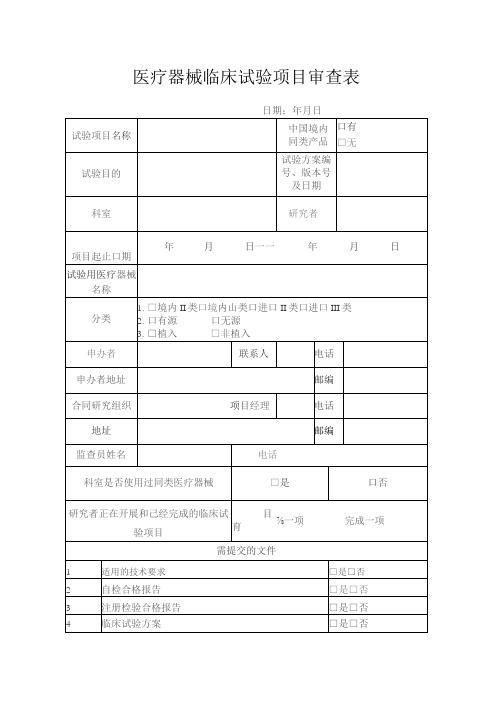
医疗器械临床试验项目审查表
15
其他与伦理审查相关的材料
□是□否
申办方申请意向及盖章:
年月日
研究者所在科室意见:
负责人签名:
年月日
临床试验机构的管理部门意见:
口同意,准备递交伦理审查
口不同意
口暂不同意,补充资料
口其它
签名;
年月日
□是□否
8
研究者资格证明文件
□是□否
9
病例报告表文本
□是□否
10
临床试验机构的设施条件能够满足试验的综述
□是□否
11
申办者及代理人(如有)资质证明文件
□是□否
12
试验用医疗器械的研制符合适用的医疗器械质量管理体系相关要求的声明
口是口否
13
申办者保证所提供资料真实性的声明
□是□否
14
研究者保证所提供资料真实性的声明
医疗器械临床试验项目审查表
日期:年月日
试验项目名称
中国境内
同类产品
口有
□无
试验目的
试验方案编号、版本号及日期
科室
研究者
项目起止口期
年月日一一年月日
试验用医疗器械名称
分类
1.□境内II类口境内山类口进口II类口进口III类
2.口有源口无源
3.□植入□非植入
申办编
合同研究组织
项目经理
电话
地址
邮编
监查员姓名
电话
科室是否使用过同类医疗器械
□是
口否
研究者正在开展和己经完成的临床试验项目
目育
⅞一项完成一项
需提交的文件
1
适用的技术要求
□是□否
2
自检合格报告
江苏省2017年医疗器械临床试验监督抽查项目

20170126
术股份有限公司 院
法)
人绒毛膜促性腺激素检测
苏械临备
南 通 伊 仕 生 物 技 吉林省中医药科学院第一临床医
34
试剂盒(胶体金免疫层析
20170127
术股份有限公司 院
法)
苏 械 临 备 游离β-人绒毛膜促性腺激 南 通 伊 仕 生 物 技 吉林省中医药科学院第一临床医
35
20170128
18
常州市第二人民医院
20170101
体金法)
苏有限公司
中性粒细胞明胶酶相关脂
苏 械 临 备 质运载蛋白/尿微量白蛋 瑞莱生物科技江
19
常州市第二人民医院
20170102
白联合检测试剂(胶体金 苏有限公司
法)
苏 械 临 备 肌红蛋白(Myoglobin)检 瑞 莱 生 物 科 技 江
20
常州市第二人民医院
试剂盒(免疫荧光法)
苏 械 临 备 胱抑素 C 检测试剂(胶体 瑞 莱 生 物 科 技 江
25
常州市第二人民医院
20170108
金法)
苏有限公司
苏 械 临 备 D-二聚体检测试剂盒(胶 南 通 伊 仕 生 物 技 吉林省中医药科学院第一临床医
26
20170119
体金法)
术股份有限公司 院
苏 械 临 备 肌红蛋白检测试剂盒(胶 南 通 伊 仕 生 物 技 吉林省中医药科学院第一临床医
8
抑菌抗炎型鼻腔喷雾器
河南省中医院(河南中医学院第
20170013
限公司
二附属医院)
苏械临备
9
低频神经调控仪
20170044
无锡神平心泰医 上海中医药大学附属曙光医院
YYT0287-2017医疗器械内审检查表(内容已填写)全部门

18
11.3.1
量、不良事件、顾客反馈和质量管理体系运 行有关的数据,验证产品安全性和有效性,
并保持相关记录。
查看数据分析的实施记录,是否按程序规定 进行,是否应用了统计技术并保留了数据分 析结果的记录。
是。查看《程序文件》 FX/CX 8.4 《数据分析 程序》。符合要求
应当建立质量管理体系内部审核程序,规定
17
*8.5.1
应当规定产品放行程序、条件和放行批准要 求。
查看产品放行程序,是否明确了放行的条件 和放行批准的要求。应当规定有权放行产品 人员及其职责权限, 并应当保持批准的记录。
是。查看《管理文件》 FX/GL 8.2.4-03 《产 品放行管理制度》 。符合要求
应当建立数据分析程序,收集分析与产品质
*4.1.1
应当建立健全质量管理体系文件,包括质量 方针和质量目标、质量手册、程序文件、技 术文件和记录,以及法规要求的其他文件。
标准实用
查看管理者代表的任命文件。 查看是否对上述职责作出明确规定。查看管 理者代表报告质量管理体系运行情况和改进 的相关记录。 查看相关人员的资格要求。
是。查看《质量手册》 ,企业按照法律、法规 和规章的要求编写文件、组织生产。符合要 求
FX/ JL8.2.2-03 审核日期
受审部门
序号
涉及条款
1
1.1.1
2
*1.1.2
3
1.2.1
4
1.2.2
5
1.2.3
6
1.2.4
2017.04.07
标准实用
XXXX医疗器械有限公司
内部审核检查表
审核人员
XXXX、 XXXX、 XXXX
№ :201704070001
邵逸夫医院专业医疗器械临床试验总结表

邵逸夫医院专业医疗器械临床实验总结表
验证项目名称:方案编号:
是否进口产品有否进口许可证:是否国内新产品:
验证产品:规格:
有否批准文号、日期:产品检测合格文件批号:
产品生产厂家:
申办者:
联系人及电话:
:
第一例受试者入组日期:年月日
最后一例受试者出组日期:年月日
合同签订入组人数例,筛选人数例,入组人数例,完成例数例脱落例,剔除例,严重不良事件例,不良事件例
附受试者筛选入选表(和研究者代表签名)
参加研究人员:
小结:主要数据来源情况
主要研究者()签名:负责项目协调研究者签名:
监查员签名:临床实验机构办公室审核签名:
监查员联系方式:
临床实验机构负责人签名:
日期:年月日。
临床试验核查项目一览表【模板】

完成试验受试者编码目录
受试者各信息与筛选入组表中的信息一致
3
其他类文件
以下文档质控时若无可不查
3.1
分中心小结表
本中心的信息如入组数量、SAE数量等总结无误
3.2
统计分析报告
查看各方面信息是否准确无误
3.3
总结报告
查看各方面信息是否准确无误
3.4
至伦理委员会的结题报告
查看各方面信息是否准确无误
CFDA批件号:______
CFDA批准日期:______
试验应在批件有效期内前开始实施(目前为3年内)
1.2
伦理委员会相关文件
本院伦理委员会共______次会审,______次快审。
首次伦理批准时间:______
有本院伦理委员会(及组长单位)历次批件、委员会成员表等复印件
各批件信息准确
1.3
研究者手册
4
4.1
原始医疗记录(包括住院、门诊病历、化验单、检查单、患者日志、医生科研病历记录、AE/合并用药表格等等)
1、病历中应有参与该临床试验的记录
2、受试者原始文件中相关信息应符合入选/排除标准,查看各种检查/检验结果(项目是否有遗漏,是否在窗口内,结果是否符合方案要求)
3、受试者入组、随机、访视、合并用药、不良事件均需准确、完整记录(查看是否由授权的医师进行;各种原始记录是否有不一致)
实际完成病例数
第一例受试签署ICF时间
最后一例受试者完成时间
试验过程中发生SAE发生例数
2.核查记录(因各项目不同,包括但不限于以下文件)
序号
文件名称
检查要点
检查结果
备注
有
无
NA
1
研究者文件夹
邵逸夫医院 专业医疗器械临床试验总结表

附受试者筛选/入选表(PI和研究者代表签名)
参加研究人员:
小结:主要数据来源情况
主要研究者(PI)签名: 负责项目协调研究者签名:
监查员签名: 临床试验机构办公室审核签名:
监查员联系方式:
临床试验机构负责人签名:
日期: 月 日
邵逸夫医院专业医疗器械临床试验总结表
验证项目名称:方案编号:
是否进口产品有否进口许可证:是否国内新产品:
验证产品:规格:
有否批准文号、日期:
产品检测合格文件批号:
产品生产厂家:
申办者:
CRO:
联系人及电话:
第例受试者入组日期:月日
最后例受试者出组日期:月日
合同签订入组人数例 ,筛选人数来自 ,入组人数例,完成例数例
临床试验的分中心小结表(医疗器械、体外诊断试剂)

试验盲态:□双盲□单盲□非盲有无紧急揭盲:□无□有
试验期间方案偏பைடு நூலகம்情况
□无□有(如有,提供受试者方案偏离的具体情况)
本中心医疗器械缺陷和严重不良事件发生情况
医疗器械缺陷:□无□有严重不良事件:□无□有
临床研究监查情况
委派临床试验监查员单位:□申办方□CRO监查次数:次监查质量评价:
主要研究者意见
签字:日期:
本中心临床试验机构管理部门审核意见
盖章:日期:
表1:参加试验人员列表
姓名
科室
职称
研究中的职务
研究中分工
表2:受试者入选情况一览表
受试者筛
选号
受试者姓
名缩写
医疗器
械编号
知情同
意日期
筛选失
败原因
入组
日期
是否
脱落
脱落
原因
完成(随
访)日期
临床试验的分中心小结表(医疗器械/体外诊断试剂)
试验名称
试验目的
申办者/CRO
试验用医疗器械
名称
型号规格
分类
1
□境内Ⅱ类□境内Ⅲ类□进Ⅱ类□进Ⅲ类
2
□有源□无源□体外诊断试剂
3
□植入□非植入
需进行临床试验审批的第三类医疗器械
□是□否
中国境内同类产品
□有□无
多中心临床试验
□是□否
组长单位
本中心试验专业名称
主要研究者
参加试验人员(可提供附表)
参加试验人员姓名、职称、科室、研究中分工等信息(附表1)
本中心伦理委员会批准日期
试验计划入组受试者数
筛选人数
随机化/入组人数
YYT0287-2017医疗器械内审检查表(内容已填写)全部门.doc

XXXX医疗器械有限公司内部审核检查表FX/ JL8.2.2-03审核日期2017.04.07审核人员受审部门管理层受审部门负责人№:201704070001 XXXX、 XXXX、 XXXXXXXX序号涉及条款检查内容1 1.1.1 应当建立与医疗器械生产相适应的管理机构,具备组织机构图。
2 *1.1.2 应当明确各部门的职责和权限,明确质量管理职能。
3 1.2.1 企业负责人应当是医疗器械产品质量的主要责任人。
4 1.2.2 企业负责人应当组织制定质量方针和质量目标。
5 1.2.3 企业负责人应当确保质量管理体系有效运行所需的人力资源、基础设施和工作环境。
企业负责人应当组织实施管理评审,定期对6 1.2.4 质量管理体系运行情况进行评估,并持续改进。
7 *1.2.5 企业负责人应当确保企业按照法律、法规和规章的要求组织生产。
检查方法查看提供的质量手册,是否包括企业的组织机构图,是否明确各部门的相互关系。
查看企业的质量手册,程序文件或相关文件,是否对各部门的职责权限作出了规定;质量管理部门应当能独立行使职能, 查看质量管理部门的文件,是否明确规定对产品质量的相关事宜负有决策的权利。
查看质量方针和质量目标的制定程序、批准人员。
查看管理评审文件和记录,核实企业负责人是否组织实施管理评审。
检查结果是。
查《质量手册》中的 FX/SC 2.0 《组织机构图》和 FX/SC 3.0 《职责分配表》。
符合要求是。
查《质量手册》和《程序文件》 FX/CX 5.5《职责、权限与内部沟通程序》。
符合要求是。
查《任命书》与《生产许可证》,企业负责人为蔡俊,为医疗器械产品质量的主要责任人。
符合要求是。
查《质量手册》,质量方针由总经理组织制定并签发,质量方针和目标不适宜时需由总经理组织修订并重新签发。
符合要求是。
查看《程序文件》 FX/CX 6.1 《资源管理程序》,有以上规定。
符合要求是。
查看《程序文件》 FX/CX 5.6 《管理评审程序》,有以上规定。
医疗器械临床试验项目审批表
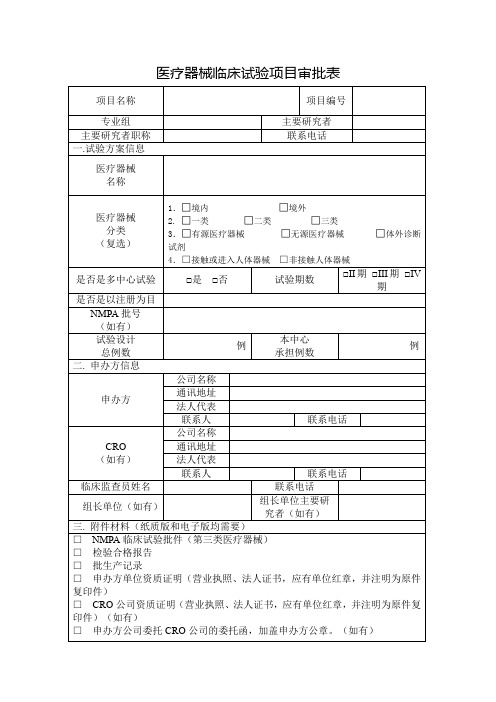
主要研究者签字:
年月日
GCP 机构办立项审核结果: □ 同意立项 □ 不同意立项 GCP 机构审核员:
学科办复核结果: □ 同意立项 □ 不同意立项 学科办审核员:
GCP 机构办主任签字:
学科办主任签字:
年月日 伦理委员会审查意见:
年月日
1.合同/协议 2.法律意见书: GCP 机构办审批意见:
盖章: 年月日
签字:
学科办意见:
年月日
财务部意见:
签字: 年月日
机构副主任意见:
签字: 年月日
审计科意见:
签字: 年月日
签字: 年月日
总会计师意见: 机构主任意见:
签字: 年月日
□II 期 □III 期 □IV 期
是否是以注册为目
NMPA 批号
(如有)
试验设计 总例数
例
本中心 承担例数
例
二. 申办方信息
公司名称
申办方
通讯地址 法人代表
联系人
联系电话
公司名称
CRO
通讯地址
(如有)
法人代表
联系人
联系电话
临床监查员姓名
联系电话
组长单位(如有)
组长单位主要研 究者(如有)
三. 附件材料(纸质版和电子版均需要)
□ NMPA 临床试验批件(第三类医疗器械)
□ 检验合格报告
□ 批生产记录
□ 申办方单位资质证明(营业执照、法人证书,应有单位红章,并注明为原件
复印件)
□ CRO 公司资质证明(营业执照、法人证书,应有单位红章,并注明为原件复
2017版医疗器械记录表格

2017版医疗器械记录表格1.前言2.质量管理体系文件3.设备清单及维护记录4.产品检验记录5.不合格品处理记录6.培训记录7.客户投诉处理记录8.内部审核记录9.管理评审记录前言:本表格为___医疗器械质量管理文件记录表格,用于记录公司医疗器械质量管理的各项文件和记录。
质量管理体系文件:公司建立了完善的医疗器械质量管理体系文件,包括质量手册、程序文件、工作指导书、记录表格等,所有文件均经过修订、审核和批准,并在实际工作中得到贯彻执行。
设备清单及维护记录:公司对医疗器械设备进行了清单管理,并制定了维护计划,定期对设备进行检查、维修和保养,并记录在设备维护记录表中,确保设备处于良好的工作状态。
产品检验记录:公司对生产的医疗器械进行全面的检验,包括原材料的检验、生产过程中的检验和最终产品的检验。
所有检验结果均记录在产品检验记录表中,以便追溯和管理。
不合格品处理记录:公司对不合格品进行了严格的管理和处理,制定了不合格品处理程序,并记录在不合格品处理记录表中,以确保不合格品得到及时处理和追溯,避免对产品质量和客户安全造成影响。
培训记录:公司对员工进行了全面的培训,包括医疗器械质量管理体系的培训、操作规程的培训和技能培训等。
所有培训记录均记录在培训记录表中,以确保培训工作得到有效的管理和跟踪。
客户投诉处理记录:公司对客户投诉进行了及时的处理和跟踪,制定了客户投诉处理程序,并记录在客户投诉处理记录表中,以确保客户投诉得到及时的处理和回复,提高客户满意度。
内部审核记录:公司定期进行内部审核,对医疗器械质量管理体系进行审核,发现问题及时进行纠正和改进,并记录在内部审核记录表中,以确保质量管理体系得到有效的管理和改进。
管理评审记录:公司定期进行管理评审,对医疗器械质量管理体系进行评审,确保质量管理体系的有效性和适应性,并记录在管理评审记录表中,以确保质量管理体系得到有效的管理和改进。
1.___的采购记录共有300项。
医疗器械临床试验核查项目汇总表

医疗器械临床试验核查项目汇总表XX年医疗器械临床试验核查项目汇总表试验用医疗备案号器械名称器械类别试验用医疗临床试验名称临床试验机构同时注明代理人)申办者吉林省中医药科学院第一临床医院吉林省赛凯生物技术有限公司β-葡聚糖液体敷料境内Ⅱ类β-葡聚糖液体敷料治疗急慢性鼻炎临床试验吉林邦安宝医用设备有限公司β-葡聚糖阴道灌洗液β-葡聚糖阴道灌洗液长春中医药大学附属医院治疗细菌性阴道炎、外境内Ⅱ类阴阴道假丝酵母菌病吉林省中医药科学院临床试验第一临床医院β-葡聚糖液体敷料治疗生殖器疱疹的临床试验长春中医药大学附属医院吉林省中医药科学院第一临床医院吉林邦安宝医用设备有限公司β-葡聚糖液体敷料境内Ⅱ类吉林邦安宝医用设备有限公司1脂蛋白相关磷脂脂蛋白相关磷脂酶A2北华大学第一附属医酶A2活性测定院境内Ⅱ类活性测定试剂盒试剂盒(速率法)临床吉林市人民医院(速率法) 试验长春恒晓生物科技有限责任公司中性粒细胞载脂蛋白检测试剂盒中性粒细胞载脂蛋白检测试剂盒视黄醇结合蛋白测定试剂盒中性粒细胞载脂蛋白境内Ⅱ类检测试剂盒临床试验中国人民解放军第二零八医院长春博德生物技术有限公司中性粒细胞载脂蛋白境内Ⅱ类检测试剂盒临床试验吉林大学第一医院长春博德生物技术有限公司中国人民解放军第视黄醇结合蛋白测定吉林普阳医用科技医院境内Ⅱ类试剂盒临床试验葛洲坝集团中心医院中国人民解放军第血清淀粉样蛋白A测吉林普阳医用科技医院境内Ⅱ类定试剂盒临床试验葛洲坝集团中心医院血清淀粉样蛋白A测定试剂盒2中性粒细胞明胶酶相关脂质运载蛋白测定试剂盒境内Ⅱ类抗环瓜氨酸肽抗体测定试剂盒胱抑素C测定试剂盒中性粒细胞明胶酶相关脂质运载蛋白测定试剂盒临床试验中国人民解放军第医院葛洲坝集团中心医院吉林普阳医用科技有限公司中国人民解放军第抗环瓜氨酸肽抗体测吉林普阳医用科技医院境内Ⅱ类定试剂盒临床试验葛洲坝集团中心医院中国人民解放军第胱抑素C测定试剂盒吉林普阳医用科技医院境内Ⅱ类临有限公司床试验葛洲坝集团中心医院β2微球蛋白测β2微球蛋白测定试剂定试剂盒α1-微球蛋白测定试剂盒境内Ⅱ类盒葛洲坝集团中心医院临床试验α1-微球蛋白测定试剂盒临床试验中国人民解放军第医院葛洲坝集团中心医院。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
吉林市人民医院
长春恒晓生物科技 有限责任公司
2016
0011
中性粒细胞载脂 蛋白(HNL检测 试剂盒(酶联免 疫法)
境内n类
中性粒细胞载脂蛋白 (HNL检测试剂盒(酶 联免疫法)临床试验
中国人民解放军
第二零八医院
长春博德生物技术 有限公司
2016
0012
中性粒细胞载脂 蛋白(HNL检测 试剂盒(酶联免 疫法)
吉林大学第一医院
长春光机医疗仪器 有限公司
2017
0045
尿液分析试纸条
6840
尿液分析试纸条
(FUS-14Cai)临床试
验
吉林省中吉林省中医 药科学院第一临床医 院日联谊医院、吉林 省人民医院
长春迪瑞医疗科技 股份有限公司
2017
0047
贻贝粘蛋白鼻粘 膜洗液
6864
评价贻贝粘蛋白鼻粘 膜洗液治疗急慢性鼻 炎
吉林省中医药科学院 第一临床医院
四平市中心人民医院
吉林省博涵医疗器 械有限公司
2017
0048
贻贝粘蛋白水凝 胶
6864
评价贻贝粘蛋白水凝 胶治疗痔疮有效性和 安全性
吉林省中医药科学院 第一临床医院
四平市中心人民医院
吉林省博涵医疗器 械有限公司
中国人民解放军第
161医院
葛洲坝集团中心医院
吉林普阳医用科技 有限公司
2016
0022
抗环瓜氨酸肽抗 体测定试剂盒 (免疫散射比浊 法)
境内n类
抗环瓜氨酸肽抗体测 定试剂盒(免疫散射比 浊法)临床试验
中国人民解放军第
161医院
葛洲坝集团中心医院
吉林普阳医用科技 有限公司
2016
0023
胱抑素C测定试 剂盒(免疫散射
2017
备案号
试验用医疗
器械名称
试验用医疗
器械类别
临床试验名称
临床试验机构
申办者(进口器械
同时注明代理人)
2016
00Байду номын сангаас2
即用型琼脂固体 培养基
境内n类
即用型琼脂固体培养 基临床试验
吉林大学中日联谊医 院
吉林大学第一医院
吉林省赛凯生物技 术有限公司
2016
0005
P-葡聚糖液体 敷料
境内n类
P-葡聚糖液体敷料治 疗急慢性鼻炎临床试
2016
0025
a1-微球蛋白测 定试剂盒(免疫
散射比浊法)
境内n类
a1-微球蛋白测定试 剂盒(免疫散射比浊 法)临床试验
中国人民解放军第
161医院
葛洲坝集团中心医院
吉林普阳医用科技 有限公司
2016
0029
光谱治疗仪
境内n类
评价光谱治疗仪治疗 膝骨性关节炎有效性 和安全性的临床试验
吉林大学中日联谊医 院
2016
0009
P-葡聚糖液体 敷料
境内n类
P-葡聚糖液体敷料治 疗生殖器疱疹的临床 试验
长春中医药大学附属 医院(牵头)
吉林省中医药科学院 第一临床医院
吉林邦安宝医用设 备有限公司
2016
0010
脂蛋白相关磷脂 酶A2( Lp-PLA2) 活性测定试剂盒
(速率法)
境内n类
脂蛋白相关磷脂酶A2
(Lp-PLA2)活性测定 试剂盒(速率法)临床 试验
比浊法)
境内n类
胱抑素C测定试剂盒
(免疫散射比浊法)临 床试验
中国人民解放军第
161医院
葛洲坝集团中心医院
吉林普阳医用科技 有限公司
2016
0024
卩2微球蛋白测 定试剂盒(免疫
散射比浊法)
境内n类
卩2微球蛋白测定试剂 盒(免疫散射比浊法) 临床试验
中国人民解放军第
161医院
葛洲坝集团中心医院
吉林普阳医用科技 有限公司
2016
0020
血清淀粉样蛋白A测定试剂盒(免 疫散射比浊法)
境内n类
血清淀粉样蛋白A测 定试剂盒(免疫散射比 浊法)临床试验
中国人民解放军第
161医院
葛洲坝集团中心医院
吉林普阳医用科技 有限公司
2016
0021
中性粒细胞明胶 酶相关脂质运载 蛋白测定试剂盒
(免疫散射比浊 法)
境内n类
中性粒细胞明胶酶相 关脂质运载蛋白测定 试剂盒(免疫散射比 浊法)临床试验
验
长春中医药大学附属 医院(牵头)
吉林省中医药科学院 第一临床医院
吉林邦安宝医用设 备有限公司
2016
0006
P-葡聚糖阴道 灌洗液
境内n类
P-葡聚糖阴道灌洗液 治疗细菌性阴道炎、外
阴阴道假丝酵母菌病 临床试验
长春中医药大学附属 医院(牵头)
吉林省中医药科学院 第一临床医院
吉林邦安宝医用设 备有限公司
境内n类
中性粒细胞载脂蛋白 (HNL检测试剂盒(酶 联免疫法)临床试验
吉林大学第一医院
长春博德生物技术 有限公司
2016
0019
视黄醇结合蛋白 测定试剂盒(免 疫散射比浊法)
境内n类
视黄醇结合蛋白测定 试剂盒(免疫散射比浊 法)临床试验
中国人民解放军第
161医院
葛洲坝集团中心医院
吉林普阳医用科技 有限公司
