氧化还原反应(单双线桥法)ppt课件
合集下载
氧化还原反应ppt课件

根据下列反应判断有关物质还原性强弱的顺序 A
H2SO3 + I2 + H2O === 2HI + H2SO4
2FeCl3 + 2HI === 2FeCl2 + 2HCl + I2 A.H2SO3 > I- > Fe2+ B.I- > Fe2+ > H2SO3 C.Fe2+ > I- > H2SO3 D.Fe2+ > H2SO3 >I-
电子的得失、共用电子对的偏移
氧化反应 还原反应 二者关系
元素化合价
电子的转移
升高
失电子(偏离)
降低
得电子(偏向)
二者是同时进行的
1.下列变化过程中,元素失去电子的是( D )
A.MnO2 → Mn2+
B.CuO → CuCl2
C.Ag+ → Ag2O
D.Sn2+ → Sn4+
2.下列说法正确的是( D ) A.有得、失氧的反应才是氧化还原反应 B.氧化还原反应中,氧化反应与还原反应是先后进行的 C.有电子得失的反应才是氧化还原反应 D.凡是有化合价升降的反应,都是氧化还原反应
高温
C + H2O ===== H2 + CO
CuO + H2 ==== Cu + H2O
物质 CuO
C H2O
C CuO H2
氧化(还原)反应 还原 氧化 还原 氧化 还原 氧化
化合价变化 降低 升高 降低 升高 降低 升高
化合价升高 —— 氧化反应
化合价降低 —— 还原反应
化合价升高,发生氧化反应
Zn + 2HCl ==== ZnCl2 + H2↑
化合价
得失电子
氧化还原反应的基本规律-课件

【解析】选B。A项反应若发生则有氧化性S>Fe3+,与题 干矛盾,A错误;C项Fe3+可以氧化S2-;D项中Fe3+已是最高 价,没有还原性,不能被Cl2氧化。
3.在反应3NO2+H2O====2HNO3+NO中,发生还原反应和发 生氧化反应的分子个数之比为 ( )
A.3∶1 B.1∶3 C.1∶2 D.2∶1
④被还原的物质和被氧化的物质得、失电子数守恒。 如
(3)记忆口诀: 先标化合价,再看价变化;起止同元素,桥上标变化。
2.单线桥法 (1)基本步骤
(2)注意事项 ①不需要标明“得到”或“失去”,只标明电子转移数 目; ②要用箭头标明电子转移的方向;
③箭头由反应物中失电子元素原子指向得电子元素原 子。 如
向和数目正确的是 ( )
【解析】选D。选项A中应该转移2个电子;选项B中是亚 铁离子被氧化为铁离子,失去电子;选项C中,C失去电子, 氧气得到电子。
2.实验室里迅速制备少量氯气可利用以下反应:2KMnO4 +16HCl(浓)====2KCl+2MnCl2+5Cl2↑+8H2O。 (1)用双线桥法表示出电子转移情况:2KMnO4+ 16HCl(浓)====2KCl+2MnCl2+5Cl2↑+8H2O。
氧化性,则氧化性
XO
4
>Z2>B2>A3+,可发生反应Z2+2A2+
====2A3++2Z-,氧化性Z2>A3+,A、C正确;①中Z元素的化
合价升高,③中Z元素的化合价降低,分别作还原剂、
氧化剂,B错误;①中X得到电子被还原,则X2+是
《氧化还原反应》》PPT课件

精选ppt
8
第5讲 氧化还原反应
❖考 向 互 动
探究•
还原剂失去电子被氧化后
5.氧化产氧物化剂、得还到原电子产被物还原后
•
氧化产物是得指到
______________失_去_________的生成物。
• 还原产物是指
________________________的生成物。
• 6.氧化性、还原性
• 氧化性是指物质________电子的性质。
被还原为 Mn2+。浓硫酸,一般被还原为 SO2。浓硝酸一般被还
原为 NO2。Fe3+被还原为 Fe2+。
③过氧化物:如 H2O2,一般被还原为水。
(2)常见还原剂
①活泼的金属单质:如 K、Na、Mg、Al 等。
②非金属离子及低价态化合物:S2-、H2S、I-、SO2、SO23-
等。
③低价阳离子:Fe2+、Cu+等。
❖考
向 (4)依据反应的条件及反应的剧烈程度
互 动 探
反应条件要求越低,反应越剧烈,对应物质的氧化性或 还原性越强,如是否加热、反应温度高低、有无催化剂和反
究 应物浓度大小等。
例如:
第5讲 氧化还原反应
❖考
向 (5)依据氧化还原的程度
互 动 探
相同条件下: ①不同氧化剂作用于同一种还原剂,氧化产物价态高的
❖考 向 互 动 探 究
❖典 型
第5讲 氧化还原反应
易
错
必
纠
❖教 师 备 用 习 题
考纲要求
1.了解氧化还原反应的本质是电子的转移。 2.了解常见的氧化还原反应,能判断反应中的氧化剂、 还原剂、氧化产物、还原产物。 3.能判断氧化还原反应中电子转移的方向和数目。 4.掌握物质氧化性、还原性强弱的比较方法。 5.能运用原子守恒、得失电子守恒、电荷守恒,进行 氧化还原反应的有关计算。
高考化学一轮复习(新高考)氧化还原反应的基本概念课件(102张)

√D.由以上信息可推知:可发生反应2CuSO4+2NaCl+SO2+2H2O===
2CuCl↓+Na2SO4+2H2SO4
解析 根据反应方程式可知,Cu2HgI4中Cu的化合价为+1价,则Hg的化 合价为+2价,A选项错误; 上述反应中,只有Cu元素被还原,B选项错误; 上 述 反 应 中 , CuSO4 中 Cu 的 化 合 价 由 + 2 价 降 至 + 1 价 , 生 成 1 mol Cu2HgI4时,转移2 mol电子,转移的电子数为2NA,C选项错误; 根据题干信息,CuSO4可与SO2在盐溶液中发生氧化还原反应,Cu2+被还 原为Cu+,SO2被氧化为 SO24- ,则反应2CuSO4+2NaCl+SO2+2H2O=== 2CuCl↓+Na2SO4+2H2SO4可以发生,D选项正确。
化还原反应、置换反应,A正确;
B、C错误;
③不属于复分解反应,D错误。
返回
考点二 氧化还原反应的概念
知识梳理·夯基础 1.基于双线桥理解氧化还原反应概念之间的关系
概括为“升失氧、降得还,剂性一致、其他相反”。
2.常见的氧化剂和还原剂 (1)常见氧化剂 常见氧化剂包括某些非金属单质、含有高价态元素的化合物、过氧化物 等。如:
价发生变化,属于氧化还原反应,选项D错误。
题组二 基于双线桥分析复杂氧化还原反应
3.(2020·江西赣州模拟)制取新型水处理剂ClO2的化学方程式为2KClO3+ H2C2O4+H2SO4===2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法错误的是
√3在反应中失去电子
2是还原产物 2C2O4 在反应中被氧化
续上页 H2C2O4 C _+__3_ CrO24- Cr +__6_ S2O28- S +6 O -__1_、__-__2__
2CuCl↓+Na2SO4+2H2SO4
解析 根据反应方程式可知,Cu2HgI4中Cu的化合价为+1价,则Hg的化 合价为+2价,A选项错误; 上述反应中,只有Cu元素被还原,B选项错误; 上 述 反 应 中 , CuSO4 中 Cu 的 化 合 价 由 + 2 价 降 至 + 1 价 , 生 成 1 mol Cu2HgI4时,转移2 mol电子,转移的电子数为2NA,C选项错误; 根据题干信息,CuSO4可与SO2在盐溶液中发生氧化还原反应,Cu2+被还 原为Cu+,SO2被氧化为 SO24- ,则反应2CuSO4+2NaCl+SO2+2H2O=== 2CuCl↓+Na2SO4+2H2SO4可以发生,D选项正确。
化还原反应、置换反应,A正确;
B、C错误;
③不属于复分解反应,D错误。
返回
考点二 氧化还原反应的概念
知识梳理·夯基础 1.基于双线桥理解氧化还原反应概念之间的关系
概括为“升失氧、降得还,剂性一致、其他相反”。
2.常见的氧化剂和还原剂 (1)常见氧化剂 常见氧化剂包括某些非金属单质、含有高价态元素的化合物、过氧化物 等。如:
价发生变化,属于氧化还原反应,选项D错误。
题组二 基于双线桥分析复杂氧化还原反应
3.(2020·江西赣州模拟)制取新型水处理剂ClO2的化学方程式为2KClO3+ H2C2O4+H2SO4===2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法错误的是
√3在反应中失去电子
2是还原产物 2C2O4 在反应中被氧化
续上页 H2C2O4 C _+__3_ CrO24- Cr +__6_ S2O28- S +6 O -__1_、__-__2__
人教版化学必修一氧化还原反应ppt33张课件
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
氧化还原反应ppt课件

失2C氧u物O质+ CC高=u温O2C、u +Fe2COO32
Fe2O3 +还3 C原O反=高应温2Fe + 3 CO2
氧化反应和还原反应是同时发生的,这样的反应称为氧化还原反应。
2CuO + C 高==温= 2Cu + CO2↑ 失去氧,被还原,发生还原反应
CuO 还原反应 Cu O
Fe2O3 + 3CO ==高=温 2Fe + 3CO2
练习:以上面的双线桥表示形式为例,对下面的反应进
行双线桥分析: (1)Zn + 2HCl = ZnCl2 + H2↑
失去1x2e-,化合价升高,被氧化,发生氧化反应
0 +1
Zn + 2HCl
+2
0
= ZnCl2 + H2↑
得到2×1e-,化合价降低,被还原, 发生还原反应
典例 〔变式训练 2〕根据下列两个氧化还原反应回答问题: ①2KClO3=M=△n=O==2 2KCl+3O2↑ ②MnO2+4HCl(浓)==△===MnCl2+Cl2↑+2H2O
NaCl+H2SO4==Na2SO4+2HCl
人教版必修第一册
网第一章 物质及其变化
科
第三节 氧化还原反应 1.3.1 氧化还原反应
学
钢铁会生锈
食物会腐败
都因为发生了氧化还原反应
补充维生素为何能延缓皮肤老化?
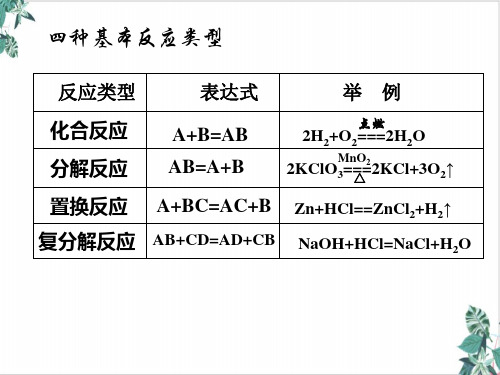
1.从得失氧角度认识氧化还原反应
物质
反应物
发生的反应(氧化反应或还氧反应) 已学知识
(1得)氧请物根质据初中C学、过的CO氧化反应和还氧反应的知识氧,分化析反以应下反应,完成下表。
根据是否有 化合价变化
氧化还原反应 非氧化还原反应
氧化还原反应(单双线桥法)PPT课件

精选ppt课件2021
7
单双线桥对比
失去4e-,化合价升高,被氧化
2e-
+2
0 高温 0 +4
+2
0
2CuO + C 2Cu + CO2 CuO+H2
0 +1
Cu+H2O
得到2×2e-,化合价降低,被还原
注意事项:
注意事项:
(1)箭头标明电子转移的实际情况,
(1)箭头由反应物指向生成物, 反应物失电子元素指向得电子元素
精选ppt课件2021
2
任务分配
导思4(1)、导练2(1)、 导思1
导思4(2)、导练2(2)、 导思2
导思4(3)、导练2(3)、 导思3
导思4(4)、导练2(4)、 目标三导读
导思4(5)、导练2(5)、 导思7
3组
导思4(6)、导练2(6)、 导练3
6组
1组
导练1
2组
7组
目标检测
8组
5组
课堂小结
(1)箭头由反应物指向生成物,
+2
0 高温 0 +4
2CuO + C 2Cu + CO2
箭头箭尾指向化合价变化的元素 (2)注明“得到”“失去”
得到2×2e-,化合价降低,被还原
(3)得失电子总数相同
精选ppt课件2021
5
精选ppt课件2021
6
单线桥法
1.单线桥法:表明反应过程中不同元素原子间的电子转移情况 2.单线桥法的书写步骤:
还原剂还原产物氧化产物得到电子化合价降低被还原失去电子化合价升高被氧化氧化产物发生氧化反应还原剂转化成被氧化还原产物发生还原反应氧化剂转化成被还原失去电子化合价升高得到电子化合价降还原性氧化性氧化性还原性常见氧化剂和还原剂常见的氧化剂包括具有氧化性的粒子常见的还原剂包括具有还原性的粒子活泼金属单质
优质课件人教版高一化学必修一氧化还原反应第二课时单线桥双线桥讲解

又有还原性。
+2 0 高温 0 +4 2CuO + C ==== 2Cu + CO2
用双线桥法标出下列反应电子转移的方向和数目:
(1) Mg+H2SO4 ===MgSO4+H2↑
(2)
高温 Fe2O3+3CO===2Fe+3CO2
(3)Cl2+2NaOH===NaCl+NaClO+H2O
0 +1
+2
0
Mg + H2SO4 === MgSO4+H2↑
失去1×e-,化合价升高,被氧化
2、单线桥法
4e+2 0 高温 0 +4 2CuO + C ==== 2Cu + CO2
用单线桥法标出下列反应电子转移的方向和数目:
(1) Mg+H2SO4 ===MgSO4+H2↑
(2)
高温 Fe2O3+3CO===2Fe+3CO2
(3)Cl2+2NaOH===NaCl+NaClO+H2O-20S
S
+4 +6
S
S
-2 +6 0 +4
如:H2S+H2SO4=S+SO2+2H2O 价态靠近
0 +6
+4
S+2H2SO4(浓)=3SO2↑+2H2O
价态归中
失6 ×e-
+5
-1
-1 0
(A) KClO3+6HCl====KCl+3Cl2 +3H2O
得1 ×6e-
√ 失5 ×e-
不交叉
+5
-1
+2 0 高温 0 +4 2CuO + C ==== 2Cu + CO2
用双线桥法标出下列反应电子转移的方向和数目:
(1) Mg+H2SO4 ===MgSO4+H2↑
(2)
高温 Fe2O3+3CO===2Fe+3CO2
(3)Cl2+2NaOH===NaCl+NaClO+H2O
0 +1
+2
0
Mg + H2SO4 === MgSO4+H2↑
失去1×e-,化合价升高,被氧化
2、单线桥法
4e+2 0 高温 0 +4 2CuO + C ==== 2Cu + CO2
用单线桥法标出下列反应电子转移的方向和数目:
(1) Mg+H2SO4 ===MgSO4+H2↑
(2)
高温 Fe2O3+3CO===2Fe+3CO2
(3)Cl2+2NaOH===NaCl+NaClO+H2O-20S
S
+4 +6
S
S
-2 +6 0 +4
如:H2S+H2SO4=S+SO2+2H2O 价态靠近
0 +6
+4
S+2H2SO4(浓)=3SO2↑+2H2O
价态归中
失6 ×e-
+5
-1
-1 0
(A) KClO3+6HCl====KCl+3Cl2 +3H2O
得1 ×6e-
√ 失5 ×e-
不交叉
+5
-1
氧化还原反应电子转移表示方法ppt课件

基本步骤 从失电子物质指向得电子物质 不写“得失”,只写转移电子总数
4e-
2
+2
CuO
+
0
C
高温
===
2
0
Cu
+
+4
CO2
↑
知能通练 1.判断下列反应中,电子转移表示方法正确的是( B)
得到6e-
+5
A. 2KClO3
-1 0
2KCl+3O2↑
失去6e-
失去2e-
2e0 +1
B. 2Na+2H2O=2NaOH+ H2↑
移的情况。
2e-
Fe+CuSO4 === Cu+FeSO4
基本步骤 从失电子物质指向得电子物质 不写“得失”,只写转移电子总数
See you next time!
③反应中转移电子数守恒。
失去3 × 2e-
+3
+2
0 +4
Fe2O3+3CO === 2Fe+3CO2
得到2×3e-
巧记口诀: 先标化合价,再看价变化; 起止同元素,桥上标变化。
拓展提升 电子“得‘’“失” 数目判断
2个Al原子
1个Al原子失去3个电子 失去2 × 3e-
+3
Fe2O3
+
0
2Al
=高=温=
失去3× 2e-
+3
Fe2O3
+3
+2
CO
=高=温=
2
0
Fe
+
+4
3 CO2
得到2 × 3e-
知能通练 用双线桥法配平化学反应方程式:
第7讲 氧化还原反应课件高考化学创新复习(共62张PPT)

2.教材改编题
(据人教必修一P39T8)在Fe+H2SO4===H2↑+FeSO4的反应中,
Fe( )
A.是氧化剂
B.被氧化
C.得电子
D.被还原
答案
3.按要求填空。 (1)在Fe、Fe2+、Fe3+、H+中, ①只有氧化性的是________, ②只有还原性的是________, ③既有氧化性又有还原性的是________。 (2)某同学写出以下三个化学方程式(未配平) ①NO+HNO3―→N2O3+H2O ②NH3+NO―→HNO2+H2O ③N2O4+H2O―→HNO3+HNO2
解析
1.解决氧化还原反应概念的一般思路 找变价、判类型、分升降、定其他。其中“找变价”是非常关键的一 步,特别是不同反应物中含有同种元素的氧化还原反应,必须弄清元素化 合价的变化情况,熟记8个字“升、失、氧、还,降、得、还、氧”。 2.确定元素化合价 (1)常见元素的化合价口诀 一价氢、氯、钾、钠、银;二价氧、钙、镁、钡、锌;三铝、四硅、 五氮磷;二三铁、二四碳,二四六硫都齐全;铜汞二价最常见。
基础自测
1.判断正误,正确的画“√”,错误的画“×”,并指明错因。 (1)有单质参加或有单质生成的化学反应一定是氧化还原反应。( × ) 错因:同素异形体的转化不是氧化还原反应。
(2)金属阳离子一定只具有氧化性。( × )
错因:Fe2+有还原性。
(3)氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原。 (× )
错因:Cl2与H2O反应,NO2与H2O反应等是同一元素既被氧化又被还 原。
(4)在氧化还原反应中H2O2只能是氧化剂不可能作还原剂。( × )
错因:H2O2与KMnO4(H+)反应生成O2,作还原剂。 (5)某元素从游离态变为化合态,该元素一定被氧化。( × ) 错因:可能被氧化也可能被还原。 (6)Na2O2与水的反应中,水是还原剂。( × ) 错因:Na2O2与H2O反应,H2O既不是氧化剂,又不是还原剂。
氧化还原反应 双线桥、单线桥 课件【新教材】人教版高中化学必修一

系数)
NaNO2在此反应中为?氧化产物和还原产物的物质的量之比? 氧化产物是由什么物质而来?还原产物呢?
失去2×2e-
(1)2H2S + SO2 = 3S + 2H2O
得到1×4e得到1×5e-
(2)KClO3 + 5KCl +3H2SO4= 3K2SO4 + 3Cl2↑+ 3H2O
失去5×e-
氧化还原反应的一些规律
0 +1
+3
0
例如:2Al+3H2SO4=Al2(SO4)3 +3H2↑
步骤: 1.正确判断各反应物、生成物各元素的化合价及其变化。
◆◆◆ §2-1-3.氧化还原反应◆◆◆
一、氧化还原反应得失电子的表示方法——双线桥法
步骤:
0 +1
+3
0
例如:2Al+3H2SO4=Al2(SO4)3 +3H2↑
2.两个线桥一个在上、一个在下,线桥的方向是从反应物一 方指向生成物一方,首尾都必须对应与发生化合价发生变化 的同种元素。
3Cl2 + 6KOH == 5KCl + KClO3 + 3H2O
得到5×e-
Cl2在此反应中起到什么作用?氧化剂和还原剂的物质的量之比为?
失去1×e-
(1) Cl2 + H2O ⇌ HCl + HClO
得到1×e-
失去1×4e-
(2) 3S + 6KOH = 2K2S + K2SO3 + 3H2O
注得失——标出得失电子的总数目 注意事项: Ⅰ.单线桥表示反应物中变价元素原子得失电子的情况; Ⅱ.不需标明“得”或“失”,只标明电子转移数目; Ⅲ.箭头标明电子转移的方向;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见的还原剂 (包括具有ห้องสมุดไป่ตู้原性的粒子)
活泼金属单质:Na、Mg、Al、Zn、Fe 某些非金属单质:C、H2、S 低价金属离子:Fe2+ 非金属的阴离子及其化合物:S2-、 H2S、I-、HI、NH3、Cl-、HCl、Br-、HBr
低价含氧化合物: CO、SO2、H2SO3、Na2SO3、Na2S2O3、 NaNO2、H2C2O4
应 物
成 氧 化 被 剂 还 发 原 生 还 转 原 化 还 成 反原 应物产 物
氧化性
得到电子,化合价降 低
还原性
常见氧化剂和还原剂
常见的氧化剂 (包括具有氧化性的粒子)
活泼非金属单质:X2、O2、S
高价金属离子:Fe3+ 不活泼金属离子:Cu2+、Ag+
含氧化合物: NO2、MnO2、Na2O2、H2O2、HClO、 HNO3、浓H2SO4、王水、NaClO、 Ca(ClO)2、KClO3、KMnO4
+2
0 高温 0 +4
2CuO + C 2Cu + CO2
箭头箭尾指向化合价变化的元素 (2)注明“得到”“失去”
得到2×2e-,化合价降低,被还原
(3)得失电子总数相同
单线桥法
1.单线桥法:表明反应过程中不同元素原子间的电子转移情况 2.单线桥法的书写步骤:
标价态
连线桥
注电子
标出反应前后 反应物升价元素指 标出转移电子
任务分配
导思4(1)、导练2(1)、 导思1
3组
导思4(2)、导练2(2)、 导思2
1组
导思4(3)、导练2(3)、 导思3
7组
导思4(4)、导练2(4)、 目标三导读
5组
导思4(5)、导练2(5)、 导思7
4组
导思4(6)、导练2(6)、 导练3
6组
导练1
2组
目标检测
8组
课堂小结
8组或 9组
导思4后黑板、导练2前黑板
根据元素的化合价可判断物质可否作氧化剂和还原剂。
•若元素处于最高价态,则只表现氧化性,作氧化剂; •若元素处于最低价态,则只表现还原性,做还原剂; •若元素处于中间价态,则既表现氧化性又表现还原性,既 可作氧化剂又可作还原剂。
此课件下载可自行编辑修改,供参考! 感谢您的支持,我们努力做得更好!
其余口述
单线桥和双线桥
双线桥法
1.双线桥法:表明反应前后同一元素原子间的电子转移情况
2.双线桥法的书写步骤
标价态
连线桥
注得失
标出反应前后 反应物升价(降价)元素 标出“得到或
各元素化合价 指向生成物对应元素 失去m×ne-” 失去4e-,化合价升高,被氧化 注意事项:
(1)箭头由反应物指向生成物,
• 氧化产物:反应物中发生氧化反应的某元素所对应的生成物。 • 还原产物:反应物中发生还原反应的某元素所对应的生成物。
失去电子,化合价升高,被氧化 氧化剂+还原剂→还原产物+氧化产物 得到电子,化合价降低,被还原
还原性
失去电子,化合价升高
氧化性
反 还 原 被 剂 氧 发 化 生 氧 转 化 化 氧 成 反化 应产 生 物
(2)注明“得到”“失去”
(3)转移电子数目=失去/得到电子数
(3)得失电子总数相同
目,不等于二者的加和
两剂两产物概念
• 氧化剂:在氧化还原反应中,得到电子(或电子对偏向)的物质。 • 还原剂:在氧化还原反应中,失去电子(或电子对偏离)的物质。
• 氧化性:氧化剂所表现出的得电子的性质。 • 还原性:还原剂所表现出的失电子的性质。
+2
0 高温 0 +4
+2
0
2CuO + C 2Cu + CO2 CuO+H2
0 +1
Cu+H2O
得到2×2e-,化合价降低,被还原
注意事项:
注意事项:
(1)箭头标明电子转移的实际情况,
(1)箭头由反应物指向生成物, 反应物失电子元素指向得电子元素
箭头箭尾指向化合价变化的元素 (2)不需注明“得到”“失去”
各元素化合价 向反应物降价元素注意数事目项::“ne-”
2e-
(1)箭头标明电子转移的实际情况,
反应物失电子元素指向得电子元素
+2
0
CuO+H2
0 +1
Cu+H2O
(2)不需注明“得到”“失去” (3)转移电子数目=失去/得到电子数
目,不等于二者的加和
单双线桥对比
失去4e-,化合价升高,被氧化
2e-
氧化还原反应(2)
学习目标
学会判断氧化还原反应中氧化剂和还原剂,氧化产物 和还原产物的方法 学会用双线桥法、单线桥法表示氧化还原反应中电子 的转移情况。
识记一些常见的氧化剂和还原剂,学会判断物质是否 具有氧化性和还原性的方法,掌握氧化还原反应中相 关概念间的联系。
重点难点: 1.判断氧化剂、还原剂、氧化产物、还原产物的方法 2.判断物质具有氧化性、还原性的方法 3.氧化还原反应相关概念间的联系
