11尼妥珠单抗注射液说明书--泰欣生
常用抗肿瘤药物配制方法一览重点

7
5-氟脲嘧啶
(5-Fu)
遮光
5%GS
\NS
可静滴、静注、瘤内注射、腔内注射,但不可鞘内注射;
与甲氨蝶呤合用,应先给予甲氨蝶呤,4-6小时后再给予5-氟尿嘧啶。
8
呋喃氟尿嘧啶(喃氟啶,替加氟,
FT-207)
遮光
5%GS\NS
可静滴。遇冷析出结晶,温热溶解后摇匀使用。避免与含钙离子及镁离子及酸性的药物合用。
可静注、静滴、动脉给药、腔内注射;不可使用含铝的输注用具。
38
卡铂
(铂尔定)
遮光
遮光5%GS溶解成
10mg/ml,
5%GS 250-500ml
与氯化钠配伍禁忌。8 h室温,24 h冷藏,避光。
静滴,不可使用含铝的输注用具。
39
奥沙利铂
(草酸铂,乐沙定,艾恒)
24h冷藏
5%GS或注射用水,
5%GS
250-500ml
34
左旋门冬酰胺酶
15℃
以下
注射用水
10000U/4ml
不得用NS直接溶解
避光,6 h.
NS,5%GS
250-500ml
用前须皮试(首次用药或停药一周以上者皮试:用5ml注射用水把5000KU的药物溶解,抽取0.1ml药液注入另一含9.9ml稀释液的小瓶内,其浓度为10KU/ml,用0.1ml此药液皮试,观察1小时,如有红斑或风团出现即为阳性反应)。
羟基喜树碱
(HCPT)
遮光
NS
可静注(缓慢)、肝动脉给药、动脉滴注、膀胱灌注。本品不宜用GS等酸性药液溶解。
28
伊立替康
(开普拓)
遮光
尼妥珠单抗注射液说明书--泰欣生

尼妥珠单抗注射液说明书【药品名称】通用名称:尼妥珠单抗注射液商品名称:泰欣生英文名称:Nimotuzumab Injection汉语拼音:NiTuoZhu DanKang ZhuSheYe【成份】每瓶含50mg尼妥珠单抗、4.5mg磷酸二氢钠、18.0mg磷酸氢二钠、86.0mg氯化钠、2.0mg聚山梨醇酯80。
【性状】本品为无色澄明液体。
【适应症】试用于与放疗联合治疗表皮生长因子受体(EGFR)表达阳性的Ⅲ/Ⅳ期鼻咽癌。
【规格】50mg/瓶(10 mL)。
【用法用量】将两瓶(100mg)尼妥珠单抗注射液稀释到250mL生理盐水中,静脉输液给药,给药过程应持续60分钟以上。
在给药过程中及给药结束后1小时内,需密切监测患者的状况。
首次给药应在放射治疗的第一天,并在放射治疗开始前完成。
之后每周给药1次,共8周,患者同时接受标准的放射治疗。
【不良反应】在中国进行的晚期鼻咽癌II期临床试验中,共有137例晚期鼻咽癌患者入组,试验组70例用药,尼妥珠单抗注射液每周给药1次,每次100mg,共8周。
与本品相关的不良反应主要表现为轻度发热、血压下降、恶心、头晕、皮疹,见表1:表1 与药物相关的不良反应发生率不良反应发生率%Ⅰ/Ⅱ级发生率%Ⅲ/Ⅳ级总发生率%Ⅰ-Ⅳ级缓解方法/是否影响治疗发热 4.28% (发热,最高39℃)- 4.28%用药缓解,未影响治疗血压下降、头晕 2.86%(最低80/50毫米汞柱)- 2.86%休息后缓解,未影响治疗恶心 1.43%- 1.43%自行缓解,未影响治疗皮疹 1.43%- 1.43%自行缓解,未影响治疗在古巴、德国、加拿大等国家进行了本品单药或联合放化疗治疗头颈部肿瘤、神经胶质瘤、胰腺癌、结直肠癌和非小细胞肺癌的临床试验。
尼妥珠单抗的剂量范围为100~400 mg/次,用药1~6次,其中86.5%的患者用药6次,每周1次。
患者平均年龄55岁(20~75岁),男性57例,女性32例,共89例。
11 尼妥珠单抗

3.1.2 鉴别试验
3.1.2.1 等电点
依法测定(附录Ⅳ D)。等电点图谱应与对照品一致。
3.1.2.2 相对结合活性
照 3.1.5.2 项下的方法测定。与空白对照相比,供试品应有明显的相对结合活性。
3.1.2.3 肽图 依法测定(附录Ⅷ E),肽图图谱应与对照品一致。 供试品经变性、还原和烷基化,按 1:50(mg/mg)加入测序级胰蛋白酶(酶切缓冲液:50
或其它适宜的色谱柱),柱温为 35±0.5℃;流速为 0.8ml/分钟;检测波长为 214nm,取供
试品溶液 20l 注入液相色谱仪;按下表进行梯度洗脱(表中流动相 A 为 0.1%三氟乙酸,
流动相 B 为 0.1%三氟乙酸-90%乙腈水溶液)。对照品同法操作。
时间(分钟) 流动相 A(%) 流动相 B(%)
白单体不得低于 92.0%。3.3.4.3 高效液相色谱法 按 3.1.3.3 项进行,采用分子排阻色谱法, 免疫球蛋白单体含量应不低于 95.0%;采用弱阳离子色谱法,供试品图谱应与对照品一致。 3.3.5 蛋白质含量
按 3.1.4 项进行,应为 4.6~5.5 mg/ml。 3.3.6 效价 3.3.6.1 生物学活性
依法测定(附录 XXX),生物学相对活性应为标准品的 50%-200%。 3.3.6.2 相对结合活性
依法测定(附录 XXX),相对结合活性应不低于标准品的 60~140%。 3.3.7.无菌试验
依法检查(附录 XII A),应符合规定。 3.3.8 细菌内毒素检查
依法检查(附录 XII E),应小于 1 EU/mg。 3.3.9 异常毒性检查 依法检查(附录 XII F),应符合规定。 4 保存、运输及有效期
0
100
尼妥珠单抗联合同步放、化疗治疗局部晚期鼻咽癌的近期疗效观察

尼妥珠单抗联合同步放、化疗治疗局部晚期鼻咽癌的近期疗效观察李赓;游雁;高健全【摘要】目的:探讨尼妥珠单抗联合同步放、化疗治疗局部晚期鼻咽癌的近期疗效.方法:选取2016年2月—2017年5月我院收治的35例局部晚期鼻咽癌(Ⅲ~Ⅳa 期)患者,随机分为对照组15例和试验组20例.对照组采取同步放、化疗治疗,试验组采取尼妥珠单抗联合同步放、化疗治疗,比较两组患者的近期疗效及不良反应严重程度.结果:治疗后1个月,试验组的临床疗效明显高于对照组(P<0.05);治疗期间两组患者不良反应严重程度比较差异无统计学意义(P>0.05),且未见影响治疗的严重不良反应发生.结论:尼妥珠单抗联合同步放、化疗治疗局部晚期鼻咽癌的近期疗效确切,安全有效,其远期疗效有待进一步观察.【期刊名称】《医学理论与实践》【年(卷),期】2019(032)001【总页数】3页(P56-58)【关键词】局部晚期鼻咽癌;同步放化疗;尼妥珠单抗;近期疗效【作者】李赓;游雁;高健全【作者单位】广西梧州市红十字会医院 543002;广西梧州市红十字会医院 543002;广西梧州市红十字会医院 543002【正文语种】中文【中图分类】R739.6鼻咽癌是一种常见的头颈部恶性肿瘤,其局部侵蚀力强,呈浸润性生长且恶性程度高,可直接侵犯周围及邻近的组织器官,具有淋巴结转移发生早、转移率极高的特点[1-2]。
该疾病发病部位深,早期症状缺乏特异性而难以诊断,约75%的患者确诊时已属中晚期[3-4]。
以往放射治疗是鼻咽癌的首选治疗方式,但由于晚期患者局部复发率和远处转移率较高,常规放疗效果欠佳[5]。
目前同期放化疗已成为治疗局部晚期鼻咽癌的标准模式,其疗效显著优于单纯放疗,大大提高了总生存率,但降低了患者机体免疫力,毒副反应亦明显增加,而近年来新兴的分子靶向治疗则有效提高了放化疗的疗效[6-7]。
尼妥珠单抗为一种新型抗EGFR单克隆抗体,张星霖等发现尼妥珠单抗联合放疗治疗晚期鼻咽癌的近期疗效好,且未增加不良反应,临床耐受性好[8]。
泰欣生(尼妥珠单抗注射液)说明书

泰欣生(尼妥珠单抗注射液)说明书【泰欣生药品名称】通用名称:尼妥珠单抗注射液商品名称:泰欣生英文名称:Nimotuzumablnjection汉语拼音:NiTuoZhuDanKangZhusheye【泰欣生成份】每支10mL含50mg尼妥珠单抗、4.5mg磷酸二氢钠、18.0mg磷酸氢二钠、86.0mg氯化钠、2.0mg聚山梨醇酯80。
【泰欣生性状】外观澄清、无色无味,无不溶物的液体。
【泰欣生适应症】泰欣生与放疗联合适用于治疗表皮生长因子受体(EGFR)阳性表达的Ⅲ/Ⅳ期鼻咽癌。
使用泰欣生前,患者应先确认其肿瘤细胞EGFR表达水平,EGFR中、高表达的患者推荐使用泰欣生。
检验操作应由熟练掌握EGFR检测试剂盒检测技术的实验室完成。
检验中的某些失误,如使用较差的组织样本、未能严格遵从操作规程、使用不当的对照等均可能导致不可靠的结果。
【泰欣生规格】13.5毫升西林瓶装量10毫升(±0.5毫升),尼妥珠单抗浓度为5mg/mL,每支含50毫克。
【泰欣生用法用量】100mg尼妥珠单抗稀释于250ml生理盐水中,前臂静脉输液给药,进药过程在60分钟以上。
次给药时间为放射治疗的天,于放疗前完成,以后每周一次,共8次。
患者同时接受标准的鼻咽癌放射治疗。
【泰欣生不良反应】该药物的不良反应主要表现为发热、血压下降、恶心、头晕、皮疹。
在70例晚期鼻咽癌患者中进行的Ⅱ期临床试验中发现,用药后发热的发生率为4.28%,体温39℃,对症处理后缓解,不影响治疗;血压下降,头晕发生率2.86%,达80/50mmHg,休息后缓解,不影响治疗;恶心发生率为1.43%,轻度,可自行缓解,不影响治疗;头晕发生率2.86%,时有头晕,可自行缓解,不影响治疗;皮疹发生率1.43%,轻度,可自行缓解,不影响治疗。
在古巴和加拿大进行的临床试验发现该药常见的不良反应有发热、寒颤、恶心、呕吐、发冷、贫血、血压降低。
不常见的不良反应有肌肉痛、运动语言障碍、口干、潮红、下肢无力、嗜睡、丧失方向感、肌酐水平升高、白细胞减少、血尿、胸痛、口腔绀紫。
常用化疗药物的毒副作用及使用注意事项

(希罗达)
抗代谢药
口服
骨髓抑制、恶心、呕吐、腹泻、手足综合症(是手掌-足底感觉迟钝或化疗引起肢端红斑,是一种皮肤毒性)、口腔炎、疲乏、发热、
每日总剂量分早晚两次于饭后半小时用温开水200ml吞服,使药物能尽快通过胃部到达肠腔,减少消化道反应,连续服用2周,休息1周为1个周期。
用药后不能接触冷水、金属物品,外出时戴口罩、手套,避免冷刺激引起喉头水肿,尽量穿长衣裤,避免阳光照射,同时使用防晒用品防护。
口服
骨髓抑制、白细胞减少、恶心、呕吐
低温保存,每晚口服100~200mg/m2,单用2~3次,用药期间严格检查血象和肝肾功能。
5-氟尿嘧啶
(5-Fu)
抗代谢药
0.9%NS或5%GS
食欲减退、恶心、呕吐、口腔炎、腹痛、腹泻、骨髓抑制、脱发,严重者血便、肠穿孔
350ml~500ml/m2输注4~8小时,用药前予甲酰四氢叶酸静滴,开始用药42分钟内滴速240ml/h。
化疗前采用有效镇吐药治疗。
有听力减退、耳鸣、头晕等中毒毒性反应应立即停药。
避免接触铝金属。
奥沙利铂
(进口:乐沙定/国产:
艾恒)
杂类
5%GS
500ml
神经毒性、胃肠道反应、腹泻、血液学毒性
本药必须在氟尿嘧啶前给药,静脉输注2~6小时。
不要与碱性药物或溶液或氯化物,包括任何浓度的氯化钠一起使用。
与铝接触后会降解,使用奥沙利铂时不能用铝制容器。
重组人血管内皮抑制素注射液(恩度)
小分子化合物
0.9%NS
主要是心脏反应,偶见腹泻、肝功能异常以及皮肤过敏反应
询问过敏史,过敏体质或对蛋白类生物制品有过敏史慎用。
有严重心脏病或病史者以及顽固性高血压者慎用。
药物说明书drins-尼妥珠单抗-百泰

对本品或其任一组份过敏者禁用。
【注意事项】
本品应在具有同类药品使用经验的临床医师指导下使用,并具备相应抢救措施。 冻融后抗体的大部分活性丧失,故本品在储存和运输过程中严禁冷冻。本品稀释于生理盐水后,在2℃-8℃可保持稳定12小时,在室温下可保持稳定8小时。如稀释后储存超过上述时间,不宜使用。 应由熟练掌握EGFR检测技术的专职人员进行EGFR表达水平的检验。检验中若出现组织样本质量较差、操作不规范、对照使用不当等情况,均可导致结果偏差。
尼妥珠单抗注射液
说明书来源: 百泰生物药业有限公司
【药品名称】
通用名称:尼妥珠单抗注射液 英文名称:NimotuzumabInjection 商品名称:泰欣生
【成份】
每瓶含50mg尼妥珠单抗、4.5mg磷酸二氢钠、18.0mg磷酸氢二钠、86.0mg氯化钠、2.0mg聚山梨醇酯80。
【性状】
本品为无色澄明液体。
【适应症】
试用于与放疗联合治疗表皮生长因子受体 (EGFR) 表达阳性的III/IV期鼻咽癌。
【规格】
50mg/瓶(10mL)。
【用法用量】
将两瓶 (100mg) 尼妥珠单抗注射液稀释到250mL生理盐水中,静脉输液给药,给药过程应持续60分钟以上。在给药过程中及给药结束后1小时内,需密切监测患者的状况。首次给药应在放射治疗的第一天,并在放射治疗开始前完成。之后每周给药1次,共8周,患者同时接受标准的放射治疗。
【老年用药】
在70例接受尼妥珠单抗注射液联合放射治疗的患者中,4例(5.7%)年龄在65岁或以上。尚未确定老年患者使用本品安全性和疗效方面的特殊性。
【药物相互作用】
尚缺乏本品与其它药物相互作用的数据。
分子靶向药物
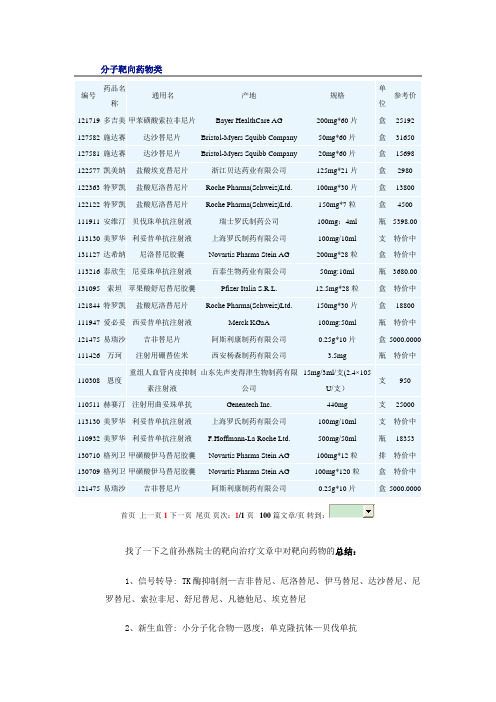
分子靶向药物类首页上一页1下一页尾页页次:1/1页100篇文章/页找了一下之前孙燕院士的靶向治疗文章中对靶向药物的总结:1、信号转导: TK酶抑制剂—吉非替尼、厄洛替尼、伊马替尼、达沙替尼、尼罗替尼、索拉非尼、舒尼替尼、凡德他尼、埃克替尼2、新生血管: 小分子化合物—恩度;单克隆抗体—贝伐单抗3、调控基因: 曲妥珠单抗4、EGFR受体: 小分子化合物—TKIs;单克隆抗体—西妥昔单抗、尼妥珠单抗、帕尼单抗5、表面受体: 利妥昔单抗因为这个是2010年总结的药物,过了1年多,所以里面肯定不全,先将这些慢慢的进行整理,后面再逐步添加新的。
吉非替尼商品名:易瑞沙英文名:Gefitinib Tablet 、Iressa、ZD1839结构式:适应症及作用机制:吉非替尼( gefitinib)是第一个批准用于治疗晚期非小细胞肺癌的分子靶向药物,通过竞争性结合到酪氨酸激酶的ATP结合区,抑制EGFR 酪氨酸激酶的活化,并能抑制EGFR的磷酸化作用和下游区的信号转导通路。
规格:250mg x 10 片/盒用法用量:推荐剂量为250mg(1片)每日1次,空腹或与食物同服。
不推荐用于儿童或青少年,对于这一患者群的安全性和疗效尚未进行研究。
不良反应:最常见的药物不良反应( ADRs )为腹泻、皮疹、瘙痒、皮肤干燥和痤疮,发生率20%以上,一般见于服药后一个月内,通常是可逆性的。
更多阅读分子靶向药物易瑞沙Iressa 吉非替尼治疗晚期或转移性非小细胞肺癌吉非替尼治疗晚期NSCLC2012-03-12 回复阳光明媚3楼厄洛替尼商品名:特罗凯英文名:Erlotinib Hydrochloride Tablets, Tarceva结构式:适应症及作用机制:可试用于两个或两个以上化疗方案失败的局部晚期或转移的非小细胞肺癌的三线治疗。
厄洛替尼(erlotinib) 可与ATP 结合区可逆性结合,并且完全抑制EGFR 酪氨酸激酶的自主磷酸化作用,从而阻断下游区EGFR 信号通路,引起细胞周期停滞,以及抑制血管生成。
注射用伊尼妥单抗说明书

注射用伊尼妥单抗说明书警告:心脏毒性:抗HER2单抗药物会导致亚临床和临床心力衰竭,其发生率和严重程度在合并蒽环类抗生素治疗的患者中最高。
在给予本品治疗前以及治疗过程中需对左心室功能进行评估。
在临床显著的左心室功能下降的转移性乳腺癌患者中,应停用本品。
输注相关反应及肺部反应:抗HER2单抗药物会导致严重的并可能致命的输注相关反应和肺部反应。
症状多发生于其输注过程中或24小时内。
对于发生呼吸困难或临床显著的低血压患者,应当立即停止输注本品,并对患者进行监控直至症状完全消失。
发生过敏、血管性水肿、间质性肺炎或者急性呼吸窘迫综合征的患者应停止输注。
胚胎毒性:孕期使用抗HER2单抗药物会导致羊水过少并继发造成胎儿肺发育不全、骨骼异常和新生儿死亡。
药品名称:通用名称:注射用伊尼妥单抗英文名称:Inetetamab for Injection商品名称:赛普汀成份:活性成份为伊尼妥单抗,是重组抗人表皮生长因子受体-2人源化单克隆抗体,由悬浮培养于无菌培养基中的哺乳动物细胞(中国仓鼠卵巢细胞CHO)生产,为IgG1/k型免疫球蛋白分子。
辅料:盐酸组氨酸、组氨酸、蔗糖、聚山梨酯20。
适应症:本品适用于HER2阳性的转移性乳腺癌:与长春瑞滨联合治疗已接受过1个或多个化疗方案的转移性乳腺癌患者。
用法用量:HER2检测在使用本品治疗前,应进行HER2状态的检测。
免疫组化(IHC)检测显示阳性(+++)或免疫组化检测显示可疑阳性(++)同时荧光原位杂交(FISH)检测结果阳性的患者可以使用本品。
推荐剂量和给药方法伊尼妥单抗的推荐初始负荷剂量为4mg/kg,静脉滴注90分钟以上;维持剂量为2mg/kg,每周1次,如果在首次滴注时患者耐受性良好,后续滴注可改为30分钟。
严禁静脉推注或快速静脉注射。
长春瑞滨的推荐剂量为25 mg/m2,第1,8,15天静脉滴注,在伊尼妥单抗输注后当天应用,每28天为1个周期。
有关长春瑞滨用药的详细信息,请参见长春瑞滨的药品说明书。
注射用曲妥珠单抗说明书

6
表 1 药物不良反应 身体器官分类 感染与侵染
血液与淋巴系统障碍
免疫系统障碍 代谢与营养障碍 精神障碍 神经系统障碍
眼疾病 心功能障碍
血管疾病
不良反应* 鼻咽炎 感染 流感 咽炎 鼻窦炎 鼻炎 上呼吸道感染 尿道感染 贫血 血小板减少 中性粒细胞减少 白细胞计数减少/白细胞减少 发热性中性粒细胞减少
超敏反应 体重下降 体重增加 食欲下降 失眠 抑郁症 焦虑 瞌睡 头晕 头痛 感觉异常 感觉减退 张力亢进 周围神经病 多泪 结膜炎 +心力衰竭 (充血性) 心肌病 +1 室上性快速性心律失常 射血分数下降 1 心悸 淋巴水肿 +1 低血压 高血压 血管舒张
1 表示不良反应主要与输注相关反应有关。尚未获得这些不良反应的具体百分比。
以下信息与所有适应症相关:心脏毒性 乳腺癌
8
发生率 常见 极常见 极常见 极常见 极常见 极常见 常见 常见 常见 极常见 极常见 极常见 极常见 极常见 极常见 极常见 极常见 极常见 极常见 常见 常见 常见 常见 常见 常见 极常见 极常见 常见 常见 常见 常见 常见 极常见 极常见 极常见 极常见 极常见 极常见 极常见 极常见 极常见 极常见
核准日期:2006 年 07 月 31 日 修改日期:2006 年 10 月 27 日
2007 年 09 月 05 日 2008 年 12 月 31 日 2009 年 03 月 03 日 2009 年 04 月 03 日 2009 年 11 月 04 日 2011 年 01 月 24 日 2011 年 10 月 27 日 2012 年 08 月 01 日 2012 年 08 月 10 日
消化道肿瘤常用化疗方案

mF()I.FOX7 方案:OXA 85 mg/m2静滴 2h di5-Fu 2400mg/m- civ 46h2周为一周期虫复.适用于人肠無和円癌。
FOLF1R1OT-11 ISOmg/m2 CF2(X)mg/m25-Fu 40()nig/m2 5-Fu24OOmg/m22周为一周期电災。
紫杉聊多烯鷺杉护5FSDDP方案(PCF/DCF人紫杉醇175mg/m2朴滴山3h或多烯紫杉般60mg/n? 静滴山lh5-Fu 2500-3<X)0mg/m2.d civ 120hDDP 60mg/m2的滴 2h di注®: DDF^JK杉醉之后注入I21天为一周期.适用于胃癌。
紫杉W(+Xeloda方案:紫杉肿80 mg/m2静滴di. gXekxia 1000mg/m* bid dl-1421天为一周期。
适用于肖辎-XP方案(卡培他滨+DDP)Xeloda 1000mg/m2 bid dl-14 DDP 80mg/m2静滴 2hdi 毎21天为一周期.适用于円癌.SOX方案(奥沙利怕+替吉奧)OX.X 85mg/n?静滴 3hdlS-l 40-60m S bid. dl-7 毎14天为一周期。
适用于胃癌.S-UDDH方案DDP 80mg/m2饰滴 2h diS-l 40.60mg bid. dl-14 毎21天为一周期。
适用于肖癌.腆腺癌化疗方案健择单药Gemzar 1.0g/m'挣滴 30min 每周一次连用7周休1周.以后3周停一周。
或连用2周休1周.毎3周直复'健择+Xel(>da方案:Gemzar 1.0g/m2能滴 3()min 山.&Xeloda 100()nig/m2 bid dl-14 <5 21天为一周期.健择+草酸钳方案,Gemzar 1.0g/m2静滴 3()min 山乂OXA 130 mg/m2挣滴 3h di 毎21天为一周期.靶向治疗厄洛普尼(特罗凯)l(XM50mg Qd食管癌一找治疗方案紫杉醇+DDP方案:紫杉肿175mg/n? 挣滴山DDP 6O.75mg/m2挣滴di (或分2天给予) 21天为一周期。
曲妥珠单抗 (Herceptin)使用说明书

曲妥珠单抗 (Herceptin)使用说明书曲妥珠单抗 (Herceptin) 使用说明书I. 药品信息曲妥珠单抗,商品名称为Herceptin,是一种单克隆抗体药物,用于治疗HER2阳性乳腺癌和HER2阳性转移性胃癌。
II. 药物治疗适应症曲妥珠单抗适用于以下症状的患者:1. HER2阳性乳腺癌:用于早期HER2阳性乳腺癌术后辅助治疗,以及未接受曲妥珠单抗的晚期或转移性HER2阳性乳腺癌患者的一线治疗和二线治疗。
2. HER2阳性转移性胃癌:与化疗药物联合使用可以作为一线治疗。
III. 药物使用方法1. 注射剂制剂:曲妥珠单抗为无色或淡黄色透明溶液,适用于静脉注射。
按患者体重和疾病状态确定治疗剂量和疗程。
2. 首次治疗:推荐首次治疗方案为:初始剂量为8mg/kg,随后每周维持剂量为6mg/kg,连续治疗至少为18个疗程。
3. 维持治疗:治疗后期,维持剂量为6mg/kg,每三周一次,直至疾病进展或不可耐受。
4. 药物注射后,应监测患者的生命体征和药物不良反应。
IV. 注意事项和禁忌症1. 使用曲妥珠单抗前,应评估患者的心脏功能,并进行相关监测。
2. 孕妇和哺乳期妇女应避免使用曲妥珠单抗。
3. 对曲妥珠单抗或其他成分过敏的患者禁止使用。
4. 使用曲妥珠单抗可能引发心脏毒性反应,如心衰、心律不齐等,需密切监测患者的心脏功能。
V. 不良反应1. 常见不良反应包括:恶心、呕吐、腹泻、疼痛、乏力、头痛、发热等。
2. 严重不良反应:包括肺炎、肺水肿、心衰、过敏反应等。
VI. 药物相互作用1. 药物相互作用可能影响曲妥珠单抗的疗效或增加不良反应的风险。
2. 与其他心脏毒性药物联用应注意风险。
VII. 储存和处理1. 曲妥珠单抗冷藏储存,并在2-8摄氏度下保存。
2. 不要冻结曲妥珠单抗。
3. 未使用的药品应按照规定的处置方法处理。
VIII. 有效期限1. 未拆封的曲妥珠单抗有效期为36个月。
2. 拆封后,避免阳光直射和潮湿环境,根据说明使用。
常用化疗药物的毒副作用及使用注意事项[1]
![常用化疗药物的毒副作用及使用注意事项[1]](https://img.taocdn.com/s3/m/0b4780fb9e31433239689341.png)
白细胞、血小板减少、贫血及骨髓抑制或合并严重感染。
静滴30~90分钟,本药稀释后立即使用。
用药期间患者避免食用可能引起腹泻的食物和饮料,禁用增加肠蠕动的药物。
VP-16)
抗肿瘤植物药
0.9%NS
骨髓抑制、胃肠道反应、心悸、头晕、低血压、脱发
缓慢滴注,不少于30分钟,以防低血压。
替尼泊苷
(威猛VM-26)
抗肿瘤植物药
0.9%NS
骨髓抑制、恶心、呕吐、脱发
缓慢滴注,时间30~60分钟,以防低血压。
伊力替康
(开普拓/艾力)
抗肿瘤植物药
0.9%NS或5%GS
胃肠道反应:延迟性腹泻(用药24h后发生)
烷化剂
口服
骨髓抑制、白细胞减少、恶心、呕吐
低温保存,每晚口服100~200mg/m2,单用2~3次,用药期间严格检查血象和肝肾功能。
5-氟尿嘧啶
(5-Fu)
抗代谢药
0.9%NS或5%GS
食欲减退、恶心、呕吐、口腔炎、腹痛、腹泻、骨髓抑制、脱发,严重者血便、肠穿孔
350ml~500ml/m2输注4~8小时,用药前予甲酰四氢叶酸静滴,开始用药42分钟内滴速240ml/h。
静滴3小时,了解过敏史,给药期间尤其输液开始的15分钟内应密切观察有无过敏反应,给药前予皮质类固醇和抗组胺药预防过敏反应(用药前12h、6h口服地塞米松20mg,用药前30~60分钟肌注非那根25mg、静注西米替丁0.3mg)。
心电监测4小时,测量心率、血压变化,防止低血压。观察神经毒性反应。
泰欣生说明书

泰欣生说明书(总5页) -CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除规格 50mg/瓶(10mL)瓶【泰欣生功效】尼妥珠单抗注射液;泰欣生(尼妥珠单抗注射液)治疗鼻咽癌及其他肿瘤的单抗药. 【简述】泰欣生(尼妥珠单抗注射液)与放疗联合适用于治疗表皮生长因子受体(EGFR)阳性表达的Ⅲ/Ⅳ期鼻咽癌。
使用本品前,患者应先确认其肿瘤细胞EGFR表达水平,EGFR中、高表达的患者推荐使用本品。
本品联合放疗、化疗对头颈癌、神经胶质瘤、结直肠癌、胰腺、非小细胞肺癌等多种癌症疗效显著,不良反应轻微。
【泰欣生药理作用】【泰欣生临床疗效】【泰欣生不良反应】【其它】【商品名】泰欣生【通用名】尼妥珠单抗注射液【英文名】Nimotuzumab Injection【汉语拼音】Nituozhudankang Zhusheye【成份】每支10ml含50mg尼妥珠单抗(人源化抗人表皮生长因子受体单克隆抗体)、磷酸二氢钠、磷酸氢二钠、氯化钠、聚山梨醇酯80。
【性状】本品为无色澄明液体。
【适应证】本品与放疗联合适用于治疗表皮生长因子受体(EGFR)阳性表达的Ⅲ/Ⅳ期鼻咽癌。
使用本品前,患者应先确认其肿瘤细胞EGFR表达水平,EGFR中、高表达的患者推荐使用本品。
本品联合放疗、化疗对头颈癌、神经胶质瘤、结直肠癌、胰腺、非小细胞肺癌等多种癌症疗效显著,不良反应轻微。
【用法用量】100或200mg泰欣生(尼妥珠单抗)稀释于250ml生理盐水中静脉滴注,输液进药过程在60分钟以上,每周1次,共8次,患者同时接受标准的放、化疗【药理作用】泰欣生(尼妥珠单抗)能够竞争性抑制内源性配体与EGFR的结合,阻断由EGFR介导的下游信号传导通路和细胞学效应,从而抑制肿瘤细胞增殖,促进肿瘤细胞凋亡,抑制肿瘤血管生成,抑制肿瘤细胞浸润和转移,增强放、化疗疗效。
药理研究:EGFR是分子量为170KD的跨膜糖蛋白,其胞内区具有特殊的酪氨酸激酶活性。
注射剂药物溶媒和配制浓度要求汇总(2023)

注射剂药物溶媒和配制浓度要求汇总(2023)一、说明书指定固定溶媒的药物(一)抗肿瘤药物(二)抗菌药物(三)其他药物(四)中药注射剂二、说明书中有溶媒用量及稀释浓度要求的药物(一)抗肿瘤药物(二)其他药物(三)中药注射剂药物溶解或稀释所用溶媒需注意相容性,原则上应参照药品说明书列出的溶媒种类及溶媒量进行配置。
O1.溶媒的选择:静脉药物溶媒的选择需考虑溶媒PH值、电解质成分的因素。
溶媒PH值偏低或偏高时,其氢离子、氢氧根离子可催化药物的水解,引起药物溶解度或降解速度的变化,影响质量稳定性。
强电解质溶媒或含有如Ca2÷.Na+等强电解质成分的,加入弱离子溶液或非电解质溶液中时,可降低药物的水溶性,诱导药物析出产生沉淀,或者对某些胶体溶液的稳定性产生破坏作用。
02溶媒量的选择:溶媒量过大,滴注浓度偏低,会降低药物疗效,并可能因滴注时间延长而增加药物毒副作用概率;溶媒量过小,药物溶解不充分,容易产生药物微粒,从而增加静脉炎或静脉血栓的发生率。
有时也会因药物浓度过高对血管产生刺激疼痛。
5%葡萄糖注射液:3.2~6.510%葡萄糖注射液:3.2〜6.5葡萄糖氯化钠注射液:3.5-5.5复方氯化钠注射液:4.5-7.50.9%氯化钠注射液:4.5-7.0一、说明书指定固定溶媒的药物(一)抗肿瘤药物01溶媒:5%GS注射用紫杉醇脂质体(力扑素)30mg注射用奥沙利粕(乐沙定)50mg卡粕注射液(波贝)IOOmgIOm1.注射用盐酸叱柔比星(依比路)IOmg盐酸多柔比星脂质体注射液(多美素、立幸)IOm1.NOnig 02溶媒:NS阿米福汀注射粉针(美罗)0∙4g注射用紫杉醇(白蛋白结合型)(克艾力)IOOmg贝伐珠单抗注射液(安维汀)4m1.:0.Ig注射用培美曲塞二钠(力比泰)0.5g甲磺酸艾立布林注射液(海乐卫)2m1.:Img注射用曲妥珠单抗(赫赛汀)440mg帕妥珠单抗注射液(帕捷特)420mg;14m1.替雷利珠单抗注射液(百泽安)10m1.:IOOmg信迪利单抗注射液(达伯舒)IOOmg:IOm1.特瑞普利单抗注射液(拓益)240mg尼妥珠单抗注射液(泰欣生)50mg:IOm1.西妥昔单抗注射液(爱必妥)IoOmg(20m1.)达雷妥尤单抗注射液(兆珂)400mg:20m1.注射用奈达箱(捷佰舒)IOmg注射用吉西他滨(健择)0.2g依托泊昔注射液(齐鲁)5m1.:0.Ig(二)抗菌药物注射用醋酸卡泊芬净(科赛斯)50mg:70mg,溶媒NS两性霉素B注射粉针(华北)25mg,溶媒pH>4.2的5%GS (三)其他药物O1.溶媒:10%GS葡萄糖酸钙注射液(华润双鹤)Igi1.Om1.02溶媒:5%GS盐酸精氨酸注射液(上海信谊金朱)20m1.:5g门冬氨酸钾镁注射液(潘南金)10m1.脱氧核甘酸钠注射液(北京赛升)50mg地塞米松磷酸钠注射液(天津金耀)Ini1.:5mg03溶媒:5%GS或10%GS间苯三酚注射液(南京恒生)4m1.:40mg多烯磷脂酰胆碱注射液(成都天台山)5m1.:232.5mg 04溶媒:NS艾司奥美拉哇钠注射粉针(艾速平)20mg注射用艾司奥美拉哇钠(耐信)40mg注射用兰索拉哇(山东罗欣)30mg肝素钠注射液(华北)2m1.:12500iu丙戊酸钠注射粉针(德巴金)0.4g+4m1.巴曲酶注射液(东菱迪芙)0.5m1.:5BU蔗糖铁注射液(南京恒生)IOm1.:20Omg矛头蝮蛇血凝酶注射粉针(巴曲亭)2iu罂粟碱注射粉针(阔舒)30mg注射用英夫利西单抗(类克)IoonIg注射用骨肽(I)(西若非)IOmg依达拉奉注射液(必存)IOm1.硫辛酸注射液(亚宝)6m1.∕20m1.注射用脑蛋白水解物(In)(山西普德)60mg甘露聚糖肽注射液(徐州莱恩)5mg(四)中药注射剂O1.溶媒:10%GS舒肝宁注射液(贵州瑞和)2m1.灯盏花素注射液(石药银湖)5m1.:20mg 02溶媒:5%GS丹参注射液(正大青春宝)10m1.∕2m1.静脉注射时使用50%GS稀释丹香冠心注射液(上海通用)IonI1.静脉注射时使用50%GS稀释瓜萎皮注射液(上海第一生化)4m1.静脉注射时使用25%GS稀释舒血宁注射液(北京双鹤)5m1.生脉注射液(雅安三九)IOm1.参麦注射液(河北神威)10m1.蟾酥注射液(江苏浦金)2m1.华蟾素注射液(华润金蟾)5m1.大株红景天注射液(通化玉圣)10m1.03溶媒:5%GS或10%GS香丹注射液(正大青春宝)IOm1.鱼腥草注射液(湖南正清)2m1.路路通注射液(东北虎制药)10m1.:250mg 04溶媒:NS血必净注射液(天津红日)IOm1.灯盏细辛注射液(云南生物谷)10m1.银杏二格内酯葡胺注射液(江苏康缘)5m1.复方苦参注射液(山西振东)5m1.鸦胆子油乳注射液(江苏九旭)10m1.注射用红花黄色素(山西德元堂)150mg注射用丹参多酚酸(天津天力士)0.13g二、说明书中有溶媒用量及稀释浓度要求的药物盘点(一)抗肿瘤药物注射用卡瑞利珠单抗(艾瑞卡)200mg溶媒与用量(浓度要求):5%GS∕NS,IOOm1.注射用雷替曲塞(正大天晴)2mg溶媒与用量(浓度要求):5%GS∕NS,50"250m1.帕博利珠单抗注射液可瑞达IOOng:4m1.i溶媒与用量(浓度要求):5%GS∕NS,最终浓度为1.~10πιg∕πι1. 重酒石酸长春瑞滨注射液(诺维本)1m1.:IOmg5%GS∕NS,20zv50m1.注射用阿糖胞昔(赛德萨)100mg:500mg5%GS∕NS,最高浓度为IOOmgM卡隹1注射液(伯尔定)15m1.:150mg5%GS∕NS,≥0.5mg∕m1.注射用奥沙利柏(乐沙定)50mg5%GS,≥0.2mg∕m1.多柔比星脂质体(多美素、立幸)20mg(IOm1.)5%GS,剂量V90mg,使用250m1.5%GS稀释;剂量290mg,使用500m1.5%GS稀释(2m1.)盐酸伊立替康注射液(开普拓)40mg5%GS∕NS,O.12"2.8mg∕m1.多西他赛注射液(泰索帝)20mg0.5m1.5%GS∕NS,250m1.,浓度不超过0・74mg∕m1.多西他赛注射液(艾素)20mg0.5m1.5%GS∕NS,浓度不超过0.9mg∕m1.利妥昔单抗注射液(美罗华)100mg∕10m1.5%GS∕NS,1.mg/m1.紫杉醇注射液(泰素)5m1.:30mg5%GS∕NS,5%NGS等,0.3"1.2mg∕m1.贝伐利珠单抗注射液(安维汀)IOOmg(4m1.)NS,1.4^16.5mg∕m1.信迪利单抗注射液(达伯舒)IOOnIg(IOm1.)NS,1.5~5mg∕m1.甲磺酸艾立布林注射液(海乐卫)2m1.:ImgNS,IOOm1.特瑞普利单抗注射液(拓益)240mgNS,IOOm1.,浓度P3mg∕m1.甲氨喋吟注射液IgNS,1.mg/m1.(鞘内注射)尼妥珠单抗注射液(泰欣生)50mgNS,250m1.曲妥珠单抗注射粉针(赫赛汀)440mg(20m1.)NS,250m1.帕妥珠单抗注射液(帕捷特)420mg(14m1.)NS,250m1.注射用异环磷酰胺(匹服平)0.5gNS,500"1000m1.注射用奈达粕(捷佰舒)IOmgNS,500m1.注射用紫杉醇(白蛋白结合型)(克艾力)IOOmg NS,5mg∕m1.注射用吉西他滨(健泽)200mgNS,浓度不超过40mg∕III1.多西他赛注射液(艾素)60mg:1.5m1.5%GS∕NS,浓度不超过0.9mg∕m1.依托泊昔注射液(齐鲁)5m1.:0.IgNS,浓度不超过0.25mg∕m1.注射用盐酸多柔比星(山西德普)IOmgNS,2mg∕m1.注射用盐酸表柔比星(法玛新)IOmgNS/注射用水,浓度不超过2mg∕m1.利巴韦林注射液(广东南国)1m1.:0.Ig5%GS∕NS,ImgM注射用阿昔洛韦(湖北荷普)0.25g5%GS∕NS,浓度不超过7g∕1.硫酸庆大霉素注射液(辰欣药业)1m1.:4万单位40mg;2m1.:8万单位80mg5%GS∕NS,药物浓度<0.1%注射用万古霉素(稳可信)0.5g5%GS∕NS,每O.5g至少需要IOOm1.注射用阿奇霉素(希舒美)IOmg5%GS∕NS∕乳酸林格氏注射液/5%GNS等,250~500m1.,终浓度为1.0~2.Omg/m1.注射用两性霉素B(新欧泊)25mg(25万单位)5%GS(pH>4.2),滴注液药物浓度W1.o1.ng/10Om1.注射用氨曲南(海南灵康)0.5g;1.g;2g5%或10%GS∕NS∕林格氏注射液,浓度W2%注射用替加环素(泰阁)50mg5%GS∕NS∕乳酸林格氏注射液,最高浓度为1.mg∕In1.注射用更昔洛韦(赛美维)5OnIg5%GS∕NS∕林格氏液或乳酸林格氏液,滴注浓度<1Omg/m1.注射用喷昔洛韦(恒奥普康)0.25gNS,IOOm1.注射用醋酸卡泊芬净(科赛斯)50mg;70mg0.9%氯化钠注射液或者乳酸林格氏注射液,终浓度W0.5g∕m1.注射用伏立康哇(丽福康、威凡)IOOnIg丽福康;20OnIg威凡5%GS∕NS等,0.5〜5mg∕m1.注射用亚胺培南西司他丁钠(泰能、俊特)500mg:500mg5%GS∕NS等,每50OnIg亚胺培南(即Ig本品)需用IoOnI1.溶媒稀释注射用头孜他脸(复达欣)Ig5%GS∕NS等,1〜40mg∕m1.注射用头泡曲松钠(罗氏芬)Ig无钙静脉注射液,静脉滴注时2g溶于至少40m1.无钙静脉注射液(二)其他药物伊班瞬酸注射液(邦罗力)2m1.;6m1.5%GS∕等渗NS,500m1.注射用帕米麟酸二钠(博宁)30mg5%GS∕NS,最大浓度W90mg∕500πι1.尿多酸肽注射液(喜滴克)IOOm1.5%GS∕NS,1:1稀释注射用人凝血酶原复合物(康舒宁)300IU5%GS∕NS,50"IOOm1.注射用右雷佐生(奥诺先)25OnIg5%GS∕NS,稀释成右雷佐生1.3~5.Omg/m1.溶液氢化可的松注射液(醇型)氢化可的松2m1.:IOmg 5%GS∕NS,必须用25倍体积的溶媒稀释注射用门冬氨酸鸟氨酸(瑞甘)2.5g5%GS∕10%GS∕NS,浓度不超过2%托烷司琼注射液(欣贝)1m1.:5mg5%GS∕NS∕林格氏液,IoOnI1.甲磺酸托烷司琼注射液(舒欧亭)2m1.:4.48mg 5%GS∕NS∕林格氏液,IoOnI1.甲磺酸多拉司琼注射液(立必复)1m1.:12.5mg 5%GS∕NS,50m1.复方曲肽注射液(吉林天成)2m1.5%GS∕NS,250~500m1.脑昔肌肽注射液(吉林四环)2m1.5%GS∕NS,250m1.注射用乌司他丁(天普洛安)10万单位5%GS∕NS,500m1.法舒地尔注射粉针(朗来)35mgGS/NS,50"IOOm1.注射用艾司奥美拉嗖钠(耐信)40mgNS,IOOm1.兰索拉哇注射粉针(山东罗欣)30mgNS,IOOm1.注射用雷贝拉哇(江苏奥赛康)20mgNS,IOOm1.泮托拉哇注射粉针(潘妥洛克)40mg奥美拉嗖注射粉针(奥西康)20mg5%GS∕NS,20mg溶于50m1.液体;40mg溶于IOonI1.液体氯化钾注射液(湖北科伦)10m1.:Ig5%GS∕NS等,钾浓度不超过3.4g∕1.(45mmo1.∕1.)注射用福沙匹坦双葡甲胺(坦能)0.15gNS,150m1.,终浓度为Img/m1.蔗糖铁注射液(南京恒生)5m1.NS,InI1.最多稀释到20m1.的NS中注射用脑蛋白水解物(In)(山西普德)以总氮计60mgNS,250m1.注射用英夫利西单抗(类克)IOOmgNS,250m1.,浓度0.4~4mg∕m1.左乙拉西坦注射用浓溶液(开浦兰)5m1.:500mgNS∕5%GS∕乳酸钠林格液,Ioom1.多种微量元素注射液(II)(安达美)IOm1.复方氨基酸注射液或葡萄糖注射液,每IOm1.至少用500m1.溶媒稀释注射用丙氨酰谷氨酰胺(欣坤畅)10g;20g必须与含有氨基酸的输液混合,20g本品用100注射用水溶解,加入至少五体积的载体溶液,混合液最大浓度≤3.5%(三)中药注射剂注射用丹参多酚酸盐(多普赛、百通美)50mg.IOOmg 疏血通注射液(牡丹江友搏)2m1.5%GS∕NS,250~500m1.银杏叶提取物注射液(金纳多)5m1.:17.5mgGS/NS,混合比例1:10醒脑静注射液(无锡济煜山禾)10m1.5%"10%GS∕NS,250"500m1.灯盏细辛注射液(云南生物谷)10m1.NS,250~500m1.复方苦参注射液(岩舒)5m1.NS,200m1.注射用红花黄色素(山西德元堂)150mgNS,250m1.注:(1)以上参考厂家药品说明书;(2)GS:葡萄糖注射液(G1.ucose);(3)NS:0.9%氯化钠注射液(Norma1.sa1.ine)o。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
尼妥珠单抗注射液说明书
【药品名称】
通用名:尼妥珠单抗注射液
商品名:泰欣生
英文名:Nimotuzumab Injection
汉语拼音:Nituozhudankang Zhusheye
【成份】
每支含50 mg 尼妥珠单抗、4.5 mg 磷酸氢二钠、18.0 mg 磷酸钠、86.0 mg 氯化钠、2.0 mg 聚山梨醇酯80 。
【性状】本品为无色澄明液体。
【适应症】试用于与放疗联合治疗表皮生长因子受体(EGFR) 表达阳性的Ⅲ/ Ⅳ期鼻咽癌。
【规格】50mg/瓶(10mL).
【用法用量】将两瓶(100mg)尼妥珠单抗注射液稀释到250 ml 生理盐水中,静脉输液给药,给药过程应持续60 分钟以上。
在给药过程中及给药结束后 1 小时内,需密切监测患者的状况。
首次给药应在放射治疗的第一天,并在放射治疗开始前完成。
之后每周给药一次,共8 周,患者同时接受标准的放射治疗。
【不良反应】
在中国人种中进行的晚期鼻咽癌临床研究中,该药所表现出的不良反应主要表现为轻度发热、血压下降、恶心、头晕、皮疹。
在70 例试验组晚期鼻咽癌病人中发现,Ⅰ度发热发生率 4.28% ,最高体温39 ℃,对症处理后缓解,不影响治疗;Ⅰ度血压下降、头晕发生率 2.86% ,最低80/50mmHg ,休息后缓解,不影响治疗;Ⅰ度恶心发生率为 1.43% ,可自行缓解,不影响治疗;Ⅰ度皮疹发生率 1.43% ,可自行缓解,不影响治疗。
在古巴,国进行的临床试验中与使用重组人源化抗人表皮生长因子受体单克隆抗体相关的不良反应描述如下: 该药物曾单药用于治疗各种不同部位(包括乳腺、肺、卵巢、胃和肾脏)的晚期上皮肿瘤以及与放疗联合用于治疗头颈部肿瘤。
在各治疗组中,单抗的剂量范围是100 ~400 mg ,单次或多次使用,用药次数1 ~6 次,其中86.5% 的患者在6 周的治疗期内用药6 次。
患者平均年龄55 岁(20 ~75 岁),男性57 例,女性32 例,共89 例。
报告的不良反应是在可评估的临床入组患者中发生的与药物相关的反应。
与药物相关的不良反应中,Ⅰ、Ⅱ级不良反应占多数。
未见皮疹和其它皮肤毒性的报告。
【禁忌症】对本品或其任一组份过敏者禁用。
【注意事项】
本品应在具有同类药品使用经验的临床医师指导下使用,并具备相应抢救措施。
1.冻融后抗体的大部分活性将丧失,故本品在贮藏和运输过程中严禁冷冻。
本品稀释
于生理盐水后,在2~ 8 ℃可保持稳定12小时,在室温下可保持稳定8小时。
如
稀释后超过上述时间,不宜使用。
2. 应由熟练掌握EGFR 检测技术的专职人员进行EGFR表达水平的检验。
检验中若出现组织样本质量较差、操作不规范、对照使用不当等情况,均可导致结果偏差。
【孕妇及哺乳期妇女用药】
本品可透过胎盘屏障,研究提示EGFR与胎儿组织分化、器官形成有关,故孕妇或没有采用有效避孕措施的妇女慎用。
本品属于IgG1类抗体,由于人IgG1能够分泌至人乳汁,建议哺乳期妇女在本品治疗期间以及在最后一次给药60天内停止哺乳。
【儿童用药】尚未确定18 岁以下儿童使用本药的安全性和疗效。
【老年患者用药】在70 例接受尼妥珠单抗注射液联合放射治疗的患者中,4 例( 5.7% )年龄在65 岁以上。
尚未确定老年患者使用安全性或疗效方面的特殊性。
【药物相互作用】尚缺乏本品与其它药物相互作用的数据。
【药物过量】在每人每次200mg~400mg剂量下可以耐受,目前尚未获得使用超过400mg剂量时的安全性数据。
【临床试验】
【药理毒理】
药理作用:
1.体外抑制细胞增殖实验显示,重组人源化抗人表皮生长因子受体单克隆抗体有抑制肿瘤细胞增殖的效应,实验采用H-125 肺腺癌细胞株、A431 外阴鳞状癌细胞株、MDA-MB-435 乳腺癌细胞株,增殖抑制率分别为66.97% 、40.32% 和4
2.28% 。
2.体内和体外实验均显示重组人源化抗人表皮生长因子受体单克隆抗体有减少血管内皮生长因子产生的能力,可以减少肿瘤新生血管的形成,从而起到抑制肿瘤转移的作用。
体外实验采用H-125 肺腺癌细胞株,VEGF 表达抑制率为40 % 。
体内实验采用小鼠接种A431 外阴鳞状癌细胞株,免疫组化检测结果,40 倍显微镜下观察10 个任选阳性染色区平均对照组微血管数17.5 ,重组人源化抗人表皮生长因子受体单克隆抗体组微血管数 5.4 。
3.采用H-125 肺腺癌细胞株,体外细胞培养进行重组人源化抗人表皮生长因子受体单克隆抗体的抗体依赖细胞介导的细胞毒性(ADCC )和补体依赖的细胞毒性(CDC )实验,重组人源化抗人表皮生长因子受体单克隆抗体可以通过这些免疫学效应机制诱导肿瘤细胞的溶胞效应,对H-125 肺腺癌细胞杀伤率分别为ADCC 28% ,CDC 23% 。
4.重组人源化抗人表皮生长因子受体单克隆抗体对肿瘤细胞周期影响的研究显示,采用重组人源化抗人表皮生长因子受体单克隆抗体处理A431 外阴鳞状癌细胞,经流式细胞仪检测发现S 期合成降低,G 1 期停滞,引起大量肿瘤细胞凋亡。
体内和体外试验结果均显示了重组人源化抗人表皮生长因子受体单克隆抗体有抗肿瘤增殖的功能,还具有抗血管生成和促进肿瘤细胞凋亡的特性。
毒理研究:
在两种动物(小鼠和绿猴)中进行重组人源化抗人表皮生长因子受体单克隆抗体的4 个单次给药急性毒性试验,剂量分别为1.42 mg /kg 、7.14 mg /kg 、28.57 mg /kg 、57 mg /kg ,给药一次,未见到毒性反应。
该药剂量是临床剂量0.85 倍到34 倍(在中国临床中的建议剂量,1.67 mg/Kg )。
重复给药的毒性试验,采用两种动物(小鼠和绿猴),剂量分别为 2.85 mg /kg 、11. 4 mg /kg 、26 mg /kg 、57 mg /kg ,重复给药,14 天中每天注射一次,这些单剂量重复给药试验未发现任何毒性迹象。
绿猴体内为期6 个月的长期毒性试验,采用高低两个剂量,即33 mg /kg 和 3. 3 mg /kg ,分别是人用剂量的20 倍和2 倍,结果显示血生化检查、心电图、体重、各器官病理组织学检查均未见异常。
未见长期静脉注射导致的动物皮肤的损害。
用小鼠和家兔进行重组人源化抗人表皮生长因子受体单克隆抗体的局部耐受性试验,试验结果显示注射局部未见静脉刺激作用。
用成人不同组织的冷冻切片进行交叉反应性试验,结果显示重组人源化抗人表皮生长因子受体单克隆抗体和人活体组织(如心脏、血管、肾脏和肺)无交叉反应。
尚未进行致癌、致突变和生殖力损害的特殊毒性研究。
【药代动力学】
古巴人体药代动力学研究中对12 名晚期上皮源性癌症患者(11 名女性和1 名男性,平均年龄59.33 岁,卵巢 4 例、乳房4 例、肺2 例、胃1 例、肾1 例)进行了观察:各组病人通过静脉分别注射50 、100 、200 和400 毫克的重组人源化抗人表皮生长因子受体单克隆抗体(其中每个剂量中均含有3 毫克99m Tc- 标记的重组人源化抗人表皮生长因子受体单克隆抗体)。
血浆清除曲线与双指数方程显示:用药剂量50 、100 、200 和400
毫克组对应的清除半衰期(t 1/2 b )分别为:62 小时、82 小时、302 小时和304 小时。
生理条件下,不同剂量用药24 小时由尿路排出量占注射剂量(ID )的比例分别是,50 mg 排出21.1% ,100 mg 排出28.20% ,200 mg 排出27.36% ,400 mg 排出33.57% 。
生物分布研究显示:重组人源化抗人表皮生长因子受体单克隆抗体在人体内主要分布的器官为肝脏、脾脏、心脏、肾脏和胆囊,其中肝脏是单抗特异摄取最高的器官。
动物药代动力学数据证实给药后24 小时以肿瘤组织药物浓度最高。
尚缺乏在中国人种中进行药代动力学的研究数据。
【贮藏】本品在2~ 8 ℃储存和运输,不得冷冻。
【包装】硼硅玻璃管制注射剂瓶,1瓶/盒。
【有效期】24个月。
