大学无机化学 化学实验 铁钴和镍
无机化学实验铁钴镍实验报告

无机化学实验铁钴镍实验报告今天我们要聊聊一个有点儿“金属味儿”的实验——铁、钴、镍的实验。
想想看,这些元素可都是大人物哦,在化学领域可是有一席之地的。
咱们从实验开始吧!一开始,实验室里的那些试管、烧杯啥的都准备好了,我一站进去,心里想,这不就跟上课听老师讲化学一样吗?只不过今天,咱不是听别人说,而是亲自操作。
你知道那种感觉吗?就是“啊!我也能行!”的瞬间。
不过,话说回来,要搞清楚铁、钴、镍这些金属是怎么回事儿,我们得先搞明白它们的基本性质。
比如铁,大家都知道,特别容易生锈,没错,就那么一碰水就开始腐蚀,大家是不是都知道那种黄色的锈斑?哎呀,咱就从这里开始,往下继续看看。
一开始,铁、钴、镍这三种金属的外观差别不大,乍一看,都是银白色或者稍微带点灰色。
嘿,像不像那些典型的“硬汉”?不过,别被它们的外表骗了,铁的性子可是挺倔强的,尤其在水分和氧气的作用下,它简直就变成了个脆弱的小家伙。
试试把铁片放到水里,几天后你会发现,那上面不知不觉多了一层锈,变成了棕色的老样子。
而钴呢,虽然也有点儿容易生锈,但比铁好一点儿,不那么容易见锈。
再说说镍,它可就稳妥多了,镍就像是“沉得住气”的那种,几乎不生锈。
大家可能会觉得这些金属有啥不一样的地方?其实它们之间的反应性差异,就像是我们每个人的性格一样:有的外向,有的内敛,有的特别急躁,有的则稳重。
实验的时候,咱们要对这三种金属进行一些反应,看看它们在不同条件下会怎么样。
比如把它们分别放进酸里,哎呀,铁在酸中反应得可快了,溶解得很彻底,立马就能见到氢气泡腾腾冒出来。
而钴和镍呢?哎,没那么“热心”,钴的反应没铁那么激烈,但也能看到气体冒出来,慢慢来。
而镍呢?几乎没有什么反应,这可是让我们很惊讶的地方。
镍这家伙真是超稳,跟个不爱吵架的家伙似的。
想想看,镍就像是个“佛系”金属,永远不和你计较,不急不躁,啥都不说,啥都不做,就那么默默地待着。
再往下说,咱们还做了一些还原反应,简单点说,就是让金属变成离子。
无机化学实验二十五 铁、钴、镍

无机化学实验二十五铁、钴、镍实验二十五铁、钴、镍[实验目的]1、试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2、试验并掌握铁、钴、镍配合物的生成和Fe2+、Fe3+、Co2+、Ni2+离子的鉴定方法;3、了解金属铁腐蚀的基本原理及其防止腐蚀的方法。
[实验用品] 仪器:试管、离心试管固体药品:硫酸亚铁铵、硫氰酸钾液体药品:H2SO4(1mo1·L-1,6mo1·L-1)、HCl(浓)、NaOH(6mo1·L-1、2mo1·L-1)、氨水(6 mo1·L-1,浓)、(NH4)2Fe(SO4)2(固体,0.1mo1·L-1)、CoC12(0.1mo1·L-1)、NiSO4(0.1mo1·L-1)、KI(0.5mo1·L-1)、K4[Fe(CN)6](0.5mo1·L-1)、FeCl3(0.2mo1·L-1)、KSCN(0.5mo1·L-1)、H2O2(3%)、氯水、碘水、四氯化碳、戌醇、乙醚材料:碘化钾淀粉试纸 [实验内容]一、铁(Ⅱ)、钴(Ⅱ)、镍(Ⅱ)的化合物·的还原性1.铁(Ⅱ)的还原性(1)酸性介质:往盛有5d氯水的试管中加入2d 6mo1·L-1硫酸溶液,然后滴加硫酸亚铁铵溶液1-2d,观察现象,写出反应式。
(如现象不明显,可加1滴KSCN 溶液,出现红色,证明有Fe3+生成)(2)碱性介质:在一试管中放入2mL蒸馏水和3d 6mo1·L-1硫酸溶液,煮沸,以赶尽溶于其中的空气,然后溶入少量硫酸亚铁铵晶体(溶液表面若加3~4d油以隔绝空气,效果更好)。
在另一试管中加入1m1 6mo1·L-1氢氧化钠溶液,煮沸(为什么?)。
冷却后,用一长d管吸取氢氧化钠溶液,插入硫酸亚铁铵溶液(直至试管底部)内,慢慢放出氢氧化钠(整个操作都要避免空气带进溶液中,为什么?)观察产物颜色和状态。
实验二十四第一过渡系元素(二)(铁、钴、镍)

2Fe3++2I-=2Fe2++I2
结论
水溶液中Fe3+的氧化力大于I2,而Co3+和Ni3+的氧化力大于Cl2。
三、配合物的生成
1铁的配合物
(1) 亚铁氰化钾溶液中加入碘水,摇荡试管后,加入硫酸亚铁。
加入硫酸亚铁后生成蓝色物质。
Fe(II)的CN-配合物被I2氧化成Fe(III)配合物,加入Fe2+后生成了铁蓝。
查电极电势可知,Fe2+不能被I2氧化
Fe2+?+I2=(不反应)
强氧化剂可以将Fe2+氧化成Fe3+,后者与SCN-反应生成血红色配合物:
Fe2++H2O2=Fe3++H2O
Fe3++nSCN-=[Fe(SCN)n]3-n(n=1~6)
结论
由于电极电势 I2不能将Fe2+氧化成为Fe3+,生成配合物改变了电极电势, 因此I2可以将Fe(II)的氰配合物氧化成Fe(II)配合物;H2O2能将Fe2+氧化成Fe3+。
总结:
铁、钴、镍的主要化合价为+2和+3。
其中+2氧化态具有还原性,+3氧化态具有氧化性。
通常,酸性条件下的氧化能力增加;碱性条件下物质还原能力增加;
配合物的形成能够在较大的程度上能改变元素电对的电极电势;
还原性增强
Fe(II)
Co(II)
Ni(II)
Fe(III)
Co(III)
Ni(III)
氧化性增强
2钴的配合物
(1)CoCl2溶液中加入少量KSCN固体,观察固体周围溶液的颜色。再加入戊醇和乙醚,观察有机相颜色。
铁钴镍实验报告

一、实验目的1. 掌握铁、钴、镍的化学性质及其在反应中的表现。
2. 熟悉铁、钴、镍化合物的制备方法和实验操作技巧。
3. 通过实验观察和分析,培养实验操作能力、观察能力和分析问题的能力。
二、实验原理铁(Fe)、钴(Co)、镍(Ni)是周期表中的过渡金属元素,它们具有相似的化学性质,但在反应中表现出不同的特点。
本实验主要涉及铁、钴、镍的氢氧化物、配合物及其氧化还原性质。
三、实验仪器与试剂1. 仪器:试管、烧杯、酒精灯、滴管、玻璃棒等。
2. 试剂:硫酸亚铁铵、硫酸钴、硫酸镍、氢氧化钠、氨水、溴水、氯水、硫酸等。
四、实验内容1. 铁(II)、钴(II)、镍(II)化合物的还原性(1)铁(II)的还原性- 在酸性介质中,往盛有1毫升溴水的试管中加入3滴1:1 H2SO4的溶液,然后滴加0.2mol/L (NH4)2Fe(SO4)2溶液,观察现象。
反应式:2Fe2+ + Br2 → 2Fe3+ + 2Br-(2)钴(II)的还原性- 往盛有CoCl2和NiSO4的试管中分别滴入氯水,观察现象。
反应式:Co2+ + Cl2 → Co3+ + 2Cl-2. 铁、钴、镍氢氧化物的生成和性质- 将Fe粉3g加入煮沸冷却的NaOH溶液中,观察现象。
反应式:Fe + 2NaOH → Fe(OH)2 + H2↑- 将0.5mL氢氧化钠溶液滴入硫酸亚铁铵溶液中,观察现象。
反应式:Fe2+ + 2OH- → Fe(OH)2↓3. 铁、钴、镍配合物的生成和性质- 将过量的氨水加入Co2+或Ni2+离子的水溶液中,观察现象。
反应式:[Co(NH3)6]2+ + 2OH- → [Co(NH3)6]2+ + 2H2O五、实验现象1. 铁在酸性介质中与溴水反应,溶液由橙红色变为棕黄色。
2. 钴在氯水中反应,溶液由蓝色变为棕黄色。
3. 铁粉与NaOH反应,生成白色沉淀,逐渐变为灰绿色,最后变为红棕色。
4. 硫酸亚铁铵溶液中加入NaOH,生成白色沉淀。
无机化学实验第四版实验24 铁钴镍
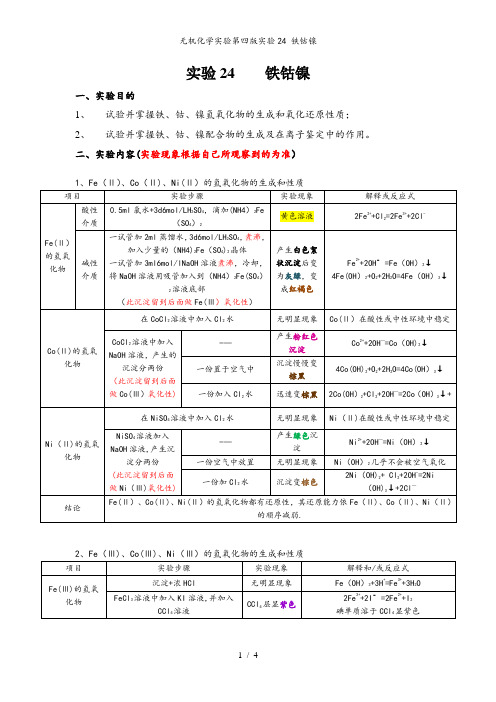
实验24 铁钴镍一、实验目的1、试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验内容(实验现象根据自己所观察到的为准)三、实验讨论(从自己实验操作展开)四、实验思考题和习题1。
实验步骤(2)要求整个实验不能带入空气到溶液中,为什么?Fe(Ⅱ)易被氧化,如若带入了空气,可能不能观察到颜色的转化过程。
2.根据实验现象总结+2价的铁、钴、镍化合物的还原性和+3价的铁钴镍化合物氧化性的变化规律。
Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)的氢氧化物都有还原性,其还原能力依Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)的顺序减弱。
Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)在酸性介质中的氧化能力依Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)的顺序增加。
3。
比较钴镍氨配合物的氧化还原性相对大小及溶液稳定性。
钴盐和镍盐生成碱式盐溶于过量的氨水生成氨配合物,Co(Ⅱ)氨配合物易氧化转化成 Co(Ⅲ)氨配合物。
即镍盐更稳定.4。
为什么制取+3价的钴镍氢氧化物要用+2价为原料在碱性条件下进行氧化,而不+3价直接制取?首先,作为最高价氧化值,Co3+、Ni3+氧化性比较不稳定,易变成其它价态,故不用采用+3价直接氧化得到。
其次,而Co(OH)2、Ni(OH)2两性,在碱性条件下易被氧化成+3价氢氧化物。
5。
如何分离混合液中的?Fe3+、Cr3+、Ni2+ ?6.总结Fe(Ⅱ、Ⅲ)、Co(Ⅱ、Ⅲ)、Ni(Ⅱ、Ⅲ)主要化合物性质。
Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)具有强的还原性,都易形成配合物,且Co的配合物极易被氧化,它们的氢氧化物也易被氧化;Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)具有强的氧化性,也易生成配合物。
7。
(此题面字太多,不好打得,请谅解)A:(NH4)2Fe (SO4)2B:(NH4)2Fe (SO4)2溶液C:Fe(OH)2D:NH3E:I2F:Fe3+G:KFe[Fe(CN)6]H:BaSO4这些方程式都是简单的,都可以轻易写出,在此我不一一写出了。
实验二十四-第一过渡系元素(二)-铁钴镍

♦(三) Fe Co Ni的配合物
• 铁的配合物
(1)往盛有1mL六氰合铁(Ⅱ)酸钾溶液的试管中 加入约0.5mL碘水,摇动试管后,滴入数滴硫 酸亚铁铵溶液,观察现象。此为Fe2+的鉴定反 应。
2[Fe(CN)6]3-+3Fe2+=Fe3[Fe(CN)6]2
(2)向盛有1mL新制(NH4)2Fe(SO4)2溶 液中加入碘水,摇动试管,将溶液分成 两份,各滴入数滴硫氰酸钾溶液,然后 向其中一支试管中加入约0.5mL 3% H2O2 溶液,观察现象。此为鉴定Fe3+的反应。
实验二十四 第一过渡系元素(二) ------铁、钴、镍
一、实验目的
1、掌握Fe(II)、Co(II) 、Ni(II)化合物的还 原性和Fe(III)、Co(III) 、Ni(III)化合物的氧化 性及其变化规律;
2、 掌握Fe、Co 、Ni主要配位化合物的性 质及其在定性分析中的应用;
3、掌握Fe2+、Fe3+、Co2+、Ni2+离子分离鉴 定的原理和方法。
Fe3++nSCN-=[Fe(NCS)n]3-n(n=1~6)
(血红色)
(3)往FeCl3溶液中加入K4[Fe(CN)6]溶液,观察 现象,写出反应方程式。这也是鉴定Fe3+的 一种常用方法。
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3 (4)往盛有0.5mL 0.2mol•L-1 FeCl3的试管中, 滴入浓氨水至过量,观察沉淀是否溶解。
(1)在前面实验中留下的氢氧化铁(Ⅲ),氢氧化 钴(Ⅲ)与氢氧化镍(Ⅲ)溶液中均加入浓盐酸,震 荡后有何变化,并用碘化钾淀粉试纸检验放出的气体。
铁骨镍的实验报告

一、实验目的1. 掌握铁、钴、镍三种金属的基本性质。
2. 了解铁、钴、镍在化学反应中的表现。
3. 培养实验操作能力、观察能力和分析问题的能力。
二、实验原理铁(Fe)、钴(Co)、镍(Ni)是周期表中的过渡金属元素,它们在化学反应中表现出不同的性质。
本实验通过观察铁、钴、镍与不同试剂的反应,分析其化学性质。
三、实验材料1. 试剂:硫酸铁、硫酸钴、硫酸镍、氢氧化钠、盐酸、硫酸铜、氯水、溴水等。
2. 仪器:试管、烧杯、滴管、酒精灯、铁架台、石棉网等。
四、实验步骤1. 铁的化学性质研究(1)铁与硫酸铜反应取一定量的硫酸铁溶液于试管中,加入少量硫酸铜溶液,观察反应现象。
(2)铁与盐酸反应取一定量的硫酸铁溶液于试管中,加入少量盐酸,观察反应现象。
2. 钴的化学性质研究(1)钴与硫酸铜反应取一定量的硫酸钴溶液于试管中,加入少量硫酸铜溶液,观察反应现象。
(2)钴与氯水反应取一定量的硫酸钴溶液于试管中,加入少量氯水,观察反应现象。
3. 镍的化学性质研究(1)镍与硫酸铜反应取一定量的硫酸镍溶液于试管中,加入少量硫酸铜溶液,观察反应现象。
(2)镍与溴水反应取一定量的硫酸镍溶液于试管中,加入少量溴水,观察反应现象。
五、实验现象1. 铁与硫酸铜反应:生成红色沉淀,溶液由蓝色变为浅绿色。
2. 铁与盐酸反应:生成气泡,溶液由黄色变为无色。
3. 钴与硫酸铜反应:生成蓝色沉淀,溶液由蓝色变为浅绿色。
4. 钴与氯水反应:无明显现象。
5. 镍与硫酸铜反应:无明显现象。
6. 镍与溴水反应:无明显现象。
六、实验结论1. 铁与硫酸铜反应生成红色沉淀,说明铁可以置换出铜。
2. 铁与盐酸反应生成气泡,说明铁可以与盐酸反应生成氢气。
3. 钴与硫酸铜反应生成蓝色沉淀,说明钴可以置换出铜。
4. 钴与氯水反应无明显现象,说明钴不易被氯水氧化。
5. 镍与硫酸铜反应无明显现象,说明镍不易被硫酸铜氧化。
6. 镍与溴水反应无明显现象,说明镍不易被溴水氧化。
七、实验讨论1. 本实验中,铁、钴、镍的化学性质具有一定的相似性,如都能与硫酸铜反应生成相应的金属沉淀。
大学铁钴镍实验报告步骤

一、实验目的1. 掌握铁、钴、镍三种金属的化学性质,特别是它们在不同氧化还原反应中的表现。
2. 了解铁、钴、镍的配合物生成及其性质。
3. 通过实验加深对金属化学性质的理解,提高实验操作技能。
二、实验材料1. 试剂:硫酸亚铁铵、硫酸钴、硫酸镍、溴水、氯水、氢氧化钠、硫酸、硫酸铵、氯化钴、硫酸镍、硫酸铁、氯化钠等。
2. 仪器:试管、烧杯、滴管、酒精灯、铁架台、玻璃棒、石棉网等。
三、实验步骤1. 铁的还原性实验(1)在试管中加入1毫升溴水,滴加3滴1:1硫酸溶液,然后滴加0.2mol/L硫酸亚铁铵溶液,观察现象。
(2)在碱性介质中,加入2毫升蒸馏水和5滴3mol/L硫酸,煮沸以赶尽溶于其中的空气,然后加入少量硫酸亚铁铵晶体。
在另一试管中加入3mL 6mol/L氢氧化钠溶液,煮沸。
冷却后,用长滴管吸取约0.5mL氢氧化钠溶液,插入硫酸亚铁铵溶液中,慢慢放出氢氧化钠溶液。
2. 钴的还原性实验(1)在试管中加入CoCl2和NiSO4溶液,分别滴入氯水,观察现象。
(2)在两只盛有0.5ml 0.2mol/L CoCl2溶液的试管中,分别滴加2mol/L氢氧化钠溶液,所得沉淀分为两份,一份放于空气中,一份滴加氯水。
3. 镍的还原性实验(1)在试管中加入NiSO4溶液,滴加氯水,观察现象。
(2)在两只盛有0.5ml 0.2mol/L NiSO4溶液的试管中,分别滴加2mol/L氢氧化钠溶液,所得沉淀分为两份,一份放于空气中,一份滴加氯水。
4. 铁的配合物实验(1)在试管中加入少量硫酸铁溶液,滴加氨水,观察现象。
(2)在试管中加入少量硫酸铁溶液,滴加氯化钠溶液,观察现象。
5. 钴的配合物实验(1)在试管中加入少量氯化钴溶液,滴加氨水,观察现象。
(2)在试管中加入少量氯化钴溶液,滴加氢氧化钠溶液,观察现象。
6. 镍的配合物实验(1)在试管中加入少量硫酸镍溶液,滴加氨水,观察现象。
(2)在试管中加入少量硫酸镍溶液,滴加氢氧化钠溶液,观察现象。
铁 钴镍实验报告

铁钴镍实验报告实验目的本实验旨在研究铁、钴和镍之间的物理和化学性质,以及它们在不同条件下的反应和变化。
实验原理铁、钴和镍是过渡金属元素,具有相似的物理和化学性质。
它们在自然界中广泛存在,并且在工业生产中具有重要的应用。
在本实验中,我们将研究铁、钴和镍的磁性、溶解性和反应性。
实验材料- 铁粉- 钴粉- 镍粉- 磁铁- 盐酸- 硫酸- 氯化铈溶液实验步骤1. 观察铁、钴和镍的性状取一小部分铁、钴和镍粉,观察它们的外观和性状。
比较它们的颜色、质地和反应性。
2. 研究铁、钴和镍的磁性使用磁铁对铁、钴和镍进行磁性测试。
将磁铁分别靠近铁、钴和镍粉,观察它们是否受到磁性吸引。
记录下每种金属的反应。
3. 铁、钴和镍的溶解性研究将少量铁、钴和镍粉分别加入盐酸和硫酸溶液中,观察它们的溶解情况。
注意观察溶液的颜色变化和气体的释放。
4. 铁钴镍合金反应取一小部分铁、钴、镍粉,混合在一起,然后加入氯化铈溶液中进行反应。
观察反应后的颜色变化和产物的形成。
实验结果与讨论铁、钴和镍的性状比较在观察铁、钴和镍的性状时,我们发现它们的颜色分别为灰白色、银白色和灰色。
铁粉呈细粉状,质地坚硬;钴粉呈细粉状,略微有些粘性;镍粉呈较粗粉状,质地较软。
在环境中,铁表面易出现氧化,呈红锈色;钴和镍相对稳定。
铁、钴和镍的磁性测试结果在磁性测试中,我们发现铁、钴和镍对磁铁均具有一定吸引力。
然而,铁对磁铁的吸引力最强,钴次之,镍最弱。
这表明铁具有最高的磁性,钴次之,镍最弱。
铁、钴和镍的溶解性测试结果在盐酸和硫酸溶液中,我们发现铁粉可以快速溶解,并产生氢气的释放。
钴粉在盐酸中溶解较慢,但在硫酸中溶解较快,同样会产生氢气。
镍粉在盐酸和硫酸中均不溶解。
铁钴镍合金反应结果在铁钴镍合金与氯化铈溶液的反应中,产生了橙红色的沉淀。
这表明铁、钴和镍可以与氯化铈发生反应,生成相应的氧化物。
结论通过对铁、钴和镍的性状、磁性、溶解性和反应性的研究,我们得出以下结论:1. 铁、钴和镍具有相似的物理和化学性质,但也存在一些差异。
大学铁钴镍实验报告

大学铁钴镍实验报告一、实验目的1、掌握铁、钴、镍氢氧化物的生成和性质。
2、了解铁、钴、镍盐的氧化还原性。
3、熟悉铁、钴、镍离子的鉴定方法。
二、实验原理铁、钴、镍是周期表中第Ⅷ族元素,它们的价电子构型分别为3d⁶4s²、3d⁷4s²、3d⁸4s²,常见的氧化态为+2 和+3。
1、氢氧化物的生成和性质铁(Ⅱ)氢氧化物:向含 Fe²⁺的溶液中加入碱,可生成白色的Fe(OH)₂沉淀,该沉淀在空气中迅速被氧化为红棕色的 Fe(OH)₃。
钴(Ⅱ)氢氧化物:向含 Co²⁺的溶液中加入碱,生成蓝色的Co(OH)₂沉淀,在空气中缓慢被氧化为棕色的 Co(OH)₃。
镍(Ⅱ)氢氧化物:向含 Ni²⁺的溶液中加入碱,生成浅绿色的Ni(OH)₂沉淀,在空气中不被氧化。
2、盐的氧化还原性铁(Ⅱ)盐具有还原性,在酸性溶液中能被氧化剂(如 KMnO₄)氧化为铁(Ⅲ)盐。
钴(Ⅱ)盐在酸性溶液中较稳定,但在碱性溶液中能被氧化剂(如H₂O₂)氧化为钴(Ⅲ)盐。
镍(Ⅱ)盐在一般条件下较稳定。
3、离子的鉴定铁离子的鉴定:Fe³⁺与 KSCN 溶液反应生成血红色的 Fe(SCN)₆³⁻。
钴离子的鉴定:Co²⁺与 KSCN 溶液反应,再加入丙酮,生成蓝色的 Co(SCN)₄²⁻。
镍离子的鉴定:Ni²⁺与丁二酮肟在氨性溶液中反应生成鲜红色的沉淀。
三、实验仪器与试剂1、仪器试管、玻璃棒、点滴板、酒精灯。
2、试剂FeSO₄溶液、FeCl₃溶液、CoCl₂溶液、NiSO₄溶液、NaOH 溶液、HCl 溶液、KMnO₄溶液、H₂O₂溶液、KSCN 溶液、丙酮、丁二酮肟、氯化铵。
四、实验步骤1、铁、钴、镍氢氧化物的生成和性质取三支试管,分别加入 1mL 01mol/L 的 FeSO₄溶液、CoCl₂溶液、NiSO₄溶液。
然后向每支试管中逐滴加入 2mol/L 的 NaOH 溶液,观察沉淀的生成及颜色。
铁_钴_镍实验报告

一、实验目的1. 了解铁、钴、镍三种金属的基本性质及其在化学反应中的表现。
2. 掌握铁、钴、镍化合物的制备方法及其性质。
3. 培养实验操作能力、观察能力和分析问题的能力。
二、实验原理铁(Fe)、钴(Co)、镍(Ni)是周期表中的过渡金属元素,它们具有丰富的化学性质。
本实验通过观察铁、钴、镍在不同条件下的反应,分析其化学性质。
三、实验材料与仪器1. 实验材料:- 铁(Fe)片- 钴(Co)片- 镍(Ni)片- 盐酸(HCl)- 硫酸(H2SO4)- 氢氧化钠(NaOH)- 氯化钠(NaCl)- 硫氰酸钾(KSCN)- 硫酸铜(CuSO4)- 氨水(NH3·H2O)- 碘化钾(KI)- 氯水(Cl2)2. 实验仪器:- 试管- 烧杯- 滴定管- 研钵- 电子天平- 酒精灯- 铁架台- 玻璃棒四、实验步骤1. 铁的性质实验:a. 将铁片放入盐酸中,观察铁片表面变化。
b. 将铁片放入硫酸铜溶液中,观察溶液颜色变化。
c. 将铁片放入氨水中,观察溶液颜色变化。
2. 钴的性质实验:a. 将钴片放入盐酸中,观察钴片表面变化。
b. 将钴片放入硫酸铜溶液中,观察溶液颜色变化。
c. 将钴片放入氨水中,观察溶液颜色变化。
3. 镍的性质实验:a. 将镍片放入盐酸中,观察镍片表面变化。
b. 将镍片放入硫酸铜溶液中,观察溶液颜色变化。
c. 将镍片放入氨水中,观察溶液颜色变化。
4. 铁钴镍化合物的制备:a. 将铁、钴、镍分别与盐酸反应,观察反应现象。
b. 将铁、钴、镍的盐溶液与氢氧化钠反应,观察沉淀颜色。
c. 将铁、钴、镍的盐溶液与氯化钠反应,观察溶液颜色变化。
五、实验结果与分析1. 铁的性质实验:a. 铁片与盐酸反应产生气泡,溶液颜色由无色变为浅绿色。
b. 铁片与硫酸铜溶液反应,溶液颜色由蓝色变为浅绿色,铁片表面出现红色沉淀。
c. 铁片与氨水反应,溶液颜色由无色变为浅绿色。
2. 钴的性质实验:a. 钴片与盐酸反应产生气泡,溶液颜色由无色变为浅蓝色。
铁钴镍实验报告实验结果(3篇)

第1篇一、实验目的本次实验旨在通过一系列化学反应和物理实验,研究铁、钴、镍三种金属的性质,包括它们的还原性、氧化性、配合物生成以及磁性等。
通过对比实验结果,加深对这三种金属化学性质的理解。
二、实验原理1. 还原性:在还原反应中,金属原子失去电子,氧化态降低。
铁、钴、镍在酸性或碱性介质中表现出不同的还原性。
2. 氧化性:在氧化反应中,金属原子获得电子,氧化态升高。
铁、钴、镍的三价离子具有氧化性。
3. 配合物生成:金属离子与配体形成配合物,配体提供孤对电子与金属离子配位。
4. 磁性:铁、钴、镍为铁磁性材料,其磁性能受温度、磁场等因素影响。
三、实验内容1. 还原性实验(1)铁(II)的还原性:在酸性介质中,铁(II)具有还原性,可还原溴水中的溴离子。
实验结果显示,加入(NH4)2Fe(SO4)2溶液后,溶液颜色由黄色变为棕色,说明铁(II)具有还原性。
(2)钴(II)和镍(II)的还原性:在酸性介质中,钴(II)和镍(II)的还原性较弱,氯水不能将它们氧化。
实验结果显示,加入氯水后,溶液颜色无变化,说明钴(II)和镍(II)的还原性较弱。
2. 氧化性实验(1)三价铁的氧化性:在碱性介质中,三价铁具有氧化性,可将亚铁离子氧化为铁离子。
实验结果显示,加入氯水后,溶液颜色由浅绿色变为棕色,说明三价铁具有氧化性。
(2)三价钴和三价镍的氧化性:在碱性介质中,三价钴和三价镍具有氧化性,可被还原为二价离子。
实验结果显示,加入NaOH溶液后,溶液颜色由浅绿色变为蓝绿色,说明三价钴具有氧化性;加入氯水后,溶液颜色由蓝绿色变为棕色,说明三价钴具有氧化性。
3. 配合物生成实验(1)铁(II)配合物:在氨水存在下,铁(II)难以形成稳定的氨配合物。
实验结果显示,加入氨水后,溶液中出现白色沉淀,说明铁(II)难以形成稳定的氨配合物。
(2)钴(II)和镍(II)配合物:在氨水存在下,钴(II)和镍(II)可形成稳定的氨配合物。
实验结果显示,加入氨水后,溶液颜色由浅绿色变为深蓝色,说明钴(II)和镍(II)与氨形成了稳定的配合物。
实验铁钴镍实验报告

一、实验目的1. 了解铁钴镍合金的制备方法和特点;2. 掌握电解铁钴镍时的反应机理及控制技术;3. 熟悉常规化学分析方法的操作;4. 培养实验观察能力。
二、实验原理铁(Fe)、钴(Co)、镍(Ni)是周期表中的过渡金属元素,它们具有相似的化学性质。
在实验中,我们将通过电解法制备铁钴镍合金,并观察其物理和化学性质。
三、实验材料与仪器1. 实验材料:- 铁、钴、镍金属片- 硫酸- 硫酸铜- 氢氧化钠- 氯化钠- 碘化钾- 氢氧化铵- 氨水- 硫氰酸钾- 银氨溶液- 氢氧化钠溶液- 硫酸亚铁铵溶液2. 实验仪器:- 电解槽- 铂电极- 银电极- 滴定管- 烧杯- 烧瓶- 烧杯夹- 玻璃棒- 铁架台- 热水浴四、实验步骤1. 制备铁钴镍合金- 将铁、钴、镍金属片分别放入硫酸中,去除表面的氧化物。
- 将去除氧化物的金属片放入电解槽中,加入适量的硫酸铜溶液。
- 将铂电极和银电极分别插入电解槽中,连接电源。
- 开启电源,进行电解反应,直至金属片表面形成合金层。
- 关闭电源,取出金属片,用热水清洗。
2. 观察合金的性质- 将制备好的铁钴镍合金进行外观观察,记录其颜色、硬度等性质。
- 将合金进行导电性测试,记录其电阻值。
3. 分析合金成分- 将合金样品溶解于硫酸中,制备成溶液。
- 采用化学滴定法,分别测定铁、钴、镍的含量。
- 计算合金中各元素的摩尔比。
4. 研究合金的化学性质- 将合金样品溶解于氢氧化钠溶液中,观察其颜色变化。
- 将合金样品与碘化钾溶液反应,观察其颜色变化。
- 将合金样品与硫氰酸钾溶液反应,观察其颜色变化。
- 将合金样品与银氨溶液反应,观察其颜色变化。
五、实验结果与分析1. 铁钴镍合金的制备- 通过电解法制备的铁钴镍合金呈银灰色,硬度较高。
- 合金具有良好的导电性,电阻值为1.5×10^-4Ω·m。
2. 合金成分分析- 铁钴镍合金中,铁、钴、镍的摩尔比为2:1:1。
3. 合金的化学性质- 铁钴镍合金在氢氧化钠溶液中呈灰绿色,表明其具有一定的还原性。
铁_钴镍实验报告

一、实验目的1. 了解铁、钴、镍三种元素的基本性质。
2. 掌握铁、钴、镍的氧化还原性质。
3. 熟悉铁、钴、镍的配合物生成及鉴定方法。
4. 培养实验操作能力、观察能力和分析问题的能力。
二、实验原理铁(Fe)、钴(Co)、镍(Ni)是周期表中的过渡金属元素,它们在化学反应中表现出丰富的氧化还原性质。
实验过程中,我们将通过一系列反应来观察和分析铁、钴、镍的性质。
三、实验器材与试剂1. 器材:试管、烧杯、滴管、酒精灯、镊子、试管架、铁架台、滤纸等。
2. 试剂:铁粉、钴粉、镍粉、硫酸亚铁铵、硫酸铜、氯化钴、硫酸镍、氢氧化钠、氨水、盐酸、氯水等。
四、实验步骤1. 铁的氧化还原性质(1)取一小试管,加入少量硫酸亚铁铵溶液,观察溶液颜色。
(2)向溶液中加入少量铁粉,观察溶液颜色变化及有无沉淀生成。
(3)向溶液中加入少量氯水,观察溶液颜色变化及有无沉淀生成。
2. 钴的氧化还原性质(1)取一小试管,加入少量氯化钴溶液,观察溶液颜色。
(2)向溶液中加入少量钴粉,观察溶液颜色变化及有无沉淀生成。
(3)向溶液中加入少量氯水,观察溶液颜色变化及有无沉淀生成。
3. 镍的氧化还原性质(1)取一小试管,加入少量硫酸镍溶液,观察溶液颜色。
(2)向溶液中加入少量镍粉,观察溶液颜色变化及有无沉淀生成。
(3)向溶液中加入少量氯水,观察溶液颜色变化及有无沉淀生成。
4. 铁的配合物生成及鉴定(1)取一小试管,加入少量硫酸亚铁铵溶液,观察溶液颜色。
(2)向溶液中加入少量氨水,观察溶液颜色变化及有无沉淀生成。
(3)向溶液中加入过量氨水,观察溶液颜色变化及沉淀是否溶解。
5. 钴的配合物生成及鉴定(1)取一小试管,加入少量氯化钴溶液,观察溶液颜色。
(2)向溶液中加入少量氨水,观察溶液颜色变化及有无沉淀生成。
(3)向溶液中加入过量氨水,观察溶液颜色变化及沉淀是否溶解。
6. 镍的配合物生成及鉴定(1)取一小试管,加入少量硫酸镍溶液,观察溶液颜色。
(2)向溶液中加入少量氨水,观察溶液颜色变化及有无沉淀生成。
铁镍钴实验报告

一、实验目的1. 掌握铁、镍、钴三种过渡金属的基本化学性质。
2. 了解这三种金属在不同条件下的反应规律。
3. 通过实验,加深对金属腐蚀与防护知识的理解。
二、实验原理铁(Fe)、镍(Ni)、钴(Co)是周期表中的过渡金属元素,它们在化学反应中表现出不同的性质。
本实验通过一系列的化学反应,观察和分析这三种金属的化学性质。
三、实验材料与仪器1. 实验材料:铁片、镍片、钴片、稀盐酸、硫酸铜溶液、硫酸亚铁溶液、硫酸镍溶液、硫酸钴溶液、氢氧化钠溶液、蒸馏水。
2. 实验仪器:试管、烧杯、酒精灯、滴管、玻璃棒、试管夹。
四、实验步骤1. 铁的化学性质- 将铁片放入盛有稀盐酸的试管中,观察现象。
- 将铁片放入硫酸铜溶液中,观察现象。
- 将铁片放入硫酸亚铁溶液中,观察现象。
2. 镍的化学性质- 将镍片放入盛有稀盐酸的试管中,观察现象。
- 将镍片放入硫酸铜溶液中,观察现象。
- 将镍片放入硫酸亚铁溶液中,观察现象。
3. 钴的化学性质- 将钴片放入盛有稀盐酸的试管中,观察现象。
- 将钴片放入硫酸铜溶液中,观察现象。
- 将钴片放入硫酸亚铁溶液中,观察现象。
4. 金属腐蚀与防护- 将铁片、镍片、钴片分别放入氢氧化钠溶液中,观察现象。
- 将铁片、镍片、钴片分别放入蒸馏水中,观察现象。
五、实验现象1. 铁的化学性质- 铁片与稀盐酸反应:产生气泡,溶液变浅绿色。
- 铁片与硫酸铜溶液反应:铁片表面有红色物质析出,溶液由蓝色变为浅绿色。
- 铁片与硫酸亚铁溶液反应:无明显现象。
2. 镍的化学性质- 镍片与稀盐酸反应:无明显现象。
- 镍片与硫酸铜溶液反应:无明显现象。
- 镍片与硫酸亚铁溶液反应:无明显现象。
3. 钴的化学性质- 钴片与稀盐酸反应:无明显现象。
- 钴片与硫酸铜溶液反应:无明显现象。
- 钴片与硫酸亚铁溶液反应:无明显现象。
4. 金属腐蚀与防护- 铁片、镍片、钴片在氢氧化钠溶液中均无明显现象。
- 铁片、镍片、钴片在蒸馏水中均无明显现象。
铁钴镍实验报告

铁钴镍实验报告实验报告:铁、钴、镍的性质研究一、实验目的了解铁、钴、镍的基本物理和化学性质。
通过实验观察和分析,掌握铁、钴、镍在化学反应中的表现。
培养实验操作能力、观察能力和分析问题的能力。
二、实验原理铁(Fe)、钴(Co)、镍(Ni)是周期表中的过渡金属元素,它们具有相似的电子构型和化学性质。
通过本实验,我们将观察这些元素在空气中的氧化反应、与酸的置换反应以及与某些盐溶液的置换反应等现象。
三、实验材料与设备实验材料:铁丝、钴丝、镍丝、稀盐酸、稀硫酸、氯化钠溶液、硫酸铜溶液等。
实验设备:试管、烧杯、镊子、酒精灯等。
四、实验步骤与观察记录观察铁、钴、镍丝的外观和颜色,并记录。
将铁丝、钴丝、镍丝分别放入试管中,加入稀盐酸,观察并记录反应现象。
将铁丝、钴丝、镍丝分别放入试管中,加入稀硫酸,观察并记录反应现象。
将铁丝、钴丝、镍丝分别放入含有氯化钠溶液的烧杯中,观察并记录反应现象。
将铁丝、钴丝、镍丝分别放入含有硫酸铜溶液的烧杯中,观察并记录反应现象。
用酒精灯加热铁丝、钴丝、镍丝至红热状态,然后迅速伸入盛有氧气的集气瓶中,观察并记录反应现象。
五、实验结果与分析铁丝、钴丝、镍丝的外观均为银白色金属光泽。
在空气中放置一段时间后,表面会逐渐氧化形成一层氧化物薄膜。
铁丝、钴丝、镍丝与稀盐酸反应均产生气泡,说明它们能与酸发生置换反应生成氢气。
反应方程式如下:Fe + 2HCl →FeCl2 + H2↑Co + 2HCl →CoCl2 + H2↑Ni + 2HCl →NiCl2 + H2↑铁丝、钴丝、镍丝与稀硫酸反应也产生气泡,同样说明它们能与酸发生置换反应生成氢气。
反应方程式与上述类似。
在氯化钠溶液中,铁丝、钴丝、镍丝均未发生明显反应,说明它们与氯化钠溶液不反应。
在硫酸铜溶液中,铁丝、钴丝、镍丝表面均出现红色物质析出,说明它们能与硫酸铜发生置换反应生成铜。
反应方程式如下:Fe + CuSO4 →FeSO4 + CuCo + CuSO4 →CoSO4 + CuNi + CuSO4 →NiSO4 + Cu当加热铁丝、钴丝、镍丝至红热状态后迅速伸入盛有氧气的集气瓶中时,观察到铁丝剧烈燃烧火星四射生成黑色固体四氧化三铁;钴丝和镍丝也发生燃烧但火星较少生成相应的氧化物。
实验八第一过渡系元素(铁、钴、镍)

实验⼋第⼀过渡系元素(铁、钴、镍)
实验⼋第⼀过渡系元素(⼆) (铁、钴、镍)
实验摘要:
为了了解铁、钴、镍的氧化还原性质和配合物特征,本实验⽤简单的⽅法完成了铁、钴、镍(Ⅱ、Ⅲ)氧化态的化合物的氧化还原及配合物实验。
结果表明铁、钴、镍(Ⅱ)均具有⼀定的还原性,并且依次减弱,⽽其(Ⅲ)氧化态化合物具有⼀定氧化性,且依次增强;铁、钴、镍(Ⅱ、Ⅲ)氧化态离⼦具有较强的形成配合物的能⼒,且与氨、硫氰根等能形成具有特殊颜⾊的配合物。
关键词:
铁(Ⅱ) 钴(Ⅱ) 镍(Ⅱ) 还原性铁(Ⅲ) 钴(Ⅲ) 镍(Ⅲ) 氧化性配合物
实验⽤品:
试管离⼼试管碘化钾淀粉试纸
实验内容:
⼆.铁(Ⅲ)、钴(Ⅲ)、镍(Ⅲ)化合物的氧化性
三.配合物的形成
4.镍的配合物
结果及讨论:
铁、钴、镍的氧化还原规律:⼆价氧化态均具有氧化性,其还原性依次减⼩,还原性受介质酸碱性影响,Fe2+⽆论在酸性介质还是碱性介质中均表现较强还原性,⽽Co2+、Ni2+主要在碱性介质中表现还原性;Fe3+、Co3+、Ni 3+均具有⼀定的氧化性,其氧化性依次增强,Fe3+在酸性溶液中有中等氧化能⼒。
铁、钴、镍的配合物特征: Fe2+、Co2+、Ni 2+、Fe3+、Co3+、Ni 3+均具有较强的配位能⼒,主要形成四配位、六配位、⼋配位的配合物;不同配合物表现出特殊的颜⾊,配合物的电极电势降低,使得配合物氧化性低。
铁钴镍的性质实验报告

一、实验目的1. 掌握铁、钴、镍三种金属的物理性质和化学性质。
2. 了解铁、钴、镍在空气中氧化和水溶液中反应的特性。
3. 研究铁、钴、镍的还原性和氧化性。
4. 探究铁、钴、镍的配合物生成及其在离子鉴定中的作用。
二、实验原理铁、钴、镍是过渡金属,具有丰富的化学性质。
在空气中,铁、钴、镍容易被氧化生成相应的氧化物;在水溶液中,它们可以与酸、碱反应,表现出还原性和氧化性。
铁、钴、镍的配合物在离子鉴定中具有重要作用。
三、实验仪器与试剂1. 仪器:试管、烧杯、酒精灯、镊子、滴管、玻璃棒、电子天平、pH计等。
2. 试剂:铁粉、钴粉、镍粉、硫酸、盐酸、氢氧化钠、氨水、氯水、溴水等。
四、实验步骤1. 物理性质观察(1)观察铁、钴、镍的颜色、硬度、磁性等物理性质。
(2)分别将铁、钴、镍放入试管中,用酒精灯加热,观察其燃烧现象。
2. 化学性质实验(1)氧化性实验①将铁、钴、镍分别放入试管中,加入少量硫酸,观察反应现象。
②将铁、钴、镍分别放入试管中,加入少量盐酸,观察反应现象。
③将铁、钴、镍分别放入试管中,加入少量氢氧化钠,观察反应现象。
(2)还原性实验①在酸性介质中,往盛有1毫升溴水的试管中加入3滴1:1H2SO4的溶液,然后滴加0.2mol/L(NH4)2Fe(SO4)2溶液,观察现象。
②在碱性介质中,在一试管中加入2毫升蒸馏水和5滴3mol/LH2SO4,煮沸以赶尽溶于其中的空气,然后溶入少量硫酸亚铁铵晶体。
在另一试管中注入3mL6mol/LNaOH溶液,煮沸。
冷却后,用一长滴管吸约0.5mL氢氧化钠溶液,插入硫酸亚铁铵溶液内,慢慢放出氢氧化钠溶液。
(3)配合物生成实验①将Fe2+、Co2+、Ni2+分别与氨水反应,观察沉淀现象。
②将过量的氨水加入Co2+或Ni2+离子的水溶液中,观察沉淀溶解现象。
3. 离子鉴定实验根据实验现象,鉴定Fe2+、Co2+、Ni2+的存在。
五、实验结果与分析1. 物理性质观察结果铁、钴、镍均为银白色金属,具有磁性。
铁、钴、镍实验报告
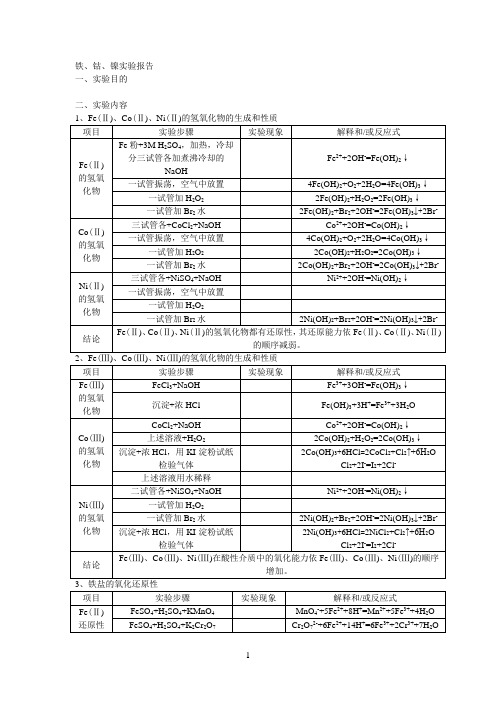
Fe(Ⅲ)的氧化性
FeCl3+TAA,加热
2Fe3++H2S=2Fe2++S↓+2H+
FeCl3+KI+CCl4
2Fe3++2I-=2Fe2++I2
I2在CCl4中显色
结论
在酸性介质中Fe(Ⅲ)有一定的氧化能力,Fe(Ⅱ)还原性较弱需较强氧化剂将其氧化。
结论
铁盐生成氢氧化物不溶于过量的氨水,钴盐和镍盐生成碱式盐溶于过量的氨水生成氨配合物,Co(Ⅱ)氨配合物易氧化转化成Co(Ⅲ)氨配合物。Fe(Ⅲ)、Co(Ⅱ)与SCN-生成配合物,Fe(Ⅱ)、Ni(Ⅱ)与SCN-不生成配合物,
5、离子的鉴定
实验步骤
实验现象
解释和/或反应式
FeCl3+K4Fe(CN)6
4、Fe、Co、Ni的配合物
项目实验步骤实来自现象解释和/或反应式氨的配合物
FeCl3+适量NH3水
Fe3++3OH-=Fe(OH)3↓
上述溶液+过量NH3水
FeSO4+适量NH3水
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3↓
上述溶液+过量NH3水
CoCl2+适量NH3水
Fe(OH)3+3H+=Fe3++3H2O
Co(Ⅲ)的氢氧化物
CoCl2+NaOH
Co2++2OH-=Co(OH)2↓
铁钴镍的性质

铁钴镍的性质 The following text is amended on 12 November 2020.实验六铁、钴、镍的性质一、实验目的1、试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验原理铁、钴、镍常见氧化值:+2和+3 另外 Fe还有+61、Fe2+、Co2+、Ni2+的还原性(1)酸性介质+ 2Fe2+(浅绿)=2Fe3+(浅黄)+2Cl-Cl2(2)碱性介质铁(II)、钴(II)、镍(II)的盐溶液中加入碱,均能得到相应的氢氧化物。
易被空气中的氧气氧化,往往得不到白色的氢氧化亚铁,而是变成灰绿Fe(OH)2色,最后成为红棕色的氢氧化铁。
Co(OH)也能被空气中的氧气慢慢氧化。
22、Fe3+、Co3+、Ni3+的氧化性由于Co 3+和Ni 3+都具有强氧化性,Co(OH)3,NiO(OH)与浓盐酸反应分别生成Co(II)和Ni(II),并放出氯气。
CoO(OH)和NiO(OH )通常由Co (II )和Ni(II)的盐在碱性条件下用强氧化剂(Cl 2、Br 2)氧化得到。
Fe 3+易发生水解反应。
Fe 3+具有一定的氧化性,能与强还原剂反应生成Fe 2+。
3、配合物的生成和Fe 2+、Fe 3+、Co 2+、Ni 2+的鉴定方法 (1)氨配合物Fe 2+和Fe 3+难以形成稳定的氨配合物。
在水溶液中加入氨时形成Fe(OH)2和Fe(OH)3沉淀。
将过量的氨水加入Co 2+或Ni 2+离子的水溶液中,即生成可溶性的氨合配离子[Co(NH 3)6]2+或[Ni(NH 3)6]2+。
不过[Co(NH 3)6]2+ 不稳定,易氧化成[Co(NH 3)6]3+。
(2)氰配合物Fe 3+,Co 3+,Fe 2+,Co 2+,Ni 2+都能与CN -形成配合物。
使亚铁盐与KCN 溶液作用得Fe(CN)2沉淀,KCN 过量时沉淀溶解。
