克隆载体表达载体构建详细版
表达载体的构建

中国海洋大学 科学馆319 (4)设原始质粒为对照,意为检测整个操作过程中是否有误。
谢 谢
中国海洋大学 科学馆319
1. 尽可能除去无关的DNA序列 从而增加载体容量。 2. 选择表达载体时,要根据所表达蛋白的最终应用考虑。如为方 便纯化,可选择融合表达;如为获得天然蛋白,可选择非融合 表达,融合表达时在选择外源DNA同载体分子连接反应时,对 转录和转译过程中密码结构的阅读不能发生干扰。 3. 选择的酶切位点在靶基因上没有相应的酶切序列,否则在构建 重组子进行酶切时会把靶基因给切开。 4. 在惠赠或交换的质粒中确定MCS的正确性,否则会造成错读密 码子
中国海洋大学 科学馆319
二 构建表达载体的基本步骤
引物设计
目的基因(CDS区)的克隆
目的基因进行酶切
质粒进行酶切线性化,电泳,胶回收纯化
中国海洋大学 科学馆319
模板与线性化质粒连接
转化到大肠杆菌DH5α
鉴 定(PCR,测序,酶切)
将表达载体导入表达菌株
中国海洋大学 科学馆319
三 载体构建具体范例:
大菱鲆GHR基因构建入pEGFP载体中
中国海洋大学 科学馆319
1. GHR从大菱鲆cDNA模板中扩增
5‘非翻译区
CDS区 内引物
3‘非翻译区
初次PCR引物设计(外引物)
中国海洋大学 科学馆319
2. 分析酶切GHR基因酶切位点
将GHR基因mRNA序列的CDS区(蛋白编码区)导入
DNAMAN 软件中,进行酶切位点分析:
中国海洋大学 科学馆319
3. 引物的设计
克隆载体构建实验报告(3篇)

第1篇一、实验目的1. 学习克隆载体的构建方法,掌握分子克隆的基本原理和操作步骤。
2. 掌握利用限制性内切酶和DNA连接酶进行DNA片段的插入和连接。
3. 熟悉重组质粒的鉴定和扩增方法。
二、实验原理克隆载体是分子生物学研究中常用的工具,它可以将目的基因插入其中,并在宿主细胞中进行扩增。
克隆载体的构建主要包括以下步骤:1. 设计引物:根据目的基因序列设计特异性引物,用于PCR扩增目的基因片段。
2. PCR扩增:利用引物扩增目的基因片段。
3. 载体线性化:利用限制性内切酶将载体线性化,使其具有末端粘性。
4. DNA片段连接:将目的基因片段与载体进行连接。
5. 转化宿主细胞:将连接后的重组质粒转化至宿主细胞。
6. 鉴定和扩增:通过PCR、酶切等方法对转化后的细胞进行鉴定和扩增。
三、实验材料1. 试剂:PCR引物、限制性内切酶、DNA连接酶、DNA分子量标准、Taq酶、pUC19载体、感受态细胞等。
2. 仪器:PCR仪、电泳仪、凝胶成像系统、移液器、DNA纯化柱等。
四、实验步骤1. 设计引物:根据目的基因序列设计特异性引物,引物长度一般为20-30个碱基,其中包含酶切位点。
2. PCR扩增:利用引物扩增目的基因片段,PCR反应体系如下:- 10×PCR缓冲液5μl- dNTPs(每种2.5μmol/L)4μl- 引物(上下游引物各1μmol/L)2μl- DNA模板1μl- Taq酶0.5μl- ddH2O补充至50μl3. 载体线性化:利用限制性内切酶将载体线性化,反应体系如下:- 载体DNA 5μl- 10×酶切缓冲液5μl- 限制性内切酶1μl- ddH2O补充至20μl4. DNA片段连接:将PCR产物与载体进行连接,反应体系如下:- 线性化载体DNA 5μl- PCR产物5μl- 10×连接缓冲液5μl- DNA连接酶1μl- ddH2O补充至20μl5. 转化宿主细胞:将连接后的重组质粒转化至感受态细胞,具体操作方法如下:- 将感受态细胞铺板于含有适当抗生素的培养基上,37℃培养过夜。
表达载体的构建方法及步骤

表达载体的构建方法及步骤一、载体的选择及如何阅读质粒图谱目前,载体主要有病毒和非病毒两大类,其中质粒DNA 是一种新的非病毒转基因载体。
一个合格质粒的组成要素:(1)复制起始位点Ori 即控制复制起始的位点。
原核生物DNA 分子中只有一个复制起始点。
而真核生物DNA 分子有多个复制起始位点。
(2)抗生素抗性基因可以便于加以检测,如Amp+ ,Kan+(3)多克隆位点MCS 克隆携带外源基因片段(4)P/E 启动子/增强子(5)Terms 终止信号(6)加poly(A)信号可以起到稳定mRNA 作用选择载体主要依据构建的目的,同时要考虑载体中应有合适的限制酶切位点。
如果构建的目的是要表达一个特定的基因,则要选择合适的表达载体。
载体选择主要考虑下述3点:【1】构建DNA 重组体的目的,克隆扩增/基因表达,选择合适的克隆载体/表达载体。
【2】.载体的类型:(1)克隆载体的克隆能力-据克隆片段大小(大选大,小选小)。
如<10kb 选质粒。
(2)表达载体据受体细胞类型-原核/真核/穿梭,E.coli/哺乳类细胞表达载体。
(3)对原核表达载体应该注意:选择合适的启动子及相应的受体菌,用于表达真核蛋白质时注意克服4个困难和阅读框错位;表达天然蛋白质或融合蛋白作为相应载体的参考。
【3】载体MCS 中的酶切位点数与组成方向因载体不同而异,适应目的基因与载体易于链接,不能产生阅读框架错位。
综上所述,选用质粒(最常用)做载体的5点要求:(1)选分子量小的质粒,即小载体(1-1.5kb)→不易损坏,在细菌里面拷贝数也多(也有大载体);(2)一般使用松弛型质粒在细菌里扩增不受约束,一般10个以上的拷贝,而严谨型质粒<10个。
(3)必需具备一个以上的酶切位点,有选择的余地;(4)必需有易检测的标记,多是抗生素的抗性基因,不特指多位Ampr(试一试)。
(5)满足自己的实验需求,是否需要包装病毒,是否需要加入荧光标记,是否需要加入标签蛋白,是否需要真核抗性(如Puro、G418)等等。
构建基因表达载体的流程

构建基因表达载体的流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!Download Tip: This document has been carefully written by the editor.I hope that after you download, they can help you solve practical problems. After downloading, the document can be customized and modified. Please adjust and use it according to actual needs. Thank you!构建基因表达载体的流程:①目的基因选择与克隆:确定需要表达的基因序列,通过PCR扩增或从基因文库中提取,随后克隆到适合的质粒载体上,如pUC系列质粒,便于后续操作。
②载体选择与准备:根据表达系统(细菌、酵母、哺乳动物细胞等)和目的蛋白特性,选择合适的表达载体,如pET系列(原核)、pYES2(酵母)、pcDNA3.1(哺乳动物)。
载体需预先线性化或具有特定限制酶切位点。
③酶切与连接:使用限制性内切酶对目的基因片段和载体分别进行酶切,以产生相匹配的黏性末端或平末端。
之后,通过T4 DNA连接酶将目的基因片段连接到载体上。
④转化与筛选:将连接产物转入相应的宿主细胞(如大肠杆菌DH5α),通过热激、电击等方法促进细胞吸收DNA。
随后在含有抗生素的选择培养基上培养,筛选出含重组载体的阳性克隆。
⑤验证与测序:挑取阳性克隆,通过PCR、酶切分析或直接测序等方法验证目的基因是否正确插入载体,以及阅读框是否正确。
⑥表达验证:将验证后的重组载体转入最终的表达宿主细胞中,诱导表达目标蛋白,通过SDS-PAGE、Western Blot等方法检测蛋白的表达效率及特性。
克隆载体与表达载体

克隆载体与表达载体
1. T载体是克隆载体,你的基因通过TA克隆法插入载体,这一步的目的是扩增基因,得到大量你要的目的基因片段,以便进行下一步表达载体的构建;DH5α是克隆菌株,不能用来做表达;
2. 欲在大肠杆菌中表达外源基因,需要首先构建原核表达载体,如可将构建至T 载体的目的通过双酶切切下来然后连接到表达载体上,如PET系列的载体等,构建成原核表达载体后,可将此载体转化表达菌株,如BL21(DE3,)等,如果你的目的基因含有稀有密码子,也可以转化Rosetta系列的表达菌株。
最后将构建成功的基因工程菌进行诱导表达。
1、T载体常用于克隆,一般来讲都会再把目的基因亚克隆到表达载体上。
但是并非T载体不能用来表达。
常见的pMD18-T,含有lacZ操纵子,可以IPTG诱导表达。
pGEM-T则含有T7和SP6启动子。
2、为了能够顺利地使用T7系统来表达蛋白,在如BL21(DE3)一类的大肠杆菌菌株中,编码T7RNA聚合酶的基因被整合到其染色体上,并位于lacUV5启动子的下游,受乳糖操纵子调控。
而目标蛋白的编码序列则被构建到含T7启动子序列的质粒上,并受T7RNA聚合酶调控转录。
3、构建质粒、基因表达看似比较成熟,也比较简单。
其实这里面大有学问。
学会看菌株和质粒的相关文档,答案就在其中。
克隆载体构建 Protocol

克隆载体构建是一个生物学实验中常用的过程,用于将目的基因插入到特定的DNA序列中,以便在细胞内进行表达和功能研究。
以下是克隆载体构建所需试剂和耗材、实验仪器、准备工作、实验方法、注意事项、常见问题及解决方法。
一、所需试剂和耗材1.限制性内切酶:用于识别和切割特定的DNA序列。
2.DNA连接酶:用于将目的基因与载体DNA连接在一起。
3.质粒DNA:用作克隆载体的DNA分子,通常使用经过改造的质粒。
4.目的基因:需要插入克隆载体的DNA片段。
5.T4 DNA连接酶:用于将目的基因与载体DNA连接在一起。
6.缓冲液:用于维持反应液的pH值和其他辅助因子的浓度。
7.dNTPs(脱氧核糖核苷三磷酸):DNA合成的原材料,包括dATP、dTTP、dCTP、dGTP。
8.无菌水:用于稀释和配制溶液。
9.酚/氯仿/异戊醇混合液:用于抽提质粒DNA。
10.氯仿:用于沉淀和分离DNA。
11.无水乙醇:用于洗涤和沉淀DNA。
12.70%乙醇:用于清洗PCR管和其他器具。
二、实验仪器1.实验室搅拌器:用于混合和振荡反应液。
2.离心机:用于离心DNA溶液和其他反应液。
3.水浴锅:用于保温反应液。
4.移液器:用于精确添加试剂和溶液。
5.PCR仪:用于扩增目的基因。
6.电泳仪和电泳槽:用于分析DNA样品。
7.紫外分光光度计:用于测量DNA浓度。
8.显微镜:观察细胞和组织样品。
三、准备工作1.阅读实验步骤和注意事项,了解所需的试剂和耗材及其使用方法。
2.准备好所需的试剂和耗材,并确保它们处于保质期内。
3.检查实验室内是否具备上述实验仪器,并确保其正常运行。
4.准备好实验服、口罩、手套等个人防护用品。
5.用70%乙醇擦拭实验台面,以确保无菌环境。
6.用高压蒸汽灭菌法灭菌所有的实验器具,包括离心管、移液器等。
7.设置PCR仪的温度循环程序以及其他相关参数。
8.计算所需的质粒DNA和目的基因的摩尔数,以便进行后续反应。
四、实验方法1.用酚/氯仿/异戊醇混合液抽提质粒DNA,并将其沉淀在氯仿中。
构建克隆载体步骤

构建克隆载体步骤构建克隆载体主要有以下步骤:一、基本动作要领1. 目的基因的获取- 首先,如果是从基因组DNA中获取目的基因,咱们就得先提取基因组DNA。
就像摘果子得先找到果树一样,这里提取基因组DNA的方法有很多,像酚- 氯仿抽提法就比较经典。
提取的时候,一定要保证样本的新鲜度。
我之前就做错过,用了放置很久的样本,结果提取出来的DNA 质量特别差。
如果是从mRNA经反转录得到cDNA再获取目的基因的话,就要注意mRNA的质量了。
要使用质量好的逆转录酶,这就好比建房子得用好的砖头,mRNA就是建基因这座“房子”的砖头。
2. 载体的选择- 载体就像是一辆“车”,用来搭载我们的目的基因。
常见的载体有质粒、噬菌体、病毒等。
如果是简单的在细菌里克隆,一般就选质粒载体。
要根据自己的实验需求来选,比如要有合适的筛选标记,像抗药性基因之类的,这样才能方便后续筛选出带有重组载体的细胞。
3. 目的基因和载体的酶切- 这是很关键的一步,要选择合适的限制性内切酶。
就像开锁得用对钥匙一样,酶切位点必须是载体和目的基因上都有的,而且要在合适的反应体系里进行。
酶切反应的缓冲液、温度、反应时间都得严格控制。
我试过好多次,温度稍微不对,酶切就不完全。
反应体系里的底物浓度也要合适,别加太多或者太少的DNA,就像做菜加盐一样,得适量。
- 给大家简单画个示意图来理解一下。
就好比长条形的目的基因和环状的载体,用内切酶在特定的位置“咔嚓”一刀,这样就产生了可以连接的黏性末端或者平末端。
二、个人小技巧1. 在酶切之前,可以先做个小的预实验。
就像试水温一样,看看用什么浓度的酶、多长的反应时间是最合适的。
对了这里可以把目的基因和载体分别做预酶切,这样如果有问题就可以很快定位是哪一个的问题。
2. 在选择内切酶的时候,尽量选择产生不同黏性末端的酶,这样在连接的时候特异性会更好。
这就好比把两个不同形状的拼图碎片拼在一起,不容易拼错。
三、容易忽视的细节1. 酶切完后一定要进行凝胶电泳来检验酶切产物是否正确。
克隆载体与表达载体
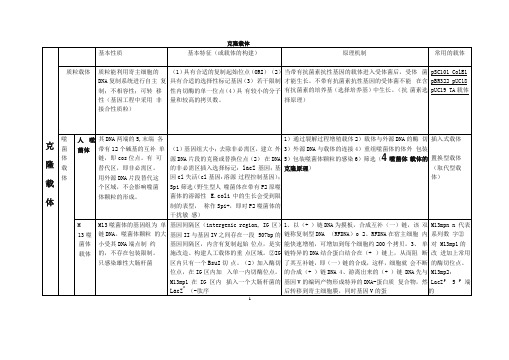
分类
结构组成及表达兀件
特点或优点
备注
质 粒 表 达 载 体
原核表达载 体
1启动子、
2转录终止子(防止克隆的外源基因表达干
扰载体的稳定性)
(1)基因组大小;去除非必需区,建立 外源DNA片段的克隆或替换位点(2) 在DNA的非必需区插入选择标记:lacZ基因;基因cl失活(cl基因:溶源 过程控制基因);Spi筛选(野生型人 噬菌体在带有P2原噬菌体的溶源性E.coli中的生长会受到限制的表型, 称作Spi+,即对P2噬菌体的干扰敏 感)
YAC的构建有比在细菌中克隆的一些优点,因为某些真核 细胞的序列,特别是重复序列是难以甚至不可能在细菌中 繁殖的,酵母细胞却具有这样的能力
5
色
体
细菌人工染色体 载体
BAC
是基于大肠杆菌 的F质粒构建 的,高通量低拷 贝的质粒载体
每个环状DNA分子中携带一个抗生素抗性标 记,一个来源于大肠杆菌F因子(致育因子) 的严谨型控制的复制子oriS(Shizuya et al.
主要使用EcoR I
ColEl
天然质粒,属松弛型多拷贝型
6.3 kb
大肠杆菌素(colicin) E1和对E1免疫的 基因(immE1)
EcoR I位于E1内部,插入外源DNA会导致E1失活,使受体菌不能合成E1 (ColE1-),但仍然 表现出对E1免疫型(皿1^1+)
pBR322
兀件来源①复制起点orip
酵母人工染 色体载体YAC细菌人工染 色体载体BAC
P1噬菌体人 工染色体载 体PAC
质粒载体总结
质 粒 载 体
类型
长度
选择标记
克隆位点
pSC101
分子克隆之载体构建完整步骤

分子克隆之载体构建完整步骤一、目的片段的扩增和酶切PCR反应的基本成分包括:模板DNA(逆转录所得cDNA)、引物、4种脱氧核苷酸(dNTPs)、DNA聚合酶和适宜的缓冲液及水。
PCR由变性--退火--延伸三个基本反应步骤构成:①模板DNA的高温变性:模板DNA经加热至95℃左右一定时间后,使模板DNA双链或经PCR扩增形成的双链DNA解离,使之成为单链,以便它与引物结合,为下轮反应作准备;②模板DNA与引物的低温退火(复性):模板DNA经加热变性成单链后,温度降至55℃左右,引物与模板DNA 单链的互补序列配对结合;③引物的适温延伸:DNA模板--引物结合物在。
准备:A.模板DNA:质粒DNA,逆转录cDNA或挑菌落B.引物配制:a)存储液100uM:公司合成的引物干粉,13000rpm离心2min,加入管壁nmol数x10ul的ddH2O振荡充分溶解。
b)工作液10uM:上下游引物存储液各10ul加80ul ddH2O混匀配制100ul工作液。
终浓度200-400nM。
1. PCR反应体系(50ul)Taq酶体系:Thermo10x buffer (无Mg2+)5ulMgCl2(25mM)5uldNTP (10mM)1ul上下游引物工作液1ul模板cDNA(质粒DNA 不超过100ng)2-4ulTaq DNA聚合酶0.5ulddH2O 补充至50 ul注:1. 其他体系如菌落PCR反应20ul按比例调整即可。
2. 其他公司Taq酶或2x buffer mix已包含Taq酶、dNTPs时作相应调整。
PCR仪设置反应条件:95℃ 5min 预变性循环x30-35:变性95℃ 30s退火60℃ 30s (退火温度为引物Tm值-3~5℃)延伸72℃ 60s (延伸时间根据产物长度:Taq酶效率约1kb/min)72℃ 7 min 补充延伸4-10℃ 保温高保真Pfu酶体系(优选):Thermo10x buffer 5uldNTP (10mM)1ul上下游引物工作液1ul模板DNA或cDNA(质粒DNA 不超过100ng)2-4ulpfu DNA聚合酶1ulddH2O 补充至50 ulPCR仪设置反应条件:95℃ 5min 预变性循环x30:变性95℃ 30s退火60℃ 30s (退火温度为引物Tm值-5℃,特殊酶如NEB公司Phusion高保真酶需要高退火温度,参考官网)延伸72℃ 60s (延伸时间根据产物长度:pfu酶合成效率约600-1kb/min)72℃ 7 min 补充延伸4℃ 保温2. 琼脂糖凝胶电泳验证取5ul样品+1ul DNA Loading buffer(6x)混匀上样,150V恒压电泳30min,凝胶成像仪紫外观察保存电泳图片。
克隆载体与表达载体教程文件

克隆载体:大多是高拷贝的载体,一般是原核细菌,将需要克隆的基因与克隆载体的质粒相连接,再导入原核细菌内,质粒会在原核细菌内大量复制,形成大量的基因克隆,被克隆的基因不一定会表达,但一定被大量复制。
克隆载体只是为了保存基因片段,这样细胞内不会有很多表达的蛋白质而影响别的工作。
克隆载体(Cloning vector ):携带插入外源片段的质粒或噬菌体,从而产生更多物质或蛋白质产物。
(这是为“携带”感兴趣的外源DNA、实现外源DNA的无性繁殖或表达有意义的蛋白质所采用的一些DNA 分子。
)其中,为使插入的外源DNA序列可转录、进而翻译成多肽链而设计的克隆载体又称表达载体。
是否含有表达系统元件,即启动子--核糖体结合位点--克隆位点--转录终止信号,这是用来区别克隆载体和表达载体的标志。
表达载体:有的是高拷贝的,有的是低拷贝的,各有各的用处,是一些用于工程生产的细菌,被导入的目标基因会在此类细菌中得到表达,生产出我们需要的产物,导入的基因是由克隆载体产出的。
表达载体具有较高的蛋白质表达效率,一般因为具有强的启动子。
表达载体(Expression vectors)就是在克隆载体基本骨架的基础上增加表达元件(如启动子、RBS、终止子等),是目的基因能够表达的载体。
如表达载体pKK223-3是一个具有典型表达结构的大肠杆菌表达载体。
其基本骨架为来自pBR322和pUC的质粒复制起点和氨苄青霉素抗性基因。
在表达元件中,有一个杂合tac强启动子和终止子,在启动子下游有RBS位点(如果利用这个位点,要求与ATG之间间隔5-13bp),其后的多克隆位点可装载要表达的目标基因。
(RBS位点:1974年Shine和Dalgarno首先发现,原核生物,在mRNA上有核糖体的结合位点,它们是起始密码子AUG和一段位于AUG上游3~10 bp处的由3—9bp组成的序列。
这段序列富含嘌呤核苷酸,刚好与16S rRNA 3,末端的富含嘧啶的序列互补,是核糖体RNA的识别与结合位点。
构建表达载体的一般流程

构建表达载体的一般流程
构建表达载体的一般流程如下:
1. 选择合适的载体:根据需要表达的基因或蛋白质,选择一个合适的表达载体。
常用的载体有质粒、病毒、合成RNA等。
2. 插入目标基因:将需要表达的基因插入到载体的多克隆位点中。
可以通过PCR 扩增目标基因并使用限制性内切酶切割载体和基因,然后进行连接。
3. 连接启动子和终止子:为确保基因在宿主细胞中能够正常表达,需要在基因的上游添加启动子和在基因的下游添加终止子。
这些序列将调控基因的表达方式和水平。
4. 检验构建质量:通过限制性内切酶切割、PCR扩增或测序等方法,验证所构建的载体和目标基因的正确性和完整性。
5. 转化宿主细胞:将构建好的表达载体导入到宿主细胞中。
常用的转化方法有电穿孔、热激冲击和化学转化等。
6. 筛选和鉴定:通过特定的筛选方法或选择标记,在转化的宿主细胞中筛选和鉴定表达目标基因的阳性克隆。
7. 表达优化:根据需要,可以通过调节培养条件、添加诱导剂或使用特定的宿主菌株等方法,优化目标基因的表达水平和质量。
8. 收获表达产物:经过一段时间的培养后,收获表达的基因产物,如蛋白质,进行后续的纯化、鉴定和应用等。
需要注意的是,具体的构建流程和方法可能会因实验的目的和要求而有所不同。
在实施过程中,需要对不同步骤和条件进行优化和调整,以确保表达载体的构建和表达目标基因的成功。
分子克隆详细步骤

分子克隆详细步骤分子克隆是通过重组DNA分子来产生大量完全相同的DNA序列的技术。
在分子克隆工作中,我们主要进行克隆载体的构建、目标DNA的扩增、将目标DNA插入克隆载体中、转化和筛选等步骤。
下面将详细介绍这些步骤:1.克隆载体的构建:克隆载体是用于插入目标DNA的DNA分子。
常用的克隆载体包括质粒、噬菌体和人工染色体等。
在构建克隆载体时,我们首先需要选择适合的载体,并提取载体的DNA。
然后,利用酶切酶对载体进行酶切,生成线性的载体DNA。
接下来,将目标DNA插入克隆载体的相应位点上,形成重组的载体。
2.目标DNA的扩增:目标DNA可以通过PCR(聚合酶链反应)来扩增。
首先,设计引物,使其与目标DNA的两端末端相互互补。
然后,在PCR反应中,通过DNA聚合酶的扩增作用,使目标DNA得以扩增。
PCR反应通常包括模板DNA、引物、核苷酸和聚合酶等成分。
3.目标DNA的插入:将扩增后的目标DNA与酶切后的载体进行连接,利用DNA连接酶催化目标DNA与载体之间的连接反应,生成重组的克隆载体。
连接后的载体含有目标DNA的序列。
4.转化:将克隆载体引入宿主细胞中进行复制。
这一步骤通常称为转化。
转化可以通过电击、热激、化学方法等方式进行。
宿主细胞通常是大肠杆菌等细菌。
5.筛选:利用筛选方法来选择包含目标DNA的克隆。
常用的筛选方法包括抗生素筛选、报告基因筛选和限制性内切酶酶切筛选等。
抗生素筛选是将带有选择性抗生素耐受基因的克隆引入含有相应抗生素的培养基中,只有带有目标DNA的克隆才能生长。
报告基因筛选是通过将报告基因插入克隆载体中,使之与目标DNA一起被转录和翻译,从而表达报告基因的蛋白质,以此来筛选包含目标DNA的克隆。
限制性内切酶酶切筛选是通过限制性内切酶对重组载体和目标DNA进行酶切,并通过凝胶电泳的方法来分离并检测含有目标DNA的克隆。
以上就是分子克隆的详细步骤。
通过这些步骤,我们可以获得大量完全相同的DNA序列,并用于各类分子生物学研究和应用中。
构建表达载体的实验流程及其注意事项

质粒纯化:
1、PEG纯化
缺点:摇菌液几百毫升,耗时长,步骤繁多 优点:质粒纯度高(不含线状DNA)
浓度大
2、过柱法:
缺点:柱子吸附能力有限,浓度低,纯度差(甚至有RNA) 优点:省时省力
29
质粒的电泳
Marker是酶切片段; 质粒是环形的,还会形成超螺旋结构。
30
质粒验证
1、酶切验证
一般将质粒切成2-3个片段,片段大小是否相符? 如:连接后酶切的载体片段、目标片段大小与连接前相同?
三、人工化学合成
最后的选择。公司会将合成片段连入克隆载体。需测序验证。
12
汇报内容
1 表达载体的分类 2 目的基因的获得 3 酶切 4 片段回收 5 连接 6 质粒的检测
13
基因工程所用的酶
限制性内切酶 从商品目录上得到有关信息
EcoR I
Pst I
GAATTC CTTAAG
CTGCAG GACGTC
验证每步产物,设置对照以检查每一反 应的效率,都是可取的良策。而要对上述问题应对自 如,又必须透彻理解每一步实验流程所涉 及的实验原理。
——第一版前言(p11)
《分子克隆实验指南》 第二版 ,1996,科学出版社
2
汇报内容
1 表达载体的分类 2 目的基因的获得 3 酶切 4 片段回收 5 连接 6 质粒的检测
质粒提取:碱裂解法
收获细菌:含有质粒的DH5α、TOP10等 LB可富集2-3次,Teriffic可2次。
溶液Ⅰ: Tris-HCl, EDTA, 葡萄糖 溶液Ⅱ: NaOH, SDS
冰上3-5min,时间过长会: 质粒断裂;羟基化影响酶切
溶液Ⅲ:乙酸钾,冰乙酸 迅速颠倒3次混匀后,置于冰上
lic法构建表达载体

lic法构建表达载体
LIC(Ligation-Independent Cloning)法是一种高效的分子克隆技术,它不需要依赖于连接反应,可以简化克隆过程并降低假阳性率。
在构建表达载体时,可以使用LIC法将目的基因插入到表达载体中。
以下是使用LIC法构建表达载体的基本步骤:
1.准备目的基因和表达载体:获取目的基因的DNA片段,并将其与LIC载体进行酶切或PCR扩增。
同时,准备好表达载体,如质粒DNA。
2.消化处理:将目的基因和表达载体进行消化处理,去除其自身的黏性末端,使其形成平末端或单链突出末端。
这一步可以通过酶切或化学方法实现。
3.转化:将处理好的目的基因和表达载体进行混合,并加入适量的T4 DNA连接酶。
在适宜的温度下进行转化反应,使目的基因与表达载体进行连接。
4.筛选与鉴定:对转化后的产物进行筛选和鉴定,可以使用抗生素筛选、PCR鉴定等方法。
确认目的基因已正确插入到表达载体中。
5.表达分析:将鉴定正确的表达载体转入宿主细胞中,进行目的基因的表达分析,如蛋白质表达、酶活性检测等。
使用LIC法构建表达载体的优点包括:操作简便、快速、高效、不需要特殊的仪器设备等。
同时,由于其不依赖于连接反应,可以避免连接效率低下和假阳性率高等问题。
然而,使用LIC法构建表达载体时也需要注意一些问题,如酶切位点的选择、转化条件的选择等,以确保克隆的效率和准确性。
克隆载体与表达载体
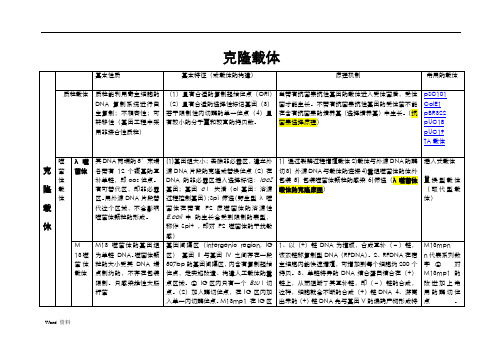
噬菌 粒载 体
M13-DNA 那样体外包 装,并高效转染受体细 胞 装载量比常规的 M13mp 系列要大很多
点、抗生素抗性选择标记和丝状体噬菌 体 DNA 间隔区(含有噬菌体 DNA 复制 起始、终止以及噬菌体颗粒形态发生所 必需的全部顺式作用元件)
个 ampr 基因作为选择记号,便于转化子的选择; 3. 拷贝数含量高 4. 存在着一个多克隆位点区,因 此多种不同类型的外源 DNA 片段,不经修饰便可 直接插入到载体分子上;5.多克隆位点区阻断了大
噬 黏粒 装,并高效转染受体细 位点,因而能象质粒一样转化和增殖。 DNA 可大于 40kb。重组的柯斯质粒可象噬菌体λ
菌 载体 胞;能像质粒那样在受 克隆的最大 DNA 片段可达 45kb 。 一样感染大肠杆菌,并在细菌细胞中复制。
体-
体细胞中自主复制具有 有的粘粒载体含有两个 cos 位点,在
质
M13 噬菌 体的 基 因组 为单链 DNA。噬菌体颗 粒的大小受其 DNA 端 点制约的,不存在包装 限制。只感染雄性大肠 杆菌
(1)基因组大小;去除非必需区,建立外 源 DNA 片段的克隆或替换位点(2)在 DNA 的非必需区插入选择标记:lacZ 基因;基因 cⅠ 失活(cI 基因:溶源 过程控制基因);Spi 筛选(野生型 λ 噬 菌 体 在 带 有 P2 原 噬 菌 体 的 溶 源 性 E.coli 中 的生长会受到限制的表型, 称作 Spi+ ,即对 P2 噬菌体的干扰敏 感) 基因间隔区(intergenic region, IG 区) 基因 II 与基因 IV 之间存在一段 507bp 的基因间隔区,内含有复制起始 位点,是实施改造、构建人工载体的重 点区域。② IG 区内只有一个 Bsu I 切 点。(2)加入酶切位点,在 IG 区内加 入单一内切酶位点。M13mp1 在 IG 区
克隆载体表达载体(课件)PPT课件

组成型表达载体是将基因整合到宿主细胞的染色体上,使基因在任何生长条件下都能稳定表达。这种 表达载体适用于需要持续稳定表达的基因。
组织特异性表达载体
总结词
在特定的组织或器官中,表达载体才能 启动基因的表达。
VS
详细描述
组织特异性表达载体是将基因与特定的组 织或器官相关的调控序列结合,使基因只 在特定的组织或器官中表达。这种表达载 体适用于需要组织特异性表达的基因。
05
克隆载体和表达载体的未来发展
克隆载体和表达载体的新技术和新方法
基因编辑技术
利用CRISPR-Cas9等基因编辑技术,实现对克隆载体和表达载体的精确修饰,提高基 因治疗的效率和安全性。
人工染色体技术
开发人工染色体技术,实现对大型基因组的克隆和表达,为遗传病研究和治疗提供新的 工具。
克隆载体和表达载体的新应用和新领域
04
克隆载体和表达载体的应用
克隆载体在基因工程中的应用
基因克隆
克隆载体可以将目的基因插入到质粒 或病毒载体中,实现基因的复制和扩 增,为基因工程提供大量目的基因。
基因保存
基因突变
通过将目的基因插入到克隆载体中, 进行定点突变或随机突变,研究基因 功能和蛋白质活性。
克隆载体可以保存和传递目的基因, 为基因工程提供长期稳定的基因来源。
01
02
03
基因治疗
利用克隆载体和表达载体, 开发新型基因治疗策略, 针对遗传性疾病、肿瘤等 进行有效治疗。
生物制药
通过克隆载体和表达载体, 实现高效、大规模的蛋白 质药物生产,推动生物制 药产业的发展。
农业育种
利用克隆载体和表达载体, 培育抗逆、抗病、高产的 农作物新品种,提高农业 生产效益。
表达载体的构建方法及步骤

表达载体的构建方法及步骤一、载体的选择及如何阅读质粒图谱目前,载体主要有病毒和非病毒两大类,其中质粒 DNA 是一种新的非病毒转基因载体。
一个合格质粒的组成要素:(1)复制起始位点 Ori 即控制复制起始的位点。
原核生物 DNA 分子中只有一个复制起始点。
而真核生物 DNA 分子有多个复制起始位点。
(2)抗生素抗性基因可以便于加以检测,如 Amp+ ,Kan+(3)多克隆位点 MCS 克隆携带外源基因片段(4) P/E 启动子/增强子(5)Terms 终止信号(6)加 poly(A)信号可以起到稳定 mRNA 作用选择载体主要依据构建的目的,同时要考虑载体中应有合适的限制酶切位点。
如果构建的目的是要表达一个特定的基因,则要选择合适的表达载体。
载体选择主要考虑下述3点:【1】构建 DNA 重组体的目的,克隆扩增/基因表达,选择合适的克隆载体/表达载体。
【2】.载体的类型:(1)克隆载体的克隆能力-据克隆片段大小(大选大,小选小)。
如<10kb 选质粒。
(2)表达载体据受体细胞类型-原核/真核/穿梭,哺乳类细胞表达载体。
(3)对原核表达载体应该注意:选择合适的启动子及相应的受体菌,用于表达真核蛋白质时注意克服4个困难和阅读框错位;表达天然蛋白质或融合蛋白作为相应载体的参考。
【3】载体 MCS 中的酶切位点数与组成方向因载体不同而异,适应目的基因与载体易于链接,不能产生阅读框架错位。
综上所述,选用质粒(最常用)做载体的5点要求:(1)选分子量小的质粒,即小载体(1-)→不易损坏,在细菌里面拷贝数也多(也有大载体);(2)一般使用松弛型质粒在细菌里扩增不受约束,一般 10个以上的拷贝,而严谨型质粒<10个。
(3)必需具备一个以上的酶切位点,有选择的余地;(4)必需有易检测的标记,多是抗生素的抗性基因,不特指多位 Ampr(试一试)。
(5)满足自己的实验需求,是否需要包装病毒,是否需要加入荧光标记,是否需要加入标签蛋白,是否需要真核抗性(如Puro、G418)等等。
构建基因表达载体的步骤

构建基因表达载体的步骤基因表达载体是用来将外源基因转录和翻译为蛋白质的重要工具。
构建一个高效的基因表达载体是基因工程的重要一步。
下面将介绍构建基因表达载体的步骤。
第一步:选择合适的表达载体在构建基因表达载体之前,需要选择适合自己研究对象的表达载体。
一般来说,常用的表达载体有质粒、病毒载体和细胞质表达系统等。
对于不同的表达载体,其表达效率和表达特点也有所不同,需要根据自己的实验需要进行选择。
第二步:选择合适的启动子和信号序列在表达载体中,启动子和信号序列是控制基因表达的关键元素。
启动子是转录起始位点上游的DNA序列,可以控制基因的转录水平;信号序列则可以控制基因的翻译和定位。
因此,在构建基因表达载体之前,需要选择适合自己实验需要的启动子和信号序列。
第三步:克隆外源基因在构建基因表达载体时,需要将外源基因克隆到载体中。
一般来说,可以使用PCR扩增方法或限制性内切酶切割方法将外源基因克隆到载体中。
此外,还需要选择合适的克隆位点,以便快速筛选出正确的克隆子。
第四步:构建表达载体在将外源基因克隆到载体中后,需要构建表达载体。
具体操作包括将启动子和信号序列插入到载体中,以实现对基因表达的控制。
此外,还需要进行质粒线性化和酶切等操作,以实现转染或转化细胞。
第五步:筛选表达载体在构建表达载体后,需要进行筛选,以确定正确的表达载体。
此时可以通过限制性内切酶酶切、PCR扩增和测序等方法进行筛选,以确保表达载体的正确性。
第六步:转染或转化细胞在确定正确的表达载体后,需要将其转染或转化到细胞中。
转染方法包括热激转染、电穿孔转染和基因炮转染等;转化方法则包括化学转化和电转化等。
根据自己的实验需要选择合适的转染或转化方法。
第七步:检测基因表达在转染或转化细胞后,需要检测外源基因的表达情况。
检测方法包括Western blotting、RT-PCR和荧光显微镜等。
根据自己的实验需要选择合适的检测方法。
总结构建基因表达载体是基因工程研究的重要一步。
克隆载体表达载体构建详细版

一、稀释引物1、4℃,15min、13000转离心(先等离心机降温)2、根据OD值加DD水。
3、静置30min(冰上)4、准备1.5毫升EP管,并加90ulDD水。
5、向EP管中加10ul引物,震荡离心,-20℃保存。
二、跑MIX检测引物(20ul体系)、上引物0.8ul下引物0.8ulMix 10ulDNA(日本晴)1ulDD水7.4ul三跑高保真酶(50ul体系)DNAorCDNA 2ul上引物2ul下引物2ul5*buffer 10uldNTPs 5ulDD水28ulPfu(最后加)1ul四胶回收流程1、在紫外线下切胶,用牙签装入2ml的EP管中。
2、按量加XP2,放在55℃水浴锅中10min,每2min摇匀1次,涡旋,短离。
3、将液体冷却到室温,转移到平衡住中,离心10000转,1min30s,倒掉滤液。
4、加入xp2 300ul,离心10000r,1min30s,倒掉滤液。
5、加入spw700ul,离心10000r,1min,倒掉滤液(重复一次)6、空转2min,13000r,之后换1.5mlEP管。
7、套上保鲜膜放入37℃烘箱中,30min。
8、加入DD水10ul,静置2min,离心2min,13000r,重复3次,-20℃保存。
五、胶回收产物检测(10ul)体系上引物0.4ul下引物0.4ulMix 5ul回收产物1ulDD水 3.2ul六、构建blunt cloning 载体(克隆载体)(4ul 体系)胶回收产物 3.5ulBlunt cloning 0.5ul混匀后,PCR:25℃15min 盖子温度50℃之后转化1、提前5min从-70℃冰箱中拿出大肠杆菌感受态,冰上解冻5min。
2、将样品(4ul)加入感受态的大肠杆菌中,冰上30min,大约剩5min左右,打开水浴锅预热到42℃,并拿出SDC 培养基解冻(室温解冻)。
3、水浴锅42℃,60-90s迅速转移到冰浴2min,该过程中不要摇动离心管。
基因克隆 载体构建和转化

拟南芥转化,筛选
侵染: 收种子:2-3次 筛选:收完及时筛选
双酶切
酶切buffer: 平衡两种酶 酶切温度: 酶切时间: 酶切效率 酶切体系: 1ul酶/20ul体系
酶切后电泳,回收
电泳:更换新的电泳缓冲液 胶: 浓度低的胶,厚,上样量尽量多 切胶:选准片段, 快,减少紫外注射的时间 切胶:尽量去除多余的无样的胶
回收:
胶要充分溶解, 注意:EB污染手,枪等 用20-25ul 两次冲洗,共得到20ul左右 电泳:3-5ul上样,加相同量的Maker,确
测序
选出能通过质粒PCR扩增出的菌液(4度保 存,当天送样测序),
用封口膜封好, 填好测序单, 送样测序, 保存好存根.
DNA限制性内切酶消化 酶切
如何做酶切反应?
正确使用和保存酶: 酶需要保存在-20度的低温环境中,只是在需 要用酶才从冰箱中取出来,取酶时放于冰上。 手拿酶管时不要接触酶管下部含酶的部分, 用完后需要及时送回原处。 加酶后用枪头充分混匀(内含甘油) 注意:酶通常是最后加。
连接:按照试剂盒说明操作 连接buffer要分装 连接buffer要完全融化再用 可在4度冰箱接着连接1-3天
转化大肠杆菌感受态细胞:
1) 感受态细胞要在冰上融化,上下颠倒混匀 2) 加样在超净台上进行,加样混匀要上下颠倒,不能
用枪头混. 3) 42度 热击 温度时间要严格,用温度计标温度. 4) 含Amp 的LB平板上加X-gal, IPTG时,将
PCR鉴定
注意:菌种的标记(标签纸)
测序载体:pMD-at1392 pMD-RGT
表达载体:pBI121-RGT-E(E.coli)
转化农杆菌:pBI121-RGT-A( Agro bacterium tumefaciems )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、稀释引物
1、4℃,15min、13000转离心(先等离心机降温)
2、根据OD值加DD水。
3、静置30min(冰上)
4、准备1.5毫升EP管,并加90ulDD水。
5、向EP管中加10ul引物,震荡离心,-20℃保存。
二、跑MIX检测引物(20ul体系)、
上引物0.8ul
下引物0.8ul
Mix 10ul
DNA(日本晴)1ul
DD水7.4ul
三跑高保真酶(50ul体系)
DNAorCDNA 2ul
上引物2ul
下引物2ul
5*buffer 10ul
dNTPs 5ul
DD水28ul
Pfu(最后加)1ul
四胶回收流程
1、在紫外线下切胶,用牙签装入2ml的EP管中。
2、按量加XP2,放在55℃水浴锅中10min,每2min摇匀1次,涡旋,短离。
3、将液体冷却到室温,转移到平衡住中,离心10000转,1min30s,倒掉滤液。
4、加入xp2 300ul,离心10000r,1min30s,倒掉滤液。
5、加入spw700ul,离心10000r,1min,倒掉滤液(重复一次)
6、空转2min,13000r,之后换1.5mlEP管。
7、套上保鲜膜放入37℃烘箱中,30min。
8、加入DD水10ul,静置2min,离心2min,13000r,重复3次,-20℃保存。
五、胶回收产物检测(10ul)体系
上引物0.4ul
下引物0.4ul
Mix 5ul
回收产物1ul
DD水 3.2ul
六、构建blunt cloning 载体(克隆载体)(4ul 体系)
胶回收产物 3.5ul
Blunt cloning 0.5ul
混匀后,PCR:25℃15min 盖子温度50℃
之后转化
1、提前5min从-70℃冰箱中拿出大肠杆菌感受态,冰上解冻5min。
2、将样品(4ul)加入感受态的大肠杆菌中,冰上30min,大约剩5min左右,打开水浴锅预热到42℃,并拿出SDC 培养基解冻(室温解冻)。
3、水浴锅42℃,60-90s迅速转移到冰浴2min,该过程中不要摇动离心管。
4、加入900ulSOC培养基,混匀。
5、37℃,160r摇床1h,使细菌复苏。
6、取出后离心3000r,2min。
7、吸出上清,留下100-150ul左右冻在LB 100ml+kana或者A 固体培养基上。
8、涂板,37℃过夜培养。
9、挑单菌落(一般不超过7个)加入到10ul的DD水中。
菌液PCR体系(10ul体系)
上游引物0.4ul
下游引物0.4ul
Mix 5ul
菌液1ul
DD水 3.2ul
之后跑电泳,若有目的条带则继续。
七摇菌
菌液+LB液体(加抗生素)-------L管(过夜摇菌)
第二天500ul菌液+500ul甘油混匀保存2管,其中一管送检,另一管-70℃保存。
若检测结果正确
八、提取质粒
1、在1.5ul的EP管中收集菌液,10000转,1min,弃上清,重复一次。
2、加205ul solution I(提前预热),用枪头打匀,室温静置2min。
3、加250ul solution II(提前预热),混匀,室温静置2min。
4、加350ul solutionIII,混匀,室温静置2min(有白色丝状物产生)
5、13000转,10min,取700ul上清液于吸附柱中,10000转,1min。
6、加500ul HBbuffer,12000转,1min,倒掉废液。
7、加700ul DNA wash buffer,13000转,1min,倒掉废液,重复一次。
再空离心2min 13000转。
8、37℃烘箱中干燥5分钟,加50ulDD水溶解,静置2min,离心13000转,2min。
九做酶切(50ul)
DD水19ul
K-B 5ul
质粒20ul
bamI 3ul
HIndIII 3ul
之后37℃烘箱,不超过16h
十、加5ul lodding buffer
若有条带胶回收。
十一胶回收(步骤同四)
十二做连接,连接表达载体
目的基因(胶回收的)4ul
载体(1300)1ul
DD水2ul
Buffer 2ul
T4连接酶1ul
过夜16℃,水浴连接。
十三、连接后转化,同“六”
十四、挑条单菌落
跑菌落PCR,若有条带,将剩下的9ul +LB液体+K 加入L管过夜培养。
十五、取L管500ul与500ul 甘油加入EP管中,并与-70℃保存
将L管剩下的菌液取1ul跑菌落PCR(10ul体系)
跑电泳检测结果。
十六提质粒
十七酶切检测
DD水7ul
K-B 1ul
质粒1ul
BamI 0.5ul
HinIII 0.5ul
37℃2.5h后可以检测。
