第三章_金属有机反应
高等有机化学——第三章有机反应活性中间体

乃春) 五. 氮烯 (乃春)(Nitrenes)
1. 氮烯的类型 2.氮烯的结构 氮烯的结构 单重态氮烯 三重态氮烯 3. 氮烯的反应 加成反应 插入反应
六. 苯炔 (Benzyne)
1. 苯炔的结构 2. 苯炔的产生 3. 苯炔的反应 亲核加成 亲电加成 环加成
一. 正碳离子 (Carbocations)
• 关于三苯甲基游离基 的二聚体结构不是象 冈伯格所提出的六苯 乙烷结构, 乙烷结构 , 经核磁共 振谱研究表明为醌式 结构: 结构:
Ph3C C H
Ph
Ph
离子游离基
O Na C O Na
当金属钠和二苯甲酮在二甲氧基乙烷中反应时,得到 当金属钠和二苯甲酮在二甲氧基乙烷中反应时, 兰色物质, 兰色物质,为二苯甲酮负离子游离基的钠盐
直接与杂原子相连的正碳离子结构: 直接与杂原子相连的正碳离子结构:
氧上未共有电子对所 占 p 轨道 与中心碳原子上的空的 p轨道 轨道 侧面交盖,未共有电子对离域, 侧面交盖,未共有电子对离域, 正电荷分散。 正电荷分散。
CH3O
CH2
类似地,羰基正离子: 类似地,羰基正离子:
R C O
R C
O
乙烯型正碳离子: 乙烯型正碳离子:
CH3 H3C C OH CH3
HSO3F - SbF5 - SO2 -60℃ ℃
CH3 H3C C + H +O + SO F3 3 CH3 + SbF + SO
5 2
很多正碳离子的结构与稳定性的研究都是在超酸 介质中进行的。 介质中进行的。
非经典正碳离子
1) π键参与的非经典正碳离子 键参与的非经典正碳离子 实验表明: 实验表明: 反-7-原冰片烯基对甲苯磺酸酯 - 在乙酸中的溶剂解的速度 大 1011倍 +
有机合成化学:第三章 还原反应

碳碳不饱和键: C4H9-CH=CH2
C4H9-CH2CH3
第三章 还原反应
炔烃: 2.锌与锌汞齐 ①锌的还原能力随介质的变化而变化,在弱酸性条件下:
②锌汞齐:锌汞齐(锌和汞的混合物)在酸性条件下的还原为 clemmesen还原:
第三章 还原反应
③在碱性介质中:
NaOH, Zn
Ph2CO
Ph2CHOH
CH3CHCH3 OH
HgCl2和Mg在苯中回流形成镁汞齐,它可还原酮得醇或片呐醇:
第三章 还原反应
5.铁: 铁是还原-NO2化合物的常用还原剂:
6.锡:锡及SnO2是还原-NO2化合物的常用还原剂,还原能 力比Fe强。
第三章 还原反应
二. 金属氢化物
1. LiAlH4:
LiAlH4的还原能力强,需要无质子溶剂,多为四氢呋喃,需要充分 干燥;反应物较大量时注意安全。
1.含硫还原剂: 1)硫化物还原剂:
第三章 还原反应
2)含氧硫化物:Na2SO3和NaHSO3:
PhN2Cl Na2SO3-H2O PhNHNH2
Na2S2O4+NaOH是较强还原剂,反应条件温和、快、收率高。
第三章 还原反应
2. 肼:
另一种合成方法?
C O NH2NH2
OHC N NH2
CH2
PhCH2CONH2
PhCH2CH2NH2 PhCH2CN
PhCH2CH2NH2
第三章 还原反应
⑷ NaBH4-H2SO4体系:此体系是还原氨基酸常用的方法:
3. 硼烷(BH3、B2H6) 一般为四氢呋喃溶液或二甲硫醚溶液。
第三章 还原反应
液体样品取样图 橡胶塞
第三章 还原反应
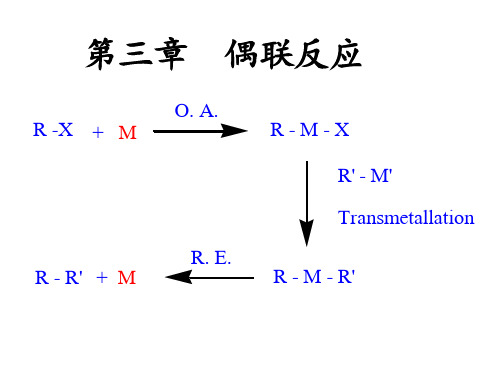
金属有机化合物

第三章金属有机化合物在有机合成中的应用第一部分金属有机化合物概述一、什么是金属有机化合物?金属有机化合物,简单的说,就是碳原子和金属原子直接相连的化合物。
最经典的金属有机化合物包括格氏试剂、丁基锂等;后来研究范围扩展到过渡金属有机物。
金属与碳直接键合的“有机的”化合物才是金属有机化合物含B—C,Si—C,P—C等键的有机化合物,在制法、性质、结构等方面与金属有机化合物很相似,可称它们为元素有机化合物或类金属有机化合物并把它们放在金属有机化学中讨论。
广义金属有机化合物,将硫、硒、碲、磷、砷、硅、硼等带有金属性质的非金属都算成金属,实际上已经超越了经典金属有机化合物的范畴。
但是由于元素有机化学和金属有机化学有着千丝万缕的联系,将其混在一起也不致引起太大的混乱。
二、金属有机化合物的分类总体上可分为二大类:即非过渡金属有机化合物和过渡金属有机配合物。
(1) 非过渡金属有机化合物:包括主族金属有机化合物和类金属(元素)有机化合物。
主族金属的d层轨道中已填满了电子,用s、p轨道中的电子与有机基团成键。
(2) 过渡金属有机配合物:主要是指由过渡金属与有机基团所形成的化合物。
过渡金属除s、p轨道外,d轨道的电子也参加成键。
配位不饱和的过渡金属有机配合物存在空轨道,为它们作为催化剂和有机合成试剂提供了条件。
非过渡金属有机化合物通常包括三类:第一类:主族金属有机化合物第一族的锂、钠、钾第二族的铍、镁、钙第十三族的铝、镓、铟、铊第十四族的锡、铅第十五族的铋第二类:第十一、十二族金属有机合物第十一族的铜、银、金第十二族的锌、镉、汞CuLiRCu R2第三类:元素有机化合物第十三族的硼第十四族的硅第十五族的磷、砷第十六族的硫、硒、碲等所形成的有机化合物用于形成非过渡金属有机化合物的金属包括:过渡金属有机配合物主要是指由第三~第十族的过渡金属形成的有机物几种有代表性的过渡金属配合物三、金属有机化合物的发展历程下面按时间顺序来说明金属有机化合物产生和发展及其规律以及在实践中的应用,并探讨学科的研究方法。
金属参与的现代有机合成反应(麻生明)课件class no. 3
Br
R
Ph Pd(PPh 3)4
R (17)
H
COOR Kto3luPeOn4e-3, H1020OoC
H COOR
Ph
O CONMe 2 CH 2N2/Pd(OAc) 2
Ph
B
O CONMe 2
Et2O
O CONMe 2 B
O CONMe 2
H2O
Ph
Pd(PPh 3)4
Ph
B(OH) 2
Kto3luPeOn4e-3, H1020OoC
8
Ph
9%
Bu
Ph 9
RPdXLn + NaOMe RH + PdL4
RPdOMeLn - CH2O
RPdHLn
Hex
Cl
+
BX2
Cl
Cl PdY (PPh3)2
Hex Cl
Cl
Cl
(9)
10
11
12
Y = OAc, OMe
Yes
Cl
No
RX Pd (0)
R'' R
16
RP dXL2 13
R'' 15 PdRL2
[ Pd ] LiCl
(36)
1. LDA 2. Tf2NPh
OT f
Me3Sn SiMe 3
SiMe 3
O
91 %
95:5
PdL4, LiCl 100 %
95:5 29
1. i-Pr2NMgBr 2. Tf2NPh
OT f
Me3Sn
SiMe 3
SiMe 3
63 %
97:3
PdL4, LiCl
有机反应-成环反应

内型为主
+
H rt
H
条件与结果:
a.反应需要加热
b.顺式加成 c.桥环化合物以内型为主 d.优先形成“邻、对为产物”
区域选择性
具有取代基的反应物,在二烯加成中有两种可能的 定向。 1-取代的二烯与1-取代的亲二烯体可以生成邻和间 位加合物,同样的1-取代亲二烯体与2-取代的二烯 能够产生间和对位加合物。
中的取代基与最短的二环桥(在这里是亚甲基)
处于分子的相反两侧时,这类化合物称为具有 内向构型(endo configuration)。如果最短的桥和 取代基在分子的同侧,称为外向构型 (exocofiguration)。虽然外向构型通常是更稳 定的异构体,但D-A反应的加合物一般是内向构 型。例如:
4.六元环衍生物 环己烯(烯键的共轭位没有羰基):常用Diels-Alder 反应
ab-不饱和的环己烯酮:常用Robinson环化反应
(1)D-A反应([4+2]环加成反应 双烯体:含有供电子基有利 亲双烯体:含有吸电子基有利 反之也可
反电子需求的D-A反应
维生素D3 A环的不对称合成
常见的具有代表性二烯化合物有:链状二烯及其衍生物,如丁二烯 及其衍生物;环内二烯和某些环外二烯及其衍生物,如环戊二烯和 1-乙烯基环已烯等;稠环芳烃,如蒽等。
亲二烯体的活性 亲二烯体的活性依赖于反应的电子要求。在亲二 烯体中,有吸电基时,使反应加速进行。例如,四氰基乙烯作为 亲二烯体比环戊二烯要快4.6×108倍。亲二烯体中最活泼的是:苯
N2 O
O
二碘甲烷/锌铜齐
O
+
CH2I2
Zn/Cu
O
2.四元环衍生物
前面学过用丙二酸 与1,3-二溴丙烷制备环丁烷衍生物。
第三章 形成碳碳单键的反应 第三节 麦克尔加成反应 第四节 有机金属化合物的反应

O
O
H+
Br
O
KOH C2H5OH
O
H+
O
4 由α- 卤代烯制备
hv Br2
Br
NaOH
OH
CrO3 吡啶
O
5 通过烯烃和酰卤的反应制备
O + RCCl
AlCl3
Cl CR O
Na2CO3, H2O
O CR
6 通过魏悌息反应来制备
O R-CHO + Ph 3P-CHCPh O R-CH=CH-CPh
CH3K 甲基钾 (CH3)2Hg 二甲基汞 (CH3CH2)3Al 三乙基铝 n-C4H9Li 正丁基锂
2、以硅烷或锡烷等衍生物命名。
(CH3)4Si (CH3CH2)2SnCH3 四甲基硅烷 三乙基甲基锡烷
3、当金属原子除了与有机基团相连外,还连有 无机原子,可将其看作是带有有机基团的无机 盐加以命名.
CMgBr + HCON
CH3 CH3
CH3(CH2)3C
C CHO
51%
反应的可能机理是:
H RMgX + C O H R C OMgBr 2H NR 2' H R C O NH R'2 H R H C O NR'2
RMgX + R'CON
R'' R''
OMgX R C R' N
R'' R''
H
RCOR' + MgX + R''2NH
+
②与酮反应: R'COR'' ③与酰卤反应:
[理学]第三章-金属有机化学-part2
![[理学]第三章-金属有机化学-part2](https://img.taocdn.com/s3/m/7ad8a60054270722192e453610661ed9ad5155a5.png)
2. 分子氮配合物中的化学键
N2与CO是等电子体,分子氮与过渡金属离子(原子) 生成配合物时的成键情况也与一氧化碳相似。
氮原子上的孤对电子进入过渡金属离子(原子)的空 轨道,形成σ配键,同时过渡金属离子(原子)的d电子进 入N2分子的反键π*空轨道,形成反馈π键,构成σ-π双键结 构。
N2比CO不易给出电子(N2的2σg比CO的5σ负),N2的 Lewis碱性较CO弱;同时N2的2πg比CO的2π正,不易接 受电子,因此,N2的π酸性较CO弱,一般认为N2是中等强 度的π-接受体和弱的σ给予体。 【 问 题 】N2 是 π- 配 体 , 在 形 成 分 子 氮 配 合 物 对 金 属 离 子 (原子)有何要求? 【问题】N2与CO配位性谁更强?哪一种更稳定?
N
NO
NO+与CO是等电子体, 键级为3。 NO的键长为115.1 pm, NO+的键长 106.2 pm。
NO 作 配 体 时 是 三 电 子 给 予 体 。 当它跟金属配位时,处于反键*轨道 上的电子先转移到金属原子上.
M+NO → NO++M-
NO+与金属M-的配位方式同CO一 样,即NO+(亚硝酰阳离子)向金属M-提 供一对电子形成配键, 而M-提供d电子 到NO+的反键* 轨道形成反馈配键, 亦即形成-反馈键。
从Raman光谱来看,端配N2配合物伸缩频率为1930 2230cm-1 ,说明NN键被削弱。
如图所示为端配和侧配的N2配合物:
N
110.1
178o N
178.4 P
Cl 218.5Co
216.7 220.2
160 P
H
(a)
Li
Li
Li
Ni
N
Li Li
第三章 有机金属化合物的反应

*** 1. 有机锂试剂与格氏试剂的差异:
⑵ 与α,β-不饱和羰基化合物加成
与α,β-不饱和羰基化合物加成时,格氏试
剂优先发生1,4-加成反应,而有机锂试剂则优先
进行1,2-加成反应。
O C6H5CH=CHCC6H5
C6H5MgX
OH
(C6H5)2CHCH=CC6H5
(C6H5)2CHCH2COC6H5
RMgX
该反应是法国有机化学家Grignard(格利雅)于1901年在
他的博士论文研究中首次发现的。为纪念这位化学家对化学
事业的贡献,人们将烷基卤化镁称为Grignard试剂。
(2) 机理 : R-X Mg R• + X • (在金属表面产生)
X • + Mg
X Mg • RX R Mg X + X •
RCH2CH2OH
合成增加两个碳的伯醇
11
格氏反应 (2)与醛(除甲醛外)、取代环氧乙烷反应制备仲醇
1) R' MgX RCHO 2) H3+O
OH R-CH-R'
OH
O
1) RMgX
CH3 2) H3 +O
R-CH2-CH-CH3
注:格氏试剂一般是进攻空间位阻小的碳原子。
12
格氏反应
(3)与酮、羧酸衍生物反应制备叔醇
(CH3)2CHCH2CH2Li
3. 有机锂化合物与同某些电正性较低的金属 卤化物反应,制备该金属的有机化台物。
4RLi + SnCl4
R4Sn + 4LiCl
2RLi + HgC]2
R2Hg + 2LiCl
2RLi + CuI 乙醚/THF R2CuLi + LiI
第三章 过渡金属有机化合物

0价金属的d 电 子数
3 2 1 0
4 3 2 1 0
5 4 3 2 1
6 5 4 3 2
7 6 5 4 3
8 7 6 5 4
9 8 7 6 5
⑩ 9 8 7 6 ⑩ 9 ⑩
Ⅰ价 Ⅱ价 Ⅲ价 Ⅳ价
金属有机化学
EAN规则应用
Fe (3d ) Fe(CO)5 5个CO配体 10个电子 18个电子
0 8
L 与金属配位的中性分子 CO、Ph3P
金属有机化学
具有过渡金属—碳σ键的配 合物的合成
♚ 烷基过渡金属配合物
1.用另一种烷基金属使过渡金属烷基化 2.阴离子型过渡金属配合物和卤代烷等反应 3.由氧化加成反应合成烷基过渡金属配合物 4.由插入反应合成烷基过渡金属配合物
5.由消除反应生成烷基配合物
金属有机化学
不服从EAN规则的配合物
不服从EAN规则的一类重要化合物是四方平面d8配合物。
金属有机化学
过渡元素金属有机化合物
过渡元素金属有机配合物分子中至少有一个化 学键是金属原子和碳原子之间形成的。
其通式为: LaMRb
M 过渡金属原子 Ti、Fe等
R 自由基形式独立存在的中性物种 甲基、苯基
fac-CrPh3(thf)3
Ph2Fe(PEt3)2
金属有机化学
问题-思考-创新
• 网查18电子规则原理与应用
金属有机化学
H Zr Cl
一氯
氢根
二茂
合锆 二羰基
三苯基
Mn CO CO PPh3
膦茂合
锰
金属有机化学
过渡金属有机化学研究论文 和专利发表情况
6 5 5 5 5 5 5 107
第三章 金属有机化物作中间体的反应

例3.
CH3CH=CH CO 2CHCH 2CH3 CH3
+
CH3
n C4H9MgBr
CH3CHCHCO 2CHCH 2CH3
例4.
O
C4H9 n
C6H5CH=CHCO 2C2H5
1 . (CH3)3CMgBr 2 . H 3O 100%
C6H5CH=CHC C(CH 3)3
Organic Synthesis
3.2.2. 有机锂化合物
1.制备
RX 10 C 1 . R 脂肪族 , 则X为Cl(不用 Br , I ),因 : RBr
+ 2Li
N2
0
RLi
+ LiX
+ RLi
R R
+ LiBr
2 . 低温 RX
+
R1Li , Ar
R ynthesis
例 n BuLi
3.1.2 金属试剂的制备通法
1) 卤代烃与金属反应
R-Br + 2Li
R-Li + LiBr
2)有机金属化合物与卤代烃的交换
R-X + R'-M Ph-Br + Bu-Li R-M + R'- X PhLi + BuBr
Organic Synthesis
3)有机金属化合物与金属盐的交换
2R-Li + CdCl2 R2Cd + 2LiCl
+
O DME CH 2=CHLi CH 3CH 2C CH=CH 2 92%
Organic Synthesis
(4) 偶合反应(产率很高)
RLi
+
R1X
第三章 有机反应的选择性与控制

+
H OH endo(10%)
定义:一个反应中可能生成两种空间结构不同的立体异构体, 生成的两种异构体的量不同,称反应具有立体选择性包括顺 反异构,对映异构,非对映异构选择性。这种反应常与作用 物的位阻、过渡状态的立体化学要求以及反应条件有关
CH3 H CHO Ph + CH3MgI
CH3 H
OH H +
THP醚脱保护方法:室温下,在酸性条件下
H+/H2O水解 稳定存在范围:中性或碱性条件下稳定,对 格氏试剂,烷基锂、氢化铝锂、烃化剂和酰 化剂等存在时均不受影响 应用范围:广泛用于炔醇类、甾体类,核苷 酸以及糖、甘油酯、环多醇和肽类;缺点: 不能在酸性介质中反应,并且将在体系中引 入一个新的手性中心
合成路线:
OH + HO C(CH3)3 H2SO4 OH Cl2, Fe Cl OH Cl
C(CH3)3 , AlCl3 OH Cl Cl + C(CH3)3
C(CH3)3
D
selectivity
O CO2Et [H] OH CO2Et NaBH4
O CO2Et
H
+
? [H]
O CH2OH
H 3O +
OH
OMEM O
2-甲氧基乙氧甲基醚的去保护方法:溴化锌/二氯甲 烷;四氯化钛/二氯甲烷。MEM醚的生成和裂解都 是在非质子性溶剂中进行的 在AcOH-H2O;TsOH/MeOH酸性条件下,不发生 裂解
OMe
OMe
催化氢解
与烯丙基或苄基相连的C-O键,C-N键易发生氢解 反应,苄酯、苄醚、苄胺的苄基可以氢解除去。而苄 基可用于羧基、醇及胺的保护基团,钯-碳是氢解 苄-氧键或苄-氮键的有效催化剂
《金属有机化学教案》课件

《金属有机化学教案》课件第一章:金属有机化学概述1.1 金属有机化学的定义1.2 金属有机化学的发展简史1.3 金属有机化学的研究方法1.4 金属有机化学的应用领域第二章:金属有机化合物的结构与性质2.1 金属有机化合物的结构特点2.2 金属有机化合物的键合理论2.3 金属有机化合物的物理性质2.4 金属有机化合物的化学性质第三章:金属有机化合物的制备方法3.1 金属有机化合物的合成策略3.2 金属有机化合物的制备方法概述3.3 常见金属有机化合物的制备实例3.4 金属有机化合物的结构表征方法第四章:金属有机化学在材料科学中的应用4.1 金属有机化学在材料合成中的应用4.2 金属有机化学在材料加工中的应用4.3 金属有机化学在功能材料研究中的应用4.4 金属有机化学在新型材料探索中的应用第五章:金属有机化学在有机合成中的应用5.1 金属有机化学在有机合成中的催化作用5.2 金属有机化学在有机合成中的模板作用5.3 金属有机化学在有机合成中的活化作用5.4 金属有机化学在有机合成中的区域选择性控制第六章:金属有机化学在药物化学中的应用6.1 金属有机化学在药物合成中的作用6.2 金属有机化学在药物设计中的应用6.3 金属有机化学在生物活性分子研究中的应用6.4 金属有机化学在药物化学领域的挑战与展望第七章:金属有机化学在有机催化中的应用7.1 金属有机催化原理7.2 金属有机催化剂的设计与合成7.3 金属有机催化在有机合成中的应用实例7.4 金属有机催化的未来发展第八章:金属有机化学在超分子化学中的应用8.1 金属有机超分子的定义与特点8.2 金属有机超分子的设计与合成8.3 金属有机超分子在材料科学中的应用8.4 金属有机超分子研究的挑战与展望第九章:金属有机化学在环境化学中的应用9.1 金属有机化合物在环境污染治理中的应用9.2 金属有机化学在环境监测中的应用9.3 金属有机化学在环境友好材料制备中的应用9.4 金属有机化学在环境保护领域的挑战与展望第十章:金属有机化学实验操作安全10.1 金属有机化学实验操作中的安全问题10.2 金属有机化学实验中的安全操作规范10.3 实验室事故的预防与处理10.4 金属有机化学实验操作的安全教育与培训重点和难点解析一、金属有机化学的定义与研究方法难点解析:金属有机化合物的结构与性质之间的关系,研究方法的原理与实际应用。
第三章__有机化学反应

诱导效应的影响。
诱导效应不仅可以沿σ键链传递,同
样也可以通过 π键传递,而且由于π键电
子云流动性较大,因此不饱和键能更有效
地传递这种原子之间的相互影响。
②动态诱导效应。 在化学反应中,当进攻试剂接近时, 因外界电场的影响,也会使共价键上电子 云分布发生改变,键的极性发生变化,这 被称为动态诱导效应,也称可极化性,用 Id表示。
• • • •
3.2.1 亲核取代反应机理
此反应是亲核试剂对带有部分正电荷的碳原子进
行攻击,属于亲核取代反应,用 SN 表示。 R-L 是受攻 击对象,称为底物;把进行反应的碳原子称为中心碳
发生动态导效应时,外电场的方向 将决定键内电子云偏离方向。如果Id和Is 的作用方向一致时,将有助于化学反应
的进行。在两者的作用方向不一致时,
Id往往起主导作用。
③诱导效应的相对强度
对于静态诱导效应,其强度取决于原子或
基团的电负性。
( a )同周期的元素中,其电负性和 -Is 随族数的 增大而递增,但+Is则相反。如: -Is:—F>—OH>—NH2>—CH3
亲核取代反应的类型 常见的亲核取代有以下四种类型: 1)中性底物与中性亲核试剂作用; R—L + Nu: → R—Nu+ + L2)中性底物与带负电荷的亲核试剂作用; R—L + Nu:- → R—Nu + L-: 3)带正电底物与中性试剂作用; RL+ + Nu: → RNu+ + L: 4)带正电底物与带负电亲核试剂作用; RL+ + Nu:- → R—Nu + L:
3.2 亲核取代反应 (Nucleophilic Substitution )
第三章 有机化学知识点总结

第三章有机化学知识点总结有机化合物:含有碳元素的化合物。
常有氢和氧,还含有氮、磷、硫、卤素等元素。
【注意】(碳的氧化物、碳酸及其盐、碳的金属化合物是无机化合物)。
烃:只含有碳和氢两种元素的有机物,甲烷是最简单的烃。
)2、物理性质:甲烷是一种没有颜色,没有气味的气体。
密度比空气小,极难溶于水。
(可以用排水法和向下排空气法收集甲烷)3、化学性质:通常情况下,甲烷比较稳定,与酸性高锰酸钾等强氧化剂不反应,与强酸、强碱也不反应。
但在一定条件下,甲烷也会发生某些反应。
1)燃烧反应:CH4+2O2CO2+2H2O 。
(纯净的甲烷在空气中安静地燃烧,火焰呈淡蓝色)2)取代反应:(有机化合物分子里的原子或原子团被其它原子或原子团所代替的反应)甲烷与氯气的反应方程式①。
②。
③。
④。
★(条件:光照)五种产物(两种气体:一氯甲烷和氯化氢,其他三种均为液体)甲烷与氯气取代反应实验现象:气体颜色逐渐变浅,试管壁有油状液滴出现,同时试管上方有白雾生成,试管内液面逐渐降低。
二、烷烃:(烃分子中碳原子之间都以碳碳单键结合成链状,剩余价键均与氢原子结合,使每个碳原子的化合价都达到“饱和”,这样的烃叫做饱和烃,也称为烷烃)。
分子通式为C n H2n+21、烷烃的命名:烷烃碳原子数在十以内时,以甲、乙、丙、丁、戊、己、庚、辛、壬、癸依次代表碳原子数,其后加“烷”字,碳原子数在十以上时,以“汉字数字”代表。
例如:十一烷。
2、烷烃的物理性质:常温下的状态(设碳原子数为n),当n ≤4 时为气态;随着碳原子数的增加,烷烃的熔沸点依次升高,烷烃的密度依次增大。
3. 烷烃的化学性质:1、稳定性:与甲烷类似,通常情况下,不与强酸、强碱、高锰酸钾等强氧化剂反应。
2、可燃性:都能燃烧,反应通式为C n H2n+2+213nO2nCO2+(n+1)H2O。
3、在光照条件下能与氯气发生取代反应。
4、同系物和同分异构体1. 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称同系物。
金属有机第三章配体

Lewis Base Ligands第三章 几种重要的配体Survey of Ligand Typesσ-donors: Typical M-L bonding arrangement. Lone pair orbital of ligand interacts with metal orbitals.Lone pair donors:L H3N: .. .. NH2-CH2-CH2-NH2 (en) M empty :CO :PR3 M .. : R-O ..-.. Cl : ..Lπ-donors:Dialkylamide, alkoxide, and fluoride are strong π-donors.In terms of bonding:L filledL or MM LMO description of Metal-Ligand interactionsAntibondingML ligandNote: • Ligands that donateM L ligandelectron pairs to form M-L σ bond are also called σ donors.MBondingLigands with lone pairs on the coordinating atom (i.e., -OR, -X, -NR2) can act as π-donor ligands. The atom can rehybridize to place the lone pairs in orbitals with π symmetry that can overlap with the metal dπ orbitals.L ligandSome lone pair donor ligands may have orbitals to form M-L π bonds. ===> π donor, π acceptor.e.g. OR.. : R-O .. M + M (a) (a) .. : R-O .. M ORORNote: although ligands such as OR- can form π bond with a metal, we usually don't indicate such interaction in writing the structures.M OR M M OR ORFor a metal with filled dπ orbitals, π-donation will result in a destabilization of these orbitals due to repulsion between the lone pair electrons and the dπ electrons. This results in a smaller Δ and a weaker M-L bond.OR-MOR- or M Mempty filled (b)R-O+MR-OMFor d0 metals, such as W6+, π-donation is a favorable interaction and leads to stronger M-L bonds.Ligands that donate electrons to metal to form π bond are called π donor1M-X bond is stabilized for 16e or less species (early TM)In late, 18 e transition metal complexes, π donation weakens theMM-X bond due to repulsion between filled orbitals.MunfilledXfilledORM-X bond is destabilized for 18e speciesIn early transition metals π-donation is a favorable interaction between the filled ligand orbital and empty dπ orbitals on the metal center. Early transition metals are often referred to as being oxophilic or fluorophilic.MMfilledXfilledOR2Alkoxides:Alkoxides commonly act as bridging ligands for electropositive metals. To avoid formation of bridges, bulky alkoxides must be used. With high valent transition metals, π-donation becomes important. M-O-C angles approaching 120 °or even 180 ° are common.3Science, 2002, 297, 1696-1700.立体电子效应 理论有机化学概念之一。
第三章 有机金属化合物

端基 CO=6, 桥基CO =3, 则: 8+6+3+1=18 (Fe-Fe) =1,
Fe=8,
⑥对于n 型给予体,如 1-C5H5(给予体), 5- · C5H5、 6-C6H6(给予体)等
n —表示固定的意思,其中的n代表给予的电子数。如: Fe(CO)2(5-C5H5)(1-C5H5) 2CO=4, 5-C5H5=5, 1-C5H5=1,Fe=8 电子总数=4+5+1+8=18 Mn(CO)4(3-CH2=CH2-CH3) 4CO=8, (3-CH2=CH2-CH3)=3, Mn=7 电子总数=8+3+7 =18 Cr(6-C6H6)2 2(6-C6H6)=12,Cr=6, 电子总数=12+6=18
面桥基CO: CO(3-CO)=1625 cm-1
C-O键能越大, CO越大
例:测得Fe3(CO)12中νco为2043、2020、1997和1840 cm-1,说明CO与Fe之间的配合形式有 种,分别 是
、
。
C-O间的伸缩振动频率(IR):νco的 大小: (1)与键合形式有关, (2)与羰基化合物中金属离子的氧化态大小有关,氧 化态代数值越小,形成M-C反馈π倾向越大,νco越小。 如: Fe (CO)42-、 Co(CO)4- 、Ni(CO)6、Mn(CO)6+ νco(cm-1)
H[Co(CO)4]+Na+ Co(CO)4- + H+ pKa≈7
(2)与酸作用生成羰基氢化物
(3)与PPh3、 AsPh3 、RP3、NO、Br-的取代反应 Fe2(CO)9+4NO 2Fe(CO)2(NO)2 + 6CO (4)氧化还原反应 Mn2(CO)10 +Br2 2Mn(CO)5Br
三、有效原子序数规则(EAN规则)
A1C13,苯
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、有机锂试剂的制备
1.卤代烷和金属锂反应
卤代烷与金属锂在非极性溶剂(无水乙醚、
石油醚、苯)中作用生成有机锂化合物:
RX + 2Li → RLi + LiX
C4H9X + 2 Li
石油醚
C4H9Li + LiX
卤代烷与锂反应的活性次序为:R1>RBr >RCl>RF。氟代烷的反应活性很小.而 碘代烷又很容易与生成的RLi发生反应生成 高碳的烷烃,所以常用RBr或RCl来制取 RLi。 由于烯丙基氯和苄氯易发生Wurtz类偶联反 应,不易用此法制备相应的烯丙基锂和苄 基氯。
O2N
MgBr
+
O2N
CHO
1.
乙 醚
?
CH3COCH3 Cl2
(CH3)2CHMgBr
?
KOH
?
2. O O NH MgBr
?
?
CH3COCl
CH22H27NO2
O O
NH
O N
MgBr O O N OH N
CH3COCl
3.3
有机锂试剂
有机锂试剂与Grinard试剂有许多相似之处,并比 Grinard试剂活泼,且具备一些特殊的反应性能: 与位阻大的酮反应 与羧酸盐负离子反应生成酮 与α,β-不饱和羰基化合物反应 与酰胺和-C=NR官能团化合物反应 与CO2反应 与烯烃双键反应 偶联反应 与电正性较低的金属卤化物反应
提示:锂的反应活性高于镁,烷基锂的化学活
性也高于烷基卤化镁,在有机合成中有机锂显
得特殊重要。由于有机锂中的碳锂键的离子性
很强,碳负离子非常容易被氧化或与活泼氢结 合,所以在制备有机锂时应在情性气体保护下 进行,所用溶剂如乙醚、苯、环己烷等必须是 特别干燥。
丁基锂的制备: 1/3用量无水乙醚用于配制溴代正丁烷乙醚溶
1. 有机锂化合物的亲核性和碱性比格利 雅试剂强。大体积的烷基锂可与有很大 空间位阻的羰基化合物发生亲核加成反 应,而格利雅试剂则不能。例如:
O Et2O (CH3)3CLi + (CH3)3C-C-C(CH3)3 -60℃
H2O [(CH ) C] C-OH 3 3 3
合 成
OH
O
+
Li
2. 有机锂可以与羧酸和二氧化碳反应制备酮。
C. 与醛酮的亲核加成反应 羰基碳有亲电性
O MgX R
H2C O
H 2O
OMgX R C H2 O R
OH C
C
亲核加成 醇
R CH2 OH
伯醇
R'CH R MgX O R' C R"
H 2O R
提示:合成上用 于制备比卤代烷 多 R`+1 个碳原
O
H 2O
R' R CH OH
仲醇
第三章 有机金属化合物的反应
有 机 化 合 物
含C、H、O、N、Cl、Br、I、S等典型元素 含非典型元素如B、Si、P、Na、K、Li、Mg、Cu、Cd等
本章学习要求
了解有机金属化合物的基本概念; 掌握有机镁、有机锂、有机锌和有 机镉及有机铜化合物的反应原理制 备方法和应用范围。
R' RMgX + R'C N R C NMgX
1 )H
+
2 )H2O
RR'CO
F.和共轭不饱和羰基化合物的加成反应 与αβ-不饱和羰基化合物反应,可发生1,2或1,4加成
R
1,2加成 4 3 2 1
R -CH=C-C-OH
H3+O
-CH=C-C-OMgX
-CH=C-C=O +RMgX
1,4加成
所形成的烃基化合物,通式为RM, R2M,它们具有离子 化合物的典型特征。如:不溶于烃类溶剂,溶液可以导
电,对空气敏感,遇水发生剧烈分解。
极性共价键型(与第II、第III族金属形成的化合 物) R MgX 烷基镁
R2CuLi 二烷基铜锂
烷基镉 R2Cd 共价键化合物:ⅠB、ⅡB、Ⅲ-ⅦA元素电负性 大,它们主要生成σ 键化合物,如: R2Hg,(C2H5)4Pb等。虽然有些化合物的离子特性 仍相当大,但大多数化合物是共价键占优势。
2. 通过金属-卤素交换制备(锂-卤交换)
RLi + R’X → R’Li + RX 例: RX + C4H9Li → C4H10 + RLi
通过金属-卤素交换是制备有机锂试剂的 另一重要方法。该法主要用于1-烯基锂 或芳基锂的制备。此类反应进行的方向是 朝着生成更稳定的有机锂化合物,即金属 连接到电负性更大的碳上。
主要内容 一般原理 有机镁化合物 有机锂化合物 有机锌和有机镉化合物 有机铜化合物
有机金属化合物
金属 R = M (M = 金属, metal) Li 1. 类型 Mg Cd 离子型(与碱金属形成的化合物) Cu 烷基锂 电负性 1.0 1.2 1.7 1.9
R
Li
离子型化合物:碱金属和碱土金属的电负性很小,它们
二、 格氏试剂的制备 Grignard试剂
现制现用
+ Mg R X 活泼烯丙基格氏试剂
CH2=CHCH2Cl
+ Mg
醚 冰浴
醚
RMgX
CH2=CHCH2MgCl
乙醚作溶剂优点:1.格氏试剂在醚中溶解度高; 2.醚易挥发,在格氏试剂上形成保护层,使格 氏试剂不被氧化。
乙烯型卤代烃制备格氏试剂
+
Br N
CH3MgCl CH3CH CHCHO COPh PhMgBr
Grignard 试剂在合成中应用小结
R'X
烃类化合物
偶联反应 醛、酮、酯
Mg R X R MgX
亲核加成 环氧乙烷 亲核取代
CO2
各类醇 (多R+1碳) 各类醇 (多2碳)
无水醚
羧酸 (多1碳)
亲核加成
合成应用
合 成
O2N
OH O2N
R' C OH
子的醇类化合物。
R" 叔醇
HI CH2CHO OH O + C 2H5OC CMgX (1)(C 2H5)2O (2)H H3O Hg
+ +
CH CHOC 2H5 OH
C C OC 2H5 OH O CH2C OC 2H5
O CH2C OC 2H5 OH
- H2O
2+
D. 与酯类加成
Victor Grignard (1871 ~1935)
R
X
+
Mg
醚
RMgX
烷基卤化镁 Grignard试剂 (溶解于醚)
一、格氏试剂的结构
R Mg R' O R' R' O R' X R Mg R'2O X X Mg R OR'2
常用醚:乙醚 四氢呋喃 (THF) O
单体(稀溶液)
二聚体(浓溶液)
R
MgX
+
H H H
pKa
71 62 60
共轭碱
(CH3)3CΘ CH3CH2Θ CH3Θ
化合物
H2NH HCCH CH3CH2OH
pKa
36 26 16
共轭碱
H2NΘ HCCΘ CH3CH2OΘ
HOH
15.7
HOΘ
提示
制备Grignard试剂应在无水(无氧)条件下进行。
底物中不能有活泼氢存在。
Bu-C CH + BuLi + BuLi
Bu-C CLi
+ BuH
Br N
Li N
+ BuBr
3. 通过 Shapiro反应制备
O R R`
ArSO2NHNH2
NNHTs R R`
2 n-BuLi
Li R
R`
该法是制备烯基锂的特殊方法。
4. 丁基锂与烃类反应 (锂-氢交换)
丁基锂和某些烃反应,使锂原子取代烃中的氢原子,生 成新的有机锂化合物,这里反应称为烃的金属化反应,
O
空间位阻小
O
H2C
CH2
H2C
CH
R'
环氧乙烷
O H2 C R MgX CH2 OMgX
取代环氧乙烷
三元环较 活泼,易 开环。
OH H2O R CH2 CH2
R CH2 CH2 亲核取代 烷氧基镁 O
伯醇
R
MgX
H2C
CH
R'
H 2O
OH R CH2 C H R'
仲醇
பைடு நூலகம்
提示:合成上用于制备比卤代烷多2个碳的醇类化合物
C2H5Br
+
Mg
醚
I2
BrMg
N
C2H5Br 和I2为催化剂
格氏试剂与活泼氢原子的交换反应
+
+
C2H5MgBr
THF
MgBr
RC
CH
C2H5MgBr
RC
THF
CMgBr
三、烷基卤化镁(Grignard试剂)的性质
醚
R
X
+
Mg
RMgX
基本性质:活泼,不稳定
R
MgX
强碱
R
强亲核试剂
遇氧气发生反应
液,2/3用量投入反应器中。在氮气保护下加入
锂丝,-10℃下搅拌滴入少量溴代正丁烷乙醚溶
液,待反应液变浑浊,锂丝出现金属光泽时反
