烷烃 自由基取代反应共34页
烷烃自由基取代反应PPT学习教案

CH2 CHCH2
H
CH2 CHCH2 H
均裂
H=359.8kJ/mol (88kcal/mol)
共价键均裂时所需的能量称为键解离能。 键解离能越小,形成的自由基越稳定。
CH2 > CH2 CHCH2 > (CH3)3C > (CH3)2CH
苯甲基自由基
烯丙基自由基 三级丁基自由基 异丙基自由基
> CH3CH2 > CH3 >
第18页/共36页
甲烷氯化反应势能图的分析
1 第一步反应的活化能比较大,是速控步骤。 2 第二步反应利于平衡的移动。 3 反应 1 吸热,反应 2 放热,总反应放热,所以反应
只需开始时供热。 4 过渡态的结构与中间体(中间体是自由基)相似,
所以过渡态的稳定性顺序与自由基稳定性顺序一致。 推论:3oH最易被取代,2oH次之,1oH最难被取代。
反应机理是根据很多实验事实总结后提出的,它有 一定的适用范围,能解释很多实验事实,并能预测反应 的发生。如果发现新的实验事实无法用原有的反应机理 来解释,就要提出新的反应机理。反应机理已成为有机 结构理论的一部分。
第8页/共36页
4.4 烷烃的结构和反应性分析
1. 稳定。对强酸,强碱,强氧化剂,强还原剂 都不发生反应。 2. 烷烃的多数反应都是通过自由基机理进行的。
第9页/共36页
4.5 自由基反应
1. 自由基 定义:带有孤电子的原子或原子团称为自由基
。碳自由基:含有孤电子碳的体系称为碳自由 基。 4.5.1 碳自由基:含有孤电子碳的体系称为碳自由基。
CH3CH2 一级碳自由基
CH3CHCH3 二级碳自由基
CH3CCH3 CH3
三级碳自由基
第4章烷烃自由基取代反应ppt课件

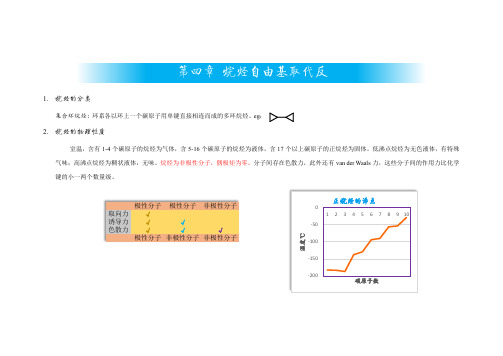
二 熔点
取决于分子间的作用力和晶格堆积的密集度。
烷烃熔点的特点
(1) 随相对分子质量增大 而增大。
(2) 偶数碳烷烃比奇数碳 烷烃的熔点升高值 大 (如右图)。
(3)相对分子质量相同的烷 烃,支链增多,熔点下降。
高度对称的烷烃分子熔点比同分子量的直链烷烃高。
伯,仲,叔氢原子的反应活性
2.溴化
C H 3 C H 2 C H 3 + B r 2
B r
1 2 7 o CC H 3 C H C H 2 B r+C H 3 C H C H 3 h v
3 %
9 7 %
Br
C H 3C H C H 3 +Br2
127oC C H 3C H C H 2Br+C H 3CC H 3 hv
第 四 章 烷烃 自由基取代反应
Chapter 2 Alkanes and free radical substitution reaction
4.1 烷烃的分类
4.2 烷烃的物理性质
外
观: 状态, 颜色, 气味
1-4 气态 5-16 液态 17- 固态 t
物理常数: 沸点(b.p.) 熔点(m.p.)
C HC H 2+B r2
C H 2 C H 2 C HC HC H 2 B r B r B r B r
4.12 烷烃的来源
(1) 石油(分馏产物); (2) 天然气
干天然气--甲烷86%~99%(体积) 湿天然气--甲烷60%~70%,还含有一定的乙烷,
丙烷,丁烷等气体. (3) 油田气--低级烷烃,如甲烷,乙烷,丙烷,丁烷和戊烷等; (4) 煤层气,沼气--甲烷等; (5) 甲烷冰.
烷烃自由基取代反应

28%
72% Cl
CH3CHCH3 + Cl2 CH3
35 oC hv
(CH3)2CHCH2Cl + (CH3)3CCl
63%
37%
V1oH : V2oH = 28/6 : 72/4 = 1 : 4
V1oH : V3oH = 63/9 : 37/1 = 1 : 5.3
氯化 V1oH : V2oH : V3oH = 1 : 4 : 5.3
自由基反应:
取代反应
(原有旳化学键发生均裂) 加成反应
离子型反应: (原有旳化学键发生异裂)
亲电反应: 取代反应 加成反应
取代反应 亲核反应:
加成反应
协同反应: (旧键断裂和新键形成相互协调地同步完毕)
二、反应机理
反应机理是指反应旳详细环节(或者说是指反
应所经历旳详细途径)。
如,甲烷氯代反应
CH4 + Cl2
第十二节 烷烃旳起源
一、起源于自然界:天然气和石油 二、人工制备
二、与氯和溴反应
+ Br2 r.t + Cl2 FeCl3
BrCH2CH2CH2Br ClCH2CH2CH2Cl
三 、与氢碘酸反应 CH3 + HI
I 开环 CH3CHCH2CH3
此反应是离子型机理,极性大旳键易 打开;三元环比四元环易发生此反应,其 它环不发生此反应。
开环反应活性:
三员环>四员环>>一般环
CH3 O O 单自由基
第六节 烷烃旳卤化
一、甲烷旳氯化
反应式 CH4 + Cl2
hv
CH3Cl + HCl
卤代反应 分子中旳原子或 基团被卤原子取代 旳反应称为卤代反 应。
第四章 烷烃 自由基取代反应
键解离能 平均键能和自由基
1、键解离能 和自由基稳定性
键的解离能: 某一键断裂所吸收的热量, 是键解离反应的焓( ΔHο反应热),用 DHο 表示,如: CH3-H → CH3 ·+ H · ΔHο= DHο= + 439.3 kJmol-1
1
CH3CH2- H → CH3CH2 ·+ H · CH3CH2CH2-H → CH3CH2CH2 ·+ H · ( CH3 )2CH-H → ( CH3 )2CH · + H ·
甲烷氯化的反应热如下所示:
(1) Cl2 (+242.7 ) (2)Cl · CH4 + (+439.3 ) (3)CH3· Cl2 + CH3· HCl + (- 431.8) CH3Cl + Cl · ΔHο= (+439.3 )+(-431.8) = + 7.5 kJmol-1 ΔHο = (+ 242.7)+ (-355.6) 2Cl · ΔHο= + 242.7 kJmol-1
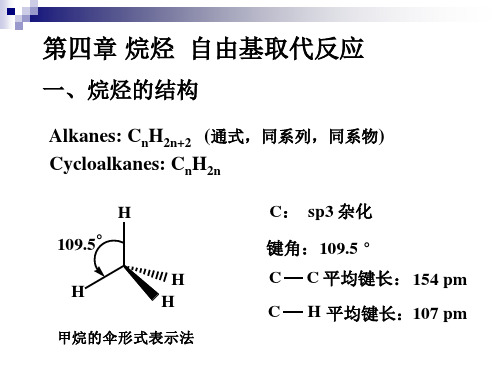
第四章 烷烃 自由基取代反应
一、烷烃的结构
Alkanes: CnH2n+2 (通式,同系列,同系物) Cycloalkanes: CnH2n
H 109.5° H H H C: sp3 杂化 键角:109.5 ° C C C 平均键长: 154 pm H 平均键长:107 pm
甲烷的伞形式表示法
二、烷烃的结构特点 1、非极性分子,偶极矩为0 2、在运动中可以产生瞬时偶极矩 3、分子间有色散力(瞬时偶极矩间的相互 作用)、vander waals 引力
一步反应 A + BC [A---B---C] 过渡态 AB + C
二步反应 A + B 反应物 C 中间体 D 产物
第四章 烷烃自由基取代反应
3. 有机反应的分类
按反应时键断裂和生产的方式 :自由基型、离子型、协同 亲电反应: 决进攻而发生的反应。 协同反应: 旧键的断裂与新键的生成都相互协调地在同一步骤中完成。 按反应物和生成物的结构关系 : 酸碱 (acid-base) 、 取代 ( substitution reaction) 、 加成 (addition reaction) 、 消除 (elimination reaction) 、 重排 ( rearrangement reaction) 、氧化还原( oxidation and reduction) 、缩合( condensation) 。
→ R3COOH + R3C·
过氧化物易产生爆炸的原因: -O-O-键是个弱键,在适当温度下很容易分解,产生自由基,自由基引发链反应,产生大量自由基,促使反应很快 进行,并放出大量热。
10. 烷烃的硝化
烷烃与硝酸或四氧化二氮进行气相(400~450℃)反应,生成硝基化合物(RNO2) 。 硝基烷烃可以转变成多种其他类型的化合物,如胺、羟胺、腈、醇、醛(Nef 反应) 、酮及羧酸等。硝基烷烃在工业上是很有用的溶剂,例如溶 解醋酸纤维、假漆、合成橡胶以及其他有机化合物。低级硝基烷烃都是可燃的,而且毒性很大。
6. 自由基反应
自由基碳呈 sp2 杂化(碳正离子 P 248 也是一样;碳负离子一般为 sp3 杂化,中的一对负电子占用的轨道会对其他 σ 轨道有排斥, 而成三角锥形,即这对负电子占有一个 sp3 杂化轨道) , p 轨道被一个孤电子占据。 在同系列中第一个化合物往往是比较特殊的。 解离能越低的碳自由基越稳定。 数据表明断裂 C-C 键所需的能量比 C-H 键小,因此 C-C 键易断同时还可以看出断裂 CH3CH2CH2CH3 中 C-C 键,形成两个 CH3CH2· 时H 最小, 说明大分子在中间断裂的机会是比较多的。 慢引发,快增长,速终止,有转移。 自由基反应的特点是没有明显的溶剂效应,酸、碱等催化剂对反应也没有明显影响当反应体系中有氧气(或有一些能捕捉自由基的杂质存在,如 下)时,反应往往有一个诱导期。所以自由基反应要做到防水防氧防铁。
第4章烷烃 自由基取代反应

4.5.3. 自由基反应的共性
定义:由化学键均裂引起的反应称为自由基反应。 共 (1)反应机理包括链引发、链增长、链终止三个阶段。 性
(2)反应必须在光、热或自由基引发剂的作用下发生。 (3)溶剂的极性、酸或碱催化剂对反应无影响。 (4)氧气是自由基反应的抑制剂。
C H + O O 3
双自由基
C H O O 3
支链烷烃比同碳数的直链烷烃更稳定。
4.11小环烷烃的开环反应
大环的环烷烃是稳定的,而小环的环烷烃不稳 定,由于张力较大,易开环进行加成反应。 1、与氢反应
H2/Ni
80 ℃
CH 3CH 2CH 3
H2/Ni
200℃
CH 3CH 2CH 2CH 3
思考题:为什么环丙烷易开环发生亲电加 成反应?
(1)“弯曲键”重叠程度小,键能下降, 从而产生角张力——恢复正常σ 键的倾 向,开环后即可形成正常的σ 键,所以 易开环。 (2)“弯曲键”使电子云暴露在成键两 原子(核连线)的外侧,类似于烯烃中 的π 键,易受亲电试剂的进攻。
结论:烷烃异构体中,直链烷烃的燃烧热最大, 支链越多,燃烧热越小,其焓值越小,越稳定。 每增加一个CH2,燃烧热平均增加659klmol-1
⑵生成热:由标准状态下的元素生成某一化合物 的反应中焓的变化。用△Hf¢表示。
化合物的生成热若为负值,表示它比生成它的元素更稳定。 烷烃的生成热为负值,生成热越小,越稳定。
苯甲基自由基 烯丙基自由基 三级丁基自由基 异丙基自由基
>C H C H C H 3 2 > 3 >
乙基自由基 甲基自由基 苯基自由基
两点说明
•影响自由基稳定 性的因素是很多 的,如: 电子离 域,空间阻碍, 螯合作用和邻位 原子的性质等; •碳自由基的最外 层为七个电子, 反应时总要寻找 另外的电子来达 到八隅体结构, 所以是亲电的。
第二章 烷烃和环烷烃 自由基取代反应
中文命名时:优先基团编号大!
4-丙基-8-异丙基十一烷 4-isopropyl-8-propylundecane
3. 命名编号取代基 • Name the substituents as alkyl groups. • Every carbon belongs to either the longest chain or a substituent, not both. • Each substituent needs its own number
•
二、系统命名法
1.
系统命名法(续) • 系统命名法适用于所有的有机化合物。
• 烷烃的命名:对于直链烷烃,根据烷 烃分子中碳原子命名为“某烷”;对 于含有支链的烷烃,将其看作直链烷 烃的取代衍生物来命名。
构造式
CH4 CH3CH3 CH3CH2CH3 CH3(CH2)2CH3 CH3(CH2)3CH3
中文名称
甲烷 乙烷 丙烷 正丁烷 正戊烷
英文名称
methane Ethane Propane n-butane n-pentane
构造式
中文名称
英文名称
n-octane n-nonane n-decane n-undecane n-dodecane
CH3(CH2)6CH3 正辛烷 CH3(CH2)7CH3 正壬烷 CH3(CH2)8CH3 正癸烷 CH3(CH2)9CH3 十一烷 CH3(CH2)10CH 十二烷
• •
二、系统命名法
5. 环烷烃的命名 2). 螺环烷烃的系统命名
2
1
6
7 8
1
4 5
5 3 4 10 9
3 2 7 6
螺[4. 5]癸烷 spiro[4. 5]decane
yq有机chapt-04 烷烃 自由基取代反应 2

支链烷烃比同碳数的直链烷烃更稳定。
4.9 小环烷烃的开环反应
大环的环烷烃是稳定的,而小环的环烷烃不稳定,由于张力 较大,易开环进行加成反应。
1、与氢反应 +
H2
Ni 80℃ Ni 120℃ Pt 300℃
CH3CH2CH3
+ +
H2
CH3CH2CH2CH3
H2
CH3(CH2)3CH3
环己烷则很难发生加氢反应。
物理性质:不牵涉物质分子化学组成 改变的性质,是物质本力:是电子在运动中产生的瞬时偶极力,与分子的 极化率、分子的接触面积有关。 又称为诱导偶极-诱导偶极相互作用。
色散力与分子中原子的数目大小约成正比。它弱于其 它分子间作用力,但是普遍存在的。
偶极力:极性分子间的相互作用力,为一分子偶极正端 对另一分子偶极负端的相互吸引作用。 也称为偶极-偶极相互作用。
4.5.3 高级烷烃的卤化
1.氯化
CH3CH2CH2CH3 + Cl2 35 oC hv CH3CH2CH2CH2Cl + CH3CH2CHCH3 28% 72% Cl
CH3CHCH3 + Cl2 CH3
35 oC hv
(CH3)2CHCH2Cl + (CH3)3CCl 63% 37%
V1oH : V = 28/6 : 72/4 = 1 : 4 2oH V 1oH : V 3oH = 63/9 : 37/1 = 1 : 5.3 氯化 V 1oH : V 2oH : V 3oH = 1 : 4 : 5.3
Ea (KJ/mol)
F Cl Br I
+4.2 +16.7 +75.3 > +141
第二章 烷烃和环烷烃 自由基取代反应(修正)

正戊烷
异戊烷
新戊烷
如何用普通命名法命名?
15
• 系统命名法(Systematic Names / IUPAC names)
IUPAC: International Union of Pure and Applied Chemistry
1. 直链烷烃:
根据烷烃分子中的碳原子数称为某烷,前面不需加“正”。
若环上只有一个取代基,则与
取代基相连的环碳原子为1号碳, 取代基的位次不需标出。
1-甲基-2-乙基环戊烷
若环上有两个基团存在:
IUPAC:基团名称首字母优先的,其相连环碳原子编为1号;
中国化学会:“次序规则”中不优先的基团,其相连环碳原子
编为1号。
27
2-甲基-4-乙基-1-丙基环己烷
28
环上有复杂取代基时,可将环作为取代基命名。 1-环丁基戊烷
7-环丙基螺[4.5]癸烷
30
3. 桥环烷烃(bridge cycloalkanes) 根据桥环上的环数和所含碳原子总数称为几环某烷。 环数的确定: 将环上任意一根键剪断,每次剪断一根 键,即破坏一个环。根据所需剪断键的 最小次数确定该桥环化合物所含的环数。
31
在几环和某烷间插入方括号,用阿拉伯数字标出每一 条桥上的碳原子数(不包括桥头碳原子),数字由大 到小排列。 编号:从一个桥头碳原子开始,沿最长的桥到第二个 桥头碳原子,再从次长的桥回到第一个桥头,最后给 出最短的桥编号。并使取代基位次最小。
1,3-二环己基丙烷
29
2. 螺烷烃(spiroalkanes)
根据螺环上碳原子总数称为螺某烷。在“螺”与某烷 间插入方括号,用阿拉伯数字标出螺原子所夹碳链上 碳原子的数目(不包括螺原子),数字由小到大排列。 编号:从螺原子邻位碳开始,沿较小的环开始编号, 并使环上取代基位次最小。
有机化合物烷烃自由基取代反应

烷烃的制备
4.12 烷烃的来源(自学)
4.2 烷烃、环烷烃的物理性质
外
观:
状态
颜色
气味
物理常数:
沸点(b.p.) 折光率(n) 密度() 溶解度 光谱特征
熔点(m.p.) 旋光度[α ]λ 相对密度(d) 偶极矩(μ) μ =qd
t
(1) 熔点
取决于分子间的作用力和晶格堆积的密集度 烷烃熔点的特点
第 4 章 烷烃 自由基取代反应
本章提纲
4.1
4.2
烷烃的分类(自学)
烷烃、环烷烃的物理性质 环烷烃的反应
4.3 4.4
预备知识 烷烃的结构和反应性分析
4.5
4.6
自由基反应
烷烃的卤化
本章提纲
4.7
4.8 4.9
烷烃的热裂(自学)
烷烃的氧化(自学) 烷烃的硝化(自学)
4.10 烷烃的磺化及氯磺化(自学) 4.11 小环烷烃的开环反应
AB
A+ + B
这种经过异裂生成离子而引发的反应称为离子型反应。
B + (CH3)3C Cl
-
(CH3)3CB + Cl
离子型反应根据反应试剂的类型不同,又可 分为亲电反应(electrophilic reaction)与亲 核反应(nucleophilic reaction)两类:
对电子有显著亲和力而起反应的试剂称为亲电试 剂(electrophile或electrophilic reagent)。决速 步由亲电试剂进攻而发生的反应称为亲电反应。如:
RCH2CN + Cl (亲核反应)
3. 协同反应 在反应过程中,旧键的断裂和新键的形成都相互协调地在同一 步骤中完成的反应称为协同反应。协同反应往往有一个环状过渡 态(cyclic transition state)。它是一种基元反应(elementrary reaction)。如:
烷烃和环烷烃自由基取代反应

05 烷烃和环烷烃自由基取代 反应的挑战与展望
反应选择性与效率的提高
开发高效催化剂
通过研究新型催化剂,提高自由 基取代反应的选择性和效率,减 少副反应的发生。
优化反应条件
通过调整温度、压力、溶剂等反 应条件,促进目性
研究控制反应位点的策略,实现 自由基取代反应的区域选择性, 提高产物纯度。
当两个自由基碰撞时,它们可以 结合形成分子,或者与其他物质 发生反应,使链终止。
环烷烃自由基取代反应的实例
烷基取代
01
如甲基环己烷在光照条件下与氯气反应,生成氯化甲基环己烷。
氢取代
02
如四氢萘在硫酸中加热,生成萘。
异构化
03
如甲基环戊烷在加热条件下异构化为异丁烷。
04 烷烃和环烷烃自由基取代 反应的应用
有机合成中的烷烃和环烷烃自由基取代反应
烷烃和环烷烃自由基取代反应在有机 合成中具有广泛的应用,如合成醇、 醚、卤代烃等。通过自由基取代反应, 可以方便地引入特定基团,实现化合 物的结构修饰和改造。
VS
烷烃和环烷烃自由基取代反应在药物 合成中也有重要应用,如合成药物中 间体、活性物质等。通过自由基取代 反应,可以高效地合成具有特定结构 和活性的化合物,为药物研发提供有 力支持。
热引发
在高温下,烷烃分子吸收能量,使得化学键断裂, 形成自由基。
光引发
在紫外光的照射下,某些物质(如碘)吸收光能, 形成自由基,引发链式反应。
化学引发
使用引发剂(如过氧化物)分解,产生自由基, 从而启动反应。
链增长
自由基与烷烃分子碰撞
与未反应的烷烃分子碰撞,使其化学 键断裂,形成新的自由基。
自由基之间的碰撞
高分子合成中的烷烃和环烷烃自由基取代反应
04烷烃-自由基取代反应讲解

二、有机反应机理
反应机理是对一个反应过程的详细描述, 是根据实验事实总结后提出来的,有一定 的适用范围,并在不断发展。
表示一对电子的转移
表示单电子的转移
三、有机反应中的热力学和动力学
1、热力学与化学平衡
热力学是研究一个反应能否进行及进行的程度。
A+B
C+D
K = [C][D]/[A][B] △G = -RT㏑K
第四章 烷烃 自由基取代反应
第一节 烷烃的分类
链烷烃(CnH2n+2)
小环(3、4元环)
烷烃 环烷烃
单环烷烃(CnH2n) 中环(8-11元环)
大环(≥12元环)
集合环烷烃
普通环(5-7元环)
多环烷烃
桥环烷烃
Cl
螺环烷烃
第二节 烷烃、环烷烃的物理性质
外 观: 状态, 颜色, 气味
物理常数: 沸点(b.p.)
.......态的特点: (1)能量高。 (2)极不稳定,不能分离得到。 (3)旧键未完全断开,新键未完全形成。
第一过渡态
反应势能图
二步反应: 势 能
Ea1 C A+ B
△H
第二过渡态 Ea2
A+B
C
D
反应进程 过渡态:在反应物互相接近的反应进程中,与势能最高点相 对应的结构称为过渡态。
熔点(m.p.)
折光率(n) 旋光度[α]λ t 密度(D) 溶解度 偶极矩(μ) μ=qd 光谱特征
一 沸点
沸点高低取决于分子间的作用力 (色散力,范德华力) 烷烃沸点的特点 (1)沸点一般很低(非极性,只有色散力和范德 华力)。 (2)正烷烃的沸点随相对分子质量增大而升高 (运动所需能量增大,范德华引力也增大)。 (3)相对分子质量相同、叉链越多、沸点越低。 (叉链多,分子不易接近)
烷烃和自由基反应

2、烷烃的结构
Structure of Alkanes
3、化学反应
Chemical reactions
4、作业
Work after class
甲烷自由基反应 Free radical reactions
自由基反应三部曲 (IPT)
Three-step feature of free radical reactions
123 4
5
6
78
实
876 5
4
3
21
CH3CH2CH2CH CH CH CHCH3
例 二
CH3 6 CH2 7 CH2
CH3 CH3
8 CH3
1 确定主链: 有两个等长的最长链。
比侧链数: 一长链有四个侧链,另一长链有二个 侧链,多的优先。
2 编 号: 第二行取代基编号2,3,4,5; 第一行取代基编号 4,5,6,7。根据最低系列原则, 选第二行编号
二、甲烷的正四面体结构
H
键长:0.110nm 键角:10928’
H sp3 轨道和甲烷分子的形成
CH H
109.5
-键 H
C
H
H
H
烷烃分子的模型和表示方法
① 键线表示法:
己烷
2-甲基戊烷
② 楔形式 :
H
H
HC CH HH
乙烷
(3)模型: Kekkule(凯库勒)模型:球和棍棒,表示原子和键; stuart(斯陶特)模型:原子半径和键长的比例;
Initiation
Bond-dissociation energy
自由基反应三部曲 (IPT)
烷烃的卤代自由基反应机理.ppt

反应机理是指反应物到产物经过的途径和 过程,是根据大量实验事实作出的理论假 设。烷烃的卤代反应是典型的自由基反应 机理,分三个步骤进行: 反应式:CH4+Cl2 hν CH3Cl + HCl
反应机理:
第一步 链引发 第二步
{ 链增长
第பைடு நூலகம்步
链终止{
注意的几个问题(i)自由基定义:具有未配对电子的原子或原子团
(ii)自由基结构:
平面型:
角锥型:
(iii)自由基产生:热和光,也可用自由基引发剂,如:
. (CH3CH2)4Pb Δ 4CH3CH2 + Pb
. CH3CH2 +Cl2
CH3CH2Cl + Cl.
(iv)自由基稳定性 3o自由基>2o自由基>1o自由基>甲基自由基
(v)过渡态理论:任何一个化学反应都是经过 一个过渡态才完成
第二章 烷烃和环烷烃 自由基取代反应

烃(hydrocarbon):仅由碳和氢两种元素组成的化合物
第一节 分类、构造异构和碳原子的级
碳原子之间以单键相连,碳的其余的价键都与氢原子相连。 一、分类 1烷烃:具链状骨架的烷烃称为链烷烃简称烷烃,分子通式 CnH2n+2 烷烃 支链烷烃 2.环烷烃:是指碳原子以单键连接成环,性质与开链烃相似, 属脂环化合物,通式: CnH2n 直链烷烃
CH3 H C 3
H CH H CH3 33 H CH
H
H H H
H H H
H H H H H H
H H
H H H H H H H H
H H H H
H H H H
HH H H HH H H H H
H H
H H H CH3 CH3 3 CH
H HCH H
H
3
H
CH CH3 33 CH
H H H
全重叠式
道具有较多p成分。
环丙烷分子轨道图
第四节 构象(conformation) 由单键的自由旋转而引起的分子中各原子或基团在空间的排布 形象称为构象。 交 叉 式
H
一、乙烷的构象
重 叠 式
H
H H H H
HH
H
H H
H
锯架式
H
H
H
H H H H
纽曼(Newman) 投影式
H H
HH
H
乙烷构象能量变化图
N=3
偏转角度
24o44’
4
9o44’
5
44’
6
-5o16’
7
-9o33’
这种由于键角偏离正常键角而引起的张力叫角张力
4.1.1 自由基取代反应

4.1.1 自由基取代反应自由基作为一种重要的有机机活性中间体,在很多有机化学反应中存在。
其中,最常见的自由基反应为饱和烷烃的自由基取代反应。
通过自由基取代反应,饱和烷烃和卤素生成卤代烃。
甲烷氯化过程中甲基自由基的生成一. 烷烃的结构与化学性质饱和烷烃是最基本的有机化合物,在分子中只存在C—C单键和C—H单键,其化学性质不活泼。
碳与氢的电负性相差不大,所以饱和烷烃中的共价键C—C键和C—H键的极性很小,不易发生亲核和亲电反应。
烷烃最常见和最重要的反应为自由基取代反应。
C的电负性为2.5,H为2.2二. 甲烷自由基卤代反应的机理甲烷在光照或加热的条件下和卤素(氯或溴)发生反应,生成卤代甲烷和卤化氢。
首先,卤代反应的几个实验事实:(1). 光照或加热条件;(2). 反应过程中的链式反应;(3). 氯代反应的速率>溴代反应(4). O2的存在会使反应速率减慢1. 链引发2. 链传递3. 链终止各种自由基结合形成中性分子二. 甲烷自由基卤代反应的机理甲烷在光照或加热的条件下和卤素(氯或溴)发生反应,生成卤代甲烷和卤化氢。
1. 链引发两种断裂的可能键离解能△H = 242.7 KJ/mol键离解能△H = 439.3 KJ/mol二. 甲烷自由基卤代反应的机理甲烷在光照或加热的条件下和卤素(氯或溴)发生反应,生成卤代甲烷和卤化氢。
2. 链传递注:本页动画由Gaussian软件和Gaussview程序制作二. 甲烷自由基卤代反应的机理甲烷在光照或加热的条件下和卤素(氯或溴)发生反应,生成卤代甲烷和卤化氢。
2. 链传递注:本页动画由Gaussian软件和Gaussview程序制作二. 甲烷自由基卤代反应的机理甲烷在光照或加热的条件下和卤素(氯或溴)发生反应,生成卤代甲烷和卤化氢。
3. 链终止注:本页动画由Gaussian软件和Gaussview程序制作二. 甲烷自由基卤代反应的机理除了甲烷之外,其他饱和烷烃的卤代反应的机理是类似的。
