人教版第五单元化学方程式 复习课课件
人教版九年级化学上册第五单元化学方程式复习(共25张PPT)

必须以客观事实为基础 必须遵守质量守恒定律
四、书写化学方程式的步骤
写 •(1) 根据实验事实,在式子两边写
出反应物和生成物的化学式,并在两边 之间画一条短线
•(2)配配平化学方程式,将短线改为
等号
•(3)标标明化学反应发生的条件,短
线改成等号。
六、化学方程式的配平
36: : 4 : 32
21K2C2.l5O×3M2△nO:2 274K.5C×l 2+3:O322×3
245 : 149 :96
九、根据化学方程式计算的步骤
1.设未知量(求什么就设什么,将所求的问题 一次设出)
2.写出化学方程式并配平(计算中所用到的化 学方程式)
3.写出有关物质的相对分子质量和已知量、未 知量(只写与已知和所求有关的物质,上写相对 分子质量,下写物质的质量,已知的带单位)
1.观察法
2.最小公倍数法:
配平时,首先找出反应式左、右两边各出现一次,且 原子个数即不相等,又相差较多的元素,求出最小公倍 数。如:P+ O2—P2 O5中 ,O2和P2 O5中的O最小公倍 数为2×5=10,用最小公倍数分别除以含有该元素的化 学式中的原子个数,其商就是该化学式的化学计量数。 如:P2 O5中有5个O原子,P2 O5的系数为10/5=2;O2中 有2个O原子, O2的系数为10/2=5。
② 量的方面:每32份质量的硫跟32份质量的氧气完全反
应生成64份质量的二氧化硫。
③粒子方面:每1个硫原子与1个氧分子反应生成1个二氧
化硫分子。
八、根据化学方程式计算各物质的质量比
各物质的质量比等于化学方程式中每种物质 的相对分子质量乘以化学计量数的比
人教版化学方程式复习课件

(选填“含有”、“不含有”、“可能含有”)。
(2)4.6g某物质在空气中完全燃烧生成8.8g CO2和 5.4gH2O,通过计算,该物质 含有 碳元素, 含有氢元素, _含_有__氧元素。(以上三空选填“含有”、“不含有”、
“可能含有”)。其中碳元素 2.4 g,氢元素0.6 g,氧元
素 1.6 g。
“一个可能变”:
分子的总数目可能变。
2H2+O2 2H2O H2+Cl2 2HCl
【例1】判断下列说法是否正确(正确的打“√”,错误的打“×”)
(1)根据质量守恒定律,1L氢气和1L氧气反应生成2L水。
( ×)
(2)10g水蒸发变成10g水蒸气符合质量守恒定律。(
×)
(3)蜡烛完全燃烧后,蜡烛没有了,这违背了质量守恒定律。
大家有疑问的,可以询问和交流
可以互相讨论下,但要小声点
8
【练习2】根据2CH3OH+3X+4NaOH=2Na2CO3+6H20, 推求X的化学式为( A )
A.O2
B.CO
C.CO2
D.H2
【练习3】a克过氧化氢溶液和b克二氧化锰混合, 待完
全反应后得c克残余物,则生成氧气的质量为( B )
A. (a-c)克
三、有关化学方程式的计算 1.计算依据 ①质量守恒定律:反应物质量总和等于生成物质 量总和;
②方程式中各物质的质量之比等于它们的相对分 子质量与化学计量数乘积之比
2.计算步骤:“设、方、关、比、算、答”。
【例7】已知化学反应:2A+B=2C+D,当10gA 和8gB恰好完全反应后,生成6gC。如果要得到
注意:
①反应物无气体,而生成物有 气体的,需要在生成物气体物质的化 学式右边标“↑”。②在溶液中的反 应,如果反应物没有固体,生成物有 固体,需要在生成物固体物质的化学 式右边标“↓”。③配平化学方程式 时不能改动化学式右下角的数字。
2024新人教版九年级化学上册第五单元化学反应的定量关系复习课课件

考点二、质量守恒定律的应用
3. 四种物质在一定条件下充分混合反应,测得反应前后各物质的质量分
数如图所示,则有关说法错误的是( B )
A.乙可能是这个反应的催化剂 B.生成甲、丙的质量比为8∶1 C.丁一定是化合物 D.参加反应的丁的质量等于生成甲、丙的质量之和
2.镁带在密闭的容器中加热,其总质量与时间的关系
正确的是 ( B )
总
总
总
总
质
质
质
质
量
量
量
量
时间
时间
时间
时间
A
B
C
D
2
质量守恒定律的验证
考点三、质量守恒定律的验证
1.药品选择:必须能发生化学反应,且反应现象明显。 2.装置选择:如果所选的化学反应中有气体参加或生成,反应必须在 密闭容器中进行。
第五单元 化学反应的定量关系 单元复习课
单元知识脉络构建
遵守
质量守恒定律
载体
化学方程式
化学反应
应 用
根据化学方程式进行简单计算
单元重难点
1 质量守恒定律的理解 2 质量守恒定律的验证 3 质量守恒定律的应用 4 化学方程式的书写和意义 5 化学方程式的有关计算
目前全世界都在关注能源问题,有人曾经宣布可以 直接把水变成油,一时间引起了广泛的关注和争论,你 认为水可能变成油吗?
【易错提醒】无论天平是否平衡,任何化学反应都遵守质量守恒定律。
为了验证质量守恒定律,某同学设计了如图实验。该实验能否达到 目的?请说明理由。
不能。理由:反应生成的气体逸散到空气中 改进措施:_改__为__在___密__闭__容__器__中__进__行__。__
3
人教版九年级化学(上)第五单元《化学方程式》复习教学课件

《化学方程式》复习课(一)质量守恒定律的理解与运用反应 各 质量 生成 各 化学 物理 质量 不能 原子的重新组合种类数目质量密闭实验现象分析:(1 )所选实验现象一定要现象明显(说明一定发生了化学反应)。
(2)实验中用到气体或生成气体的都必须在_________中进行才能验证质量守恒。
(3)所用反应都遵循_________ 。
造成天平不平衡的原因有:有的生成物或反应物的状态不同,其质量没有计算在内;反应装置_________不好;使得部分物质溢散或进入,造成质量发生变化。
密闭容器质量守恒定律气密性引申:质量守恒可以理解为 : 六个不变;两个一定变;一个可变可不变。
六个不变:化学反应前后物质总质量不变,元素种类,元素质量不变,原子的种类不变,原子的数目不变,原子的质量不变。
两个一定变:物质的种类;分子的种类一定会变一个可变可不变:分子的数目不一定变1.判断题:(1)100g 水加热变成100g 水蒸气遵守质量守 恒。
(2)因为四氧化三铁的质量大于铁丝的质量,所有铁丝在氧气中燃烧的实验不遵守质量守恒。
(3)3g 镁和3g 氧气充分反应会生成6g 氧化镁。
(4)化学反应前后原子种类、数目一定守恒,但分子数目不一定守恒。
x 因为是物理变化x 所有的化学变化都遵循质量守恒。
× 要求是参加反应的等于生成的。
√DA 如果X 前面没系数,则化学式是什么?已知反应前原子种类及个数N 4H 12O 6已知反应后原子种类及个数 N ? H 12O 6利用化学反应前后原子种类数目质量不变N 4化学反应前后原子种类、数目不变 4.工业上煅烧硫铁矿用来生产硫酸,用X 表示硫铁矿中的主要成分。
煅烧反应的化学方程式为: 4X + 11O 2 ===2Fe 2O 3 + 8SO 2,则x 为( ) A. FeS 2 B. Fe 2S 3 C. FeSO 4 D. Fe 4S 8高温Fe 4个 O (6+16)=22个S 8个O 22个X A D 已知反应物中已知生成物中还差Fe 4个, S 8个A利用化学反应前后元素种类不变A利用化学反应前后元素种类不变化学反应的关系式:有机物 + O 2 → CO 2 + H 2O + SO 2已知变化后元素种类 CHSO已知变化前元素种类O 点燃根据参加化学反应的各物质质量总和等于生成的各物质的质量总和。
人教版九年级上册化学 第五单元 化学方程式复习课件(共43张PPT)
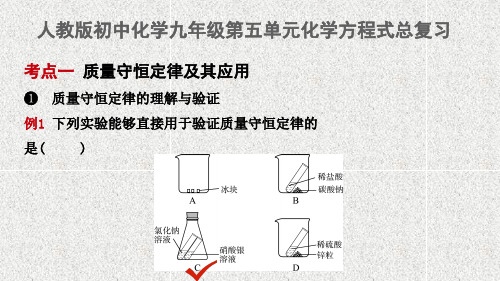
考点一 质量守恒定律及其应用
❶ 质量守恒定律的理解与验证
例1 下列实验能够直接用于验证质量守恒定律的
是(
)
【思路解析】 首先质量守恒定律的适用范围是化学反应,其次在设计有 气体参加或生成的实验时需要在密闭容器中进行。
❷ 运用质量守恒定律推断物质化学式
例2 钛和钛合金被认为是21世纪的重要金属材料,在冶炼金属钛时会发生
【思路解析】 先明确坐标曲线中横纵坐标代表的量,其次明确曲线的三 点——起点、拐点、终点,以及平台所代表的意义。结合由题干以及坐标 曲线获得的信息,根据化学方程式中的质量关系解答。
随堂练习
6.某化学课外活动小组测定长期放置的铁粉中铁单质的百分含量。他们 准确称量两份质量各为10.0 g的铁粉样品,分别进行如图操作:
【思路解析】 通过某反应的化学方程式可得到的信息有反应条件,反应 物、生成物各物质间的质量关系,反应体系中微观粒子的数量关系,反应 类型,元素化合价的变化;无法获得的信息有反应速率,反应过程中的能 量变化。
❷ 化学方程式的书写
例6 下列化学方程式书写正确的是( )
A.2NaOH+CuSO4===Cu(OH)2↓+NaSO4
考点二 化学方程式
❶ 化学方程式的意义
例5 镁条在氧气中燃烧的化学反应可用“2Mg+O2 2MgO”来表示。以下信息:①反应条件 ②反应速率 ③反应物、生成物
各物质间的质量关系 ④反应的微观过程 ⑤反应过程中的能量变化 ⑥
反应体系中微观粒子的数量关系。能从上述化学方程式中获得的是(
)
A.①③④ B.②③⑤ C.①③⑥ D.②④⑥
原子。
(1)该化学反应中,发生变化的是 反应的两种分子的个数比为 。
人教版九年级上册化学 第五单元 化学方程式 复习课件

∆
点燃
【例2】关于化学方程式CH4+2O2====CO2+2H2O的描述正确的
是 A.(甲C烷)加氧气在点燃条件下,反应生成二氧化碳和水
B.1个甲烷和2个氧气在点燃条件下,生成1个二氧化碳和2个水 C.每1个甲烷分子和2个氧分子反应生成1个二氧化碳分子和2个 水分子D.1g甲烷和2g氧气在点燃条件下,生成1g二氧化碳和2g 水
第五单元化学方程式 小结与复习
书写原则
质量守恒定律
意义
设
写 写
配
书 写
步
注骤
化学方程式
计标 算
列
等
2KClO3=M=n=O=2 2KCl+3O2↑ ∆
解
答
考点一质量守恒定律
1.质量守恒定律:参加化学反应的各物质___质__量___ 总和,__等__于____反应后生成的各物质的质量总和。
2.解释:化学反应的过程,实际上就是参加反应的 各物质所含的_原__子___重新组合生成其他物质的过程, 因此在化学反应前后原子的_____没有改变,原子 的_____没有增减,原子的__种__类_也没有改变(原子 三不数变目),所以物质的总质量质在量反应前后保持不变。
(2)步骤
写、配、注、等
书写
通电
配平方法
写配 步
2 H2O——— 2H2+↑ O2↑ 最小公倍数法
骤注
点燃
C3H8+O52——— 4 H2O+ 3 CO2 定“1”法
等
8Al+Fe3O4——一--定-F条e件+A9l2O3 4
练 一
加热氯酸钾和二氧化锰混合物制取氧气
练
______2K__C_l_O_3_—__—M__nKO_2_C2_l+__O_2___3____↑_
人教版九年级化学上册第五单元 化学方程式 复习课件(共15张)

课后作业
解:(1)根据质量守恒定律可得,生成O2的质量为:30g-20.4g=9.6g (2)设混合物中氯酸钾的质量为x。
2KClO3
=M=nO=2
△
2KCl+3O2↑
245
96
X
9.6g
245/96=x/9.6g
x=24.5g
(3)二氧化锰的质量为:30g-24.5g=5.5g
答:(1)生成氧气的质量为9.6g;
2Mg +O2
2MgO
48 : 32 : 80
知识点3 化学方程式的计算
利用化学方程式计算的过程: 设——根据题意设未知量(设未知数时,不带单位) 写——正确写出反应的化学方程式 算——算出已知物和待求物之间的质量关系,并代入 列——列出比例式 解——求解(计算结果要带单位) 答——简明地作答
知识点3 化学方程式的计算
【例】小滨同学为了测定某珍珠粉中碳酸钙的质量分数,称取 12.5g珍珠粉样品,进行四次高温煅烧、冷却、称量剩余固体 的重复操作(杂质不参加反应),记录数据如下:
操作次数
第1次 第2次 第3次 第4次
剩余固体质量(g) 10.8 9.6 8.1 8.1
试计算:
(1)完全反应后生成二氧化碳的质量是 4.4 g。
部通入80克质量分数为20%的氢氧化钠溶液中充分吸收,测得最终所得溶液
的质量为86.6克,则原混合气体中碳元素和氧元素的质量比为( A )
A.9:16
B.1:2
C.3:8
D.17:8
课后作业
3.小红将30g氯酸钾和二氧化锰的固体混合物加热制取氧气,待反应完全后,将 试管冷却、称量,得到固体的总质量为20.4g,请计算: (1)生成氧气的质量是多少? (2)原混合物中氯酸钾的质量是多少? (3)混合物中二氧化锰的质量是多少?(写出计算过程)
人教版九年级化学第五单元化学方程式复习课件(共30张PPT)

• 2方.程下式列是各(式中B),正确表示铝与稀硫酸反应的化学
• A.Al + H2SO4 ==== AlSO4 + H2↑ • B.2Al+ 3H2SO4 ==== Al2(SO4)3 + 3H2↑
• C. Al + 2H2SO4 ==== Al(SO4)2 + 2H2↑
• D. 2Al + H2SO4 ==== Al2SO4 + H2↑
下生成二氧化碳。 ② 量的方面:每12份质量的碳跟32份质量的氧 气完全反应生成44份质量的二氧化碳。 ③微观(粒子方面):每1个碳原子与1个氧分子 反应生成1个二氧化碳分子。
练一练
1、根据化学方程式不能获得的信息是—D— A、该反应中的反应物和生成物 B、各反应物和生成
物的质量比
C、发生反应所需要的条件 慢
化 学 方 程 式
根据化学方程式进行计 算
知识点1:质量守恒定律
1、质量守恒定律的定义
参总加和化—_等—_学—_于反_—反_—应_—应_的—_后_—_生各__成—物——的—质—各的——物质—质量—的— 质量总和
知识点1:质量守恒定律
运用质量守恒定律要注意以下几点
⒈适用范围是化学反应,不能用来解释物 理变化。 ⒉“守恒”是指质量守恒,并不是指体积等 守恒。 ⒊“质量守恒”对反应前的物质而言,是指 “参加反应”的物质质量的总和,不参加 反应的物质的质量不能计算在内。
D、化学反应的快
2、反1应0,克生A和成足8克量C的和B混合加热发生反应D,10克A完全
人教版初中化学九上复习课:第五单元 化学方程式 课件

学习目标
1.认识质量守恒定律,能说明常见化学反应中的 质量关系;能从微观角度解释质量守恒定律并认 识化学反应。 2.理解化学方程式的涵义,能正确书写简单的化 学方程式。 3.掌握有关反应物、生成物质量的计算;掌握化 学计算的解题格式,提高化学计算题的解题能力; 通过有关化学反应的计算,能从定量的角度理解 化学反应。
■化学反应前后“五个不变,两个一定改变,一个可能改变”
①一定不变 宏观:
的总质量不变; 种类质量不变
微观:原子的 、 、 ②一定改变 宏观:物质的 一定变
微观: 种类一定变 ③可能改变:分子总数可能变
不变
知识点二:化学方程式
知识点三:根据化学方程式的计算
1.依据:
定律。
2.步骤:
(1)设
。
(2)写出反应的
(1)以食盐和水为反应物,经过电解制得Cl2、H2、NaOH三种物质, 该反应的化学方程式__________________________
(2)氯气溶于水可生成次氯酸(HClO)和盐酸(HCl),该反应的化 学方程式 __________________________
(3)氢气可在氯气中燃烧,生成氯化氢气体(HCl),该反应的化学 方程式 _______________________
发生改变的是分子的
。
(4)由图③还能获得的一条是
。 ,可能
。
24.(6 分)(2015•山西)如图分别是水蒸气液化,水通电分解和氢气在氯气中燃烧的微观 变化示意图.请回答下列问题:
(1)图②表示的化学方程式为 2H2O
2H2↑+O2↑ ;
(2)从微观角度解释图①、图②的本质区别是 ①中水分子本身没有改变,只是分子间 隔变小,发生了物理变化;②水分子变为氢分子和氧分子,发生了化学变化 ; (3)由图②、图③可得到:化学变化中一定不变的粒子是 原子 ,可能发生改变的分 子的 数目 .
人教版九年级化学上册:第五单元《化学方程式》复习课件(共12张PPT)

,这 都 是 自 悲 的心态 在捣蛋 。 感 觉 困 难 挺 多的,自 己
A.生成的丙与丁的分子个数比为1∶1 B.乙的相对分子质量为32 C.两种生成物均为化合物 D.甲中氮、氢原子个数比为1∶3
应用:解释现象、推断元素、确定化学式、辅助 计算等
2.化生__成__物__和__反__应__条__件__ 表示各物质的_质__量__比___
微观:表示各物质的____微__粒__个__数__比____
化学方程式 书写 原则:以_客__观__事__实___为基础;遵守_质__量__守__恒__定__律___ 步骤:写→配→注
(3)现要制得830 kg含杂质20%的高铁酸钠,至少需要次氯酸钠的质量是多少?
2.(关注化学模型)如图是某反应的微观示意图。请回答下列问题。
(1)B框中的物质属于_②___(填序号)。 ①化合物 ②单质 ③氧化物 (2)此反应的化学方程式为______2_H_2S_+__3_O_2___点_燃___2_S_O_2_+__2_H_2O_____。 (3)此图说明化学反应前后发生改变的粒子是__分___子___。
易错点2 微观示意图
2.(北京中考)氨催化氧化是制硝酸的主要反应之一。该反应前后分子 种类变化的微观示意图如下。下列说法不正确的是( A )
寒 假 实 践 体 会_9 寒假实践报告 常 听 一 些 同 龄的打 工族说 ,出去打 工是怎 样怎样 的辛苦 。百闻 不如一 试。对此,我也 想 亲 身 经 历 一次,所 以,我和 另一舍 友便以 一个打 工者的 身份,以 增加 社会经 验,提高 实 践 能 力 ,丰 富暑假 生活为 宗旨而 去找工 作。这 次的社 会实践 收获可 不少。 顶 着 烈 日 找 了几天 的工作 ,见过的 单位不 少,不是 已经招 满就是 回去等消息。经过坎 坷 的 寻 职 路 ,终于在 一家大 型超市 某得一 职——服 务员 。虽然 很辛苦 ,很不好受,可这 些 经 历 在 书 上是没 得学的 。 善 于 与 他 人 沟通,是 作为服 务员所 必须进 行的一 项工作 。经过 一段时 间的寻 找工作 让 我 认 识 更 多的人 。如何 与别人 沟通好 ,这门技 术是需 要长期 的练习 。以前 工作的 机 会 少 之 又 少,即便 是去年 暑假在 医院的 实践也 是很少 与病人 接触,这使我与别人对 话 时 不 会 应 变,会使 谈话时 有冷场 ,这也是 很尴尬 的。在 百汇超 市工作 时,因 为是服 务 员 ,与 别 人 谈话的 时间变 多了,此 时,不 得不学 着与顾 客沟通 ,使顾客 接受你 的意见 和 建 议 。 与 同事间 的沟通 也同样 重要。 别人给 我意见 ,我就得 认真听 取,耐心、虚心
化学人教版九年级上册九年级化学第五单元 化学方程式复习课 PPT课件

NaClO在空气中敞口放置可以得到碳酸氢钠和HClO, 该反应的化学方
程式为 NaClO+H2O+CO2═NaHCO3+HClO
。
考点讲练
考点四: 利用化学方程式的简单计算
1.利用化学方程式进行简单计算的依据: 化学方程式表示了反应前后反应物
和生成物的质量关系。
2.利用化学方程式进行简单计算的步骤和方法:
化学(人教版) 九年级 上册
第五单元 化学方程式 单元复习(课件)
01 知识框架 02 考点讲练 03 难点突破 04 趁热打铁
01
知识框架
知识框架
内容 微观解释
应用
计算依据 解题步骤
质 量 守 恒 定 律
利用化学 方程式的
计算
写
最小公倍数法
书
观察法
配
写
步
奇数配偶法
标
骤
查
概念
化 学 方 程 式
2KMnO4
K2MnO4+MnO2+O2↑可以获得一些信息, 下列说法不正确
的是(D )A.KMnO4是反应物 B.“△”表示反应条件为加热
C.K2MnO4是生成物 D.MnO2是催化剂
【巩固训练8】(2020•徐汇区一模)化学方程式2Mg+O2 的正确读法是( C )A.镁加氧气点燃后生成氧化镁
2MgO B.2个
表示反应物、生成物、反应条件
含
表示反应物与生成物的粒子数之比
义
表示反应中各物质的质量比
读法
必须以客观事实为基础
书
写
原
则
必须遵守质量守恒定律
02
考点讲练
考点讲练 考点一: 质量守恒定律 1.内容: 在化学反应里, _参__加__反__应_____的各物质的_质_量__总__和__, 等于反 应后生成的各物质的质量总和。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
不变。 不变。
。
二、化学方程式 1.书写化学方程式的原则: ①必须以 为基础; ②要遵守 定律。等号两 边原子的 和 必须相等。 2.书写步骤: ①写 ②配 ③等 ④注 ⑤标
3.化学方程式表示的意义(提供的信息) 以2H2+O2 2H2O为例:
①质的方面:表示
、
;
关系,
②量的方面:表示各物质间的 即各物质之间的 ; ③微观方面:表示反应物和生成物的
第五单元 化学方程式 复习
复习目标
1.认识质量守恒定律的内容、涵义、
应用。
2.学会正确书写化学方程式,掌握基
本的配平方法。
3.学会利用化学方程式进行简单计算
的步骤、格式。
重点、难点
1.质量守恒定律的应用。
2.正确书写化学方程式。
3.能够正确规范的利用化学方程式 进行简单计算。
情景导入
•
“质量守恒定律”是学好本单元内容的基 础。 “化学方程式”是初中化学入门的三种 重要化学用语之一,掌握了它们才有可能 学好化学,其重要性可想而知。 “利用化学方程式的计算”是从量的方 面来研究化学反应,指导我们进行高效生 产。
例1.下列变化中,是化学变化,不能用质 量守恒定律解释的是( C ) A.水变成水蒸气时,质量保持不变 B.铁生锈时,固体质量增加 C. 蜡烛燃烧后,长度变短
D.高锰酸钾受热分解后,剩余固体质量
减轻
例2.为了研究物质之间反应的质量关系,小李 同学作了如下实验:将6 g镁分别在不同质量的氧气 中充分燃烧,请将生成氧化镁的质量填入下表: 5 10 10 10 根据以上数据,回答: 1 (1)上述4次实验中,第_ 3 _次氧气过量;第_____ 次镁过量。 (2)解释为什么后面几次实验中,虽然氧气的量不 断增加,但是生成的氧化镁的质量却不再增加? 6g镁最多只能反应4g氧气,生成10g氧化镁。氧气 质量增加,生成氧化镁的质量也不会增加。
关系,即各物质之间的
比。
三、利用化学方程式的计算 1.原理: 2.步骤与格式: (1)设(2)写(3)求(4)标(5)列(6) 解(7)答 • 三个要领:①步骤要完整;②格式要规范; ③得数要准确。 • 三个关键:①正确书写化学式;②化学方程 式要配平;③准确计算相对分子质量。
定位提升
智能应用
2
B.2KClO3
MnO2
2KCl+3O2
C.2KClO3 D.2KClO3
MnO2
2KCl+3O2↑ 2KCl+3O2↑
MnO2
6.在“宏观、微观、符号”之间建立联 系,是化学学科特有的思维方式。某化学 反应的微观模拟示意图如右下图所示: 请写出该反应的化学方程式: 2CO + O2 点燃 2CO2 ; 该反应的反应类型是 化合反应 。
光照
4.某有机物6.0g在空气中完全燃烧,共 得到17.6g二氧化碳和10.8g水,则该化合 物的组成元素是( B )
A.一定只含有碳元素
B.一定只含有碳、氢两种元素
C.一定含有碳、氢、氧三种元素
D.一定含有碳、氢元素,可能含有氧元 素
5.氯酸钾制氧气的化学方程式书写正确 的是( D ) MnO A.2KClO3 2KCl+O2↑
2.植物光合作用可表示为CO2+H2O 淀 粉+O2,下列关于说法中正确的是( A ) A.淀粉中一定含C、H两种元素 B.淀粉中一定只含C、H两种元素 C.淀粉中可能含有三种以上的元素 D.淀粉可能是一种单质或一种化合物 3.如图表示四种物质的密闭容器中反应 一段时间后质量的变化,则其化学反应表 达式是( C ) A.a+b→c+d B.c→a+b d d C.a+b c D .C a+b
•
•
交流回顾
一、质量守恒定律: 1.内容: 化学反应的各物质 的 ,等于反应后 的各物 质的 。 2.微观解释:在化学反应前后,原子 的 、 、 均保 持不变(原子的“三不变”)。
3.化学反应前后 (1)一定不变的: 宏观: 微观: 、 (2)一定改变: 宏观: 微观: (3)可能改0.5g二氧化锰与一定量氯酸钾共
热到质量不减少为止,称得残渣质量为
15.4g。
求:(1)生成氧气多少克?
(2)原先氯酸钾的质量是多少克?
解: 生成氯化钾的质量是: 15.4g-0.5g=14.9g 设、生成氧气的质量为x,原先氯酸钾的 质量为y。 MnO 2KClO3 2KCl + 3O2↑ 149 245 96 y x 14.9g
例3.有一中有机化合物23 g在空气中 完全燃烧后共生成44 g二氧化碳和27 g水, 该有机化合物含碳元素的质量是 12g 是有 g。含氢元素的质量是 3g C 、H 、O 元素组成的。 g。它
诊断练习
1.下列变化中,能用质量守恒定律解 释的是( D ) A.5g水受热变成5g水蒸气 B.5g食盐溶解在95g水中,成为100g食 盐溶液 C.100mL水加入100mL酒精,成为体积 小于200mL的溶液 D.木炭燃烧后质量减少
2
149 96 245 149 答:略
14.9g x y 14.9g
X=9.6g y =24.5g
合作愉快!
• • • • • • • • • • • • • • • • • • • • • • • • • • • • • •
31、生活中若没有朋友,就像生活中没有阳光一样。 32、任何业绩的质变,都来自于量变的积累。 33、空想会想出很多绝妙的主意,但却办不成任何事情。 34、不大可能的事也许今天实现,根本不可能的事也许明天会实现。 35、再长的路,一步步也能走完,再短的路,不迈开双脚也无法到达。 36、失败者任其失败,成功者创造成功。 37、世上没有绝望的处境,只有对处境绝望的人。 38、天助自助者,你要你就能。 39、我自信,故我成功;我行,我一定能行。 40、每个人都有潜在的能量,只是很容易:被习惯所掩盖,被时间所迷离,被惰性所消磨。 41、从现在开始,不要未语泪先流。 42、造物之前,必先造人。 43、富人靠资本赚钱,穷人靠知识致富。 44、顾客后还有顾客,服务的开始才是销售的开始。 45、生活犹如万花筒,喜怒哀乐,酸甜苦辣,相依相随,无须过于在意,人生如梦看淡一切,看淡曾经的伤痛,好好珍惜自己、善待自己。 46、有志者自有千计万计,无志者只感千难万难。 47、苟利国家生死以,岂因祸福避趋之。 48、不要等待机会,而要创造机会。 49、如梦醒来,暮色已降,豁然开朗,欣然归家。痴幻也好,感悟也罢,在这青春的飞扬的年华,亦是一份收获。犹思“花开不是为了花落,而是为了更加灿烂。 50、人活着要呼吸。呼者,出一口气;吸者,争一口气。 51、如果我不坚强,那就等着别人来嘲笑。 52、若不给自己设限,则人生中就没有限制你发挥的藩篱。 53、希望是厄运的忠实的姐妹。 54、辛勤的蜜蜂永没有时间悲哀。 55、领导的速度决定团队的效率。 56、成功与不成功之间有时距离很短只要后者再向前几步。 57、任何的限制,都是从自己的内心开始的。 58、伟人所达到并保持着的高处,并不是一飞就到的,而是他们在同伴誉就很难挽回。 59、不要说你不会做!你是个人你就会做! 60、生活本没有导演,但我们每个人都像演员一样,为了合乎剧情而认真地表演着。
