化学反应速率(公开课)
合集下载
化学反应速率公开课

催化剂 温度 浓度(压强) 固体的表面积 反应物的状态
(外因)
起决定作用的因素是反应本身(内因)
你能解释吗?
使用说明: 将原液与水以1:4 的比例混合浸泡 以除去水垢。 若水垢较重,可 以用1:1的比例浸 泡。
你能行!
解释教材49页“从化学
反应速率的角度让化学更好的为我们服 务。例如:你还能多提出一些
快速除水垢的建议吗?
你能解释吗?
保质期:常温下密闭保存6个月
储藏方法: 2-6℃冷藏 保质期:二、三季度48小时
一、四季度72小时
新型食品标签:时间——温度指示器
汇报结束
谢谢大家! 请各位批评指正
化学反应速率公开课
撞车时,约在0.01 s内引 发下列反应:
2NaN3=2Na+3N2
反应在约0.03 s内完成
要是塑料降解的速度快一些,就不会有这么 多白色垃圾了
钟乳石平均生长速度是
每十年增加约1 mm
如何比较化学反应的快慢?
如何准确描述化学反应的快慢?
借鉴 常见的描述 快慢的例子
我们的结论
用单位时间内反应物浓度的减少量或生成 物浓度的增加量来表示
——化学反应速率
试一试
一定条件下,在10 L的密闭容器中进行如 下反应。N2+3H2 2NH3 。10 s后,NH3的物质 的量增加了4 mol。
物质
物质的量变化 (mol)
浓度变化(mol/L)
化学反应速率 mol/(L. ·s)
NH3 4
0.4
0.04
N2+3H2
2NH3
合成氨工业因为对人类生存有重大意义, 分别在1918年,1931年,2007年三次受到 诺贝尔奖的垂青。
化学反应速率公开课一等奖优质课大赛微课获奖课件

第8页
提醒: ①假如压强改变不能引发反应物浓度改变, 则压强对反应速率无影响。 ②对于可逆反应,当外界条件改变时,v(正) 、v(逆)均增大或减小,改变程度可能相同, 也可能不同。 ③比较化学反应速率快慢时,不要忽略原电 池形成能加紧化学反应速率。
第9页
例2 硫代硫酸钠溶液与稀硫酸反应化学方程式为 Na2S2O3+H2SO4===Na2SO4+SO2↑+ S↓+H2O, 下列各组试验中最先出现浑浊是( D)
号
①
0.80
②
1.60
③
0.80
0.20 0.0010 0.20 0.0010 0.40 0.0010
290
145
145
第24页
分析试验数据所得出结论不正确是( ) D
A.增大c(CH3COCH3),v(Br2)增大 B.试验②和③v(Br2)相等 C.增大c(HCl),v(Br2)增大 D.增大c(Br2),v(Br2)增大
第19页
3. 可逆反应2SO2(g)+O2(g) 2SO3(g) DH<0, 在一定条件下达到平衡状态。在t1时刻改变某一条件, 化学反应速率与反应时间关系如右图所表示。下列说 法正确是( ) D
A.维持温度、反应体系容 积不变,t1时充入SO3(g) B.维持压强不变,t1时升 高反应体系温度
C.维持温度、容积不变,t1时充入一定量Ar D.维持温度、压强不变,t1时充入SO3 (g)
【解析】 A.反应在前50 s内平均速率应当 是前50 s内PCl3浓度改变与时间比值,而不是PCl3 物质量改变与时间比值。B.保持其它条件不变, 升高温度,c(PCl3)变大,平衡向正方向移动,阐 明正方向为吸热反应,ΔH>0。C.相同温度下, 起始时向容器中充入1.0molPCl5、0.20molPCl3和 0.20molCl2,应先求平衡常数K为0.025,再求浓 度商(Qc)为0.02,K>Qc,阐明平衡向正反应方 向移动。D.从等效平衡角度,先建立原容器两倍 关系模型,即与原平衡完全等效,再把容器两倍 关系压缩成原容器,则平衡向逆反应方向移动, PCl3转化率应不小于80%。
提醒: ①假如压强改变不能引发反应物浓度改变, 则压强对反应速率无影响。 ②对于可逆反应,当外界条件改变时,v(正) 、v(逆)均增大或减小,改变程度可能相同, 也可能不同。 ③比较化学反应速率快慢时,不要忽略原电 池形成能加紧化学反应速率。
第9页
例2 硫代硫酸钠溶液与稀硫酸反应化学方程式为 Na2S2O3+H2SO4===Na2SO4+SO2↑+ S↓+H2O, 下列各组试验中最先出现浑浊是( D)
号
①
0.80
②
1.60
③
0.80
0.20 0.0010 0.20 0.0010 0.40 0.0010
290
145
145
第24页
分析试验数据所得出结论不正确是( ) D
A.增大c(CH3COCH3),v(Br2)增大 B.试验②和③v(Br2)相等 C.增大c(HCl),v(Br2)增大 D.增大c(Br2),v(Br2)增大
第19页
3. 可逆反应2SO2(g)+O2(g) 2SO3(g) DH<0, 在一定条件下达到平衡状态。在t1时刻改变某一条件, 化学反应速率与反应时间关系如右图所表示。下列说 法正确是( ) D
A.维持温度、反应体系容 积不变,t1时充入SO3(g) B.维持压强不变,t1时升 高反应体系温度
C.维持温度、容积不变,t1时充入一定量Ar D.维持温度、压强不变,t1时充入SO3 (g)
【解析】 A.反应在前50 s内平均速率应当 是前50 s内PCl3浓度改变与时间比值,而不是PCl3 物质量改变与时间比值。B.保持其它条件不变, 升高温度,c(PCl3)变大,平衡向正方向移动,阐 明正方向为吸热反应,ΔH>0。C.相同温度下, 起始时向容器中充入1.0molPCl5、0.20molPCl3和 0.20molCl2,应先求平衡常数K为0.025,再求浓 度商(Qc)为0.02,K>Qc,阐明平衡向正反应方 向移动。D.从等效平衡角度,先建立原容器两倍 关系模型,即与原平衡完全等效,再把容器两倍 关系压缩成原容器,则平衡向逆反应方向移动, PCl3转化率应不小于80%。
公开课化学反应速率和化学平衡图像PPT课件
T2C
T1C
看图技巧: •先拐先平衡,
0 t1
t2 时间
•先平衡则速率快, •速率快则温度高。
1.物质百分含量(w%)——时间(t)曲线
7
mA(g)+nB(g) pC(g)+qD(g)
问题:1 、P1与P2的相对大小
2 、 m+n 与 p+q 的大小
B
?的
物
质 的 量
P2 P1
答 P1 > P2 案 m+n > p+q
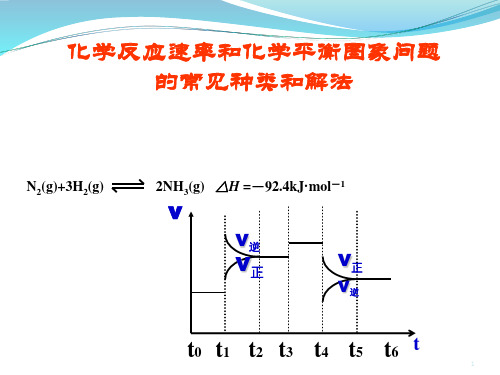
△H =-92.4kJ·mol-1右图是某一时间段中反应速率与反
应进程的曲线关系图,回答下列问题:
(1)处于平衡状态的时间段 ν
是_t0_~__t1_,__t_2~__t_4_,__t5_~__t6。
ν逆
(2)t1、t3、t4时刻体系中分
ν正
ν逆
别是什么条件发生了变化?
ν正
t1:升温; t3:加催化剂; t4:减压
0
时间
8
2.转化率(α)——时间(t)曲线
mA(g)+nB(g) pC(g)+qD(g) ΔH=Q
问题: m+n<p+q还是 m+n<p+q
A
m+n>p+q
的
转
化
1.01106Pa
率
1.01107Pa
0 t1
t2
时间
9
mA(g)+nB(g) pC(g)+qD(g)
A
转
化
1.01107Pa
率
m+n = p+q
时间(t)图
【公开课】化学反应速率++课件高二上学期化学人教版(2019)选择性必修1

②A的转化率:α(A)=
× %
思考交流
二、化学反应速率的计算方法
2. 利用速率之比=化学计量数之比计算
提取表格信息计算化学反应速率
在2 L密闭容器中进行反应:mX(g)+nY(g) ⇌ pZ(g)+qQ(g)。
已知2 min内v(Q)=0.075
(Z)
mol·L-1·min-1,
|Δn(Q)|=0.3 mol
A.A+B
C
B.2A+2B
)
3C
C.3A+B
2C
D.A+3B
2C
D 解析:由 v(B)=3v(A),v(C)=2v(A),得 v(A)∶v(B)∶v(C)
=v(A)∶3v(A)∶2v(A)=1∶3∶2,即 A、B、C 的化学计量数之比为
1∶3∶2,则化学方程式为 A+3B
2C。
3.在 4 L 密闭容器中充入 6 mol A 气体和 5 mol B 气体,在一定
=0.75
5
4L
1 mol
4L
-1
-1 -1
mol·
L ,C 错误;v(B)=
=0.05 mol·
L ·
s ,D 错误。
5s
4.在某一容积为 4 L 的密闭容器中,A、B、C、D 四种物质的物
质的量 n(mol)随时间 t(min)的变化曲线如图所示。
完成下列问题:
(1)该反应的化学方程式为_______________________________。
=(1.0-0.4) ∶(1.0-0.2) ∶(1.2-0) ∶(0.4-0)
=3∶4∶6∶2
二、化学反应速率的计算方法
4. 利用数值比较化学反应速率的大小
【公开课】化学反应速率的表示方法++课件高二上学期化学苏教版(2019)选择性必修1

应的过程和测量反应速率。
用于比色分析的分光分度仪
课堂小结
定义
化
学
反
应
速
率
表示方法
单位
简单计算
测定
例题讲解
1. 对于反应A2+3B2 ⇌ 2AB3以下表示的反应速率中,速率最大的
是( D )
A. v(A2)=0.4 mol·L-1·min-1
B. v(B2)=0.8 mol·L-1·min-1
C. v(AB3)=0.6 mol·L-1·min-1
v(NH3)=
Δt
合作探究
二、化学反应速率的计算 ——“三段式法”
试通过数据来分析化学反应速率、各物质浓度变化量与系数之间的有什么关系?
v(N2)∶v(H2)∶v(NH3) = Δc(N2)∶Δc(H2)∶Δc(NH3) = 1∶3∶2
(单位:mol/L) N2 + 3H2 ⇌ 2NH3
1.5
c(起始浓度) 0.5
D. v(A2)=0.01 mol·L-1·s-1
解析:比较同一反应的快慢,只要比较同一物质的化学反应速率的相
对大小, 单位要统一。
例题讲解
2. 已知某反应中各物质的浓度变化如下:
aA(g) +
bB(g) ⇌ cC(g)
起始浓度/mol·L-1
3.0
1.0
0
2 s末浓度/mol·L-1
1.8
0.6
4. 常用单位:
mol·L-1·s-1 或 mol·L-1·min-1
mol/(L·s) 或 mol/(L·min)
思考交流
例1.
一、化学反应速率及其表示方法
催化剂
室温下,有少量催化剂存在时,发生反应:2H2O2 == 2H2O
用于比色分析的分光分度仪
课堂小结
定义
化
学
反
应
速
率
表示方法
单位
简单计算
测定
例题讲解
1. 对于反应A2+3B2 ⇌ 2AB3以下表示的反应速率中,速率最大的
是( D )
A. v(A2)=0.4 mol·L-1·min-1
B. v(B2)=0.8 mol·L-1·min-1
C. v(AB3)=0.6 mol·L-1·min-1
v(NH3)=
Δt
合作探究
二、化学反应速率的计算 ——“三段式法”
试通过数据来分析化学反应速率、各物质浓度变化量与系数之间的有什么关系?
v(N2)∶v(H2)∶v(NH3) = Δc(N2)∶Δc(H2)∶Δc(NH3) = 1∶3∶2
(单位:mol/L) N2 + 3H2 ⇌ 2NH3
1.5
c(起始浓度) 0.5
D. v(A2)=0.01 mol·L-1·s-1
解析:比较同一反应的快慢,只要比较同一物质的化学反应速率的相
对大小, 单位要统一。
例题讲解
2. 已知某反应中各物质的浓度变化如下:
aA(g) +
bB(g) ⇌ cC(g)
起始浓度/mol·L-1
3.0
1.0
0
2 s末浓度/mol·L-1
1.8
0.6
4. 常用单位:
mol·L-1·s-1 或 mol·L-1·min-1
mol/(L·s) 或 mol/(L·min)
思考交流
例1.
一、化学反应速率及其表示方法
催化剂
室温下,有少量催化剂存在时,发生反应:2H2O2 == 2H2O
化学反应速率的影响因素公开课课件

• (2)①增大 ②增大 ③不变 ④减小
2
考点突破
外界条件对化学反应速率的影响
★★★★
• 1.对反应A+B===AB来说,常温下按以下情况进行反应:
• ①20 mL溶液中含A、B各0.01 mol ②50 mL溶液中含A、B各0.05 mol ③0.1 mol·L-1的A、B溶液各10 mL ④0.5 mol·L-1的A、B溶液各50 mL
|
其他 因素
→反应物间的___接__触__面__积___、光辐照、放射线辐照、超声波等
• 3.速率的理论解释——有效碰撞理论 • (1)有效碰撞:__活__化____分子之间能够引发化学反应的碰撞。 • (2)活化分子:能够发生__有__效____碰撞的分子。 • (3)活化能:
• 图___中__:E__E1-_1为,E2_反__应__热_正_为反___应___的____活___化____能__________,_(注使:用E催2为化逆剂反时应的的活活化化能能E为3)。
控制变量法探究影响化学反应速率的因素
★★★★
• 4.(2017·浙江卷,21)对水样中溶质M的分解速率影响因素进行研究。 在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实 验数据见表。下列说法不正确的是( )
水样
Ⅰ(pH=2) Ⅱ(pH=4) Ⅲ(pH=4) Ⅳ(pH=4,含Cu2+)
• (2)一定温度下,反应N2(g)+O2(g)===2NO(g)在密闭容器中进行。 • ①缩小体积使压强增大:______________;
• ②恒容充入N2:______________; • ③恒容充入He:______________;
• ④恒压充入He:______________。
2
考点突破
外界条件对化学反应速率的影响
★★★★
• 1.对反应A+B===AB来说,常温下按以下情况进行反应:
• ①20 mL溶液中含A、B各0.01 mol ②50 mL溶液中含A、B各0.05 mol ③0.1 mol·L-1的A、B溶液各10 mL ④0.5 mol·L-1的A、B溶液各50 mL
|
其他 因素
→反应物间的___接__触__面__积___、光辐照、放射线辐照、超声波等
• 3.速率的理论解释——有效碰撞理论 • (1)有效碰撞:__活__化____分子之间能够引发化学反应的碰撞。 • (2)活化分子:能够发生__有__效____碰撞的分子。 • (3)活化能:
• 图___中__:E__E1-_1为,E2_反__应__热_正_为反___应___的____活___化____能__________,_(注使:用E催2为化逆剂反时应的的活活化化能能E为3)。
控制变量法探究影响化学反应速率的因素
★★★★
• 4.(2017·浙江卷,21)对水样中溶质M的分解速率影响因素进行研究。 在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实 验数据见表。下列说法不正确的是( )
水样
Ⅰ(pH=2) Ⅱ(pH=4) Ⅲ(pH=4) Ⅳ(pH=4,含Cu2+)
• (2)一定温度下,反应N2(g)+O2(g)===2NO(g)在密闭容器中进行。 • ①缩小体积使压强增大:______________;
• ②恒容充入N2:______________; • ③恒容充入He:______________;
• ④恒压充入He:______________。
全国公开课一等奖初中化学《化学反应速率》课件

反应速率为何有大小之分?
什么影响了 化学反应的速率?
二、实 验 探 究 “影响化学反应速率的因素”
• 影响化学反应速率的因素有哪些? • 这些因素是怎么影响速率大小的?
• 要求: • (1)实验完成时限: 14分钟(4分钟讨论和分
工);(2)边实验、边记录
• 待选试剂:
• MnO2固体、 5%H2O2溶液、 稀盐酸、 大理石、CaCO3粉末、钠、冰水混合物、 讲台上提供开水 、蒸馏水
(2)实验室用的氯水实验效果不好,可能是什么原因? 请帮实验老师想办法解决。
解决问题
1、 NO和CO都是汽车尾气中的有害物质, 它们能缓慢地起反应,生成无害的N2和 CO2,你能想办法加快它的反应速率吗?
解决问题
(2)威斯威科市是什么发生了爆炸?要知道,它是一个 仅有数万人口的小城市,此地既没有军队的弹药仓库, 也没有易燃易爆的工厂啊! 惊魂未定的人们将眼光扫向了爆炸声传来的方向。 啊!那里升腾起了十多层楼高的火柱,而且,有大朵 蘑菇状的烟云正在升起。被此情景惊骇的人们更加疑 惑不解了:那里是一座贮存面粉的粮库啊,面粉怎么 可能发生爆炸呢?同学们能想办法帮他们预防吗?
哈哈:化学反应
由我控制 为所欲为?
有的化学反应要加快,如炼钢、合成橡胶等。而 有的反应要减慢,如钢铁生锈、橡胶老化。这对提高 生产效率、减少浪费、发展生产,都有好处。
硫酸的工业
选中所有按钮
净
化
冷却
作业
1、完成实验探究表
2、请你提出方案解决以下问题: ( 1 ) 把 下 列 四 种 X 溶 液 分 别 加 入 四 个 盛 有 10ml ,
2mol/L盐酸的烧杯中,均加水稀释到50mL,此时,X 和盐酸缓慢地进行反应,其中反应最快的是( ) A. 10℃ 20mL 3mol/L 的 X 溶 液 B. 20℃ 30mL 2molL 的 X 溶 液 C. 10℃ 10mL 4mol/L 的 X 溶 液 D. 10℃ 10mL 2mol/L的X溶液
什么影响了 化学反应的速率?
二、实 验 探 究 “影响化学反应速率的因素”
• 影响化学反应速率的因素有哪些? • 这些因素是怎么影响速率大小的?
• 要求: • (1)实验完成时限: 14分钟(4分钟讨论和分
工);(2)边实验、边记录
• 待选试剂:
• MnO2固体、 5%H2O2溶液、 稀盐酸、 大理石、CaCO3粉末、钠、冰水混合物、 讲台上提供开水 、蒸馏水
(2)实验室用的氯水实验效果不好,可能是什么原因? 请帮实验老师想办法解决。
解决问题
1、 NO和CO都是汽车尾气中的有害物质, 它们能缓慢地起反应,生成无害的N2和 CO2,你能想办法加快它的反应速率吗?
解决问题
(2)威斯威科市是什么发生了爆炸?要知道,它是一个 仅有数万人口的小城市,此地既没有军队的弹药仓库, 也没有易燃易爆的工厂啊! 惊魂未定的人们将眼光扫向了爆炸声传来的方向。 啊!那里升腾起了十多层楼高的火柱,而且,有大朵 蘑菇状的烟云正在升起。被此情景惊骇的人们更加疑 惑不解了:那里是一座贮存面粉的粮库啊,面粉怎么 可能发生爆炸呢?同学们能想办法帮他们预防吗?
哈哈:化学反应
由我控制 为所欲为?
有的化学反应要加快,如炼钢、合成橡胶等。而 有的反应要减慢,如钢铁生锈、橡胶老化。这对提高 生产效率、减少浪费、发展生产,都有好处。
硫酸的工业
选中所有按钮
净
化
冷却
作业
1、完成实验探究表
2、请你提出方案解决以下问题: ( 1 ) 把 下 列 四 种 X 溶 液 分 别 加 入 四 个 盛 有 10ml ,
2mol/L盐酸的烧杯中,均加水稀释到50mL,此时,X 和盐酸缓慢地进行反应,其中反应最快的是( ) A. 10℃ 20mL 3mol/L 的 X 溶 液 B. 20℃ 30mL 2molL 的 X 溶 液 C. 10℃ 10mL 4mol/L 的 X 溶 液 D. 10℃ 10mL 2mol/L的X溶液
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
你知道吗
氢气能在氯气中安静地燃烧,氢气和氯 气的混合气体光照时为什么会发生爆炸?
结论5: 增大反应物的接触面积,
可以加快反应速率。
问题解决 2. 碳酸钙与稀盐酸反应生成的CO2气体体积随 时间变化的曲线。请分析讨论以下问题。
(1)在0~t1、t1~t2、 t2~t3各相同的时间段 里,收集到气体最多的 t1-t2 时间段,反 是_______ 应速率最大的是 t1___化剂能显著地增大反应速率
不同催化剂的催化效果不同。
[实验2]取三支试管,各加入2mL 2%、6%、 12%的过氧化氢溶液,分别滴入5~6滴氯化铁 溶液,观察气泡生成的快慢。
结论2:
其他条件相同时,反 应物浓度越大,反应 速率越大。
[实验3]将实验2的三只试管,用水浴加热, 观察发生的变化。
0.04
①以N2、H2、NH3表示的反应速率各是多少? ②根据①的计算结果你能得出什么结论?
活动与探究
同一反应的速率可能 受哪些因素影响?
[实验1]取两支试管,各加入5mL 4%的过氧化 氢溶液,滴入几滴洗涤剂,用药匙往其中一支试 管中加入少量二氧化锰粉末,观察发生的变化。 再往另外一支试管中,加入几滴氯化铁溶液, 观察并比较两支试管中的变化。
生成物浓度的增加来表示。
整理与归纳
(2)表达式:
△c v = ——— △t
(3)常用单位: mol· (L· min)-1或 mol· (L· s)-1
二、化学反应速率的影响因素 v 温度 浓度 催化剂 压强 接触面积
v
一般能显著增大反应速率 v v
反应物的性质(决定因素)
与化学反应速率相关的诺贝尔化学奖
(2)试分析三个时间段里,反应速率不同 的可能原因(该反应是放热反应)。
t1-t2时间段,温度升高 是影响化学反应速率的 主要因素; t2-t3时间段,浓度减小 是影响化学反应速率的 主要因素; (3)在t4后,为什么收集到 的气体的体积不再增加?
一、化学反应速率 (1)表示方法:用单位时间内反应物浓度的减少或
爆炸
煤的形成
观察与思考
观察并比较CO2气体放出的快慢 。 化学反应速率如何表示呢?
化学反应速率
(1)表示方法: 单位时间 化学反应速率可用_________________ 内 生成物浓度的增加 反应物浓度的减少 _________________或______________ __来表示。
1909年 W. 奥斯特瓦尔德(德国人) 从事催化作用、化学平衡 以及反应速度的研究 1929年 A. 哈登(英国),冯· 奥伊 阐明了糖发酵过程和酶的 勒 – 歇尔平(瑞典) 作用 1963年 K. 齐格勒(德国)、G. 纳 发现了利用新型催化剂进 行聚合的方法,并从事这 塔(意大利) 方面的基础研究 发明了测定快速化学反应 1967年 R.G.W.诺里会、G. 波特 (英国) M. 艾根(德国) 的技术 1997年 P.B.博耶(美国)、J.E.沃 发现人体细胞内负责储藏 克尔(英国)、J.C.斯科(丹麦) 转移能量的离子传输酶 2001年 威廉· 诺尔斯、巴里· 夏普莱 在“手性催化氢化反应” 斯(美国) 、野依良治(日本) 领域取得成就
结论3:
其他条件相同时,温度 越高,反应速率越大。
压强
结论4:
有气体参 加的反应
增大 压强
反应物的 浓度增大
反应速 率增大
练习2:增大压强,能使下列反应速率 加快的是( BC) A.Na2SO4溶液与BaCl2溶液反应 B.CO和水蒸气在一定条件下反应生 成CO2和H2
C.将CO2通人石灰水中 D.Na2O溶于水
(2)表达式: △c v = ——— △t 平均速率, 无负值!
(3)常用单位:mol· (L· min)-1或mol· (L· s)-1
练习1、合成氨工业中发生如下反应:
N2 + 3H2 == 2NH3
测得反应进行10min时,各物质的浓度变化如下: C 开始时 C 10min 末 (mol· L-1) (mol· L-1) N2 H2 NH3 1 2 0 0.8 1.4 0.4 V(x) (mol· L-1· min-1) 0.02 0.06
