常用气体的基本物理化学参数
SF6气体

当SF6气体中含有水分时会对电气设备造成 以下危害: (1)在水分存在下,SF6分解产物发生水解反 应,阻碍了SF6分解产物的复合,降低了SF6的介质 恢复强度,从而降低设备的绝缘特性; (2)加剧了低氟化物水解和金属氟化物的分 解。生成的氟化亚硫酸剧毒,对人体有很大的危害, HF还会腐蚀电极和绝缘材料; (3)在设备内结露。由于气体中的水分以水 蒸气的形式存在,当温度降低时,可能在设备内部 结露,附着在设备表面如电极、绝缘子表面等,容 易产生沿面放电(闪络)而引起事故。
SF6电器设备现场水分检测时注意事项: 选合适的管材:测量管路材质应采用不锈钢、厚壁 聚四氟乙烯管,不得使用乳胶管和橡胶管。 管路尽量短、接头少、密封严格; 正确使用各类仪器; 认真准确记录; 尽量在20℃,101325Pa下测定,环境湿度不可 太大; 使用的仪器必须在检定期内。
SF6电器设备现场水分检测测试误差产生 的原因及控制方法
温度的影响
由于露点仪是通过冷却镜面使水蒸气凝露来测量气体湿度的,环境温度 的高低必然影响到制冷的效果。对于大多数测量下限为-60℃的露点仪,如 DP9、DP19,在炎热的夏季环境温度很高时测量湿度较低的气体,有可能出 现仪器的制冷量达不到要求的情况,即镜面温度已无法再下降,但却始终没 有结露。这种情况下,根据理论分析和DP系列说明书的推荐,可采用提高测 量室内的气体压力,从而升高露点,最后再进行换算的方法。但实践证明, 该法并不总是可行,大多数情况下仪器示值反复振荡,不能得到稳定值。其 原因可能是因为升高压力后,SF6气体液化温度随之上升,测量过程中SF6气 体在镜面上液化从而干扰测定。 在露点仪受高温影响无法正常工作的情况下,目前最好的办法是避开高温天 气,如趁早晚较凉爽时进行测试,或换用其它类型的测试仪器。
标准气体常数

标准气体常数标准气体常数是描述气体物理性质的一个重要物理常数,通常用符号R表示。
在理想气体状态方程中,标准气体常数R是一个关键参数,它与气体的摩尔质量和摩尔体积有关。
本文将对标准气体常数的定义、计算方法以及在物理学和化学中的应用进行详细介绍。
1. 标准气体常数的定义。
标准气体常数R是指在标准状态下,1摩尔理想气体的压强与体积之比,通常用J/(mol·K)或cal/(mol·K)作为单位。
在国际单位制中,标准气体常数的数值约为8.314 J/(mol·K)。
在化学反应中,标准气体常数R可以用来计算气体的压强、体积和温度之间的关系,是气体物理性质研究的重要基础参数。
2. 标准气体常数的计算方法。
标准气体常数R的数值可以通过测定气体的压强、体积和温度,并应用理想气体状态方程进行计算。
理想气体状态方程可以表示为PV=nRT,其中P为气体的压强,V为气体的体积,n为气体的摩尔数,T为气体的温度,R为标准气体常数。
通过测定实验数据,可以利用理想气体状态方程计算得到标准气体常数R的数值。
3. 标准气体常数的应用。
标准气体常数R在物理学和化学中有着广泛的应用。
在热力学和动力学的研究中,标准气体常数R可以用来描述气体的热力学性质,如内能、焓、熵等。
在化学反应动力学中,标准气体常数R可以用来计算气体反应速率常数,从而推导出反应速率方程。
此外,在工程领域中,标准气体常数R也被广泛应用于气体的工艺设计和控制中。
4. 结语。
标准气体常数是描述气体物理性质的重要物理常数,它在理想气体状态方程中起着关键作用。
本文对标准气体常数的定义、计算方法以及在物理学和化学中的应用进行了简要介绍,希望能够对读者有所帮助。
在今后的学习和工作中,我们应该深入理解标准气体常数的概念和意义,进一步探索其在科学研究和工程实践中的应用价值。
烟气空气参数
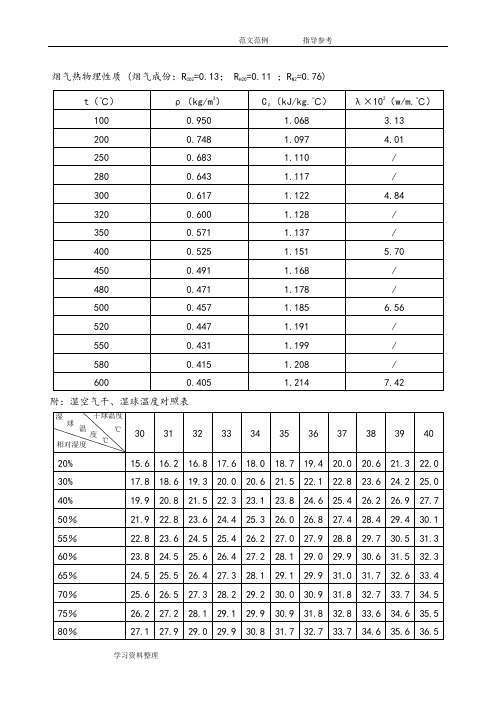
烟气热物理性质 (烟气成份:RCO2=0.13; RH2O=0.11 ;RN2=0.76)附:湿空气干、湿球温度对照表水的汽化热为40.8千焦/摩尔,相当于2260千焦/千克天然气是一种无毒无色无味的气体,其主要成份是甲烷,天然气的低热值为34.91MJ/Nm3。
天然气(甲烷)的密度在0℃,101.352Kpa时为0.7174Kg/Nm3,相对密度(设空气的密度为1)为0.5548,天然气约比空气轻一半,完全燃烧时,需要大量的空气助燃。
1立方米天然气完全燃烧大约需要9.52立方米空气。
如果燃烧不完全,会产生有毒气体一氧化碳,因而在燃气器具使用场所,必须保持空气流通。
在封闭空间内,天然气与空气混合后易燃、易爆、当空气中的天然气浓度达到5-15%时,遇到明火就会爆炸,因而一定要防止泄漏。
天然气的密度定义为单位体积气体的质量。
在标准状况(101325Pa,15.55℃)下,天然气中主要烃类成分的密度为0.6773Kg/m3(甲烷)-3.0454Kg/m3(戊烷)。
天然气混合物的密度一般为0.7-0.75Kg/m3,其中石油伴生气特别是油溶气的密度最高可达1.5Kg/m3甚至更大些。
天然气的密度随重烃含量尤其是高碳数的重烃气含量增加而增大,亦随CO2和H2S的含量增加而增大。
天然气的相对密度是指在相同温度、压力条件下天然气密度与空气密度的比值,或者说在相同温度、压力下同体积天然气与空气质量之比。
天然气烃类主要成分的相对密度为0.5539(甲烷)-2.4911(戊烷),天然气混合物一般在0.56-1.0之间,亦随重烃及CO2和H2S的含量增加而增大。
在标准状况下,天然气的比重与密度、相对比重与相对密度在数值上完全相同。
天然气中常见组分的密度和相对密度值如表所示。
天然气在地下的密度随温度的增加而减小,随压力的增加而加大。
但鉴于天然气的压缩性极强,在气藏中,天然气的体积可缩小到地表体积的1/200-1/300,压力效应远大于温度效应,因此地下天然气的密度远大于地表温压下的密度,一般可达150-250Kg/m3;凝析气的密度最大可达225-450Kg/m3。
LNG的物理化学特性

LNG的物理化学特性LLNG 的基本性质的基本性质1.LNG的物理性质主要成分:甲烷,临界温度:190.58K在常温下,不能通过加压将其液化,而是经过预处理,脱除重烃、硫化物、二氧化碳和水等杂质后,深冷到-162 O C,实现液化。
主要物理性质如表1-1所示:无色透明41.5~45.3 430~460 约-162°C 0.60~0.70 颜色高热值(MJ/m 3 )液体密度(g/l)(沸点下)沸点/°C (常压)气体相对密度表1-1 4 4 . LNG . LNG 的基本性质的基本性质2. 典型的LNG组成(摩尔分数)/% N 2 CH 4 C 2 H 6 C 3 H 8 I-C 4 H 10 N-C 4 H 10 C 5 H 12 摩尔质量/(kg/mol)泡点温度/ o C 密度/(kg/m 3 )LNG 的基本性质的基本性质3. LNG的性质特点温度低在大气压力下,LNG沸点都在-162°C左右。
液态与气态密度比大1体积液化天然气的密度大约是1体积气态天然气的600倍,即1体积LNG大致转化为600体积的气体。
可燃性一般环境条件下,天然气和空气混合的云团中,天然气含量在5%~15%(体积)范围内可以引起着火,其最低可燃下限(LEL)为4%LNG 的基本性质4. LNG的安全特性1)燃烧特性燃烧范围:5%~15%,即体积分数低于5%和高于15%都不会燃烧;自燃温度:可燃气体与空气混合物,在没有火源的情况下,达到某一温度后,能够自动点燃着火的最低温度称为自燃温度。
甲烷性质比较稳定,在大气压力条件下,纯甲烷的平均自燃温度为650°C。
以甲烷为主要成分的天然气自燃温度较高,LNG的自燃温度随着组份的变化而变化。
燃烧速度:是火焰在空气-燃气的混合物中的传递速度。
天然气的燃烧速度较低,其最高燃烧速度只有0.3m/s。
LNG 的基本性质的基本性质低温特性隔热保冷:LNG系统的保冷隔热材料应满足导热系数低,密度低,吸湿率和吸水率小,抗冻性强,并在低温下不开裂,耐火性好,无气味,不易霉烂,对人体无害,机械强度高,经久耐用,价格低廉,方便施工等。
物理化学第一章气体

17
18
第一章 气体的pVT关系
1.了解理想气体的微观模型,能熟练使用理 想气体的状态方程 2.理解气体的液化和临界参数 3.了解真实气体的状态方程及对应状态原理 与压缩因子图 重点: 理想气体的状态方程、微观模型、 临界参数。 难点:对应状态原理与压缩因子图。
1
问题:1.理想气体的状态方程式主要有哪些 应用? 2.何为理想气体混合物?在理想气体混合物中 某组分的分压是如何定义的?其物理意义如何,如 何计算? 3.何为纯液体的饱和蒸气压?它与哪些因素
有关?
2
3
1.分子之间无相互作用力 2.分子本身不占有体积
状态方程 理想气体 分压及分体积定律 气体 液化及临界现象 实际气体 对应状态原理及压缩因子图 状态方程
如何变成理 想气体?
4
1.1 理想气体的状态方程
pV nRT
导出公式:
M mRT / pV
pM / RT
例:六氟化铀UF6是密度很大的一种气体,求在
适合条件:理想气体或低压下的真实气体
6
1.分子之间无相互作用力 2.分子本身不占有体积
状态方程 理想气体 分压及分体积定律 气体
液化及临界现象
实际气体 状态方程 对应状态原理及压缩因子图
7
1.3 气体的液化及临界参数
饱和蒸气压:指定温度下,密闭系统中某物质处 于气液平衡共存时其蒸气的压力。
临界参数:
9
b.求真实气体的压缩因子Z
真实气体的pVT关系: 对比参数: 对比压力: pr =p/pc
pVm ZRT
对比温度: Tr =T/Tc
对比体积: Vr =Vm/ Vm,c
第一章 气体pTV的关系 物理化学资料

现
nA=1
kmol,故得:
nB
pB pA
nA
3.167 101 .198
1000
31.30mol
(2) 设所求初始体积为V
V nRT nART nBRT 24.65m3
p pA pB
15
4. 阿马加定律
•数学表达式: V VB*
B
证: V nRT / p ( nB )RT / p
He CH4
2500
2000
15 100000 2 4 60 80 1001
3000K下N0 2,He,CH4的pVm2 –p等温2线5
N2
H2 问题:
CH4
CO2
N2、H2、 CH4、CO2何者
1.000
TB最高、最低?
p/MPa
26
2. 范德华方程
Van der Waals J D,1837—1923 27
( p a Vm2 )(Vm b) RT
范德华方程
29
内压:
压力修正项a Vm2
p内
1
Vm2
1 r6
pi.g. p a Vm2
p内 a Vm2
分子间引力愈大,a 愈大,愈易液化
• 体积修正项
30
例.试写出实际气体的范德华方程
。
2020/7/5
31
(2)范德华常数与临界参数的关系
p V TC 0, 2 p V 2 TC 0
水蒸气H2O(g),在平衡条件下,缓慢的压缩到压力
p=(
)kPa时,才可能有水滴H2O(l)出现。
2020/7/5
24
第四节 真实气体状态方程
1.真实气体的pVm – p图及波义尔温度
物理化学01气体

,
§1-1 理想气体的状态方程
气体理论的三位奠基者:
• 玻义尔 (1627 — 1691) Born in Ireland
00-7-22
•盖· 吕萨克 (1778 — 1850) Frenchman
• 阿伏加德罗 (1776 —1856) an Italian
3
1. 理想气体状态方程
波义尔定律 pV = 常数 (n, T 恒定)
pV (实际) nRT
Z def pV pVm (实) Vm (实) nRT RT Vm (理)
压缩因子Z:
Z 的大小描述了实际气体的关系偏离理想行为的情况:
Z 1, 理想气体; Z 1, Vm (实) Vm (理), 易压缩实际气体;
00-7-22
Z 1, Vm (实) Vm (理), 难压缩实际气体.
13
0.0323 y( Ar) 0.0094 3.452 2.694 y( N 2 ) 0.7804 3.452
00-7-22
(2)各组分气体的分压为
p( N 2 ) y( N 2 ) p 0.7804101.3 79.05kPa
p(O2 ) y(O2 ) p 0.2099101.3 21.26kPa
VB / V nB / n yB
而对非理想气体, 此二式不能成立. 应注意分压力和分体积的定义上的不同.
00-7-22 12
例:若有一空气样品,组成(质量%)如下:N275.47%,O223.19%, Ar1.29%,CO20.05%。(1)试用体积分数表示此空气的组成;(2) 计算25℃及101.325kPa下,此空气各组分气体的分压。设空气可看成理 想气体的混合物。 解:(1)体积分数即各气体的摩尔分数。设有100g空气,则
理想气体(物理化学)

将这三个定律相结合,经过一定的数据处理 参看第三版 参看第三版), 将这三个定律相结合,经过一定的数据处理(参看第三版 ,可 得到理想气体状态方程: 得到理想气体状态方程 pV=nRT 或 pVm=RT 或
m pV = RT M
(R为摩尔气体常数 为摩尔气体常数) 为摩尔气体常数 为气体的摩尔体积) (Vm为气体的摩尔体积) 为气体的相对摩尔质量) (M为气体的相对摩尔质量) 为气体的相对摩尔质量
即混合气的平均摩尔质量是其中所有各组分的摩尔分数与 其摩尔质量乘积之和。
2. 道尔顿定律与分压力 道尔顿定律与分压力(part pressure) 气体的压力是分子对容器器壁碰撞的结果,混合气的压力是 构成该混合气的各组分对压力所作贡献之和, 因此在热力学计 算中,人们提出了一个分压力的概念: 分压力pB:混合气中任一组分对压力所作贡献。 p = ∑ pB 混合气总压力 B 且有 pB = y B p 或 y B =
物理量 ,如上图及下表 如上图及下表: 如上图及下表 单位
p/MPa
…………
………… pVm/J . mol-1 ↑ ↑ 表头中物理量的表示: 物理量 表中均为纯数
单位
低压气体可近似视作为理想气体。 ⑶ 低压气体可近似视作为理想气体。 即低压气体可近似使用理想气体状态方程计算p、T、V 关系。
理想气体的微观模型( ) 二 理想气体的微观模型(p9)
按照分子运动论,理想气体微观模型应该是: 1. 分子间无作用力; 分子间无作用力; 2. 分子本身没有体积 3. 分子不停顿地作无规则的热运动 分子不停顿地作无规则的热运动。 低压气体,气体密度小,分子间距离大,分子间作用 力及分子本身的体积均可忽略,故可当作理想气体处 理。
低压混合气(理想气体混合物) 三 低压混合气(理想气体混合物)(ideal gas mixture)(p11) ( ) 在工业生产中所遇到的气体在很多情况下为混合气体,实 验表明,低压混合气也服从理想气体状态方程,即低压混合气 可视为理想混合气处理
天然气物理化学性质

海底天然气物理化学性质第一节海底天然气组成表示法一、海底天然气组成海底天然气是由多种可燃和不可燃的气体组成的混合气体。
以低分子饱和烃类气体为主,并含有少量非烃类气体。
在烃类气体中,甲烷(CH4)占绝大部分,乙烷(C2H6)、丙烷(C3H8)、丁烷(C4H10)和戊烷(C5H12)含量不多,庚烷以上(C5+)烷烃含量极少。
另外,所含的少量非烃类气体一般有氮气(N2)、二氧化碳(CO2)、氢气(H2)、硫化氢(H2S)和水汽(H2O)以及微量的惰性气体。
由于海底天然气是多种气态组分不同比例的混合物,所以也像石油那样,其物理性质变化很大,它的主要物理性质见下表。
海底天然气中主要成分的物理化学性质二、海底天然气容积分数和摩尔分数定义混合物中各组分的容积为V i ,总容积V ;摩尔分数y i :i 组分的摩尔数n i 与混合物总摩尔数n 的比值。
∑=='i i i i V VV V y ; 1='∑i y ;∑==ii i i n n n n y ; 1=∑i y 由分压定律,存在P i V= n i R M T ;P i V=n R M T 由分容定律,存在PV i = n i R M T ;PV=n R M Tppn n y i i i ==; i i i i y n n V V y ==='结论:对于理想气体混合物,任意组分的摩尔分数可以用该组分的分压与混合物总压的比值表示,且摩尔分数与容积分数相等。
三、海底天然气分子量标准状态下,1kmol 天然气的质量定义为天然气的平均分子量,简称分子量。
∑=i i M y M 四、海底天然气密度(1)平均密度混合气体密度指单位体积混合气体的质量。
按下面公式计算: 0℃标准状态 ∑=i i M y 414.221ρ; 20℃标准状态 ∑=i i M y 055.241ρ 任意温度与压力下 i i i i V y M y ∑∑=/ρ (2)相对密度在标准状态下,气体的密度与干空气的密度之比称为相对密度。
物理化学各章小结

第一章 气体本章小结1.理想气体状态方程 pV =nRT pV m =RT pV =(m /M ) RT气体的密度 ρ =m /V =pM /(RT ) 2. 道尔顿分压定律 B p p =∑B B n RTp V =BB p x p= B B p x p = 3. 实际气体的液化和临界点实际气体在临界温度以下通过加压可以被液化。
理想气体则不能。
临界温度T c 是实际气体能被液化的最高温度,在临界温度时使气体液化所需要的最小压力叫临界压力p c 。
在描述实际气体液化的p -V 图上,临界温度和临界压力所对应的点称为临界点。
0cT p V ∂⎛⎫= ⎪∂⎝⎭ 220cT p V ⎛⎫∂= ⎪∂⎝⎭ 临界温度和临界压力时所对应的体积称为临界摩尔体积V m,c 。
临界温度、临界压力和临界摩尔体积统称为临界参数,各种实际气体的临界参数可以在各类物理化学数据手册中查得。
4. 实际气体的范德华方程范德华研究了实际气体与理想气体产生偏差的两个因素-分子本身占有体积和分子间存在作用力,由此引入两个校正项,得适用于1mol 气体的范德华方程为()2m m a p V b RT V ⎛⎫+-= ⎪⎝⎭适用于n mol 气体的范德华方程为()22an p V nb nRT V ⎛⎫+-= ⎪⎝⎭公式中的a 和b 称为范德华常数,可以通过气体的临界参数计算2227,648c c ccR T RT a b p p == 符合范德华方程的气体称为范德华气体,范德华气体的玻意尔温度为,00B m B T p pV a T p Rb →⎛⎫∂=⇒=⎪∂⎝⎭5. 压缩因子与压缩因子图m pV pV Z RT nRT ==Z 称为压缩因子,Z >1,气体较难压缩,Z <1,气体较易压缩,Z =1,还原为理想气体。
Z 值可由对比温度(/c T T τ=)和对比压力(/c p p π=)通过压缩因子图查得。
查得Z 值后可用上述方程求算实际气体的p -V -T 。
常用气体的基本物理化学参数

常用气体的基本物理化学参数1.氧气(O2)- 分子量:32 g/mol-密度:1.429g/L-沸点:-183°C-熔点:-218.8°C-溶解度:在水中溶解度较低,随温度的升高而降低-导电性:非电解质- 热容:21 J/(mol·K)2.二氧化碳(CO2)- 分子量:44 g/mol-密度:1.977g/L-沸点:-78.5°C-熔点:-57°C-溶解度:在水中溶解度较高,随温度升高而降低-导电性:非电解质- 热容:37 J/(mol·K)3.氮气(N2)- 分子量:28 g/mol-密度:1.165g/L-沸点:-195.8°C-熔点:-210°C-溶解度:在水中溶解度较低-导电性:非电解质- 热容:29 J/(mol·K)4.氢气(H2)- 分子量:2 g/mol-密度:0.09g/L-沸点:-252.8°C-熔点:-259.2°C-溶解度:在水中溶解度较低-导电性:非电解质- 热容:14 J/(mol·K)5.氨气(NH3)- 分子量:17 g/mol-密度:0.73g/L-沸点:-33.34°C-熔点:-77.73°C-溶解度:在水中溶解度较高-导电性:能部分电离为电解质- 热容:35 J/(mol·K)6.甲烷(CH4)- 分子量:16 g/mol-密度:0.66g/L-沸点:-161.5°C-熔点:-182.5°C-溶解度:在水中溶解度较低-导电性:非电解质- 热容:35 J/(mol·K)以上只是一些常见气体的基本物理化学参数,不同的气体在不同的条件下,这些参数可能会有所变化。
这些参数在化学工业和实验室研究中非常重要,对于研究气体的性质和反应有着重要的指导作用。
认识常见的气体与气体的性质

认识常见的气体与气体的性质气体是一种在常温常压下呈现气态的物质,具有多种特性和性质。
本文将介绍一些常见的气体以及它们的性质。
一、氮气(N2)氮气是空气中最主要的组成部分之一,占据了空气的78%。
氮气呈无色、无味、无臭的状态,具有不易燃烧、低活性的特点。
由于其稳定性高,氮气常被用作保护气体、制造氮气气氛以及用于冷冻食品保存等领域。
二、氧气(O2)氧气是空气中的另一个重要组成成分,占据了空气的约21%。
氧气是一种无色无味的气体,能够支持燃烧并维持物质的燃烧过程。
氧气在生物体内参与新陈代谢过程,是生命的必需气体。
此外,氧气还被广泛用于医疗、焊接和氧气割等领域。
三、二氧化碳(CO2)二氧化碳是一种无色的气体,是空气中的微量成分。
二氧化碳是许多化学反应的产物,也是人类活动(如燃烧化石燃料和工业过程)的副产品。
它是温室气体之一,能够吸收太阳辐射的一部分并阻止其散失,使地球保持一定的温度。
四、氢气(H2)氢气是一种轻质、无色、无味、无毒的气体。
它是宇宙中最丰富的元素,也是最轻的元素。
氢气具有高热导率和高燃烧性,通常用作燃料或原料来产生能源。
氢气还可以用于氢气球、氢气火箭和氢气燃料电池等领域。
五、氦气(He)氦气是一种无色、无味、无毒的气体,是宇宙中第二丰富的元素。
氦气的熔点和沸点都非常低,因此常以液体形式存在。
氦气广泛用于充气球和飞船、制冷机械以及核反应堆等领域。
六、氯气(Cl2)氯气是一种黄绿色的气体,具有刺激性气味。
氯气可溶于水,形成盐酸。
氯气有强烈的氧化性,因此常用于消毒和漂白剂,也用于制造PVC 材料等。
七、氨气(NH3)氨气是一种无色气体,具有刺激性气味。
氨气有强烈的碱性,能够与酸中和生成盐。
氨气主要用于农业中作为植物营养物质的来源,也用于制备肥料、催化剂等。
总结:以上所述的气体只是常见气体中的一小部分,每种气体都有其独特的性质和广泛的应用领域。
通过深入了解不同气体的性质,我们能够更好地利用它们,满足生活和工业中的各种需求。
烷烃环烷烃的物理化学性质

F2 :反应过分剧烈、较难控制 Cl2 :正常(常温下可发生反应) Br2 :稍慢(加热下可发生反应) I2 :不反应。即使反应, 其逆反应易进行
主要讨论的内容
甲烷的卤代反应机理(反应机制,反应历程) (Reaction Machanism)
什么是反应机理: 反应机理是对反应过程的详细描述,应解释以下问题:
自由基的稳定性与不同类型H的反应活性
考虑反应的决速步骤
自由基生成的相对速度决定反应的选择性
自由基稳定性:
自由基的相对稳定性决定反应的选择性
R-H的键离解能(DH)
01
2o 自由基
02
较易生成
03
3o 自由基
04
较易生成
05
自由基的相对稳定性:3o > 2o > 1o
06
1o 自由基
07
较难生成
08
1o 自由基
09
较难生成
10
键离解能(DH)
不同类型自由基的相对稳定性
溴代反应的选择性
选择性:2o H : 1o H = 82 : 1
选择性:3o H : 1o H = 1600 : 1
溴代选择性(127oC): 3o H : 2o H : 1o H = 1600 : 82 : 1
由下列指定的化合物制备相应的卤代物,用Cl2还是Br2?为什么?
04
烷烃溶于有机溶剂中,不溶于水。
05
"相似者相溶"--普遍适用的经验规律。
06
是极性分子,烷烃是非极性分子,很难溶于水中。
07
折光率nD20 又称折光指数、折射率,是光在空气中速度与在液体中速度之比: nD20=C光空气/C光液体>1 ,它反映了分子中电子对光传播干扰的程度,或者电子被光极化的程度。
物理化学 第一章 气体

反应活性很高的O原子与O2结合形成O3: O+O2+M O3+M 臭氧自身吸收200nm~300nm的uv,而发生
分解:
O3 UV O+O2
在 STP 条 件 下 , 臭 氧 层 厚 度 仅 仅 有 3mm。本世纪七十年代中期科学家们已 关切到某些氟氯烃对臭氧层的有害影响 使用中的氟氯烃最终大多逃逸到大气中 ,然后扩散到平流层中,在175~220nm 波长的uv辐射下引起分解:
理想气体状态方程的应用
• 计算p、V、T、n中的任意物理量,
应用于低压、高温下的真实气体。 • 气体摩尔质量的计算。 • 气体密度的计算。
例:丁烷C4H10是一种易液化的气体燃 料,计算在23℃,90.6KPa下,丁烷 气体的密度。
pV=nRT= mRT/M
=m/V
=
pM RT
=2.14g·L-1
第一章 气体
气体的基本物理特性:扩散性和可压缩性。 表现为: (1)气体没有固定的体积和形状。 (2)气体是最易被压缩的一种聚集状态。 (3)不同种气体能以任意比例相互均匀混合。 (4)气体的密度比液体和固体的密度小很多。
• 1.1 理想气体状态方程 • 1.2 气体混合物 • 1.3 气体分子运动论 • 1.4 真实气体 • 1.5 大气化学
2NO(g)+O2(g) 2NO2 (g)
波长小于400nm的阳光能引起NO2的 光化学分解:
2NO2 (g)+hv NO(g)+O(g)
O(g)+O2(g)+M O3 (g)+M 继而臭氧与未燃烧的烃和其他有机化 合物反应生成过氧乙酰硝酸脂(PAN) 、醛等二次污染物。一次和二次污染物 随着每时的时间变化而变化。
大学物理化学知识整理

第一章 理想气体1、理想气体:在任何温度、压力下都遵循P V=nRT 状态方程的气体。
2、分压力:混合气体中某一组分的压力。
在混合气体中,各种组分的气体分子分别占有相同的体积(即容器的总空间)和具有相同的温度。
混合气体的总压力是各种分子对器壁产生撞击的共同作用的结果。
每一种组分所产生的压力叫分压力,它可看作在该温度下各组分分子单独存在于容器中时所产生的压力B P 。
P y P B B =,其中∑=BBB B n n y 。
分压定律:∑=BB P P道尔顿定律:混合气体的总压力等于与混合气体温度、体积相同条件下各组分单独存在时所产生的压力的总和。
∑=BB V RT n P )/(3、压缩因子ZZ=)(/)(理实m m V V 4、范德华状态方程 RT b V V ap m m=-+))((2 nRT nb V Van p =-+))((225、临界状态(临界状态任何物质的表面张力都等于0)临界点C ——蒸气与液体两者合二为一,不可区分,气液界面消失; 临界参数:(1)临界温度c T ——气体能够液化的最高温度。
高于这个温度,无论如何加压 气体都不可能液化;(2)临界压力c p ——气体在临界温度下液化的最低压力; (3)临界体积c V ——临界温度和临界压力下的摩尔体积。
6、饱和蒸气压:一定条件下,能与液体平衡共存的它的蒸气的压力。
取决于状态,主要取决于温度,温度越高,饱和蒸气压越高。
7、沸点:蒸气压等于外压时的温度。
8、对应状态原理——处在相同对比状态的气体具有相似的物理性质。
对比参数:表示不同气体离开各自临界状态的倍数 (1)对比温度c r T T T /= (2)对比摩尔体积c r V V V /= (3)对比压力c r p p p /= 9、rr r c r r r c c c T Vp Z T V p RT V p Z =⋅=10、压缩因子图:先查出临界参数,再求出对比参数r T 和r p ,从图中找出对应的Z 。
物理化学参数

物理化学参数在我们探索物质世界的奥秘时,物理化学参数就像是一把把神奇的钥匙,帮助我们打开一扇扇未知的大门。
这些参数不仅仅是一堆数字和符号,它们背后蕴含着物质的性质、变化规律以及相互作用的信息。
首先,让我们来了解一下什么是物理化学参数。
简单来说,物理化学参数是用来描述物质在物理和化学过程中的各种特性和状态的定量指标。
比如温度、压力、浓度、密度等等,这些都是我们日常生活中经常接触到的物理化学参数。
温度,这是一个大家都非常熟悉的参数。
它反映了物体的冷热程度。
在物理学中,温度的高低决定了物质的内能,进而影响物质的状态和物理化学性质。
例如,水在 0 摄氏度时会结冰,在 100 摄氏度时会沸腾。
不同的化学反应在不同的温度下进行的速率也各不相同。
温度的测量单位有摄氏度、华氏度和开尔文等。
压力也是一个重要的物理化学参数。
它表示单位面积上所受到的力。
在气体的研究中,压力的变化对气体的体积、温度和化学平衡都有着显著的影响。
比如,当我们给一个封闭的气体容器增加压力时,气体的体积会减小。
在化学反应中,如果反应体系的压力发生改变,可能会导致反应的方向和限度发生变化。
浓度是描述溶液中溶质含量的参数。
它可以用质量浓度、摩尔浓度等方式来表示。
在化学平衡和反应速率的研究中,浓度起着关键的作用。
通常情况下,反应物浓度的增加会使反应速率加快。
密度则反映了物质的紧密程度。
不同物质的密度差异很大,这使得我们可以通过测量密度来鉴别物质。
例如,金的密度远远大于铝,所以通过测量密度我们可以区分金和铝。
除了上述常见的参数,还有许多其他重要的物理化学参数。
比如,热力学中的熵和焓,它们用于描述系统的混乱程度和能量变化。
熵的增加通常意味着系统的无序性增加,而焓的变化则与化学反应中的能量吸收或释放相关。
物理化学参数之间往往存在着密切的联系和相互影响。
例如,理想气体状态方程 PV = nRT 就将压力(P)、体积(V)、物质的量(n)、温度(T)和气体常数(R)联系在了一起。
