小鼠腹腔巨噬细胞提取方法
小鼠原代腹腔巨噬细胞提取方法(超详细~)

小鼠原代腹腔巨噬细胞提取方法(超详细)
实验前准备:
超净工作台、水平式低速离心机、10ml离心管、2.5mL注射器、细胞吸管、3%肉汤淀粉溶液、无菌眼科剪、无菌眼科镊、75%酒精溶液、无菌PBS溶液、DMEM细胞培养基、胎牛血清、细胞计数版、倒置显微镜等。
实验操作步骤
(1)我们对健康雄性C57BL/6小鼠腹腔注射3%肉汤淀粉溶液1 mL,持续3d,以便刺激腹腔巨噬细胞产生。
注:3%肉汤淀粉溶液提前配制,高温除菌后使用。
(2)小鼠颈椎脱臼处死,用75%酒精溶液对其充分消毒。
(3)固定小鼠,暴露腹腔。
(4)无菌条件下用剪刀沿腹中线剪开皮肤,暴露腹膜,切记勿伤及腹膜壁。
(5)向腹膜腔注射DMEM培养基3mL,并轻柔小鼠腹部片刻。
(6)用吸管反复冲洗腹膜腔并回收灌洗液。
(7)移入无菌的10ml的离心管中,以1000r/min,离心 5min,弃上清液。
(8)加入 5ml DMEM 培养基重悬细胞,上述步骤重复两次。
(9)加入含有10% FBS的DMEM培养液重悬细胞,细胞计数,调整细胞浓度为1×106 个/mL。
(10)将细胞悬液接种于 6 孔培养板中,放于37℃、5%二氧化碳
饱培养箱中培养,待后续实验研究。
小鼠腹腔巨噬细胞提取流程

小鼠腹腔巨噬细胞提取流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!小鼠腹腔巨噬细胞的提取流程如下:1. 实验材料准备- 实验动物:C57BL/6小鼠,6-8周龄,体重18-22g。
巨噬细胞提取方法
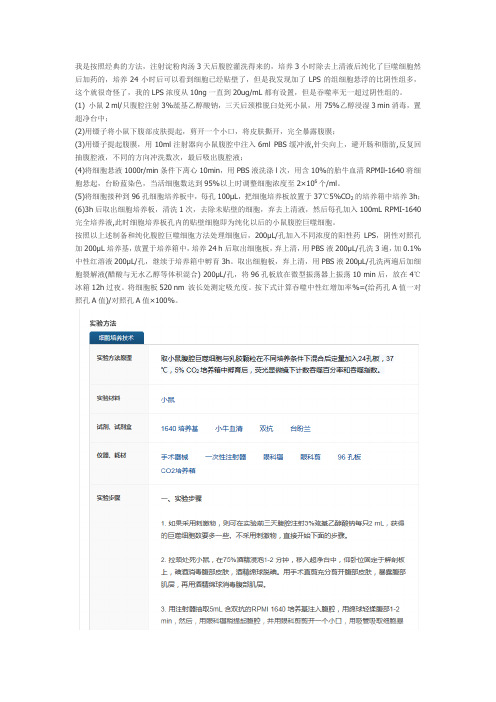
我是按照经典的方法,注射淀粉肉汤3天后腹腔灌洗得来的,培养3小时除去上清液后纯化了巨噬细胞然后加药的,培养24小时后可以看到细胞已经贴壁了,但是我发现加了LPS的组细胞悬浮的比阴性组多,这个就很奇怪了,我的LPS浓度从10ng一直到20ug/mL都有设置,但是吞噬率无一超过阴性组的。
(1) 小鼠2 ml/只腹腔注射3%巯基乙醇酸钠,三天后颈椎脱臼处死小鼠,用75%乙醇浸湿3 min消毒,置超净台中;(2)用镊子将小鼠下腹部皮肤提起,剪开一个小口,将皮肤撕开,完全暴露腹膜;(3)用镊子提起腹膜,用10ml注射器向小鼠腹腔中注入6ml PBS缓冲液,针尖向上,避开肠和脂肪,反复回抽腹腔液,不同的方向冲洗数次,最后吸出腹腔液;(4)将细胞悬液1000r/min条件下离心10min,用PBS液洗涤l次,用含10%的胎牛血清RPMIl-1640将细胞悬起,台盼蓝染色,当活细胞数达到95%以上时调整细胞浓度至2×106个/ml。
(5)将细胞接种到96孔细胞培养板中,每孔100μL,把细胞培养板放置于37℃5%CO2的培养箱中培养3h;(6)3h后取出细胞培养板,清洗1次,去除未贴壁的细胞,弃去上清液,然后每孔加入100mL RPMI-1640完全培养液,此时细胞培养板孔内的贴壁细胞即为纯化以后的小鼠腹腔巨噬细胞。
按照以上述制备和纯化腹腔巨噬细胞方法处理细胞后,200μL/孔加入不同浓度的阳性药LPS,阴性对照孔加200μL培养基,放置于培养箱中,培养24 h后取出细胞板,弃上清,用PBS液200μL/孔洗3遍,加0.1%中性红溶液200μL/孔,继续于培养箱中孵育3h。
取出细胞板,弃上清,用PBS液200μL/孔洗两遍后加细胞裂解液(醋酸与无水乙醇等体积混合) 200μL/孔,将96孔板放在微型振荡器上振荡10 min后,放在4℃冰箱12h过夜。
将细胞板520 nm 波长处测定吸光度。
按下式计算吞噬中性红增加率%=(给药孔A值一对照孔A值)/对照孔A值×100%。
巨噬细胞原代培养方法步骤

巨噬细胞原代培养方法步骤
1.实验前三天,向每只小鼠腹腔内注入无菌硫羟乙酸肉汤 1ml(勿注
入肠内)。
2.引颈杀死动物,手提鼠尾将全鼠浸入70%酒精中3~5秒。
3.置动物于解剖台上,用针头固定四肢,双手持镊撕开皮肤拉向两侧,暴露出腹膜,但勿伤及腹膜壁。
4.再用70%酒精擦洗腹膜壁后,用注射器吸10ml Eagle液注入腹腔中,同时从两侧用手指揉压腹膜壁,令液体在腹腔内充分流动。
5.用针头轻轻挑起腹壁,使动物体微倾向一侧,使腹腔中液体集于针
头下吸取入针管内。
6.小心拔出针头,把液体注入离心管中,250g ,4℃离心10分钟,去
上清,加10 ml Eagle培养基。
7.计数细胞,每只小鼠可产生20~30×105个细胞细胞,其中90%为巨
噬细胞。
8.为获取3×105个帖附细胞/平方厘米,需接种2.5×106个/ml。
9.为纯化培养细胞,去除其它白细胞,接种数小时后,去除培养液,
用Eagle液冲洗1-2次后,再加新Eagle培养液置37℃ CO2温箱中培养。
分离巨噬细胞的方法

分离巨噬细胞的方法巨噬细胞是免疫系统中重要的成分之一,其功能是吞噬和消化细菌、病毒、细胞残骸等病原体或异常细胞。
为了研究巨噬细胞的生理和病理功能,科学家需要从体内或体外分离出巨噬细胞。
下面将介绍几种常用的分离巨噬细胞的方法。
1. 腹腔巨噬细胞分离法这是一种常用的方法,适用于小鼠或大鼠的巨噬细胞分离。
首先,用适当的方法将小鼠或大鼠的腹腔打开,将腹腔洗液抽取出来。
洗液中含有大量的巨噬细胞。
然后,将洗液经过离心,将沉淀中的巨噬细胞收集起来。
最后,用适当的培养基培养巨噬细胞,使其继续生长和分化。
2. 骨髓巨噬细胞分离法这种方法适用于从小鼠或大鼠的骨髓中分离巨噬细胞。
首先,将小鼠或大鼠的骨髓从骨骼中取出,并用适当的方法将骨髓细胞洗涤干净。
然后,将洗液经过离心,将沉淀中的骨髓巨噬细胞收集起来。
最后,用适当的培养基培养骨髓巨噬细胞,使其继续生长和分化。
3. 化学法分离巨噬细胞这种方法利用化学试剂的特定性质,使巨噬细胞与其他细胞分离。
例如,可以利用巨噬细胞表面特定的受体,使用特定的抗体标记巨噬细胞,并通过离心或磁珠分离得到纯净的巨噬细胞。
此外,还可以利用化学试剂的特殊性质,如巨噬细胞对特定染料的亲和性,来分离巨噬细胞。
4. 细胞排序分离巨噬细胞细胞排序是一种高级的细胞分离技术,可以根据细胞的特定性质,如大小、形状、表面标记等,将巨噬细胞从混合细胞中分离出来。
这种方法可以高效地分离出纯净的巨噬细胞群体,但设备和技术要求较高。
总结起来,分离巨噬细胞的方法有腹腔巨噬细胞分离法、骨髓巨噬细胞分离法、化学法和细胞排序法。
这些方法各有优缺点,科学家可以根据实验需求选择适合的方法。
通过分离巨噬细胞,科学家可以更好地研究巨噬细胞的生理和病理功能,为疾病的治疗和预防提供理论基础。
小鼠腹腔巨噬细胞的分离与培养

小鼠腹腔巨噬细胞的分离与培养
目的:建立一种小鼠腹腔巨噬细胞分离的简便方法,为低强度激光照*对巨噬细胞功能的影响研究提供实验细胞.方法:以无血清的RPMI-1640培养液灌洗小鼠腹腔,分离获取小鼠腹腔巨噬细胞,在含10%小牛血清的RPMI-1640培养液中培养.采用倒置显微镜观察细胞形态,台盼蓝染*计算存活率,瑞氏染*计算纯度.结果:获得高纯度的巨噬细胞,具备巨噬细胞的形态特征.结论:本法是一种简便实用的分离小鼠腹腔巨噬细胞的方法.
肖丹,XIAODan(第四*医大学*事预防医学系,陕西,西安,710032)。
分离巨噬细胞的方法

分离巨噬细胞的方法分离巨噬细胞是研究巨噬细胞功能和特性的重要步骤。
以下是十种常用的巨噬细胞分离方法,并对每种方法进行详细描述。
1. 腹腔巨噬细胞分离法:此方法适用于小鼠或大鼠。
实验动物首先经过局部消毒,然后腹腔被切开,并用含有PBS和酶的缓冲液灌洗腹腔,酶可包括胰酶或胃蛋白酶。
灌洗液收集并离心,上清液中含有的巨噬细胞可被采集。
2. 骨髓巨噬细胞分离法:此方法适用于小鼠或大鼠的骨髓。
动物被解剖并骨髓被收集,随后经过红细胞裂解溶液处理去除红细胞,最后巨噬细胞被采集。
3. 足垫巨噬细胞分离法:此方法适用于小鼠。
小鼠足垫被切下,然后用酶解液处理,最终得到含有巨噬细胞的悬液。
4. 肝巨噬细胞分离法:此方法适用于小鼠。
小鼠肝脏被解剖切片,随后用酶解液处理使细胞解离,最后巨噬细胞被离心收集。
5. 肺巨噬细胞分离法:此方法适用于小鼠。
小鼠肺脏被灌洗,利用冰冷的灌洗缓冲液反复灌洗肺组织,然后收集悬液中的巨噬细胞。
6. 脾巨噬细胞分离法:此方法适用于小鼠或大鼠。
动物脾脏被解剖切片,然后用酶解液处理,经过红细胞裂解溶液处理去除红细胞,最终得到含有巨噬细胞的悬液。
7. 血液巨噬细胞分离法:此方法适用于人或动物。
血液被抽取并用红细胞裂解溶液处理去除红细胞,最后巨噬细胞被离心收集。
8. 胎盘巨噬细胞分离法:此方法适用于人或动物。
胎盘被解剖并切碎,随后用酶解液处理,经过红细胞裂解溶液处理去除红细胞,最终得到含有巨噬细胞的悬液。
9. 巨噬细胞树突状细胞混合分离法:此方法适用于人或动物。
细胞混合悬液经过抗体标记和磁珠分离,然后通过磁珠分选系统将巨噬细胞和树突状细胞分离。
10. 巨噬细胞分选细胞器结合法:此方法适用于人或动物。
细胞混合悬液经过抗体标记和细胞器结合分选,利用流式细胞术或显微镜观察巨噬细胞的特定标记,并进行分选。
以上十种方法是常用的分离巨噬细胞的方法,每种方法有其适用范围和特点。
研究人员可以选择合适的方法根据研究需求进行巨噬细胞的分离,以获得纯净的巨噬细胞用于后续的实验和研究。
小鼠腹腔巨噬细胞吞噬试验

剪开腹部皮肤,暴露腹膜,用镊子夹起腹膜剪
开一小口(注意避开血管),用1640灌注腹腔,收集腹
腔液于试管中(约4 ml),1500 r/min,离心10 min,
去上清,沉积细胞用1640离洗一次。最后沉积细胞
用含10%小牛血清1640配成适当浓度备用(1-2×106
/ml)。
第3页/共17页
(2)白色念珠菌制备 将白色念珠菌接种于沙氏平 皿培养基中,培养48小时,收集菌,用适量生理 盐水配成悬液,100℃,煮沸30 min灭活,离心去 掉上清,再用1%美兰染色30 min,用生理盐水洗 涤二次,用生理盐水配成1×108/ml菌悬液,4℃ 冰箱保存备用。
四角的大方格,又分为16个中方格,适用于 白细胞计数。中央大方格以双线等分为25个中方格。 每个中方格又分16个小方格,通常我们取四角的4个 中方格和中间的1个中方格来计数红细胞。
第11页/共17页
第12页/共17页
第13页/共17页
第14页/共17页
首先用吸管吸取少许稀释后的单细胞悬液,从 盖片端滴一小滴(不宜过多),液体自行向内渗入, 静置数分钟后,再放在微镜下观察计数。
第9页/共17页
3、滴片时加入的细胞数依细胞的大小而定,如果使 用的吞噬细胞是细胞系,细胞体积较大,那么加入 的细胞数就相应的少一点。
第10页/共17页
血球计数板计数法
血球计数板是由一块厚玻片特制而成,其中 央有两个计数室。每个计数室划分出9个大方格(见 下图),每格面积1mm2,加盖玻片后的深度为 0.1mm。因此,每大方格容积为0.1mm3。
第16页/共17页
感谢您的观看!
第17页/共17页
第4页/共17页
(3)吞噬细胞与菌混合培养 取巨噬细胞0.5ml加白色念珠菌悬液0.5ml,置
小鼠腹腔巨噬细胞准备

peritoneal macrophage cell preparation1.小鼠颈椎脱臼处死,75%酒精浸泡3分钟,取出小鼠,置于无菌纸上,腹面朝上;2.用镊子提起小鼠下腹部皮肤,剪开一小口,撕开皮肤,完全暴露腹膜;3. 10ml注射器装上大号针头,注入6 ml Hanks液或PBS,用镊子提起腹膜,向腹腔中注入Hanks液,针尖朝上,避开肠和脂肪,回抽腹腔液,不同方向冲洗数次,吸出腹腔液;4.细胞悬液离心200×g10分钟,用Hanks液洗一次,用RPMI1640-5%小牛血清悬起细胞,2×106细胞/ ml.5.细胞悬液置入培养瓶,37度培养2小时后,吸弃上清,用预热培养基洗二次,留下贴壁细胞;6.含10 mM EDTA的PBS加入培养瓶,覆盖细胞,37度孵育20分钟,用吸管用力吹打下细胞,或用橡皮擦帚轻轻刮下细胞,即为腹腔巨噬细胞,纯度一般大于90%,每只小鼠平均可得2×106腹腔巨噬细胞。
注:1.雌性小鼠6-8周最适用。
雄性小鼠肠壁脂肪多。
不利于腹腔液收集;2.在冲洗过程中应小心,以免刺破血管或肠壁,血液流入腹腔液;3.吸出的腹腔液应洗后再贴壁,否则有血浆膜形成,影响贴壁;4.贴壁巨噬细胞分离有较多方法,如利多卡因孵育,但大多不理想,故细胞分离后应用台盼兰染色检测活力;5.橡皮擦帚可自制,用自行车气门芯上的橡皮管套在预先折弯的滴管尖头上,灭菌后使用,较为实用;6.炎性巨噬细胞的制备可用3%的脱水硫羟乙酸培养基2ml,注入小鼠腹腔,4天后同法集腹腔细胞,每只小鼠腹腔细胞产量可以增加到3×107细胞左右。
需指出的是炎性巨噬细胞的功能活性与正常腹腔巨噬细胞有很大差异。
小鼠腹腔巨噬细胞提取的经验方法总结如下:第一:用刺激物质的方法,一般都是在实验前三天腹腔注射3%巯基乙醇酸钠(应该现配现用,否则效果较差)每只2ML。
实验当天将小鼠断头处死,置于1%的新洁尔灭或者75%的乙醇溶液中浸泡2—3MIN,消毒皮肤。
巨噬细胞培养操作方法

巨噬细胞培养操作方法
巨噬细胞属免疫细胞,有多种功能,是研究细胞吞噬、细胞免疫和分
子免疫学的重要对象。
巨噬细胞容易获得,便于培养,并可进行纯化。
巨噬细胞属不繁殖细胞群,在条件适宜下可生活2-3周,多用做原代
培养,难以长期生存。
巨噬细胞也建有无限细胞系,大多来自小鼠,如P331、 S774A.1、RAW 309Cr.l等,均获恶性,培养中呈巨噬细胞形态和吞噬功能,易于传代
和瓶壁分离,但难以建株。
培养巨噬细胞可用各样方法和各种来源来获取细胞,以小鼠腹腔取材
法最为实用,其法如下:
1、实验前三天,向小鼠腹腔内注入无菌硫羟乙酸肉汤 lml(勿注入肠内!),以刺流产生大量的巨噬细胞。
2、引颈处死小鼠。
3、手提鼠尾将其全浸入70%乙醇中 3-5秒。
4、置动物于解剖台,用针头固定四肢,持镊撕开腹部皮肤,但勿伤及
腹膜壁,把皮肤拉向上下两侧,暴露出腹膜壁。
5、用70%酒精擦洗腹膜壁,注射器吸10ml Eagle液注入腹腔中,同时
用手指从两侧压揉腹膜壁,使液体在腹腔内流动。
6、用针头轻挑起腹壁并微倾向一侧.使腹腔中液体集中于针头下吸取
入针管内。
7、小心拔出针头,把液体注入离心管。
8、4℃下250g离心10分钟后,去上清,加10ml Eagle培养基。
9、计数细胞。
每只鼠可产生20一30×106细胞,其中 90%为巨噬细胞。
10、以3×105个贴附细胞/平方厘米接种。
11、接种数小时后,除去培养液,可去除其它白细胞,纯化培养细胞,用Eagle液冲洗1一2次,再加新Eagle培养液置CO2温箱中。
小鼠腹腔巨噬细胞制备及提取

=====WORD完整版----可编辑----专业资料分享=====小鼠腹腔巨噬细胞制备及提取实验动物:6-8周的SPF级雄性BALB/C小鼠,小鼠取细胞前三天每天腹腔注射0.5-1mL淀粉肉汤,或者取细胞前一小时注射1mL淀粉肉汤。
试剂:75% 乙醇、RPMI 1640 (Gibcol/BRL,美国)、含10%小牛血清RPMI-1640液(10%牛胎血清、青霉素100U/ml、链霉素10μg/ml)步骤:1、取6周左右的小鼠,剃去腹部的毛并消毒。
2、引颈杀死动物,手提鼠尾将全鼠浸入75%酒精中3~5秒。
3、倒立小鼠,置动物于解剖台上,固定四肢,75%酒精擦洗腹膜壁后,用9号针头5ml注射器沿腹中线将预冷的不含小牛血清的PBS 5mL注入腹腔中,同时从两侧用手指揉压腹膜壁,令液体在腹腔内充分流动。
轻轻按摩腹部2-3分钟,静置5-7分钟。
4、无菌条件下,剪开腹壁,双手持镊撕开皮肤拉向两侧,暴露出腹膜,但勿伤及腹膜壁。
再用75%酒精擦洗腹壁。
5、用针头轻轻挑起腹壁,使动物体微倾向一侧,使腹腔中液体集于针头下吸入注射器内。
小心拔出针头。
把液体注入50ml离心管中。
再用同样容量的PBS冲洗腹腔2~4次。
合并渗出液于50 mL离心管中。
直至冲洗液变澄清。
6、4℃250×g(1000 rpm/min)离心10min,去上清。
7、用PBS培养液洗涤细胞3次,每次4℃250×g(1000 rpm/min)离心10min,去上清。
8、用含10%小牛血清RPMI-1640液(10%牛胎血清、青霉素100U/ml、链霉素10μg/ml)悬浮细胞。
将调整细胞浓度调整至5×106 cells/mL 加入培养皿中培养9、将培养皿置于5% CO2、37℃培养箱中培养3 h,然用37℃预温的RPMI-1640培养液清洗培养皿2-3次,去除未贴壁的细胞,即得到纯化的贴壁巨噬细胞。
种96孔板。
2h细胞贴壁。
小鼠腹腔巨噬细胞的分离与培养

·638·现代生物医学进展删.biomed.net.caProgressinModernBiomemciIIe2008V01.8No.4小鼠腹腔巨噬细胞的分离与培养李海涛1肖丹2屈学民1刘渊声1马长升1杨继庆1(1第四军医大学生物医学工程系陕西西安710032;2第四军医大学军事预防医学系陕西西安710032)摘要目的:建立一种小鼠腹腔巨噬细胞分离的简便方法,为低强度激光照射对巨噬细胞功能的影响研究提供实验细胞。
方法:以无血清的RPMI.1640培养液灌洗小鼠腹腔,分离获取小鼠腹腔巨噬细胞,在含10%小牛血清的RPMI.1640培养液中培养。
采用倒置显微镜观察细胞形态,台盼蓝染色计算存活率,瑞氏染色计算纯度。
结果:获得高纯度的巨噬细胞,具备巨噬细胞的形态特征。
结论:本法是一种简便实用的分离小鼠腹腔巨噬细胞的方法。
关键词:小鼠;巨噬细胞;分离中图分类号:Q813文献标识码:A文章编号:1673—6273【2008104—0638—02SeparationandCultivationofMousePeritonealMacrophagesLIHai-tao,XIAODan,QUXue-min,LIUYuan-sheng,MAChang-sheng,YANGJi-qing(1DepartmentofBiomedicalEngineering,theFourthMilitaryMedicalUniversity,Xi'an710032,China;2DivisionofPreventl"veMedicine,theFourthMilitaryMedicalUniversity,尉,翩710032,China)ABSllRACTObjective:Toestablishconvenientmethodofseparationandcultivationofmouseperitonealmacrophagesandtoprovideexperimentalcellsforinvestigatingtheeffectoflow-energylaserirradiationmacrophages.Methods:Amouse’SperitonealcavitywasdouchedbyusingRPMI一1640mediumwithoutFCS,andthemouse’Speritonealmacrophageswereseparatedandobtained,beingculturedinRPMI一1640mediumcontaining10%FCS.ThemorphologyofthecellsWasobservedunderinvertedmicroscopy,thesurvivalrateofmacrophagesWascalculatedwithtrypanbluestain.ThepurityofmacrophageswasanalyzedbyWright’Sstaining.Results:Thehighlypurifiedmacrophageshadmorphologiccharacteristicsofthemacrophageinorganism.Conclusion:Thismethodbeusedfortheseparationofmouseperitonealmacrophages,whichissimpleandeasytoapply.Keywords:Mouse;Macrophage;SeparationChine∞LibraryClassification:Q813Documentcode:AArticleID:1673-6273(2008)04-0638-02前言巨噬细胞是机体的重要防御细胞,在抗感染、抗肿瘤及免疫调节中起着非常重要的作用。
小鼠腹腔巨噬细胞 提取量

小鼠腹腔巨噬细胞提取量
小鼠腹腔巨噬细胞的提取量可以根据实验所需的具体目的和方法来确定。
以下是一种常用的提取方法:1. 将小鼠处死后,用70%乙醇消毒小鼠腹部。
2. 用剪刀将小鼠腹部的皮肉切开,暴露腹腔。
3. 使用无菌吸管或针头,注入预冷PBS缓冲液到腹腔内,轻轻摇动或用力揉搓腹部几分钟,以充分洗涤腹腔巨噬细胞。
4. 用吸管或注射器将洗涤液吸取出来,转移到离心管中。
5. 对洗涤液进行离心,速度和时间要根据巨噬细胞的大小和沉降速度来确定。
通常,离心速度为
300-400 g,离心时间为5-10分钟。
6. 将上清液去除,留下含有巨噬细胞的沉淀。
7. 再次加入适量的预冷PBS缓冲液进行洗涤,重复上述离心步骤。
8. 最后,根据实验要求,将沉淀溶解或悬浮于适合的细胞培养液中,用于后续实验。
需要注意的是,提取量的多少受到小鼠体内巨噬细胞的数量以及实验处理步骤的差异等因素的影响。
因此,在每个实验中,都需要根据具体实验要求进行优化和调整。
《小鼠腹腔巨噬细胞的快速提取及培养》.pdf

小鼠腹腔巨噬细胞的快速提取及培养范仕郡,刘㊀鑫,黄㊀敏,王㊀宁,郑㊀江㊀(第三军医大学西南医院中心实验室,重庆400038)㊀㊀[摘㊀要]㊀目的㊀建立一种小鼠腹腔巨噬细胞快速提取的方法,为细胞实验提供便捷㊂方法㊀用生理盐水灌洗小鼠腹腔,分离获取小鼠腹腔巨噬细胞,转入高糖DMEM 培养液中培养㊂采用台盼蓝染色计算存活率,瑞氏染色计算纯度,倒置显微镜观察细胞形态㊂结果㊀获得较高纯度的巨噬细胞,具备巨噬细胞的形态特征㊂结论㊀本方法是一种简便实用的提取小鼠腹腔巨噬细胞的方法㊂㊀㊀[关键词]BALB /c 小鼠;巨噬细胞;提取;培养;鉴定㊀㊀[中图分类号]Q813.1㊀[文献标识码]A㊀[文章编号]1672-5042(2015)02-0130-02㊀doi:10.11659/jjssx.11E014005㊀[基金项目]国家自然科学基金项目(81171781)㊀[收稿日期]2014-11-12㊀㊀[修回日期]2014-12-20Establishment of a rapid method for the isolation of murine peritoneal macrophagesFAN Shi-jun,LIU Xin,HUANG Min,WANG Ning,ZHENG Jiang㊀(Central Laboratory,Southwest Hospital,Third Military Medi-cal University,Chongqing 400038,China)㊀㊀Abstract :Objective ㊀To establish a rapid method for the isolation of murine peritoneal macrophages.Methods ㊀Abdominal lavagewas performed with NS and the peritoneal macrophages was purified from the lavage,which was later transferred into high glucose DMEM cul-ture medium.Cell viability was measured via the typan blue staining.Purity was observed via Wright's stain.Results ㊀High purity macropha-ges with typical morphology were obtained.Conclusion ㊀A simple and realistic method was set up for the isolation of murine peritoneal mac-rophages.㊀㊀Keywords :BALB /c mice;macrophage;extraction;culture;identification㊀㊀巨噬细胞是一类重要的天然免疫细胞,来源于外周血中的单核细胞,具有吞噬降解细菌㊁释放炎症介质㊁介导炎性细胞趋化㊁抗原提呈等活性,在抗感染㊁抗肿瘤免疫中发挥着非常重要的作用[1-2]㊂因此研究巨噬细胞的功能,对于深入理解机体免疫防御和免疫调节机制具有重要意义㊂获取原代细胞是体外研究巨噬细胞功能的重要方法㊂巨噬细胞在肺㊁肝㊁脑等实质器官以及腹腔等空腔部位以不同的形式分布㊂国内外已有不少文献报道从多种组织器官中成功分离和纯化巨噬细胞[3-5]㊂然而在实质脏器中的巨噬细胞,往往受到环境介质中各种理化和生物刺激因素的影响,已发生炎性活化或产生了定向分化,为其体外研究造成了干扰㊂而腹腔中存在大量静息状态的巨噬细胞,且腹腔中细胞种类较少简单,易于分离,是获取巨噬细胞的常用部位[6-9]㊂目前有关腹腔巨噬细胞的分离方法较为复杂,且操作耗时较长㊂本方法在既往文献报道基础上,对小鼠腹腔巨噬细胞提取方法加以改良,建立了一种更为简便实用的小鼠腹腔巨噬细胞的提取方法㊂1㊀材料与方法1.1㊀材料及实验设备㊀㊀实验用材料及试验设备有:8周龄BALB /c 雌性小鼠(由北京华阜康生物科技股份有限公司提供)㊁生理盐水㊁胶头滴管㊁75%乙醇㊁眼科剪㊁眼科镊㊁10mL 一次性注射器㊁50mL 离心管㊁台盼蓝㊁瑞氏染液㊁奥林巴斯IX71倒置显微镜㊁奥林巴斯E400显微镜㊁细胞培养箱等㊂1.2㊀实验方法1.2.1㊀实验准备㊀㊀将眼科剪㊁眼科镊㊁胶头滴管高压灭菌;离心管辐照消毒;BALB /c 小鼠3只禁食8h;实验前将超净台紫外线消毒30min㊂1.2.2㊀细胞提取㊀㊀将小鼠脱颈椎处死,并浸入75%乙醇中10s㊂然后取出小鼠,沥干,将其仰卧于不锈钢方盘上㊂用注射器吸6mL 生理盐水液注入腹腔中,轻揉小鼠腹部2min,使液体在腹腔内充分流动㊂用眼科镊提起下腹皮肤,使动物微倾向一侧㊂剪开腹部皮肤后在肌肉层剪1个小口,用胶头滴管将腹腔液吸出转入离心管中㊂每只吸出量约为4~5mL㊂1.2.3㊀细胞培养㊀㊀在4ħ条件下,将收集的腹腔灌洗液在1000r /min 条件下离心10min,去上清,加入高糖DMEM 细胞培养液用细胞计数板计数㊂显微镜下(10ˑ100倍)计数巨噬细胞㊂调整细胞浓度至所需,接种至细胞培养瓶,37ħ培养箱孵育4h,充分贴壁后,弃上清,除去非粘附细胞再加入高糖DMEM 细胞培养液,放回培养箱中培养备用㊂2㊀结果2.1㊀台盼蓝染色㊁瑞氏染色结果㊀㊀分别用台盼蓝染色计数(图1a)㊁瑞氏染色计算纯度(图1b)㊂台盼蓝染色后,3min 内,镜下分别计数活细胞和死细胞㊂死细胞被染成蓝色,而活细胞呈无色透明状㊂细胞活力(%)=活细胞总数/(活细胞总数+死细胞总数)ˑ100%>95%㊂瑞氏染色后,在镜下通过细胞形态计数巨噬细胞和细胞总数㊂巨噬细胞获得率(%)=巨噬细胞细胞总数/细胞总数ˑ100%>90%㊂a:台盼蓝染色;b:巨噬细胞瑞氏染色,箭头指示为瑞氏染色后巨噬细胞图1㊀提取细胞台盼蓝染色㊁瑞氏染色(ˑ1000)2.2㊀细胞形态观察㊀㊀培养12h 后,在倒置显微镜下可观察到细胞呈椭圆形㊁多角形或不规则形,部分贴壁(图2a)㊂培养24h 后观察可以观察到细胞贴满培养瓶,大部分出现伪足㊂部分细胞伸展开并牢固粘附在培养瓶表面(图2b)㊂a:培养12h 后细胞形态;b:培养24h 后细胞形态图2㊀培养后细胞形态3㊀讨论㊀㊀在鉴定细胞方面,采用台盼蓝染色其原理是活细胞的胞膜结构完整,台盼蓝不能够进入胞内,不能着色㊂反之死细胞的细胞膜通透性增加,台盼蓝进入后被染成蓝色㊂因此,采用台盼蓝染色计数死细胞和活细胞非常简便快捷,是组织和细胞培养中经典的鉴定染色方法㊂瑞氏染液为中性染料,它使细胞核及胞浆着色㊂染液中含有缓冲液来调节酸碱度,因此细胞染色后,蓝色和红色都比较适中,细胞核㊁胞浆显色都非常清楚,是目前在细胞染色中最简单和常用的方法㊂在细胞的提取过程中要注意无菌操作,注意器械和实验环境的消毒㊂选用雌性小鼠是因其肠壁脂肪较少,方便腹腔液的收集㊂周龄较大的小鼠腹腔巨噬细胞数量较少,最好选用6~8周龄小鼠㊂㊀㊀巨噬细胞广泛分布于体内,它不仅在非特异性免疫反应中发挥重要作用,而且也是机体特异性免疫中的一类关键细胞[10-11]㊂由于腹腔巨噬细胞多游离存在,易于获得,因此,许多实验室在进行基础或配合临床研究巨噬细胞功能及其与疾病的关系㊁或筛检免疫增强药物和探讨其作用机制时,往往选用小鼠腹腔巨噬细胞为研究对象[12-13]㊂本方法在提取时,和其他方法一样,均是灌洗腹腔后,吸出含有巨噬细胞的灌洗液,然后离心培养㊂但传统方法中均采用淀粉肉汤㊁无菌液体石蜡等腹腔注射预刺激几天,以提高其获得率㊂预刺激处理一方面增加了操作的复杂程度,另一方面可影响分离巨噬细胞的静息特征㊂本方法实验前不需预刺激,减少了污染概率,大大缩短了细胞获取的准备时间,所得的巨噬细胞活力和获得率均大于90%㊂因此,此方法是一种简便实用的小鼠腹腔巨噬细胞的提取方法,为巨噬细胞的相关实验研究奠定了基础㊂[参考文献][1]Classen A,Lloberas J,Celada A.Macrophage activation:classical versus alternative[J].Methods Mol Biol,2009,531(6):29-43.[2]Bayne LJ,Beatty GL,Jhala N,et al.Tumor-derived granulocyte-macro-phage colony-stimulating factor regulates myeloid inflammation and Tcellimmunity in pancreatic cancer[J].Cancer Cell,2012,21(6):822-835.[3]Kitani H,Takenouchi T,Sato M,et al.A novel isolation method for mac-rophage-like cells from mixed primary cultures of adult rat livercells[J].J Immunol Methods,2010,360(1-2):47-55.[4]Neng L,Zhang W,Hassan A,et al.Isolation and culture of endothelialcells,pericytes and perivascular resident macrophage-like melanocytes from the young mouse ear[J].Nat Protoc,2013,8(4):709-720.[5]Zhang X,Goncalves R,Mosser DM.The isolation and characterization of murine macrophages[J].Curr Protoc Immunol,2008,83(14):1-14.[6]Schon Hegrad MA,Holt PG.Improved method for the isolation of puri-fied mouse peritoneal macrophages [J ].J Immunol Methods,1981,43(2):169-173.[7]黄㊀琼,李志场,杏㊀芬,等.流式细胞术检测小鼠腹腔巨噬细胞吞噬功能[J].中国药理学与毒理学杂志,2007,21(2):140-146.[8]张㊀华,钟英英,方廖琼,等.羊胎盘免疫调节因子对小鼠腹腔巨噬细胞免疫功能的影响[J].中国生化药物杂志,2005,26(2):70-72.[9]李海涛,肖㊀丹.鼠腹腔巨噬细胞的分离与培养[J].现代生物医学进展杂志,2008,8(4):638-639.[10]Biswas SK,Mantovani A.Macrophage plasticity and interaction withlymphocyte subsets:cancer as a paradigm [J].Nat Immunol,2010,11(10):889-896.[11]Mantovani A,Biswas SK,Galdiero MR,et al.Macrophage plasticity andpolarization in tissue repair and remodelling [J].J Pathol,2013,229(2):176-185.[12]Davies JQ,Gordon S.Isolation and culture of murine macrophages[J].Methods Mol Biol,2005,290(8):91-103.[13]Ghosn EE,Cassado AA,Govoni GR,et al.Two physically,functional-ly,and developmentally distinct peritoneal macrophage subsets [J].Proc Natl Acad Sci USA,2010,107(6):2568-2573.(编辑:周小林)。
小鼠腹腔巨噬细胞的获取

小鼠腹腔巨噬细胞的获取1材料准备好血清56℃灭活1h,完全冷却后1000rpm/5min,然后0.22μm滤膜过滤,配含10%不含双抗的灭活FBS血清的1640培养基,另外再配含有双抗的完全培养基。
泡沫板,小注射器6个,10mL注射器几个,无菌剪刀、镊子。
提前预冷的未加双抗的1640培养基。
加了双抗的完全培养基37℃预热。
50mL管几个。
无菌PBS,台盼兰,75%酒精。
C57BL/6小鼠8-12周。
Corning极低吸附培养板,细胞不能黏附,或者用0.25%胰酶+0.02%EDTA。
用Hanks液终止胰酶和EDTA消化。
2实验步骤1)拉颈处死小鼠,在75%酒精浸泡1-2min,移入超净台,把小鼠放到泡沫板上,用枕头固定四肢,用镊子和剪刀剪开皮肤,露出腹膜,但勿伤及腹膜壁。
注意:在处死老鼠时,如果腹腔内有血,则这只老鼠不能用,容易有血细胞污染。
2)用10mL注射器吸取提前预冷的无双抗的164010mL,换小针头注射到腹腔中,同时从两侧用手指按压腹膜壁2-5min,使液体在腹腔内充分流动。
然后放置20-25min。
提前预冷离心机到4℃。
3)轻轻拔出针头,然后从侧壁吸出培养基,注意不要吸到体内器官。
然后再注射5mL的培养基,按压1min,停滞5min,吸出到提前预冷的50mL的离心管中。
4)500g/8min,然后用无双抗的培养基洗一次,500g/8min,弃去上清液,然后用预热的完全培养基重悬。
5)台盼兰计数,很难消化下来,所以接种的时候,必须直接接种到目的培养器皿中。
如果是96孔板,一般是2X10^5个/mL,如果温箱孵育2-4h,用提前预热的是6孔板,200w个/mL,5%CO21640洗1-2次,然后换液,洗去未贴壁细胞,贴壁细胞则为单层的巨噬细胞。
3实验结果巨噬细胞刚贴壁时偏圆形,或者类似鹅卵石形状,然后慢慢伸出伪足,铺开呈三角形或多角形。
4注意事项1)巨噬细胞使终末分化细胞,不会增殖。
在条件适宜下可存活2-3周,多用原代培养。
小鼠腹腔巨噬细胞提取方法

小鼠腹腔巨噬细胞提取方法
操作步骤
一、将小鼠以颈椎脱臼法处死,仰卧,固定四肢。
二、依次用碘酒及酒精棉球消毒腹部,以镊子提取腹壁,剪去小块皮肤,继以镊子提取腹腔。
剪一小口,以注射器注入少量冲洗液。
用滴管吸出,再注入冲洗液并吸出,滴管在腹腔内各个位置吸取液体,冲洗每只小鼠腹腔约5ml。
三、将腹腔细胞悬液滴于干净载玻片上,置37度湿盒内,1-2小时后倾去玻片上的液体,
并用腹腔冲洗液轻洗玻片,即可见玻片上有毛玻璃样的单层巨噬细胞粘附,巨噬细胞含量可达90%
四、在显微镜下计算巨噬细胞的百分比,检测分离结果。
小鼠腹腔巨噬细胞的提取与鉴别方法探讨。
小鼠腹腔巨噬细胞(peritoneal macrophage)培养

小鼠腹腔巨噬细胞(peritoneal macrophage)培养发布: 2010-02-22来自: 易生物实验阅读数:2683次1 材料1.1 动物:各个品系的小鼠2-4 只。
1.2 试剂:RPMI1640 培养基(含酚红),小牛血清,双抗,培养液(10%小牛血清、RPMI1640、双抗),台盼兰等。
碘酒绵球和酒精绵球。
1.3 器械:一次性注射器、手术器械。
2 方法如果采用刺激物,则可在实验前三天腹腔注射3%巯基乙醇酸钠每只2 mL,获得的巨噬细胞数要多一些。
不采用刺激物,直接开始下面的步骤。
2.2.1 拉颈处死小鼠,在75%酒精浸泡1-2 分钟,移入超净台中,仰卧位固定于解剖板上,碘酒消毒腹部皮肤,酒精绵球脱碘。
用手术直剪充分剪开腹部皮肤,暴露腹部肌层,再用酒精绵球消毒腹部肌层。
2.2.2 用注射器抽取5 mL 含双抗的RPMI1640 培养基注入腹腔,用绵球轻揉腹部1-2 min,然后,用眼科镊稍提起腹腔,并用眼科剪剪开一个小口,用吸管吸取细胞悬液,移入离心管中(个人认为,此法比用注射器抽吸好一些)。
2.2.3 1000 rpm 离心5 min 后,用含双抗的RPMI1640 培养基洗涤一次,再次离心,重悬细胞于含10%小牛血清的RPMI1640 培养液中,如果是作为饲养细胞使用,则选择相应的培养液。
台盼蓝拒染法计数,将细胞稀释到目的浓度后,接种即可。
2.2.4 如果是作为饲养细胞使用,调整浓度至2x105个/mL,接种到96 孔板中,每孔100-200 μL;如果作为其它实验使用,可以调整成2x106/mL,加到24 孔平底培养板中,1 mL/孔;5% CO2温箱孵育2 h 后,换液,并用RPMI1640 培养基洗1-2 次,弃去未粘附细胞,贴壁细胞为单层的巨噬细胞。
3 结果和讨论巨噬细胞刚贴壁时偏圆形,或者类似鹅卵石形状,然后慢慢伸出伪足,铺开呈三角形或多角形。
巨噬细胞有吞噬的特性,当与细菌混合在一起的时候,在40 倍物镜下可以看到巨噬细胞吞噬细菌,因此,巨噬细胞作为饲养细胞可以清除部分污染的细菌、支原体和部分细胞碎片。
腹膜巨噬细胞提取

腹膜巨噬细胞提取腹膜巨噬细胞是一类重要的免疫细胞,它们存在于腹膜腔内,具有吞噬和清除病原体、细胞垃圾、细胞凋亡产物等功能。
本文将从腹膜巨噬细胞的提取方法、特征和功能等方面进行介绍。
腹膜巨噬细胞的提取方法有多种,其中一种常用的方法是腹腔注射法。
具体操作时,首先将小鼠或大鼠按照实验需求进行处理,比如给予某种刺激物。
随后,在消毒条件下,将小鼠或大鼠的腹腔用注射器注入适量的缓冲盐水,轻轻按摩腹部,使腹腔内的细胞混合均匀。
然后,用注射器吸取腹腔内的混合液,将其转移到离心管中,并进行离心分离。
最后,将上清液中的腹膜巨噬细胞收集起来,即可得到腹膜巨噬细胞。
腹膜巨噬细胞具有一些独特的特征。
首先,它们是一类大型细胞,形状呈椭圆形或不规则形状。
其次,腹膜巨噬细胞具有丰富的胞质,含有大量的溶酶体和吞噬体,这使得它们能够进行吞噬和降解病原体。
此外,腹膜巨噬细胞表面具有多种受体,可以识别和结合多种病原体,从而发挥其免疫功能。
此外,腹膜巨噬细胞还能够分泌多种细胞因子,如肿瘤坏死因子和白细胞介素,参与调节免疫反应。
腹膜巨噬细胞在机体的免疫防御中起着重要的作用。
首先,它们是机体的第一道防线,当病原体侵入腹腔时,腹膜巨噬细胞能够迅速识别和吞噬这些病原体,从而阻止其进一步传播。
其次,腹膜巨噬细胞能够分泌多种细胞因子,如干扰素和肿瘤坏死因子,这些细胞因子能够激活和招募其他免疫细胞,如自然杀伤细胞和T淋巴细胞,共同抵抗病原体的侵袭。
此外,腹膜巨噬细胞还能够清除细胞垃圾和细胞凋亡产物,维持组织的正常功能。
除了在免疫防御中的作用外,腹膜巨噬细胞还具有其他重要的生理功能。
例如,研究表明腹膜巨噬细胞参与了脂质代谢的调节,能够调控血脂水平和胆固醇代谢。
此外,腹膜巨噬细胞还参与了肿瘤的发生和发展过程,可以诱导肿瘤细胞凋亡和抑制肿瘤的生长。
因此,对腹膜巨噬细胞的研究不仅对于了解机体的免疫防御机制有重要意义,还对于疾病的预防和治疗具有潜在的临床应用价值。
巨噬细胞培养

巨噬细胞属免疫细胞,有多种功能,是研究细胞吞噬、细胞免疫和分子免疫学的重要对象。巨噬细胞容易获得,便于培养,并可进行纯化。巨噬细胞属不繁殖细胞群,在条件适宜下可生活2-3周,多用做原代培养,难以长期生存。
巨噬细胞也建有无限细胞系,大多来自小鼠,如P331、S774A.1、RAW309Cr.l等,均获恶性,培养中呈巨噬细胞形态和吞噬功能,易于传代和瓶壁分离,但难以建株。
2)用不连续密度梯度离心纯化巨噬细胞
1. 取15ml离心管,将制备好的各浓度密度梯度材料按下浓上淡的顺序依次分层加在离心管中,每个浓度2ml。最后加上上述巨噬细胞悬液3~5ml(约含2×107~5×107细胞)。
2.4℃中,水平离心1000×g 30分钟,垂直取出离心管,小心吸出各交界面的细胞。分别用预冷的含1%小牛血清RPMI-1640培养液洗涤各交界面细胞2次,每次200×g 10分钟。用含10%小牛血清的RPMI-1640培养液将细胞配成所需的浓度。
培养室的设备:
液氮罐、储品柜(存放杂物)、日光灯和紫外灯、空气净化器系统、低温冰箱(-80℃)、空调、二氧化碳缸瓶、边台(书写实验记录)。必须放在无菌间的设备:离心机(收集细胞)、超净工作台、倒置显微镜、CO2孵箱(孵育培养物)、水浴锅、三氧消毒杀菌机、4℃冰箱(放置serum和培养用液)。
二.无菌操作
3.器皿使用前必须过火灭菌
4.继续使用的器皿(如瓶盖、滴管)要放在高处,使用时仍要过火。
5.各种操作要靠近酒精灯,动作要轻、准确,不能乱碰。如吸管不能碰到废液缸。
6.吸取两种以上的使用液时要注意更换吸管,防止交叉污染。
三.器械的清洗和消毒
玻璃器械洗消:
(1)新的玻璃器皿的洗消:
1.自来水刷洗,除去灰尘。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
操作步骤
一、将小鼠以颈椎脱臼法处死,仰卧,固定四肢。
二、依次用碘酒及酒精棉球消毒腹部,以镊子提取腹壁,剪去小块皮肤,继以镊子提取腹腔。
剪一小口,以注射器注入少量冲洗液。
用滴管吸出,再注入冲洗液并吸出,滴管在腹腔内各个位置吸取液体,冲洗每只小鼠腹腔约5ml。
三、将腹腔细胞悬液滴于干净载玻片上,置37度湿盒内,1-2小时后倾去玻片上的液体,
并用腹腔冲洗液轻洗玻片,即可见玻片上有毛玻璃样的单层巨噬细胞粘附,巨噬细胞含量可达90%
四、在显微镜下计算巨噬细胞的百分比,检测分离结果。
小鼠腹腔巨噬细胞的提取与鉴别方法探讨。
