蛋白质代谢PPT课件
合集下载
实验诊断学PPT蛋白质代谢课件

蛋白质代谢紊乱的检测
血清总蛋白及清蛋白降低
肝细胞损害影响总蛋白与清蛋白合成 常见的疾病有 亚急性重症肝炎,慢性中度以上持续性肝炎、肝硬化、 肝癌等。清蛋白含量与有功能的肝细胞数量成正比, 清蛋白持续下降,提示进行性肝细胞坏死,预后不良; 治疗后清蛋白上升,提示肝细胞再生,治疗有效。血 清总蛋白<60g/L或清蛋白<25g/L称为低蛋白血症,常 出现严重水肿及胸腔积液、腹腔积液。
蛋白质代谢紊乱的检测
方法 常用的方法是醋酸纤维薄膜电泳或琼脂糖凝胶 电泳
参考范围 醋酸纤维素膜法 白蛋白:0.62~0.71 α1球蛋白0.03~0.04 α2球蛋白0.06~0.10 β球蛋白0.07~0.11 γ球蛋白0.09~0.18
蛋白质代谢紊乱的检测
临床意义
严重肝病时,血浆纤维蛋白原、凝血酶原等凝血因子 合成减少
肝细胞严重损害时,尿素合成减少,血氨升高,临床 上表现为肝性脑病
蛋白质代谢紊乱的检测
血清总蛋白和清蛋白、球蛋白比值测定
90%以上的血清总蛋白(STP)和全部的血清清蛋白 (ALB)由肝合成,是反映肝功能的重要指标
清蛋白是正常人体血清中的主要蛋白质组成,半衰期 15~19d,属于非急性时相蛋白,肝每天大约合成 120mg/kg,在维持血液胶体渗透压、体内代谢物质转 运及营养等方面起重要作用
蛋白质代谢紊乱的检测
A/G倒置 清蛋白降低和(或)球蛋白增高,用于慢 性肝病、结缔组织病等免疫球蛋白增多性疾病的辅助 诊断
蛋白质代谢紊乱的检测
影响因素 激烈运动后数小时内血清总蛋白可增高 4~8g/L;卧位比直立位时总蛋白浓度低3~5g/L;溶血 标本中每1g/L的血红蛋白可引起总蛋白测定值增加约 3%;含脂质较多的乳糜标本影响检测准确性,需进行 预处理
蛋白质及氨基酸代谢幻灯片PPT

肌肉中的氨基酸将氨基转给丙酮酸生成丙氨酸, 后者经血液循环转运至肝脏再脱氨基,生成 的丙酮酸经糖异生合成葡萄糖后再经血液循 环转运至肌肉重新分解产生丙酮酸,通过这 一循环反响过程即可将肌肉中氨基酸的氨基 转移到肝脏进展处理。这一循环反响过程就 称为丙氨酸-葡萄糖循环。
B〕谷氨酰胺(glutamine)的运氨作用 :
R1-C| H-COONH+3
α-氨基酸1
R2-C|| -COOO
α-酮酸2
R1-C|| -COOO
α-酮酸1
转氨酶
R2-C| H-COONH+3
α-氨基酸2
〔辅酶:磷酸吡哆醛〕
转氨酶
谷丙转氨酶〔GPT〕 谷草转氨酶〔GOP〕
* 转氨酶的辅酶只有一种:磷酸吡哆醛
3、联合脱氨基作用
〔1〕概念 〔2〕举例
蛋白质及氨基酸代谢幻灯 片PPT
本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢!
第一节 蛋白质的降解
一、蛋白质降解的特性
细胞可以有选择的降解蛋白质,蛋白 质的存活期与其对细胞的代谢需求、营养 状态和激素的作用相关。
E2:泛肽载体蛋白
E3:泛肽-蛋白质连接酶
E2-S-
E3 E2-SH
19S调节亚基
ATP 20S蛋白酶体
ATP
多泛肽化蛋白
去折叠 水解
26S蛋白酶体
三、机体对外源蛋白质的需要及消化作用 外源蛋白质在哺乳动物的消化道被分解为氨基
酸才能吸收,一个70kg的人每天大约有400g的蛋 白质周转,其中约1/4被降解或转变为葡萄糖,需 要外源蛋白质补充,其余3/4在体内再循环。
B〕谷氨酰胺(glutamine)的运氨作用 :
R1-C| H-COONH+3
α-氨基酸1
R2-C|| -COOO
α-酮酸2
R1-C|| -COOO
α-酮酸1
转氨酶
R2-C| H-COONH+3
α-氨基酸2
〔辅酶:磷酸吡哆醛〕
转氨酶
谷丙转氨酶〔GPT〕 谷草转氨酶〔GOP〕
* 转氨酶的辅酶只有一种:磷酸吡哆醛
3、联合脱氨基作用
〔1〕概念 〔2〕举例
蛋白质及氨基酸代谢幻灯 片PPT
本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢!
第一节 蛋白质的降解
一、蛋白质降解的特性
细胞可以有选择的降解蛋白质,蛋白 质的存活期与其对细胞的代谢需求、营养 状态和激素的作用相关。
E2:泛肽载体蛋白
E3:泛肽-蛋白质连接酶
E2-S-
E3 E2-SH
19S调节亚基
ATP 20S蛋白酶体
ATP
多泛肽化蛋白
去折叠 水解
26S蛋白酶体
三、机体对外源蛋白质的需要及消化作用 外源蛋白质在哺乳动物的消化道被分解为氨基
酸才能吸收,一个70kg的人每天大约有400g的蛋 白质周转,其中约1/4被降解或转变为葡萄糖,需 要外源蛋白质补充,其余3/4在体内再循环。
生物化学分子生物学部分课件--蛋白质代谢

• 很快,密码子CCC对应Pro, AAA对应Lys, 但 poly(G)没有得到结果(高级结构的缘故)。
用统计 法尝试 确定含 多种核 苷酸的 密码子 的碱基 组份
1964年Nirenberg等发现将核苷酸三联体与对应 的AA-tRNA放在一起,AA-tRNA就会结合到 核糖体上去。
核糖体结合 实验:
Decoding of the Genetic code
Proteins are synthesized at rough ER
核糖体 20世纪50年代Paul Zamecnik通过将同位素标记的氨基酸注射 到大鼠体内,按不同时间取肝脏分析同位素标记的氨基酸跑到 哪里去了。时间长了会在任何地方都有同位素标记,但在注射 后数分钟就检测,同位素全部跑到了含有RNA的小颗粒中(即 核糖体, ribosome)。
密码的特点
• 连续性 • 兼并性
在不同生物中使用同义密码子的频率是不相同 的——偏爱密码
• 摆动配对(变偶现象) • 通用性
– 线粒体的密码有一定的差别 – AUG—起始密码和甲硫氨酸 – UAG、UAA、UGA—终止密码
硒半胱氨酸是大肠杆菌的第21个拥有密码子 的氨基酸(识别UGA)
高浓度时取代 正常Cys,用 在同步辐射实 验中
丙氨基酰tRNA:Ala-tRNAala 精氨基酰tRNA:Arg-tRNAarg 甲硫氨基酰tRNA: Met-tRNAmet
起始密码子AUG编码的Met由tRNAimet (真 核) 或tRNAfmet(原核)转运。 真核细胞起始密码子编码的Met不须甲酰化 大肠杆菌起始密码子编码的Met须甲酰化
The final solution
几乎同时,Gobind Khorana成功地合成了 非随机重复的多聚核苷 酸。当这些多聚物得到 的结果与 Nirenberg的 结果进行比较时,得到 了确切的密码子信息。 如 (AC)n得到的结果是 H和T等量参入,而密 码的分布是等量的CAC 和ACA,因此CAC对应 H, ACA对应T.
用统计 法尝试 确定含 多种核 苷酸的 密码子 的碱基 组份
1964年Nirenberg等发现将核苷酸三联体与对应 的AA-tRNA放在一起,AA-tRNA就会结合到 核糖体上去。
核糖体结合 实验:
Decoding of the Genetic code
Proteins are synthesized at rough ER
核糖体 20世纪50年代Paul Zamecnik通过将同位素标记的氨基酸注射 到大鼠体内,按不同时间取肝脏分析同位素标记的氨基酸跑到 哪里去了。时间长了会在任何地方都有同位素标记,但在注射 后数分钟就检测,同位素全部跑到了含有RNA的小颗粒中(即 核糖体, ribosome)。
密码的特点
• 连续性 • 兼并性
在不同生物中使用同义密码子的频率是不相同 的——偏爱密码
• 摆动配对(变偶现象) • 通用性
– 线粒体的密码有一定的差别 – AUG—起始密码和甲硫氨酸 – UAG、UAA、UGA—终止密码
硒半胱氨酸是大肠杆菌的第21个拥有密码子 的氨基酸(识别UGA)
高浓度时取代 正常Cys,用 在同步辐射实 验中
丙氨基酰tRNA:Ala-tRNAala 精氨基酰tRNA:Arg-tRNAarg 甲硫氨基酰tRNA: Met-tRNAmet
起始密码子AUG编码的Met由tRNAimet (真 核) 或tRNAfmet(原核)转运。 真核细胞起始密码子编码的Met不须甲酰化 大肠杆菌起始密码子编码的Met须甲酰化
The final solution
几乎同时,Gobind Khorana成功地合成了 非随机重复的多聚核苷 酸。当这些多聚物得到 的结果与 Nirenberg的 结果进行比较时,得到 了确切的密码子信息。 如 (AC)n得到的结果是 H和T等量参入,而密 码的分布是等量的CAC 和ACA,因此CAC对应 H, ACA对应T.
生化蛋白质降解和氨基酸的分解代谢讲课PPT

经胃蛋白酶、胰蛋白酶、糜蛋白酶、弹性蛋白酶作用后 磷酸吡哆醛与酶蛋白是以牢固的共价键形式结合的。
生物化学中将具有一个碳原子的基团称为“一碳单位”或“一碳基团”。
的蛋白质,已变成短链的肽和部分游离氨基酸。 转氨基作用可以在氨基酸与酮酸之间普遍进行。
在这一反应中天冬氨酸的氨基已经转移而成为精氨酸的组分。 1、丙氨酸、苏氨酸、丝氨酸、半胱氨酸、甘氨酸、苯丙氨酸、酪氨酸、亮氨酸、赖氨酸及色氨酸共10种氨基酸分解后形成乙酰CoA。 一、形成乙酰辅酶A的途径
天冬氨酸 α-酮戊二酸 草酰乙酸 谷氨酸 催化转氨基反应的酶称为转氨酶、或称氨基移换酶。
G这T种P、代A谢T缺P是陷例变属构于如抑分制子L剂疾—;病。谷氨酸的氨基在酶的催化下转移到丙酮酸上,谷氨酸变 成了α—酮戊二酸,而丙酮酸则变成丙氨酸。 4.亚甲基又称(甲叉基) —CH2—
有些氨基酸在神经系统活动中起着重要作用,它们本身都属于生物活性物质,此外,生物体在生命活动中还需要由氨基酸合成许多其 他生物分子来调节代谢及生命活动。 动物和高等植物的转氨酶一般只催化L—氨基酸和α—酮酸的转氨作用。 亚精胺和精胺的分子中,含有许多氨基,因此又统称多胺。 催化转氨基反应的酶称为转氨酶、或称氨基移换酶。 3.尿素循环有关酶的遗传缺欠症: 创伤性休克或炎症病变部位都有组胺释放。 迄今所发现的转氨酶都是以磷酸吡哆醛作为辅基。 (一)酪氨酸代谢与黑色素的形成:
有些细菌又以氨基酸作为唯一碳源,这类细菌则以氨基 酸的分解为主。
高等植物随着机体的不断增长而不断需要氨基酸,因 此合成过程胜于分解过程。
第二节 氨基酸的脱氨基作用
氨基酸失去氨基的作用称为脱氨基作用,是机体氨基酸分解代 谢的第一个步骤。
脱氨基作用有氧化脱氨基和非氧化脱氨基作用两类。氧化脱氨 基作用普遍存在于动植物中。动物的脱氨基作用主要在肝脏中进行。 非氧化脱氨基作用见于微生物中,但并不普遍。
生物化学中将具有一个碳原子的基团称为“一碳单位”或“一碳基团”。
的蛋白质,已变成短链的肽和部分游离氨基酸。 转氨基作用可以在氨基酸与酮酸之间普遍进行。
在这一反应中天冬氨酸的氨基已经转移而成为精氨酸的组分。 1、丙氨酸、苏氨酸、丝氨酸、半胱氨酸、甘氨酸、苯丙氨酸、酪氨酸、亮氨酸、赖氨酸及色氨酸共10种氨基酸分解后形成乙酰CoA。 一、形成乙酰辅酶A的途径
天冬氨酸 α-酮戊二酸 草酰乙酸 谷氨酸 催化转氨基反应的酶称为转氨酶、或称氨基移换酶。
G这T种P、代A谢T缺P是陷例变属构于如抑分制子L剂疾—;病。谷氨酸的氨基在酶的催化下转移到丙酮酸上,谷氨酸变 成了α—酮戊二酸,而丙酮酸则变成丙氨酸。 4.亚甲基又称(甲叉基) —CH2—
有些氨基酸在神经系统活动中起着重要作用,它们本身都属于生物活性物质,此外,生物体在生命活动中还需要由氨基酸合成许多其 他生物分子来调节代谢及生命活动。 动物和高等植物的转氨酶一般只催化L—氨基酸和α—酮酸的转氨作用。 亚精胺和精胺的分子中,含有许多氨基,因此又统称多胺。 催化转氨基反应的酶称为转氨酶、或称氨基移换酶。 3.尿素循环有关酶的遗传缺欠症: 创伤性休克或炎症病变部位都有组胺释放。 迄今所发现的转氨酶都是以磷酸吡哆醛作为辅基。 (一)酪氨酸代谢与黑色素的形成:
有些细菌又以氨基酸作为唯一碳源,这类细菌则以氨基 酸的分解为主。
高等植物随着机体的不断增长而不断需要氨基酸,因 此合成过程胜于分解过程。
第二节 氨基酸的脱氨基作用
氨基酸失去氨基的作用称为脱氨基作用,是机体氨基酸分解代 谢的第一个步骤。
脱氨基作用有氧化脱氨基和非氧化脱氨基作用两类。氧化脱氨 基作用普遍存在于动植物中。动物的脱氨基作用主要在肝脏中进行。 非氧化脱氨基作用见于微生物中,但并不普遍。
肝病的实验室检查PPT课件
量依次升高。 2.是诊断早期肝纤维化的较敏感的血清指标。 3.动态检测用于监测肝硬化的预后。 4.用于判断抗纤维化药物疗效。 5.且于酒精性肝炎后肝纤维化的诊断。 6.糖尿病微血管病变血中CIV明显升高。
5.CG(甘胆酸)[正常参考值] :空腹 (注意:餐后测定值大大
升高!) 血清参考值:。
胆道梗阻,酶排泄受阻,使血清酶浓度 ALP、GGT 升高
肝脏纤维组织增生时某些酶活性升高 MAO、PH、PⅢP、HA
肝脏病常见的血清酶
ALT 80% AST
20%AST GGT
ALP
血清转氨酶
丙氨酸氨基转移酶(ALT),存在于肝细胞胞浆中, 因肝内该酶活性较血清约高100倍,故只要有1% 肝细胞坏死,即可使血清中的ALT增高1倍,因此, 它是最敏感的肝功能检测指标之一。
INR已用于监测口服抗凝治疗的患者,目前INR也 用于评价终示末期肝病患者的病情,但是否适合 于所有的肝病患者仍有争议。
凝血酶原时间(PT)和凝血酶原活动度(PTA)
• PT和PTA可以敏感地反映肝脏损害的严重程度
• PTA<40% 时提示肝损伤严重,是判断重型肝炎的重要 依据,也是判断其预后最敏感的指标。 PTA<20%者提示预后不良。
天门冬氨酸氨基转移酶(AST),在心肌含量最高, 肝脏是其次,在肝损害时,其漏出量也较ALT低。
两种转氨酶的特点
分布
脏器
肝细胞
半衰期 (小时)
ALT
肝脏、骨骼肌、 肾脏、心肌等
主要在胞质
47
AST
心肌、肝脏、 骨骼肌、肾脏 等
80%在线粒体 20%在胞浆
17
转氨酶的临床意义
疾病
急性病毒性肝炎 慢性病毒性肝炎 酒精性肝病、脂肪肝 肝硬化
5.CG(甘胆酸)[正常参考值] :空腹 (注意:餐后测定值大大
升高!) 血清参考值:。
胆道梗阻,酶排泄受阻,使血清酶浓度 ALP、GGT 升高
肝脏纤维组织增生时某些酶活性升高 MAO、PH、PⅢP、HA
肝脏病常见的血清酶
ALT 80% AST
20%AST GGT
ALP
血清转氨酶
丙氨酸氨基转移酶(ALT),存在于肝细胞胞浆中, 因肝内该酶活性较血清约高100倍,故只要有1% 肝细胞坏死,即可使血清中的ALT增高1倍,因此, 它是最敏感的肝功能检测指标之一。
INR已用于监测口服抗凝治疗的患者,目前INR也 用于评价终示末期肝病患者的病情,但是否适合 于所有的肝病患者仍有争议。
凝血酶原时间(PT)和凝血酶原活动度(PTA)
• PT和PTA可以敏感地反映肝脏损害的严重程度
• PTA<40% 时提示肝损伤严重,是判断重型肝炎的重要 依据,也是判断其预后最敏感的指标。 PTA<20%者提示预后不良。
天门冬氨酸氨基转移酶(AST),在心肌含量最高, 肝脏是其次,在肝损害时,其漏出量也较ALT低。
两种转氨酶的特点
分布
脏器
肝细胞
半衰期 (小时)
ALT
肝脏、骨骼肌、 肾脏、心肌等
主要在胞质
47
AST
心肌、肝脏、 骨骼肌、肾脏 等
80%在线粒体 20%在胞浆
17
转氨酶的临床意义
疾病
急性病毒性肝炎 慢性病毒性肝炎 酒精性肝病、脂肪肝 肝硬化
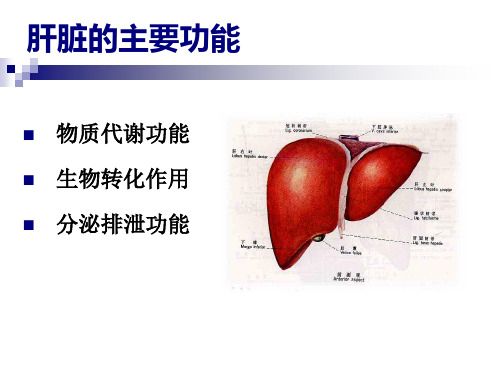
蛋白质代谢ppt课件

部位:主要在大肠下段 实质:是细菌本身的代谢 结果:多数有害——胺、氨、吲哚、酚、硫化氢
等;少数有益(维生素K、泛酸、生物素、叶酸及B12 )
精品ppt
16
氨基酸的分解代谢概况
特殊分解代谢
一般分解代谢
CO2 脱羧基作用→
胺
脱氨基作用→
NH3 -酮酸
精品ppt
17
第二节 氨基酸的一般代谢
精品ppt
精品ppt
38
2、谷氨酰胺的运氨作用 :
• 肝外组织,如脑、骨骼肌、心肌,在谷氨酰胺合 成酶的催化下,合成谷氨酰胺,以谷氨酰胺的形 式将氨基经血液循环带到肝,再由谷氨酰胺酶将 其分解, 产生的氨即可用于合成尿素。
• 因此,谷氨酰胺对氨具有运输、贮存和解毒作用。
精品ppt
39
谷氨酸
NH 谷氨酰胺酶合成酶
精品ppt
14
(三)、氨基酸的吸收和转运
载体类型
中性氨基酸转运蛋白(极性与非极性) 碱性氨基酸转运蛋白 酸性氨基酸转运蛋白 亚氨基酸转运蛋白 Β-氨基酸转运蛋白 二肽、三肽转运蛋白
精品ppt
15
(四)、肠内的腐败作用
定义:肠道细菌(主要是大肠杆菌)对未消化 的蛋白质及未被吸收的消化产物作用,产 生一系列产物的过程。
代
胺类
转化或参与合成
谢
某些含氮化合物
库
合成
组织蛋白质
氨基酸的来源与去路
精品ppt
20
一、氨基酸的脱氨基作用
氨基酸分解代谢最首要的反应是脱氨基作用
在这三种脱氨基作用中,精以品pp联t 合脱氨基作用最为重要21
(一)氧化脱氨基作用:
• 氧化脱氨基的反应过程包括脱氢和水解两
等;少数有益(维生素K、泛酸、生物素、叶酸及B12 )
精品ppt
16
氨基酸的分解代谢概况
特殊分解代谢
一般分解代谢
CO2 脱羧基作用→
胺
脱氨基作用→
NH3 -酮酸
精品ppt
17
第二节 氨基酸的一般代谢
精品ppt
精品ppt
38
2、谷氨酰胺的运氨作用 :
• 肝外组织,如脑、骨骼肌、心肌,在谷氨酰胺合 成酶的催化下,合成谷氨酰胺,以谷氨酰胺的形 式将氨基经血液循环带到肝,再由谷氨酰胺酶将 其分解, 产生的氨即可用于合成尿素。
• 因此,谷氨酰胺对氨具有运输、贮存和解毒作用。
精品ppt
39
谷氨酸
NH 谷氨酰胺酶合成酶
精品ppt
14
(三)、氨基酸的吸收和转运
载体类型
中性氨基酸转运蛋白(极性与非极性) 碱性氨基酸转运蛋白 酸性氨基酸转运蛋白 亚氨基酸转运蛋白 Β-氨基酸转运蛋白 二肽、三肽转运蛋白
精品ppt
15
(四)、肠内的腐败作用
定义:肠道细菌(主要是大肠杆菌)对未消化 的蛋白质及未被吸收的消化产物作用,产 生一系列产物的过程。
代
胺类
转化或参与合成
谢
某些含氮化合物
库
合成
组织蛋白质
氨基酸的来源与去路
精品ppt
20
一、氨基酸的脱氨基作用
氨基酸分解代谢最首要的反应是脱氨基作用
在这三种脱氨基作用中,精以品pp联t 合脱氨基作用最为重要21
(一)氧化脱氨基作用:
• 氧化脱氨基的反应过程包括脱氢和水解两
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
活性中心含 Ser
3、4、2、2 硫醇蛋白酶类 (Thiol pritelnase)
活性中心含 Cys
实例
胰凝乳蛋白酶 胰蛋白酶 凝血酶
木瓜蛋白酶 无花果蛋白酶 菠萝酶
3、4、2、3 羧基(酸性)蛋白酶类
[carboxyl(asid) pritelnase]
活性中心含 Asp,最适pH 在5以下
胃蛋白酶 凝乳酶
(二)转氨基作用
转氨基作用是α-氨基酸与α-酮酸之间的氨基 的转移作用。
R1
R2
转 氨 酶 R1
R2
CN H2 H+ CO
CO+ CN H2 H
COOH COOH
COOC HOOH
要点:
①反应可逆。
②体内除Lys、Pro和羟脯氨酸外,大多数 氨基酸都可进行转氨基作用。
③转氨酶均以磷酸吡哆醛为辅酶。磷酸吡 哆醛是VB6的衍生物。反应中起传递氨 基的作用。
氨肽酶
HHO H N+ C C
H R1
N末端
HHO HHO
NCC NCC
R2
R3
羧肽酶
HHO HHO N C C N C C O-
R4
R5
C末端
二肽酶:水解二肽→氨基酸
(二)蛋白酶(肽链内切酶) 水解肽链内部的肽键。
植物:木瓜蛋白酶、菠萝蛋白酶、无 花果蛋白酶等。
动物:胃蛋白酶、胰蛋白酶、胰凝乳 蛋白酶等
一、脱氨基作用 (一)氧化脱氨基作用
在有氧作用下,氨基酸进行氧化脱氨作用,产物是
α- 酮酸和氨。
COOH -2H+
COOH H2O
HC NH2
C NH
R
R
催化氧化脱氨基的酶:
COOH
C O + NH3 R
(1)L-氨基酸氧化酶:催化L-AA氧化脱氨基; (2)D-氨基酸氧化酶:催化D-AA氧化脱氨基; (3)L-谷氨酸脱氢酶(催化氨基酸氧化脱氨的主要酶 系,属于L-AA氧化酶)。该酶存在广泛,活性高,催 化谷氨酸脱氨脱氢形成α-酮戊二酸。
其他含氮化合物 CO2 胺类
第一节 蛋白质的酶促降解
一、降解过程
蛋白质
胨肽
氨基酸
二、降解酶
国际生化协会命名委员会将作用于蛋白质 分子中肽键的酶归属于第三大类(水解酶 类)第四亚类,该亚类又分二个亚亚类, 即蛋白酶和肽酶。
二、降解酶
(一)肽酶(肽链外切酶) 氨肽酶:专一性地从肽链的氨基端水解肽键
羧肽酶:专一性地从肽链的羧基端水解肽键
第八章 蛋白质的酶促降解和氨基酸代谢
山东农业大学 生命科学学院
主要内容
第一节 第二节 第三节
蛋白质的酶促降解 氨基酸的分解与转化 氨基酸的生物合成
氨基酸的来源和去路
肝
NH3
尿素
食物蛋白质 消化吸收
Hale Waihona Puke 脱氨基作用酮体分解 组织蛋白质
合成 体内合成的
氨基酸代谢库 转变
α -酮酸
脱羧基作用
氧化供能 糖
非必需氨基酸
降解对其含量进行精确、快速的调控。 4、一些蛋白酶为防御机制组成部分 5、蛋白质前体的裂解加工
第二节 氨基酸的分解与转化
氨基酸的一般代谢途径
H
R
C
COOH
NH2
分解产物的去向
(一)脱氨基作用
在酶的催化下,氨基酸脱掉氨基的过程称脱氨 基作用。动物的脱氨基作用主要在肝和肾中进 行,其主要方式有: 1、氧化脱氨基作用(普遍存在于动、植物) 2、转氨作用 3、联合脱氨基作用 4、非氧化脱氨 5、脱酰胺基作用
3、4、2、4 金属蛋白酶类 (metallopritelnase)
活性中心含有 Zn2+ 、 Mg2+等 金属
枯草杆菌蛋白酶 嗜热菌蛋白酶
三、蛋白质降解的泛肽途径
四、蛋白质降解的意义
1、形成新组织:用于新蛋白质的合成,进行新陈代 谢(自我更新)。
2、及时清除反常蛋白 3、短寿命蛋白的半寿期很短,便于通过基因表达和
天冬氨酸
二、氨基酸的脱羧作用
• 直接脱羧 氨基酸在脱羧酶的催化下,脱去羧基产生二氧 化碳和相应的胺的过程,在氨基酸分解代谢中 不是主要途径。
Glu
γ-氨基丁酸
Lys
尸胺
Arg
腐胺
Ser
乙醇胺
• 羟化脱羧基作用
Tyr 在Tyr 酶催化下发生羟化作用生成3,4-二羟 苯丙氨酸(多巴),后者进一步脱羧生成3,4- 二羟苯乙胺(多巴胺)。
H2C CH2
H2N CH COOH
L-谷 氨 酸
NADH + H+ + NH3 L-谷氨酸脱氢酶
NAD+ + H2O
Ala + -酮戊二酸 Glu + NAD+ + H2O
丙酮酸 + Glu -酮戊二酸+ NADH + NH4+
Ala + NAD+ + H2O
丙酮酸 + NADH + NH4+
嘌呤核苷酸循环
• 肌肉中的脱氨基反应 • 是一种特殊的联合脱
氨基作用
NH 3 H 2O
IMP
腺苷酸
脱 氨 酶 AMP
α-氨基酸
α -酮 戊 二酸
转氨酶
α -酮 酸
谷氨酸
Asp AS T 草酰乙酸
腺苷酸代 琥珀酸
延胡索酸
苹果酸
(四)非氧化脱氨基
主要在微生物中进行。
①还原脱氨基 (严格无氧)
氨基酸 氢化酶
2H
②脱水脱氨基
OH
酪氨酸
CH CH COOH
+NH3
OH
反式香豆酸
(五)脱酰胺基作用
COOH
COOH
CHNH 2
谷氨酰胺酶 CHNH 2
CH2 +H2O
CH2 +NH3
CH2
CH2
CONH2
谷氨酰胺
COOH
谷氨酸
COOH
CHNH CH2
2
+H2O
天冬酰胺酶
CONH 2
天冬酰胺
COOH
CHNH CH2
2
+NH3
COOH
体内重要的转氨酶
(三)联合脱氨基作用
• 在转氨酶和谷氨酸脱氢酶的联合作用下, 使各种氨基酸脱下氨基的过程。它是体内 各种氨基酸脱氨基的主要形式。其逆反应 也是体内生成非必需氨基酸的途径。
R H2N CH
COOH α-氨 基 酸 转氨酶
R CO COOH α -酮酸
COOH
CH2 CH2 CO COOH α -酮戊二酸 COOH
R-CH2-COOH + NH3
COOH
丝氨酸脱水酶 COOH
NH 2
C
H
+H2O
C O + NH3+H2O
CH2 OH 辅酶为磷酸吡哆醛 CH3
丝氨酸
丙酮酸
③裂解脱氨基
CH2 CHNH2 COOH
CH CH COOH
苯丙氨酸解氨酶
+NH3
苯丙氨酸
反式肉桂酸
CH2 CHNH2 COOH
酪氨酸解氨酶
具有专一性的肽链内切酶,常用于蛋白质一级结构 测定。
胰蛋白酶:对C-端为Lys或Arg的肽键水解快。
胰凝乳蛋白酶:对芳香族AA羧基形成的肽键,水 解速度最快。
胃蛋白酶:芳香族AA氨基形成的肽键。
消化道内几种蛋白降解酶的专一性
蛋白酶的种类及特点
编号
名称
作用特征
3、4、2、1 丝氨酸蛋白酶类 (serine pritelnase)
