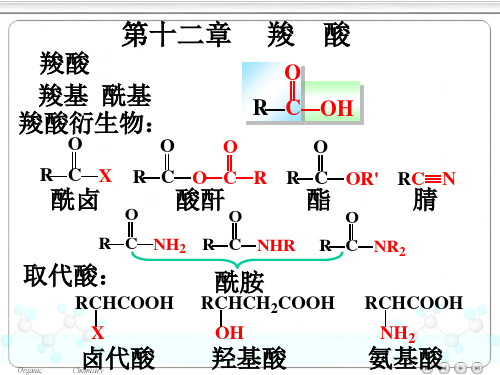
羧酸羧酸衍生物取代酸
羧酸及其衍生物和取代酸

O R1 C NH2 NH3
3.氨解:产物为酰胺。
O R1 C Cl NH4Cl
O R1 C O
O C R2 R4 R3 N H O R1 C R4 N R3 +
O R2 C ONH4
O R1 C O R2 R 2 OH
O R1 C NH2 NH3
4.克莱森(Claisen)缩合反应:得到β-羰基酯 例如:
⑷ 酰胺的生成:
O R 1 C OH O O
+
NH3
R 1 C O NH4
△ -H2O
O
R 1 C O─NH2
△ -H2O
R1 C
+H2O N
R 1 C NH2
二元酸也有上述反应。 3.还原:用催化氢化法(H2/Pt)难以还原,LiAlH4可以还原羧基为羟基。
O R C OH LiAlH4 R CH2 OH
O CH2 CH2 C O Cl
PCl5 H3C ( CH 2) 6 COOH H3C ( CH 2) 6 C Cl
⑶ 酯的生成:
O R1 COOH
+
R2 OH
浓 H2SO4
△
R1 C
O
R2
+H2O
上述反应为可逆反应。提高反应速度的措施有两个: a 加入酸作为催化剂; b 升高温度。 提高反应的产率的措施有两个:a 增加反应物醇(一方面是因为副反应主要 来自于醇另一方面是因为醇相对于酸来说较为便宜);b 移去产物,使平衡向 右移动。
名称(俗名) 熔点 沸点 溶解度(克/100克水) PKa
甲酸(蚁酸) 乙酸(醋酸) 苯甲酸(安息香酸) 乙二酸(草酸) 丙二酸(缩苹果酸) 丁二酸(琥珀酸) 顺丁烯二酸(马来酸) 反丁烯二酸(延胡索酸) 邻苯二甲酸(酞酸)
羧酸、羧酸衍生物和取代羧酸

O RCHX C X + HX
O RCHX C X + RCH2COOH
O RCHXCOOH + RCH2C X
生成的一卤代物还可以被进一步卤代,直至所有-H的
全部被取代
43
羧酸的化学性质
应用
生成的α-卤代酸可以转化成各种取代酸:
BrCH2-COOH NaOH
BrCH2COONa NaCN NCCH2COONa
酸性
成-消除
(表现为羟基的
取代)
O
RC COH
H
还原成 CH2
α–H 反应
脱羧反应
14
羧酸的化学性质
酸性
在水溶液中
一般羧酸属弱酸,但比碳酸强,所以可以分解碳酸盐, 这个性质可用来区别或分离酚和酸。上述性质可用 来使羧酸与不溶解于水的或易挥发的物质分离
15
羧酸的化学性质
羧酸和醇在结构上只差一个C=O,但其酸性却相差 很大。
诱导效应的特点:
A. 具有加和性
Cl3CCOOH > Cl2CHCOOH > ClCH2COOH
pKa
0.64
1.26
2.86
B. 诱导效应强度与距离成反比,距离↑,诱导效应强度↓
α
CH3CH2CHCOOH
Cl
pKa
2.82
>
βα
CH3CHCH 2COOH
Cl
4.41
>
γ βα
CH2CH2CH2COOH
(3)芳香族羧酸命名,若羧基直接连在苯环上的以苯甲酸 为母体,若羧基连在侧链,则把芳环作为取代基来命名, 编号从羧基所连的碳原子开始
CH CHCOOH
CH3CHCOOH
3苯基丙烯酸(肉桂酸)
第十章羧酸及其衍生物和取代酸详解演示文稿

第十七页,共53页。
4、 羧酸的受热分解-脱羧反应
羧酸分子脱去CO2的反应叫脱羧反应,根据羧酸结构不同可以得 到不同产物
(1) 一元羧酸
R – COONa NaOH-CaO
共熔
R - H + Na2CO3
羧酸的α位上有强吸电子基团时,容易脱羧
CCl3 – COOH
△
CHCl3 + CO2↑
R'
浓H2SO4
R
O C
O
△
R' + H2O
CH2COOH 浓H2SO4
OH
CH2
CO O
H3O+
CH2COOH OH
第十六页,共53页。
3、 还原
用LiAlH4可以将羧酸还原为醇,该还原剂不影响化合物中的
不饱和键.
O R C OH
LiAlH4
R CH2 OH 伯伯醇醇
H2C CH CH2 COOH LiAlH4 H2C CH CH2 CH2 OH
⑴ 酰氯、酰胺:将相应的“酸”改为酰氯、酰胺即可。例如:
第二十七页,共53页。
⑵ 酸酐
由相应的酸来命名
两分子酸相同:
O CH3 C
O CH3 C
O
乙酸酐
O CH3 CH2 C
O CH3 CH2 C
O
丙酸酐
O C
O
C O
苯甲酸酐
两分子酸不同:
O CH3 C
O
CH3 CH2 C O
乙(酸)丙(酸)酐
第二十八页,共53页。
3、苯甲酸 安息香酸,苯甲酸钠作为防腐剂. 4、乙二酸 草酸,酸性最强的二元酸.具有很强的配位能力.在定量分析中
羧酸及衍生物

H HOOC
H
chrysanthemic acid (pyrethrin)
二、物理性质(physical properities)
沸 点:
CH3CH2CH2OH CH 3CO OH
2OH
HCOO H
+ H2O
COOH 230℃ COOH
丁二 酸 酐 二 丁 CO 酸 酐 O
KMnO4 H2SO4
O
COOH COOH
P2O5
O
O + H2OFra bibliotek⑷ 酰卤 (acyl halide)的生成:
O R C O OH + Cl S Cl 亚硫酰氯 氯化亚砜 O
R
C
Cl + HCl + SO2
卤化试剂:PCl3, PCl5, SOCl2, PBr3
COOH
A-CH2-COOH
加热 ,碱
CH
ACH3 + CO2
在结构上,两个吸电子基连在同一个碳上的 化合物,热力学上是不稳定的,受热易脱羧。
HOOCCH2COOH
CH3COOH + CO2
当-碳上连有吸电子基团时,羧酸受热易发生脱 羧反应。
O O CH3 C C O H
-CO2
O CH3 C H
合成题:
COOH CH2Br
解:
COOH 1).LiAlH4 2).H3O+
HBr CH2Br
CH2OH
4. 脱羧反应(decarboxylation)
—羧酸失去羧基的反应,即脱去一分子CO2。
有机化学(第二版)答案__赵建庄
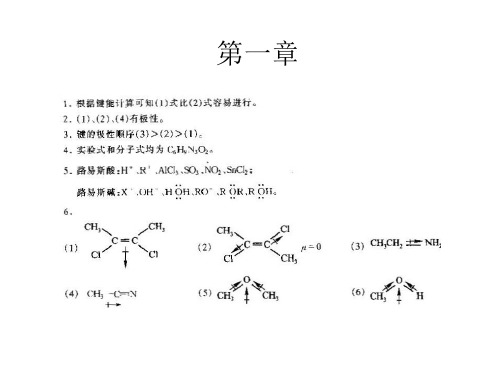
另一组答案为: A.
B. H3C CH2 CH2 CH2Br
C. H3C CH 2 CH CH2
10.
氧化后得到的
对称二酮为:
11.
反应式如下:
12. 透视式
纽曼式
第五章 卤代烃习题参考答案
1. (1) 2-甲基-4-氯戊烷 (3) 4-溴-1-环己烯 (5) 2-氯-4-溴甲苯
(2) 2-氯-2-己烯-4-炔 (4) 苄溴(溴化苄,苯溴甲烷) (6) 3,6-二氯-2-甲萘
H+ -H2O
H3C C CH CH 2 CH3 CH3
+ (1) O3
(2) Zn, H2O H3C CH 2 CHO
O H3C C CH3
丙醛可发生银镜反应,丙酮可发生碘仿反应。
第十章 羧酸、羧酸衍生物和取代酸 参考答案
1. (1) 3-甲基丁酸
(2) 3-乙基-3-丁烯酸
(3) 2,3-环氧丁酸
(4) 1,3-(间)苯二甲酸
(5) 2,4-二氯苯氧乙酸
(6) 反-1,2-环丙二甲酸
(7) 4-甲基-2,4-戊二烯酸
(8) 2-甲基丁酸
(9) 3-(间)甲基苯甲酰溴 (10) 乙酸对甲基苯酯
(11) N-甲基-N-乙基甲酰胺 (12) 乙丙酐
(13) 二乙酸乙二酯
(14) γ –丁内酯
(15) 2-甲基-3-丁酮酸
2.
3. (1)
(2)
(3)
(4)
(5)
4. (1)
(2)
5. (1)
+ CH3I
(2)
O
(3)
(4) 2 H3C C CH3
(5)
(6)
,
有机化学08-羧酸、羧酸衍生物及取代酸

C H 3C H C H C O O H
2-丁烯酸(琥珀酸) 丁烯酸( 丁烯酸 琥珀酸)
2,3-二甲基丁酸 二甲基丁酸
③芳香酸和脂环酸,可把芳环和脂环作为取代基来命名。 芳香酸和脂环酸,可把芳环和脂环作为取代基来命名。
CH CHCOOH
COOH OH
(1) 诱导效应是影响羧酸酸性的主要因素: 诱导效应是影响羧酸酸性的主要因素: 吸电子取代基使O—H键极性增强,较易解离出 +,且 键极性增强, 吸电子取代基使 键极性增强 较易解离出H 吸电子效应使-COO-负离子的电荷更加分散,酸性增强; 负离子的电荷更加分散,酸性增强; 吸电子效应使 供电子取代基使酸性减弱。 供电子取代基使酸性减弱。 -I使酸性增强 X-CH2COOH 使酸性增强 X= F Cl Br I H pKa 2.66 2.86 2.90 3.18 4.76 +I使酸性减弱 使酸性减弱 HCOOH CH3COOH pKa 3.75 4.76 NO2 1.68 N+(CH3)3 1.83
COOH COOH
顺-丁烯二酸
邻苯二甲酸
二元酸
HOOCCOOH HOOCCH2COOH HOOC(CH2)2COOH (Z)-HOOCCH=CHCOOH (E)-HOOCCH=CHCOOH
系统命名
乙二酸 丙二酸 丁二酸 顺-丁烯二酸 丁烯二酸 反-丁烯二酸 丁烯二酸
普通命名
草酸 缩苹果酸 琥珀酸 马来酸 富马酸
二、羧酸的结构
O R C O-H
p-π共轭 共轭
C=O碳原子为sp2杂化; C=O碳的p轨道与C=O氧的p轨道平行,相互重叠形成π键; -OH氧p轨道上的孤对电子与C=O的π键形成π34大π键, -OH中氧上电子云密度降低, C=O中碳原子正电性下降。 氧上电子云密度降低, 碳原子正电性下降。
有机化学10第10章 羧酸及其衍生物

• 取代基的供电子(+I效应)强弱次序:
•注意: 与苯环、1,3-丁二烯和烯烃的-,p-共轭效应比较: 共轭效应是指在共轭体系中原子间的一种相互影响,这种 影响造成分子更加稳定,内能更小,键长趋于平均化。 共 轭效应常与诱导效应同时存在,共同起作用。(苯的定位)
有机化合物酸性的强弱主要受其结构的电子效应、杂 化、氢键、空间效应和溶剂的影响。 1. 羧酸的酸性 (1) 脂肪族羧酸
CH3
KMnO 4 / NaOH
COOH
KMnO 4 / NaOH
C2 H5
CH3
K2Cr2O 7 / H2SO 4
COOH
NO2
NO2
CH(CH3)2
Na2Cr2O 7 / H2SO 4
COOH
COOH (CH2)6CH3
CH3
KMnO 4 / NaOH
COOH
侧链是叔烷 基,很难氧 化,强氧化 剂时环发生 破裂。
• 羧酸的沸点高于质量相近的醇——双分子缔合
O H O CH3 C O H O C CH3
R O H O R H O H O R R H
10.4 羧酸的化学性质
-H取 代反应
H C
O C O
C=O 基亲核加成 O H 键断裂而
呈酸性
R
H
脱羧反应
H
OH被取代反应
羧酸的化学反应包括: (1) O—H键的酸性; (2) —H取代反应 (3) —OH基取代反应; (4) C=O亲核加成 (5) 脱羧反应
第十章 羧酸及其衍生物、取代羧酸
(一)羧酸
10.1 羧酸的结构、分类和命名
——羧酸的分子中都含有羧基官能团
10.1.1 羧酸的结构
有机化学第九章(2024版)

NH3 (过 量) NH4B r
H2NC H2C O O H
= CH2 CHBrCOOH KOH / CH3OH CH2 CHCOOH
CH2 CHBrCOOH
CH2 =CHCOOH
26
甲酸
❖ 俗名蚁酸,其结构特殊,它的羧基与一氢原子相连, 表现出某些醛的性质,具有较强的还原性,能被托
伦试剂、斐林试剂氧化,也容易被一般的氧化剂氧 化生成二氧化碳和水:
F
OH
pKa
2.66
3.83
3)与碳原子相连的基团不饱和性↑,吸电子能力↑。 = C CH > CH CH2 > CH2CH3
= C H CC H2C O O H > C H2 C HC H2C O O H > C H3C H2C H2C O O H
pKa
2.85
4.35
4.82
(C H3)3N+C H2C O O H
CH2NH2
H
反-4-(氨甲基环己烷)甲酸
止血环酸
6
❖ 芳香羧酸的命名,把芳基作为取代基:
COOH
COOH
CH2COOH
苯甲酸 安息香酸
OH 邻羟基苯甲酸 水杨酸
COOH
α-萘乙酸 COOH
COOH 1,2-苯二甲酸
HO
OH
OH 33,,44,,5-5三-三 羟羟 基苯基甲甲酸酸
没食子酸
7
第一节 羧酸
COOH
2
命名
❖ 脂肪族一元羧酸的命名与醛类相似,即选择含羧基 的最长的碳链为主链,按主链的碳原子数称为某酸:
HCOOH 甲酸
CH3COOH
乙酸 醋酸
γ βα
4 3 21
H
羧酸
NH2
12.1 羧酸的分类和命名 分类:脂肪族、脂环族、芳香族、 分类:脂肪族、脂环族、芳香族、杂环族 命名: 命名:
•含羧基的最长链为主链,称“某酸”; 编号从羧基开 含羧基的最长链为主链, 含羧基的最长链为主链 某酸” O 始 BrCH2CH2CH2COOH CH CH CHCH CH C OH
羧酸
醇
酯
酯化反应机理: 酯化反应机理: 羰基质子化: 第一步 羰基质子化:
O R C OH
H+
OH R C OH R
OH C OH
醇分子对质子化羰基的亲核进攻: 第二步 醇分子对质子化羰基的亲核进攻:
OH R C OH
R'OH
OH R C OH H R' O
四面体中间体
质子转移与脱水: 第三步 质子转移与脱水:
O O O CH3 CH2 CH C OH > CH3 CH CH2 C OH > CH2 CH2 CH2 C OH Cl Cl Cl
pKa: 2.86 4.0 4.52 诱导效应随着传递距离的增大而迅速减小。 诱导效应随着传递距离的增大而迅速减小。
B.共轭效应: .共轭效应:
苯甲酸的对位连有第二类定位基时酸性增强 苯甲酸的对位连有第二类定位基时酸性增强 对位
K2Cr2O7 - H2SO4 82%
(CH3)3C
CH C(CH3)3 COOH
12.3.3 腈水解
CH3 CN
H2O, H2SO4 ~85%
CH3 COOH
12.3.4 Grignard 试剂与 试剂与CO2作用
Grignard 试剂的羧化作用
+
C(CH3)3 (CH3)3C MgCl O C O O C O MgCl
羧酸、羧酸衍生物及取代酸

三、羧酸的物理性质
室温下,十个碳原子以下的饱和一元脂肪羧酸是有 刺激性或腐败气味的液体,十个碳原子以上的脂肪羧酸是 蜡状固体,饱和二元脂肪羧酸和芳香羧酸在室温下是结晶 状固体。 直链饱和一元羧酸的熔点随分子量的增加而呈锯齿 状变化,偶数碳原子的羧酸比相邻两个奇数碳原子的羧酸 熔点都高,这是由于含偶数碳原子的羧酸碳链对称性比含 奇数碳原子羧酸的碳链好,在晶格中排列较紧密,分子间 作用力大,需要较高的温度才能将它们彼此分离,所以熔 点较高。 羧酸在水中的溶解度比相应的醇大。
HOOC
CH 2
COOH
CH 3COOH + CO 2
丁二酸及戊二酸加热至熔点以上不发生脱羧 反应,而是分子内脱水生成稳定的内酐。
O CH2 COOH CH2 COOH
△
CH2 C O CH2 C O
O
+
H 2O
CH2 COOH H2C CH2 COOH
△
CH2 C H2C CH2 C O O
+
O CH3 C Cl
O CH3CH2
丙酰溴
O
C
Br
苯甲酰氯
C
Cl
乙酰氯
酸酐根据相应的羧酸命名。两个相同羧酸形成的酸酐 为简单酸酐,称为“某酸酐”,简称“某酐”;两个不相 同羧酸形成的酸酐为混合酸酐,称为“某酸某酸酐”,简 称“某某酐”;二元羧酸分子内失去一分子水形成的酸酐 为内酐,称为“某二酸酐”。
4.52
(4)当烃基上连有供电子基团时,基团的供电子 能力越强,羧酸的酸性就愈弱。供电子基团的数目增加, 酸性减弱:
第九章羧酸及其衍生物

第九章羧酸及其衍⽣物第九章羧酸及其衍⽣物和取代酸第⼀部分羧酸⼀、羧酸的结构亲核加成反应活性不如醛酮⼆、羧酸的分类三、羧酸的命名1、许多羧酸有俗名,主要是根据其来源命名的2、系统命名法:1)选择分⼦中含有羧基最长碳链为主链,根据主链上碳原⼦数称为某酸,超过10个碳时⼀般称为“某碳酸”,如⼗⼋碳酸。
2)脂肪族⼆元羧酸的命名,是选择分⼦中含有两个羧基的最长碳链为主链,称为某⼆酸3)芳⾹族羧酸和脂环族羧酸,芳基或脂环基作为取代基。
四、羧酸的物理性质五、羧酸的化学性质R C C O HOH-活泼H 的反应酸性羰基的亲核加成,然后再消除(表现为羟基的取代)。
羰基的亲核加成,还原。
脱羧反应1、酸性A 、诱导效应A.相连原⼦或基团的电负性B.电负性原⼦或基团的加和性C.原⼦或基团与羧基的相关距离B 、共轭效应芳⾹酸:间位只考虑诱导效应对位同时考虑共轭效应和诱导效应,共轭为主邻位要考虑共轭效应和诱导效应外,还要考虑可能存在氢键吸电⼦取代基:邻>对>间给电⼦取代基:邻>间>对1)取代基团对酸性影响影响成盐及有关反应羧酸盐与卤代烷反应合成酯2)酸性相关的反应2、羧酸衍⽣物的⽣成酰基化反应: 羧酸衍⽣物的⽣成1)酰卤的⽣成(PX3, PX5, SOCI2)酰卤极其怕⽔,遇⽔⽔解.2)酸酐的⽣成⼄酸酐本⾝具有较强的脱⽔能⼒,因此常作为脱⽔剂使⽤交叉酸酐的制备:羧酸钠盐和酰氯3)酯化反应4)酰胺的⽣成反应是可逆的,加热、脱⽔有利于正反应,为了使正反应顺利进⾏,常采⽤苯、甲苯带⽔的⽅式除去反应体系中产⽣的⽔。
2、羧酸的还原羧基的吸电⼦能⼒⽐羰基⼩,羧酸必须在磷或硫等催化剂存在下才能发⽣α-H 的卤代反应双键不受影响*1. 反应不能得到醛,因为醛在此条件下⽐酸更易还原。
*2. ⽤LiAlH 4还原时,常⽤⽆⽔⼄醚、四氢呋喃做溶剂。
4、脱羧反应 PPT265、α-H 的卤代6、⼆元羧酸的反应——Blanc 规则Blanc 规则:有成环可能时,⼀般易形成五元或六元环第⼆部分羧酸衍⽣物⼀、羧酸衍⽣物的结构与命名1、结构2 命名1)酰胺和酰卤根据酰基的名称,命名为“某酰卤”或“某酰胺”2)酸酐根据⽔解所得的酸命名为“某酸酐”(根据来源的酸进⾏命名)。
有机第八章羧酸和取代酸

内容重点:
羧酸及其衍生物的命名
羧酸及其衍生物的物理性质
羧酸及其衍生物的化学性质(酸性比较、羧酸衍生物的转化、 酯的缩合、互变异构、乙酰乙酸乙酯的应用)
羧酸及其衍生物的相互转化
ቤተ መጻሕፍቲ ባይዱ难点:
羧酸的分类和命名 羧酸的物理性质(氢键的形成及其作用) 羧酸的结构和化学性质
羧酸是许多有机物氧化的最后产物,它
H3C C H3C C O OH OH O
P2O 5
O OH OH
P2O5
R R
C C O + H2O O
H3C C H3C C
O O O
-H2O
+
H 3PO 4
CH2COOH
O O CH3COCCH3 O O O
COOH
若羧酸为长链二元酸,则脱水生成内酸酐。
CH 2 C H2C CH 2
O OH OH C O
4-溴丁酸
12-羟基-9-十八碳烯酸
HCOOH
甲酸
CH3CH2COOH
丙酸
CH3 CH2CH3 CH3 CH CH CH2 COOH
4-甲基-3-乙基戊酸
H3C H
C
C
CH3 CH2 COOH
E-3-甲基-3-戊烯酸
HOOC-CH 2-CH2-COOH
丁二酸
分子中含有脂环或芳环的羧酸,按羧基所连接的位 置的不同,母体有两种选择:
DCC/THF 0C
o
CH3CON(CH3)2
二元羧酸与氨共热生成酰亚胺
3、脱羧反应 羧酸分子失去CO2的反应叫脱羧反应。羧酸只有在
较强烈的条件下,才可发生脱羧反应。 一元羧酸:
(1)羧酸的钠盐与强碱共熔,生成少一个碳原子的烃
羧酸和取代羧酸

羧酸的系统命名法与醛相似。对于简单的脂肪 酸也常用 a、b、g 等希腊字母表示取代基的位次;
CH3 CH3-CH2-CH-CH2-CO2H
54 3 2 1 gb a
3-甲基戊酸 b-甲基戊酸
CH3 Br-CH2-CH2-CH-CO2H
4321 g ba
2-甲基-4-溴丁酸 a-甲基-g-溴丁酸
6
Cl
Cl
Cl
pKa 2.84
4.06
4.52
4.82
(4) HO2C-CO2H HO2C-CH2-CO2H HO2C-CH2CH2-CO2H
Ka1 5.9×10-2
1.6×10-3
6.8×10-5
电离后的羧基负离子对第二个羧基有斥电子 诱导效应,因此第二个羧基比第一个难离解。
15
(5)
COOH
COOH
20
21
(3) 酯(ester)的生成
O C6H5-C—OH + H O-CH3
H2SO4
D
O C6H5-C—O-CH3 + H2O
85-95%
HO2C(CH2)4CO2H+C2H5OH
H2SO4
甲苯/D
OO C2H5O-C(CH2)4C-OC2H5+H2O
95%
该反应可逆,必须在催化剂及加热下才能较快进
1. 羧酸的结构 羰基与羟基通过p-p共轭构成一个整体 2. 命名 俗名; 系统命名 3. 性质 酸性;生成羧酸衍生物;二元酸脱羧 4. 羟基酸 酸性;氧化;脱水;酚酸脱羧 5. 酮酸 酸性;脱羧
29
合物称羧酸衍生物(derivatives of carboxylic acid)。
O R C OH
有机化学——羧酸

酯化和酯水解反应历程
+ O
R-C-OH
H-O18-R' -H2O H+
O R-C-O18-R'
O
H+
O+H R'-O:-H
R-C-OH
R-C-OH
OH
R-C-O-H H-O+-R'
O
- H+
R-C-O-R'
OH
-H2O
R-C+-O-R'
OH R-C-O+H2
O-R'
②还原反应(比羧酸易还原)
酰卤的还原:
+ CH3-CO-CH2-C-O-C2H5 C2H5OH
乙酰乙酸乙酯 O
其历程类似于羟醛缩合反应。P232
Ⅲ、取代酸:
羧酸分子中烃基上的H原子被其它原子 或基团取代后的产物,如卤代酸、羟基酸、 羰基酸等。含多个官能团,称复合官能团化 合物。
R-CH-COOH R-CH-COOH R-C-COOH R-CH-COOH
己内酰胺
CH3 H-C N
O
CH3
N,N-二甲基甲酰胺 (DMF)
2、化学性质
①水解、醇解和氨解反应(活性:酰卤>酸酐>酯)
O
R-C-Z +
H-O-H H-O-R'
O
R-C-OH + H-Z
O
R-C-OR' + H-Z
O
H-NH2
R-C-NH2 + H-Z
Z = -X、 -O-CO-R’、 -O-R’
(4)羧酸的还原反应
羧基是有机物中碳的最高氧化态,用催 化氢化或金属加酸方法都不能将羧基还 原,但用氢化铝锂可将羧基还原。
羧酸和取代酸

Cl3C-COOH > Cl2CH-COOH> ClCH2-COOH > CH3-COOH
pKa
0.693
1.36
2.86
4.76
Cl
Cl
Cl
CH3CH2 CH COOH > CH3CH CH2COOH >CH2 CH2 CH2 COOH
pKa
2.86
4.41
4.70
(2)芳香族羧酸酸性大小的比较
CH3COOH
Cl2 S
ClCH2COOH
H3C
P
H3C CH COOH + Cl2
Cl2CHCOOH Cl3CCOOH
H3C Cl C COOH
H3C
5、还原反应
羧酸比较稳定,不被一般的还原剂所还原,但其可被强还 原剂氢化铝锂(LiAlH4)还原生成醇。
CH3COOH LiAlH4
CH3CH2OH
M=78.5 b.p=50.9 ℃
正戊酸
乙酸酐
M=102 b.p=187 ℃
M=102 b.p=139 ℃
正丁酸
乙酸乙酯
M=88 b.p=164 ℃
M=88 b.p=77 ℃
三、羧酸衍生物的化学性质
1、水解反应
羧酸衍生物经水解后都得到羧酸,但它们水解的难易程度不 同,酰卤最易,酰胺最难。即:酰卤>酸酐>酯>酰胺
CH3 CH2CH3 CH3 CH CH CH2 COOH
H3C C
H
CH3 C
CH2 COOH
4-甲基-3-乙基戊酸
E-3-甲基-3-戊烯酸
若与羧基相连的是芳烃基或脂环烃基,则将它们看作取代基。
COOH
09-羧酸衍生物取代酸

2016/8/22
2
(二)命名
羧酸的命名常用俗名
HCOOH
CH3COOH
HOOCCH2CH2COOH
甲酸(蚁酸)
乙酸(醋酸)
丁二酸(琥珀酸)
2016/8/22
3
系统命名与醛相似 1.选取包括羧基在内的最长碳链为主链。
CH3 CH CH2 COOH γ β α CH3 3-甲基丁酸
2.从羧基碳开始编号,不需指羧基的位置。
CH2
2—乙基丙烯酸
4.芳香酸把芳香环看作取代基。
COOH
CH COOH CH3
2—苯基丙酸
苯甲酸(安息香酸)
2016/8/22
5
5.二元酸的命名以包括两个羧基在内的最长碳链。
COOH CH3 CH2 CH COOH
2-乙基丙二酸 乙二酸(草酸)
HOOC COOH
COOH COOH
邻苯二甲酸
COOH COOH
2016/8/22
17
(四)烃基上的反应
(1)α―卤代作用
脂肪羧酸的α―氢受羧基的影响较活泼,可被卤素 取代,但由于P-π共轭效应,反应速度较慢且α―氢是 逐步被取代的。
CH3 COOH 日光
Cl2
ClCH2 COOH
日光 Cl2
日光 Cl2CH COOH Cl2
Cl3C COOH
(2)芳香环上的取代反应(间位定位基)
酯中的α-H较活泼,在醇钠作用下,与另1分子酯缩去 1分子醇,生成β-酮酸酯。简称酯缩合。
O CH 3COC 2H 5
O CH 2COC 2H 5 H
O-
NaOC 2H5
O -CH COC H 2 2 5
O CH 3C CH 2C OC2H5 OC 2H 5
羧酸及其衍生物和取代羧酸

第13章 羧酸及其衍生物和取代羧酸一、学习基本要求·掌握羧酸及其衍生物、取代羧酸的分类和命名。
·了解羧酸及其衍生物的结构特点,熟悉结构对羧酸及其衍生物的物理性质影响;掌握羧酸及其衍生物的化学性质。
·了解取代酸的结构特点,熟悉取代酸化学性质。
二、重点和难点·重点:羧酸及其衍生物的重要性质,如酯缩合反应、Hoffmann 降解反应等。
·难点:结构对羧酸及其衍生物性质的影响,以及各类羧酸酸性强弱的比较。
13.1 羧酸(一)基本概念1.羧酸:羧基与烃基或氢原子连接而成的化合物叫做羧酸。
2. 酰基:羧酸分子中去掉羟基留下的部分称为酰基,羧酸中羧基去掉氢留下的部分称为酰氧基,羧酸电离出氢离子留下的部分称为羧酸根。
(二)基本知识1、羧酸的结构羧基是羧酸的官能团,一元羧酸的通式为R -COOH 。
羧基中的碳原子是sp 2杂化,羧基中羟基氧原子上的未共用电子对与羰基的π键形成 p-π共轭体系。
羧基不是羰基和羟基的简单加合,所以羧基中不存在典型的羰基和羟基的性质,而是两者互相影响的统一体。
羧酸分子间可以形成氢键,缔合成较稳定的二聚体和多聚体,羧酸的沸点比分子量相近的醇还高。
2、羧酸的命名羧酸的系统命名与醛的命名相似,选择包括羧基碳原子在内的最长碳链为主链,根据主链碳原子数目称为某酸,由羧基碳原子开始给主链编号,或用希腊字母α、β等从与羧基相邻碳原子开始编号。
二元脂肪酸的命名,主链两端必须是羧基。
许多羧酸都根据其来源或生理功能有俗名。
3.羧酸化学性质 (1)羧酸的酸性羧基p-π共轭体系的存在,使羟基氧原子的电子云密度降低,增强了O -H 键的极性,有利于离解H +;而酸根的p-π共轭更为显著,实验证明在酸根离子中2个C -O 键长是完全相等的,这说明羧基碳与2个氧间的电子密度是完全平均化的,其负电荷分散在两个氧与一个碳上,故酸根负离子比较稳定,易生成。
因此羧酸的酸性比水和醇要强得多。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
含有二个羧基的羧酸称为二元酸。
二、羧酸的性质
1. 物理性质:羧酸是极性分子 。 (1)物态
C1~C3 有酸味的无色液体
C4~C9 有腐败酸臭味的油状液体
C10 以上——蜡状固体,没有气味 芳香族羧酸(Ar-COOH)和脂肪族二元羧酸 为结晶的固体
(2) 沸点
液态脂肪酸以二聚体形式存在。 所以羧酸的沸点比相对分子质量相 当的醇高。
基础化学
(下)
羧酸是一种有机机酸,常以盐或酯的形 式广泛存在于自然界中,对人类生活关系密切。
例如:食用的醋,就是2%的醋酸水溶液; 日常用的肥皂,是高级脂肪酸的钠盐;
食用的油以及许多工业用的油都是属于羧酸 的甘油酯
羧酸也是一类非常重要的工业原料, 例如化合成纤维(尼龙、的确良)的重要 原料之一就是羧酸。
反 (1)反应速率慢,需要强酸催化,且加热 应 (浓硫酸,对甲苯磺酸等) 特点:(2)反应的可逆性。(K较小)
增大产率:可减少生成物水(分水装置,带 水剂);或增加反应物,改变醇酸摩尔比。
生成酰胺
O
RC OH + NH3
O R C O NH4+
O
+ RC NH2 H2 O
⑶ 脱羧反应
通式:
+ 或碱
⑴ 羧基中氢原子的反应 ①酸性
能溶与水的羧酸在水溶液中可离解出 氢离子而呈酸性,使蓝色石蕊试纸变红。
O R C OH
O
R C O- + H+
大多数脂肪族一元羧酸的pKa值在4~5范 围内。芳香酸及二元酸的酸性强于一元脂肪族 羧酸;羧酸的酸性弱于无机强酸而强于碳酸 (pKa=6.38)和一般的酚(pKa≈10)。
甲酸 乙酸 丙酸 丁酸 十六酸 十八酸
蚁酸 醋酸 初油酸 酪酸 软脂酸 硬脂酸
二元酸
系统命名
HOOCCOOH
乙二酸
HOOCCH2COOH HOOC(CH2)2COOH (Z)-HOOCCH=CHCOOH
丙二酸 丁二酸 顺丁烯二酸
(E)-HOOCCH=CHCOOH 反丁烯二酸
普通(俗名)命名 草酸 缩苹果酸 琥珀酸 马来酸 富马酸
§17-1 羧 酸
官能团:
O C OH
饱和一元脂肪酸通式:CnH2nO2
分类
按羧基数目分
一元羧酸:OOH
二元羧酸: COOH
COOH
多元羧酸:
COOH HO-C-COOH
COOH
命名
1. 系统命名法:[同“醛”(选主链,编号,命名)
例:
HOCH2CH2CHCH2COOH
Cl
5-羟基-3-氯戊酸
甲酸 乙醇 乙酸 丙醇
分子量
HCOOH
46
CH3CH2OH
46
CH3COOH
60
CH3CH2CH2OH 60
沸点/℃ 100 78.3 118 97.2
(3) 熔点
饱和一元酸的熔点随碳链的增长而升高, 显锯齿状变化,
即含偶数碳原子羧酸的熔点比前后两个 相邻的含奇数碳原子酸的熔点要高。
(4)水溶性
ACH2COOH
ACH3 CO2
O
O
A为-COOH,-CN, CR,-NO2,-CX3, C C6H5-等吸电子基团时,脱羧反应相当容易进行。
⑷烃基中α-H的卤代
X
+ 少量 P
RCH2COOH X2
RCHCOOH
⑸还原
RCOOH LiAlH4 或 B2H6
RCH2OH
三、重要化合物
1.甲酸(HCOOH)
•酯化反应、羧酸衍生物的亲核取代 反应。
•羧酸衍生物在有机合成中的应用和 几个重要的有机人名反应等。
学习要求 1. 了解羧酸及其衍生物的结构,物理性质, 理解羧酸结构对其性质的影响; 2. 掌握羧酸及其衍生物的分类、命名和主 要化学性质; 3. 熟悉常见取代酸的命名及其重要性质; 4. 了解几种重要的羧酸、羧酸衍生物、取 代酸的性质和应用。
0.136nm
O
RC O-
O
R-C
-
O
比醛酮(>C=O)键长(0.123nm)要长 键长平均化
比醇C-O键长(0.143nm)要短
羧酸根比较稳定,所以羧酸的氢 能解离而表现出酸性。
化学性质
• 酸性(p-π共轭,使O-H极性增大)
O R C ..
OH
• -OH的取代反应(酰化) • 还原 • 脱羧
• α-H的卤代
低级酸易溶于水。羧基是亲水基团易 与水形成氢键
O R-C
H -O H
O -H O -H
H H -O
H
高级羧酸随分子量增大( R↑) 而在水中的溶 解度减小。
2. 化学性质
羧酸和羧酸根的结构比较 两个碳氧键等长,完全离域。
两个碳氧 键不等长 ,部分离 域。
H0.125nm
Rα- C
C
O
..
SP2
H OH
O RC OH
RCOX
酰卤
RCOOCOR 酸酐 RCOOR 酯 RCONH2 酰胺
生成酸酐
O
O
R C OH + HO C R1
O
O
R C O C R1 + H2O
生成酰氯
PCl5 SOCl2
O
RC Cl + POCl3 + H Cl O
RC Cl + SO2 + H Cl
二氯亚砜(亚硫酰氯)
成酯反应
羧酸的通式:R-COOH 或 Ar-COOH
第17章 羧酸 羧酸衍生物 取代酸
§17-1 羧 酸 一、羧酸的分类和命名
二、羧酸的性质
三、个别化合物
§17-2 羧酸衍生物 一、分类和命名 二、羧酸衍生物的性质
§17-3 取代酸 一、羟基酸 二、羰基酸
本章重点 •羧酸及其衍生物和取代酸的分子结 构与性质。
甲酸可用作还原剂、消毒剂和防腐剂等
2.乙酸 俗称醋酸,普通食醋含4%~8%的乙酸。 乙酸是染料、香料、制药、塑料等工业 不可缺少的工业原料。
3.丁烯二酸
H
H
CC
HOOC
COOH
顺丁烯二酸
H
COOH
CC
HOOC
H
反丁烯二酸
4.苯甲酸
俗名安息香酸 其钠盐用作食物和某些药物的防腐剂
羧酸的俗名(根据酸的来源命名) 根据它们的天然来源而有其俗名。
甲酸最初是从一种蚂蚁中得到,故称蚁酸 乙酸存在于食醋中,因而又称醋酸
一元酸
系统命名
普通(俗名)命名
HCOOH CH3COOH CH3CH2COOH CH3CH2CH2COOH CH3(CH2)14COOH CH3(CH2)16COOH
R COOH + NaHCO3
R COONa + CO2 + H2O
羧酸的碱金属盐具有一般无机盐的性质, 加入强酸又可以使羧酸重新游离出来。
R COONa + HCl
应用:利用羧酸的酸性可以分离羧酸和不具酸性 的有机化合物,也可以用于羧酸的鉴别和精制。
CH3COOH + NaOH CH3COONa + H2O CH3COOH + NaHCO3 CH3COONa + CO2 + H2O
BrCH2CH
CCH2CH2COOH C2H5
4-乙基-6-溴-4-己烯酸
COOH
环己基甲酸
2. 普通命名法 选主链:含羧基在内的最长碳链 编号:从羧基邻位碳原子开始,依次为 α,β,γ,δ(德尔塔) ,ε(艾普西龙)…ω
CH3CH2CHCH2COOH CH3
β-甲基戊酸
γ –环己基丁酸
CH2CH2CH2COOH
