Southern+杂交+-+试剂盒
地高辛标记探针的Southern杂交
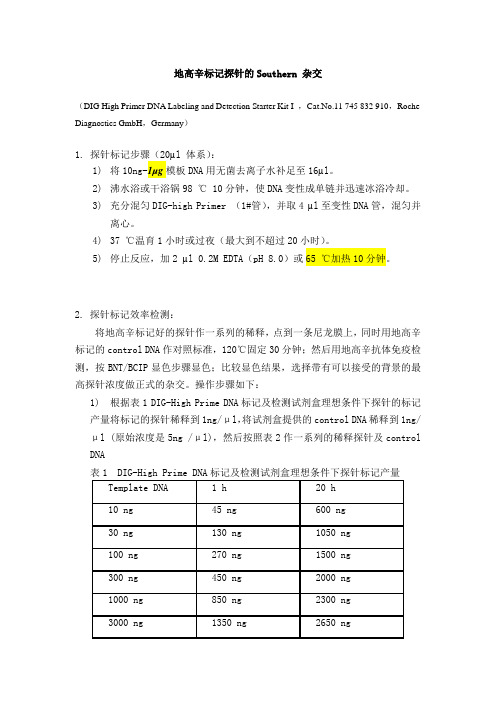
地高辛标记探针的Southern 杂交(DIG High Primer DNA Labeling and Detection Starter Kit I ,Cat.No.11 745 832 910,Roche Diagnostics GmbH,Germany)1. 探针标记步骤(20µl 体系):1)将10ng-1µg模板DNA用无菌去离子水补足至16µl。
2)沸水浴或干浴锅98 ℃ 10分钟,使DNA变性成单链并迅速冰浴冷却。
3)充分混匀DIG-high Primer (1#管),并取4 µl至变性DNA管,混匀并离心。
4)37 ℃温育1小时或过夜(最大到不超过20小时)。
5)停止反应,加2 µl 0.2M EDTA(pH 8.0)或65 ℃加热10分钟。
2. 探针标记效率检测:将地高辛标记好的探针作一系列的稀释,点到一条尼龙膜上,同时用地高辛标记的control DNA作对照标准,120℃固定30分钟;然后用地高辛抗体免疫检测,按BNT/BCIP显色步骤显色;比较显色结果,选择带有可以接受的背景的最高探针浓度做正式的杂交。
操作步骤如下:1)根据表1 DIG-High Prime DNA标记及检测试剂盒理想条件下探针的标记产量将标记的探针稀释到1ng/μl,将试剂盒提供的control DNA稀释到1ng/μl (原始浓度是5ng /μl),然后按照表2作一系列的稀释探针及control DNA表1 DIG-High Prime DNA标记及检测试剂盒理想条件下探针标记产量表2)将上述稀释的2-9 号管的control DNA 及探针DNA各取1μl点膜3)120℃固定30分钟或紫外交链3-5分钟4)将膜放入装有20ml Maleic acid buffer 的塑料器皿中,室温振荡2分钟5)将膜放入10ml Blocking solution中室温温育30分钟6)将膜放入10ml Antibody solution 中室温温育30分钟7)用10ml Washing buffer 洗2次,每次15分钟8)在10ml Detection buffer 平衡2-5分钟9)将膜放入2ml 新配制的Color substrate solution 中暗室条件下显色。
Southern杂交实验

Southern 杂交实验Southern 杂交的原理是将待检测的DNA分子用限制性内切酶消化,通过琼脂糖凝胶电泳进行分离,继而将其变性并按照其在凝胶中的位置转移到硝酸纤维素薄膜或尼龙膜上,固定后再与同位素或其他标记物标记的DNA探针进行反应。
如果待测物中含有与探针互补的序列,则二者通过碱基互补原理进行结合,游离的探针洗涤后用显影或其他合适的技术进行检测,从而显示出待检的片段及其相对大小。
一、溶液配制(1)20 X SSC(1000 mL) :组分浓度 3.0M的Nacl,0.3M的柠檬酸钠NaCl 175.32g柠檬酸钠88.26gNaOH调PH值到7.0,高温高压灭(2)洗涤缓冲液Washing buffer 200ml组分浓度:0.1M Maleic acid, 0.15M Nacl; pH 7.5(20℃); 0.3%(v/v) Tween20.Maleic acid:2.32gNacl: 1.75gTween20 0.6mlNaOH固体约1.7g调Ph值7.5(3)马来酸缓冲液Maleic acid buffer 200ml组分浓度:0.1M Maleic acid, 0.15M Nacl; pH 7.5 (20ºC)Maleic acid:2.32gNacl: 1.75gTween20 0.6mlNaOH固体约1.7g调Ph值7.5(4)检测缓冲液Detection buffer 100ml组分浓度:0.1M Tris-HCl, 0.1M Nacl, pH 9.5(20ºC)Tris 1.21g,NaCl 0.584gMgCl2 1.01g调ph值到9.5(5)变性溶液(500 mL): 1 mol/L NaCl (43.83 g), 0.5 mol/L NaOH (10 g),(6)中和溶液(500 mL):0.5 mol / L Tris (30.27 g),3 mol/L NaCl (87.66 g),用1 mol/L HCl调(7)5 × TBE (250 mL):13.5g Tris 6.9g硼酸, 0.9 g EDTA-Na2,定容250 mL(8)6 ×溴酚蓝载样液:0.25 %溴酚蓝,40 %蔗糖(9)4 mol/L EDTA 100 mL(10)1M Tris-HCl (pH 8.0): 称取12,。
Southern 杂交技术-1

Southern 杂交技术-1Southern技术是指以Southern名字命名的DNA转移杂交技术。
它可用于基因组特定D NA序列的定位,可以测定相关片段的同源性、可以从c库、基因组文库中筛选完整基因等。
用一种或多种限制性内切酶对基因组DNA加以切割,通过琼脂糖凝胶电泳分离酶切片段,随后,使DNA在原位变性,并从凝胶转移至固相膜,用已知核苷酸片段加以标记作为探针,通过分子杂交来检测待测样品中是否存在互补的核酸序列。
该技术已成为分子生物学中一类重要的检测手段。
下面分别介绍利用光敏生物素试剂盒及DIG试剂盒进行杂交的方法。
十五-1:光敏生物素试剂盒杂交实验一仪器:分子杂交仪、摇床、烤箱、取液器、电泳仪、电泳槽二试剂:硫酸葡聚糖钠盐(可不用)、聚乙烯吡赂啉酮(PVP)、聚蔗糖、牛血清白蛋白(BSA)、100mM EDTA、3MnaAC、无水乙醇、电泳缓冲液、切变性鲱鱼精DNA (100ug/ml)20×SSC溶液氯化钠3M预杂交液6×SSC柠檬酸三钠 0.3M (含100ug/ul变性鲱鱼精DNA)pH 7.0 5×Denhardt's 溶液0.5%SDS变性液 0.5M NaOH 中和液 1M Tris-HCL pH 7.41.5M NaCL 1.5M NaCL封闭液 3gBSA溶于70ml水中,浓盐酸调pH至3.0,煮沸20分钟后,冷至室温,NaOH调pH至7.5,加入10ml以下缓冲液(1M Tris-HCL pH7.5, MgCL2 0.19%, NaCL 5.8%, T riton X-100 0.05ml)定容至100ml50×Denhardt's 溶液 1%PVP 1M PBS NaCL 0.8% pH 7.41%BSA KCL 0.02%1%聚蔗糖 Na2HPO4 0.144%KH2PO4 0.024%洗涤液A:2×SSC,250ml中含0.1%SDSB:0.1×SSC,250ml中含0.1%SDS C:Tris-HCL 100mM pH 7.5 D:Tris-HCL 100mMNaCL 1M NaCL 0.5MMgCL2 2mM Tween 20 0.5% pH 7.5Triton X-100 0.05%亲和素-碱性磷酸酶溶液 Tris-HCL 100mMNaCL 1MMgCL2 2mMTriton X-100 0.05%pH 7.5碱性磷酸酶2-3单位/ml底物溶液 Tris-HCL 100mM pH 9.5 终止液NaCL 100mM Tris-HCL 10mMMgCL2 5mM EDTA 1mM。
Southern杂交

PCR扩增线粒体基因(atp9 gene as sample)以提取的基因组DNA为模板进行PCR反应。
PCR反应体系:Template 0.5μL10×Taq buffer (含Mg2+ ) 5.0μLdNTP (2.5mM) 4.0μLPrimer F (20μM) 1.0μLPrimer R (20μM) 1.0μLTaq酶(2.5U/μL)0.5μLddH2O 38μLTatal 50μLPCR反应热循环程序为:1)94℃预变性5min,2)94℃变性45s,3)60℃退火45s,4)72℃延伸1min,5)Go to step2,35 cycle;6)72℃延伸10min。
7)4℃保存。
PCR反应在Biometra(Bio-Rad)PCR仪上进行。
退火温度按照每个基因的引物Tm值确定。
扩增产物用0.8%的琼脂糖凝胶电泳检测,电泳缓冲液为1×TAE,EB染色,凝胶成像仪照相。
照相后将目的条带用刀切下后,用凝胶回收试剂盒回收。
据实验室经验,模板应在200-2000bp,一般选择1000bp。
基因探针的标记将基因片段回收后,用分光光度计进行定量,取1 µg回收DNA,定容到16 µL。
沸水浴煮10min,快速放到冰中(5min),然后快速离心10秒,再放回冰浴中10min。
加入4 µL充分混合的DIG-High Prime,混匀,37℃反应20h,其间手指弹外壁混匀数次。
标记结束后,65℃加热10分钟终止反应。
原实验室操作:标记结束后,沸水浴10min,冰上速冻,然后放入-20℃冰箱备用。
(此时已变性。
)个人建议:探针标记好后每2µL分装,暂不变性。
待用时变性。
孟老师建议,标记后直接变性,冻存,用时解冻直接用,不再变性。
没有问题。
冰乙醇混合物温度较冰低。
DNA Ladder的标记取1 µg(2µl)进行标记,方法同上。
Southern 杂交试验方案—本实验室

Southern 杂交试验方案一、探针标记1、探针标记严格按照罗氏试剂盒说明书进行;2、标记探针检测:取标记产物和普通PCR扩增产物各1μl,1.0%的琼脂糖凝胶电泳。
由于大分子量的DIG掺入,标记产物泳动速度比普通PCR产物要慢。
所以根据电泳图就可以判断是否标记上和有没有非特异标记!其余标记产物-20℃保存。
如果要准确检测标记效率(一般不必),取标记产物1μl和Dig标记的对照DNA,用DNA 稀释液按10倍系列稀释后点样于带正电荷尼龙膜上。
用紫外交联仪或真空烘烤固定DNA探针,按杂交检测方法进行信号检测,然后与膜条上的Dig标记的对照DNA信号强度对比,推算出标记的探针浓度。
如初始模板量较大,可取1μl标记产物稀释10~100倍后定量。
二、基因组DNA酶切1、采用EcoRI和一对甲基化敏感同裂酶HPaIl、MspI消化高粱基因组DNA 5ug,3 Unit/ug DNA,50uL反应体系,在37℃条件下酶切消化10h。
2、酶切产物经1%琼脂糖凝胶电泳(电压小于1v/cm,12h)分离。
凝胶在0.2mol/L的HCl 中脱嘌呤处理,至溴酚蓝变为黄色,弃去HCl后用蒸馏水洗几次,然后以0.4mol/L的NaOH 为转移液,利用毛细管作用将DNA转移到Hybond N+尼龙膜上,转移过夜后将膜取出夹放于滤纸间,80℃烘烤2小时。
常温放于干燥处保存备用。
(转膜:1、将胶裁成9.8cm×8.0cm 大小,于平皿中用蒸馏水冲洗一次;(此步一定记好胶的大小,后面裁纸/膜以及杂交液体积的选择都要用到)2、加入100ml 0.25 mol/L 的盐酸脱嘌呤,室温振荡15~30 min,至溴酚蓝完全变成黄色。
(如果限制性片段>10kb,酸处理时间可适当延长;若限制性片段很小,此步可省略)3、用蒸馏水冲洗2 次。
加入变性液(1.5mol/L NaCl、0.5mol/L NaOH)室温振荡20~30min;至溴酚蓝完全恢复到原来的蓝色。
Southern Blot 试剂盒汇总

• Digest target DNA with the restriction enzyme(s) and perform electrophoresis;
• Alkaline transfer DNA onto positively charged nylon membrane;
DNA of interest is hybridized with a biotinylated probe specific to it. It is then treated with HRP-conjugated streptavidin which attaches to the hybridized DNA. Finally, the membrane is incubated in a substrate solution containing TMB/ H2O2 that reacts with HRP and as a result a blue colored DNA band develops on the nylon membrane
CSPD Luminescent
reaction Detection
Immunological detection
Detector™ Chemiluminescent Blotting Kits
• Chemiluminescent-AP (Alkaline phosphatase) & HR P(horseradish peroxidase);
Procedure for southern blotting
Procedure for southern blotting
Template DNA
Isolated DNA
southern杂交技术

Sourthern杂交技术摘要:使用sourthern杂交技术来检测转基因植物中插入的外源基因的拷贝数。
以含有外源基因的水稻转基因植株叶片为材料,CTAB法少量抽提总DNA,总DNA经限制性内切酶切割、琼脂糖凝胶电泳、转移尼龙膜上,最后与地高辛标记的探针进行杂交。
通过条带的有无来判断是否为含有外源基因的转基因植物,条带的多少反映了转基因植株中外源基因的拷贝数。
结果:关键词:抽提酶切转膜探针杂交Southern 杂交是分子生物学的经典实验方法。
该项技术广泛被应用在遗传病检测、DNA指纹分析和PCR产物判断等研究中。
但由于该技术的操作比较烦琐、费时,所以现在有一些其他的方法可以代替Southern 杂交。
但该技术也有它的独特之处,是目前其他方法所不能替代的,如限制性酶切片段的多态性(RFLP)的检测等。
1材料与方法1.1材料及试剂水稻转基因植株叶片、限制性内切酶HindⅢ、尼龙膜、地高辛标记系统试剂盒等。
1.2水稻总DNA的少量抽提CTAB法抽提DNA步骤:(1)采取新鲜幼嫩叶片在研钵中用液态氮冷冻,研磨成细粉;(2)取约0.4g左右细粉于1.5ml离心管,加入1ml预热至95ºC以上的1.5⨯CTAB,混匀;(3)65ºC水浴中放置30分钟以上,每隔5分钟上下颠倒混合数次(DNase变性,促进内溶物释放);(4)12000g离心2分钟;(5)吸取600μl上清于新的1.5ml离心管,加入等体积氯仿/异戊醇(24:1),上下颠倒混合至下层有机相呈深绿色;(6)12000g离心5-10分钟;(7)吸取450μl上清于新的1.5ml离心管,加入两倍体积95%乙醇和1/10体积3M NaAc,轻轻的上下颠倒混匀至白色絮状沉淀出现;(8)12000g离心10分钟;(9)弃去上清,用500μl 75%乙醇浸洗沉淀5分钟,除去离子及CTAB残余,12000g离心5分钟,弃上清,自然干燥;(10)加入50μlTE(含20μg/ml RNaseA),放于4ºC溶解;(11)充分溶解后,测定并调整浓度。
Southern印迹杂交

Southern印迹杂交Southern印迹杂交实验原理核酸分⼦杂交技术是分⼦⽣物学领域中最常⽤的具体⽅法之⼀。
其基本原理是:具有⼀定同源性的两条核酸单链在⼀定的条件下,可按碱基互补的原则形成双链,此杂交过程是⾼度特异的。
由于核酸分⼦的⾼度特异性及检测⽅法的灵敏性,综合凝胶电泳和核酸内切限制酶分析的结果,便可绘制出DNA分⼦的限制图谱。
但为了进⼀步构建出DNA分⼦的遗传图,或进⾏⽬的基因序列的测定以满⾜基因克隆的特殊要求,还必须掌握DNA分⼦中基因编码区的⼤⼩和位置。
有关这类数据资料可应⽤Southern印迹杂交技术获得。
Southern印迹杂交技术包括两个主要过程:⼀是将待测定核酸分⼦通过⼀定的⽅法转移并结合到⼀定的固相⽀持物(硝酸纤维素膜或尼龙膜)上,即印迹(blotting);⼆是固定于膜上的核酸同位素标记的探针在⼀定的温度和离⼦强度下退⽕,即分⼦杂交过程。
该技术是1975年英国爱丁堡⼤学的E.M.Southern⾸创的,Southern印迹杂交故因此⽽得名。
早期的Southern印迹是将凝胶中的DNA变性后,经⽑细管的虹吸作⽤,转移到硝酸纤维膜上。
近年来印迹⽅法和固定⽀持滤膜都有了很⼤的改进,印迹⽅法如电转法、真空转移法;滤膜则发展了尼龙膜、化学活化膜(如AP T、ABM纤维素膜)等。
利⽤Southern印迹法可进⾏克隆基因的酶切、图谱分析、基因组中某⼀基因的定性及定量分析、基因突变分析及限制性⽚断长度多态性分析(RFLP)等。
实验⽅法本节以哺乳动物基因组DNA为例,介绍Southern印迹杂交的基本步骤。
⼀、待测核酸样品的制备(⼀)制备待测DNA基因组DNA是从动物组织(或)细胞制备。
1. 采⽤适当的化学试剂裂解细胞,或者⽤组织匀浆器研磨破碎组织中的细胞;2. ⽤蛋⽩酶和RNA酶消化⼤部分蛋⽩质和RNA;3. ⽤有机试剂(酚/氯仿)抽提⽅法去除蛋⽩质。
(⼆)DNA限制酶消化基因组DNA很长,需要将其切割成⼤⼩不同的⽚段之后才能⽤于杂交分析,通常⽤限制酶消化DNA。
southern杂交主要流程

southern杂交主要流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!Southern 杂交是一种用于检测特定 DNA 序列的分子生物学技术。
southern_杂交实验流程

SOUTHERN BLOTTING实验操作流程A.小麦基因组DNA的提取1)采集5g鲜嫩的小麦幼苗,将其剪成2cm左右的片段,用液氮冷冻后在研钵中将其研成粉末(研磨15min左右)。
2)将研磨好的样品转移到预冷的50ml离心管中,加入20ml预热的S buffer,颠倒混匀。
S Buffer成分100mM Tris.Cl pH8.5100mM NaCl50mM EDTA pH8.02% SDS3)于65℃水浴锅中温育1-2h,并不时轻柔混匀。
4)加入20ml(等体积的)酚/氯仿,轻柔地颠倒混匀,直至呈乳状(注意:保证混匀。
为有效除去蛋白,此步可以重复)。
5)用水平转子离心机以2000rpm的转速离心20-30min。
6)加入等体积的氯仿,轻柔地颠倒混匀,2000rpm离心20min。
7)转移上清到1个灭菌的50ml离心管中,加入0.6倍体积的异丙醇,颠倒混匀,室温放置一段时间,用玻璃勾将DNA钩出。
8)用70%的乙醇清洗DNA 2-3次后,将其挑在玻璃钩上晾干,然后溶解在5ml 1×TE中。
9)待DNA完全溶解后接入10μl RNase,于37℃恒温箱中温育1h。
10)加入等体积的酚/氯仿,轻柔颠倒混匀,以2000rpm的转速离心15min。
11)转移上清至1个灭菌的离心管中,加入等体积的氯仿,混匀,以2000rpm的转速离心15min。
12)转移上清至1个灭菌的离心管中,加入1/10 体积 3M pH 5.0的乙酸钠(终浓度为0.3M),混匀后再加入2倍体积95%的乙醇,混匀。
13)用玻璃勾将DNA钩出,然后用70%的乙醇清洗2-3次,晾干后加入1.8-2ml 1×TE溶解。
14)待DNA完全溶解后,取1μL DNA电泳,检测DNA的浓度和完整性。
15)DNA样品可以放在4℃保存备用。
B.小麦基因组DNA的酶切1)通常情况下采用下列酶进行谷类作物DNA分析。
识别6碱基序列的酶识别4碱基序列的酶Apa I Hind III Bam HI Alu I Mbo I Hha ISal I Bgl I Sst I Dde I Msp I Taq IDra I Pvu II Eco RV Hae III Rsa I Hinf IEco RI Xba I2)如果一次酶切DNA的量在10μg左右,一般采用30μL反应体系。
Southern印迹杂交

Southern印迹杂交实验原理核酸分子杂交技术是分子生物学领域中最常用的具体方法之一。
其基本原理是:具有一定同源性的两条核酸单链在一定的条件下,可按碱基互补的原则形成双链,此杂交过程是高度特异的。
由于核酸分子的高度特异性及检测方法的灵敏性,综合凝胶电泳和核酸内切限制酶分析的结果,便可绘制出DNA分子的限制图谱。
但为了进一步构建出DNA分子的遗传图,或进行目的基因序列的测定以满足基因克隆的特殊要求,还必须掌握DNA分子中基因编码区的大小和位置。
有关这类数据资料可应用Southern印迹杂交技术获得。
Southern印迹杂交技术包括两个主要过程:一是将待测定核酸分子通过一定的方法转移并结合到一定的固相支持物(硝酸纤维素膜或尼龙膜)上,即印迹(blotting);二是固定于膜上的核酸同位素标记的探针在一定的温度和离子强度下退火,即分子杂交过程。
该技术是1975年英国爱丁堡大学的E.M.Southern首创的,Southern印迹杂交故因此而得名。
早期的Southern印迹是将凝胶中的DNA变性后,经毛细管的虹吸作用,转移到硝酸纤维膜上。
近年来印迹方法和固定支持滤膜都有了很大的改进,印迹方法如电转法、真空转移法;滤膜则发展了尼龙膜、化学活化膜(如APT、ABM纤维素膜)等。
利用Southern印迹法可进行克隆基因的酶切、图谱分析、基因组中某一基因的定性及定量分析、基因突变分析及限制性片断长度多态性分析(RFLP)等。
实验方法本节以哺乳动物基因组DNA为例,介绍Southern印迹杂交的基本步骤。
一、待测核酸样品的制备(一)制备待测DNA基因组DNA是从动物组织(或)细胞制备。
1. 采用适当的化学试剂裂解细胞,或者用组织匀浆器研磨破碎组织中的细胞;2. 用蛋白酶和RNA酶消化大部分蛋白质和RNA;3. 用有机试剂(酚/氯仿)抽提方法去除蛋白质。
(二)DNA限制酶消化基因组DNA很长,需要将其切割成大小不同的片段之后才能用于杂交分析,通常用限制酶消化DNA。
southern杂交标准步骤

一、试剂的选用和配置:不同种类的尼龙膜其所采用的转移缓冲液和洗膜液不同。
本实验标准采用带正电荷的尼龙膜。
变性液/碱性转移缓冲液(应用于带正电荷尼龙膜的碱性转移)0.4mol/L NaOH1mol/L NaCl配2×母液1L。
中和缓冲溶液Ⅱ(只用于碱性转移)0.5mol/L Tris-Cl (pH 7.2)1mol/L NaCl20×SSC800ml H2O溶解175.3g NaCl和88.2g柠檬酸钠,用几滴14mol/LHCl调pH至7.0,用水定容至1L。
分装后高压灭菌,试剂终浓度为3.0mol/L NaCl和0.3mol/L柠檬酸钠。
10%(m/V) SDS配制时68℃加热助溶,浓盐酸调pH至7.2,定容室温保存。
(pH极易调过,需小心!)二、技术操作步骤:Ⅰ、DNA酶切和低压电泳:概述:酶切所需DNA的量为10μg~30μg,所需限制性内切酶量为10Unit酶/1μg DNA,neb公司的限制性内切酶的最佳酶切条件为50μl体系酶切1~2μgDNA。
为了避免型号活性,注意所加酶的甘油含量和盐分含量(glycerol concentration > 5%, or pH > 8.0 may result in star activity酶储液含50% glycerol,因而酶最大用量不能超过酶切体系的10%),同时,选择内切酶时要注意其可能因甲基化的敏感性导致基因组酶切效果不好。
1、400μl的酶切反应体系:(10~30μg)30 μg DNA 酶300 U 37℃酶切16h。
电泳检测酶切效果。
1/10体积(40μl)3mol/L 醋酸钠 2.5倍体积的冷无水乙醇(或0.6~1倍体积的遇冷异丙醇)-20℃沉淀DNA,70%乙醇洗涤沉淀,溶解于25μl 1×TE。
2、荧光定量测定浓度后,加入5μl 6×上样缓冲溶液,56℃水浴5min,迅速置于冰上2min,以破坏粘性末端可能形成的碱基对。
Southern杂交技术手册

Southern杂交探针标记及检测试剂盒:DIG High Prime DNA Labeling and Detection Starter Kit II (detection with CSPD)原理所谓DNA探针,实质上是一段已知的基因片段,应用这一基因片段即可与待测样品杂交。
如果靶基因和探针的核苷酸序列相同,就可按碱基配对原则进行核酸分子杂交,从而达到检查样品基因的目的。
在随机引物法标记反应液中,有随机合成的六聚体核昔酸(hexanucleotide)作为引物,dATP、dCTP、dGTP、dTTP 和DIG-dUTP作为合成底物,以单链DNA作为模板,在Klenow酶的作用下,合成掺入地高辛的DNA链。
以地高辛标记的探针与靶基因DNA链杂交后,再通过免疫反应来进行检测。
一般通过酶标抗地高辛抗体来检测,就可以肯定杂交反应的存在。
免疫检测采用CSPD发光曝光到X光片。
试剂盒内容:1. DIG-High Prime,vial 1,50ul(5×);2. 地高辛标记的对照DNA,vial 2,20ul(5ug/ml pBR328 DNA);3. DNA稀释缓冲液,vial 3,(3×1ml);4. AP Conjugate,vial 4,50ul(750U/ml);开封后2-8℃稳定保存。
5. CSPD,vial 5,50 ml;开封后2-8℃避光稳定保存。
6. Blocking solution(封闭液),vial 6,4×100ml(10×);开封后应分装,在-15~-25℃稳定保存,或2-8℃保存1个月,工作液应现用现配。
7. DIG Easy Hyb Granules,vial 7,4×100ml。
表1 需准备的其他试剂及设备过程设备试剂DIG标记探针水浴、电炉双蒸水,灭菌;0.2 M EDTA溶液(pH 8.0),灭菌。
探针灵敏度检测尼龙膜(Hybond-N+ NylonMembrane)洗脱缓冲液马来酸缓冲液检测缓冲液转膜转膜装置、紫外交联装置或烘箱TBE,酸变性液,碱变性液,中和液,20×SSC杂交电炉、冰水混合物、尼龙膜、杂交炉、杂交瓶20×SSC,1% SDS免疫检测洗脱缓冲液;马来酸缓冲液;检测缓冲液;重新杂交水浴20×SSC;1% SDS;1 M NaOH试剂配制:1. 马来酸缓冲液——0.1 M马来酸(M.W. 116.1),0.15 M NaCl,NaOH固体调pH至7.5,常温(称取11.61g马来酸,8.77g NaCl,定容至1000mL,高压灭菌)。
Southern印迹杂交实验原理和方法-3

Southern印迹杂交实验原理和方法-3真空转移法的最大优点是迅速,可在转膜的同时进行DNA变性与中和整个过程约需3 0~60分钟。
但在操作中应注意两个问题,一是真空压力不能太大,若压力过大,凝胶被压缩,转移效率会降低;二是真空转移液要密封严,防止漏气影响压力的产生。
下表列出了不同的印迹方法。
表10-2 不同印迹方法的比较表五、探针标记用于Southern印迹杂交的探针可以是纯化的DNA片段或寡核苷酸片段。
探针可以用放射性物质标记或用地高辛标记,放射性标记灵敏度高,效果好;地高辛标记没有半衰期,安全性好。
人工合成的短寡核苷酸可以用T4 多聚核苷酸激酶进行末端标记。
探针标记的方法有随机引物法、切口平移法和末端标记法,详细方法参见本书相关章节。
这里介绍放射标记。
以下为 Promega公司随机引物试剂盒提供的标记步骤:(一)取25~50mg模板DNA于0.5ml离心管中,100℃水浴5min,立即置冰浴。
(二)在另一个0.5ml离心管中加入:Labeling 5×Buffer (含随机引物) 10μldNTPmix(含dCTP.dGTP.dTTP各0.5mmol/L) 2μlBSA(小牛血清蛋白) 2μl[α-32ρ] dATP 3μlKlenow 酶 5U(三)将变性模板DNA加入到上管中,加ddH2O至50μl混匀。
室温或37℃ 1h.(四)加50μl终止缓冲液终止反应标记后的探针可直接使用或过柱纯化后使用。
由于α-32ρ的半衰期只有14天,所以标记好的探针应尽快使用。
探针的比活性最好大于 1091计数/分/μl。
六、预杂交(prehybridizafion)将固定于膜上的DNA片段与探针进行杂交之前,必须先进行一个预杂交的过程。
因为能结合DNA片段的膜同样能够结合探针DNA,在进行杂交前,必须将膜上所有能与DNA结合的位点全部封闭,这就是预杂交的目的。
预杂交是将转印后的滤膜置于一个浸泡在水浴摇床的封闭塑料袋中进行,袋中装有预杂交液,使预杂交液不断在膜上流动。
Southern杂交分析原理和操作

Southern杂交分析原理和操作【原理】Southern杂交是分子生物学的经典实验方法。
其基本原理是将待检测的DNA样品固定在固相载体上,与标记的核酸探针进行杂交,在与探针有同源序列的固相DNA的位置上显示出杂交信号。
通过Southern杂交可以判断被检测的DNA样品中是否有与探针同源的片段以及该片段的长度。
一.基因组DNA的限制酶切【操作】DNA (1μg/ml)20μg、10×酶切buffer5.0μl、限制性内切酶(lOU /μl) 5.0μl、加ddH2O至50μl,在最适温度下消化1~3h。
消化结束时可取5μl电泳检测消化效果。
如果消化效果不好,可以延长消化时间,但超过6h己没有必要。
或者放大反应体积,或者补充酶再消化。
如仍不能奏效,可能的原因是DNA样品中有太多的杂质,或酶的活力下降。
消化后的DNA 加入1/10体积的0.5mol/L EDTA,以终止消化。
然后用等体积酚抽提、等体积氯仿抽提,2.5倍体积乙醇沉淀,少量TE溶解(参见DNA提取方法,但离心转速要提高到12000g,以防止小片段DNA的丢失)。
如果需要两种酶消化DNA,而两种酶的反应条件可以一致,则两种酶可同时进行消化;如果反应条件不一致,则先用需要低离子强度的酶消化,然后补加盐类等物质调高反应体系的离子强度,再加第二种酶进行消化。
二.基因组DNA消化产物的琼脂糖凝胶电泳【操作】1.制备0.8%凝胶一般用于Southern杂交的电泳胶取0.8%。
2. 电泳电泳样品中加人6×Loading缓冲液,混匀后上样,留一或两泳道加DNAMarker。
1~2V/cm,DNA从负极泳向正极。
电泳至溴酚蓝指示剂接近凝胶另一端时,停止电泳。
取出凝胶,紫外灯下观察电泳效果。
在胶的一边放置一把刻度尺,拍摄照片。
正常电泳图谱呈现一连续的涂抹带,照片摄人刻度尺是为了以后判断信号带的位置,以确定被杂交的DNA长度。
三.DNA从琼脂糖凝胶转移到固相支持物【操作】1.碱变性室温下将凝胶浸入数倍体积的变性液中30min。
Southern+杂交+-+试剂盒

Southern 杂交一、目的二、基本原理DNA印迹杂交法是指利用毛细管作用,将变性DNA从凝胶上转移到硝酸纤维素膜或尼龙膜上,加以固定后用探针杂交的技术。
此法是由Dr.Southern 1975年建立的,它是分子生物学研究领域中最常用的技术之一,为后来发展的各种生物大分子杂交技术提供了重要的理论和实践基础。
分子杂交技术是根据两条单链DNA(或DNA与RNA)中互补碱基序列能专一配对的原理进行的。
在一定条件下,单链DNA或RNA能与另一条单链DNA互补的碱基形成氢键,从而使两条单链杂交形成双链DNA分子。
Southern印迹杂交技术是由:电泳,印迹,固定和检测4个步骤组成。
即用一种或几种限制性内切酶消化DNA分子,通过琼脂糖凝胶电泳按分子量大小分离所得片段,随后使DNA在原位发生变性,并从凝胶中转移至一固相支持物上(通常为硝酸纤维素膜或尼龙膜)。
DNA转至固相支持物的过程中,各个DNA片段的相对位置保持不变,用放射性标记或非放射性标记的DNA或RNA探针与固定于膜上的DNA分子进行杂交,经放射自显影或显色反应确定所有与探针杂交的片段的位置。
探针很难与琼脂糖凝胶中的DNA进行杂交,因此必须把DNA转移至一固相支持物上。
DNA 在高盐存在下,可以通过毛细作用印迹到膜上(目前又发展了真空转移和电转移等技术)。
DNA 片段的大小对转移率有很大的影响,大的DNA片段较难定量转移,一般可用短波长紫外线照射凝胶,将其中的DNA断裂为较小的片段,以利转移。
实验表明,单链DNA的平均长度在大约1000个碱基时即可充分转移。
能产生可检测杂交信号所需的DNA量取决于几个因素:DNA中与探针互补部分所占比例,探针的大小与比活,膜上DNA的量。
在最佳条件下经放射自显影曝光书天后这一方法的灵敏度足以检出不到0.1pg的与高比活32P标记的探针(109cpm/)互补的DNA。
Southern印迹杂交方法通常需要10µg基因组DNA。
基因组DNA Southern杂交操作步骤

基因组DNA Southern杂交操作步骤1)基因组DNA Southern印迹的制备预备1.用适当的限制性内切酶消化基因组DNA样品(10μg)。
2.进行琼脂糖凝胶电泳。
一般用0.7~1.0%的琼脂糖凝胶分离基因组DNA,它在1~15kb的范围内有较好的分辨率,可选用TBE或TAE缓冲液。
琼脂糖凝胶电泳需在1V/cm的电压下进行,如果要分离片段大小相似的DNA带,应用较大的凝胶(20×25cm)。
常用的标准品是由Hind Ⅲ消化的λDNA、Hae Ⅲ消化的ΦX174 DNA和100或1000bp的梯形图谱。
电泳完毕,将凝胶放在紫外透射仪上,并在凝胶旁放一尺子进行拍照。
当把凝胶从盘内移动紫外透射仪时,小心不要将凝胶滑落或弄破。
Southern印迹的制备1.将凝胶转移至塑料盒内。
2.加入至少4倍凝胶体积的0.25mol/L HCl使DNA脱嘌呤,置室温摇床温育15min。
这时凝胶上样缓冲液中的溴酚蓝应变黄色,如果15min后仍呈蓝色,应再温育5min。
3.小心地塑料盒内HCl弃去,用蒸馏水漂洗凝胶一次。
4.加入至少4倍体积的变性缓冲液,置室温摇床温育20min。
5.用新鲜缓冲液重复步骤4,小心弃去变性缓冲液,用蒸馏水稍加漂洗。
6.加入至少4倍体积的中和反应缓冲液,置室温摇床温育15min。
7.用新鲜缓冲液重复步骤6。
8.当处理凝胶时,裁一张略大于凝胶的滤膜(硝酸纤维膜或尼龙膜),预先用蒸馏水将滤膜浸湿后用20×SSC浸泡至少15min。
9.安装转移装置。
在盘中加入印迹缓冲液(20×SSC),在缓冲液面作一平台,比如可倒置一凝胶盘,上面盖三张经20×SSC饱和过的滤纸(Whatman 3MM),平台两侧的滤纸应浸泡在缓冲液中,用10ml的玻璃吸管在其表面小心滚动以赶出所有气泡,并将滤纸推平。
10.倒数毫升20×SSC于滤纸表面,将凝胶面向下倒扣在滤纸上,小心赶出凝胶与滤纸间的气泡,凝胶四周用胶布或塑料薄膜包裹以防缓冲液从凝胶周围直接流至纸中(虹吸短路)。
southern杂交实验方法和步骤

southern杂交实验方法和步骤一、主要仪器:离心机恒温水浴锅Orbital shaker 恒温摇床Poner PAC300核酸电泳仪VersaDoc凝胶成像系统水平摇床HL-2000 Hybrilinker分子杂交仪烘箱二、主要材料whatman 3mm滤纸尼龙膜吸水纸玻璃板玻璃棒废旧胶片方形果盘平板三、主要试剂RNase A真菌基因组提取试剂盒DIG-High Prime DNA Labeling and Detection Starter Kit IDNA MakerNaOH,NaCl,浓盐酸,Tris碱,柠檬酸钠,马来酸四、试剂准备变性液:0.5 mol/L NaOH,1.5 mol/L NaCl;Southern blot中和液:0.5 mol/L Tris-HCl(pH=7.5),1.5 mol/L NaCl;20×SSC:3 mol/L NaCl,0.3 mol/L 柠檬酸钠,浓盐酸调节pH至7.0;2×SSC:取100 mL 20×SSC溶液,灭菌去离子水定容至1L;2×SSC+0.01%SDS:取100 mL 20×SSC溶液,10 mL 10% SDS,灭菌去离子水定容至1L;0.5×SSC0.01%SDS:取25 mL 20×SSC溶液,10 mL 10% SDS,灭菌去离子水定容至1L;洗涤缓冲液:0.1 M马来酸,0.15 M NaCl,pH 7.5,0.3% (v/v)Tween 20;马来酸缓冲液:0.1 M马来酸,0.15 M NaCl,用NaOH(固体)调节pH值至7.5;检测缓冲液:0.1 Tris-HCl,0.1M NaCl,pH 9.5;封阻溶液:将DIG试剂盒内的6号瓶置于37℃水浴锅中预热,充分溶解后,取12mL,与108mL马来酸缓冲液混匀备用(新鲜配制,立即使用);抗体溶液:将DIG试剂盒内的4号管10000rpm高速离心5min,取4µL上清,加入20mL封阻溶液中,备用;底物显色液:取20mL检测缓冲液,避光加入400µL DIG试剂盒内的5号管。
Southern杂交

Southern 杂交(一)目的通过分子杂交,检测重组DNA分子中插入的外源基因是否确是原供体中的某一基因片段。
(二)原理Southern 印迹杂交是指将经凝胶电泳分离的DNA片段转移到合适的固相支持物上(通常是尼龙膜或硝酸纤维膜),再通过特异性的探针杂交来检测被转移的DNA的片段的一种技术。
Southern 杂交的实验流程如下:基因组DNA样品的限制性酶切-> 酶切样品的琼脂糖凝胶电泳-> DNA的变性、转膜与固定-> 杂交与杂交后清洗-> 杂交结果的检测(三)材料1.基因组DNA样品的限制性酶切:1)样品:GFP蛋白基因2)试剂:限制性内切酶;10x酶切缓冲液;0.5mol/L EDTA;Tris-饱和酚;氯仿/乙醇=24:1(体积比);预冷无水乙醇和70%乙醇;TE缓冲液3)仪器及器材:恒温水浴锅;电泳仪;水平电泳槽;微波炉;紫外透射仪2.酶切样品的琼脂糖凝胶电泳:1)样品:上一个实验的酶切产物2)试剂:琼脂糖;1xTAE缓冲液;6xDNA加样缓冲液;EB溶液;DNA分子量标准(DNA Marker)3)仪器及器材:电泳仪;水平电泳槽;微波炉;紫外透射仪;凝胶成像分析系统;微量移液器3.DNA的变性、转膜与固定:1)样品:电泳后的琼脂糖凝胶2)试剂:水解液(0.25mol/L HCL);变性液(1.5mol/L NaCl, 0.5mol/L NaOH, 0.2mol/L HCL);中和液(1mol/L Tris-HCL pH=7.4, 1.5mol/L NaCl);硝酸纤维膜(NC膜)或尼龙膜;碱性转移缓冲液(0.4mol/L NaOH, 1mol/L NaCl);20xSSC(3mol/L NaCl, 0.3mol/L 柠檬酸三钠pH=7.0);20xSSPE(3.6mol/L NaCl, 0.2mol/L NaH2PO4, 0.02mol/L EDTA pH=7.7);50xDenhardt 试剂(5g聚蔗糖Ficoll 400, 5g聚乙烯吡咯烷酮和5g牛血清白蛋白,加入无菌蒸馏水至500ml)3)仪器及器材:印迹转膜装置(托盘、支持物、Whatman 3MM滤纸、纸巾、玻璃板、重物等),紫外交联仪4.杂交与杂交后清洗:1)样品:固定了DNA酶切样品的硝酸纤维膜2)试剂:预杂交液(6xSSC, 5xDenhardt试剂, 0.5% m/V SDS, 1μg/ml polyA, 100μg/ml 鲑鱼精DNA, 50% V/V 甲酰胺)3)仪器及器材:杂交管(瓶),杂交炉5.杂交结果的检测:1)样品:杂交后已清洗的NC膜2)试剂:显影液,定影液3)仪器及器材:X线胶片,X线胶片盒(带增感屏),保鲜膜(四)步骤基因组DNA样品的限制性酶切:1)酶切:在1.5ml离心管中依次加入ddH2O Xμl;1μg/μl DNA 20μg;10x酶切缓冲液4.0μl;10U/μl限制性内切酶5.0μl,总体积500μl。
Southern Blot试剂、仪器

一、核酸提取:
核酸提取试剂盒及相关仪器设备、SmartSpec Plus--核酸蛋白测定仪
二、基因组DNA的限制酶切
10×酶切buffer、限制性内切酶、ddH2O 、0.5M EDTA、苯酚、氯仿、乙醇、TE缓冲液(10mM Tris-HCl 1mM EDTA PH=8.0)
三、基因组DNA消化产物的琼脂糖凝胶电泳
琼脂糖、6×Loading 缓冲液、DNA Marker、电泳仪、电泳槽
四、DNA变性及从琼脂糖凝胶转移到固相支持物
0.2M HCl、NaOH、NaCl、1M Tris-HCl(pH 7.4)、柠檬酸三钠、ddH2O、NC膜或尼龙膜、滤纸、吸水纸、纸巾
Bio-rad Trans-Blot SD 半干转印槽、烤箱
五、探针标记
模板DNA(需购买或自己设计另外合成)、Labeling 5×buffer(含有随机引物)、dNTPmix (含dCTP、dGTP、dTTP)、BSA(小牛血清白蛋白)、[a-32P]dATP 、Klenow酶、ddH2O、终止缓冲液
水浴箱、冰盒
六、预杂交
2×SSC、杂交液(PEG 6000 10%;SDS 0.5%;6×SSC;50%甲酰胺)、鲑鱼精DNA(已溶解在水或TE中)、NC膜、杂交瓶、杂交炉
七、杂交
鲑鱼精DNA、探针
八、洗膜与检测
2×SSC溶液、放射性检测仪、滤纸、保鲜膜、暗盒(加双侧增感屏)、红光灯、X光片、-70℃低温冰箱,(防辐射屏风)
计时器、镊子、手套、0.5ml离心管、透明胶带。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Southern 杂交一、目的二、基本原理DNA印迹杂交法是指利用毛细管作用,将变性DNA从凝胶上转移到硝酸纤维素膜或尼龙膜上,加以固定后用探针杂交的技术。
此法是由Dr.Southern 1975年建立的,它是分子生物学研究领域中最常用的技术之一,为后来发展的各种生物大分子杂交技术提供了重要的理论和实践基础。
分子杂交技术是根据两条单链DNA(或DNA与RNA)中互补碱基序列能专一配对的原理进行的。
在一定条件下,单链DNA或RNA能与另一条单链DNA互补的碱基形成氢键,从而使两条单链杂交形成双链DNA分子。
Southern印迹杂交技术是由:电泳,印迹,固定和检测4个步骤组成。
即用一种或几种限制性内切酶消化DNA分子,通过琼脂糖凝胶电泳按分子量大小分离所得片段,随后使DNA在原位发生变性,并从凝胶中转移至一固相支持物上(通常为硝酸纤维素膜或尼龙膜)。
DNA转至固相支持物的过程中,各个DNA片段的相对位置保持不变,用放射性标记或非放射性标记的DNA或RNA探针与固定于膜上的DNA分子进行杂交,经放射自显影或显色反应确定所有与探针杂交的片段的位置。
探针很难与琼脂糖凝胶中的DNA进行杂交,因此必须把DNA转移至一固相支持物上。
DNA 在高盐存在下,可以通过毛细作用印迹到膜上(目前又发展了真空转移和电转移等技术)。
DNA 片段的大小对转移率有很大的影响,大的DNA片段较难定量转移,一般可用短波长紫外线照射凝胶,将其中的DNA断裂为较小的片段,以利转移。
实验表明,单链DNA的平均长度在大约1000个碱基时即可充分转移。
能产生可检测杂交信号所需的DNA量取决于几个因素:DNA中与探针互补部分所占比例,探针的大小与比活,膜上DNA的量。
在最佳条件下经放射自显影曝光书天后这一方法的灵敏度足以检出不到0.1pg的与高比活32P标记的探针(109cpm/)互补的DNA。
Southern印迹杂交方法通常需要10µg基因组DNA。
杂交所用探针一般多采用放射性同位素标记,但由于非放射性探针标记对人体无害,无同位素污染及其后处理等优点,此外,标记的探针可长期保存,随时可用,所以非放射性探针标记越来越受到重视。
本试验采用非放射性地高辛标记技术非放射性DIG系统利用地高辛(digoxigenin, DIG)标记DNA、RNA或寡核苷酸作探针,以便进行杂交及随后的显色或化学发光检测。
非放射性探针标记方法之一是采用由间壁连接有类固醇半抗原的异羟基泽地黄毒苷配基标记的dUTP(缩写DIG-dUTP)作为DNA合成的底物,经随机标记法掺入新合成的DNA中,形成非放射性同位素标记探针,杂交后,用相应的碱性磷酸酶酶联抗体检测DIG标记DNA的存在。
在X-磷酸盐和硝基蓝四锉盐(NBT)存在下,碱性磷酸酶催化生色反应。
显示出所检测的目标DNA所在。
对DNA标记来说,DIG通过一个不耐碱的酯键与dUTP相联。
使用不耐碱的DIG-11dUTP 可以更容易和有效地除去膜上的探针,利用第二种DIG标记的探针进行再杂交。
不耐碱的DIG-11dUTP标记的DNA探针不能用碱(NaOH)变性。
必须在沸水中保温变性。
DNA标记:DIG-High Prime 系统是以随机引物标记的原理标记DNA探针。
在5×反应缓冲液中预先混合了随机引物标记的所有试剂,即可节省步骤又可以提高产量和可重复性,十分方便。
DIG-High Prime 系统可以用小到200bp的DNA片段、线性化的质粒、粘粒或λDNA甚至超螺旋的质粒作为标记的模板。
DIG-High Prime标记反应的产量:在标准反应中37℃保温1小时,由1μg的对照DNA可以产生800ng的DIG标记的DNA。
标记片段的长度为200-1000bp。
杂交:有别于同位素标记的杂交反应,我们推荐使用DIG Easy Hyb(一种可以立即使用的无毒的杂交液),它可以将杂交的时间降到低于4小时。
免疫检测:杂交后的探针与偶联有碱性磷酸酶的抗体(anti-DIG-AP)结合,然后用显色底物NBT/BCIP(见DIG DNA Labeling and Detection kit)或化学发光底物CSPD(见DIG Luminescent Detection Kit for Nucleic Acid)检测与DIG结合的抗体。
步骤反应时间DNA标记10分钟-过夜杂交6小时或过夜免疫检测 1.5小时显色反应0.5-16小时三、试剂配制(1)美莱博(Mylab)公司DIG High Primer Labelling and Dection Sterter Kit I成分这些试剂按下面的配方配制:缓冲液 1. 马来酸缓冲液(maleic acid buffer)[含有组分:0.1M maleic acid, 0.15M NaCl; 用固体NaOH将pH调到7.5(20℃)] 配制方法:将马来酸缓冲液(干粉)用800ml水溶解,反复冲洗干净瓶内干粉。
检查pH是否为7.5。
定容至1L。
灭菌。
缓冲液 2. 洗涤缓冲液(Washing buffer)马来酸缓冲液加入0.3% Tween20(v/v)缓冲液 3. 阻断液将10×阻断液母液用马来酸缓冲液稀释10倍,制备成1×阻断液缓冲液 4. 检测缓冲液0.1M Tris-HCl, 0.1M NaCl, pH9.5(20℃)缓冲液 5. TE缓冲液10mM Tris-HCl, 1mM EDTA pH8.0溶液 6. 抗体溶液每次使用前,需10,000rpm离心抗DIG-AP酶结合物5分钟,从表面小心吸取所需的量。
用阻断液按1:5000稀释抗体。
溶液 7. 显色溶液(避光存放)必须新鲜配制:在10ml检测缓冲液中加入200μl NBT/BCIP浓贮备液(2)显色溶液必须新鲜配制:在10ml缓冲液3中加入200μl NBT/BCIP浓贮备液(3)采用公司“primer-a-gene” labeling kit 和DIG-dUTP进行探针标记四、使用仪器稳压电泳仪;电泳槽;紫外检测仪;电热恒温水浴锅;杂交炉;恒温振荡器等。
用品及器具:保险膜,杂交管,吸水纸,解剖刀,增感屏,瓷盘,镊子,塑料手套,滤纸,尼龙膜等。
五、实验材料1、样品DNA;2、DIG-DNA探针六、实验操作(一)Southern 转移1、将PCR样品1%琼脂糖凝胶电泳1小时,取出凝胶在紫外灯下照相(最好放一标尺,可以读出DNA迁移的距离)。
2、将凝胶放入白瓷盘中,加入300-500ml变性液(3MNaCl,0.4M NaOH),室温下轻轻摇动,变性处理2×20min。
3、加入300-500ml转移液(3M NaCl,8mM NaOH)室温下轻摇15min。
4、将电泳胶盘倒置放入瓷盘中,其上放一张与胶盘同宽但稍长的普通滤纸,在瓷盘中倒入转移液(3M NaCl,8mM NaOH,pH7.2),将电泳胶反转使其背面朝上,放置在滤纸上,除去胶与滤纸间的气泡。
5、切一张比电泳胶大1-2mm的尼龙杂交膜或硝酸纤维素滤膜,浸入转移液约2-3分钟。
6、将浸湿的滤膜平铺在电泳胶上,小心除去其间的气泡。
切数张同电泳胶一样大小的滤纸,用转移液浸湿后,放在滤膜上,切5-10cm 厚的一叠比滤纸稍小的吸水纸放在滤纸上面,并在吸水纸上压一重物(约0.5公斤),水平静置12-24小时。
7、取去重物及吸水纸,在滤膜上用铅笔标记电泳胶加样孔的位置。
将滤膜放入转移液约5分钟,室温自然干燥数分钟后将膜夹入滤纸中在80℃下烘烤2小时(或者紫外交联数秒),使DNA牢固结合在膜上,即使在沸水中煮也不会脱离。
(二)DNA探针的制备1.随机引物末端标记目的片段(Promega公司Primer-a-Gene Labeling system)注:(1)每个标准反应可标记10ng-3μgDNA,要标记更多的DNA必须将所有的成分和体积放大。
(2)线性化的DNA应用酚/氯仿抽提并用乙醇沉淀,这样可以显著提高标记效率。
(3)37℃下延伸保温时间(至20小时),可以提高DIG标记DNA的产量。
(4)用DIG-High Prime标记的探针的长度为200-1000bp。
(三)DNA分子杂交1、将适当体积(20ml/100cm2)的预热到杂交温度的杂交缓冲液加入到有膜的杂交管中,预杂交1-2小时。
2、将DIG标记的探针(5-25ng/ml杂交液)在沸水中变性10分钟,在冰水上迅速冷却10分钟。
3、加到预热的预杂交缓冲液(2.5ml/100cm2)中,充分混匀但不要摇动出泡沫(气泡会造成背景)4、倒去预杂交液,换上探针和缓冲液的混合物,温和摇动,保温至少6小时。
如检测低丰度靶DNA 中的单拷贝基因,我们建议保温16小时。
杂交温度为65℃(无甲酰胺)或42℃(含50%甲酰胺)(四)杂交后洗膜:(1)在室温下用2×SSC,0.1%SDS洗两次,每次5分钟。
(2)在50℃用0.1×SSC,0.1%SDS洗两次,每次15分钟,不停搅动。
(五)免疫检验1、在杂交及严格洗膜后,将膜在洗涤缓冲液中稍微漂洗1-5分钟。
2、在20ml阻断液(1×)中孵育30分钟。
3、在10ml抗体液中孵育30分钟。
4、用20ml洗涤液洗涤2×15分钟。
5、在15ml检测缓冲液中平衡2-5分钟。
6、在避光条件下,于10ml新鲜制备的显色底物液中反应显色。
在显色过程中勿摇动。
7、当点或带显色到合适的深度后,将膜用50ml去离子水或TE缓冲液漂洗5分钟后终止反应。
将湿膜复印或照相记录。
七、注意事项1.杂交温度不可太高,时间不宜过长;杂交温度应比杂交分子的解链温度低20-25℃,一般同源探针的杂交温度在65℃,异源探针的杂交温度应适当调低,一般可在50℃下进行杂交,如是不匹配程度较高的异源探针可以加入50%甲酰胺在42℃杂交。
2.洗膜的严紧性:应尽量控制洗膜的严禁性以降低背景,如用放射性标记应在洗膜的过程中密切检测放射性强度,以防过高的严紧度致使探针脱落。
3.杂交膜不立即进行杂交,可保鲜膜包被,放到密封的杂交袋中长期保存。
4.尼龙膜的再生(回收)当用同位素标记时,可将膜至于煮沸的0.1×SSC/0.1%SDS溶液中5-10min,并用盖革计数器检测残留的放射强度为零,取出膜,滤纸吸干,用保鲜膜包好保存。
