邻苯三酚自氧化法测定sod活性及含量
邻苯三酚—鲁米诺发光体系测定SOD活性

邻苯三酚—鲁米诺发光体系测定SOD活性
徐靖;杨秀岑
【期刊名称】《郧阳医学院学报》
【年(卷),期】1999(18)2
【摘要】目的:建立一种测定SOD活力的方法。
方法:利用邻苯三酚在碱性条
件下自氧化—鲁米诺化学发光体系测SOD活性。
结果:本方法一个活力单位
(抑制50%发光程度)的SOD量为16ng/ml。
本法测定SOD浓度范围为5~150ng/ml,线性回归方程的相关系数:r=0.998。
检测限为1ng。
重复性:批内C.V.=1.0%,批间(隔7d)C.V.=5.1%。
结论:本法具有简易、灵敏、试剂价廉等优点。
【总页数】3页(P68-70)
【关键词】鲁米诺;超氧化物歧化酶;化学发光;邻苯三酚
【作者】徐靖;杨秀岑
【作者单位】郧阳医学院基础化学教研室;华西医科大学药学院应用化学研究室【正文语种】中文
【中图分类】Q554.903
【相关文献】
1.多酚氧化酶对邻苯三酚自氧化法测定SOD活性的干扰 [J], 荣俊;杨待建
2.鲁米诺、异鲁米诺和邻苯三酚发光效率的比较 [J], 陈玉兰
3.邻苯三酚自氧化法在SOD活性测定中的应用 [J], 贾红玉;王亚森;田晓辉;张伟;杜
建芳;康明;刘建荣
4.邻苯三酚自氧化—化学发光法测定SOD活性 [J], 郭蔼光;王振镒
5.邻苯三酚自氧化法测定SOD活性中测定波长的选择 [J], 孙雪奇;陈齐英;别小琳因版权原因,仅展示原文概要,查看原文内容请购买。
邻苯三酚法测定超氧化物歧化酶缓释片中SOD的活性

! 5 6 5 6 供试品溶液的制备 取 9.: 骨架缓释片 +’ 片, 研细, 精密称取适量 (约相当于 9.: &’’ !<) , 置 用 0, 3(’ 磷酸盐缓冲液定容至 )’’ !# 的量瓶中, 冰水浴间断超声 2’ !56, 用 ’(1 ! )’’ !#, ! 微孔滤膜 滤过, 弃去初滤液, 取续滤液作为供试品溶液。 ! 56 5 8 辅料对含量测定的影响 按骨架缓释片的 处方比例称取辅料适量, 置 &’’ !# 量瓶中, 照 “& J 2 J 项下方法处理, 取续滤液, 于 +’’ P /’’ 6! 范围内 2” 扫描, 结果表明辅料在 2+) 6! 处无吸收, 不影响测 定。 “ & J 2 J +” 项下的对照品 ! 56 5 9 线性关系的考察 取 溶液, 用 0, 3(’ 的磷酸盐缓冲液分别稀释成 O’、 /1、 ・!# % & O 种溶液, 照 “ & J 2 J &” 项下方法 2O、 +/、 &+、 O! < 测定 9.: 的活力, 以活力值对浓度进行线性回归, 在 得到回归方程: ; = 1N&(1) # Q /(&N。结果表明: %& ・ 线性关系良好 ( $ = ’(NNNO) 。 O’ P O ! < !# 范围内, ! 5 6 5 : 方法精密度考察 取一批 9.: 骨架缓释片, 照 “&J2J2” 项下方法制得供试品溶液, 再按 “&(2(&” 项 下方法进行活力测定, 分别测定 ) 次, %&’ = +(2)? 。 ! 56 5 ; 空白加样回收实验 按 处 方 量 的 1’? 、
其中邻苯三 的顺应性。测定 ;<= 活性的方法很多, 酚法简便易行, 现用其测定缓释片中 ;<= 的活性, 可有效地控制制剂的质量。
实验报告 猪血中超氧化物歧化酶

实验三 猪血中超氧化物歧化酶(SOD)的分离纯化及活力测定一、 实验原理超氧化物歧化酶(SOD)是一种能够专一性清除超氧离子自由基-2O 的金属酶。
它是一种酸性蛋白,对热、pH 和蛋白酶的水解较一般酶稳定。
SOD 催化下述反应:222222O O H O H +→+-+.。
机体内-2O 过量或不足都会对人体产生危害,SOD 对过量的-2O 及时清除保证-2O 含量的相对平衡。
本实验采用有机溶剂沉淀法以新鲜猪血为材料,从中提取SOD 并进行纯化。
该实验SOD 酶活性采用邻苯三酚自氧化法测定,其酶活性单位定义为:每毫升反应液中,每分钟抑制邻苯三酚自氧化速率达50%酶量定义一个酶单位。
样品中蛋白质含量采用考马斯亮蓝250-G 法测定。
考马斯亮蓝250-G 在游离状态下呈粉红色,与蛋白质结合后呈蓝色。
在一定范围内,溶液在595nm 波长下的光密度与蛋白质含量成正比,可用比色法测定,测定范围是1-1000ug 。
SOD 同工酶鉴定采用不连续聚丙烯酰胺凝胶电泳技术分离鉴定。
二、试剂与材料[1]试剂:ACD 抗凝剂、0.9%NaCl 、丙酮、05%乙醇、氯仿、50mmol/L pH8.3磷酸缓冲液、10mmol/LEDTA 钠盐溶液、3 mmol/L 邻苯三酚钠溶液、考马斯亮蓝250-G 标准蛋白质溶液、[2]器材:分光光度计、试管、刻度吸管、离心机、烧杯。
三、操作步骤1、SOD 提取[1] 取40ml 新鲜猪血,5000r/m 离心10min ,去上层血浆,取下层红血球粘稠液。
加入2倍体积的0.9%Nacl 溶液清洗,5000r/m 离心10min ,弃上层清液。
[2] 向洗净的红血球中加入适量蒸馏水至15ml ,剧烈搅拌30min ,使其充分溶血。
再向溶血溶液中缓慢加入预冷的0.25倍体积的95%的乙醇溶液和0.15倍体积的氯仿,均浆呈红色,再继续搅拌15min ,4000r/m 离心10min ,去变性蛋白质沉淀物,得上层液,留样1ml 。
猪血中超氧化物歧化酶(SOD)的分离纯化及活力测定、同工酶电泳

一、原理1.超氧化物歧化酶(SOD)超氧化物歧化酶(superoxide dismutase,SOD)是一种能专一地清除超氧离子自由基()的金属酶,它具有抗衰老、抗辐射、抗炎及抗癌等作用因而在医药、化妆品及食品工业等方面有了广泛的应用前景。
SOD是一种酸性蛋白,对热、pH和蛋白酶的水解较一般酶稳定。
按照它所含金属离子的不同,可分为Cu-Zn-SOD(二聚体,蓝绿色)、Mn-SOD(紫红色)和Fe-SOD(黄褐色)三种。
SOD催化下述反应:2+2→+。
机体内的过量和不足均对机体不利,SOD 对过量的的及时清除保证了机体内的含量相对的平衡。
机体内的形成可分为生理性和病理性两方面。
在一些正常生理过程中会形成一些。
例如:呼吸链中电子传递结果可产生一些。
在某些疾病(如氩中毒、辐射病等)过程中会产生大量的。
过量的如不及时清除,会对细胞损伤。
SOD将歧化为和,而过氧化氢(物)酶、谷胱甘肽过氧化酶可催化或氧化氢分解,在机体内形成一套解毒系统,对机体起防护作用。
2.有机溶剂沉淀法分离纯化蛋白质本实验采用有机溶剂沉淀法以新鲜猪血为原料,从中提取SOD并进行分离纯化。
有机溶剂沉淀法的基本原理:①亲水性有机溶剂加入溶液后降低了介质的介电常数,使溶质分子之间的静电引力增加,聚集形成沉淀;②水溶性有机溶剂本身的水合作用降低了自由水的浓度,压缩了亲水溶质分子表面原有水化层的厚度,降低了它的亲水性,导致脱水凝集。
常见的有机溶剂有丙酮和乙醇等。
3.邻苯三酚自氧化法测定酶活力酶活性测定的方法有以下几种方法:邻苯三酚自氧化法、黄嘌呤氧化酶法、NBT光还原法、化学发光法、肾上腺素自氧化法及亚硝酸法等。
本实验SOD酶活性采用邻苯三酚自氧化法测定,酶活性单位定义为:每毫升反应液中,每分钟抑制邻苯三酚自氧化速率达50%的酶量定义为1个酶单位。
邻苯三酚自氧化法的原理:利用邻苯三酚在碱性条件下能迅速自氧化,产生,生成有颜色的中间产物。
反应开始后先变成黄绿色,几分钟后转为黄色,吸光度值与反应时间能在3~4 min内维持线性关系。
邻苯三酚法测定超氧化物歧化酶缓释片中SOD的活性

邻苯三酚法测定超氧化物歧化酶缓释片中SOD的活性
蔡骏;李颖;尹宗宁
【期刊名称】《华西药学杂志》
【年(卷),期】2005(20)1
【摘要】目的建立超氧化物歧化酶 (SOD)缓释片的活性测定方法。
方法采用邻苯三酚自氧化法。
结果在SOD浓度为 0 .0 6 0~0 . 0 0 6mg·ml-1时线性关系良好(r=0 .9996 ) ;平均空白加样回收率为 10 1 .94 % (n=9)。
结论所用方法简单、快速 ,结果准确。
【总页数】2页(P54-55)
【关键词】缓释片;超氧化物歧化酶(SOD);超氧化物歧化酶;邻苯三酚自氧化法;活性测定;方法;线性关系
【作者】蔡骏;李颖;尹宗宁
【作者单位】四川大学华西药学院
【正文语种】中文
【中图分类】R446.11;Q503
【相关文献】
1.多酚氧化酶对邻苯三酚自氧化法测定SOD活性的干扰 [J], 荣俊;杨待建
2.邻苯三酚自氧化法测定甲烷氧化菌素-铜配合物的超氧化物歧化酶活性 [J], 陈林林;张伟;王振兴;辛嘉英
3.邻苯三酚自氧化法测定超氧化物歧化酶活性的研究 [J], 许雅娟;赵艳景;胡虹
4.四种邻苯三酚自氧化法测定超氧化物歧化酶活性方法的比较 [J], 张宏;谭竹钧
5.邻苯三酚自氧化法测定血中超氧化物歧化酶的活性 [J], 赵云斌;刘敏;余忠谊因版权原因,仅展示原文概要,查看原文内容请购买。
SOD活性测定

SOD活性测定:SOD的测定方法很多,常见的有化学法,免疫法等电点聚焦法等,化学法测定的原理主要是利用有些化合物如邻苯三酚,在自氧化过程中会产生有色中间物降超氧游离基(O2)这样就可以利用SOD分例(O2)。
阻止中间物的积累而测定其酶活性。
1、试剂及仪器(1)邻苯三酚分析纯,用10mmol/LECL配成50mmol/L溶液。
(2)UV-754紫外分光光度计。
2、测定方法:(1)邻苯三酚自氧化速度的测定。
在25度、45ml`50mmol/L、PH值8.3、K2HPO4-KH2PO4缓冲液中加入10mmol/L的邻苯三酚,迅速摇匀,倒入光径1cm的比色杯内,在325mm波长下每隔30秒测A值一次,要求自氧化速度控制在0.0700d/mm 左右。
(2)SOD或粗酶抽提液活性测定:测定方法同测邻苯三酚自氧化速度,在加入邻苯三酚前加入待测SOD样液,测得数据按以下公式计算酶活性。
0.0700-A325mm/min----------------------------------------*100%度0.70样液稀释倍数样液稀释倍数酶活性(u/m1)=------------*反应液总体积*----------------50%样液体积3、蛋白浓度(mg/ml)和蛋白的计算:SOD或粗酶抽提液,经280mm紫外比色测定后,查牛轿清白蛋的标准曲线,由此算出每ml含ug蛋白的量。
蛋白浓度=ug蛋白/ml*样液稀释倍数*10负3次方=mg蛋白/ml总蛋白=mg蛋白/ml*原液总体积=mg蛋白。
4、比活(u/mg蛋白)的计算:单位活力(u/ml) 总活力比活=-----------------------=-----------------=u/mg蛋白蛋白的浓度(mg蛋白/ml) 总蛋白超氧化物歧化酶的活性测定超氧化物岐化酶(Superoxide dismutase,简称 SOD)广泛存在于生物体内的含Cu、Zn、Mn、Fe的金属类酶。
单项技能实训指导书-自由基清除剂SOD活性的测定(精)
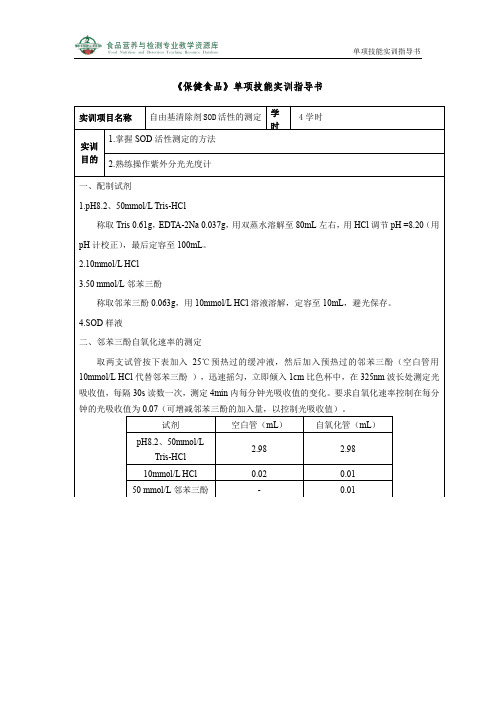
样品管(mL)
pH8.2、50mmol/L
Tris-HCl
2.98
2.98
10mmol/L HCl
0.02
-
SOD样液
-
0.01
50 mmol/L邻苯三酚
-
0.01
4、结果处理
《保健食品》单项技能实训指导书
实训项目名称
自由基清除剂SOD活性的测定
学时
4学时
实训目的
1.掌握SOD活性测定的方法
2.熟练操作紫外分光光度计
一、配制试剂
1.pH8.2、50mmol/L Tris-HCl
称取Tris 0.61g,EDTA-2Na 0.037g,用双蒸水溶解至80mL左右,用HCl调节pH =8.20(用pH计校正),最后定容至100mL。
2.10mmol/L HCl
3.50 mmol/L邻苯三酚
称取邻苯三酚0.063g,用10mmol/L HCl溶液溶解,定容至10mL,避光保存。
4.SOD样液
二、邻苯三酚自氧化速率的测定
取两支试管按下表加入25℃预热过的缓冲液,然后加入预热过的邻苯三酚(空白管用10mmol/L HCl代替邻苯三酚),迅速摇匀,立即倾入1cm比色杯中,在325nm波长处测定光吸收值,每隔30s读数一次,测定4min内每分钟光吸收值的变化。要求自氧化速率控制在每分钟的光吸收值为0.07(可增减邻苯三酚的加入量,以控制光吸收值)。
试剂
空白管(mL)
自氧化管(mL)
pH8.2、50mmol/L
Tris-HCl
2.98
2.98
10mmol/L HCl
0.02
0.01
50 mmol/L邻苯三酚
邻苯三酚自氧化法简易操作图解-测量SOD活性方法

邻苯三酚自氧化法简易操作图解-测量SOD活性方法连苯三酚自氧化法测定·O2-自由基的清除能力简介(适用于:SOD及各种抗氧化剂)文献来源[1] Xican Li. Improved Pyrogallol Autoxidation Method: A Reliable and Cheap Superoxide-scavenging Assay Suitable for All Antioxidants. Journal of Agricultural and Food Chemistry, 2012, 60:6418-6424.操作图解具体方法1 溶液配制1.1 Tris溶液(0.1mol/L):1.21 gTris(三羟甲基氨基甲烷,M.W. 121.1)+100 mL蒸馏水。
1.2 HCl溶液(0.1mol/L):取0.1 mL浓盐酸,加蒸馏水稀释到6 mL。
1.3 Tris-HCl缓冲液(0.05mol/L,pH7.4,含1mmol/L Na2EDTA)40 mL0.1 mol/L Tris溶液+ x mL0.1 mol/L HCl溶液+15.2 mgNa2EDTA,混合,稀释到80 mL。
用pH计测量,pH应为7.4。
用棕色瓶保存在冰箱内(最多保存三天) 。
(以上为一个样品的用量)用前稍热至室温,再测pH值,符合要求即可。
1.4 60 mmol/L连苯三酚溶液(溶于1 mmol/L盐酸中)取0.1mol/L HCl溶液(见1.2项)20μL,用蒸馏水稀释到2 mL,得1 mmol/L盐酸溶液(用pH计测量,pH=2.5-3.0)。
再往里加连苯三酚14.6 mg (M。
W.126.1 ),即得。
(当天有效,以上为1个样品的用量)。
2 测试液2.1连苯三酚溶液:取2950μL Tris-HCl缓冲液加入到石英比色皿中,再加约50μL连苯三酚溶液,迅速混合(颠覆式),开始计时,每隔30秒读数一次A值(325nm),至300秒(5min)时为止。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
邻苯三酚自氧化法测定sod活性及含量
一、实验原理:
邻苯三酚在碱性条件下,能迅速自氧化,释放出O2-,生成带色的中间产物,中间物的积累在滞留30~45s后,与时间成线性关系,一般线性时间维持在4min的范围内,中间物在420nm波长处有强烈光吸收。
当有SOD存在时,由于
它能催化O2-与H+结合生成O
2和H
2
O
2
,从而阻止了中间产物的积累,因此,通过
测定光吸收即可求出SOD的酶活性。
二、实验试剂:
大宝sod蜜、冷丙酮、磷酸缓冲液(PH7.8,0.05mol/L)、氯仿-乙醇混合液、邻苯三酚、浓盐酸、天平、石英砂、研钵、冷冻离心机、50mL离心管 8个、紫外-可见分光光度计、250mL三角瓶8个、玻璃棒8根、试剂瓶250mL 3个、500mL 3个、250mL烧杯16个、试管带胶塞80根、移液管各5根
这个液体貌似是不能研磨的,而且本身就是酶,正常的生物体内的酶不都是可溶的?研磨是为了破碎细胞的。
我觉得应该是通过加水——打碎胶体,把抗氧化剂全都搞到水中(这个拜托查下)——分液——乙醇-氯仿沉淀(用来鉴别是带Mn还是CuZn)(不知道会不会有另外两种抗氧化剂干扰)——透析(去离子电泳用)
乙醇-氯仿的浓度比
酶的保存问题:测一下大宝pH应该可以作为参考,但是这个酶种类太多了,要点就是pH至少不能小于6,关于最适合pH是否也要测量?还是说我们是为了测量大宝里面SOD的活性所以就按照大宝的pH保存。
还有一个小小的想法就是。
这部分是1次做完还是两次做完?
EDTA二钠:几乎不溶于乙醇、乙醚,其水溶液pH值约为5.3。
用于络合金属离子和分离金属。
干扰物,但是没有氧化性
三、实验步骤:
(1)SOD提取:
取大宝sod蜜加入15mL的PH7.8 0.05mol/L的磷酸缓冲液,研磨搅拌20分钟,使SOD充分溶解,6000rpm离心,弃去沉淀,得上清液。
(留出1mL备用,准确量取剩余上清液体积,记录)
(2)除杂蛋白:
提取液加入1/4体积的氯仿-乙醇混合液搅拌10min,6000rpm离心15min去沉淀,得粗酶液。
(取1mL粗酶液备用,精确测量剩余粗酶液体积)
(3)SOD酶的沉淀分离:
剩余的粗酶液中加入等体积的冷丙酮,搅拌15min,6000rpm离心15min,得到SOD酶沉淀。
将沉淀先加2mL磷酸缓冲液,溶解后再加3mL混匀。
6000rpm 离心15min,取上清得到SOD酶液。
取1mL备用,其余量取体积。
(4)粗酶液活性测定:
提取液、粗酶液、酶液中SOD活力检测,具体步骤如下。
加入邻苯三酚后迅速混匀,准确计时4min,加一滴浓盐酸停止反应,420nm测吸光值。
(5)溶液中可溶性蛋白含量测定:
分别从1mL备用的提取液、粗酶液、酶液各取0.3mL按以下倍数稀释,260nm/280nm测定吸光值,按公式计算蛋白质浓度。
提取液稀释:50 ×
粗酶液稀释:20 ×
酶液稀释:10 ×
四、实验数据:
五、实验结果及数据处理:
(1)酶活力单位
提取液酶活力单位:=2(OD
1-OD
2
)×5/0.1=
粗酶液活力单位:=2(OD
1-OD
2
)×5/0.1=
酶液活力单位:=2(OD
1-OD
2
)×5/0.1=
(2)总活力
提取液总活力U=活力单位×总体积=
粗酶液总活力=活力单位×总体积=
酶液总活力=活力单位×总体积=
(3)比活力
提取液酶液比活力U/mg=活力单位/蛋白质浓度= 粗酶液比活力U/mg=活力单位/蛋白质浓度=
酶液比活力U/mg=活力单位/蛋白质浓度=
(4)纯化倍数
粗酶液纯化倍数=粗酶液比活力/提取液比活力= 酶液纯化倍数=酶液比活力/提取液比活力= (5)回收率
粗酶液回收率=粗酶液总活力/提取液总活力=
酶液回收率=酶液总活力/提取液总活力=。
