邻苯三酚自氧化法测定超氧化物歧化酶活性
邻苯三酚自氧化法测定超氧化物歧化酶活性

2.1试剂和主要仪器
一.试剂
0.1mol/L Tris-HCl缓冲液(pH8.2,内含2mmol/L EDTA):0.2mol/L Tris(内含4mmol/L EDTA)100ml与0.2mol/L HCl44.76ml混合,加双蒸水至200ml,调pH8.2±0.01;邻苯三酚(45mmol/L):以10mmol/LHCl配制成6mmol/L溶液,存放于冰箱备用;所用试剂均为国产分析纯;实验用水为自制双蒸水;
目前超氧化物歧化酶sod活性测定结果混乱为提高测定结果的可比性对邻苯三酚自氧化法测定sod活性的方法进行了研究就该活力测定体系中缓冲溶液的介质组成浓度ph及所含的edta量等因素对测定结果响进行了探讨根据实验结果提出了新的改良方法超氧化物歧化酶sod是一种特殊的金属酶它能催化超氧阴离子自由基02发生歧化反应从而能有效清除机体内超氧阴离子自由基02是生物体重要的细胞防御系统之一具有防御氧毒抗辐射防衰老以及防治肿瘤和抗炎等药用功效1超氧化物歧化酶sod这一独特的生理功能使其在医药领域具有良好的应用前景激起了人们广泛的研究热情
2.SOD或粗醉抽提液的活性浏定:
测定时按表2加样,测定步骤与测邻苯三酚的自氧化速率同。
酶活力单位定义:在1ml反应液中,每分钟抑制邻苯三酚自氧化速率达50%时的酶量定为一个活力单位,即420nm0.030D/分为一个活力单位。若自氧化速率在36~65%,通常可按比例计算,不在此范围内的数值应增减样液量。
二、仪器:
721型分光光度计(上海第三分析仪器厂)
操作方法
1.邻苯三酚自氧化速率的测定:在试管中按表l加入缓冲液和双蒸水,25℃保温劝分钟,然后加入25℃预温的邻苯三酚(对照管用10mMHCI代替),迅速摇匀,倒入比色杯中,在4加nm的分光光度计中,每隔半分钟测一次OD值,要求自氧化速率控制在0.060OD/分。
邻苯三酚法测定超氧化物歧化酶缓释片中SOD的活性

! 5 6 5 6 供试品溶液的制备 取 9.: 骨架缓释片 +’ 片, 研细, 精密称取适量 (约相当于 9.: &’’ !<) , 置 用 0, 3(’ 磷酸盐缓冲液定容至 )’’ !# 的量瓶中, 冰水浴间断超声 2’ !56, 用 ’(1 ! )’’ !#, ! 微孔滤膜 滤过, 弃去初滤液, 取续滤液作为供试品溶液。 ! 56 5 8 辅料对含量测定的影响 按骨架缓释片的 处方比例称取辅料适量, 置 &’’ !# 量瓶中, 照 “& J 2 J 项下方法处理, 取续滤液, 于 +’’ P /’’ 6! 范围内 2” 扫描, 结果表明辅料在 2+) 6! 处无吸收, 不影响测 定。 “ & J 2 J +” 项下的对照品 ! 56 5 9 线性关系的考察 取 溶液, 用 0, 3(’ 的磷酸盐缓冲液分别稀释成 O’、 /1、 ・!# % & O 种溶液, 照 “ & J 2 J &” 项下方法 2O、 +/、 &+、 O! < 测定 9.: 的活力, 以活力值对浓度进行线性回归, 在 得到回归方程: ; = 1N&(1) # Q /(&N。结果表明: %& ・ 线性关系良好 ( $ = ’(NNNO) 。 O’ P O ! < !# 范围内, ! 5 6 5 : 方法精密度考察 取一批 9.: 骨架缓释片, 照 “&J2J2” 项下方法制得供试品溶液, 再按 “&(2(&” 项 下方法进行活力测定, 分别测定 ) 次, %&’ = +(2)? 。 ! 56 5 ; 空白加样回收实验 按 处 方 量 的 1’? 、
其中邻苯三 的顺应性。测定 ;<= 活性的方法很多, 酚法简便易行, 现用其测定缓释片中 ;<= 的活性, 可有效地控制制剂的质量。
用邻苯法三酚测定大蒜中超氧化物歧化酶活性

FFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFFF
得到充分的锻炼, 从而培养了他们的科研思维、 科研意识, 增加 了对科学的兴趣。
参考文献: . " / 012%34 5 0 6, 7384%982:’ ;<=13%>841 48?@<AB?1 BC 1CDE@82 F<C2A8%C F%3 13EA:3%2<=318C G :13C%2%=318C H . 5 / ’ I<3 5 J8%K:1@ , "LML , (## : M*#L N
原理: 邻苯
三酚在碱性条件下,能迅速自氧化,释放出 ,$ , +,- 能催化 ,$ ! 发生歧化反应,生成 0$ ,$ 和 ,$ ,从而抑制邻苯三酚的自氧 化, 反应如下: 样品对邻苯三酚自氧化速 $,$ F $0= 0$ ,$ F ,$ 。
!
率的抑制率, 即反映样品中 +,- 的含量。 % " ) 邻苯三酚自氧化速率的测定。取 #3A (’33GA D = HC2I ! 用 89 ! $:( 岛津自动记录分光光度 0JA, K0L& ’ 缓冲液作空白, 迅速混匀, 然后快 计, 调零点, 再取 #3A 缓冲液加入邻苯三酚, 速倒入 "M3 石英比色杯中,置 $(N 恒温池中,波长 #$(B3,在 计算线性范围内每分钟光密 $32B 内连续测定其光密度值变化。
采用邻苯三酚自氧化法对普通大蒜、 紫皮独头蒜的酶粗液进行 +,- 活性测定。结果 紫皮独头蒜与普通大蒜酶活性不同。 紫皮独头蒜酶活性高于普通大蒜酶活性。结论 在实验教学中选用食用大蒜为材料可增加学生对科学的兴趣。 关键词: 超氧化物歧化酶; 邻苯三酚; 酶活性 中图分类号: T>$>& #" 文献标识码: U 文章编号: ":P" ! "$>: % $’’P ) ’# ! ’""# ! ’$ 度值的增加 ( , 即为邻苯三酚自氧化速率 ( 。 E ?) E ?’ ) % $ ) 样品酶活性的测定。采用邻苯三酚自氧化法测定酶活 性。在加入邻苯三酚之前, 需先加入待测酶粗液于缓冲液中, 混 匀, 再加入邻苯三酚, 迅速混匀, 然后快速倒入 "M3 石英比色杯 中, 置 $(N 恒温池中, 波长 #$(B3, 在 $32B 内连续测定其光密 度值变化。 % # ) 样品酶活性的计算。
动物血中超氧化物歧化酶的提取和活性测定

动物血中超氧化物歧化酶的提取和活性测定原理超氧化物岐化酶(Superoxide dismutase,简称SOD)广泛存在于生物体内的含Cu、Zn、Mn、Fe的金属类酶。
它作为生物体内重要的自由基清除剂,可以清除体内多余的超氧阴离子,在防御生物体氧化损伤方面起着重要作用。
离子(02-)是人体氧代谢产物,它在体内过量积累会引起炎症、肿瘤、色斑沉淀、衰老等疾病,超氧阴离子与生物体内许多疾病的发生和形成有关。
由于SOD能专一消除超氧阴离子(O2 -)而起到保护细胞的作用,SOD作为一种药用酶,具有广阔的应用前景,并引起了国内外医药界、生物界和食品界的极大关注。
按金属辅基成分的不同可分成3种类型。
最常见的一种含有铜锌金属辅基(CuZn-SOD),主要存在于真核细胞的细胞质中,在高等植物的叶绿体基质、类囊体内以及线粒体膜间隙也有存在,CuZn-S0D 酶蛋白的分子量约为3.2×104,纯品呈蓝绿色,每个酶分子由2个亚基通过非共价键的疏水基相互作用缔合成二聚体。
每个亚基(肽链)含有铜、锌原子各一个,活性中心的核心是铜。
第二种含有锰离子(Mn-SOD),主要存在于真核细胞的线粒体和原核细胞中,在植物的叶绿体基质和类囊体膜上也有存在,纯品呈粉红色,由4条或2条肽链组成。
第三种是Fe-S0D,过去一直认为只存在于原核细胞中,近来发现有一些真核藻类甚至某些高等植物中也有存在。
Fe-SOD纯品呈黄色或黄褐色,由2条肽链组成,多数情况下每一个二聚体中含有一个Fe原子。
l969年,McCord和Fridovich第一次从牛血中提纯到超氧化物岐化酶。
自然界中SOD分布极广,其含量随生物体的不同而不同,即使同一种生物的不同组织或同一组织的不同部位,其SOD的种类和含量也有很大差别。
迄今为止人们已从细菌,真菌、原生动物。
藻类、昆虫、鱼类、植物和动物等各种生物体内分离得到SOD。
为拓宽提取SOD的原料,筛选或基因过程开发产SOD量较高的菌株。
邻苯三酚自氧化法测定血浆超氧化物歧化酶的方法学评价及临床应用探讨

邻苯三酚自氧化法测定血浆超氧化物歧化酶的方法学评价及临床应用探讨张凡;李兴武;钟政荣【期刊名称】《淮海医药》【年(卷),期】2015(000)003【摘要】目的:对邻苯三酚自氧化法测定血浆超氧化物歧化酶( SOD)的方法学进行评价,并探索其临床应用价值。
方法根据美国临床和实验室标准协会(CLSI)的评价方法,应用邻苯三酚自氧化法检测血浆SOD,评价其精密度、准确度、线性和回收率;随机选取2014年健康体检者42例作为对照组,2014年3-12月我院住院氧化应激反应相关疾病患者1580例作为疾病组,测定血浆SOD的活性水平,进行临床应用评价。
结果用邻苯三酚自氧化法测定SOD精密度试验中批内精密度为1.57%和4.8%,批间精密度为2.17和2.21%;准确性试验相对偏倚为:1.6%和2.4%;线性试验在0~250 U/ml内R2为0.9978;回收率为96.2%~103.4%;SOD在各疾病组与健康对照组差异均具有显著性(P<0.01)。
结论邻苯三酚自氧化法测定SOD方法学评价符合要求,其精密度高、准确性好,线性范围宽,具有较高的临床应用价值。
%Objective To evaluatethe methodology of determination of plasma superoxide dismutase(SOD) by means of pyrogallol autoxidation and explore its clinicalapplication.Methods Based on the USA Clinical and Laboratory StandardsIn-stitute (CLSI),plasma SOD was determined using pyrogallol autoxidation to evaluate its precision,accuracy,linearity and re-covery rate.42 healthy checkup people in 2014 were selected as a control group and 1580 casesof inpatients from March to December in 2014 who had related disease with oxidative stress reaction were chosen as a disease group.Their level activity of plasma SOD was determined.These inpatients were divided into 6 disease groups in terms of liver,renal,digestive system,re-spiratory system,cardiovascular,and diabetes diseases.Results By the test of determining the precision of SOD with pyrogal-lol autoxidation,the within-run precision were 1.57%and 4.8%and the between-run precision were 2.17%and 2.21%.The relative biases were 1.6% and 2.4% in the accuracy test.R2 was 0.9978 within 0~250U/ml in the linear test.Recovery rates were 96.2%~103.4%.There were significant differences of SOD between each disease group and healthy control group (P<0.01).Conclusion The methodological evaluation of determining SOD with pyrogallol autoxidation meets the require-ment for its high precision,good accuracy and wide linear range.The method has high value in clinical application.【总页数】3页(P227-229)【作者】张凡;李兴武;钟政荣【作者单位】蚌埠医学院第一附属医院检验科,安徽蚌埠 233004;蚌埠医学院第一附属医院检验科,安徽蚌埠 233004;蚌埠医学院第一附属医院检验科,安徽蚌埠 233004【正文语种】中文【中图分类】R44【相关文献】1.邻苯三酚自氧化法测定血清超氧化物歧化酶变异因素的探讨和控制 [J], 张建新;石南宁;康学军;王彦;黄新生2.邻苯三酚自氧化法测定超氧化物歧化酶活性的研究 [J], 许雅娟;赵艳景;胡虹3.人血浆、红细胞超氧化物歧化酶活性邻苯三酚自氧化抑制同步测定法及其临床应用 [J], 徐元仁;穆红;孙传珍;翟德佩;苏中;刘春艳4.四种邻苯三酚自氧化法测定超氧化物歧化酶活性方法的比较 [J], 张宏;谭竹钧5.邻苯三酚自氧化法测定血中超氧化物歧化酶的活性 [J], 赵云斌;刘敏;余忠谊因版权原因,仅展示原文概要,查看原文内容请购买。
超氧化物歧化酶(SOD)活性测定方法

超氧化物歧化酶(SOD )活性的测定方法
一、试剂
1. 0.1mol/L HCl
2. 10mmol/L HCl
3. 0.1mol/L Tris 标准溶液:12.114g 三羟甲基氨基甲烷溶于蒸馏水,并定容至1000ml.
4. 50mmol/LTris 缓冲溶液:50ml0.1mol/L Tris 标准溶液中加入0.1mol/L HCl 19.9~22.0ml,定容至100ml ,PH 为8.20。
5. 30mmol/L 邻苯三酚盐酸溶液:3.7833g 邻苯三酚溶于10mmol/LHCl 中,并用10mmol/LHCl 定容至1000ml.
二、仪器
1. 紫外分光光度计
2. 酸度计
3. 恒温水浴锅
三、操作方法
1.邻苯三酚自氧化速率测定
在试管中加入4.5ml 50mmol/LTris 缓冲溶液,于25℃保温20min,加入10~20ul 30mmol/L 邻苯三酚,立即计时并摇匀,倾于比色杯内,于325nm 下,每隔1min 测吸光值一次,空白以10mmol/L HCl 代替邻苯三酚,要求自氧化速率控制在0.070 OD/min 左右。
%1004
min 1min 5⨯值值-第第自氧化速率=OD OD 2.SOD 活性测定
将样液加入到Tris 缓冲溶液中,其余步骤同自氧化速率测定方法。
活力单位定义:将一定条件下使每毫升反应液自氧化速率抑制50%的酶量定义为一个单位(u )。
样品质量样液体积样品稀释倍数自氧化速率速率自氧化速率-样液氧化=活力(⨯⨯⨯⨯5.4%50%100)/SOD ml u。
超氧化物歧化酶(SOD)活力测定
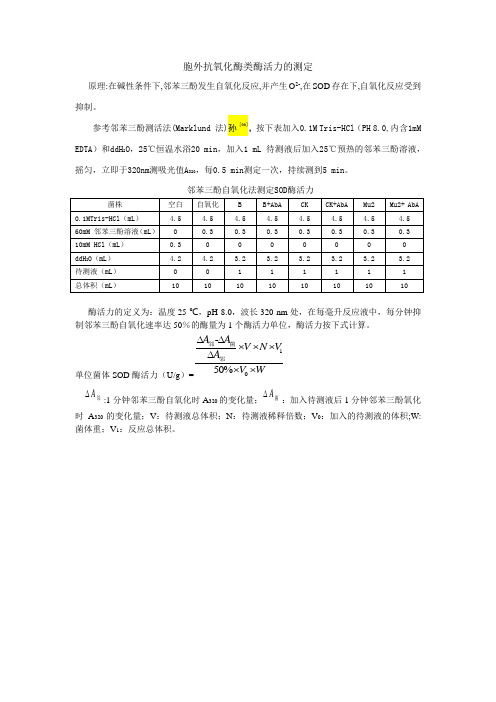
胞外抗氧化酶类酶活力的测定
原理:在碱性条件下,邻苯三酚发生自氧化反应,并产生O2-,在SOD存在下,自氧化反应受到抑制。
参考邻苯三酚测活法(Marklund 法)孙 [66],按下表加入0.1M Tris-HCl(PH 8.0,内含1mM EDTA)和ddH2O,25℃恒温水浴20 min,加入1 mL 待测液后加入25℃预热的邻苯三酚溶液,摇匀,立即于320nm测吸光值A320,每0.5 min测定一次,持续测到5 min。
邻苯三酚自氧化法测定SOD酶活力
酶活力的定义为:温度25 ℃,pH 8.0,波长320 nm处,在每毫升反应液中,每分钟抑制邻苯三酚自氧化速率达50%的酶量为1个酶活力单位,酶活力按下式计算。
单位菌体SOD酶活力(U/g)=
1
-
50%
A A
V N V A
V W
∆∆
⨯⨯⨯∆
⨯⨯
邻菌
邻
A∆
邻:1分钟邻苯三酚自氧化时A320的变化量;A∆
菌:加入待测液后1分钟邻苯三酚氧化
时A320的变化量;V:待测液总体积;N:待测液稀释倍数;V0:加入的待测液的体积;W:菌体重;V1:反应总体积。
稻米中超氧化物歧化酶含量及活性分析

稻米中超氧化物歧化酶含量及活性分析作者:杨先炯来源:《安徽农业科学》2017年第02期摘要[目的]对不同稻米中超氧化物歧化酶(SOD)的含量及活性进行测定、分析。
[方法]采用沉淀法从不同种类稻米中提取SOD,然后用改良的邻苯三酚自氧化法进行SOD活性分析,比较不同稻米中SOD含量及活性的差异。
[结果]糯米中的SOD含量高于粳米,但两者活性差异不大。
高纬度地区所产稻米的SOD含量及活性均高于低纬度地区所产稻米。
胚芽保留程度高的鲜糙米SOD含量及活性最高。
[结论]沉淀法可以有效地从稻米中提取SOD。
不同种类、产区和加工工艺稻米中SOD含量及活性存在差异。
关键词稻米;超氧化物歧化酶;含量;活性;邻苯三酚自氧化中图分类号 S511 文献标识码 A 文章编号 0517-6611(2017)02-0011-02Abstract[Objective] To determine and analyze the content and activity of superoxide dismutase (SOD) in different types of rice.[Method] SOD was isolated by precipitation process from different types of rice, and its activity was determined through modified pyrogallol selfoxidation.[Result] Glutinous rice had higher SOD content than japonica rice, however, SOD activity did not have significant difference. Both of SOD content and activity in rice from high latitude area were higher than that of rice from low latitude region. Moreover, brown rice with germ exhibited the highest SOD content and activity.[Conclusion] Precipitation process is an effective method for SOD isolation from rice. There are significant differences of SOD content and activity in different types of rice.Key words Rice;Superoxide dismutase;Content;Activity;Pyrogallol selfoxidation超氧化物歧化酶(SOD)是生物体内的重要抗氧化酶,具有特殊的生物学活性[1]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三、温度对邻苯三酚自氧化的影响
实验表明,温度对邻苯三酚自氧化速率的影响远比pH要小得多。特别在25一27.5℃时,其影响差别小于4%,基本上不变化。这对测定带来方便。本法测定的灵敏度与经典的黄嗓吟氧化酶法基本相同。
二、不同的邻苯三酚浓度对自氧化速率
的影响:图3和图4都表明:不同的邻苯三酚浓度对自氧化速率有影响。在一定的范围内,线性速率随邻苯三酚浓度的增加而增加,见图3,这是本法的优点之一。这样,我们就可在较大范围内选用邻苯三酚的浓度,以便更显著地观察邻苯三酚被SOD抑制的情况。根据图4的关系表明在温度和pH不变情况下,可以灵敏地检测贮存的邻苯三酚溶液的自氧化程度,以便决定要否新鲜配制。
SOD活性测定法按上述表1操作,加入邻苯三酚前,先加入一定量SOD,并减少同体积双蒸水,其它操作均与上述2.2.1相同,所测吸光度为
方法2:
一、试剂及其配制:
1.pH8.2,100mM三羟甲基氨基甲烷一二甲胂酸钠缓冲液(内含2mM二乙基三氮基五乙酸)。以加200mM三羟甲基氨甲烷-二甲胂酸钠50ml(内含4mM二乙基三氮基五乙酸)加200mN盐酸22.38ml,然后用双蒸水稀释至100ml。2.10mN盐酸3.6mM邻苯三酚,用10mN盐酸配制,4℃保存。4.实验用水均应用玻璃双蒸水
二、仪器:
721型分光光度计(上海第三分析仪器厂)
操作方法
2.2方法
2.2.1邻苯三酚自氧化速率的测定
在试管中按表1加入缓冲液和双蒸水,于25℃恒温20min后加入25℃预热过的邻苯三酚(对照管用10mmol/L盐酸代替),迅速摇匀,立即倾入比色杯中,在波长325nm处每30s测定一次吸光值A0
2.2.2 SOD活力的测定
2材料与方法(1)
2.1试剂和主要仪器
一.试剂
0.1mol/L Tris-HCl缓冲液(pH8.2,内含2mmol/L EDTA):0.2mol/L Tris(内含4mmol/L EDTA)100ml与0.2mol/L HCl44.76ml混合,加双蒸水至200ml,调pH8.2±0.01;邻苯三酚(45mmol/L):以10mmol/LHCl配制成6mmol/L溶液,存放于冰箱备用;所用试剂均为国产分析纯;实验用水为自制双蒸水;
2.SOD或粗醉抽提液的活性浏定:
测定时按表2加样,测定步骤与测邻苯三酚的自氧化速率同。
酶活力单位定义:在1ml反应液中,每分钟抑制邻苯三酚自氧化速率达50%时的酶量定为一个活力单位,即420nm0.030D/分为一个活力单位。若自氧化速率在36~65%,通常可按比例计算,不在此范围内的数值应增减样液量。
及所含的EDTA量等因性条件下,邻苯三酚迅速氧化释放出超氧化物阴离子,生成有色中间产物,吸光度随之增加,使吸光度值与反应时间呈良好的线性关系. SOD加入邻苯三酚自氧化反应体系后,催化超氧化物阴离子生成过氧化氢,使有色中间产物的生成受阻,导致吸光值下降,邻苯三酚自氧化速率降低,可作为测定SOD活性的理论依据.
邻苯三酚自氧化法测定超氧化物歧化酶活性的研究
摘要:目前超氧化物歧化酶(SOD)活性测定结果混乱,为提高测定结果的可比性,对邻苯三酚自氧化法测定SOD活
性的方法进行了研究,就该活力测定体系中缓冲溶液的介质组成、浓度、pH及所含的EDTA量等因素对测定结果的影
响进行了探讨,根据实验结果,提出了新的改良方法.
邻苯三酚在碱性条件下能迅速自氧化,而在酸性环境中却相当稳定。为了尽可能使缓冲液的pH维持恒定,要求加样量尽可能少些,因为PH变化对自氧化速率有较大的影响,见图2
实验表明:不同pH对滞后时间和线性维持时间影响不大,而对线性速率影响很大。实验还表明,降低pH要比升高pH对速率影响更大。测定时,要求将反应液pH严格控制在8.2,误差不得超过士0.01。
邻苯三酚自氧化的机理极为复杂,从实验来看,邻苯三酚在碱性条件下,能迅速自氧
化,释放出O易一,生成带色的中间产物。反应开始后溶液先变成黄棕色,几分钟后遂转绿,几小时后又转变成黄色,这是因为生成的中间物不断氧化的结果。我们测定的是邻苯三酚自氧化过程中的初始阶段,在这阶段,中间物的积累在滞后30~45秒后,就与时间成线性关系,一般线性时间维持在4,~411511。中间产物在4幼nm时有强烈的光吸收,在有超氧物岐化酶存在时由于它能催化O玉一与H十结合生成O:和HZO:,从而阻止了中间产物的积累,因此通过计算就可求出SOD的活性。邻苯三酚自氧化结果见图1.
二、仪器:
721型分光光度计(上海第三分析仪器厂)
操作方法
1.邻苯三酚自氧化速率的测定:在试管中按表l加入缓冲液和双蒸水,25℃保温劝分钟,然后加入25℃预温的邻苯三酚(对照管用10mMHCI代替),迅速摇匀,倒入比色杯中,在4加nm的分光光度计中,每隔半分钟测一次OD值,要求自氧化速率控制在0.060OD/分。
