Western blot试剂配制及操作步骤
Western blot 试剂与操作步骤

[主要试剂]1、SDS-PAGE 试剂:2、匀浆缓冲液:1.0M Tris-HCl(pH 6.8)1.Oml;10%SDS 6.0ml;β-巯基乙醇0.2ml;ddH2O2.8ml。
3、转膜缓冲液:甘氨酸2.9g;Tris 5.8g;SDS 0.37g;甲醇200ml;加ddH2O 定容至1000ml。
4、0.01M PBS(pH7.4):NaCl 8.0g;KCl 0.2g;Na2HPO4 1.44g;KH2PO4 0.24g;加ddH2O 至1000ml。
5、膜染色液:考马斯亮兰0.2g;甲醇80ml;乙酸2ml;ddH2O118 ml。
包被液(5%脱脂奶粉,现配):脱脂奶粉1.0g 溶于20ml 的0.01M PBS 中。
6、显色液:DAB 6.0mg;0.01M PBS 10.0ml;硫酸镍胺0.1ml;H202 1.0μl。
7、兔抗猪R 蛋白抗体、HRP 标记羊抗兔IgG(二抗)。
[操作步骤]1、蛋白质样品获得:细菌诱导表达后,可通过电泳上样缓冲液直接裂解细胞,真核细胞加匀浆缓冲液,机械或超声波室温匀浆0.5-1min。
然后4℃,13,000g 离心15min。
取上清液作为样品。
2、电泳:制备电泳凝胶,进行SDS-PAGE。
3、转移(半干式转移):(1)电泳结束后将胶条割至合适大小,用转膜缓冲液平衡,5min×3 次。
(2)膜处理:预先裁好与胶条同样大小的滤纸和NC 膜,浸入转膜缓冲液中10min。
(3)转膜:转膜装置从下至上依次按阳极碳板、24 层滤纸、NC 膜、凝胶、24 层滤纸、阴极碳板的顺序放好,滤纸、凝胶、NC 膜精确对齐,每一步去除气泡,上压500g 重物,将碳板上多余的液体吸干。
接通电源,恒流1mA/cm2,转移1.5hr。
转移结束后,断开电源将膜取出,割取待测膜条做免疫印迹。
将有蛋白标准的条带染色,放入膜染色液中50s 后,在50%甲醇中多次脱色,至背景清晰,然后用双蒸水洗,风干夹于两层滤纸中保存,留与显色结果作对比。
Westernblot实验操作步骤

Western blot实验步骤一、制备蛋白样品(单层贴壁细胞总蛋白提取)1.倒掉细胞培养液,加3ml预冷的PBS洗涤细胞,重复两次,弃掉PBS后将细胞培养瓶置于冰上。
2.裂解液RIPA(强)1ml +PMSF10ul(100:1),两者混匀后加入培养瓶中裂解细胞,冰上裂解30min,为使细胞充分裂解,培养瓶要经常来回摇动。
3.裂解完后,用细胞刮将细胞刮于一侧(动作要快),转移至ep管中.4.4度,12000rpm,离心5min.离心后取上清至新的ep管中,用于后续实验(-80保存)常用蛋白收样:倒掉细胞培养基后,预冷PBS洗涤细胞2次,弃去,再加入1ml PBS,用细胞刮轻轻刮取细胞,转移至1.5ml ep管中,12000rpm,离心5min,尽量吸净上清,沉淀于-80保存,用于后续实验。
融化蛋白样品,加入RIPA+PMSF细胞裂解液(200ul/ep管),充分混匀,冰上裂解20min,4度离心,5min ,12000rpm,小心吸取上清至新的ep管中。
二、蛋白浓度测定(BCA法)BCA(碧云天)蛋白浓度测定试剂盒灵敏度高,检测浓度下限达到25ug/ml,最小检测蛋白量达到0.5ug,待测样品体积为1-20ul。
在50-2000ug/ml浓度范围内有较好的线性关系。
标准蛋白BSA浓度:5mg/ml (-20保存) ,完全溶解蛋白标准品,取10ul稀释至100ul,使终浓度为0.5mg/ml(ug/ul)。
蛋白样品在什么溶液中,标准品也宜用什么溶液稀释。
但为了简便起见,也可以用0.9%NaCl或PBS稀释标准品。
1. 配置BCA工作液A液: B液= 50 : 1 ,混匀 A液+B液=200ul (每个样本)样本数量: 7个标准品 + N 个待测蛋白样本2. 先将每孔加入200ul BCA工作液,再加入蛋白样本。
(96孔板),总体积为10ul.待测蛋白样本先10倍稀释。
3.37度,温箱中孵育30min。
WesternBlot相关试剂配方及详细实验步骤

WesternBlot相关试剂配方及详细实验步骤Western Blot详细实验步骤及试剂配方1. 溶液配置1.1 5×SDS-PAGE上样缓冲液(Loading buffer)药品用量1 M Tris-HCl (PH=6.8) 1.25 mLSDS 0.5 gBPB(溴酚蓝,有毒)25 mg甘油 2.5 mL去离子水up to 5 mL分装至1.5 mL离心管中,每管500 μL,室温保存,使用前每管加入25 μL的β-巯基乙醇。
1.2 10×SDS-PAGE电泳缓冲液(Running buffer 母液)药品用量Tris 30.3 gGlycine (甘氨酸) 144.2 gSDS 10 gddH2O up to 1 L室温保存即可,使用时稀释为1×的工作液,可回收反复使用4~5次。
1.3 Tris-HCl缓冲液(1)1.5 M Tris-HCl (PH=8.8)→制分离胶Tris (MW: 121.14) 45.43 gH2O up to 250 mL浓盐酸调PH 8.8(2)1.0 M Tris-HCl (PH=6.8)→制浓缩胶Tris (MW: 121.14) 30.29 gH2O up to 250 mL浓盐酸调PH 6.8二者高压灭菌后,置于室温保存即可。
1.4 10% SDS (十二烷基硫酸钠)SDS 10 gddH2O up to 100 mL室温保存即可。
1.5 10% AP (过硫酸铵)→1.5 mL 离心管配制过硫酸铵(刺激性,腐蚀性) 0.1 g超纯水up to 1 mL混匀后,锡箔纸包住,避光处理,置于-20℃保存。
1.6 30% 丙烯酰胺溶液丙烯酰胺 150 g甲叉双丙烯酰胺 4 gMilli-Q水 30 mL滤纸过滤,Milli-Q水定容至500 mL,装入棕色瓶子中,4℃保存。
1.7 10×转膜缓冲液(Trans buffer 母液)Tris (MW: 121.14) 30.3 gGlycine (甘氨酸) 144 g去离子水 up to 1 L室温保存即可,其1×的工作液配制为:100 mL母液+200 mL甲醇(有毒)+700 mL水。
Westernblot试剂配制及操作流程

Westernblot试剂配制及操作流程试剂配制:1.电泳缓冲液:a. 准备1×蛋氨酸-甘氨酸缓冲液(Tris-Glycine缓冲液):每一升缓冲液中加入30.3g Tris base、288g glycine,并调节pH至8.3±0.1b. 准备3×SDS-凝胶缓冲液:每一升缓冲液中加入30g Tris base、144g glycine、10g SDS,并调节pH至8.3±0.12.蛋白提取缓冲液:a. 准备RIPA缓冲液:每一升缓冲液中加入5g Tris base、15g NaCl、5g sodium deoxycholate、1g NP-40,并将pH调节至7.4b.按需添加蛋白酶抑制剂和磷酸酶抑制剂。
操作流程:1.样品制备:a. 收集细胞或组织样品,加入适量的蛋白提取缓冲液,并使用超声波细胞破碎仪或玻璃Dounce破碎器破碎细胞,释放蛋白。
b.在4℃下离心细胞提取物,收集上清液,并在离心后尽快使用或存储在-80℃的冰箱中。
2.SDS-凝胶制备:a. 准备15%缩胆凝胶:加入7.5mL 30%丙烯酰胺、10mL 10×SDS-凝胶缓冲液、7.5mL去离子水和20uL 10%Tetramethylethylenediamine (TEMED),混合均匀。
b.将混合液倒入立方形凝胶模具中,插入两根不锈钢导电丝作为电极,并进一步注入10%胶解剂。
c.待凝胶定形后,用1×蛋氨酸-甘氨酸缓冲液冲洗凝胶表面。
3.蛋白电泳:a.加载样品:将样品加入离心管中,加入1×电泳缓冲液以使样品浓度均匀。
b. 加载样品:将样品加入凝胶孔中,通常每孔加入20-30ug样品。
c.进行电泳:将装有凝胶的电泳槽放入电泳缓冲液中,将蛋白电泳至凝胶顶部。
d.转移凝胶:根据需求选择湿式或半湿式转印方式,将蛋白转移到PVDF或NC膜上。
4.免疫印迹:a.封闭膜:将转印膜放入封闭溶液中(如5%脱脂奶粉或3%BSA)封闭非特异性结合位点。
Westernblot试剂配制及实验步骤

Westernblot试剂配制及实验步骤Western印迹法这种技术是把电泳分离的组分从凝胶转移到一种固相支持体,并以针对特定氨基酸序列的特异性试剂作为探针检测之。
Western使用的探针是抗体,它与附着于固相支持体的靶蛋白所呈现的抗原表位发生特异性反应。
这种技术的作用是对非放射性标记蛋白组成的复杂混合物中的某些特异蛋白进行鉴别和鉴定。
仪器:高压锅、玻璃匀浆器、高速离心机、分光光度仪、—20℃低温冰箱、垂直板电泳转移装置、恒温水浴摇床、多用脱色摇床。
试剂:单去污剂裂解液、0.01mol/L PBS (pH7.3)、10%分离胶、4%浓缩校、G250考马斯亮蓝溶液、0.15mol/L NaCl 溶液、2X(5X)SDS上样缓冲液、电泳缓冲液、转移缓冲液、10X丽春红染液、封闭液、TBST、TBS、洗脱抗体缓冲液、显影液、定影液、抗体、化学发光试剂。
杂品与耗材:各种规格的吸头、离心管和加样器;各种规格的烧杯、量筒和平皿等玻璃器材;硝酸纤维素膜,乳胶手套,保鲜膜,搪瓷盘(>20×20cm),X-光片夹,X-光片,玻棒长短各一根,计时器,吸水纸,试剂配制:(一)母液1.0mol/L Tris·HClTris (MW121.14) 30.29g蒸馏水 200ml溶解后,用浓盐酸调pH至所需点(见下所示),最后用蒸馏水定容至250ml,高温灭菌后室温下保存。
PH HCl7.4 约17ml7.5 约16m7.6 约15ml8.0约10ml1.74mg/ml (10mmol/L)PMSFPMSF 0.174g异丙醇 100ml溶解后,分装于1.5ml离心管中,-20℃保存。
0.2mol/L NaH2PO4NaH2PO4(MW119.98) 12g蒸馏水至 500ml溶解后,高压灭菌,室温保存。
0.2mol/LNa2HPO4Na2HPO4·12H2O(MW 358.14) 71.6g蒸馏水至 1000ml溶解后,高压灭菌,室温保存。
Westernblot实验操作详细步骤

Westernblot实验操作详细步骤1.样本制备:a.收集细胞或组织样本并加入提取缓冲液,破碎细胞或组织以释放蛋白质。
b.用超声波破碎机或搅拌器处理样本,使其彻底破碎。
c.避免加入蛋白酶抑制剂和磷酸酶抑制剂以防止蛋白质的降解。
2.蛋白质分离:a.将样本加入离心管中,并用高速离心分离细胞碎片和细胞核。
b.收集上清液,其中包含溶解的蛋白质。
3.蛋白质浓度测定:a. 使用BCA或Bradford等方法测定提取的蛋白质浓度。
b.根据需要调整蛋白质浓度,以确保每个样本使用相同的蛋白质量。
4.准备SDS-凝胶:a.准备解聚凝胶和浓缩凝胶以进行垂直电泳。
b.根据需要选择合适的胶百分比和凝胶组装器。
c.制备足够的凝胶和凝胶缓冲液。
5.蛋白质电泳:a.将蛋白质样本加入加载缓冲液,并在煮沸过程中使其变性。
b.将蛋白质样本加载至凝胶槽中。
c.根据需要在凝胶中加入预定分子量标记物,以便于蛋白质分子量的确定。
d.以恒定电流进行电泳,直到预定分子量标记物到达所需位置。
6.蛋白质转膜:a.选择合适的膜材料(例如聚偏氟乙烯或硝酸纤维素)。
b.用蛋白质转膜装置将凝胶上的蛋白质转移到膜上。
c.确保膜与凝胶完全贴合,并尽量避免气泡的产生。
7.阻塞和抗体孵育:a.将膜放入含有5%非脂奶粉或1%牛血清蛋白的TBST缓冲液中进行阻塞。
b.在蛋白质靶向抗体中稀释贮存液,并使用适当的稀释倍数进行孵育。
c.将膜和抗体一起放入摇床或孵育箱中,在适当的温度下进行孵育。
8.洗涤:a.用TBST缓冲液洗涤膜以去除未结合的抗体。
b.进行3至5次洗涤,每次洗涤持续5到10分钟。
9.二次抗体孵育:a.将膜放入稀释过的二抗溶液中进行孵育。
b.孵育时间和温度根据抗体种类和需求进行调整。
10.再洗涤:a.用TBST缓冲液进行大约3至5次洗涤。
b.确保彻底洗涤以去除未结合的二抗。
11.信号检测:a.使用化学发光或荧光探针对膜上的蛋白质进行检测。
b.按照探针供应商的说明进行操作。
western blot操作规程-相关试剂配制
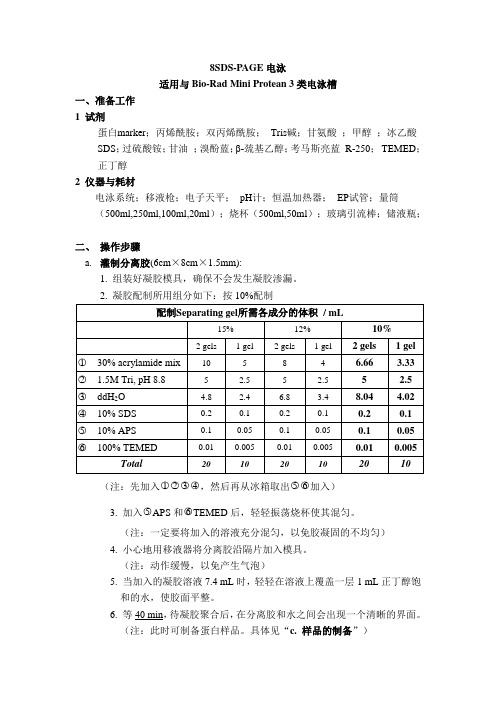
8SDS-PAGE电泳适用与Bio-Rad Mini Protean 3类电泳槽一、准备工作1 试剂蛋白marker;丙烯酰胺;双丙烯酰胺;Tris碱;甘氨酸;甲醇;冰乙酸SDS;过硫酸铵;甘油;溴酚蓝;β-巯基乙醇;考马斯亮蓝R-250;TEMED;正丁醇2仪器与耗材电泳系统;移液枪;电子天平;pH计;恒温加热器;EP试管;量筒(500ml,250ml,100ml,20ml);烧杯(500ml,50ml);玻璃引流棒;储液瓶;二、操作步骤a.灌制分离胶(6cm×8cm×1.5mm):1. 组装好凝胶模具,确保不会发生凝胶渗漏。
2. 凝胶配制所用组分如下:按10%配制(注:先加入○1○2○3○4,然后再从冰箱取出○5○6加入)3. 加入○5APS和○6TEMED后,轻轻振荡烧杯使其混匀。
(注:一定要将加入的溶液充分混匀,以免胶凝固的不均匀)4. 小心地用移液器将分离胶沿隔片加入模具。
(注:动作缓慢,以免产生气泡)5. 当加入的凝胶溶液7.4 mL时,轻轻在溶液上覆盖一层1 mL正丁醇饱和的水,使胶面平整。
6. 等40 min,待凝胶聚合后,在分离胶和水之间会出现一个清晰的界面。
(注:此时可制备蛋白样品。
具体见“c. 样品的制备”)b. 灌制浓缩胶1.浓缩胶配制所需组分如下:按3.9%配制2.倒出并用滤纸吸干覆盖在分离胶表面的水层。
(注:先加入○1○2○3○4,然后倒出水,最后再从冰箱取出○5○6加入)3.加入○5APS和○6TEMED后,轻轻振荡烧杯使其混匀。
4.小心地用移液器将浓缩胶沿隔片加入模具,直至凝胶到达模具的顶部。
5.斜着插上梳子。
(注:动作缓慢,尽量不要产生气泡)6.放置30 min左右,待凝胶聚合后,小心拔出梳子。
(注:拔出梳子时,要垂直拨出,以免损坏制好的泳道)7.将凝胶放入电泳槽中,在槽中加入1×电泳缓冲液。
(注:1,缓冲液所加入的量,○1玻璃内液面高于玻璃外液面,○2玻璃内的,液面高于短玻璃低于长玻璃。
western blot 操作流程

Western blot protocol第一部分:样品制备(一)、所需试剂:1. Western及IP细胞裂解液(KGP701):Western及IP细胞裂解液分装后存于-20℃冰箱中,避免反复冻融;2. PMSF(100mM):sigma;3. PBS(二)、所需耗材:离心管、细胞刮、各种规格的枪头(三)、所需仪器:各种量程的移液器、4℃高速离心机(四)、操作步骤:1.在每mL 冷Western及IP细胞裂解液加入10μL 100mM PMSF,混匀。
冰上保存数分钟待用;2. 倒掉已处理好的细胞的培养液,预冷的PBS冲洗两次,每次振摇数次以尽量去除培养液,将培养瓶置于冰上;3. 加入上述适量配制好的Western及IP细胞裂解液(107个细胞加入Western及IP细胞裂解液1 mL~2 mL),用枪吹打数下,使裂解液和细胞充分接触;4. 裂解完毕后,迅速用细胞刮将细胞刮于培养瓶一侧(动作须块),然后用枪将细胞碎片和裂解液转移至1.5ml EP管中(操作在冰上进行),10000转/分,4℃离心5 min(离心机需要预冷);5. 取上清转移至新的预冷的离心管中,蛋白定量(BCA法);第二部分:测定蛋白浓度(一)、所需试剂:凯基BCA蛋白含量检测试剂盒(KGPBCA),分装后存于-20℃冰箱中,避免反复冻融。
(二)、所需耗材:Ep管、96孔板、离心管、细胞刮、各种规格的枪头(三)、所需仪器:各种量程的移液器、振荡器、37℃烤箱、酶标仪(四)、操作步骤:1. 根据样品数量,按50体积BCA试剂A加1体积BCA试剂B(50:1)配制适量BCA工作液,充分混匀;2. 取一块96孔板,按照下表加入试剂:3. 把96孔板放在振荡器上振荡30sec,37℃放置30min,然后在562nm下比色测定。
以蛋白含量(μg)为横坐标,吸光值为纵坐标,绘出标准曲线;4. 稀释待测样品至合适浓度,使样品稀释液总体积为20μL,以标准曲线0号管做参比,在562nm波长下比色,记录吸光值;5. 根据标准曲线计算样品实际浓度(单位:μg/μl),将所有样品浓度用裂解液调至4μg/μl;6. 分装保存于-80℃,避免反复冻融。
Western Blotting操作步骤及说明

Western Blot操作方法及步骤1).蛋白质提取Extraction buffer组成:蔗糖0.7 MTris/HCl0.5 MEDTA 50 mMKCl0.1 M配制成母液pH 9.4巯基乙醇2%蛋白酶抑制剂25×取100-200 mg植物叶片,用液氮速冻后用研磨仪打碎(若量比较大可用液氮研磨,分装到多管中),加入500 µl 提取缓冲液,涡旋;完全混匀后加入500 µl 苯酚(分层,取下层酚层), 涡旋;在3000 g 的转速下离心10 min, 4 °C拿两只新的EP管,各取200 µl 离心后的上清液;向两只EP管中各加入1 ml 0.1M NH4Ac(用甲醇溶解配制);在-20°C下沉淀放置至少2 h过夜放置;在13000 rpm转速下离心5 min,4 °C;用0.1 M NH4Ac(用甲醇溶解配制)洗涤,用枪头将蛋白吹散,洗净杂质;在13000 rpm转速下离心5 min,4 °C;取上清后空甩EP管,去除多余的溶液;室温干燥蛋白, 用1% SDS(100ul左右)溶解蛋白。
2). 测定总蛋白浓度。
用BCA蛋白检测试剂盒测定提取物中的蛋白质含量(1)蛋白浓度测定1、考马斯亮蓝G250通过与蛋白质内的氨基和羧基基团间的静电结合作用以及范德华力,考马斯亮蓝与蛋白质形成强但非共价键连接的复合物。
蛋白-染料复合物的形成稳定染料携带的负电荷阴离子,从而产生在膜上或者胶上肉眼可见的蓝色①测定总蛋白浓度步骤:按照BCA试剂盒说明书进行操作1.配制标准曲线的标准样品--胎牛血清蛋白(BSA)浓度BSA原液浓度:5mg/ml②待测样品稀释用Nanophotometer(纳米光度计)初步测一下待测样品的浓度,计算好稀释的体积,使得终浓度在标准曲线区间内。
③加样准备测定标准样品和待测样品各准确吸取20μl溶液于酶标孔中,加入BCA工作液200μl。
western blot 超详细步骤

一、蛋白质的样品制备:一、溶液:裂解液及蛋白酶抑制剂(每毫升裂解液加20ulcocktail)二、操作步骤:1、6孔板置于冰上,细胞经预冷的PBS漂洗3次,每孔加入100μl裂解液,5min 后用细胞刮刀刮取细胞,用枪头转移至1.5mlEP管中,编号置于冰上。
2、以上所得的样品用超声细胞破碎仪超声处理,超声时间为3S,间歇时间为10S,重复三次。
3、于4℃离心机(预冷)12000r离心15min,取上清,收集于0.5mlEP管中。
二、蛋白浓度的测定(BCA法测定蛋白浓度)1.取标准蛋白(2mg/ml)备用。
2.于标准蛋白稀释为2mg/ml 1mg/ml 0.5 mg/ml 0.25 mg/ml 0.125mg/ml 0mg/ml,96孔板中每孔加入10ul,设3个复孔,待测蛋白稀释8倍,每孔加入10ul,设3个复孔,每孔加入BCA工作液(A液:B液=50:1混匀)90ul,37℃温浴30min,酶标仪测出各吸光度值,EXCEL输入数据,绘制标准曲线。
测出待测蛋白浓度。
测完蛋白含量后,计算含30、50μl蛋白的溶液体积即为上样量。
按上样量取出样品至0.5ml的EP管中,加入5×SDS 上样缓冲液至终浓度为1×。
后蛋白于95℃煮5min(干湿温箱预热)。
样品于-80℃保存。
三、电泳1.制胶分离胶:电泳凝胶浓度试剂 10%H2O(ml) 4.030%丙烯酰胺 3.31.5mol/lTris.cl(PH8.8) (ml)2.510%SDS(ml) 0.110%AP(ml) 0.1TEMED(μl) 5总体积(ml) 10浓缩胶试剂浓度(5%)H2O(ml) 230%丙烯酰胺(T: 30%,C: 3%(ml) 0.51.0mol/lTris.cl(PH8.8) (ml) 0.510%SDS(μl) 4010%AP(μl) 30TEMED(μl) 4总体积(ml) 31、玻璃板对齐后放入夹中卡紧。
western blot实验实验步骤

western blot实验实验步骤
Western blot实验步骤如下:
收集蛋白样品:使用细胞裂解液,对贴壁细胞、悬浮细胞或组织样品进行裂解。
然后测定每个蛋白样品的蛋白浓度。
SDS-PAGE凝胶配制:参考一些文献资料进行配制。
样品处理:在收集的蛋白样品中加入适量浓缩的SDS-PAGE蛋白上样缓冲液。
例如2X或5X的SDS-PAGE蛋白上样缓冲液。
使用5X的SDS-PAGE蛋白上样缓冲液可以减小上样体积,在相同体积的上样孔内可以上样更多的蛋白样品。
5X的SDS-PAGE蛋白上样缓冲液可以参考相关文献资料配制,100℃或沸水浴加热3-5分钟,以充分变性蛋白。
上样与电泳:将处理后的蛋白样品冷却到室温后,直接上样到SDS-PAGE胶加样孔内即可。
Western_blot_试剂配制及操作流程

Western-Blot操作流程试剂配制蛋白提取试剂1. RIPA裂解液:50mM Tris(MW121.14,PH7.5) 3.02g150mM NaCl 4.38g1%TritonX-100 5ml1%脱氧胆酸钠5g0.1%SDS 0.5g蒸馏水至500ml。
调pH值至7.5。
混匀后4℃保存,长期保存于-20℃。
使用时,加入蛋白酶抑制剂cooktail。
2. 蛋白酶抑制剂cooktail所需母液成分:(1)100mmol/L PMSFPMSF 17.4mg异丙醇1ml溶解后,分装于1.5ml离心管中,-20℃保存。
(2)10mM 亮肽素leupeptin: -20℃保存(3)2.1mg/ml 抑肽素Aprotinin: 4℃保存配制:成分终浓度每ml裂解液所加母液量PMSF 1mmol/L(储存浓度稀释100倍)10ulLeupeptin 0.1mmol/L(储存浓度稀释100倍)10ulAprotinin 1ug/ml (储存浓度稀释2000倍)0.5ul各成分直接加入所用的RIPA裂解液中,之后按照60ul/孔(12孔板)提取蛋白。
蛋白定量试剂1. G250考马斯亮蓝溶液(蛋白定量专用)考马斯亮蓝G250 100mg95%乙醇50ml85%磷酸100ml蒸馏水至1000ml配制时,先用乙醇溶解考马斯亮蓝染料,再加入磷酸和水,混匀后,用滤纸过滤,4℃保存于棕色瓶中。
2.牛血清白蛋白BSA储存液(1mg/ml):100mg BSA粉末溶于20 ml双蒸水,定容至100 ml,加少量防腐剂,4℃保存。
上样用试剂1.4X上样缓冲液1.0 mol/L Tris·HCl(pH6.8)2mlSDS 0.8g溴酚蓝0.04g甘油4ml去离子水定容至10ml。
混匀后,分装于1.5ml离心管中,4℃保存。
使用时稀释成1X。
2.1.0 mol/L二硫苏糖醇(DTT)(10X)用20 ml 0.01 mol/L乙酸钠溶液(pH5.2)溶解3.09g DTT,分装成1ml小份储存于-20?C。
Western 步骤

Western blot规范化操作步骤1、主要试剂配制2、操作步骤(1)细胞总蛋白提取1)收集细胞,冰预冷PBS洗两遍2)加入适量细胞裂解液(50-100uL),涡旋混匀冰上放置5min3)超声破碎细胞(程序化)4)超声后,在4℃,12000rpm离心10min。
收集上清,即为总蛋白裂解物(2)检测蛋白浓度1)使用BCA法检测蛋白浓度2)调整样品浓度一致3)加入蛋白4×loading buffer,煮沸20min,冷却后-20℃保存(3)SDS-PAGE电泳根据目的蛋白分子量大小选择合适浓度的分离胶(根据图1确定分离胶浓度),5%的浓缩胶,蛋白上样量一般为25-40ug(根据目的蛋白表达水平调整上样量)。
电泳以恒压进行,浓缩胶电压80V(约30min),待蛋白进入分离胶后,改变电压至120V。
待溴酚蓝行进至分离胶下缘时停止电泳(1-1.5h)。
(4)湿式转膜1)电泳结束前准备合适大小的PVDF膜(甲醇浸泡2-3min,活化正电基团,肉眼观察膜表面无白色点状或块状区域存在后,置于电转缓冲液至少15min待用)或硝酸纤维素膜(NC膜,浸泡于蒸馏水10min,平衡离子强度)。
准备适合大小的滤纸浸泡于电转缓冲液备用。
电泳结束后,小心撬开玻璃板,用切胶器将上层浓缩胶剥去,将凝胶转移至电转缓冲液中。
2)在电转缓冲液中按照以下顺序制作三明治:海绵-滤纸-PVDF膜-凝胶-滤纸-海绵(厚海绵,压缩滤纸上下各一块或薄滤纸上下各3层,电转板白色部分在下方),对齐,用玻璃棒赶走气泡。
3)将电转板放入电转槽中(黑色对着黑色面),浸泡在电转缓冲液中,冰浴中以200mA恒流电转2h(分子量较大的可以延长转移时间)。
电转结束后,将PVDF 膜(或NC膜)放在丽春红染液中染色3-5min,观察蛋白转移情况后,根据蛋白大小在合适位置剪膜(在一抗孵育前,勿把膜完全分离),然后用TBST缓冲液将染料洗去。
(5)封闭将PVDF膜(或NC膜)置于封闭液中(含5%脱脂奶粉的TBST缓冲液),室温晃动1h(85rpm。
Westernblot试剂配制及操作步骤(最新整理)

Western blot试剂配制1.30%丙稀酰胺储存液丙稀酰胺29gN,N’-亚甲双丙稀酰胺1g双蒸水定容到100ml,经高压蒸汽灭菌的滤纸过滤避光,4℃保存于棕色瓶中2.1.5 M Tris-HCl (MW=121.1)pH 8.8Tris碱90.75g双蒸水400ml用浓HCl调pH至8.8,加双蒸水定容至500ml。
4℃冰箱保存3.1.0 M Tris pH6.8Tris碱12g双蒸水60ml用浓HCl调pH至6.8,加双蒸水定容至100ml。
4℃冰箱保存4.10%SDS(w/v)SDS 10g溶于加水至100ml,室温放置5.10%过硫酸胺(10%APS)过硫酸胺1g溶于10ml双蒸水中。
可在密闭的管子里4℃保存一周6.10×Tris-甘氨酸电泳缓冲液Tris 30.3g甘氨酸144gSDS 10g定容至1000ml室温放置。
临用时稀释成1×电泳缓冲液7.1%溴酚蓝(w/v)溴酚蓝Tris-base MilliQ 水100 mg60 mg定容至10 ml8.TEMED原液,4℃冰箱保存9.2×sample buffer(2×样品缓冲液)1.0 M Tris pH6.82.5mlSDS 0.8gDTT 0.3085g甘油3ml溴酚蓝0.004g加双蒸水至10ml,分装—20℃保存10. 4×SDS加样缓冲液10ml1M Tris-HCl(ph:6.8) 2.5mlSDS 0.8g溴酚蓝0.004g甘油4mlTakara5x buffer 总5ml1M Tris-HCl(ph:6.8) 1.25mlSDS 0.5g溴酚蓝BPB 25mg甘油 2.5ml500ul每管分装,使用前将25ul的2-ME加到没管中11.转膜缓冲液Tris 碱 5.8g甘氨酸 2.9gSDS 0.37g甲醇200ml加双蒸水至1000ml,临用前配制,4℃冷却12.1×TBSTTris 碱 3.0285 g氯化钠8.766gTween-20 500ul加双蒸水至1000ml,现配现用。
WesternBlot配方和方法

Western Blot 配方和方法Western Blot配液:1.10% SDS 溶液(m/v):SDS 0.1gDDH O 1ml2加热溶解,室温保存,用后马上拧紧瓶盖。
2.10% 过硫酸铵:APS 0.1gDDH O 1ml2由于过硫胺酸会缓慢分解,最好颖配制,或隔周配制〔也可每 200 微升 EP 分装,4℃保存 4W,-20℃保存 1 月〕3.1× 电泳缓冲液Tris base 3.028gGlycine 14.4gSDS 1.0g用蒸馏水溶解至 1000ml,调整PH 8.3。
冰箱内可保存数月。
4.10 ×转膜液〔储存液〕甘氨酸72.07gTris base 15.14gDDH O 400ml2加水至 500ml,储存液不加甲醇,4℃保存。
1 × 转膜液 1L 配制:10 × 转膜液储存液 100ml,150ml 甲醇,加 DDH O2 750ml,PH 8.5,定容至总量 1L5.1×转膜液〔现配现用〕:Tris base 3.03gGlycine 14.42g甲醇150ml加水定容至 1000ml6.10 × TBS:Tris base 12.1gNaCl 40g加水,用浓盐酸调整 PH 至 7.6 后定容至500ml 7.TBST:1 × TBS/吐温 = 1000/18.封闭液:脱脂奶粉2gTBST 40ml温度适当调整〕〔pH6.8〕配胶:先配分别胶,再配积层胶。
一般两者同时配制,只是最终分别胶先加TEMED 混合后马上灌胶,而积层胶放4℃,等分别胶凝固后再加TEMED 混匀后灌胶。
TEMED 量加大,一般加至原来的2-3倍,依据试验当时的2ml 3ml 5ml 5ml 10% 5ml 5% 5% 8% 10% 两 15% 积 积 分 分 块 分 层 胶 层 胶 离 胶 离 胶胶 离胶超纯水1.42.1 2.3 1.9 2.8 1.1530%Acr/Bic0.3 0.4 1.3 1.7 2.5 2.539551.5mol/L1.3 1.3 0.9 1.3Tris · HCl5 〔pH8.8〕1mol/L 0.2 0.3Tris · HCl 5 75〔为了加快凝胶,可以将过硫酸胺和10%SDS 0.0 0.0 0.0 0.0 0.0 0.0235575 5 10%APS〔过硫胺0.0 0.0 0.0 0.0 0.0 0.0 酸〕235575 5TEMED 0.0 0.0 0.0 0.0 0.0 0.002 03 03 02 03 02 双丙烯酰胺:丙烯酰胺摩尔比1:29 配制时,SDS- 有效分别范围凝胶浓度〔%〕线性分离范围〔KD)15 12-4310 16-687.5 36-945.0 57-212按所需分别的蛋白质分子大小选择适宜的丙烯酰胺百分比浓度,一般地,5%的凝胶可用于 60~200kDa 的 SDS变性蛋白质分子的分别,10%用于 16~70kDa,15%用于12~45kDa。
Western blot实验流程

Western blot一.仪器及器皿:棕色广口瓶5个(50ml),灭菌,烧杯3个灭菌,EP管,枪及枪头,分光光度计,超声破碎机,冷冻离心机,灭菌0.9%生理盐水,冰,灭菌水(1000ml),两套灭菌器械。
二.药品配制:1.TBS×10(Tris Buffered Saline):2.42 g Tris base8g NaCl100ml H2O, 用HCl调pH 7.6,4°C保存.(配TBST用)TBST=TBS+0.05%Tween 2.TBS:0.303 g Tris base0.4383g NaCl (150mM)0.05gSDS用HCl调pH至8.0(配裂解液用),50ml约用2.1mlHCl。
3.0.5M Tris-HCl(pH6.8),50ml,:3gTris-base加灭菌水约30ml,用6N盐酸缓缓调pH至6.8(约用1ml),定容至50ml,4℃保存。
(若调小了,用5.6%NaHCO3调回) 。
1.5M Tris-HCl(pH8.8),50ml,9.08gTris-base加灭菌水约40ml,用6N盐酸缓缓调pH至8.8(约用2ml),定容至50ml,4℃保存。
4.5×Running buffer pH8.3,500ml:Tris-base 7.5g,Glycine(甘氨酸) 36g,SDS 2.5g加灭菌水至500ml, 4℃保存,用时若有沉淀析出可提前拿出置37℃,不用调pH值,用时按1:5稀释,即60ml的5×Running buffer加入240ml水。
5.30%acrylamide(丙稀酰胺贮液):8.76g acrylamide, 0.24g N, N'-methylene-bisacrylamide(亚甲基双丙烯酰胺),加少许灭菌H2O搅匀,最后定容至30 ml 。
用0.45 µm的过滤器过滤后4°C避光保存6.10%SDS:5gSDS+50 ml H2O,(难溶,需较长时间),常温保存。
Westernblot试剂与步骤

1.Westernblot试剂储存液2 M Tris-HCl (pH 8.8)将141.2g Tris溶于300ml去离子水,待溶解充分后用浓盐酸调pH值至pH 为8.8(25℃),加入去离子水至500ml,混匀,用0.22μm滤器过滤除菌,室温保存。
1 M Tris-HCl (pH 6.8)将70.6g Tris溶于300ml去离子水,待溶解充分后用浓盐酸调pH值至pH 为6.8(25℃),加入去离子水至500ml,混匀,用0.22μm滤器过滤除菌,室温保存。
10XPBS将80g NaCl、14.4g Na2HPO4、2g KCl、2.4g KH2PO4溶于800ml去离子水中,待充分溶解后加去离子水至1L,混匀,高压蒸汽灭菌,室温保存。
20% TritonX-100将20ml TritonX-100溶于60ml去离子水中,40℃加热溶解,待充分溶解后加去离子水至100ml,混匀,室温保存。
10% SDS将10g SDS溶于60ml去离子水中,40℃加热溶解,待溶解充分后加去离子水至100ml,混匀,室温保存。
10X电泳液将144g甘氨酸、30g Tris、10g SDS溶于600ml去离子水中,待溶解充分后加去离子水至1L,混匀,室温保存。
10X转膜液将90g甘氨酸、19.3g Tris溶于600ml去离子水中,待溶解充分后加去离子水至1L,混匀,室温保存。
工作液30%丙烯酰胺溶液(A液)将29.2g 丙烯酰胺、0.8g双丙烯酰胺溶于40ml去离子水中,待充分溶解后加去离子水至100ml,混匀,用滤纸过滤,保存于4℃。
4×分离胶缓冲液(B液)2 M Tris-HCl(pH 8.8)75 ml,10%SDS 4 ml,加入去离子水至100ml4 ×堆积胶缓冲液(C液)1 M Tris-HCl(pH 6.8)50 ml,10%SDS 4 ml,加入去离子水至100ml10% APS将1g过硫酸铵溶于8ml去离子水中,加入去离子水至10ml,分装至1.5ml离心管,于-20℃保存。
(完整word版)Westernblot试剂配制及操作步骤

Western blot试剂配制1.30%丙稀酰胺储存液丙稀酰胺29gN,N’-亚甲双丙稀酰胺1g双蒸水定容到100ml,经高压蒸汽灭菌的滤纸过滤避光,4℃保存于棕色瓶中2.1.5 M Tris-HCl (MW=121.1) pH 8.8Tris碱90.75g双蒸水400ml用浓HCl调pH至8.8,加双蒸水定容至500ml。
4℃冰箱保存3.1.0 M Tris pH6.8Tris碱12g双蒸水60ml用浓HCl调pH至6.8,加双蒸水定容至100ml。
4℃冰箱保存4.10%SDS(w/v)SDS 10g溶于加水至100ml,室温放置5.10%过硫酸胺(10%APS)过硫酸胺1g溶于10ml双蒸水中。
可在密闭的管子里4℃保存一周6.10×Tris-甘氨酸电泳缓冲液Tris 30.3g甘氨酸144gSDS 10g定容至1000ml室温放置。
临用时稀释成1×电泳缓冲液7.1%溴酚蓝(w/v)8.TEMED原液,4℃冰箱保存9.2×sample buffer(2×样品缓冲液)1.0 M Tris pH6.82.5mlSDS 0.8gDTT 0.3085g甘油3ml溴酚蓝0.004g加双蒸水至10ml,分装—20℃保存10. 4×SDS加样缓冲液10ml1M Tris-HCl(ph:6.8) 2.5mlSDS 0.8g溴酚蓝0.004g甘油4mlTakara5x buffer 总5ml1M Tris-HCl(ph:6.8) 1.25mlSDS 0.5g溴酚蓝BPB 25mg甘油 2.5ml500ul每管分装,使用前将25ul的2-ME加到没管中11.转膜缓冲液Tris 碱 5.8g甘氨酸 2.9gSDS 0.37g甲醇200ml加双蒸水至1000ml,临用前配制,4℃冷却12.1×TBSTTris 碱 3.0285 g氯化钠8.766gTween-20 500ul加双蒸水至1000ml,现配现用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Western blot试剂配制1.30%丙稀酰胺储存液丙稀酰胺29gN,N’-亚甲双丙稀酰胺1g双蒸水定容到100ml,经高压蒸汽灭菌的滤纸过滤避光,4℃保存于棕色瓶中2.1.5 M Tris-HCl (MW=121.1) pH 8.8Tris碱90.75g双蒸水400ml用浓HCl调pH至8.8,加双蒸水定容至500ml。
4℃冰箱保存3.1.0 M Tris pH6.8Tris碱12g双蒸水60ml用浓HCl调pH至6.8,加双蒸水定容至100ml。
4℃冰箱保存4.10%SDS(w/v)SDS 10g溶于加水至100ml,室温放置5.10%过硫酸胺(10%APS)过硫酸胺1g溶于10ml双蒸水中。
可在密闭的管子里4℃保存一周6.10×Tris-甘氨酸电泳缓冲液Tris 30.3g甘氨酸144gSDS 10g定容至1000ml室温放置。
临用时稀释成1×电泳缓冲液7.1%溴酚蓝(w/v)8.TEMED原液,4℃冰箱保存9.2×sample buffer(2×样品缓冲液)1.0 M Tris pH6.82.5mlSDS 0.8gDTT 0.3085g甘油3ml溴酚蓝0.004g加双蒸水至10ml,分装—20℃保存10. 4×SDS加样缓冲液10ml1M Tris-HCl(ph:6.8) 2.5mlSDS 0.8g溴酚蓝0.004g甘油4mlTakara5x buffer 总5ml1M Tris-HCl(ph:6.8) 1.25mlSDS 0.5g溴酚蓝BPB 25mg甘油 2.5ml500ul每管分装,使用前将25ul的2-ME加到没管中11.转膜缓冲液Tris 碱 5.8g甘氨酸 2.9gSDS 0.37g甲醇200ml加双蒸水至1000ml,临用前配制,4℃冷却12.1×TBSTTris 碱 3.0285 g氯化钠8.766gTween-20 500ul加双蒸水至1000ml,现配现用。
(4℃最多保存一周)13.n%封闭液(一般5%)脱脂奶粉n克溶于100ml 1×TBST,4℃冰箱保存附表1 配制Tris-甘氨酸SDS-PAGE聚丙烯酰胺凝胶电泳分离胶所用溶液溶液成分不同体积(ml)凝胶液中各成分所需体积(ml)5 10 15 20 25 30 40 506%水 2.6 5.3 7.9 10.6 13.2 15.9 21.2 26.5 30%丙烯酰胺溶液 1 2 3 4 5 6 8 101.5 mol/L Tris (pH8.8) 1.32.53.8 5 6.3 7.5 10 12.510% SDS 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 10%过硫酸氨0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 TEMED 0.004 0.008 0.012 0.016 0.02 0.024 0.032 0.04 8%水 2.3 4.6 6.9 9.3 11.5 13.9 18.5 23.2 30%丙烯酰胺溶液 1.3 2.7 4 5.3 6.7 8 10.7 13.31.5 mol/L Tris (pH8.8) 1.32.53.8 5 6.3 7.5 10 12.510% SDS 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 10%过硫酸氨0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 TEMED 0.003 0.006 0.009 0.012 0.015 0.018 0.024 0.03 10%水 1.9 4 5.9 7.9 9.9 11.9 15.9 19.8 30%丙烯酰胺溶液 1.7 3.3 5 6.7 8.3 10 13.3 16.71.5 mol/L Tris (pH8.8) 1.32.53.8 5 6.3 7.5 10 12.510% SDS 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 10%过硫酸氨0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 TEMED 0.002 0.004 0.006 0.008 0.01 0.012 0.016 0.02 12%水 1.6 3.3 4.9 6.6 8.2 9.9 13.2 16.5 30%丙烯酰胺溶液 2 4 6 8 10 12 16 201.5 mol/L Tris (pH8.8) 1.32.53.8 5 6.3 7.5 10 12.510% SDS 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 10%过硫酸氨0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 TEMED 0.002 0.004 0.006 0.008 0.01 0.012 0.016 0.02 15%水 1.1 2.3 3.4 4.6 5.7 6.9 9.2 11.5 30%丙烯酰胺溶液 2.5 5 7.5 10 12.5 15 20 251.5 mol/L Tris (pH8.8) 1.32.53.8 5 6.3 7.5 10 12.510% SDS 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 10%过硫酸氨0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 TEMED 0.002 0.004 0.006 0.008 0.01 0.012 0.016 0.02附表2 配制Tris-甘氨酸SDS-PAGE聚丙烯酰胺凝胶电泳5%积层胶(浓缩胶)所用溶液溶液成分不同体积(ml)凝胶液中各成分所需体积(ml)1 2 3 4 5 6 8 105%水0.68 1.4 2.1 2.7 3.4 4.1 5.5 6.8 30%丙烯酰胺溶液0.17 0.33 0.5 0.67 0.83 1 1.3 1.71.5 mol/L Tris (pH8.8) 0.13 0.25 0.38 0.5 0.63 0.75 0 1.2510% SDS 0.01 0.02 0.03 0.04 0.05 0.06 0.08 0.110%过硫酸氨0.01 0.02 0.03 0.04 0.05 0.06 0.08 0.1 TEMED 0.001 0.002 0.003 0.004 0.005 0.006 0.008 0.01实验步骤:一、电泳1.制胶:按附表1和附表2配制电泳凝胶,下层为分离胶,上层为浓缩胶;配置分离胶:1)一旦加入TEMED,马上开始聚合,故应快速旋动混合物并进入下一步操作。
2)迅速在两玻璃板的间隙中灌注正丁醇或者双蒸水溶液,留出灌浓缩胶所需的空间。
(梳齿长+1cm)3)在凝胶上加满0.1%SDS(也可以用dd水),将凝胶垂直放于室温下。
覆盖水层可防止因氧气扩散进入凝胶而抑制聚合反应。
4)分离胶聚合后(约30min),倾出覆盖层液体,用去离子水洗涤凝胶顶部数次以除去未聚合的丙稀酰胺。
尽可能地排去凝胶上的液体,再用纸巾的边缘吸净残留液体。
配置浓缩胶1)一旦加入TEMED,为防止马上开始聚合,故应快速旋动混合物。
2)在已经聚合的分离胶上快速直接灌注浓缩胶,直到加满后3)立即在浓缩胶中插入干净的梳子,小心避免混入气泡(如果梳子间有气泡,需要从新插梳子)。
4)约30min后凝胶凝聚,小心拔出梳子。
把凝胶固定于电泳装置上,准备电泳缓冲液约500ml,将电泳缓冲液加满电泳槽的中间,保持内外不通且使外面的电泳缓冲液没过电泳槽下面的金属导线。
2.样品处理及加样(1)等质量样品加入等体积2×或4×样品缓冲液,99℃煮5min;(注意:煮样品时不要盖锅盖,以免样品溢出或者盖子鼓开)(2)2000转离心样品10-30秒;样品冷却后,按照预定顺序,根据梳子厚度加样。
(1.5mm的梳子上样40ul左右, 1mm的梳子加样15ul左右)(3)将样品加入浓缩胶的梳孔中,留一合适的梳孔中加入蛋白Marker;3.电泳装置正负极正确连接后开始电泳,起始电压100V,待样品在浓缩胶部分浓缩成一条线后,加大电压至120V,待溴酚兰达到底部边缘,即可停止电泳。
二、转膜1.膜的准备。
甲醇浸泡PVDF膜10~15min,转膜缓冲液平衡15~30min。
戴手套,剪一块合适大小的PVDF膜在甲醇中浸泡1分钟。
(注意:当进行接触滤纸、凝胶和膜的操作时,一定要带手套,否则,手上的油脂会阻断转移)。
将500ml转膜缓冲液倒入较大的托盘中,把两块海绵、两块与膜等大的滤纸、已经浸泡好的PVDF膜放入托盘中,充分的浸泡。
2.胶的准备。
将玻璃板撬开,撬的时候动作要轻,要在两个边上轻轻的反复撬。
(禁止一个位置用力,防止玻璃破碎)撬一会儿玻璃板便开始松动,直到撬去玻板,去除浓缩胶,根据目的蛋白的位置,切胶。
胶和PVDF膜、滤纸一样大(注意:撬玻璃板和切胶时一定要小心,胶很易裂,要用巧劲,最好将撬板蘸水浸湿后再敲胶,可以避免由于胶黏在撬板上而破损)3.装入转膜仪器。
将转膜夹子打开,使黑的一面保持水平。
在上面垫一张纤维垫,用玻棒来回擀几遍以擀走里面的气泡。
(一手擀另一手要压住垫子使其不能随便移动)。
然后,在垫子上垫一层滤纸。
小心剥下切好的分离胶盖于滤纸上,调整位置,使其与滤纸对齐,轻轻用玻棒擀去气泡。
接着,将膜盖于胶上,要盖满整个胶(膜盖下后尽量不再移动)并除气泡。
在膜上盖一层滤纸并除去气泡。
最后盖上另一个海绵垫,擀几下就可合起夹子。
(按照:夹子黑面—纤维垫—1张滤纸-凝胶-膜-1张滤纸-纤维垫—夹子白面的顺序排列。
整个操作在转移液中进行,要不断的擀去气泡)。
4.转膜仪器入电泳槽进行转膜将夹子放入转移槽中,使夹的黑面对槽的黑面,夹的白面对槽的红面。
电转移时会产热,在槽的一边放一块冰来降温,并且使转移槽在冰浴中进行转膜。
加入转膜缓冲液至刚能没过夹子,100V,100min,(蛋白质在转移缓冲液中从负极向正极转移,也就是从夹子的黑面向白面。
对于大分子量的蛋白,转膜时电压要高一点,时间也要延长一点。
特别是务必注意加强降温措施。
)三、封闭:转膜结束后用封闭液室温摇床封闭1-2小时;四、免疫1.一抗孵育:用n%封闭液适当比例稀释一抗(根据说明书,一般先从1:1000开始摸索浓度,然后根据实验结果调节到合适的浓度),室温孵育半小时后,4℃冰箱孵育过夜;次日从4℃冰箱拿出室温再孵育半小时;2.1×TBST洗膜:10min×3次;3.二抗孵育:用n%封闭液适当比例稀释二抗(根据具体抗体摸索),室温孵育1小时;4.1×TBST洗膜:15min×4次;五、显影1.按膜的大小取适量ECL(等量A液和B液混合),将膜从TBST中取出,用滤纸吸干TBST,将膜蛋白面朝下置于ECL上1 min,然后将膜正面朝上用保鲜膜包裹起来;2.在暗房中,将感光胶片放在膜上,置于X射线摄影暗盒中1~30min,曝光时间取决于样品;3.将感光胶片放在显影液中10sec~1min ,在清水中漂洗后浸入定影液中,至胶片透明。
