技术四:MACS(磁珠分选)人细胞分选与分析试剂
磁珠分选细胞原理

磁珠分选细胞原理
磁珠分选细胞是一种基于磁珠与细胞表面标记物相互作用的技术,用于对混合细胞群进行分离和纯化。
其原理主要包括细胞表面标记物选择、磁珠标记和磁力分选三个步骤。
在细胞表面标记物选择步骤中,研究人员会根据所需的细胞类型特异性表面标记物,选取相应的抗体、抗原或配体等标记物。
这些标记物能够特异性地与目标细胞的表面蛋白、糖基或其他分子结合。
磁珠标记步骤是将磁性珠子表面修饰上与选择的细胞表面标记物相对应的配体。
一般来说,这些配体可以是与标记物相互作用的抗体、配体或其他分子。
磁珠表面的配体与目标细胞的表面标记物结合后,形成磁珠-细胞复合物。
磁力分选是将磁珠-细胞复合物与外部磁场相互作用,利用磁
力将目标细胞从混合细胞群中分离出来。
外部磁场可以通过磁力分选仪或其他磁场控制装置来产生。
在磁力作用下,磁珠-
细胞复合物会被聚集在一定位置,而非标记的细胞则被排除在外。
通过改变磁场的强度、方向和时间等参数,可以实现对目标细胞的精确控制和分离。
总之,磁珠分选细胞利用磁珠与细胞表面标记物的相互作用,通过磁力分选实现对目标细胞的分离和纯化。
这一技术在生物医学研究、临床诊断和细胞治疗等领域具有广泛的应用前景。
美天旎公司磁珠分选产品

美天旎公司磁珠分选产品标准化管理处编码[BBX968T-XBB8968-NNJ668-MM9N]美天旎公司MACS(磁珠分选)相关产品一、MACS微珠(MicroBeads)MACS微珠是一种与高度特异性单克隆抗体相偶联的超顺磁化微粒,用于目的细胞或者去除细胞的磁性标记。
微珠直径约有50nm,比细胞小200多倍,体积为细胞的百万分之一,光学显微镜下不可见。
微珠由多聚糖和氧化铁组成,无毒性,对细胞无损伤,可以生物降解。
MACS微珠与流式细胞仪兼容,不会影响细胞的光散射特性;磁性标记只占用2 0-30%的结合位点,不影响细胞的荧光抗体标记。
此外,MACS微珠可以最大限度地避免细胞活化;无需解离磁珠,可以直接进行后续实验:如流式细胞仪分析或分选、细胞培养、分子生物学研究、回输给人或者动物。
MACS微珠主要有三种:直标微珠、间标微珠、多选微珠。
其中间标微珠有抗免疫球蛋白微珠、抗生物素微珠或链霉亲和素微珠、抗荧光素微珠。
多选微珠是专门为分选细胞亚群而研制的一种微珠。
这种微珠通过特殊的方式与抗体偶联,在第一次阳性分选完成后,与细胞结合的多选微珠可以被解离试剂剪切下来,阳性分选的细胞可以进行再次阳性分选或者去除分选。
MACS技术分选的CD8阳性T细胞(箭头所示为磁性结合在细胞表面的微珠)二、MACS分选柱(Separation Column)MACS分选柱是一类填充有不同规格铁珠的塑料容器,铁珠表面有亲水包被,因此不会损伤细胞。
在磁场外MACS分选柱不带有磁性,但是当置于一个永久性磁场—MACS分选器中时,分选柱内的铁珠可以使分选器的磁场增强1000倍,足以滞留仅标记有极少量微珠的目的细胞;磁性标记细胞从分选柱中通过时可以受到均匀的磁力作用,从而提高分选纯度和回收率。
手动操作在30分钟内可完成,自动分选仅需分钟,得到的细胞可立即用于后续实验。
此外,大多数MACS分选柱都是无菌包装,一次性使用,可以满足细胞培养所需的无菌条件。
干货流式细胞分选的那些事儿

干货流式细胞分选的那些事儿作者:解螺旋.罗小黑转载请注明来源:解螺旋,医生科研助手将感兴趣的目的细胞分离纯化出来,一直是细胞生物学中的一个重要研究手段。
无论是体外刺激研究细胞因子的表达谱,还是细胞共培养检测细胞功能,均对细胞的纯度具有很高的要求。
目前分离纯化细胞的手段主要有两种:MACS(magnetic-activated cell sorting),原理就是用结合了磁珠的抗体去标记细胞,让目的细胞带上磁珠,通过磁场将结合了磁珠与没结合磁珠的细胞分离开来。
MACS是细胞分选的重要手段,设备简单,只需要一块磁铁,不需要专门的大型仪器,得到的细胞活性好,适合大多数的实验室。
缺点就是能分选的细胞类型有限。
FACS(fluorescence-activated cell sorting),也就是我们今天要了解的流式分选。
这部分原理与流式分析一致。
利用荧光素标记不同的分子,通过调节合适的电压、补偿等,通过荧光将目的细胞与非目的细胞区分开来。
MACS和FACS的优缺点:流式分选和流式分析在样本的准备上具有很多相通的地方,都是把样本处理成单细胞,最后上样的时候让细胞处于单个悬液的状态。
绝大部分人不需要进行仪器的操作,更关心的是如何提高细胞得率以及如果提高分选出来的细胞活性等问题。
首先是样本的准备,无论是组织还是血液来源的细胞,均应保证细胞在上样之前处于比较好的状态。
提示:o可以在重悬细胞的时候PBS中加入1%-2%的胎牛血清o大部分流式分选仪的上样器均没有冷却系统,要想分选后获得比较好的细胞活性,应尽量减少细胞在室温的暴露时间o样本较多的时候可以分成小份体积上样,每次1ml或者2ml,剩下的放在冰箱冷藏。
该方法长时间分选的时候能较好地提高分选出来的细胞活性,缺点就是人不能长时间离开,以防止样品跑空,空气进入分选管道。
其次,我们来聊一聊分选的模式,一般的流式分选仪上都有三种模式:纯化(purify)、富集(enrich)、单细胞(single cell)。
技术四:MACS(磁珠分选)人细胞分选与分析试剂
巨核
细胞和
血小板
CD61 MicroBeads
CD61-PE
内皮
细胞
CD105 MicroBeads
表皮
细胞
Human Epithelial Antigen(HEA) MicroBeads
Anti-Cytokeratin(CK3-6H5)-pure/FITC
Anti-Cytokeratin(CK3-3E4)-pure/FITC
CD1a MicroBeads
HLA-DR MicroBeads
Blood Dendritic Cell Enumeration Kit
CD1c(Anti-BDCA-1)-pure/Biotin/FITC/PE/APC
Anti-BDCA-2-pure/Biotin/FITC/PE/APC
Anti-BDCA-3-pure/Biotin/FITC/PE/APC
CD4+CD25+ Regulatory T Cell Isolation Kit
CD6 MicroBeads
CD8 MicroBeads
CD8 Multisort Kit
CD8+ T Cell Isolation Kit II
Whole Blood CD8 MicroBeads
CD25 MicroBeads
技术四:MACS(磁珠分选)人细胞分选与分析试剂
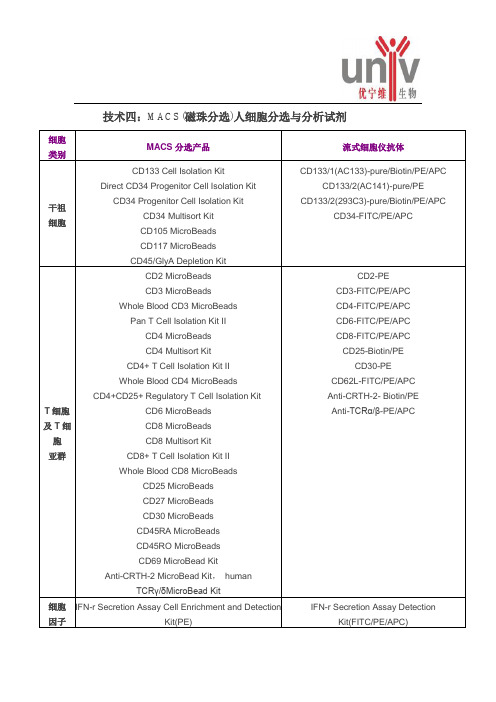
细胞
类别
MACS分选产品
流式细胞仪抗体
干祖
细胞
CD133 Cell Isolation Kit
Direct CD34 Progenitor Cell Isolation Kit
CD34 Progenitor Cell Isolation Kit
德国美天妮磁珠分选

MACS技术 技术
设备与试剂
• MACS分选器
autoMACS分选仪 分选仪
• 9种程序,一机完成所有细胞分选 种程序, 种程序 • 成本低,两个可重复使用的分选 成本低, 周内100次 柱(2周内 次) 周内 • 快速(3-10分钟) 快速( - 分钟 分钟) •重复性好 重复性好 • 全自动分选,仪器操作简单 全自动分选, • 适用范围广:从少量标本(105) 适用范围广:从少量标本( 到大量标本( ),进样量 到大量标本(4X109),进样量 0.5ml-50ml • 8种全血微珠,可以做常见细胞的 种全血微珠, 种全血微珠 全血分选, 全血分选,省去了费时的提取单个 核细胞过程
• 去除分选是磁性标记非目的细胞,并将其从细胞混合物中去 去除分选是磁性标记非目的细胞,
除,即未磁性标记的细胞为目的细胞。 即未磁性标记的细胞为目的细胞。
• 去除分选策略适用范围: 去除分选策略适用范围:
》去除不需要的细胞 缺乏针对目的细胞的特异性抗体(如肿瘤细胞) 》缺乏针对目的细胞的特异性抗体(如肿瘤细胞) 》不需要抗体和目的细胞结合 》需进一步通过阳性选择分选细胞亚群
MD0347.01
MACS® 磁性分选
MACS微珠进行 微珠进行 磁性标记
洗脱阳性分 选的细胞
未标记的细胞 先行流出
MD0651.01
分选前标本制备: 分选前标本制备:过滤
.02
MACS 技术
设备与试剂
» MACS微珠 微珠 » MACS分选柱 MACS分选柱 » MACS 分选器 » 详细分选方案 详细分选方案*
MD0197.02
MACS技术 技术
设备与试剂
• MACS微珠: 微珠: 微珠
MACS 微珠是与高度特异性单克隆抗体相偶联的超顺 磁化微粒,可用于目的细胞的磁性标记。 磁化微粒,可用于目的细胞的磁性标记。
细胞分选 磁珠

细胞分选磁珠细胞分选技术是现代生物医学研究中十分重要的技术之一,它可以完成细胞的分离和纯化,并且可以在不破坏细胞的情况下筛选出所需的细胞。
随着科学技术的不断进步,细胞分选技术也得到了不断发展和完善,其中,磁珠技术是一种有效的细胞分选方法。
磁珠是一种特殊材料,是由一些铁氧化物、氧化锆等材料组成,这些材料具有很强的磁性,故而磁珠可以在磁场的作用下受到磁力的作用,从而实现细胞的分离和纯化。
细胞分选磁珠技术的基本原理,就是先将磁珠与一种特殊的生物分子结合,生物分子可以与目标细胞的表面某些分子结合,然后将这些生物分子修饰的磁珠与混合细胞悬浮液混合,经过磁场处理后,可以通过磁性的作用将目标细胞和非目标细胞分离开来。
对于这种技术,在实际操作中,我们需要准备一些磁珠,然后将这些磁珠与我们所需要的生物分子做结合,这些生物分子一般是抗体,通过生物颗粒表面的抗原/抗体结合而选择性地粘附某些细胞或细胞亚群。
多数成型的细胞粘附到给磁珠涂层表面的生物颗粒上,通过加入一个外部磁场,使得在生物颗粒表面的磁珠运动并吸持被慮选的细胞典型,得到净化细胞。
然后,通过冲洗和剥离,最终得到所需细胞的纯度很高的样品。
细胞分选磁珠所得的细胞较为整齐、免疫原性较好,在实验室的许多实验过程中有着非常重要的应用价值。
其优点是在不破坏细胞外表面的情况下选择性地寻找到不同类别的细胞,同时,纯化的细胞质量也更加优良,这样对于生物医学的研究有着不可替代的作用。
在细胞分选磁珠技术的发展过程中,不断的有各种新的变化和进展。
其中,单克隆抗体磁珠技术是一种十分优秀的技术。
可以使用不同的单克隆抗体去寻找和提取处不同细胞和细胞群。
这种技术可以高度纯化目标细胞的应用效率。
不断的有各种新的分选方法被提出,例如流式细胞术,荧光分选等等。
其中,流式细胞术是一种被广泛应用的分选技术,它将光散射、荧光检测以及磁珠分选技术巧妙地结合起来,使得分选技术更加灵活可控。
细胞分选磁珠技术虽然有很多优势,但是也存在一些缺陷和不足。
MACS技术介绍

高功率,水 冷
需要调整 488nm、 633nm、 407nm 模拟 否 7
数据处理模 式 脱机补偿 最多检测FL
分选速度
300/sec
no
70000/sec
10000/sec
MACS分选与 FACS分选比较 MACS优势1
• 快速 》FACS分选时间: 》MACS® 分选时间: (FACS Aria) (autoMACS™ 分选仪) 每秒钟获取70 000 细胞 平均每秒钟处理107 细胞 108 cells => 2 3 min 108 cells => 5 min 109 cells => 4 h 109 cells => 5 min (没有包括操作人员调节 (无需调节机器) 机器时间) • 操作简单、无需专人操作,可随时使用 • 分选后细胞活性好 • 无菌分选:仪器小巧,可以进操净台,耐受紫外线照射, 消毒方便,耗材为无菌性包装
• 在没有直接标记微珠可选时
• 使用自备抗体或配体的磁性分选中
• 分选或去除用多个抗体混合物标记的多种细胞
• 分选稀有细胞和抗原弱表达的细胞
• 分选标记蛋白质
MACS分选柱
填充有磁性铁珠,有亲水 包被,对细胞柔和。
在分选器中产生高梯度 磁场,滞留带有微珠磁 性标记的细胞
MACS分选柱
• 能进行完全的清洗 • 单独无菌包装,便于 无菌条件使用 • 可用于分选多种细胞 及亚细胞物质、 细菌、病毒、mRNA 和蛋白质
美天旎中国
• 2001年设立中国代表处,目前美天旎中国总部位于上海, 在北京、广州设有办事处。 • 美天旎中国目前有近15名员工,分属销售与产品推广部, 市场与技术服务部,客服与物流部。 • 美天旎中国合作伙伴 总进口商:中仪英斯泰克进出口公司 代理商: 上海强智生物技术有限公司 上海优宁维生物科技有限公司 北京利文商贸有限公司
磁珠分选产品

美天旎公司MACS(磁珠分选)相关产品一、MACS微珠(MicroBeads)MACS微珠是一种与高度特异性单克隆抗体相偶联的超顺磁化微粒,用于目的细胞或者去除细胞的磁性标记。
微珠直径约有50nm,比细胞小200多倍,体积为细胞的百万分之一,光学显微镜下不可见。
微珠由多聚糖和氧化铁组成,无毒性,对细胞无损伤,可以生物降解。
MACS微珠与流式细胞仪兼容,不会影响细胞的光散射特性;磁性标记只占用20-30%的结合位点,不影响细胞的荧光抗体标记。
此外,MACS微珠可以最大限度地避免细胞活化;无需解离磁珠,可以直接进行后续实验:如流式细胞仪分析或分选、细胞培养、分子生物学研究、回输给人或者动物。
MACS微珠主要有三种:直标微珠、间标微珠、多选微珠。
其中间标微珠有抗免疫球蛋白微珠、抗生物素微珠或链霉亲和素微珠、抗荧光素微珠。
多选微珠是专门为分选细胞亚群而研制的一种微珠。
这种微珠通过特殊的方式与抗体偶联,在第一次阳性分选完成后,与细胞结合的多选微珠可以被解离试剂剪切下来,阳性分选的细胞可以进行再次阳性分选或者去除分选。
MACS技术分选的CD8阳性T细胞(箭头所示为磁性结合在细胞表面的微珠)二、MACS分选柱(Separation Column)MACS分选柱是一类填充有不同规格铁珠的塑料容器,铁珠表面有亲水包被,因此不会损伤细胞。
在磁场外MACS分选柱不带有磁性,但是当置于一个永久性磁场—MACS分选器中时,分选柱内的铁珠可以使分选器的磁场增强1000倍,足以滞留仅标记有极少量微珠的目的细胞;磁性标记细胞从分选柱中通过时可以受到均匀的磁力作用,从而提高分选纯度和回收率。
手动操作在30分钟内可完成,自动分选仅需2.5-10分钟,得到的细胞可立即用于后续实验。
此外,大多数MACS分选柱都是无菌包装,一次性使用,可以满足细胞培养所需的无菌条件。
三、MACS分选器(MACS Separators)MACS分选器由永久性磁铁和支架构成。
磁珠分选细胞原理

磁珠分选细胞原理
磁珠分选细胞(Magnetic-beads sorting cells)是一项技术,用于从特定悬液中
分离指定类型的细胞,它结合了生物学分离技术和磁性材料两大技术,可对分离样本进行高通量和准确率的分选。
磁珠分选细胞有三步:首先,将样本悬液振荡均匀,使得西伯利亚磁珠和细胞之间形成相容性;然后,将悬液中的西伯利亚磁珠充满磁场,使得细胞和磁珠之间形成共晶;最后,释放磁场,使得细胞脱离磁珠,而磁珠保持在原位不动,最后通过质量测定仪对细胞和磁珠进行分析。
相比其他细胞分选方法,磁珠分选细胞具有许多优势。
首先,其分选速度极快,在分选过程中每秒钟都能快速分选大量细胞,可以大大缩短分子生物学分离时间;其次,它可以准确的分选目标细胞,而不受到其它外来样品的干扰,有效抑制对分离样本的混杂;最后,磁珠分选细胞仪可以根据磁性粒子的位置来估计分选的准确性和精度,提高分析的可靠性。
综上所述,磁珠分选细胞具有高效率、准确、高可靠性等特点,可以为分子生物学和其他相关生物技术提供更多有用的工具,为基础研究和药物开发等提供新的可能性。
(完整word版)MACS磁珠分选

MACS磁珠分选免疫磁珠法分离细胞原理免疫磁珠法分离细胞是基于细胞表面抗原能与连接有磁珠的特异性单抗相结合,在外加磁场中,通过抗体与磁珠相连的细胞被吸附而滞留在磁场中,无该种表面抗原的细胞由于不能与连接着磁珠的特异性单抗结合而没有磁性,不在磁场中停留,从而使细胞得以分离。
一、磁性细胞标记方式应用MACS技术进行磁性细胞分选最重要的一点是高质量的标记。
要尽可能地增强阳性细胞的标记,并减弱背景染色。
有两种基本的磁性标记方式:直接标记和间接标记。
1、直接磁性细胞标记(Direct magnetic cell labeling)(磁珠结合的细胞就是所要分离获得的细胞)直接标记是最快速、最特异的磁性标记方法。
目前有多种分选人、小鼠、大鼠以及非人类灵长类细胞的MACS直标微珠可供选用。
2、间接磁性细胞标记(Indirect magnetic cell labeling)(磁珠结合不需要的细胞,游离于磁场的细胞为所需细胞)间接磁性细胞标记需要联合使用单克隆或者多克隆抗体和MACS间标微珠。
未结合抗体、生物素化抗体或者荧光素标记抗体均可作为一抗标记细胞,再使用抗免疫球蛋白微珠、抗生物素或链霉亲和素微珠、抗荧光素微珠作为二抗磁性标记细胞。
几乎针对任何种系任何细胞的任何一种单抗或多抗,均可用于间接标记。
间接标记主要在如下情况时选用:当没有直标磁珠时;需要用几种抗体的混合物同时分选或去除多种类型的细胞;间接标记有放大作用,因此可在磁性分选抗原表达弱的目的细胞时使用;使用自备抗体或者配体的磁珠分选中。
(一般而言,阴性分离法的磁珠用量比阳性分离法的大,阳性分离法用行更多。
)二、MACS分选策略有两种基本的分选策略阳性分选和去除分选。
复合分选策略是将两种基本分选策略相结合或者联合使用多选微珠,从而实现细胞亚群的分选。
1、阳性分选策略(Positive selection strategy)阳性分选中,目的细胞被磁性标记后,作为阳性标记组分直接分选出来。
08-MACS磁性分选细胞

MACS磁性分选细胞BDCA-4分离操作规则●分离PBMC1.采集新鲜抗凝血,抗凝剂可用肝素或枸橼酸等;2.用2-4倍体积的PBS(含有2mM EDTA)稀释血液;3.淋巴细胞分离液(密度1.077,20℃)15ml上铺35ml的稀释血;4.20℃,400g离心20-30分钟;5.吸取上层液体到干净管中,此层中含有稀释的自体血清,可用作缓冲液补充剂;6.仔细的把中间层转移到新的离心管中。
7.用含有2mM EDTA的PBS充满离心管,20℃,200g离心10分钟。
仔细倒掉上清;8.重复第7步;9.把细胞重悬于缓冲液中。
(每108细胞用300μl缓冲液,低于108细胞也用300μl缓冲液)注:1.缓冲液=PBS+0.5%BSA+2mM EDTA+自体血清;2.外周血保存不得超过8小时;3.悬于缓冲液中的细胞可过夜保存。
●磁标记PBMC1.将分离好的PBMC用过滤器或尼龙膜去除凝块;2.将细胞重悬于缓冲液中,每108细胞用300μl缓冲液;3.每108细胞加入100μl FcR阻断剂;4.每108细胞加入100μl 抗BDCA-4 微粒;5.充分混合,4-8℃孵育15分钟;(注:温度升高和孵育时间延长都将导致非特异性标记,冰上操作需要增加孵育时间)6.加入10-20倍体积的缓冲液洗涤细胞(每108细胞加入5-10ml), 300g离心10分钟,并完全去除上清;7.把细胞悬于缓冲液中(每108细胞加入500μ l缓冲液);8.根据需要选择合适的MACS柱和MACS分离器。
●通过MACS柱进行磁分离(LS分离柱)1.把分离柱放置在MACS分离器的磁场中;2.用3 ml缓冲液淋洗柱子以便平衡柱子基质;3.柱口处放一个合适的管子。
所需细胞滞留在柱子基质上,收集流下的含有阴性细胞的液体;注:用过滤器或尼龙膜提前去除凝块4.用3 ml缓冲液冲洗柱子3次,并用同一个管子在柱口收集;5.把柱子从分离器拿开,并放置在另外一个合适的管子上。
磁珠分选细胞原理

磁珠分选细胞原理
磁珠分选技术是一种利用磁珠对细胞进行分选的生物学技术,它基于细胞表面
特异性标记物与磁珠上特异性抗体的结合,通过外加磁场来实现对细胞的快速、高效分选。
磁珠分选技术在细胞生物学、免疫学、临床诊断等领域有着广泛的应用,成为细胞分选领域的重要技术手段之一。
磁珠分选细胞的原理主要包括磁珠标记、磁场作用和分选过程三个方面。
首先,磁珠标记是磁珠分选技术的关键步骤之一。
通过将磁珠与特异性抗体结合,使其能够与目标细胞表面的特异性标记物结合。
这些特异性标记物可以是细胞表面的蛋白质、抗原、受体等,通过与这些标记物的结合,磁珠能够实现对目标细胞的选择性识别和结合。
其次,磁场作用是磁珠分选技术实现细胞分选的关键环节。
当磁珠与目标细胞
结合后,外加磁场能够使磁珠与细胞一起受力,从而实现对细胞的快速、高效分选。
在外加磁场的作用下,未结合的细胞会被迅速排除,而与磁珠结合的目标细胞则会被集中分选,从而实现对目标细胞的高效分选。
最后,分选过程是磁珠分选技术的最终实现步骤。
在外加磁场的作用下,磁珠
与目标细胞结合的复合物会被快速、高效地分选出来,从而实现对目标细胞的选择性富集和纯化。
通过这一过程,磁珠分选技术能够实现对细胞的快速、高效分选,为细胞生物学和临床诊断等领域的研究提供了重要的技术支持。
总的来说,磁珠分选技术是一种基于磁珠与细胞特异性标记物的结合,利用外
加磁场实现对细胞的快速、高效分选的生物学技术。
通过磁珠标记、磁场作用和分选过程三个步骤,磁珠分选技术能够实现对细胞的选择性富集和纯化,为细胞生物学、免疫学、临床诊断等领域的研究提供了重要的技术支持,具有广阔的应用前景和发展空间。
《现代医学实验仪器与实验技术》细胞分选技术

细胞的分级分离
• 差速离心法 • 速度区带离心法 • 等密度离心法
1、差速离心法:用于分离大小、形状不同的 组分,根据颗粒沉降速度不同得以分离
核仁 线粒体 微粒体 核糖体
2、速度区带离心法:用于分离大小差别不显 著的组分
3、等密度离心法:
按细胞组分的浮力密度不同进行分离的方法。 适用于大小、形态相似而密度不同的组分。 常将样品通过高浓度的蔗糖或氯化铯的密度梯 度沉降在达到与自身密度相等的位置就停滞不再向 下沉降。
• 磁分离细胞的重要指标
纯度和得率,这取决于磁珠所连接单抗的特异性 和磁珠大小(磁性),然而太大的磁珠会影响细胞 活性,也无法直接上流式。
• 目前市场上有2种磁性细胞分离系统
1、Small particles (≈50 nm) - MACS 2、Large particles (1200~4500 nm) -others(如 Dynal)
4. 用毛细管插到云雾层,吸取单个核细胞。置入另一 离心管中,加入5倍以上体积的Hank‘s液或RPMI1640, 1500rpm,10分钟,洗涤细胞两次。 5. 末次离心后,弃上清,加入含有10%小牛皿清的 RPMI1640,重悬细胞。取一滴细胞悬液与一滴0.2%台 盼兰染液混合,于血球计数板上,计数。
Sort times
需要得到的 细胞数量/个
103 104 105 106 107 108
0.1 1.7min 16.8min
2.8h 1.2天 12天 116.8天
目的细胞占总细胞的百分比/(%)
1.0
5.0
10s
2s
1.7min
20s
16.8min
3.4min
2.8h
34min
提取结肠免疫细胞的方法

提取结肠免疫细胞的方法英文回答:Methods for Extracting Immune Cells from the Colon.The colon, also known as the large intestine, is avital part of the digestive system, responsible for absorbing water and electrolytes from food waste andstoring it until it is excreted. It is also home to a complex ecosystem of immune cells that play a crucial role in maintaining gut health and preventing disease.Extracting immune cells from the colon is essential for studying their function and developing immunotherapies for various diseases. Here are the most commonly used methods for extracting immune cells from the colon:1. Mechanical Disaggregation.This method involves physically breaking down the colontissue into smaller pieces using a mortar and pestle or a tissue homogenizer. The resulting cell suspension can then be filtered to remove debris and purified using cellsurface markers specific to immune cells.2. Enzymatic Digestion.Enzymatic digestion is another common method for extracting immune cells from the colon. Collagenase, a protease that breaks down collagen, is often used to digest the extracellular matrix that holds the colon tissue together. The resulting cell suspension can then befiltered and purified using cell surface markers.3. Magnetic-Activated Cell Sorting (MACS)。
免疫磁珠方法分选细胞

免疫磁珠方法分选细胞2007-12-17内容快照:用免疫磁珠做细胞分选(MACS)是高效简捷的免疫细胞及其它细胞的分离纯化方法。
原理是已包被一抗的磁珠与细胞表面相应分子特异性结合,或者已包被二抗(羊抗小鼠或羊抗大鼠)的磁珠与预先已与细胞表面分子特异结合的一抗结合。
磁珠携带与之结合的细胞吸附于分离柱/试管上,实现阳性细胞分离或阴性细胞的分离。
本节介绍超微磁珠间接标记、用分离柱阳性分选细胞的方法。
Protocal:1.离心收集待分离细胞,用少量PBE孵育液(0.5%BSA、0.08%EDTA PH7.2 PBS,真空抽滤除菌及液体内气体)充分混悬细胞(0.5ml/1×108细胞),加入一抗(10~20μg/ml终浓度),4° C孵育30分钟。
2.用20倍体积PBE洗细胞一次,再加P BE(0.3ml/1×108细胞)充分混悬细胞后,加入相应二抗包被的超微磁珠,混匀后置8~15° C孵育10~15分钟。
3.将分离柱安装入磁场中,加入0.5ml PBE,在重力作用下自然流尽,以预处理分离柱。
4.将孵育完的细胞悬液加到分离柱中,自然流尽。
5.以0.5ml的PBE加到分离柱中,自然流尽,洗柱两次。
6.从磁场中取下分离柱,插在试管口,加1-2ml的PBE,用针芯推尽液体,冲出阳性结合的细胞,用培养基洗一次,待用。
注:1.如果分离细胞用作培养,全过程在超净台中完成。
2.超微磁珠及微小磁场系统适合于少量细胞分离(如106-107),通常已适用于大多数实验研究;此外各公司尚有大磁珠及大磁场供应,可用于更大量细胞的分选;除分离柱外,也有试管及其它设备用于分选;根据我们应用的经验,分离柱由于提供了较大的接触面,在细胞分选上具有较多优点。
磁场也可以自制,用一般的磁铁即可做成简易磁场,可提供足够的磁力。
3.磁珠分离系统分离的细胞纯度可以达到80~99%,得率在60~90%左右,仅次或相当于流式细胞仪(FACS)的分选效率,与FACS 相比,MACS设备简单,耗时极短,故而应用广泛。
单细胞转录组测序的主要步骤

单细胞转录组测序的主要步骤单细胞转录组测序(scRNA-seq)是最近研究领域中新兴的一种技术,可以提供大量有关单细胞中基因表达和可塑性的信息。
本文将深入讨论单细胞转录组测序的主要步骤,以及这些步骤在研究中的应用。
首先,单细胞转录组测序的第一步是样本收集。
这包括各种细胞鉴定、分离和封装的方法,包括:支架钩捕技术(FACS)、微流控技术(μFACS)、静电沉淀(DEP)、磁珠分选技术(MACS)和细胞归类系统(CNS)等。
每种方法都有其特定的优势和局限性,有待改进。
第二步是样本处理。
样本处理包括细胞膜去除、稀释培养和脱水步骤等。
细胞膜去除可以减少假阳性的检测,而稀释培养可以改善样本检测的效率,脱水步骤可以提高检测的灵敏度。
第三步是序列文库构建。
样本构建过程包括cDNA合成、接头编码和PCR扩增等步骤。
序列文库构建过程有助于建立研究工作流程,它可以提高检测效率。
接下来是序列测序。
序列测序可以利用next-generation sequencing(NGS)技术,例如Illumina HiSeq或MiSeq等,对序列文库进行分析。
NGS测序可以批量检测单细胞细胞的基因表达,有助于研究者更深入地探索单细胞的转录组信息。
最后,序列数据分析是单细胞转录组测序的重要步骤,其中包括序列清理、细胞聚类、功能基因发现和基因表达特征鉴定等步骤。
序列清理可以消除假阳性、去除异常序列和编码误差等。
细胞聚类可以将单细胞中基因表达特征的变化归类到不同的细胞类型中,从而探讨细胞的分化轨迹和可塑性。
功能基因发现可以确定细胞功能的变化,从而以客观和系统的方式研究基因调控机制。
最后,基因表达特征鉴定可以让研究者对单细胞转录组测序数据进行深入分析,以获取更多关于基因表达、细胞间差异和细胞间相关性等信息。
总之,单细胞转录组测序是一种革命性的技术,能够提供大量有关单细胞中基因表达和可塑性的数据,有助于更好的理解细胞的复杂性。
本文重点介绍了单细胞转录组测序的主要步骤,以及这些步骤在研究中的应用,以此为基础,加深我们对单细胞转录组测序的认知,以便更有效地应用于研究工作。
一种细胞分选磁珠及合成方法以及其在细胞分选中的应用[发明专利]
![一种细胞分选磁珠及合成方法以及其在细胞分选中的应用[发明专利]](https://img.taocdn.com/s3/m/163b3cea4a7302768f9939b6.png)
专利名称:一种细胞分选磁珠及合成方法以及其在细胞分选中的应用
专利类型:发明专利
发明人:张新祥,崔毅然,高晓明,洪超
申请号:CN201010226278.2
申请日:20100714
公开号:CN101892196A
公开日:
20101124
专利内容由知识产权出版社提供
摘要:本发明提供一种新型细胞分选磁珠,该磁珠为表面上以共价键偶联proteinA,并通过protein A与IgG的Fc段的特异性相互作用,定向偶联IgG型小鼠CD3抗体的50-70nm金包裹FeO磁性纳米颗粒(FeO@Au纳米颗粒)。
本发明涉及该磁珠的合成和修饰方法,以及使用该磁珠进行细胞分选的方法。
本发明磁珠用于除去小鼠脾细胞中的CD3 T细胞,使CD3 T细胞在脾细胞中的含量由36.5%降为0.7%,分选效率极高。
本磁珠还同时具有蛋白偶联量高和超顺磁性的优点,而且制备方法简单,环境友好,成本较低,具有较好的应用前景。
申请人:北京大学
地址:100871 北京市海淀区颐和园路5号
国籍:CN
代理机构:北京万象新悦知识产权代理事务所(普通合伙)
代理人:张肖琪
更多信息请下载全文后查看。
