ch3.8热力学基本方程与麦克斯韦关系式.ppt
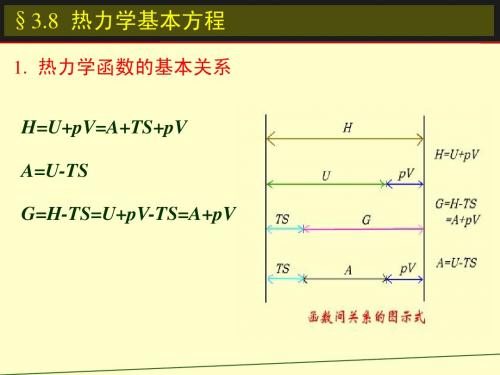
热力学函数的基本关系式

dU = TdS- pdV
(1-108)
dH = TdS + Vdp
(1-109)
dA = -SdT- pdV
(1-110)
dG = -SdT + Vdp
(1-111)
式(1-108),(1-109),(1-110),(1-111)称为热力学基本方程
dU = TdS- pdV dH = TdS + Vdp dA = -SdT- pdV dG = -SdT + Vdp
常用的是式(1-120)及式(1-121),这两等式右边的变化率是可以由 实验直接测定的,而左边则不能。可用等式右边的变化率代替左
4.热力学状态方程
由dU=TdS-pdV
定温下, dUT=TdST-pdVT
等式两边除以dVT 即
dUT T dST p
dVT
dVT
由麦克斯韦方程 于是
U T S p V T V T S p V T T V
式(1-116)及 (1-117)叫吉布斯 - 亥姆霍茨方程。
(1-117)
G-H方程常用的形式为:
即
(G / T )
T p
H T2
加△
(1-116)
Gibbs自由能随压力的变化
因
(эG/эP)T,n=V
(э△G/эP)T,n=△V 此即G---V关系式
只要知道△V--p关系式,在定温下P1的△G1就可求算出P2的△G2。
在定压下从T1到 T2积分得: (△G)2/ T2- (△G)1/ T1=- =∫T1 T2 △H/T2dT 若知△H--T关系以及T1时的△G1就可求算T2时的△G2 而: △H= △H T0+∫ T0 T △CpdT △H T0是T0时的焓变。
第三章 物理化学 热力学第二定律-4

结合基本方程,可得:
U S V
T
,
H S
p
T
,
A T
V
S
,
G T
p
S
,
U V
S
p
H
p
S
V
A V T
p
G
z y
x
dy
多变量函数混合偏导数连续,则与求导次序无关。
即是:
y
z x
y
x
x
z y
x
y
所以由:
U U (S,V )
可得:
T V
S
p S
因
Gm = G’m=0
故
dGm() =dGm( )
13
dGm() = dGm( )
– Sm()dT + Vm()dp = – Sm()dT + Vm()dp
[Sm() – Sm()]dT = [Vm() –Vm()] dp SmdT Vmdp
dT dp
V
G T
T
H T2
p
吉布斯-亥姆霍兹方程
——后边章节讨论温度对化学反应平衡影响的基础 10
3. 麦克斯韦关系式(了解)
若 z 为 x、y 的连续函数,z = f (x, y) ,其全微分为:
dz
麦克斯韦方程组(彩图完美解释版)

麦克斯韦方程组关于热力学的方程,详见“麦克斯韦关系式".麦克斯韦方程组(英语:Maxwell’s equations)是英国物理学家麦克斯韦在19世纪建立的描述电磁场的基本方程组。
它含有四个方程,不仅分别描述了电场和磁场的行为,也描述了它们之间的关系。
麦克斯韦方程组是英国物理学家麦克斯韦在19世纪建立的描述电场与磁场的四个基本方程。
在麦克斯韦方程组中,电场和磁场已经成为一个不可分割的整体.该方程组系统而完整地概括了电磁场的基本规律,并预言了电磁波的存在。
麦克斯韦提出的涡旋电场和位移电流假说的核心思想是:变化的磁场可以激发涡旋电场,变化的电场可以激发涡旋磁场;电场和磁场不是彼此孤立的,它们相互联系、相互激发组成一个统一的电磁场(也是电磁波的形成原理).麦克斯韦进一步将电场和磁场的所有规律综合起来,建立了完整的电磁场理论体系。
这个电磁场理论体系的核心就是麦克斯韦方程组。
麦克斯韦方程组,是英国物理学家詹姆斯·麦克斯韦在19世纪建立的一组描述电场、磁场与电荷密度、电流密度之间关系的偏微分方程。
从麦克斯韦方程组,可以推论出光波是电磁波。
麦克斯韦方程组和洛伦兹力方程是经典电磁学的基础方程。
从这些基础方程的相关理论,发展出现代的电力科技与电子科技。
麦克斯韦1865年提出的最初形式的方程组由20个等式和20个变量组成。
他在1873年尝试用四元数来表达,但未成功。
现在所使用的数学形式是奥利弗·赫维赛德和约西亚·吉布斯于1884年以矢量分析的形式重新表达的.麦克斯韦方程组的地位麦克斯韦方程组在电磁学中的地位,如同牛顿运动定律在力学中的地位一样.以麦克斯韦方程组为核心的电磁理论,是经典物理学最引以自豪的成就之一。
它所揭示出的电磁相互作用的完美统一,为物理学家树立了这样一种信念:物质的各种相互作用在更高层次上应该是统一的。
另外,这个理论被广泛地应用到技术领域.1845年,关于电磁现象的三个最基本的实验定律:库仑定律(1785年),安培—毕奥—萨伐尔定律(1820年),法拉第定律(1831—1845年)已被总结出来,法拉第的“电力线"和“磁力线”概念已发展成“电磁场概念”。
热力学函数的基本关系式

dG = -SdT + Vdp
S p
T
V T
p
麦克斯韦关系式 :表示的是系统在同一状态的两种
变化率数值相等。 9
二阶混合偏导数
T p V S S V 麦氏方程记忆法:
T p
S
V S
p
① 对角乘积永远是pV,TS;
② 等式两边分母与外角标互换;
S p
T
V T
4
由四个热力学基本方程,分别加上相应的条件,可得到
8个派生公式:
dU = TdS- pdV
U S
V
T
U V
S
p
dH = TdS + Vdp
T V H
S p
H p S
dA = -SdT- pdV
A T
V
S
A V
T
p
dG = -SdT + Vdp
G T
P
S
G P
则
U T p p
V T T V
11
练习:由热力学基本方程出发证明,
H p
T
T
V T
p
V
证明:
dH=TdS+Vdp
定温下,等式两边除以dp
H p
T
T
S p
T
V
由麦克斯韦方程
S p
T
V T
p
返回
H p
T
T
V T
p
V
12
U T p p V T T V
S T p
T
T
定容
S CV T V T
S T V
15
T
V
5
2. 吉布斯 - 亥姆霍茨方程
热力学第二定律(4)
dH TdS Vdp
(3) dA SdT pdV (4)
A(T ,V )
G(T , p)
dG SdT Vdp
适用条件:(1)无相变化和化学变化(恒定组成)的均 相封闭系统发生单纯pVT变化的可逆或不可逆过程(2) 对于化学反应和相变化只适用于非体积功为零的可逆过程 即非体积功为零的恒定组成的封闭系统
解:对理想气体,
pV nRT
p nRT /V
p nR ( )V T V
p nR U ( )T T ( )V p T p 0 V T V
所以,理想气体的热力学能只是温度的函数。
§3.8 热力学基本方程
8、偏微分运算规则: z f ( x, y ) 循环关系式:
=
2U U V S SV V S T V S
S一定时对V 微分 U T ; S V
§3.8 热力学基本方程 (1) dU TdS pdV
§3.8 热力学基本方程 3、热力学方程的简单应用
例:试证明理想气体恒温过程ΔA=ΔG
dT 0 dA pdV A
V2 V1
dT 0 dG Vdp G Vdp nRT ln
p1 p2
V1 pdV nRT ln V2
p2 V nRT ln 1 p1 V2
H G / T 2 T T p
积分:
G2
G1
T2 G H d( ) 2 dT T1 T T
T2 H G2 G1 dT 2 T1 T T2 T1
§3.8 热力学基本方程
物理化学(机材类第四版,ppt课件)2.9 热力学基本关系式

4
2、热力学函数的基本关系式
由热力学基本方程
热力学恒等式
dU = TdS- pdV dH = TdS + Vdp
U T ; U p
S V
V S
H T; S p
H p
S
V
dA = -SdT- pdV dG = -SdT + Vdp
再将dU = TdS – pdV 式代入得到 dH = TdS +Vdp
(c) A=U-TS 微分,并用上式代入得到
dA = -SdT- pdV
(d) G = H – T S微分,并用上式代入得到 dG = -SdT + Vdp
3
四个热力学基本方程
dU = TdS- pdV dH = TdS + Vdp dA = -SdT- pdV dG = -SdT + Vdp
G p3 p2 p1
p3>p2>p1
T Tm
T
26
(1)求U随V的变化关系 (2)求H随p的变化关系 (3)求S与Cp的变化关系 (4)求G或Δr G与温度的关系 (5)求G随p的变化关系
27
关于U,H, S, G,A与T、p、V的关系
(一定量、一定组成的单相系统)
➢理想气体 U、H 只是T 的函数,与p、V 无关;S与T、p、V 均有关。
-p -S
G T p
麦克斯韦关系式中不含熵与温度的偏微商。
问题
S T p
S T V
Cp/T CV/T
10
思考题
1、对于只作膨胀功的封闭系统 ()
A T
V
热力学方程

;或根据已知的蒸 气压方程对比1/T项的系数
§3.10 吉布斯-亥姆霍兹方程和麦 克斯韦关系式
• 10.1 吉布斯-亥姆霍兹方程
从热力学基本方程可以导出下面关系式:
( A / T )
T
V
U T2
§3.9 克拉佩龙方程
• 9.2 固-液平衡、固-固平衡积分式
★凝聚相之间的两相平衡的定性讨论
Vm很小
熔化平衡:fusHm很大,dT/dp很小,外压对熔点的影响很小 晶型转变平衡:trsHm较小,因而dT/dp比熔化平衡大
★定量计算的相关近似处理
以熔化平衡为例
dT dp
T Vm Hm
ⅰ凝聚相与蒸气相之间的两相平衡 ⅱ凝聚相的体积忽略不计 ⅲ蒸气看成理想气体 ⅳ积分时将摩尔相变焓看成常数
★微分形式
d ln p vap Hm
dT
RT 2
★定积分形式
计算题型:
ln
p2 p1
vap Hm R
1
T1
1 T2
五个物理量 已知任意四 个求第五个
★不定积分形式
ln p vap Hm 1 C RT
fusVm , fusHm不变 ln T2 T1
V fus m fus H m
( p2
p1 )
ln(1T /T1)T /T1 T
T1
V fus m fus Hm
p
问:滑冰运动员冰鞋下冰的熔点怎样变化?
§3.9 克拉佩龙方程
• 9.3 克劳修斯-克拉佩龙方程
x
z y
x
3.7 热力学基本方程及Maxwell关系式

恒T、p、W= 0: G 0
自发 平衡
dGm α dGm β Sm α dT Vm α dp Sm β dT
Vm β dp
[Sm β Sm α ]dT [Vm β Vm α ]dp
dp Sm β Sm α
βαSm
dT Vm β Vm α
βαVm
又因 βαSm
βαHm T
dp dT
βαH m T βαVm
U
SV
H
A
pT
G
说明: 1. 等式右边只有四个物理量T,S, p,V
2. 十字交叉法:
对U来说,S,V分别表示dS和dV; dS对角线 对应T,dV对角线对应p;箭头方向表示正负,指向 为负,则为TdS和 –pdV
2. U、H、A、G的一阶偏导数关系式
U f (S,V ) H f (S, p) A f (T ,V ) G f (T , p)
p
S V
T
p T
V
V T
p
S p
T
T V
S
p S
V
T p
S
V S
p
S V
T
p T
V
V T
p
S p
T
说明:
1. 关系式中只有四个物理量T, S, p,V
2. 对角线乘积为 TS 与 pV
3. 等式两边的分母与下标互换
4. S和V为广度量,而T和p为强 度量。同种性质的状态函数 的分式,不取负号。
分析:利用克拉佩龙方程 dT T βαVm
dp 解:由克拉佩龙方程有 dT
T
βαH m
lsVm lsH m
dp
积分,得 lnT2
T1
热力学基本方程及Maxwell关系识记图

S
p (" ")
p
注意:只当偏微分中分子、分母同时出现V、T时才取“”号。
5
热力学基本方程及Maxwell关系 识记图
Mnemonic diagram (识记图一)
(-)
p
dU TdS pdV dH TdS Vdp dF SdT pdV dG SdT Vdp
dZ MdX NdY M N Y X X Y e.g
U
("" arrow pointedtoward)
S H p
Example:
V
T
T V S p p S S V p T p T
(" ") S
p T
S V
p (" ") T (" ")
注意:只有T 和V作变量时 才取“”号, p和S作变量时 肯定取“+”号。
(-)
S
T
Z Z ( X , Y ), Z U , H , F , G
U
H
F
G
Potentials(势)
S V p T p T
Mnemonic diagram(识记图三)
S
H p G
U
V F
① 太阳(Sun)照在树梢(Tree) 上,河流从山峰(peak)流向 河谷(Valley); ② U、G和H、F 两对朋友各坐 在1、3象限和2、4象限(方桌 前)打牌。
e.g U 有 S 、 V 两个帮手(特征变量) T dU=( ? )dS + ( ? )dV 箭头向外取“+”号; p T 箭头向内取“”号。 dU=( T )dS + ( p )dV
热力学函数的基本关系式

⑵等温等压相变△G 对于等温等压的可逆相变,直接可得(△G)T,P=0.对于非等温 等压的非可逆相变或同温同压下两个相态的△G,可以通过设计可 逆过程进行计算,也可根据G---P关系公式求算。
1.8 热力学函数的基本关系式
H
U、H、S、A、G 、 p、V、T H =U+pV,A =U-TS,G =H-TS 1. 热力学基本方程
U
pV
TS A pV
TS
G
δWr ′=0时,则δWr=-pdV,于是
一微小可逆过程
dU=δQr+δWr,
dS δ Qr T
δWr ′ =0时,则δWr=-pdV,于是
=8586Jmol-1 故△G= △G1+ △G2 + △G3=8584Jmol-1 依Gibbs自由能减少原理,298K,1atm水不能经等温等压过程转变 为同温 同压的水蒸气,但其逆过程则是可以的。因此在298K, 1atm下液态水是稳定态。
⒊应用Gibbs--helmholtz方程求△G 将 G--H方程:{э(△G/T)/эT}P=- △H/T2
△S=0,△T=0,△H=0,
△G=0
⑵理气在等温等压的Gibbs自由能改变 △G = △H-T △S (△H=0) △S=-R∑nilnXi △G= RT∑nilnXi 其中ni为组分i的量,Xi为理想混合气中
为组分I的摩尔数。
⒌非等温等压两态的△G 若体系的两态温度,压力都不相等,根据G的定义:
麦克斯韦关系式

物态方程的关系。
例一. 理想气体 PV=nRT.
nR U p p0 T pT V V T T V
13
例二. 对于范氏气体
an 2 p V 2 V nb nRT
得:
nRT an p 2 V nb V
dU TdS pdV
S S T dT T dV pdV T V V T S S T dT T p dV T V V T
p S T dT T p dV T V T V
U p V S
T p V S S V
T V p S p S S p V T T V S V T p p T
S V p T p S T T T Cp T V T p p T V T Cp T V p p T
2
20
§2.3 基本热力学函数的确定
2
若等温下的过程A
B
不可逆,则
Q UB U A W SB S A T T
所以
W FB FA
或
FA FB W
3
2. 最大功原理:
系统自由能的减少,是在等温过程中从系统
所能获得的最大功。
FA FB W
3. 若系统只有体积变化功,则在等温等容过程中, 系统的自由能永不增加。可逆过程自由能不变, 不可逆过程自由能减小,当自由能减小到最小值 时,等温等容系统达到平衡态。
热力学基本方程PPT课件

L z x, y
N x
y,z
2w zx
余类推。
复习在热力学中常用到的偏导数关系式:
4.倒数关系式
w x
y,z
1 x w y,z
求导中保持不变的独立变量 y和z没有更改,左边取x, y 和z为独立变量,而右边取w, y和z为独立变量。
证明:
dw
w x
y,z
dx
w y
dx dy
z ,t不变
z y
x,t
0
z x
y ,t
x y
z,t
z y
x,t
复习在热力学中常用到的偏导数关系式: 6.链锁关系式
为了变换偏导数的变量,可以考虑
z z( x, y)
以dx 除式(1)
dz
z x
y
dx
z y
x
dy
(1)
dz dx
z x y
z y
Gibbs-Helmholtz equation)
T
U S
V
H S
p
S
A T V
G T p
V
H p
S
G p
T
p
U V
S
A V
T
(G T ) T p
1 T
G T
p
G
(1 T ) T
p
S T
G T2
TS T2
G
H T2
(A T) T V
T
U S
V
H S
p
H G
V
p
S
p
T
p
U V
S
A V
T
S
A T
热力学基本公式的导出关系概念图(新)知识分享

图1助学体系材料之五运用概念图制作技术,掌握热力学函数关系丽水学院化学化工系 张启伟材料简介:运用概念图制作技术,构建了热力学函数关系概念图,包括了:四个热力学基本公式的导出关系概念图,八个派生公式及四个麦克斯韦(Maxwell)关系式,便于记忆。
一、热力学基本公式的导出关系概念图:从热力学第一定律开始,根据各热力学函数的定义式,依次建立四个热力学基本公式的导出关系概念图(见图)。
热力学基本方程的适用条件:于封闭的热力学平衡系统所进行的一切可逆过程。
说的更详细些,它们不仅适用于一定量的单相纯物质,或组成恒定的多组分系统发生单纯p , V , T 变化的过程。
也可适用于相平衡或化学平衡的系统,由一平衡状态变为另一平衡态的过程。
二、导出派生公式的二种方法根据上面的四个热力学基本公式,每个热力学基本公式可派生出二个派生公式,共8个派生公式。
分别可以按二种方法得到派生公式,见图。
图2图3派生公式汇总表如下:2 d H = T d S + V d p等压(∂H/∂S)p=T等熵(∂H/∂p)S=V3 d A =-S d T-p d V 等容(∂A/∂T)V=-S等温(∂A/∂V)T=-p4 d G=-S d T+ V d p 等压(∂G/∂T)p=-S 等温(∂G/∂p)T=V注:同色偏微分的相同关系。
归纳为四组:T = (∂U/∂S)V = (∂H/∂S)p;p =-(∂U/∂V)S =-(∂A/∂V)TV= (∂H/∂p)S= (∂G/∂p)TS=-(∂A/∂T)V =-(∂G/∂T)p在学习过程中,一是要注意不同偏微分的相互替代关系;二是要注意难测或难得的偏微分可用一个简单的状态函数取代的关系。
三、麦克斯韦(Maxwell)关系式导出关系概念图同样以四个热力学基本公式为基础,每个基本公式可导出一个Maxwell关系式。
导出的数学模式概念图如下(见图):按此求Maxwell 关系通式概念图,可分别写出四个热力学基本公式的Maxwell 关系式。
热力学统计物理 第二章 课件

可得
S S dS dp dT T p p T
S S dH T V dp dT T T p p T 两式比较,即有 H S Cp T T T p p
上式给出两热容之差与物态方程的关系。由此处推导可知, 此式适用于任意简单系统。
对于理想气体,可得
Cp-CV = nR
雅可比行列式
在热力学中往往要进行导数变换的运算。 雅可比行列式是进行导数变换运算的一个有用的工具。
设u、v是独立变数x、y的函数 u = u(x,y), v = v(x,y) 雅可比行列式的定义是
H S T V p T p T 对此式,利用麦氏关系得 H V V T p T p T 此式给出温度不变时焓随压强的变化率与物态方程的关系。
对于定压热容Cp和定容热容CV,由前可得 S S C p CV T T T p T V 但由下述函数关系
例
U = U(S,V), H = H(S,p), F = F(T,V), G = G(T,p)
由自由能的全微分表达式
dF = -SdT – pdV 易知
F F , p T V 若已知F(T,V),求F 对T的偏导数即可得出熵S(T,V);求F S
对V的偏导数即可得出压强p(T,V),这就是物态方程。 根据自由能的定义F=U-TS,有
T、V参量
选取T、V为状态参量,则物态方程为
p = p (T, V ) 当然具体方程形式需由实验测定。 由第2节内容可知,内能全微分为
U U dU d T dV T V V T p CV dT T p dV T V
热力学定律和热力学基本方程

可逆过程的热温商只决定于初终态,与路径无关。
S SII SI def
II dQR IT
dS def dQR T
克劳修斯不等式及不可逆程度 :
B
S (dQ / T环 ) 0
A B
或
T环dS Q 0 A
dS dQ / T环 0 T环dS dQ 0
34
二、熵增原理
孤立系统 d Q 0 dW dW ' 0
16
结论:
(1) I1、I2进行后,环境消耗功得到热,遗留 不可逆变化,此两过程是不可逆过程。
R1进行后,没有遗留不可逆变化,此过程 无方向性。
I3 进行后,系统从单一热源吸热,并完全 转化为功,系统及环境均无遗留不可逆变化。此 违反第二定律,故I3是不可能的过程。
(2) 可逆过程是可能和不可能过程的分界。
( )T ,V ,W '0 和 ( )T , p,W '0 条件下,克劳
修斯不等式化为
A 0 和 G 0
系统和环境对方向和限度的影响,化为系 统性质的变化。
48
例1
一密闭容器中有一盛满水 的玻璃泡。今将玻璃泡击碎, 使水在100℃下恒温蒸发为 101325 Pa的水蒸气。试对过 程的可逆性作出判断?
39
解:
S S2 S1
B
A dQR
T QR
T Qp
T
H T 40.66 103 373.2 J K1 108.9 J K 1
(1)
B
d
Q
A
T环
Q1
T
108.9 J K 1
S
B d Q A
T环 0
∴ 这是一个可逆过程
(2)
B
物理化学第三章3-07基本方程

273.15K
( 37.6 75.3)dT
(例13)
7
S( 263.15K ) S( 273.15K )
263.15K C p
273.15K
263.15 1 22.039 ( 37.6 75.3) ln J K 273.15 20.633J K 1
以上4式称为热力学基本方程, 是封闭系统状态在不作非体 积功且可逆条件下发生微变时各状态函数间的定量关系。
2
2. U,H,A,G的一阶偏导数关系式
由dU TdS pdV
dH = TdS + Vdp dA = SdT pdV dG = SdT + Vdp
U 得 T, S V
T
dT
(例12)
G = H-TS = {-5643- 263.15 (-20.63)}J =-214.2J G < 0, 表明在恒温恒压下过冷水的凝固是能够自发进行的. 例27
8
例3 在25℃及100 kPa 下, 1 mol过冷水蒸汽变为同温同压下 的水,求此过程的G ,问此过程能否自动进行?已知25℃时水 的饱和蒸气压为3167Pa。 100℃ H2O(g) 100 kPa 25℃ H2O(g) 100 kPa G1 25℃ H2O(g) 3167 Pa
4
方法二:由基本方程计算 dG = SdT + VdP 恒温 dG = VdP
2
1
dG VdP
1
2
P2 G nRT ln P1
dA = SdT PdV 恒温 dA = PdV
p2 A nRTln p1
3-7热力学基本关系式
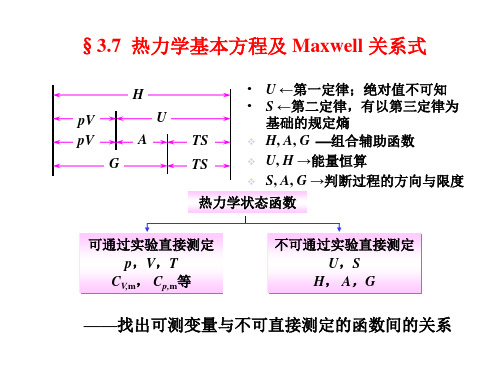
热力学状态函数 可通过实验直接测定 p,V,T , , CV,m, Cp,m等 不可通过实验直接测定 U,S , H, A,G ,
——找出可测变量与不可直接测定的函数间的关系 找出可测变量与不可直接测定的函数间的关系
一、热力学基本方程 1、推导 、 条件: ) 组成恒定的封闭系统; 条件:(1) 组成恒定的封闭系统; (2) W’=0; ) = ; (3) 经历一微小可逆过程。 ) 经历一微小可逆过程。 热力学第一定律: 热力学第一定律: 热力学第二定律: 热力学第二定律: W’=0: = :
S
−p
V
−S
∂G ∂A = = ∂T V ∂T p
2.吉布斯 亥姆霍兹方程 吉布斯-亥姆霍兹方程 吉布斯
1 ∂A A 1 A ∂( A / T ) ( )V − 2 = (− S ) − 2 V= ∂T T ∂T T T T
TS + A U =− =− 2 2 T T
V2 V1
dGT = Vdp
∆ AT = − ∫
V2 p d V = − nRT ln V1
p2 ∆ G T = ∫ V d p = nRT ln p1 p1
p2
b.凝聚相(S,l): 凝聚相( ): ):等温压缩率很小,→体积可认为不变 凝聚相 体积可认为不变
∆ AT = − ∫
V2
V1
p2
pdV → ≈ 0
——Gibbs-Helmholtz方程 方程
——后边讨论温度对化学反应平衡影响的基础 ——后边讨论温度对化学反应平衡影响的基础
三.麦克斯韦关系式 麦克斯韦关系式 有连续的二阶偏微商, 若Z=f(x,y),且Z有连续的二阶偏微商,则必有 = , , 有连续的二阶偏微商
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
直接测量的热力学量表示出来,后面我们要做若干例题。
②要求记住定义式及四个热力学基本方程。其它关系式均可
由热力学基本方程得出,故上述这些关系式不必死记。
五 其它重要关系式
在进行热力学关系式的推导、演变中,还用到如下关系式: ①物质的熵随温度的变化率
S ( T )V
nCV ,m T
( S T
)p
nC p,m T
(
rS
o m
)
p
rC p,m
T
T
②循环关系式 数学上Z= f (x, y),则有
( Z x
)y
(
x y
)
Z
( y Z
)x
1
若x、y、z是热力学上的三个状态函数,比如U= f (T,p),则有
(
U T
)
P
(
T P
)U
(
P U
)T
1
称为循环关系式。
证明: Z= f (x, y) 全微分为
三 对应系数关系式——一阶偏导关系式
既然四个热力学基本方程都是全微分式,那么就有如下的对应
关系:
dU TdS pdV
∵
dU
( U S
)V
dS
( U V
)S
dV
U f (S,V )
则此式对应于
dH TdS Vdp
∵
dH
( H S
)p
dS
( H p
)S
dp
H f (S, p)
则此式对应于
dA SdT pdV
)S
(
G p
)T
联系到化学反应
(
r Gm T
)
p
r
S
m
S
(
A T
)V
(
G T
)
p
其中
V
(
G p
)T
p
( A V
)T
S
( G T
)
p
较重要。
四 麦克斯韦关系式——二阶偏导关系式
上面的讨论我们实际应用了如下的数学方法:
若函数 Z = f (x, y) 全微分
dZ
( Z x
)y
dx
( Z y
)x
dy
T
p
( V
)S
(S )V
由 dH TdS Vdp
(
T p
)
S
( V S
)p
由 dA SdT pdV
S
p
( V
)T
( T
)V
由 dG SdT Vdp
S
V
( p )T
( T
)p
以上四式称为麦克斯韦关系式。
讲两点:
较重要
①以上这些诸多关系式有什么用途呢?
利用这些关系式可将一些不能直接测量的热力学量用一些能
∵ A f (T ,V )
dA
(
A T
)V
dT
(
A V
)T
dV
则此式对应于
dG SdT Vdp ∵
dG
(
G T
)
p
dT
(
G p
)T
dp
G f (T , p) 则此式对应于
显然四个热力学基本方程中的系数与各一阶偏导具有下列对
应关系式:
T
(
U S
)V
(
H S
)
p
p
( U V
)S
(
A V
)T
V
( H p
G U pV TS G A pV
2020/5/5
二 四个热力学基本方程
①组成恒定的封闭体系 热一律(双变量体系)
dU Q W Q W P环dV
②若体系不作非体积功 W 0
③过程可逆
p环 p系 dU Qr pdV
dS Qr
T
Qr TdS
dU TdS pdV
此式为热一二律的结合式,可称为第一个热力学基本方程。
(H、A、G)都是U、S以及 p、T、V 组合而成的状态函数。
人为的引出这些状态函数是为了使用的方便。U和H主要是解 决能量恒算问题; S、A、G主要是解决过程的方向及平衡问题。
通过这五个状态函数的各种关系式来解决大量的实际问题。
一 五个热力学函数之间的关系(定义式)
H U pV
A U TS
G H TS
恒容变温
dS Qr,V
T
nCV ,mdT T
两边除以 (dT )V
(ห้องสมุดไป่ตู้
S T
)V
nCV ,m T
恒压变温 dS Qr, p nCp,mdT
T
T
两边除以 (dT ) p
( S T
)p
nC p,m T
前面我们亦曾有:
(H T
)p
nCp,m
U ( T )V
nCV ,m
对于化学反应的摩尔熵变随温度的变化率 则应有
此式表明了封闭体系发生微小变化时,各状态函数之间的定 量关系。
注意此式的推导条件: ①组成恒定的封闭体系 ②若体系不作非体积功 ③过程可逆 使用这个公式时,则可有这样的考虑:在满足①②两个条件的前
提下,因为状态函数的改变量dU、dS、dV都只决定于始末态,
与途径可逆与否无关。因此,上式的适用条件有所扩大。
若此式亦是全微分 dZ Mdx Ndy
显然系数M、N对应于一阶偏导
Z M ( x ) y
根据全微分的充要条件,二阶混合偏导相等
N
( Z y
)x
(
Z
x y
)
y
(
Z y
)x
x
即
x
y
( M y
)x
( N x
)y
据此,我们会得到以下的二阶偏导关系式:
由 dU TdS pdV
热力学基本方程: ① dU TdS pdV
dH dU d( pV ) TdS pdV pdV Vdp ② dH TdS Vdp
dA dU dTS dU TdS SdT TdS pdV TdS SdT
③ dA SdT pdV dG dH d(TS) TdS VdpTdS SdT
§8 热力学基本方程与麦克斯韦关系式
到目前为止,我们学习过的热力学状态函数可分为两大类: 一类是可直接测量的,如p、T、V、CV,m、Cp,m等;另一类是
不能直接测量的,如U、H、S、A、G。
后面这五个状态函数中,最基本的是U、S,它们都有着明确
的物理意义(能量与混乱度),而且熵的绝对值可求。其它三个
2)封闭体系处于平衡状态下的化学变化与相变化 ⑶四个式子都是某一函数的全微分;
dU TdS pdV U f (S,V )
dH TdS Vdp H f (S, p)
dA SdT pdV A f (T ,V )
dG SdT Vdp G f (T , p) ⑷通过对四个全微分的积分计算,可计算体系始末态之间状 态函数的改变量ΔU、 ΔH、 ΔA、 ΔG。
④ dG SdT Vdp 集中写为:
dU TdS pdV
dH TdS Vdp
dA SdT pdV
dG SdT Vdp
讲几点:
⑴四个基本方程均表明了封闭体系内发生一个微小过程时各 状态函数之间的定量关系;
⑵这四个热力学基本方程适用的条件都相同; 1)封闭体系的单纯状态变化过程(过程可逆与否均可)
适用条件:
①封闭体系的单纯状态变化过程(过程可逆与否均可)
②封闭体系处于平衡状态下的化学变化与相变化
既然对于组成恒定的封闭体系(进一步为纯物质体系)是双变
量体系,那么我们令U= f (S,V),则第一个热力学基本方程 dU=TdS-pdV 就是关于U 的一个全微分。热力学基本方程除
此式外,还有另外三个。
