氨基酸和蛋白质一级结构ppt课件
合集下载
有机化学ppt-氨基酸蛋白质

蛋白质能够形成稳定亲水胶体溶液,主要有两方面的原因: 形成保护性水化膜。粒子带有同性电荷。
如果改变条件,破坏蛋白质的稳定因素,就可以使蛋白质分 子从溶液中凝聚并析出。这种现象称为蛋白质的沉淀。
盐析法:在蛋白质溶液中加入大量盐[如 NaCl、硫酸铵、 Na2SO4等],由于盐既是电解又是亲水性的物质,它能破坏蛋白 质的水化膜,因此当加入的盐达到一定的浓度时,蛋白质就会从 溶液中沉淀析出,盐浓度变稀时蛋白质溶解,为可逆沉淀。
2.氨基酸的分类
(1)据氨基和羧基的相对位置分为α-氨基酸、β-氨基酸 和γ—氨基酸,与人关系最为密切的是α-氨基酸。
R αCH COOH NH2
α 氨基酸
R β CH α CH2COOH NH2
β 氨基酸
R γ CH β CH2αCH2COOH NH2
γ 氨基酸
(2)按分子中氨基和羧基的数目分为
系统命名法: 氨基酸的命名可以采用系统命名法,与羟基酸的命名相似 ,即以羧酸为母体,氨基为取代基,称为“氨基某酸”。 氨基的位置,习惯上用希腊字母α、β、γ等来表示,并写在 氨基酸名称前面。
CH3CH CHCOOH CH3 NH2
α-氨基--甲基丁酸
CH2CH COOH NH2
α-氨基--苯基丙酸
习惯命名法: 氨基酸多根据其来源或某些特性使用俗名,有时还用中文 或英文缩写符号表示。 α-氨基乙酸因具有甜味俗名甘氨酸,中文缩写为“甘”, 英文缩写为“Gly”。天门冬氨酸是因最初是从植物天门冬的幼 苗中分离出来而得名,中文缩写“天”, 英文缩写为“Asp”。
负离子存在。在一定介质时,主要以两性离子存在。
R CH COOH
NH3+ (Ⅰ) 正离子
OH- R CH COO- OH-
如果改变条件,破坏蛋白质的稳定因素,就可以使蛋白质分 子从溶液中凝聚并析出。这种现象称为蛋白质的沉淀。
盐析法:在蛋白质溶液中加入大量盐[如 NaCl、硫酸铵、 Na2SO4等],由于盐既是电解又是亲水性的物质,它能破坏蛋白 质的水化膜,因此当加入的盐达到一定的浓度时,蛋白质就会从 溶液中沉淀析出,盐浓度变稀时蛋白质溶解,为可逆沉淀。
2.氨基酸的分类
(1)据氨基和羧基的相对位置分为α-氨基酸、β-氨基酸 和γ—氨基酸,与人关系最为密切的是α-氨基酸。
R αCH COOH NH2
α 氨基酸
R β CH α CH2COOH NH2
β 氨基酸
R γ CH β CH2αCH2COOH NH2
γ 氨基酸
(2)按分子中氨基和羧基的数目分为
系统命名法: 氨基酸的命名可以采用系统命名法,与羟基酸的命名相似 ,即以羧酸为母体,氨基为取代基,称为“氨基某酸”。 氨基的位置,习惯上用希腊字母α、β、γ等来表示,并写在 氨基酸名称前面。
CH3CH CHCOOH CH3 NH2
α-氨基--甲基丁酸
CH2CH COOH NH2
α-氨基--苯基丙酸
习惯命名法: 氨基酸多根据其来源或某些特性使用俗名,有时还用中文 或英文缩写符号表示。 α-氨基乙酸因具有甜味俗名甘氨酸,中文缩写为“甘”, 英文缩写为“Gly”。天门冬氨酸是因最初是从植物天门冬的幼 苗中分离出来而得名,中文缩写“天”, 英文缩写为“Asp”。
负离子存在。在一定介质时,主要以两性离子存在。
R CH COOH
NH3+ (Ⅰ) 正离子
OH- R CH COO- OH-
《氨基酸和蛋白质》PPT课件

COOH
H2N
H
CH
CH3
CH3
缬氨酸valine R = CH(CH3)2
2021/4/23
6
16-6
THE 20 COMMON AMINO ACIDS
中性氨基酸
COOH
H2N
H
H
Glycine 甘氨酸 5.97
COOH
H2N
H
CH CH3
CH2
CH3
Isoleucine
*异亮氨酸 6.02
2021/4/23
氨基的烃基化,酰 基化,与亚硝酸反
应等
2021/4/23
H2N O R CH C OH
羧基可生成酯,酰 卤,酰胺等
10
16-10
1.两性(Dipolar structure of amino acids)
⑴ 结构 分子中有氨基和羧基,可形成分子内盐(internal salt) 。主要以两性离子(zwitterion) 存在。
dipeptide: a molecule containing two amino acids joined by a peptide bond
4)三肽tripeptide :由三分子氨基酸缩合而成。
tripeptide: a molecule containing three amino acids joined by peptide bonds。
21
16-21
2. 多肽的命名
1)保留游离氨基部分,以“N”端表示。保留游离 羧 基部分,以“C”端表示。
2)以含“C”端的氨基酸为母体,将“酸”改为“酰 ”。
3)将“N”端氨基酸写在最前,依次写出。
4)简写:只写头一个字。
第2章蛋白质的一级结构-PPT文档资料
H 2 O2
GSH过氧化物酶 2H2O GSSG
13
Multimedia Presentation of Biochemistry
L-天冬氨酰-L-苯丙氨酰甲酯,称作:aspartame
Multimedia Presentation of Biochemistry
14
2.7 蛋白质是由一条或几条多肽链组成的具有 特定空间结构和功能的生物大分子
问题5:试简述蛋白质的重要生物学功能?
Multimedia Presentation of Biochemistry
15
2.7.2 根据蛋白质的组成、或含多肽链数目或 形状可对蛋白质进行(simple protein) 结合蛋白质 = 蛋白质 + 非蛋白质 (conjugated protein) (辅基)(prosthetic group) 辅基种类很广,常见的有 色素化合物、寡糖、脂类、 磷酸、金属离子甚至核酸
8
Multimedia Presentation of Biochemistry
问题3:肽链中可解离基团的(αCOOH,α-NH2 及侧链可解离基 团)pKa与游离氨基酸中对应基团 的pKa值有何不同?为什么?
问题4 :丛肽链的组成与结构分析 多肽有哪些主要性质?
Multimedia Presentation of Biochemistry
2.7.1 多肽与蛋白质的概念不完全相同 The term protein broadly defines molecules composed of one or more polypeptide chains; The term polypeptide is used to define the chain exceeds several dozen amino acids in length (less than 50 amino acid residues); The terms polypeptide and protein are used interchangeably in discussing single polypeptide chain.
第14章氨基酸和蛋白质xin精品课件

第14章氨基酸和蛋 白质xin
第一节 )
一、分类
氨基酸(amino acid
1.根据R-基的不同——脂肪氨基酸、芳香 氨基酸、杂环氨基酸; 2.根据R-的极性可分为:
(1)中性氨基酸:氨基和羧基数目相等 (2)碱性氨基酸:氨基数目大于羧基数
(3)酸性氨基酸:羧基数目大于氨基数
二、α-氨基酸的构型: 组成蛋白质的氨基酸的α-C均为手性
C-端
谷 - 胱 - 甘 三 肽 ( G S H )
GSH
还原态
[O] [H]
GS-SG
氧化态
第二节 蛋白质(protein)
• 蛋白蛋均含C、H、O、N四种元素,有
些还含有S、P,少数含有Fe++、Cu++、 Zn++等金属离子。 • 粗蛋白质含量(%)=6.25×N%
一、蛋白质的结构:
氨 基 酸 多 肽 蛋 白 质
碳,因此都具有旋光性,且以L-型为主。
特 例 (Gly):H 2NC H 2C O O H 甘 氨 酸 (Gly)
α-C为决定构型的碳原子:
CHO HO * H
CH2OH
L-(-)-甘油醛
COOH H2N * H
H OH CH3
L-苏氨酸
COOH
H2N * H
H3C
H
CH2CH3 L-异亮氨酸
命名:(一般用俗名)
RH CC O O HB a (2 OR H H C 2)N H 2+ C O 2
N H 2
N H 2
H 2 N
赖氨酸
COOH
H 2 N
脱羧酶
尸胺
N H 2
鸟氨酸
H 2 N
第一节 )
一、分类
氨基酸(amino acid
1.根据R-基的不同——脂肪氨基酸、芳香 氨基酸、杂环氨基酸; 2.根据R-的极性可分为:
(1)中性氨基酸:氨基和羧基数目相等 (2)碱性氨基酸:氨基数目大于羧基数
(3)酸性氨基酸:羧基数目大于氨基数
二、α-氨基酸的构型: 组成蛋白质的氨基酸的α-C均为手性
C-端
谷 - 胱 - 甘 三 肽 ( G S H )
GSH
还原态
[O] [H]
GS-SG
氧化态
第二节 蛋白质(protein)
• 蛋白蛋均含C、H、O、N四种元素,有
些还含有S、P,少数含有Fe++、Cu++、 Zn++等金属离子。 • 粗蛋白质含量(%)=6.25×N%
一、蛋白质的结构:
氨 基 酸 多 肽 蛋 白 质
碳,因此都具有旋光性,且以L-型为主。
特 例 (Gly):H 2NC H 2C O O H 甘 氨 酸 (Gly)
α-C为决定构型的碳原子:
CHO HO * H
CH2OH
L-(-)-甘油醛
COOH H2N * H
H OH CH3
L-苏氨酸
COOH
H2N * H
H3C
H
CH2CH3 L-异亮氨酸
命名:(一般用俗名)
RH CC O O HB a (2 OR H H C 2)N H 2+ C O 2
N H 2
N H 2
H 2 N
赖氨酸
COOH
H 2 N
脱羧酶
尸胺
N H 2
鸟氨酸
H 2 N
2第二章氨基酸与蛋白质的一级结构

第二节.氨基酸的分离与分析
一、氨基酸的电泳分离
•电泳(Electrophoresis)是指带电颗粒在电场中的移动。
•如果带电质点在恒定电压和恒定粘度的介质中泳动,带电质 点的迁移率(µ )可用下式表示: µ ∝ Q/r 如果它们在大小方面也没有明显的的差别,带电质点的迁 移率可用下式表示: µ∝ Q 各氨基酸所带净电的差异(Q)可用pI- pH表示。
H—C—NH3 H—C—OH CH3
L-苏氨酸
D-苏氨酸
L-别-苏氨酸
D-别-苏氨酸
四、 氨基酸的酸碱性质
(一) 氨基酸的两性电离性质
– 氨基酸分子中既含有酸性的-COOH,又含有 碱性的-NH2。属两性离子。
– 带相反电荷的极性分子叫做两性离子或偶极 离子。 – -COOH的 pK = 2左右;-NH2的pKa = 9 左右( pK 解离常数的负对数) – Arg: pKa = 12.5; Lys: pKa = 10.5; His: pKa = 6.0;
Ile
Leu Lys Met Phe Pro Ser Thr Trp Tyr Val
I
L K M F P S T W Y V
二、 非标准氨基酸 1. 不常见的蛋白质氨基酸
由常见的蛋白质氨基酸经化学修饰而成 常见的是羟基氨基酸和甲基氨基酸
不常见的蛋白质氨基酸
存在于凝血酶原中
存在于胶原蛋白中
存在于弹性蛋白中
地 球 上 天 然 形 成 的 氨 基 酸 有 300 种 以 上 , 但 是 构 成 蛋 白 质 的 氨 基 酸 只 有 20 种 , 且都是α-氨基酸(可能还存在更多的)。 答案: ----C-C-C-C-COOH γβα
提问:什么是α-氨基酸?
2014生化2-氨基酸与蛋白质的一级结构

• The primary level of structure in a protein is the linear sequence of amino acids as joined together by peptide bonds.
• This sequence is determined by the sequence of nucleotide bases in the gene encoding the protein.
• (1)多肽链的拆分。
蛋 • 由多条多肽链组成的蛋白质分子,必须先进行拆分。 白 质 一 级 结 构 的 测 定
测定步骤
• (1)多肽链的拆分。
蛋 白
•
几条多肽ቤተ መጻሕፍቲ ባይዱ借助非共价键连接在一起,称为寡聚蛋白质, 如,血红蛋白为四聚体,烯醇化酶为二聚体;可用8mol/ L尿素或6mol/L盐酸胍处理,即可分开多肽链(亚基).
NO2 DNP衍 生 物
+
氨基酸
NO2
DNP-氨 基 酸
丹磺酰氯法
末 • 在碱性条件下,丹磺酰氯(二甲氨基萘磺酰氯)可以与N-端氨基
端 基 氨
酸的游离氨基作用,得到丹磺酰-氨基酸。
• 此法的优点是丹磺酰-氨基酸有很强的荧光性质,检测灵敏度可
以达到110-9mol。
N(CH3)2
N(CH3)2
RO
质
一
级
结
构
的
测
定
• (2)测定蛋白质分子中多肽链的数目。
蛋 白
•
通过测定末端氨基酸残基的摩尔数与蛋白质分子量之间 的关系,即可确定多肽链的数目。
质
一
级
结
构
的
测
• This sequence is determined by the sequence of nucleotide bases in the gene encoding the protein.
• (1)多肽链的拆分。
蛋 • 由多条多肽链组成的蛋白质分子,必须先进行拆分。 白 质 一 级 结 构 的 测 定
测定步骤
• (1)多肽链的拆分。
蛋 白
•
几条多肽ቤተ መጻሕፍቲ ባይዱ借助非共价键连接在一起,称为寡聚蛋白质, 如,血红蛋白为四聚体,烯醇化酶为二聚体;可用8mol/ L尿素或6mol/L盐酸胍处理,即可分开多肽链(亚基).
NO2 DNP衍 生 物
+
氨基酸
NO2
DNP-氨 基 酸
丹磺酰氯法
末 • 在碱性条件下,丹磺酰氯(二甲氨基萘磺酰氯)可以与N-端氨基
端 基 氨
酸的游离氨基作用,得到丹磺酰-氨基酸。
• 此法的优点是丹磺酰-氨基酸有很强的荧光性质,检测灵敏度可
以达到110-9mol。
N(CH3)2
N(CH3)2
RO
质
一
级
结
构
的
测
定
• (2)测定蛋白质分子中多肽链的数目。
蛋 白
•
通过测定末端氨基酸残基的摩尔数与蛋白质分子量之间 的关系,即可确定多肽链的数目。
质
一
级
结
构
的
测
蛋白质和氨基酸PPT课件

②向蛋白质溶液中加入硝酸银溶液、硫酸铜溶液、 乙酸铅溶液、乙醇溶液、苯酚溶液时,会使蛋白质 从溶液沉淀出来,加水后沉淀不溶解。
第24页/共58页
实验3
取3ml鸡蛋白溶液于试管中,将试管放在酒精灯 火焰上加热。待试管冷却后,取少量沉淀物于另支试 管中向试管中加入蒸馏水,不断振荡,观察现象
现象
加热蛋白质凝结,加水后沉淀不溶解。
第25页/共58页
●结论1:
性质3:蛋白质的盐析
蛋白质溶液中加浓的无机轻金属盐溶液〔如
Na2SO4、(NH4)2SO4等〕,可使蛋白质的溶解度减 小, 破坏了蛋白质溶解形成的胶体结构,使蛋白质
转变为沉淀而从溶液中析出----盐析。
盐析是一个可逆的物理变化,故不影响蛋白质的性质
应用: ●
利用多次盐析的方法分离、提纯蛋白质。
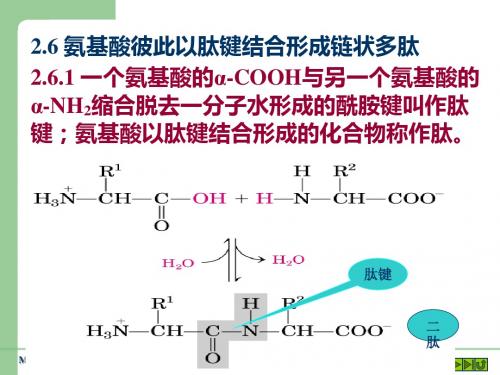
● 氨基酸在酸或碱的存在下加热,通过一分子的氨 基与另一分子的羧基间脱去一分子水,缩合形成含 有肽键的化合物,叫做成肽反应。
● 成肽反应是分子间脱水反应,属于 取代 反应。
●成肽的两个氨基酸分子(可以相同,也可 以不同)
● 两个氨基酸分子脱去一个水分子而形成二肽, 多个氨基酸分子脱去水分子而形成多肽.
第19页/共58页
【课堂练习】
1、下图表示蛋白质分子结构的一部分,图中 (A)、(B)、(C)、(D)标出分子中不同的键。 当蛋白质发生水解反应时,断裂的键是
(C )
H R OH R O —N—CH—C—N—CH—C—
(A) (B) (C)
(D)
第20页/共58页
2.当含有下述结构片段的蛋白质在胃中水解时,不
第26页/共58页
●结论2:
性质4:蛋白质的变性
在热、强酸、强碱、重金属盐、甲醛、酒精、苯酚溶液、紫外线等作用
第24页/共58页
实验3
取3ml鸡蛋白溶液于试管中,将试管放在酒精灯 火焰上加热。待试管冷却后,取少量沉淀物于另支试 管中向试管中加入蒸馏水,不断振荡,观察现象
现象
加热蛋白质凝结,加水后沉淀不溶解。
第25页/共58页
●结论1:
性质3:蛋白质的盐析
蛋白质溶液中加浓的无机轻金属盐溶液〔如
Na2SO4、(NH4)2SO4等〕,可使蛋白质的溶解度减 小, 破坏了蛋白质溶解形成的胶体结构,使蛋白质
转变为沉淀而从溶液中析出----盐析。
盐析是一个可逆的物理变化,故不影响蛋白质的性质
应用: ●
利用多次盐析的方法分离、提纯蛋白质。
● 氨基酸在酸或碱的存在下加热,通过一分子的氨 基与另一分子的羧基间脱去一分子水,缩合形成含 有肽键的化合物,叫做成肽反应。
● 成肽反应是分子间脱水反应,属于 取代 反应。
●成肽的两个氨基酸分子(可以相同,也可 以不同)
● 两个氨基酸分子脱去一个水分子而形成二肽, 多个氨基酸分子脱去水分子而形成多肽.
第19页/共58页
【课堂练习】
1、下图表示蛋白质分子结构的一部分,图中 (A)、(B)、(C)、(D)标出分子中不同的键。 当蛋白质发生水解反应时,断裂的键是
(C )
H R OH R O —N—CH—C—N—CH—C—
(A) (B) (C)
(D)
第20页/共58页
2.当含有下述结构片段的蛋白质在胃中水解时,不
第26页/共58页
●结论2:
性质4:蛋白质的变性
在热、强酸、强碱、重金属盐、甲醛、酒精、苯酚溶液、紫外线等作用
蛋白质化学一级结构及分析PPT课件

+H3N-Tyr-Gly-Gly-Phe-Leu-
Leu-脑啡肽
C ys Tyr Phe S G ln S A sn C ys P ro A rg G ly N H 2
牛牛催催产产 素素
牛牛加加压压素 素
第11页/共94页
OH
CH3 CH CH2OH
CH O
O
O
HN CH C NH CH C NH CH2 C
In 1992, the Sanger Centre in Cambridge, named after Frederick Sanger, was founded by th第e 3W3页el/共lc9o4m页e Trust and the British
Sanger试剂(FDNB)标记N末 端
• 1943-53年,Sanger确定了牛胰岛素 的 一 级 结 构 , 1 9 5 8 年第获32页得/共N94页o b e l 化 学 奖 ;
科学怪才 Fredrick
Sanger •
•
两获诺贝尔奖 (仅4人), 唯一两获诺贝 • 尔化学奖。
Frederick Sanger (1918- ) is a British
Peptides and Proteins
• 氨基酸的多聚物,分子量大小差异极大,可以是2 或3个到成千上万个氨基酸残基连接而成。
• 两个氨基酸残基之间通过共价的酰胺键(肽键)连 接形成一个二肽;三个氨基酸残基连接成三肽;…; 有限数量的数十个氨基酸残基连接成寡肽;多个氨 基酸残基则连接成多肽;蛋白质可以是成千上万个 氨基酸残基连接而成。
第17页/共94页
多肽具有特征性的氨基酸 组成,多肽或蛋白质以酸 水解产生游离-氨基酸的 混合物。当完全水解时, 每一种类型的蛋白质产生 一种特征性的氨基酸比例 或混合物。20种氨基酸 几乎从不以相同的比例出 现在一个蛋白质中,有高 有低,甚至有的只出现一 次或根本不出现。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三字母缩写 Gly Ala Val Leu Ile Pro Phe Tyr Trp Ser Thr Cys Met Asn Gln Asp Glu Lys A rg His
单字母符号 G A V L I P F Y W S T C M N Q D E K R H
1.1.1 20种标准氨基酸可以按其侧链分类
2、R为芳香族基团的氨基酸 苯丙氨酸(-氨基-β -苯丙酸)是一个含有苯基的氨基酸。酪氨酸(-
氨基-β -对羟基苯丙酸)的结构类似于苯丙氨酸,称之对羟基苯丙氨酸。 酚是个比较弱的酸,所以酪氨酸侧链的pKa值为10.5。色氨酸(β -吲哚-氨基丙酸)的侧链带有一个双环的吲哚基,所以色氨酸又称之吲哚丙氨酸。 三种芳香族氨基酸都吸收紫外光,在中性pH条件下,色氨酸和酪氨酸的紫 外吸收峰在280nm,而苯丙氨酸的在260nm,大多数蛋白质中都含有色氨 酸和酪氨酸或其中的一种,所以溶液中280nm吸收的测量常用来估算蛋白 质的浓度。
有几种与氨基酸的氨基反应的试剂常用来鉴定蛋白质和多肽的N-末端氨 基酸残基。
2,4-二硝基氟苯(2,4-dinitrofluorobenzene, DNFB)也叫做Sanger试剂。 DNFB在弱碱性溶液中与氨基酸发生取代反应,生成黄色化合物二硝基苯基 氨基酸(dinitro phenyl amino acid, DNP氨基酸)(图1.8a)。
1.1.3 使用离子交换层析可将各种氨基酸分开
层析(chromatography)也称之色谱(来自Chroma),其基本原理是分
析样品作为流动相流过固相时,样品中的各个成分与固相进行着不同程度的 相互作用,使得样品中的各个成分在固相中的迁移率产生了差别,从而达到 分离样品的目的。
根据固相与样品中各个成分之间相互作用的种类的不同,又有离子交换层
电基团相互作用,结果X+与Na+交换,即发生阳离子交换后,形成SO3-X+。
1.1.4 氨基酸可进行特征的化学反应
氨基酸的-氨基、-羧基以及氨基酸的各种侧链基团可进行很多种化学反 应。氨基酸与茚三酮(ninhydrin)的反应是一个检测和定量氨基酸和蛋白 质的重要反应。茚三酮在弱酸性溶液中与氨基酸共热,所有具有游离氨基的 氨基酸都生成紫色化合物(470)(图1.7)。然而由于脯氨酸是一个亚氨基 酸,所以与茚三酮反应生成的是黄色化合物(440)。
半胱氨酸
121
1 .9 6
8 .1 8
蛋氨酸
149
2 .2 8
9 .2 1
天冬酰胺
132
2 .0 2
8 .8 0
谷氨酰胺
146
2 .1 7
9 .1 3
天冬氨酸
133
1 .8 8
9 .6 0
谷氨酸
147
2 .1 9
9 .6 7
赖氨酸
146
2 .1 8
8 .9 5
精氨酸
174
2 .1 7
9 .0 4
组氨酸
蛋白质中 出 现 的 几 率 (% )*
7 .5 9 .0 6 .9 7 .5 4 .6 4 .6 3 .5 3 .5 1 .1 7 .1 6 .0 2 .8 1 .7 4 .4 3 .9 5 .5 6 .2 7 .0 4 .7 2 .1
氨基酸的-COOH基是个弱酸,利用Henderson-Hasselbalch方程可以计算任何 pH下离子化基团的比例。
引入SO3-Na+ 或COO -H+基团的叫做阳离子交换体;引入N+(C2H5)Cl-基团的叫做阴离子交换 体。
分离氨基酸常用的是带有耐酸性非常强的磺酸根SO3-Na+(以盐的形式 出现)的强阳离子交换树脂。首先将这种树脂填充到柱子中,然后注入含有
样品的流动相,样品中含有阳离子成分X+,通过静电吸引,与树脂中的带
3、R为含硫基团的氨基酸 蛋氨酸和半胱氨酸是两个含硫氨基酸。蛋氨酸(-氨基-γ -甲硫基丁酸)
是个疏水氨基酸,它的侧链上带有一个非极性的甲基硫醚基,不过其中的 硫原子是亲核的。半胱氨酸(-氨基-β -巯基丙酸)侧链上含有一个巯基 (-SH),所以又称之巯基丙氨酸。虽然半胱氨酸的侧链显得有点疏水性, 但-SH也是一个高反应性的基团。
表1.1 20种标准氨基酸的英文名称及简写符号
中文名称 甘氨酸 丙氨酸 缬氨酸 亮氨酸 异亮氨酸 脯氨酸 苯丙氨酸 酪氨酸 色氨酸 丝氨酸 苏氨酸 半胱氨酸 蛋氨酸 天冬酰胺 谷氨酰胺 天冬氨酸 谷氨酸 赖氨酸 精氨酸 组氨酸
英文名称 Glycine Alanine Valine Leucine Isoleucine Proline Phenylalanine Tyrosine Tryptophan Serine Threonine Cystine M ethionine Asparagine Glutarnine Aspartic acid Glutamic acid Lysine A rg in in e Histidine
1氨基酸和蛋白质的一级结构
1.1 蛋白质是由二十种不同的氨基酸构成的 1.1.1 二十种氨基酸可以按其侧链分类 1.1.2氨基酸的离子状态取决于环境的pH 1.1.3 使用离子交换层析可将各种氨基酸分开 1.1.4 氨基酸可进行特征的化学反应
1.2蛋白质中的氨基酸是通过肽键连接的 1.3肽可以化学合成 1.4蛋白质可以通过各种生物化学技术纯化
通过氨基酸的滴定曲线可以确定氨基酸的各个解离基团的pKa值。图1.4 给出了丙氨酸和组氨酸的滴定曲线。丙氨酸有两个可解离基团,-COOH
和-NH3+,它们的pKa值分别是2.4和9.9,每一个值都是位于滴定曲线缓 冲区的中心。组氨酸有3个可解离基团,即-COOH、-NH3+和侧链基团 咪唑基,pKa值分别是1.8、6.0和9.3,也都是处于缓冲区的中心。
〖RCOOH〗
-氨基的pKa值的范围是8.7至10.7。它的共轭碱(游离的胺-NH2)对共轭酸 (质子化的胺-NH3+)的比,在pH7时为1:1000。计算表明,在中性pH条件 下,游离氨基酸主要是以兼性离子形式存在的。所以将一个氨基酸画成带有COOH和-NH2基团的形式是不合适的。因为不存在这样一种pH,即在这一 pH下,-COOH和-NH2都占优势。 脯氨酸的氨基(pKa=10.6)在中性pH条件下也是质子化的碱基形式,虽然侧 链与-氨基结合,脯氨酸在pH7时仍是一种兼性离子。
9 .6 2
亮氨酸
131
2 .3 6
9 .6 0
异亮氨酸
131
2 .3 6
9 .6 8
脯氨酸
115
1 .9 9
1 0 .9 6
苯丙氨酸
165
1 .8 3
9 .1 3
酪氨酸
181
2 .2 0
9 .1 1
色氨酸
204
2 .3 8
9 .3 9
丝氨酸
105
2 .2 1
9 .1 5
苏氨酸
119
2 .1 1
9 .6 2
丹磺酰氯(dansyl chloride)是5-二甲基氨基萘-1-磺酰氯(5dimethylaminonaphthalene-1 -sulfonyl chloride)的简称。丹磺酰氯与 氨基酸反应生成荧光性质强和稳定的磺胺衍生物(图1.8b),也常用 于多肽链的N末端氨基酸的鉴定。
苯异硫氰酸酯(phenylisothiocyanate, PITC)在弱碱性条件下,与氨 基酸反应生成苯乙内酰硫脲(phenylthiohydantoin, PTH)衍生物,即 PTH-氨基酸(图1.8c),此反应又称之Edman反应,该反应是蛋白质或 多肽氨基酸序列测定常用的反应。
1.1 蛋白质是由二十种不同的氨基酸构成的
蛋白质是由氨基酸构成的聚合物,所有生物都是利用这20种氨基酸作为 构件组装成各种蛋白质分子的。因此这20种氨基酸被认为是通用的或是标 准的氨基酸。尽管氨基酸的种类有限,但由于氨基酸在蛋白质中连接的次 序以及氨基酸数目的不同,所以可以组装成几乎无限的不同种类的蛋白质。 20种氨基酸都被称之-氨基酸,因为-氨基酸分子中的-碳(分子中第2 个碳,C)结合着一个氨基和一个酸性的羧基,此外C还结合着一个H原 子和一个侧链基团(用R表示)。每一种氨基酸的R都是不同的,侧链上 的碳依次按字母命名为、、和碳,分别指的是第3、4、5和6位碳。
析、分子筛层析和吸附层析等各种层析方法。通常都是将固相装到一个柱子 里,然后使流动相流过柱子(有时需要加压力),这样的层析方法叫做柱层 析(column chromatography)。
如果被分离的样品中各个成分受溶液pH的影响,有时带正电荷,有时带 负电荷,此时就可利用离子交换层析方法进行样品的分离。离子交换层析 的固相是离子交换体,其中有离子交换树脂、离子交换纤维素、离子交换 葡聚糖。通常是以树脂、或是纤维素、或是葡聚糖作为基质,这些基质具有 网状结构,
〖共轭碱〗 pH=pKaα +log-------
〖弱酸〗
从表1.2可以看出,游离氨基酸的-COOH的pKa值的范围是1.8至2.5。对于一 个典型的氨基酸它的-COOH的pKa值大约是2,羧酸盐对羧酸的比是 100000 :1,所以在中性pH条件下,占优势的成分是羧酸盐离子。
〖RCOO-〗 7.0=2.0+log----―――
1.4.1柱层析常用于蛋白质的分离纯化 1.4.2电泳分离蛋白质是根据蛋白质在电场中的迁移率 1.5蛋白质的一级结构就是蛋白质的氨基酸序列 1.5.1蛋白质的氨基酸组成可以定量确定 1.5.2 Edman降解方法常用于氨基酸序列的测定 1.5.3大蛋白被水解成肽段后再测序 1.5.4蛋白质一级结构的比较可以揭示进化关系
1.2蛋白质中的氨基酸是通过肽键连接的
一个氨基酸的-羧基与另一个氨基酸的-氨基缩合,通过形成的酰胺键将 两个氨基酸连接在一起,这个酰胺键称之肽键(peptide bond)(图1.9),氨 基酸缩合生成的产物称之肽(peptide)。
