[理学]第八章 分子重排反应
分子重排反应

R N C OH H O
• 6、Wolff重排 • 重氮酮在氧化银或光热作用下,与水、醇、胺反应生成酸、 酯、酰胺的反应称为Wolff重排。 O
H2O O + R C CHN2 hv O R C CH R'OH NH3 R C C OH H2 O R C C OR' H2 O R C C NH2 H2 R C C O H
+
CH3 H3C C C OH2 H2
+
- H2 O
CH3 H3C C CH2
+
CH3
CH3
CH3 Cl H3 C C CH2CH3
Cl rearrgement CH3
+
-
H3C
C
CH2 - H+ H 3C
CH3 C CHCH3
CH3
CH3
• 实验证明Wagner-Meerwein重排的历程是生成碳正离子 的SN1历程。重排的趋势一般取决于碳正离子的相对稳定 性。其迁移基团的活性次序如下:
O Ph H C H2 Cl B Ph CH2 O H2O Ph C O OH
H2O
Ph
C O
OH
• 原子上有吸电子基团时,在强碱的作 用下,季铵盐上的取代基重排到具有吸电子的碳原子上, 形成叔胺的反应称为Stevens重排。
R1 Z C H2 N
+
R1 R2 NaNH2 Z C H N
O O C C KOH O C OC OH OH O C C OK
O- O C C OH
分子重排反应(molecularrearrangement)中国百科物理

分子重排反响(molecularrearrangement)中国百科物理人才源自知识 ,而知识的获得跟广泛的阅读积累是密不可分的。
古人有书中自有颜如玉之说。
杜甫所提倡的读书破万卷, 下笔如有神等 ,无不强调了多读书广集益的好处。
这篇分子重排反响(molecularrearrangement)中国百科物理 ,希望可以加强你的根底。
分子重排反响(molecularrearrangement)
【分子重排反响】(molecularrearrangement)
亦称重排反响。
有机物理反响类型之一。
一般有机物理反响只涉及到分子中个别原子或原子团 ,而碳骨胳不起变化。
但某些有机化合物的分子 ,在试剂的作用或其他因素影响下 ,使其发生某些基团转移或分子内碳原子骨胳的改变(包括环扩大或缩小)。
通常是一种不可逆的分子内的连续过程 ,和可逆的互变异构有所区别。
种类繁多 ,可按反响历程、分子内、分子间或化合物类型等加以分类。
在重排反响式中A ,B通常是碳原子或其他元素 ,为重排起点及终点 ,X为重排基 ,Y为脱离基。
主要有以下三种形式:(1)亲核重排:是包含产生缺电子的正离子中间体的反响。
(2)亲电子重排:是包含产生负离子中间体的反响。
(3)游离基重排。
感谢你阅读分子重排反响(molecularrearrangement)中国百科物理。
1 / 1。
分子重排-亲核重排

重排反应
反应中原子或基团迁移使碳架的位置发生变化,称 为重排反应。
W A
*A-迁移起点原子
W B A B
W-迁移基团/原子
B-迁移终点原子
重排反应一般分为三步: 生成活性中间体;重排;生成消去和取代产物。
(碳正离子,碳烯,氮烯,碳负离子,自由基等)
根据反应机理中迁移终点原子上的电子多少,将重排反应分为:
O
KOBr&H2COOH
O C NH C O
KOBr + 2KOH
O COH NH2
缺电子重排(亲核重排)
-Curtius(库尔修斯)重排
缺电子重排(亲核重排)
-Schmidt重排
缺电子重排(亲核重排)
-Schmidt重排
§1.缺电子重排(亲核重排)
-Lossen重排
周环反应中的σ键迁移反应也是常见的重排反应。
环氧丙烷重排
缺电子重排(亲核重排)
机理 1.缺电子中心的创建
CH3CH2CH2CH2OH H
+
H CH3CH2CH2CH2OH2 H2O H3CH2CHC CH2
2. 迁移基团带着一对电子迁移到缺乏电子中心
H H3CH2CHC CH2 H3CH2C C CH3
3.要满足迁移始点外层8电子结构,一般与亲核试剂结合或 通过β-消除完成重排过程
H3CH2C C CH3 H
+
CH3-CH=CH-CH3
缺电子重排(亲核重排)
碳正离子重排
CH3
Cl C CH2CH3 CH3
CH3C=CHCH3 CH3
OCH3 Cl
迁移基团迁移顺序:
>
>
> R3C- > R2CH-
分子重排反应

分子重排反应合作者:缪文文(20082823)江会剑(20082824)1.亲核重排1.Wagner-Meerwein重排属于分子内的亲核碳重排反应,实例:其结果是正常产物(I)仅有3%,而两种重排产物(II)和(III)共有92%。
原因是反应过程中,反应中间体碳正碳子发生了重排:脂肪族或脂环族伯胺与HNO2作用时,亦可发生此亲核碳重排反应。
2 .片呐醇重排(Pinacol重排)在无机酸作用下,连有羟基的碳原子上的烃基带着一对电子转移到失去羟基的正碳离子上,生成不对称酮的反应,称片呐醇重排:例如:正碳离子的形成和基团的迁移系经由一个正碳离子桥式过渡状态,迁移基团和离去基团处于反式位置。
迁移基团可以是烷基,也可以是芳基。
对于R1R2C(OH)-C(OH)R3R4取代基不同的片呐醇,其重排方向取决于下列两个因素:(1)失去-OH的难易;(2)迁移基团的性质和迁移倾向。
3. Beckmann重排醛肟及酮肟在酸性催化剂(如H2SO4、HCl、P2O5、POCl3、SO2Cl2等)作用下,发生重排转变为酰胺,称Beckmann重排。
其立体化学特征:不对称酮肟的重排为反式重排,例如:在迁移过程中,迁移基团原有的结构(如碳架、构型等)保持不变,例如:4 . Baeyer-Villiger重排酮类经过氧酸氧化,发生重排生成酯,称Baeyer-Villege重排。
常用的过氧酸有:H2SO5、MeCO3H、PhCO3H、HCO3和CF3CO3H等。
机理:对不对称酮而言,各种烃基迁移难易大致顺序如下:叔烷基>仲烷基~环烷基>苄基~苯基>伯烷基>环丙基>甲基(易)(难)例如:本反应是由酮合成酚的一种方法,如:5. 苯偶酰(Benzil)重排苯偶酰重排,又称苯甲酰重排:苯偶酰类化合物(即α-二酮类)在强碱作用下,发生分子内重排生成α-羟基酸的反应。
最著名的是二苯基乙二酮(苯偶酰)的重排如以代替,则产物为酯,如:2 亲核氮重排反应1 . Hofmann重排酰胺在碱性介质中用Cl2或Br2(NaOCl或NaOBr)处理,放出CO2变为减少一个碳原子的伯胺,此反应成为Hofmann降解重排。
高等有机合成化学 02.4 分子重排反应讲解

OH (CH2)n-1 C CH2NO2
H2/Pd
OH CN
H2/Pd
(CH2)n-1
OH C
CH2NH2
Rear
(CH2)n
CO
2019/6/4
(CH2)n+1 C O
1)CH3NO2
2)H2/Pd
HNO2 (CH2)n
OH C
CH2NH2 15
4. 贝克曼重排
酮肟在酸催化下脱水形成亚胺氮正离子,相邻碳 上原来与羟基处于反位的烃基迁移到氮原子上, 形成亚胺正离子中间体后,再与溶剂水加成生成 酰胺的整个过程,称为贝克曼(Beckmann)重排。
AB
M A B (亲核重排)
M
A B (亲电重排) M
A B (自由基重排)
M=迁移基团(migration group);Y=离去基团;
A=重排始点;B=重排终点
2019/6/4
6
根据迁移基团的距离,重排还可分为1,2-、1,3-、 1,4-、 重排。
大多数反应属于分子内1,2-重排,即迁移基团经 “桥”离子迁移到相邻原子上。
HNO2
CH2NH2
[(CH2)n
(CH2)n
CO CH2
C OH ] Rear CH2+
+
C
OH
(CH2)n
CH2
2019/6/4
14
该反应在合成中主要用于环酮的扩大。 由于重排起始物很容易从环酮制得,因此,重2)n-1 C O HCN (CH2)n-1 C
(CH3)2C C(CH3)2 OH Br
AgNO3 C2H5OH
(CH3)2C
C(CH3)2
(CH3)2C C(CH3)2
《分子重排反应》课件

III. 分子重排反应的机理
• 分子重排反应的机理涉及分子内、分子间的结构变化以及化学键的重组。 • 这类反应通常包括断裂原始键、形成新的共价键、转移原子或基团等
步骤。 • 具体反应机理的理解对于控制反应路径和提高反应效率至关重要。
IV. 分子重排反应的影响因素
1 1. 温度
温度对分子重排反应速率和选择性起着重要 作用,通常较高的温度会促进分子重排反应 的进行。
II. 分子重排反应的分类
1. 根据反应类型
分子重排反应可以根据不同 的反应类型进行分类,如醇 酯互变异构、氧杂环化、羰 基互变异构等。
2. 根据反应条件
分子重排反应也可以根据不 同的反应条件进行分类,如 酸催化、碱催化、高温条件 下发生的分子重排反应等。
3. 根据反应底物
分子重排反应还可以根据不 同的反应底物进行分类,如 环状化合物的分子重排反应、 链状化合物的分子重排反应 等。
VII. 分子重排反应与有机合成的关系
分子重排反应是有机合成中的重要环节,可以用于构建复杂分子结构和控制化学反应的选择性。
2
2. 药物合成
分子重排反应在药物合成中发挥着重要作用,可用于合成药物前体和改进药物性 能。
3
3. 新型材料制备
分子重排反应可用于制备新型材料,例如高分子材料、金属配合物等。
VI. 分子重排反应的实验方法
为了研究和实施分子重排反应,可以使用各种实验方法,如核磁共振(NMR)、质谱(MS)和红外光谱(IR) 等。
2 2. 反应物浓度
反应物浓度越高,分子重排反应的速率通常 会增加。
3 3. 催化剂
催化剂可以显著提高分子重排反应的速率, 并且可以排反应的进行和产物 选择性有重要影响。
[理学]第八章 分子重排反应
![[理学]第八章 分子重排反应](https://img.taocdn.com/s3/m/3ddd9aeeda38376baf1faeda.png)
4、Schmidt重排
羧酸、醛、酮等与叠氮酸在强酸作用下重排生成伯 胺及酰胺的反应称为施密特(Schmidt)重排。
RCOOH + HN3 H2SO4 R NH2 + N2 + CO2
酮的Schmidt重排实际生成取代酰胺。
O R C R + HN3 O H2SO4 R C NH R + N2
如:
3、片呐醇(Pinacol)重排
当用无机酸及其酰氯等处理邻二叔醇时发生的重排 称为片呐醇重排,重排的产物称片呐酮。
R2 R3 R C
1
C R
4
H2SO4
R2 R1 C C R3 O R4
CH3 C6H5 C C CH3 C6H5 O
OH OH
CH3 CH3 C6H5 C C C6H5 OH OH
H2SO4
(2) 通过重排转变成稳定的中性化合物。
R 2C CR2 H 片呐醇重排 R 3C C R O
OH OH
(3)重排后减少空间张力。
CH3 CH3 C CH2 CH3
张力大
CH3
C CH2CH3 CH3
张力小
又如蒎烯重排生成菠基氯也是张力减小的过程。
Cl
HCl 蒎烯
菠基氯(氯化莰)
形成缺电子体系主要有下面四种方法: (a) 碳正离子 的形成,(b) 氮烯的生成,(c) 碳烯的形成,(d) 缺电 子氧原子的形成。其中以形成碳正离子与氮烯的两 种方法最为重要。
R NH2 + CO2
在酰胺分子中可以转移的只有一种烃基,烃基的性 质可影响转移的速度。给电子的烃基反应速度高, 吸电子的烃基反应速度低。而且具有手性碳原子的 R转移时并不消失其光学活性,保持了原构型。
重排反应总结

重排反应总结1、什么叫重排反应?一般地,在进攻试剂作用或者介质的影响下,有机分子发生原子或原子团的转移和电子云密度重新分布,或者重键位置改变,环的扩大或缩小,碳骨架发生了改变等等,这样的反应称为重排反应。
简单的理解:重排反应是指反应中烃基或氢原子或别的取代基从分子中的一个原子迁移到该分子中的另一个原子上的变化。
(指分子内重排)2、重排的分类按反应机理 ,重排反应可分为:基团迁移重排反应和周环反应中的重排。
基团迁移重排反应 即反应物分子中的一个基团在分子范围内从某位置迁移到另一位置的反应。
常见的迁移基团是烃基。
基团迁移重排反应又包括缺电子重排(亲核重排),富电子重排(亲电重排)和自由基重排.。
周环反应中的重排包括电环反应、σ键迁移。
也可按照不同的标准,分成分子内重排和分子间重排,光学活性改变和不改变的重排反应等等。
本讲义把重排分为以下几类:a.从碳原子到碳原子的重排 b.从碳原子到杂原子的重排 c.从杂原子到碳原子的重排 d.其它重排一、从碳原子到碳原子的重排反应1、Wangner-Meerwein 重排(瓦格纳尔—米尔外英重排,简称瓦—米重排)两个相邻原子之间发生的重排叫1,2重排,也叫Wangner-Meerwein 重排。
如:醇或卤代烃在酸催化下进行亲核取代或消除反应时,烯烃进行亲电加成时发生的重排。
例如:a.亲电加成时发生的重排如果反应液中同时存在两种或是两种以上的亲核试剂,则通过中间体碳正离子,能够生成混合加成产物。
R 2C R 3R 1C OHR 4R 5R 2C R 3R 1CR 4R 5R 1CR 2C R 3R4R 5R1CR 2CR 3R 4R 5OH H +(-H O)重排H O(-H +)b.醇进行亲核取代和消除时的重排亲核取代时,除大多数伯醇难以形成正碳离子而按S N 2反应外,仲醇或叔醇反应常伴随着重排产物的产生。
(S N 1)消去时(S N 1):c.卤代烃进行亲核取代和消除时的重排亲核取代按S N 1机理反应时伴随着碳正离子的重排 消去时注意:有碳正离子形成时,就有可能伴随着重排反应 形成C +的方式总结: (a)卤代烃 (AgNO 3醇溶液) (b)含-NH 2,重氮化放氮气(c)-OH ,加 H + (失H 2O),烯烃加H +基团迁移顺序:对迁移顺序的理解:迁移基团的电子云密度越大越容易迁移(但具体情况下,要具体分析)(CH 3)3C-CH 2Cl(CH 3)32Ag (AgNO 3(CH 3)3C-CH 2N 2Cl-N 2(CH 3)3C-CH 2(CH 3)3C-CH 3NH 2NaNO 2△(CH 3)3C-CH 2OH (CH 3)3C-CH 2=CH 2(CH 3)32(CH 3)33H +2H +ClR 3C-R 2CH-RCH 3-CH 3-H->>>>>>OCH 3>反应举例:2、Pinacol (频哪醇)重排(邻二醇重排)当起始物的脱水产物能产生两种不同的正离子时,总是生成更稳定的正碳离子为主,有不同迁移基团时,按迁移的难易程度进行。
分子重排反应

Me Me Me MeOH
H2SO4
Me Me
Me Me
Me Me Me CH2Cl
AgNO3
ONO2 Me CH2CH3 + Me
Me Me
Me H
4
7.2.2 频哪醇(Pinacol)重排
Me Me H2SO4 Me C C Me OH OH Me Me C C Me Me O
O OH
OH Br Br + t-Bu AlCl3 Br
OH Br +
t-Bu
2
7.1.2 按反应历程分类 根据迁移基团的亲核、亲电或是自由基的性质可将重排反应分为 亲核重排、亲电重排和自由基重排。 亲核重排是迁移基团带着一对电子迁移到缺电子的迁移终点。 亲电重排是迁移基团不带电子向富电子的迁移终点转移。 自由基重排是带着一个电子的迁移。
O Ag+ R CHN2 H2O R
Wolff Rearrangement
O OH
O
Hofmann Rearrangement
Br2, NaOH NH2
R
RNH2
迁移基团如果是手性的,迁移前后其构型保持不变。
6
7.3 亲电重排
Favorskii 重排:α - 卤代酮在碱作用下重排得到羧酸盐或羧酸酯。
哪一个羟基质子化离去,取决于碳正离子的稳定性; 通常能提供电子,稳定正电荷较多的基团优先迁移。
Ph Ph C OH
Me Ph C OH
H H2SO4 C H OH
Me H2SO4 C Ph OH
Ph Ph C C H H O
Me Ph C C Me Ph O
高等有机合成化学 02.4 分子重排反应

M B B B A A A B M B M B (亲核重排) (亲电重排) (自由基重排)
A M A M A
M=迁移基团(migration group);Y=离去基团; A=重排始点;B=重排终点
2013-8-23 6
根据迁移基团的距离,重排还可分为1,2-、1,3-、 1,4-、 重排。 大多数反应属于分子内1,2-重排,即迁移基团经 “桥”离子迁移到相邻原子上。
2013-8-23
3
2.4 分子重排反应
有机化学的反应中,经常涉及反应过程中分子骨架 发生改变的问题。例如E1反应中双键的移位,傅克烷基化反应中直链烃基转变为支链烃基等。
+ CH3CH2CH2Cl AlCl3
CH CH 3 CH 3
+
CH 2CH 2CH 3
) 正丙苯(35~31% 异丙苯(65~69% )
2013-8-23
5.
贝耶尔-菲林格重排
另一种将酮转变为羧酸衍生物的方法是酮与过酸作用 成酯的反应。该反应称为贝耶尔-菲林格(BaeyerVilliger)重排。
OH R2CO OH R R O+ RCOOR R'CO3H O R2C O O CR'
2013-8-23
18
6. 杰米扬诺夫重排 脂肪族或脂环族伯胺经重氮化作用,脱氮形成碳正 离子所发生的重排称为Demjanov重排。脂环族伯 胺重排后经常发生环缩小或扩大的反应,可用来 合成三到六元环。反应机理与瓦-梅重排相似。
而分子内重排则与其它分子无关,迁移基团自始至
终没有脱离原来的分子,仅从分子的一部分迁移到 另一部分。
2013-8-23
5
根据迁移基团和迁移终点电荷的性质,重排还可分 为正离子重排、负离子重排和自由基重排等。 它们分别为迁移基团迁移到正离子、负离子和自由 基上的反应。
分子重排反应

7.The Lossen Rearrangement
The O-acyl derivatives of hy droxamic acids give isocyanates when treated with bases or sometimes even just on heating in a reaction known as the Rearrangement
Mechanism :
CH3
+ CH3 CH3 H C C CH3 OH OH
CH3
CH3 CH3 C C CH3 H2O OH +OH2
CH3 C C CH3 O CH3
CH3 CH3 C C CH3 OH CH3
+
CH3 CH3 C C CH3 +OH CH3
H+
CH3
(1)The stable cation formed superior + Ph C CH H Ph2C CH2
NH2 HNO2 OH CH2NH2 OH HNO2
CHO
O
(3)Mixtures are ofen produced,and which group
preferrntially migrates may depend on the reaction conditions as well as on the nature of the substrate.
CH3 O O C C CH3 CH3 OH H2O
-
CH3 C C O O
CH3
O O C C CH3 CH3 C C O
OH H2O
-
O C C CH3 CH3 C C O
(3): If NaOH was replaced by NaOMe or tBuONa, α-hydroxycarboxyester will be produced O O
分子重排反应

分子重排反应嘿,朋友们!今天咱们来聊聊分子重排反应这个超有趣的化学现象,就像是分子们在玩一场超级变变变的游戏呢!先来说说贝克曼重排反应吧。
你可以把分子想象成一群调皮的小木偶,在这个反应里,酮肟就像一个接到特殊指令的小木偶。
它的结构就像一座小房子,然后“啪”的一下,经过反应这座小房子的布局就变了,变成了酰胺。
反应方程式是:R - C(=NOH) - R' → R - CONH - R',就好像小木偶从一个造型突然变成了另一个超级酷炫的模样。
再看看频哪醇重排反应。
频哪醇分子就像一对手拉手的小伙伴,原本开开心心的。
可是一旦反应开始,就像是有个魔法棒一挥,其中一个小伙伴突然被拉到了另一个位置,变成了频哪酮。
反应方程式:(CH₃)₂C(OH) -C(OH)(CH₃)₂ → (CH₃)₂C = O + (CH₃)₂CHOH,这就好比原本和谐的二人组合,突然变成了一个主唱和一个伴舞的新组合。
还有霍夫曼重排反应呢。
酰胺分子像是一群等待检阅的士兵,在反应的号角吹响后,它们就开始大变身。
像是从普通的步兵一下子变成了特种部队,最后变成了胺。
反应方程式:RCONH₂ + Br₂ + 4NaOH → RNH₂ + 2NaBr + Na₂CO₃ + 2H₂O,这就像士兵们换上了全新的装备,执行新的任务去了。
接下来是克莱森重排反应。
这个反应中的分子就像一群在跳广场舞的大妈们,一开始的排列方式是一种,随着音乐节奏(反应条件)的变化,大妈们迅速调整了站位,形成了新的结构。
反应方程式:烯丙基芳基醚在加热条件下发生重排反应,具体方程式比较复杂,但就像广场舞队形的神奇转变一样有趣。
再聊聊弗里斯重排反应。
酯分子像是住在不同楼层的邻居,反应就像是一场房屋大改造,邻居们都换了楼层住。
反应方程式:Ar - O - CO - R → o - (or p - )Ar - CO - OH,就像邻居们从熟悉的家搬到了新的住所,整个社区(分子结构)都变了样。
重排反应

R O C C R'
H2O R'OH O C CH R NH3 R'NH2
RCH2COOH RCH2COOR' RCH2CONH2 RCH2CONHR'
阿恩特-埃斯特尔特(Arndt-Eistert)合成
R'COOH R'COX CH2N2 R'COCH=N2 H2O R'CH2COOH
制备多一个碳的羧酸
第六章
重排反应
Rearrangement Reaction
定义:受试剂或介质的影响,同一有机分子内的一个基团
或原子从一个原子迁移到另一个原子上,使分子构架发生 改变而形成一个新的分子的反应称为重排反应。
W A B A W B
A:重排起点原子,B:重排终点原子,W:重排基团
分类: 离子型机理(亲核重排,亲电重排) 自由基重排 周环机理重排(σ-键迁移重排)
4
AlCl3
Et2O
PhCH2NHPh
2、Hofmann重排
酰胺用溴(或氯)和碱处理转变为少一个碳原子的伯胺的 反应。又叫Hofmann降解反应。
O R C NH2
NaOX
机理:
O R C NH2
or X2/NaOH O Br2 R C NH Br -HBr
RNH2
OH O R C N Br
-Br
O EtO EtONa
Cl
CH2COOEt C 所连接的取代基越少越稳定
CH3 Br H3C C EtONa C CH3 Br H3C C C O CH2 EtO Br H3C O C C OEt H3C EtOOC C CH2 CH2 Br C CH2
COOEt
第八章_分子重排
1、经过正离子重排
• 片呐醇(Pinacol)重排——分子内C→C重排 • 不对称的取代乙二醇中,两个羟基中电子云
密度大的那个首先质子化。
H+
C CH2OH OH
_ H2O
C CH2OH _ H+
_ H+
C CH2 OH
C CHO H 主要
C CH2 O
次要
1、经过正离子重排
• 片呐醇(Pinacol)重排 ——分子内C→C重排
COOH PhNH2
Br OH
Br
Br
O2N
Ph
O2N
N OH PCl5
Br
NHCOPh O2N H2O
Br
NH2 Br
PhCOOH
1、经过正离子重排
• 贝克曼(Beckmann)重排 • ——分子内C→N重排
• The shift will keep the stereostructure of chiral center
• 以上两种历程可以通过不同底物的交叉实验 得以判别
重排反应的分类
• 2、按照所经历的活泼中间体或历程分类: • 经过正离子重排 • 经过负离子重排 • 经过卡宾Carbene 、氮宾Nitrene重排 • 周环重排反应——Pericyclic • 自由基重排——Radical
重排反应的分类
Nucleophilic rearrangement, Electrophilic rearrangement, Radical rearrangement, etc.
CH3 H3C C CH CH2
HCl
H3C
CH3CH3
CH3
C C CH3+ H3C C CH CH3
分子重排

反应机理: Claisen 重排是个协同反应,中间经过一个环状过渡 态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由 酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重 排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基 占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对 位,然后经互变异构得到对位烯丙基酚。
亲核重排反应
重排过程,Z带着一对电子从原子C迁移到另一个缺 少一对电子的原子A上。 多数亲核重排是1,2-重排,即 基团的迁移发生于相邻的两个原子间。上式中,A为 C、N、O等原子,而Z为X、O、S、N、C、H等原子。 重排后的分子与反应体系的负性部分结合生成重排取代 产物或失去质子生成重排消除产物。
值得注意的是游离基重排的限度比碳正离子小 的多。在上述实例中只有50%转移。再就是这里没 有甲基转移,一般在常温情况下不发生甲基的游离基 转移.除芳基以外,乙烯基和乙酰氧基、卤素也能转 移。迁移基团的重排动力是形成更稳定的游离基,但 在常温条件下,一般不发生烷基或很少发生氢的迁 移.这是因为芳基的1,2迁移形成一个离域的桥式芳 基游离型中间体或过渡状态,他比烷基迁移通过五价 碳结构在能量上更为有利。尽管甲基迁移可产生更 为稳定的游离基.
烷基芳基酮重排时,一般是芳基进行迁移,如:
Lossen(洛森)重排
异羟肟酸或其酰基衍生物单独加热,或在SOCl2 、 P2O5 等脱水剂存在下加热,发生重排得到异氰酸酯,再经水解生 成伯胺.
反应机理(当R是手性碳原子时,重排后其构型保持不变 ):
反应实例:
Beckmann(贝克曼)重排
《有机化学重排反应》课件

THANKS
感谢观看
详细描述
重排反应通常涉及分子内部的重排,包括电子、质子和原子的重新排列,这种 重排可以发生在分子内或分子间,并伴随着键的断裂和形成。重排反应通常伴 随着键能的变化,需要一定的活化能来启动反应。
重排反应的重要性
总结词
重排反应在有机化学中具有重要的意义,它涉及到许多有机化合物的合成、转化和降解过程。
详细描述
重排反应的动力学与热力学
动力学研究
分析重排反应的动力学特征,如反应 速率常数、活化能等,以及如何影响 反应进程。
热力学研究
探讨重排反应的热力学性质,如反应 熵变、焓变等,以及与反应条件的关 系。
重排反应的历程与过渡态
历程研究
揭示重排反应的具体步骤和中间体,以及各 步骤之间的相互转化。
过渡态研究
分析重排反应过程中的过渡态结构,以及如 何影响反应活化能和产物形成。
贝克重排反应是一种有机化学反应,涉及环丙烷环系的重排过程。在反应中,环丙烷环系通过加热或 其他能量源的激发,发生重排,生成新的化合物。
沃尔夫-凯惜纳重排反应
总结词
涉及芳香族化合物的重排反应
详细描述
沃尔夫-凯惜纳重排反应是一种有机化学反应,涉及芳香族化 合物的重排过程。在反应中,芳香族化合物通过加热或其他 能量源的激发,发生重排,生成新的化合物。
计算化学的应用
利用计算化学方法预测和优化 重排反应的途径和产物,提高
反应效率。
06
参考文献
参考文献
《有机化学重排反应》第二版,作者
01
XXX,出版社:XXX。
《有机化学重排反应》第三版,作者
02
XXX,出版社:XXX。
"有机化学重排反应研究进展",作者
分子重排反应

分子重排反应[摘要]利用稳定性原理对有机化学中常见的分子重排如亲核重排、亲电重排、自由基重排反应等作了简要的分析归纳,并介绍了有机化学中稳定性原理在分子重排反应中的应用.[关键词]稳定性结构的中间体及其产物;亲核重排;亲电重排;自由基重排[Abstract]the stability principle of organic chemistry in the common molecular rearrangements such as nucleophilic rearrangement, electrophilic rearrangement,free radical rearrangement reactions are briefly summarized analysis,and introduced the stability principle of organic chemistry in molecular rearrangement reaction and its application.[Key words]stability structure of the intermediates and products;nucleophilic rearrangement;electrophilic rearrangement;free radical rearrangement分子重排,就是指在试剂、加热或其它因素的影响下,分子中某些原子或基团发生转移或分子碳胳发生改变生成新的物质的反应.新的物质能否生成,取决于反应产物的稳定性.由反应物转化为产物,如果体系趋向于越稳定,则反应趋势就越大,反应将进行得越完全,反应产物越易生成.稳定性包括各类基本反应的中间体(如碳正离子、碳负离子、自由基等)及异构现象.利用稳定性来指导实践,探索新的合成途径,设计新的分子,这些理论在有机化学中占有相当的地位.所以它也决定了分子重排在理论和应用上的重要性.1、频呐重排频呐醇类(即邻二醇类)在强酸的催化作用下进行重排反应生成频呐酮类化合物,被称为频呐醇重排。
4.分子重排

二、分子重排反应历程的研究方法
• 重排反应历程的研究是很复杂的, 重排反应历程的研究是很复杂的 , 凡是 能够影响反应历程的各种因素, 能够影响反应历程的各种因素,如反应物的 性质、试剂的性质、溶剂的极性、温度、 性质、试剂的性质、溶剂的极性、温度、催 化剂等都应考虑。 化剂等都应考虑。研究上经常采用中间体的 分离及鉴定法、交叉实验法、示踪原子法、 分离及鉴定法、交叉实验法、示踪原子法、 立体化学研究及动力学研究等方法, 立体化学研究及动力学研究等方法,下面介 绍三种方法。 绍三种方法。
• 。
CH 3 H 3C C CH 2 CH 3
H 3C C CH 2CH 3 CH 3
• 又如α-蒎烯重排生成菠基氯(氯化莰)也是 又如α 蒎烯重排生成菠基氯(氯化莰) 张力减小的过程。 张力减小的过程。
HCl
Cl
• • • • • •
形成缺电子体系主要有下面四种方法: 形成缺电子体系主要有下面四种方法: 碳正离子的形成。 (a)碳正离子的形成。 氮烯的生成。 (b)氮烯的生成。 碳烯的形成。 (c)碳烯的形成。 缺电子氧原子的形成。 (d)缺电子氧原子的形成。 其中以形成碳正离子与氮烯的两种方法 最为重要。 最为重要。下面即根据生成缺电子中心的四 种方法、分别介绍碳正离子重排, 种方法、分别介绍碳正离子重排,缺电子氮 原子参加的重排、缺电子氧原子的重排、 原子参加的重排、缺电子氧原子的重排、碳 烯的重排等。 烯的重排等。
2
• (四)中间体的研究 • 重排反应中生成的中间体有的可以通过分 离、鉴定或捕捉来进行研究。 鉴定或捕捉来进行研究。 • 例如Beckmann Beckmann重排中生成的活性中间体可 例如Beckmann重排中生成的活性中间体可 加入试剂进行捕捉。 加入试剂进行捕捉。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3、片呐醇(Pinacol)重排
当用无机酸及其酰氯等处理邻二叔醇时发生的重排 称为片呐醇重排,重排的产物称片呐酮。
R2 R3 R C
1
C R
4
H2SO4
R2 R1 C C R3 O R4
CH3 C6H5 C C CH3 C6H5 O
OH OH
CH3 CH3 C6H5 C C C6H5 OH OH
H2SO4
4、Schmidt重排
羧酸、醛、酮等与叠氮酸在强酸作用下重排生成伯 胺及酰胺的反应称为施密特(Schmidt)重排。
RCOOH + HN3 H2SO4 R NH2 + N2 + CO2
酮的Schmidt重排实际生成取代酰胺。
O R C R + HN3 O H2SO4 R C NH R + N2
如:
丁二酰亚胺也可以发生Hofmann重排,生成氨基丙 酸。
O CH2 CH2 C C NH O KOBr + 2KOH CH2NH2 CH2COOH
3、Curtius重排
柯提斯(Curtius)重排是指酰基叠氮化物在加热时 重排为异氰酸酯的反应。反应中失N2生成乃春中间 体。迁移基团可以为各种烃基、杂环基及含各种官 能团的,反应可以用质子酸催化,但不用催化剂, 仅加热就可以得到好产率。酰基叠氮化物一般由酰 氯与叠氮化钠作用得到。
Et n-Bu C Me H N OH O C Me Et n-Bu NH H
95% H2SO4
2、Hofmann重排( Hofmann降级) Hofmann重排指氮原子上没有取代的酰胺在碱性介 质中与卤素作用重排为异氰酸酯,后者在碱性介质 中继续水解生成伯胺和二氧化碳的反应。
O R C NH2 + Br NaOH Br _ HBr O H R C N OH Br _ HBr 消除反应 R N C O 异氰酸酯 H2O O R C N Nitrene
CH3 OH CH3 O CH3 CH3 反位迁移
除邻位二醇外,卤代醇、氨基醇等也可以起类似的 重排反应。如:
C6H5 CH3 C CH2I OH CH3 C CH2C6H5 OH CH3 CH3
CH3 C C CH3 OH NH2 CH3 C C(CH3)3 OH
HgO
C6H5 CH3 C CH2 OH
产物(B)中发生了双键位移,这种烯丙基系统中双键 发生位移的反应称为烯丙基重排。
C6H5
CH CH CH2 OH
H
C6H5
CH CH CH2OH
CH3CH CHCH2Cl
NaOH CH3CH CHCH2 H2O CH3CH CHCH2OH CH3CHCH CH2 H2O CH3CHCH CH2 OH
N OH H2SO4 90~95 。 C NH O
己内酰胺(尼龙-6 的单体)
Beckmann重排的历程为:
R C R1 N OH H2O H R C R1 N OH2 R C R1 N HO C R1 R N C R1 R N O C R1 NHR
H2O C R1 _ H R N
以上几步在反应中几乎是连续同时发生的,转移基 团只能从羟基的背面进攻缺电子的氮原子,因此基 团为反位迁移,反应产物有立体专一性。
O
For example:
.
H2SO4 OH OH
mechanism:
.
H+ OH OH OH2 OH
-H2O OH
- H+ HO O
当片呐醇中两个羟基所连基团不同时,则羟基离去 能力的大小取决于生成碳正离子的稳定性。能生成 更稳定的碳正离子的一边的羟基优先离去。
C6H5 C6H5 C CH CH3 OH OH C6H5 C6H5 CH C CH3 O
第八章 分子重排反应
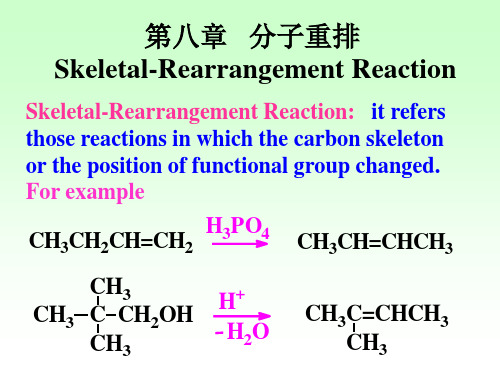
在有机化学反应中,取代基从一个原子迁移到另 一个原子上,碳胳或官能团的位置发生变化的一 类反应称为分子重排。分子重排反应是一类很重 要的有机反应,对于研究反应历程、了解有关的 有机反应及有机合成都具有很重要的意义。
一、分子重排反应的分类
分子重排反应有多种分类方法: 1、按反应历程分类:亲核重排(缺电子重排)、亲 电重排(富电子重排)与自由基重排。 2、按元素分类:CC、CN、CO、 NC、 OC、OP等重排。 3、按有机化合物类型分类:脂肪族化合物重排、芳 香族化合物重排及杂环化合物重排。
实际上重排的邻二醇并不一定是邻二叔醇,有时 叔仲醇或双仲醇也能发生片呐醇重排。例如:
C6H5 C6H5 C CH CH3 OH OH H2SO4 C6H5 C6H5 CH C H O CH2 CH2 CH CHO H2SO4 C6H5 C6H5 CH C CH3 O
C6H5 CH CH C6H5 OH OH CH2 CH2
CH3CH2CH2NH2 HNO2 CH3CH2CH2N N H2O _H _N OH CH3CHCH3 H CH3CHCH2
2
CH3CHCH3
脂环族伯胺与亚硝酸作用可以得到环的扩大或缩小 的产物。如果形成的碳正离子其正电荷在脂环基的 碳原子上,则发生环的扩大;正电荷如果在环上, 则可能发生环的缩小。
(2) 通过重排转变成稳定的中性化合物。
R 2C CR2 H 片呐醇重排 R 3C C R O
OH OH
(3)重排后减少空间张力。
CH3 CH3 C CH2 CH3
张力大
CH3
C CH2CH3 CH3
张力小
又如蒎烯重排生成菠基氯也是张力减小的过程。
Cl
HCl 蒎烯
菠基氯(氯化莰)
形成缺电子体系主要有下面四种方法: (a) 碳正离子 的形成,(b) 氮烯的生成,(c) 碳烯的形成,(d) 缺电 子氧原子的形成。其中以形成碳正离子与氮烯的两 种方法最为重要。
(2)迁移基团带着一对电子迁移至六电子原子上。 (3)最后通过与亲核试剂作用或发生消去等形成产物。
Z A B L (1) Z A B 重排 (2) Z A B (3) Nu Z A B
有时其中两步或三步实际上是几乎同时发生的。
亲核重排中绝大多数为1,2-重排,重排的动力一般来 自三个方面:
(1) 重排成更加稳定的正离子。
2
(三)缺电子氧的重排 和碳原子及氮原子相比,氧原子电负性更大,形成 缺电子氧所需要的能量更大,该体系更不稳定,一 般不大可能作为单独的电正性的质点存在于体系中, 所以其分子内部重排的特点更为明显。 1、Baeyer-Villiger重排
酮被过氧化氢或过氧酸氧化生成酯的反应称为 Baeyer-Villiger重排。在此反应中,开链酮氧化成一 般酯,环酮则氧化成内酯。如:
_H
I比OH更容易离去
CH3CCH2C6H5 O
CH3 CH3 CH3 C OH CH3 C C(CH3)3 O C CH3
HNO2 _N 2 _H
4、烯丙基重排
烯丙基卤化物在SN1反应条件下,能生成较稳定的离 域的碳正离子,与亲核试剂作用可得到两个互为异 构体的取代产物。
R CH CH CH2X R CH CH CH2 Nu R CH CH CH2Nu + R CH CH CH2 Nu (A) (B)
当酮肟具有两种顺反异构体时,重排的产物也有两种。 如:
C N OH _ C OCH3 PCl5, 10 。 O C NH OCH3
C HO N
_ C OCH3 PCl5, 10 。
C O HN OCH3
如果迁移基团是手性碳原子,迁移后,其构型保持 不变。如下面的酮肟重排后生成99%光学纯的酰胺。
在简单的链状化合物中也常发生Wagner-Meerwein 重排。最常见的为醇在酸性条件下发生的重排。
CH3 CH3 C CH2OH CH3 CH3 CH3 C CH2 CH3 CH3 CH3 CH3 CH3 C CH2OH2 CH3 C CH2CH3 Cl CH3 CH3 C CH2CH3 Cl _H O 2
R NH2 + CO2
在酰胺分子中可以转移的只有一种烃基,烃基的性 质可影响转移的速度。给电子的烃基反应速度高, 吸电子的烃基反应速度低。而且具有手性碳原子的 R转移时并不消失其光学活性,保持了原构型。
CH3 C6H5 C CONH2 H Br2 + NaOH CH3 C6H5 C NH2 + CO2 H
O R C Cl + NaN3 O R C N N N _N O R C N Nitrene R N C O H2O OH R NH2 + CO2
2
例如:
Me2CHCH2COCl + NaN3 CHCl3 Me2CHCH2 N C O Me2CHCH2CON3 H2O Me2CHCH2NH2 + CO2 70%
H2SO4ຫໍສະໝຸດ (C6H5)2CC(CH3)2
H+
(C6H5)2C
CCH3
OH OH
CH3 O
基团迁移倾向的大小顺序是芳基 > 烷基。氢原子的 迁移能力表现得不规则,一些场合下迁移能力小于 烷基,但某些场合下又优于芳基。在芳基中,当位 阻不太大时迁移能力则取决于基团的亲核能力。
取代苯基 相对迁移能力 MeO 500 Cl OMe 1.00 0.7 0.3 Me Me 15.7 1.95
HCl
氢也可以作为迁移基团,如:
H CH3 H CH3 C CHCH3 CH3 CH3 C CH2CH3 CH3 Cl CH3 C CHCH3 CH3 OH H HCl CH3 C CHCH3 CH3 OH2 Cl C CH2CH3 CH3 _H O 2
2、Demyanov重排
捷姆扬诺夫(Demyanov)重排是指脂肪族或脂环族伯 胺与亚硝酸作用发生的一种重排。
CH2COOH
HN3 H2SO4
