第七章重排反应
大学有机化学反应方程式总结重排反应

大学有机化学反应方程式总结重排反应反应方程式是有机化学中非常重要的一部分,它描述了化学反应中物质的转化过程。
在大学有机化学中,我们学习了各种各样的反应方程式,其中包括重排反应。
本文将对大学有机化学中的重排反应进行总结,介绍其机理和一些典型反应。
1. 环丙烷重排反应(C1C2速度放缓)在环丙烷分子中,碳原子1和碳原子2之间为一个甲基基团,环丙烷重排反应就是指这个甲基基团发生位移,形成其他异构体的过程。
环丙烷重排反应可以发生两种类型的重排:1,2-重排和1,3-重排。
1,2-重排:环丙烷中的甲基基团发生位移,形成丙烯和丙烯烷的异构体。
1,3-重排:环丙烷中的甲基基团发生位移,并且环丙烷的碳原子2和碳原子3之间的键断裂,形成丙烯和甲烯烷的异构体。
2.1-甲基移位反应1-甲基移位反应是指分子中一个碳原子上的甲基基团在反应中发生迁移,形成另一种异构体。
这种反应在很多有机化合物中都可以观察到,例如烷烃、烯烃等。
3. α,β-不饱和酮的Knoevenagel缩合反应Knoevenagel缩合反应是α,β-不饱和酮与活性甲基化合物(如甲醛、甲基丙烯酮等)在碱的催化下进行的加成反应。
这个反应的机理涉及羰基亲核加成和酸碱中和等步骤。
4. 列维架桥异构化反应列维架桥异构化反应发生在某些烯烃和孤立的单质金属之间的反应中。
该反应可以形成由金属和碳原子构成的稳定的配位化合物。
总结:大学有机化学中的反应方程式总结重排反应,包括环丙烷重排反应、1-甲基移位反应、α,β-不饱和酮的Knoevenagel缩合反应和列维架桥异构化反应等。
这些反应在有机合成中具有重要的地位,对于理解有机反应的机理和应用具有重要意义。
在学习和运用这些反应时,我们需要深入了解它们的机理,并且掌握相应的实验操作技巧。
7 重排反应
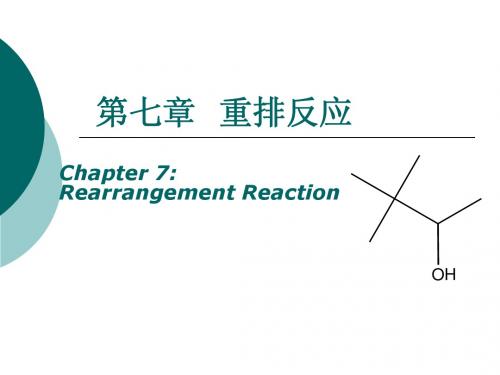
Ag+ H3C C CH2 CH3 CH3 H3C C CHCH3 CH3
CH3 Ph C H C OTs
△
H3C
C
H C
Ph
CH3 CH3
CH3 CH3
苯的迁移速度为甲基的3000倍
Wangner-Meerwein重排
反应实例
H3C CH2 CH2Br AgNO3 H3C CH2 CH2 H3C CH CH3 Br H3C H C Br CH3
1 四取代乙二醇 (a)四个取代基相同,单一产物
(b)对称
R1 R1 R2 C C R2 OH OH
得单一产物
CH3CH3 Ph C C Ph
Ph H2SO4 冷却 Ph C C CH3
OH OH
CH3O 迁移基团电荷密度越高越有利于迁移
频纳醇重排(Pinacol)
(C)
R' R R' C C R
O R C NH2
NaOX or X2/NaOH
RNH2
Hofmann重排
机理:
O R C NH2
Br2 -HBr
H R C N
O
Br
OH
O R C N Br
-Br
R
O C
N
O
C N R
H 2O
HO C N HO
HO C N R
R
HO CH OH
H N
R
△
CO2 + NH2R
HOCH3
H3CO C NHR O
CH3CH2CH=CH2 H3PO4 CH3CH=CHCH3
CH3
CH3 C CH2OH CH3
H+ H2O
第七章分子重排反应3

+ (CH3)2C=C(CH3)2 61%
反应机理是: 醇首先在酸作用下脱去羟基形成碳正离子, 接着α-位的甲基带着电子对转移过来,使仲碳正离子 变成叔碳正离子。
⑴. 形成C+ 形式
(a) 卤代烃 Ag+ AgCl
(CH3)3C-CH2Cl
Ag (AgNO3)
(CH3)3C-CH2+AgCl
(b)含-NH2 重氮化放氮
M:迁移基团
Y:离去基团
A:重排始点 B:重排终点
离子型重排反应: 缺电子重排(亲核重排)
C— A— Y Z -Y C— A Z C— A— Z
富电子重排(亲电重排)
X— B— C Y -Y X— B— C B— C X
7.1 缺电子重排(亲核重排)
缺电子重排反应一般包括三个内容:缺电子中心的创 建;基团Z带着一对电子迁移到缺电子中心,同时原来迁移 的始点成为新的缺电子中心;最后通过与亲核试剂结合或 消除反应满足迁移始点的八隅体结构:
H2O
R NH COOH
CO2
+
RNH2
经过Nitrene的重排;
酰胺重排生成少一个碳的胺;
Hoffmann重排:RCOOH→RCONH2→RNH2 。
(1) (CH3)3C-CH2CONH2
Br2/NaOH
(CH3)3C-CH2NH2
CONH2 NH2
(2)
COOH Br 2 FeBr3 Br
(CH3)3C-CH3NH2
NaNO2 HCl
(CH3)3C-CH2N2Cl
-N2
△
(CH3)3C-CH2
(c) –OH 加 H+ (-H2O)
第7章 重排反应09
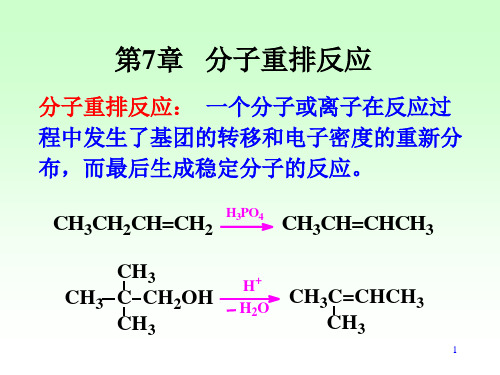
CH3 H3C C O Ph +OH2
PhOH
+
OH CH3 C CH3
O CH3 C CH3 + H+
31
脂肪族氢过氧化物也能发生类似反应: 脂肪族氢过氧化物也能发生类似反应:
R R C O OH R
H2O H
+
R R C O OH2 R
_
_
H2O
R R C O R
+
CH3 C O
CH3 C C6H5 + C6H5 C O C6H5
CH3 C CH3 C6H5
主要产物
15
下列反应的主要产物是什么? 下列反应的主要产物是什么?
OH OH H2SO4 CH3O Ph C C Ph _ H2O Ph Ph OCH3
CH3O
Ph O O Ph C C Ph + CH3O Ph C Ph OCH3 ( 28% )
1
H+ H2O
一、重排反应的分类
(一)按照分子内或分子间进行重排分为: 按照分子内或分子间进行重排分为: 1. 分子内重排 发生重排的原子或原 子团始终 分子内重排—发生重排的原子或原 没有脱离原来的分子。 没有脱离原来的分子。 2. 分子间重排—迁移的原子或原子团在没有重 分子间重排 迁移的原子或原子团在没有重 排到新的位置前,就完全与原来的分子脱离 就完全与原来的分子脱离。 排到新的位置前 就完全与原来的分子脱离。 以上两种历程可以通过不同底物的交叉实 验得以判别。 验得以判别。
6
二、分子重排反应 1、经过正离子重排 、
CH3 HCl H3C C CH CH2 CH3 CH3CH3 H3C C C CH3+ H3C Cl H (83%) CH3 C CH CH3 CH3 Cl (17%)
第7章_重排反应之芳环上的重排
AlCl
O
CH
O
进一步水解
O CH
OH
HO
CHCOOH
O
CH
HC
O
O
(2)克莱森(Claisen)重排
烯丙基芳基醚在高温(190℃~200 ℃)下,发 生[3,3]-σ迁移生成烯丙基酚的反应。
O O
慢
H
快 互变异构
OH
例:
O
CH3 H
OH
将苯腙在适当的催化剂下反应,脱氨后生成吲哚化 合物,称谓Fischer吲哚合成。 常用催化剂有:ZnCl2及其它金属卤化物,质子酸 或Lewis酸基对甲苯磺酸等
R' R N H R' N N H R' R N H R'
H+
R' R NH
R' R R NH2 NH2
H+
NH2 NH
+
R O
-NH4
H R' N H R NH
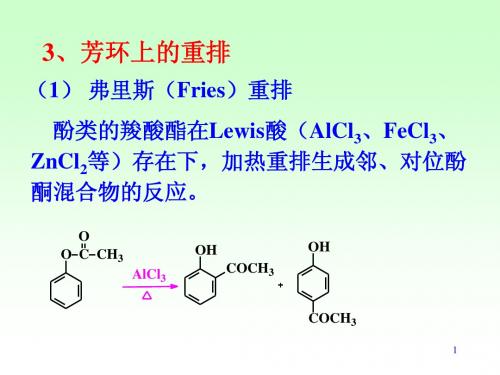
3、芳环上的重排
(1) 弗里斯(Fries)重排 酚类的羧酸酯在Lewis酸(AlCl3、FeCl3、 ZnCl2等)存在下,加热重排生成邻、对位酚 酮混合物的反应。
O O C CH3 AlCl3 OH COCH3 COCH3
1
OH
邻位和对位异构体的比率与反应的温度、 溶剂和催化剂有关,一般低温有利于产生 对位产物,高温有利于产生邻位产物。
H
CH3 H
8
H3C
H
CH3
反应机理:周环[3,3]σ迁移重排
1 O 2 1 2 3 3 H 1 1 O 2 2 3 3 H O H
[3,3]σ迁移 邻烯丙基苯酚
重排反应总结

重排反应总结1、什么叫重排反应?一般地,在进攻试剂作用或者介质的影响下,有机分子发生原子或原子团的转移和电子云密度重新分布,或者重键位置改变,环的扩大或缩小,碳骨架发生了改变等等,这样的反应称为重排反应。
简单的理解:重排反应是指反应中烃基或氢原子或别的取代基从分子中的一个原子迁移到该分子中的另一个原子上的变化。
(指分子内重排)2、重排的分类按反应机理 ,重排反应可分为:基团迁移重排反应和周环反应中的重排。
基团迁移重排反应 即反应物分子中的一个基团在分子范围内从某位置迁移到另一位置的反应。
常见的迁移基团是烃基。
基团迁移重排反应又包括缺电子重排(亲核重排),富电子重排(亲电重排)和自由基重排.。
周环反应中的重排包括电环反应、σ键迁移。
也可按照不同的标准,分成分子内重排和分子间重排,光学活性改变和不改变的重排反应等等。
本讲义把重排分为以下几类:a.从碳原子到碳原子的重排 b.从碳原子到杂原子的重排 c.从杂原子到碳原子的重排 d.其它重排一、从碳原子到碳原子的重排反应1、Wangner-Meerwein 重排(瓦格纳尔—米尔外英重排,简称瓦—米重排)两个相邻原子之间发生的重排叫1,2重排,也叫Wangner-Meerwein 重排。
如:醇或卤代烃在酸催化下进行亲核取代或消除反应时,烯烃进行亲电加成时发生的重排。
例如:a.亲电加成时发生的重排如果反应液中同时存在两种或是两种以上的亲核试剂,则通过中间体碳正离子,能够生成混合加成产物。
R 2C R 3R 1C OHR 4R 5R 2C R 3R 1CR 4R 5R 1CR 2C R 3R4R 5R1CR 2CR 3R 4R 5OH H +(-H O)重排H O(-H +)b.醇进行亲核取代和消除时的重排亲核取代时,除大多数伯醇难以形成正碳离子而按S N 2反应外,仲醇或叔醇反应常伴随着重排产物的产生。
(S N 1)消去时(S N 1):c.卤代烃进行亲核取代和消除时的重排亲核取代按S N 1机理反应时伴随着碳正离子的重排 消去时注意:有碳正离子形成时,就有可能伴随着重排反应 形成C +的方式总结: (a)卤代烃 (AgNO 3醇溶液) (b)含-NH 2,重氮化放氮气(c)-OH ,加 H + (失H 2O),烯烃加H +基团迁移顺序:对迁移顺序的理解:迁移基团的电子云密度越大越容易迁移(但具体情况下,要具体分析)(CH 3)3C-CH 2Cl(CH 3)32Ag (AgNO 3(CH 3)3C-CH 2N 2Cl-N 2(CH 3)3C-CH 2(CH 3)3C-CH 3NH 2NaNO 2△(CH 3)3C-CH 2OH (CH 3)3C-CH 2=CH 2(CH 3)32(CH 3)33H +2H +ClR 3C-R 2CH-RCH 3-CH 3-H->>>>>>OCH 3>反应举例:2、Pinacol (频哪醇)重排(邻二醇重排)当起始物的脱水产物能产生两种不同的正离子时,总是生成更稳定的正碳离子为主,有不同迁移基团时,按迁移的难易程度进行。
第七章 分子重排反应

C O
C R
N
N
Cu2+
H2O R'OH O C CH R NH3 R'NH2
RCH2COOH RCH2COOR' RCH2CONH2 RCH2CONHR'
(5)氮烯重排 )
(1). Hofmann重排 重排 酰胺在次卤酸盐(如Br2/NaOH)的作用下,重派后继而水解 /NaOH)的作用下 的作用下, 酰胺在次卤酸盐( 生成少一个碳原子的伯胺。又叫霍夫曼降级。 生成少一个碳原子的伯胺。又叫霍夫曼降级。
(6) . Beckmann (贝克曼)重排 贝克曼)
醛肟或酮肟在酸性催化剂作用下重排生成取代酰胺的反应
R ' R C N O OH H R C NHR '
机理: 机理:
R R' C N OH2
R
C
N
R'
R
C
N
R'
亲核重排
H2O
RCONHR'
RCOOH + R'NH2
(7) . Baeyer-Villiger (拜耶尔 维利格)重排 拜耶尔-维利格 维利格)
R R
OH-
R R C C O C
R R
OH
R2CHCR2CO2 H
7.3 芳环上的重排
(1)联苯胺重排 )
在强酸催化下,氢化偶氮苯类重排生成 , 二氨基联苯 在强酸催化下,氢化偶氮苯类重排生成4,4`-二氨基联苯 类的反应。 类的反应。
NH NH
H+ ~70%
H2N
,
H2N ~30% NH2 H2N
苯甲基三烷基季铵盐(或锍盐)在PhLi、NaNH2等强碱作用下 苯甲基三烷基季铵盐(或锍盐) 、 发生重排,苯环起亲核烷基化反应,烷基的α-碳原子与苯环的 发生重排,苯环起亲核烷基化反应,烷基的 碳原子与苯环的 邻位碳原子相连成叔胺。 邻位碳原子相连成叔胺。
有机化学中的重排反应

有机化学中的重排反应重排反应是有机化学中一类重要的反应类型,它指的是在分子内,原子的连接方式发生改变,形成不同的同分异构体或结构异构体的化学反应。
重排反应在有机化学领域具有广泛的应用和重要的理论意义。
本文将介绍几种常见的有机化学重排反应及其机理和应用。
一、Wagner-Meerwein重排反应Wagner-Meerwein重排反应是一类重要的碳正离子重排反应,它指的是烷基或芳基正离子的骨架发生重新排列的反应。
该反应的机理是通过重排步骤使得碳正离子的位置发生变化。
例如,烷基正离子在重排反应中可以通过氢的迁移、碳骨架的迁移或者亲电自由基的捕获等方式形成不同位置的同分异构体。
Wagner-Meerwein重排反应在合成有机化合物中有着广泛的应用,可以用于构建碳骨架、生成复杂的天然产物分子以及合成药物等领域。
二、Claisen重排反应Claisen重排反应是一类重要的氧化重排反应,它经常用于合成酮或醛类化合物。
该反应是通过氧的迁移和碳骨架的重排来转化一个氧杂环底物或氧杂环中间体到另一个化合物。
Claisen重排反应在有机合成中得到了广泛的应用。
通过选择合适的底物和条件,可以有效地实现各种氧杂环化合物的合成和转化。
三、Hofmann重排反应Hofmann重排反应是一种氮杂杂环化合物的重排反应,它可以将一些含有氮杂杂环的底物转化为相应的醇、酮或醛化合物。
该反应的机理是通过化学键的断裂和重组来完成的。
Hofmann重排反应在有机合成中具有重要的应用,可以实现对氮杂杂环底物的立体和功能改变。
同时,该反应也是许多天然产物的合成关键步骤之一。
四、Beckmann重排反应Beckmann重排反应是一种重要的氮杂环重排反应,它将氮杂杂环化合物转化为酸中的相应醛或酮类化合物。
该反应的机理是通过氮杂杂环中氧原子的迁移和化学键的重组来实现的。
Beckmann重排反应在有机合成中得到了广泛的应用,可以用于合成酮和醛类化合物,为药物和天然产物的合成提供了重要的方法。
重排反应_精品文档

重排反应7重排反应重排反应指同一分子内,其中一原子或基团从一个原子迁移到另一个原子形成新的分子的反应。
利用重排常常可以合成用其它方法难以合成的物质。
其反应机理不外乎亲核、亲电和自由基几种。
按其迁移的方式大致可分为从碳原子到碳原子的重排、从碳原子到杂原子的重排以及从杂原子到碳原子的重排等几种。
7。
1从碳原子到碳原子的重排从碳原子到碳原子的重排使碳骨架发生变化。
其中典型的重排包括亲核1,2-重排和亲电1,2-重排。
前者包括Wagner-Meerwein重排和Pinacol重排;后者包括Wolf和Arndt-Eitert重排等。
7。
1、1Wagner-Meerwein重排在质子酸或Lewi酸催化下形成的碳正离子中,烷基、芳基或氢从正离子相邻的碳原子上迁移到正离子上的反应,称为Wagner-Meerwein重排。
生成更稳定的碳正离子或产物成为重排的动力。
反应示例:双环二烯酮重排为四氢萘酚。
用质子酸处些环外烯烃可致重排。
7。
1、2Pinacol重排酸催化下,邻二醇脱水重排为醛或酮的反应称为Pinacol重排。
(1)四取代邻二醇的重排如果四个取代基相同,单一产物。
如果是对称的邻二醇,产物分配主要取决于迁移基团的迁移能力。
迁移能力可能与亲核能力正相关。
一般而言,芳基>烷基>氢。
对位供电子基取代的芳基>未取代的芳基>邻位取代的芳基(空间障碍)。
如果是不对称的邻二醇,产物分配主要取决于形成的碳正离子的稳定性,与迁移基团的迁移能力关系不大。
不对称Pinacol重排的选择性不是太好,常常得到混合物,在药物合成上的意义不太大。
(2)三取代邻二醇的重排对于三取代的邻二醇,其中的叔碳上形成的碳正离子较稳定,所以一般是仲碳上的基团(或氢原子)迁移。
如果需要叔碳上的基团迁移,可采用衍生物法在碱性条件下重排。
(3)脂环上的邻二醇重排羟基位于脂环上的邻二醇的重排常导致脂环结构的变化。
螺环形成:羟基共环的情形:如上,对于羟基共环的情形,总是处在离去的羟基反式的基团迁移,这在一定程度上说明Pinacol重排可按分子内SN2机理进行。
《有机化学重排反应》课件

THANKS
感谢观看
详细描述
重排反应通常涉及分子内部的重排,包括电子、质子和原子的重新排列,这种 重排可以发生在分子内或分子间,并伴随着键的断裂和形成。重排反应通常伴 随着键能的变化,需要一定的活化能来启动反应。
重排反应的重要性
总结词
重排反应在有机化学中具有重要的意义,它涉及到许多有机化合物的合成、转化和降解过程。
详细描述
重排反应的动力学与热力学
动力学研究
分析重排反应的动力学特征,如反应 速率常数、活化能等,以及如何影响 反应进程。
热力学研究
探讨重排反应的热力学性质,如反应 熵变、焓变等,以及与反应条件的关 系。
重排反应的历程与过渡态
历程研究
揭示重排反应的具体步骤和中间体,以及各 步骤之间的相互转化。
过渡态研究
分析重排反应过程中的过渡态结构,以及如 何影响反应活化能和产物形成。
贝克重排反应是一种有机化学反应,涉及环丙烷环系的重排过程。在反应中,环丙烷环系通过加热或 其他能量源的激发,发生重排,生成新的化合物。
沃尔夫-凯惜纳重排反应
总结词
涉及芳香族化合物的重排反应
详细描述
沃尔夫-凯惜纳重排反应是一种有机化学反应,涉及芳香族化 合物的重排过程。在反应中,芳香族化合物通过加热或其他 能量源的激发,发生重排,生成新的化合物。
计算化学的应用
利用计算化学方法预测和优化 重排反应的途径和产物,提高
反应效率。
06
参考文献
参考文献
《有机化学重排反应》第二版,作者
01
XXX,出版社:XXX。
《有机化学重排反应》第三版,作者
02
XXX,出版社:XXX。
"有机化学重排反应研究进展",作者
第七章 重排反应

Ph
先考虑碳正离子的稳定性,然后考虑基团的迁移 能力
16
如将化合物(14)用含少量硫酸的醋酸或含无 水氯化锌的醋酐处理,则主要得到苯基迁移的 产物(18)。
CH Ph CH Ph 3 3 CH PhPh C C C C CH 33 OHOH OH OH (14) (14)
Ac Ac 2O/ZnCl 2O/ZnCl 22 (85%) (85%)
(94%)*
(94%)*
(6%)*
(6%)*
13
②不对称的邻二醇的重排
结构:
R1 R1 C R2 C R2
R2 R1 C
R3 C R4
OH OH
OH OH
重排的方向主要决定于羟基失去后所 生成碳正离子的稳定性;
14
如化合物(13)重排得到的是苯基迁移的产 物。
C6H4OCH3-p Ph p-CH3OC6H4 (13)
(3)羟基位于脂环上的邻二醇的重排
羟基位于脂环上的邻二醇化合物重排后,可 引起环的扩大或缩小,如一个羟基位于脂环上 的化合物(25),重排后得扩环产物:
OH OH
(25) (25) Ph Ph Ph Ph
H2SO H2SO 4/Et 2O 4/Et 2O
O O Ph Ph (99%) Ph (99%) Ph
HONO HONO NH NH HONO 2 2 NH 2 -N N 2-N 2 2 HO 2 O H2 O H 2
ห้องสมุดไป่ตู้
CH O 2CH CH 2OH
用这种重排可制备有张力的脂环化合物。
6
在研究甾体化合物时,欲制备C(环)-加碳D(环)-双失碳甾体化合物,可用16-氨基-D (环)-失碳甾体为原料,经亚硝化,在六元 C环扩环成七元环的同时,使四元环缩小成三 元环。
七分子重排反应市公开课获奖课件省名师示范课获奖课件

实例分析2:
CH2OH
H+ -H2O
CH H2C
苯基移位
CH2
CC
H
H
-H+ or Nu
CH CH
CH CH2 Nu
1)甲基迁移
共轭
2)氢迁移 3)苯基迁移
基团旳迁移顺序
哪个基团先迁移?是C6H5还是R?
基团旳迁移顺序-反应事例1
基团旳迁移顺序-反应事例2
经过碳正离子旳重排中,一般为反式迁移,基团 迁移旳活泼性顺序大致为:
在酸催化下,邻二叔醇失去一分子水,重排成醛或酮旳反应称
Pinacol重排。 RR H+
RCCR
R R C CR
OH OH
OR
反应机理:在H+作用下失去一分子水,生成碳正离子,R’作1,2-迁移, 最终失去质子,得到醛或酮。
不但邻二醇(二叔、叔仲、双仲醇),而且卤代醇、氨基醇也可 能发生片呐醇重排。
CH3O > R3C
>
> Cl
> CH2=CH
> R2CH >CH3 > H
转移基团旳电子密度越高,亲核能越大,越易 转移。
∨ ∨
CH3
Ag+
H3C C CH2Cl
CH3
CH3 H
Ph C C OTs
CH3 CH3
H3C C CH2CH3 CH3
H3C C CHCH3 CH3
H
△
H3C C C Ph
重排反应旳分类
(一)按照分子内或分子间进行重排分为:
1. 分子内重排—发生重排旳原子或原子团一直没有脱 离原来旳分子。
2. 分子间重排—迁移旳原子或原子团在没有重排到新 旳位置前,就完全与原来旳分子脱离。
高等有机化学重排反应

3
7.1 重排反应的分类
1. 分子内重排及分子间重排 按照重排发生在分子内或分子间分为: 分子内重排——发生重排的原子或原子团始终没有
脱离原来的分子。 分子间重排——迁移的原子或原子团在没有重排到
新的位置前,就完全与原来的分子脱离。
4
2. 按反应历程分类 按照迁移基团的电性分类:
亲核重排
亲电重排
31
2. Stevens重排
季铵(硫)盐分子中与氮原子相连的碳原子上具有吸电子 的取代基时,在强碱作用下,重排得到叔胺(硫醚)。
R
H2
B
YC S R
R YC S R
H
Y = RCO , ROOC , Ph等, 最常见的迁移基团:烯丙基、二苯甲基、3-苯基丙炔基、
苯甲酰甲基等。
32
反应机理:第一步是碱夺取酸性的-氢原子形成内鎓盐,然 后重排得三级胺。
第7章 重 排 反 应
1
7.1 重排反应的分类 7.2 亲核重排 7.3 亲电重排 7.4 芳环上的重排 7.5 自由基的重排
2
什么是重排反应?
在有机化学反应中,取代基从一个原子迁移到 另一个原子,碳链或官能团发生变化称分子重排 反应。
Z AB
Z AB
A为迁移起点,B为迁移终点;A, B = C, N, O 等. Z为迁移基团.
CH3
子中间体进行的
亲核重排 CH3
C CH2 CH3
CH3
CH3
C CH
CH3 Cl
CH3 (消除产物)
CH3 C CH2 CH3
CH3
(取代产物)
11
莰醇 莰烯
12
脂环伯胺在亚硝酸作用下发生的脱氮重排反应,常常伴 随着环的扩大和缩小,称为Demyanov重排反应。
有机化学基础知识点重排反应的机理和规律

有机化学基础知识点重排反应的机理和规律有机化学是研究有机化合物的结构、性质和反应的学科。
在有机化学中,重排反应是一类重要的反应类型,指的是有机分子在条件适当的情况下,通过化学转化重新排列原子或基团的位置而形成新化合物的过程。
本文将探讨重排反应的机理和规律。
一、脱氢重排反应脱氢重排反应是指分子内的氢和一个相邻的碳原子之间迁移的过程。
这种反应通常发生在具有活泼的氢原子的有机化合物中。
脱氢重排反应常见的机理有质子迁移和自由基迁移两种。
1. 质子迁移质子迁移是脱氢重排反应中常见的机理之一。
在质子迁移过程中,质子从一个原子迁移到另一个原子上,给予其正电荷,同时,原子上的电子以共振或移动的方式重新分布。
质子迁移反应可分为环内质子迁移和链上质子迁移。
2. 自由基迁移自由基迁移是脱氢重排反应中另一种常见的机理。
在自由基迁移过程中,一个碳原子上的自由基通过氢原子的迁移,连接到一个相邻的碳原子上,形成一个新的自由基。
这种反应机理多见于烷基和烷基自由基间的迁移。
二、亲电重排反应亲电重排反应是指由于外来的亲电试剂的作用,有机化合物中的基团重新排列的过程。
亲电重排反应常涉及含有高度不稳定的中间体的形成。
1. 高能离子中的重排反应高能离子中的重排反应是一种常见的亲电重排反应。
在该过程中,高能离子首先与有机分子中的某个基团形成化学键,然后通过中间体的形成和不稳定结构的断裂,最终导致原有基团的重新排列。
2. 焦磷酰的重排反应焦磷酰是一种强酸性试剂,广泛用于重排反应中。
当焦磷酰作为试剂与有机化合物反应时,它与分子中的氧原子形成磷酰离子,从而引发重排反应。
三、杂环重排反应杂环重排反应是指含有杂环结构的有机化合物在适当的条件下发生的重排反应。
杂环重排反应通常涉及杂环内部原子间的迁移和重排。
1. 杂环内部原子迁移杂环内部原子迁移是杂环重排反应中最常见的机理。
在这种过程中,杂环内的原子通过原子间的迁移重新排列,形成新的杂环结构。
2. 杂环重排反应的特殊性杂环重排反应具有特殊的反应条件和化学特性。
重排反应医学知识讲座培训课件

四. 应用特点
重排反应医学知识讲座
91
(一) 制备伯胺
重排反应医学知识讲座
92
(二) 制备氨基甲酸酯
重排反应医学知识讲座
93
重排反应医学知识讲座
94
四、Schmidt反应
(一) 反应通式
重排反应医学知识讲座
95
二. 反应机 理 (一) 羧酸与叠氮酸de反应机理
重排反应医学知识讲座
96
四. 应用特点
在光、热或金属化合物催化下,α-重氮酮 重排生成烯酮de反应称为Wolff重排.
一. 反应通式
Wolff重排
重排反应医学知识讲座
61
Arndt-Eistert合成
重排反应医学知识讲座
62
二. 反应机理
重排反应医学知识讲座
63
三. 影响因素
重排反应医学知识讲座
64
四. 应用特点
(一) 由羧酸制备多一个碳原子de酸或其衍生物
重排反应机理复杂多样,规律性不强, 在此就不罗列讲解了,后续课程会结合具 体de重排反应进行讲解,此部分内容仅供 参考
重排反应医学知识讲座
6
第二节 从碳原子到碳原子de重排
一、Wagner-Meerwein重排
重排反应医学知识讲座
7
一. 反应通式
(如果R四 = H)
(如果R二 含一个α-氢)
R =烷基、 芳基或氢
79
三. 影响因素
(一) 反应条件de影响
如果R为脂肪取代基,碳原子数小于八
重排反应医学知识讲座
80
所用de碱用醇钠代替氢氧化钠,重排后de 异氰酸酯与醇作用得到氨基甲酸酯
重排反应医学知识讲座
81
第七章-重排反应PPT课件

1、史帝文斯重排(Stevens)
——季铵盐在碱作用下,烃基从氮迁移到邻近 的负碳离子上得到胺。
例如:
CH3 NCH+ C2PHh2CBHr- CH2 CH3
C4H9OK
CH2Ph
+-
CH3 N CH CH CH2
CH3
CH2ph
CH3 N CH CH CH2
CH3
.
形成叔胺 型化合物
22
C H 2R CH3 N+ R'
X
两处的碳负离子谁易形成?
容易
但后者除了进行分子内取代外,另有变化
.
30
✓分子内取代:
O
-OR
R
CH3
O
-
O
R
R
CH3
这个结构 不予成立
以原先与卤素 相连处断开
问题二 如果该结构式成立的话,就有二个分离 可能,但事实上只有一种。
O C OR R CH CH CH3
ROH
.
O C OR R CH CH2 CH3
1
重排反应的分类:
➢(1)以重排范围分类
分子内重排:(以此为主) 分子间重排:(是以后发展的方向)
➢(2)以重排发生的距离分类
1,2-重排:邻位重排(*) 1,3-重排:间位重排 各种位置之间的重排
重排反应的特点:
➢(1)剧烈性:与上述所说的不稳定性有关, 瞬间性
.
2
➢(2)复杂性:不可测性
许多重排的产物复杂; 许多重排的机理尚不十分明了,尚无定论
CH2N2 重氮甲烷
RO O C CH R
可用于生成 酯、酸、酰胺
+-
ROH, H2O, NH3
第七章 重排反应

I2 ,冰HOAc -H2O
(C6H5)3C C C6H5 O
B、温度 :
低温下用酸处理时,重排反应优先于单纯的脱水 反应;
较高温度和强酸条件下,可以发生脱水反应,生 成二烯烃。这是Pinacol重排反应的主要副反应。
C、反应物结构的影响
四取代邻二叔醇、 三取代邻二叔醇、 羟基位于脂环上的邻二叔醇重排 Semipinacol重排
OH
O Ph CH3 C C Ph
CH3
三取代邻二叔醇重排
在三取代邻二叔醇结构中,其中一个羟基 为叔羟基,另一个为仲羟基,叔羟基先质子 化后离去,仲碳上所连的氢原子或基团发生 迁移。 如:
Ph
Ph
Ph CH C
CH3
HCl (g) 25℃, 3h
Ph C C
CH3
OH OH
O OHH
羟基位于酯环上的邻二叔醇重排
改用醇作溶剂,以醇钠代替氢氧化钠。
C、应用
制备伯胺、氨基甲酸酯及脲
酰胺经Hofmann重排可转变成比酰胺少一个原 子的伯胺。
如磺胺甲噁唑中间体3-氨基-5-甲基异噁唑(5), 就是由Hofmann重排而制得。
CONH2 NaOCl
NH2
N
H3C
O
N
H3C
O
(5)
• 制备醛、酮、腈
当酰胺基的α-碳原子上有羟基、卤素、烯键时, 重排生成不稳定的胺或烯胺,进一步水解,则生成 醛或酮。
酮是由芳醛安息香缩合,并进一步氧化制备。如抗 癫痫药苯妥英钠的合成即是用该方法。
O OH
OO
Ar C CH Ar [O] Ar C C Ar
若用醇盐取代苛性碱,其重排产物为相应的酯。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
R'
R'
OH2
OH
(36)
R
C=N
R'
OH2
(35)
Ph
O Ph
(94%)*
(6%)*
OH OH
H
p-CH3OC6H4 C C C6H4OCH3-p
Ph Ph
Ph
P h C C (C6H4OCH3-p)2 + p-CH3OC6H4 C C C6H4OCH3-p
O Ph
O Ph
(94%)*
(6%)*
OH OH
H
p-CH3OC6H4 C C C6H4OCH3-p
H2SO4/Ac2O
Ph C C CH3
OH OH
(14)
Ph CH3 Ph C C CH3
OH (15)
Ph CH3
H2SO4/Ac2O
Ph C C CH3
OH OH
(14)
Ph CH3 Ph C C CH3
OH (15)
Ph CH3
Ph C C CH3 OH (17)
Ph
Ph C C CH3 CH3 O (16)
OH (15)
Ph CH3
Ph C C CH3 OH (17)
Ph
Ph C C CH3 CH3 O (16)
Ph
Ph CH3
C
C CH3
H2SO4/Ac2O
OH OH
(14)
Ph CH3
Ph
C
C CH3
OH
(17)
Ph CH3
Ph
C
C CH3
OH
(15)
Ph
Ph
C
C CH3
CH3 O
(16)
Ph CH3
H
R
R C CR
R C CR
R
R
-H
R C CR
R C CR
OH OH
OR H
OR H
OR
8
此反应有时通过环氧化物中间体再进行重排。
OH
H
OH
H
O
O
R2 C C R2 OH2
O R2 C C R2 - H
O R2 R2 C C R2
+H
C C R2 OH2
R2 C C R2 R2 C C R2
OH OH
(14)
CH3 Ph CH3
CH3
Ac2O/ZnCl2
Ph C C CH3Ph C C CH3
Ph C C CH3
O Ph
(85%)
OH OH
O Ph
(18)
(14)
(18)
16
(2)三取代邻二醇的重排
其中一个为仲羟基、一个为叔羟基,重排反应取 决于具体条件; a. 在酸性条件下,叔羟基优先质子化后离去形成 碳正离子;
CH3 (6)
HCl
CH 3
CH3
C
CH2CH3
CH3
CH3
C
CH 2O H2
CH3
-H2O
CH3
-H
(CH3)2C = CH CH3
Cl
(CH 3)2C Cl CH 2CH 3
CH3
C
CH2
CH3
CH3 C CH2 CH3
3
当伯醇或仲醇的β碳原子上具有两个或三个烃基 或芳基者都能发生这种重排;
如由异冰片(7)合成莰烯(8);α-氯莰烷(9) 经酸催化重排生成氯化异冰片烷(10)等。
OH H (7)
OH H -H
(7)
(8)
OH H
-H
(8) (7)
-H
OH H
(8) (7)
H
H
H
Cl
Cl Cl
Cl Cl
Cl Cl
Cl Cl
(9)
(10)
(9)
(9)
(10)
Cl Cl
Cl
H
Cl
(10)
(9)
-H
(8)
Cl Cl
Cl
(10)
4
某些多环烯烃化合物当用质子酸处理时,生成 的碳正离子也能发生Wagner-Meerwein 重排。
13
如化合物(13)重排得到的是苯基迁移的产 物。
C6H4OCH3-p Ph
Ph
p-CH3OC6H4 C C Ph H2SO4 P h C C (C6H4OCH3-p)2 + p-CH3OC6H4 C C C6H4OCH3-p
(13) OH OH
O Ph
O Ph
(72%*)
C6H4OCH3-p
(28%*)
R RC CR
OR
(26)
(27)
Y=NH2,X,SPh,OH,酯基或环氧基等
RR
RR
R
R C C R -Y
R C CR
R C CR
OH Y
OH
OR
21
(26)
(27)
常见的这类反应尚有β-氨基醇,可通过重氮化 进行去氨基反应;β-卤代醇在某些重金属盐的 作用下脱去卤原子后都进行Semipinacol重排。
CH3 CH3
CH3
CH3
Ph C C Ph H CH3 C C Ph + Ph C C CH3
Ph
OH OH
O Ph
O Ph
主产物
次产物
CH3 CH3 C C Ph OH OH
CH3
CH3
H CH3 C C Ph + Ph C C CH3
O Ph
O Ph
主产物
次产物
11
当R1和R2都为芳基时,遵循以下规律:
RR R C CR
OH
(26)
(27)
Y=NH2,X,SPh,OH,酯基或环氧基等
R
RR
R C C R R C C R -Y
OR
OH Y
(26)
RR R C CR
OH
(27)
Y=NH2,X,SPh,OH,酯基或环氧基等
R RR R C C R R C C R -Y
O R OH Y
RR R C CR
OH
O
OH
O
H2SO4/Et2O
Ph Ph
(99%)
C OH r.t . , 2h (25) Ph Ph
Ph Ph
(99%)
19
若两个羟基都属于仲羟基,或一个是叔羟基 , 另一个为仲羟基时,一般是叔羟基先消除,通 过氢的迁移而生成相应的甾酮。
O
O
H
H
OH
HO
OH HO
O
HO
O
O
H
H
OH
OH HO
O
20
1. 芳环的对位和间位为给电子基时,增加了芳环 的电子云密度,优先迁移;
2. 若在芳环的邻位有取代基(不论是给电子基还 是吸电子基),由于位阻效应,迁移能力下降。
OH OH
H
p-CH3OC6H4 C C C6H4OCH3-p
Ph Ph
Ph
Ph C O
C (C6H4OCH3-p)2 + p-CH3OC6H4 C C C6H4OCH3-p
Ph CH3
Ph C C CH3 OH (17)
Ph
Ph C C CH3 CH3 O (16)
先考虑碳正离子的稳定性,然后考虑基团的迁移
能力
15
如将化合物(14)用含少量硫酸的醋酸或含无 水氯化锌的醋酐处理,则主要得到苯基迁移的 产物(18)。
Ph CH3
Ac2O/ZnCl2
Ph C C CH3
(85%)
RR
H
R
R C CR R C CR
OH OH
OR
H
R
R
-H
C CR
OR
R
C O
R
C RR
R
RR C CR
H
R
R C CR
H
OH OH O R
H
R
C
R
-H
CR
R
C
R C RR
R C
R CR
H
R
R C CR
OR H
O R OH OH
OR H
R
R
-H
R C CR R C CR
OR OR H
RR
NaNO2/HOAc
(29)
23
第二节 从碳原子到杂原子的重排
一、Beckmann 重排
酮肟类化合物在酸性催化剂的作用下,重排成 取代的酰胺。
R
OH
H
C=N
R'
R
O C
NHR'
R C=N
R'
OH
H
O R C NHR'
24
反应机理:
R
H
C=N
R'
OH
R
C=N
R'
OH2
(35)
R
R
H
C=N
C=N
第七章 重排反应
1
第一节 从碳原子到碳原子的重排
一、Wagner-Meerwein重排
广义地说,迁移至缺电子碳原子上的反应都可 称为Wagner-Meerwein
2
如新戊醇在催化下的反应 :
CH3
CH3
CH3 C
HCl
CH2OH
CH3
C
CH2OH2 -H2O CH3
CH3
CH3
(6)
-H
(CH3)2C = CHCH3
