常见的弱电解质-课件
常见的弱电解质

2、二元弱酸
H2SHΒιβλιοθήκη + HS-HS-
H+ + S2-
总:H2S
2H+ + S2-
c(HS-)·c(H+)
Ka1=
c(H2S)
c(S2-)·c(H+)
Ka2=
c(HS-)
Ka(总)=
c(S2-)·c2(H+) c(H2S)
=Ka1·Ka2
下表为常温(25℃)时几种弱酸的电离常数:
弱酸
电离常数
弱酸
25℃时,Kw=c(H+)×c(OH-)=1×10-14
思考:水的离子积会受什么外界条件影响?
分析表中的数据,有何规律,并解释之
温度 0℃
20℃
25℃
50℃
100℃
Kw 1.3×10-15 6.8×10-15 1.0×10-14 5.5×10-14 5.5×10-13
结论:
1)影响Kw的因素——温度越高,Kw越大。 2)水的电离是吸热过程。
H2O(l) H+(aq) + OH-(aq) △H= +57kJ·mol-1
通过计算说明常温下0.1mol·L-1的HCl溶液中由 水电离的氢离子和氢氧跟离子的浓度?有何启发?
解:设由水电离产生的H+、OH-浓度均为xmol·L-1
(0.1+x) ·x=10-14
0.1x≈10-14
x≈10-13
(3)常温下,任何稀的水溶液中(不仅指纯水), Kw= c(H+)×c(OH-)=1×10-14
(4)不论是在中性溶液还是在酸碱性溶液,水电 离出的c(H+)=c(OH-)
(5)根据Kw=c(H+)×c(OH-)在特定温度下为定 值,c(H+)和c(OH-) 可以互求。
高中化学 人教版选修4 课件:第三章 第一节 第1课时 强弱电解质(36张PPT)

5.强、弱电解质在熔融态的导电性: 离子型的强电解质由离子构成,在熔融态时产生自由移 动的离子,可以导电;而共价型的强电解质以及弱电解质 由分子构成,熔融态时仍以分子形式存在,所以不导电。
栏 目 链 接
尝试
应用
1 .下列物质的水溶液能导电,但属于非电解质的是
( ) A.CH3COOH C.NH4HCO3 B.Cl2 D.SO2
栏 目 链 接
尝试
应用 解析:选项中的四种物质的水溶液都能导电,但原因有 所不同。CH3COOH和NH4HCO3均为电解质,水溶液理应 能导电;Cl2和SO2水溶液能导电,是因为它们与水反应的生
成物均为电解质,故溶液也导电(Cl2+H2O
SO2+H2O 为非电解质。 答案:D
HCl+HClO,
H2SO3)。电解质和非电解质都属于化合物,
栏 目 链 接
♨ 特别提示: 1. 强、弱电解质的范围: , 强电解质:强 酸、强碱、绝大多数盐,弱电解质:弱酸、弱碱、水。 2. 强、弱电解质与溶解性的关系: , 电解质的强弱取决 于电解质在水溶液中是否完全电离,与溶解度的大小无关。 一些难溶的电解质,但溶解的部分能全部电离,则仍属强电 解质;如:BaSO4、BaCO3等。
栏 目 链 接
Cl2是单质,它既不是电解质又不是非电解质,因此只有SO2
要点二
强弱电解质电离方程式的书写
电离:电解质在水溶液或熔融状态下离解成自由移动离 子的过程。电离不需要通电,且一般为吸热的。电离方程式 的书写如下: 1.强电解质 完全 电离,符号用“________” ,如 HCl_________________________________________________ === H++Cl- _______________________; CH3COONH4____________________________________ ===CH3COO-+NH ____________________________________; Ba(OH)2_________________________________________ ===Ba2++2OH- _______________________________。
【公开课课件】常见的弱电解质

常见的弱电解质
【总结】
抑制水电离
促进水电离
增大[H+](加酸或强酸酸式盐) 增大[OH-] (加碱) 降低温度
升高温度
减小[H+]:加含CO32- 、S2-、
CH3COO-、HCO3- 的盐
减小[OH-]:加含 NH4+、Fe3+、
Cu2+、 Al3+的盐
[小结] (1) Kw只与温度有关(T↑,Kw↑) (2) Kw = 1×10-14 ,不仅适用于纯水(或其他中 性溶液),也适用于酸、碱、盐的稀的水溶液。
1.25℃时,向纯水中加入少量氯化氢气体,仍能保持 不变的是( C ) A.c(H+) B.c(OH-) C.Kw D.c(H+)/c(OH-)
2.纯水在10℃和50℃的H+浓度,前者与后者的关系是
( B)
A、前者大
B、后者大
C、相等
D、不能确定
3.某温度下纯水中C(H+) = 2×10-7 mol/L,则此时水 中的C(OH-) = ___2_×__1_0_-_7_m_o。l/L 若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L, 则此时溶液中的C(OH-) = _2_×__1_0_-9_m__o_l_/L。
=C(H+)水= C(OH-)水
9、在常温下,由水电离产生的C(H+)=1×10-13 mol/l的溶液,则该 溶液的酸碱性如何?
可能是酸性,也可能是碱性。
5.已知100℃时,Kw =1×10-12,分别求出该温度 下,纯水、0.1mol/LHCl溶液、 0.1mol/L的NaOH 溶液中的c(H+)
18常见的弱电解质

在常温下,0.1mol/L的盐酸溶液中C(H+ ) 和C(OH-)是多少?
水电离出的C(H+)和C(OH-)是多少?
水电离出的C(OH-)=1×10-14/0.1=1×10-13mol/L
=水电离出的C(H+)
在常温下, 0.1mol/L的NaOH溶液中水电离 出的C(H+)和C(OH-)是多少?
一、水的电离 1、水是一种极弱的电解质,能微弱的电离:
+ +
H2O+H2O ( H2O
H3O++OH- H++OH-)
c(H+) · c(OH-)
电离常数:K电离=
纯水和稀溶液中水的浓度可视为定值 所以c(H+) · c(OH-)=K电离· c(H2O)为一个新的常数。 精确实验表明: 25℃时,纯水中:c(H+)=c(OH-)=1×10-7 mol/L。
1. 0.2mol/L醋酸溶液中c(H+)=a,0.1mol/L醋酸 溶液中c(H+)=b,a= 2b吗?
2. 请从平衡移动的角度分析以下反应的微观过程: Fe+2CH3COOH = ( CH3COO)2Fe + H2↑ Fe+2CH3COOH = 2CH3COO-+Fe2++ H2↑
3.一定温度下cmol/L弱酸HX的溶液(电离常数 为Ka, Ka <10-4),估求H+浓度、HX的电离度。
结论:多元弱酸的酸性由第一步电离决定。
【课堂练习】
写出H3PO4在水溶液中的电离方程式。 【思考】在磷酸溶液中存在哪些微粒?
H3PO4
H2PO4 HPO 24
Hale Waihona Puke H+ +H2PO4 一(1) + 2 H + HPO 一(2)
苏教高中化学选修专题常见的弱电解质张讲解讲解市公开课获奖课件省名师示范课获奖课件

1.你能算出平均每多少个水分子中有一
种发生电离吗?
5.56×108
2.根据此数据,你能否算出25℃时,
水旳电离平衡常数?
1.8×10-16
水旳浓度视为常数, K 电离也是常数
所以 K W= K 电离× c(H2O)= c(H+)×c(OH-) 为一种新旳常数。
2、水旳离子积 在一定温度时: c(H+)×c(OH-)=Kw,叫水旳离子积 25℃时,Kw=1×10-14
D.Mg2+ Cu2+ SO42- Cl-
8.已知一种c(H+)=1×10-3mol·L-1旳酸和一 种c(OH-)=1×10-3mol·L-1旳碱溶液等体
积混和后溶液呈酸性.其原因可能是 B
A.浓旳强酸和稀旳强碱溶液反应 B.浓旳弱酸和稀旳强碱溶液反应 C.等浓度旳强酸和弱碱溶液反应 D.生成了一种强酸弱碱盐
【总结】
加入强酸
增大c(H+) 加入弱酸 加入强酸旳酸式盐。
克制水电离 增大c(OH-)加 加入 入强 弱碱 碱
降低温度 升高温度 增进水电离 减小c(H+):加入强碱弱酸盐 减小c(OH-):加入强酸弱碱盐
【课堂练习】 写出H3PO4在水溶液中旳电离方程式。 【思索】在磷酸溶液中存在哪些微粒?
C 则该溶液中旳溶质不可能是( )
A、HCl
B、NaOH
C、NH4Cl
D、H2SO4
(7)在25 ℃,在某无色溶液中由水电离
出旳c(OH-)= 1×10-13,一定能大量共
C 存旳离子组是(Байду номын сангаас)
A.NH4+ K+ NO3- Cl-
B.NO3- CO3 2 - K+ Na+
强电解质与弱电解质课件

盐类强电解质
氯化钠
由强酸和强碱组成,在水中完全 电离,生成钠离子和氯离子,具
有良好的导电性。
硫酸钠
由强酸和强碱组成,在水中迅速 电离,生成硫酸根离子和钠离子 ,具有较高的溶解度和导电性。
碳酸钙
由强碱和弱酸组成,在水中部分 电离,生成钙离子和碳酸根离子 ,溶解度较低,但在强酸性环境 中可溶解并产生二氧化碳气体。
3. 进行实验:将强电解 质和弱电解质的溶液分 别置于试管中,观察其 颜色、导电性等性质, 并记录实验结果。
实验现象展示和结果分析
强电解质实验现象
NaOH溶液呈无色,加入酚酞指示剂后呈红色,说明 NaOH在水溶液中完全电离,产生OH-离子,使溶液呈 碱性。
CH3COOH溶液呈无色,加入甲基橙指示剂后呈橙色, 说明CH3COOH在水溶液中部分电离,产生的H+离子 浓度较低,使溶液呈弱酸性。
硝酸
在水中完全电离,生成氢离子和硝 酸根离子,具有强酸性和氧化性。
强碱类强电解质
01
02
03
氢氧化钠
在水中完全电离,生成氢 氧根离子和钠离子,具有 强碱性。
氢氧化钾
在水中迅速电离,生成氢 氧根离子和钾离子,具有 极强的碱性和腐蚀性。
氢氧化钙
在水中部分电离,生成氢 氧根离子和钙离子,具有 中强碱性。
HCl溶液呈无色,加入甲基橙指示剂后呈红色,说明 HCl在水溶液中完全电离,产生H+离子,使溶液呈酸 性。
弱电解质实验现象
NH3·H2O溶液呈无色,加入酚酞指示剂后呈粉红色, 说明NH3·H2O在水溶液中部分电离,产生的OH-离子 浓度较低,使溶液呈弱碱性。
06
思考题与课堂互动环节
思考题设计
题目1
常见的弱电解质

C(H2O)
电离平衡常数:K =
C(H+)×C(OH-)
C(H2O)
在一定温度下,纯水和稀溶液中C(H2O)可视为一定值 因此有:
Kw= K • C(H2O)= C(H+) • C(OH-)
2、水的离子积
在一定温度时:
C(H+) C(OH-)=Kw, Kw称为水
•
的离子积常数,简称水的离子积。
-14 25℃时,Kw=1×10
(2013•上海)部分弱酸的电离平衡常数如表,下列选项错误的是 ( )
弱酸 HCOOH HCN H2CO3 Ka1=4.3×10-7 Ka2=5.6×10-11
电离常数(25℃)
Ka=1.77×10
-4
Ka=4.9×10
-10
A.2CN-+H2O+CO2→2HCN+CO32B.2HCOOH+CO32-→2HCOO-+H2O+CO2 C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
+) 减小 ,Kw_____ 动,α水____ ,则 C ( H 不变
必然会____ 减小 。
【总结】
抑制水电离
增大C(H+)
增大C(OH )
降低温度 减小C(H+)
促进水电离
减小C(OH-)
升高温度
[练习] 1.下列说法正确的是 A.盐酸溶液中无OHB.NaOH溶液中无H+
(
D)
C.NaCl溶液中既无H+也无OHD.常温下,任何物质的稀溶液中都有H+
2、在酸碱溶液中,水电离出来的C(H+) 和C(OH-)是否相等?
常见弱电解质 (12张)

实用文档
[练习] 1.某温度下纯水中C(H+) = 2×10-7 mol/L, 则此时溶液中的C(OH-) = _2_×_1_0_-_7_m_o_l_/L_。 若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) = 8×10-9 mol/L 。
6、在常温下,由水电离产生的 C(H+)=1×10-13 mol/L的溶液,则该溶 液的酸碱性如何?
答:可能是酸性也可能是碱性
4、在常温下,0.1mol/L的盐酸溶液中水电 离出的C(H+ )和C(OH-)是多少?
水电离出的C(OH-)=1×10-14/0.1 =1×10-13mol/L= C(H+ )
5、在常温下, 0.1mol/L的NaOH溶液中水电 离出的C(H+)和C(OH-)是多少?
水电离出的C(H+ ) =1×10-14/0.1 =1×10-13mol/L= C(OH-)
专题3 溶液中的离子反应
常见的弱电解质
弱酸、弱碱、水
1、水是一种极弱的电解质,能微弱的电离:
H2O+H2O
H3O++OH-
( H2OH++OH-)电离平衡常数:K电离=
C(H+)×C(OH-)
C(H2O)
纯水和稀溶液中C(H2O)可视为一定值
K W= K 电离× C(H2O)= C(H+)×C(OH-) K W——水的离子积常数
4、不论是在中性溶液还是在酸、碱性溶液, 水电离出的C(H+)=C(OH-)
2、影响水电离平衡的外界因素
H2O
H++OH-
增大C(H+)
抑制水电离 增大C(OH-)
第3课时 常见的弱电解质
9.一定温度下,冰醋酸加水稀释 的过程中,溶液导电能力(I)随加 水的体积(V)变化如图所示,
下列说法正确的是 ( D)
A.“O”点导电能力为0的理由是冰醋酸是固 体,内部的离子不能自由移动
B.a、b、c三点中,a点c(H+)最大,因为电解 质溶液浓度越大,离子浓度就越大 C.a、b、c三点中,b点水电离的程度最大 D.若使b点处溶液中c(H+)减小,可向溶液中 加水或加冰醋酸
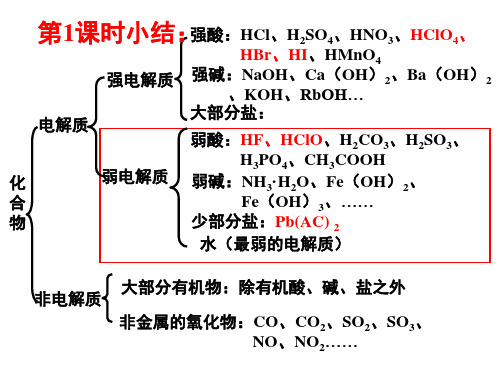
第1课时小结:强酸:HCl、H2SO4、HNO3、HClO4、
HBr、HI、HMnO4 强电解质 强碱:NaOH、Ca(OH)2、Ba(OH)2
、KOH、RbOH…
电解质
大部分盐:
弱酸:HF、HClO、H2CO3、H2SO3、
化
弱电解质
H3PO4、CH3COOH 弱碱:NH3·H2O、Fe(OH)2、
化合物类型
物质类别
阴、阳离子
电离方程式用等号
离子化合物、部分 共价化合物
强酸、强碱、绝大多 数盐、大多数活泼金 属氧化物等
阴、阳离子、弱 电解质分子 电离方程式用 可逆符号
部分共价化合物
弱酸、弱碱、少部分 盐、水
【温故】
在一定的条件下(如温度、
浓度一定),当 溶液中的弱电解
质分子电离成离子的速率与离
D.Mg2+ Cu2+ SO42- Cl-
8.已知一种c(H+)=1×10-3mol·L-1的酸和一 种c(OH-)=1×10-3mol·L-1的碱溶液等体
积混和后溶液呈酸性.其原因可能是 B
A.浓的强酸和稀的强碱溶液反应 B.浓的弱酸和稀的强碱溶液反应 C.等浓度的强酸和弱碱溶液反应 D.生成了一种强酸弱碱盐
2、已知0.1mol・L-1的醋酸溶液中存在电离平 衡
弱电解质的电离平衡ppt课件

NH3·H2O NH4+ +
起始: 电离: 平衡:
OH-c x
(c-x)
0
0
x
x
x
x
α=
x c
×100%
c(OH-)= c· α
c(OH-)= 0.1mol/L ×1.33% = 1.33 ×10-3mol/L
H2O
7
11
那么H以2下S 反响5能.7×够1发0-生的1是.2×10- A. NaHCO3+NaH8S→Na2CO153+H2S
B. H2S+Na2CO3→NaHS+NaHCO3
C. Na2S+H2O+CO2→H2S+Na2CO3
D. H2S+NaHCO3→NaHS+H2CO3
交流与讨论 1.强电解质溶液的导电才干一定比弱电解质溶 液的导电才干强吗?
弱用“可逆〞强用“等 〞;
多元弱酸分步写,
多元弱碱一步“逆〞
(4) Al(OH)3
练习1、知:〔1〕在250C时,1mol/L醋酸中电离
出来的氢离子浓度仅为0.004mol/L左右,该溶液
中醋酸的电离度为多少?
α=
已电离的醋酸浓度 醋酸的初始浓度
×100%
=
0.004mol/L 1mol/L
×100% =
H2O
H+ + OH-
c(H+)·c(OH-)
K= c(H2O)
是定值
水的离子积常数 KW c(H+)·c(OH-) 水的离子积 250=C时, KW= 1.0×10 -14
水的离子积常数与哪些要素有关? 只与温度有关
强电解质和弱电解质课件

弱电解质的电离过程
弱电解质在水溶液中部分电离,存在电离平衡,其电离方 程式通常用可逆号表示。例如,CH3COOH在水溶液中的 电离方程式为CH3COOH ⇌ CH3COO- + H+。
弱电解质在溶解过程中存在电离平衡,随着溶解的进行, 离子浓度逐渐增大,当达到一定数值时,电离平衡被打破 ,离子浓度不再增大。因此,弱电解质的溶解度与溶液的 离子浓度不成正比。
感谢观看
THANKS
离子浓度
强电解质的电离程度高,水溶液中的离子浓度也高;弱电解质的电离程度低,水溶液中的离子浓度也 低。
电离度与离子浓度关系
在相同浓度条件下,强电解质的电离度较高,其水溶液中的离子浓度也较高;而弱电解质的电离度较 低,其水溶液中的离子浓度也较低。
06
强电解质和弱电解质的实际
应用
强电解质在日常生活中的应用
02
强电解质在水中能够完全电离成 离子,不会受到水分子影响,因 此具有较高的导电能力和传递速 度。
弱电解质定义
弱电解质是指在溶液中只能部分电离 的电解质,主要包括弱酸、弱碱和水 合离子等。
弱电解质在水中的电离程度较低,因 此导电能力和传递速度受到限制。
电解质的电离平衡
电离平衡是电解质在溶液中的一种动态平衡状态,主要受到电解质的性质、溶液 的浓度和温度等因素影响。
洗涤剂
强电解质如NaCl、NaOH等是洗 涤剂的主要成分,其溶解能力有
助于去除污渍。
食品加工
强电解质如NaCl(食盐)在食品 加工中起到调味和防腐的作用。
农业
强电解质如KNO3和NaCl等在农业 中用于促进植物生长和增加产量。
弱电解质在药物和生物化学中的应用
药物
许多药物如阿司匹林、布洛芬等 都是弱电解质,它们在人体内具 有特定的药理作用。
《弱电解质的电离》人教版高二化学选修4PPT课件(第1课时)

试分析两溶液中各有哪些粒子?
盐酸
醋酸
1. 强弱电解质的概念
强电解质:在水溶液里全部电离成离子的电 解质。如:强酸、强碱和大多数盐类。
弱电解质:在水溶液里只有一部分分子电离 成离子的电解质。如 :弱酸、弱碱等。
1. 强弱电解质的概念
常见的强电解质:
强电解质、弱电解质与其溶解性无关。 如:某些难溶或微溶于水的盐,由于 其溶解度很小,但是其溶于水的部分, 却是完全电离的,所以它们仍然属于 强电解质,例如:CaCO3、BaSO4等。
二、弱电解质的电离平衡
V
V电离
V结合
0
V电离= V结合
电离平衡状态
t1
t2
弱电解质电离的V-t图像 t
二、弱电解质的电离平衡Fra bibliotek特点逆 弱电解质的电离是一个可逆过程 等 V电离= V结合= 0
动 电离平衡是一种动态平衡 定 条件不变,溶液中各分子、离子 的浓度不变,溶液 里既有离子又有分子
变 条件改变时,电离平衡发生移动
(2)HCl、H2SO4是由什么键构成的什么化合物? (3)在水溶液里电解质以什么形式存在?
离子化合物 (如强碱和大部分盐类)
某些具有极性键的共价化合物
}强电解质
电离方程式可表示为:
NaCl == Na+ + Cl-
试写出Na2SO4、NaOH、H2SO4、KHSO4、 Ba(OH)2在水溶液里的电离方程式.
注意:
1.单质/混合物 既不是电解质也不是非电解质。
2.CO2、NH3等溶于水得到的水溶液能导电,但它们不是电解质,因为导电 的物质不是其本身。 3.难溶的盐(BaSO4等)虽然水溶液不能导电,但是在融化时能导电,也是电 解质。
强弱电解质优秀课件

实验条件的 对实验
控制
现象的
解释
方法2 方法3
提示2:醋酸溶液中存在醋酸分子及电离出的离 子,请你迁移化学可逆反应,大胆猜想,醋酸 根离子与氢离子能相互结合吗?我们可以借助 什么仪器或药品获得实验现象呢?
强电解质和弱电解质
迁移应用: 请根据下列数据判断A、B哪个是盐酸、哪个 是醋酸
A的电导 率
B的电导 率
0.1 mol/L 24854
374
0.01 mol/L 2408
问题2:用稀硫酸滴定0.1mol·L-1氢氧化钡溶液,为什
么导电能力先变弱,后逐渐变强,请写出离子反应方程 式,并说明理由。
氢氧化钡溶液
相同条件下溶液 的电导率比较
氨水溶液
小
实验现象
与硫酸反应的电 与醋酸反应的电
导率变化:
导率:
问题3:用稀醋酸滴定0.2mol·L-1氨水溶液,为什么导
电能力变强,请写出离子方程式,并解释哪些因素导 致导电能力变强,哪些因素导致导电能力变弱。
与硫酸反应的电 与醋酸反应的电 导率变化趋势: 导率变化趋势:
问题1:为什么0.1mol·L-1氢氧化钡溶液的导电 能力比0.2mol·L-1氨水溶液导电强呢?请你写 出两者的电离方程式,并解释原因
氢氧化钡溶液
相同条件下溶液 的电导率比较
氨水溶
导率变化:
导率:
每6个同学组成一个小组,每一个小组有3个小实验。 请组长分配每2个同学完成其中1个小实验:
实验1:将2张相同大小pH试纸放在表面皿上,分别 滴上0.1mol/L醋酸和0.1mol/L盐酸各一滴,对比比 色卡上的颜色,读出两种溶液的pH值
实验2:往相同体积的0.1mol/L醋酸和0.1mol/L盐酸 (已装在试管中),加入相同体积大小的镁条,观察 反应速率大小
3-1 课时2 常见的弱电解质

3-1 课时2 常见的弱电解质知能定位1.识记常见的弱电解质。
2.了解水的离子积常数。
3.了解电离平衡常数与弱酸、弱碱的酸碱性强弱的关系。
4.了解多元弱酸的分步电离。
情景切入水是一种弱电解质,在水中H+和OH-到底是怎样的关系呢?自主研习一、水的电离1.水的电离水是一种极弱的电解质,电离方程式为:简写为水的电离常数K电离=)()(·)(2OHcOHcHc-+。
2.水的离子积常数(1)表达式K W=)()(-+OHcHc(2)影响因素水的离子积K W,只受温度的影响,温度升高,K W增大。
(3)适用范围K W不仅适用于纯水,还可适用于稀的电解质水溶液。
二、常见弱电解质1.常见弱酸有:氢氟酸、醋酸、次氯酸、磷酸、氢硫酸、亚硫酸等。
2.常见弱碱有:氨水、Cu(OH) 2、Fe(OH) 3等。
3.水课堂师生互动.知识点1 水的电离平衡的影响因素水的电离平衡:H2O H++OH- △H>0(1)促进水的电离平衡的因素有升温、加活泼金属、加入含弱酸(或碱)离子的盐;抑制水的电离平衡因素有降温、加入酸(或强酸的酸式盐)、加入碱。
(2)水的离子积常数K W仅仅是温度的函数,温度升高,K W增大,温度不变,K W不变,此时若c(H+)增大,则c(OH-) 必减小,反之亦然。
(3)由水电离出的c(H+)==c(OH-)或n(H+)==n(OH-)考例1 水的电离过程为H2O H++OH-,在不同的温度下其离子积常数K W(25℃)=1.0×10-14 mol2·L-2,K W(35℃)=2.1×10-14 mol2·L-2。
则下列叙述正确的是( )A.c(H+)随着温度的升高而降低B.35℃时,c(H+)>c(OH-)C.水的电离程度25℃>35℃D.水的电离是吸热的解析:水的电离:H2O H++OH-,电离出来的c(H+)等于c(OH-),同时,它是一个吸热反应,温度越高,电离度越大。
高中高中化学 3.1 强弱电解质课件 新人教版选修4

相同浓度的盐酸和醋酸溶液,由于盐酸电离 程度大,溶液中的离子浓度较大,因此盐酸溶液 的导电能力较强。
本课小结:
物质
纯净物 混合物
金属单质
①强酸
单质
②强碱
非金属单质 强电解质
③绝大多数盐 ④活泼金属氧化物
电解质
①弱酸
化合物
弱电解质 ②弱碱 ③水
①非金属氧化物
非电解质 ②有机物
均匀混合物
③NH3
非均匀混合物
是其溶于水的部分,却是完全电离的,所以
常 ①②③④强 强 绝见活酸碱大泼的::多金强它 B数HN属a电Ca们盐SO氧l、O解仍H:化4、H然质等N物2KSa属。:C:OOl于4H、K、、强2(OHNB电、NHaO(4解N)O32a、S质H2OO),2H4等、、I例、CB如aHa(SOB:OHr、4C)等2a等HC。OC。l3O、4等。
是离因程为度H不+同浓,度且不H同C,l电从离而程说度明大H。Cl和CH3COOH的电
实验验证2:
测定0.1mol/L HCl和0.1 mol/L CH3COOH的pH
0.1mol/L HCl 溶液pH大小
0.1 mol/L CH3COOH
实验验证2:
测定0.1mol/L HCl和0.1 mol/L CH3COOH的pH
2mL
0.1mol/L 盐酸
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
阅读课本并观察图3-6,了解水 的电离。
+
+
请同学们写出水的电离方程式及电离平衡常 数的表达式。
H2O+H2O ( H2O
H3O++OH- H++OH-)
c(H+)×c(OH-)
电离常数:K =
c(H2O)
『交流与讨论』
在一定温度下,纯水和稀溶液 中c(H2O)可视为一定值,观察水的 电离平衡常数,你能得出什么结论?
课堂练习:
1、若25℃时Kw=1×10-14,求由水电离出来 的 c(H+)? 2、若100℃时Kw=1×10-12,由水电离出来 的 c(H+)? 思考: 若溶液pH=7为中性溶液,那么pH=6是酸 性溶液吗?
3、25℃时,向纯水中加入少量氯化氢气体,仍能保持
不变的是 ( C )
A.c(H+) B.c(OH-) C.Kw D.c(H+)/c(OH-)
b、一级电离出的H+抑制了二级的电离 。 结论:多元弱酸的酸性由
第一步电离决定。
•
9、有时候读书是一种巧妙地避开思考 的方法 。2021/2/282021/2/28Sunday, February 28, 2021
•
10、阅读一切好书如同和过去最杰出 的人谈 话。2021/2/282021/2/282021/2/282/28/2021 5:16:10 PM
水的浓度为常数, K 也是常数。
所以 K W = K × c(H2O)= c(H+)×c(OH-)
为一个新的常数。
一、水的离子积常数
在一定温度时: Kw= c(H+)×c(OH-) ,简称水的离子积 25℃时,Kw=1×10-14
c(H+)=c(OH-)=1×10-7mol/L
思考:常数是否就不变呢?根据前面所学知识, 水的离子积会受什么外界条件影响?
4、纯水在10℃和50℃的H+浓度,前者与后者的关系
是( B )
A .前者大
B .后者大
C .相等
D .不能确定
5、某温度下纯水中c(H+) = 2×1_m_o_l_/_L。
若温度不变,滴入稀盐酸使c(H+) = 5×10-6 mol/L,则 此时溶液中的c(OH-) = 2_×__1_0_-9_m__o_l/_L_。
•
17、一个人即使已登上顶峰,也仍要 自强不 息。2021/2/282021/2/282021/2/282021/2/28
谢谢观赏
You made my day!
我们,还在路上……
水的电离被_抑__制_,Kw_不__变__,则c(H+)必然
会_减__小__。
讨论4:减少c(H+ ) 或减少c(OH-)
在H某2 O些盐 H+ +OH-平衡中,加入
,
减小左c(H+) 或c(OH增-)大,则平衡向 移动,α
水__,不促变 进水的电离,Kw_____。
含有下列离子的盐如:CO32- 、 S2-、CH3COO-、以及HCO3- 、 NH4+、Fe3+、 Cu2+、Al3+
课本P67问题解决
25℃时,水的KW为1.0×10-14,而在100℃ 时,水的KW为5.5×10-13。已知常温下水电离的
△H=57kJ ·mol-1。试解释不同温度下值出现差
异的原因。
结论: 水的电离是一个吸热过程,因此升高温
度会促使电离平衡向电离的方向移动,电离 平衡常数也随之增大。
Kw取决于温度,不仅适用于纯水,还适用 于其他溶液。
交流与讨论
改变外界条件,水的电离平衡是否 移动?向哪个方向移动?水的离子积常 数是否改变?是增大还是减小呢?
讨论1:改变温度
升高温度α水增——大—,水的
电离平衡向_右___移动,并且Kw__增__大_。 降电低 离温 平度衡向α水__左—减_—_小—移,动水,的并且Kw__减__小_。
讨论2:增大c(H+)
在H2 O
H+ +OH-平衡中,加入
( 酸或强酸的酸式盐 ),
增大c(H+),则平衡向左___移动,α水_减__小_,
水的电离被_抑__制_,Kw_不__变__,则c(OH-)
必然会_减__小__。
讨论3:增大[OH-]
在H2 O
H+ +OH-平衡中,加入_碱___
,增大c(OH-),则平衡向左__移动,α水_减___小,
【总结】
抑制水电离
促进水电离
增大c(H+)(加酸或强酸酸式盐) 增大c(OH-) (加碱) 降低温度
升高温度
减小c(H+):加含CO32- 、S2-、
CH3COO-、HCO3- 的盐
减小c(OH-):加含 NH4+、Fe3+、
Cu2+、 Al3+的盐
现在请同学们阅读课本p67 及表3-4, 思考弱酸弱碱的酸碱性与电离常数的关系?
二、弱酸、弱碱
弱酸弱碱的酸碱性强弱决定于同温度
下的电离常数,K越大,酸性(或碱性)越
强。
下面请同学们阅读教材p68资料卡 “多元弱酸分步电离”
多元弱酸,分步电离,第一步电离远大 于第二步电离,第二步电离远大于第三 步电离……,
如何用平衡移动原理来解释?
电离难的原因:
a、一级电离出H+后,剩下的酸根阴离 子带负电荷,增加了对H+的吸引力, 使第二个H+离子电离困难的多;
•
14、意志坚强的人能把世界放在手中 像泥块 一样任 意揉捏 。2021年2月28日星期 日2021/2/282021/2/282021/2/28
•
15、最具挑战性的挑战莫过于提升自 我。。2021年2月2021/2/282021/2/282021/2/282/28/2021
•
16、业余生活要有意义,不要越轨。2021/2/282021/2/28Februar y 28, 2021
•
11、越是没有本领的就越加自命不凡 。2021/2/282021/2/282021/2/28Feb-2128-Feb-21
•
12、越是无能的人,越喜欢挑剔别人 的错儿 。2021/2/282021/2/282021/2/28Sunday, February 28, 2021
•
13、知人者智,自知者明。胜人者有 力,自 胜者强 。2021/2/282021/2/282021/2/282021/2/282/28/2021
注意: (1)在水溶液中,Kw中的c(OH-) 、 c(H+) 指溶液中总的离子浓度。 (2)常温下,任何稀的水溶液中,Kw = c(H+)×c(OH-)=1×10-14 (3)不论是在中性溶液还是在酸碱性溶液, 水电离出的c(H+)=c(OH-) (4)根据Kw=c(H+)×c(OH-) 在特定温度下 为定值,c(H+) 和c(OH-) 可以互求。
