化学生物学 化学物质与蛋白质的相互作用
生物大分子与化学小分子的相互作用机制研究

生物大分子与化学小分子的相互作用机制研究随着科技的不断进步和发展,人类的生活水平和科技水平也越来越高。
而作为生物基础和生物发展的基石——生物大分子,其在生命体中扮演着极为重要的角色。
其中,蛋白质、核酸和糖类等大分子的相关研究已经成为生命科学领域的热点问题,而化学小分子则广泛应用于生物医学及药物研发等领域。
那么,生物大分子与化学小分子之间的相互作用机制是什么呢?1.蛋白质与小分子的相互作用机制蛋白质是生物体内最为重要的大分子之一,其在生物体内扮演着许多重要的生理和病理过程中的角色,如酶、抗体和激素等。
而小分子则是嵌入到蛋白质结构中相互作用的小分子,其在生物体内广泛存在。
蛋白质与小分子之间的相互作用机制主要包括以下几类。
1.1.非共价作用非共价作用是指蛋白质与小分子之间在结构上的互相作用,主要包括氢键、离子键、范德华力和氢氧化合物作用等形式。
这些作用会压缩并稳定蛋白质结构,从而保证蛋白质的正常运转。
1.2.共价作用共价作用是指蛋白质中的氨基酸残基与小分子之间的共价键。
这些键通常是由特定的酶催化形成的。
共价作用对于蛋白质的生物学活性有重要的影响,例如激酶和抑制剂等物质,其抑制机制就是通过与蛋白质共价结合。
1.3.亲疏水作用蛋白质与小分子之间发生亲疏水作用,其机制是依靠作用分子间的亲水性差异。
水是众所周知的极强的溶剂,而蛋白质分子则是一种不溶于水的有机物。
一些小分子具有亲疏水性,并且能相互作用,在水中溶解或与蛋白质结构相互作用,进而影响蛋白质的结构和功能。
2.核酸与小分子相互作用机制核酸是生命体内的信息储存分子,其重要性与蛋白质相仿。
与蛋白质不同的是,核酸的结构非常特殊,容易与结构相似的小分子形成稳定的化学键合。
对于核酸而言,小分子常常与其DNA序列有关。
这种相互作用机制可以帮助科学家寻找某些特定生物的DNA序列,并用于基因链的编辑。
3.糖类与小分子相互作用机制糖类是一种广泛存在于生物体中的分子,其作为膳食成分和药物组分具有广泛的用途。
蛋白质合成与化学生物学

蛋白质合成与化学生物学在生命的微观世界里,蛋白质合成是一项极其复杂而又关键的过程。
它就像是一座精巧的生物工厂,有条不紊地运作着,为生命活动提供着不可或缺的物质基础。
而化学生物学作为一门交叉学科,正逐渐揭示出蛋白质合成背后的神秘化学机制,并为我们带来了许多令人惊喜的发现和应用。
要理解蛋白质合成,首先得知道蛋白质是什么。
蛋白质是由氨基酸按照一定的顺序连接而成的大分子化合物。
这些氨基酸就像是一个个小积木,通过特定的方式拼接在一起,形成了具有各种功能的蛋白质。
而蛋白质的功能多种多样,有的像“建筑工人”,构成了生物体的结构;有的像“酶”,加速了各种化学反应;还有的像“信号使者”,在细胞间传递着重要的信息。
那么,蛋白质是怎么合成的呢?这就要从基因说起。
基因是存在于DNA 中的遗传信息,它们就像是一份份蓝图,决定了蛋白质的结构和功能。
当细胞需要合成某种蛋白质时,首先会通过一个叫做转录的过程,将 DNA 中的基因信息复制到 RNA 上,形成信使 RNA(mRNA)。
这个过程就像是从蓝图库中取出一份特定的蓝图并进行复制。
接下来,就是翻译的过程。
在细胞的细胞质中,有一种叫做核糖体的微小细胞器,它就像是一个蛋白质合成的“工作车间”。
mRNA 带着基因的信息来到核糖体,而细胞质中还有许多游离的氨基酸。
每个氨基酸都有一个与之对应的转运 RNA(tRNA),tRNA 就像是一个个送货员,它们能够识别 mRNA 上的密码子,并把对应的氨基酸送到核糖体上。
核糖体按照mRNA 上的密码顺序,将氨基酸一个一个连接起来,形成多肽链。
这整个过程就像是一场精心编排的舞蹈,每个参与者都有着明确的职责和精确的动作。
然而,这只是蛋白质合成的大致过程,其中的细节和调控机制则更加复杂和精妙。
化学生物学在研究蛋白质合成的过程中发挥了重要作用。
它通过运用化学的方法和技术,深入探究蛋白质合成的各个环节。
比如,利用化学合成的方法制备特定的氨基酸类似物,然后观察它们在蛋白质合成中的作用,从而了解氨基酸的结构和性质对蛋白质合成的影响。
生物化学中的亲和力研究

生物化学中的亲和力研究亲和力是一种生物化学现象,指的是分子之间的相互作用力度。
在生物化学中,亲和力对于理解生物体内分子间互相协作以及认识一些疾病的发生机制具有非常重要的意义。
因此,生物化学中的亲和力研究备受关注。
一、亲和力概述生物化学中的亲和力通常是指另一个分子或化合物对某个分子或化合物的选择性结合力。
它们以多种的方式作用,并在多个方面发挥作用。
例如,亲和力可以涉及多个过程,如酶催化、核酸与蛋白质之间的相互作用、激素与细胞受体的结合以及免疫反应。
在生物学中,亲和力还可以描述与生物体相关的概念,如抗原抗体、蛋白质分子间的互相作用、蛋白质/核酸和药物分子的作用,等等。
由于亲和力可以涉及多种生物学过程和机制,因此研究亲和力在生物化学领域也很重要。
二、亲和力的测量方法研究亲和力需要测量这些化合物之间的作用力度。
显然,这需要利用一些专门的化学方法和技术。
现在,亲和力的测量方法包括但不限于以下几种:1.琼脂糖电泳琼脂糖电泳被用作一种简单的亲和力测量方法。
这种方法可以通过对添加到研究中的溶液中的染料的迁移距离进行检测来解释化合物的亲和力。
2.荧光染料技术使用荧光染料可以实现亲和力的测量。
这种方法利用荧光信号信号的强度作为一种依赖于选择性的测量。
通过与溶液中已知某种物质的吸收光谱进行比较,可以确定浓度的大小。
3.表界面等离子体共振表界面等离子体共振(SPR)是一种在分子交互方面的高度灵敏技术。
这种技术利用表面感应科学,通过在光敏材料与薄膜之间形成极薄的电场,并测量此电场对光信号产生的影响来具体测量亲和力。
三、亲和力的应用生物化学中的亲和力在多个领域都有应用。
例如在药物研发中,候选化合物经多次筛选,可能与目标蛋白质相互作用形成复合物。
通过这种方式,了解候选化合物与目标蛋白质之间的亲和力是否能够产生治疗作用或产生不良反应。
另一个方面,亲和力的研究也有助于生物检测技术的发展。
例如,亲和分子筛分有助于提高细胞表面受体、酶、抗体等生物体分子的特异识别,对新型抗癌药物的筛选和评估,以及多肽药物的筛选和评估都具有重要意义。
生物分子的相互作用

生物分子的相互作用生物分子的相互作用是生物体内发生各种生物化学反应和生物过程的基础。
这些相互作用可以是物理性质的,也可以是化学性质的。
它们决定了生物分子的结构、功能以及生理活动的发生和进行。
本文将从分子间相互作用的类型、作用机制以及应用展开讨论。
一、分子间相互作用的类型1. 静电相互作用:生物分子中带电荷的官和偶极子之间的相互作用,如静电力、电荷转移以及电偶极作用。
2. 氢键:质子与氮、氧以及氟等原子之间的作用力,是生物分子自组装和细胞内高度有序结构形成的重要方式。
3. 范德华力:分子间的吸引力,其大小取决于分子之间的极性、偶极子和电荷分布。
4. 疏水作用:不喜水性分子相互间的相互作用,驱使水相聚一起,使非极性物质以及疏水性分子能形成有序的结构。
5. 弱键:包括范德华力、氢键以及疏水作用在内的一系列较弱的相互作用。
6. 共价键:共享电子对,生物体内主要是由于分子结构的稳定而存在。
二、分子间相互作用的作用机制1. 形成生物分子的结构特性:分子间相互作用决定了生物分子的结构特性,包括分子的形状、构象以及空间排列等。
这些结构特性直接影响着生物分子的功能和相互作用。
2. 保持生物体的稳定:分子间的相互作用能够维持生物体内的稳定性。
例如,水分子的氢键网络保持了液体水的凝聚性和高比热容。
3. 调节酶的催化作用:酶与底物之间的相互作用能够提供基于亲和性和专一性的催化条件,实现特定化学反应的高效发生。
4. 蛋白质和配体的结合:蛋白质与其配体之间的相互作用决定了信号传导、细胞识别、基因调控以及药物活性。
三、分子间相互作用的应用1. 药物研发:了解分子间相互作用有助于设计和合成药物分子,通过与靶标分子的相互作用发挥治疗作用。
2. 酶活性调控:研究酶与底物、辅因子等之间的相互作用,以调控酶的活性和功能,为酶工程和催化剂设计提供指导。
3. 蛋白质折叠和蛋白质-蛋白质相互作用:分析分子间相互作用有助于解析蛋白质折叠及其动力学、蛋白质复合物的形成和功能。
化学生物学化学物质与蛋白质的相互作用

化学生物学化学物质与蛋白质的相互作用化学生物学是一个交叉学科,涵盖了化学和生物学的知识,旨在研究和解释生物体中生化过程中发生的化学反应及其相互作用。
其中一个重要的研究领域是化学物质与蛋白质的相互作用。
本文将讨论这种相互作用的不同形式以及对生物体的影响。
化学物质与蛋白质之间的相互作用可以发生在多个层面上。
首先,化学物质可以与蛋白质的氨基酸残基之间形成共价键。
这种共价键的形成可以通过氨基酸侧链上的官能团参与,如硫化毒素与蛋白质中的半胱氨酸残基之间形成的二硫键。
此外,一些药物可能与蛋白质的氨基酸残基之间形成相似于共价键的结构,从而对蛋白质的功能产生影响。
这些共价键的形成通常是可逆的,因此当化学物质与蛋白质结合后,可以通过逆反应将其解除。
另一种常见的化学物质与蛋白质的相互作用形式是非共价键的结合。
这种结合通常是通过疏水相互作用、氢键、离子键或静电相互作用等进行的。
这些相互作用在形成和解离上相对较弱,因此它们的形成和解离通常是动态的。
这意味着化学物质和蛋白质之间的相互作用可以在不同的条件下发生改变,例如通过改变温度、pH值或离子浓度。
化学物质与蛋白质之间的相互作用可能对生物体产生多种影响。
首先,这些相互作用可以影响蛋白质的结构和稳定性。
当化学物质与蛋白质结合时,它们可能改变蛋白质的构象,使其从天然状态发生改变。
这种改变可能使蛋白质失去功能,或者导致蛋白质的结构变得不稳定,易于降解。
另外,相互作用可能影响蛋白质的活性。
化学物质与蛋白质结合后,可能阻断蛋白质与其底物或配体的结合,从而影响蛋白质的催化活性或信号传导能力。
化学物质与蛋白质的相互作用也可以用于生物医学研究和药物开发。
根据化合物与蛋白质之间的结合模式,可以设计和合成针对特定蛋白质的药物。
这些药物可以通过与蛋白质的相互作用来调节生物体内的生化过程,以达到治疗疾病的目的。
同时,研究化学物质与蛋白质的相互作用机制可以帮助我们更好地理解生化反应的基本原理,并为生物技术的开发提供新的思路。
生物化学中的蛋白质相互作用与功能

生物化学中的蛋白质相互作用与功能蛋白质是组成生命体的重要有机分子之一,它们以多种方式相互作用,形成复杂的生化反应网络,实现生物体内分子水平的调控和传递信息。
在这些相互作用中,蛋白质分子之间的相互作用尤为重要,它们决定了蛋白质的构象、折叠和功能,也是许多生命过程的关键环节。
一、蛋白质相互作用的类型蛋白质相互作用可分为三种类型:共价键结合、非共价键结合和杂交结合。
共价键结合是指两个蛋白质分子中的一些氨基酸残基之间通过共价键连接。
这种结合方式比较少见,通常是一些酶介导的化学反应过程中产生的。
非共价键结合是指蛋白质分子之间的非共价相互作用,包括范德华力、静电作用、氢键和疏水相互作用等。
其中,范德华力是指各种非极性分子之间的互相引力作用,是相对较弱的相互作用,但在蛋白质折叠中起着重要作用。
静电作用是指带有相反电荷的分子之间的相互作用,常常涉及离子对和膜蛋白。
氢键是指带有氢原子的分子与带有强电负性原子(如氧、氮和氟)的分子之间的相互作用,也是蛋白质折叠和氨基酸配对中的关键成分。
疏水相互作用是指蛋白质分子之间和蛋白质与溶液之间,由于疏水效应形成的相互作用。
杂交结合是指不同类型的相互作用与共同发挥作用而形成的相互作用。
例如,在蛋白质结构中,两个互相作用的纤维蛋白质可以通过氢键相互作用,这种作用被称为杂交氢键。
总的来说,这三种相互作用方式形成了蛋白质分子之间的复杂网络,控制着蛋白质结构和功能的形成和维持。
二、蛋白质交互作用的具体形式蛋白质的交互作用主要表现为三种基本形式:结构域域交互作用、线性序列之间的相互作用和同一蛋白质分子不同部位之间的相互作用。
结构域域交互作用是指蛋白质分子中几个结构域之间相互作用的方式。
在这种交互作用中,结构域通常是曲面状、球状、螺旋状或不规则状。
这些结构域中的氨基酸残基互相通过氢键等非共价键相互作用,形成一个整体。
线性序列之间的相互作用是指蛋白质分子中线性排列的氨基酸残基之间的相互作用。
蛋白质与药物的相互作用机理

蛋白质与药物的相互作用机理蛋白质和药物相互作用是化学和生物学领域的重要研究方向。
蛋白质是生命中最重要的分子之一,它们在细胞内起到许多重要的生理和生化功能。
而药物则是帮助人们治疗各种疾病的化学物质。
因此,了解蛋白质和药物之间的相互作用机理对于药物发现和生命科学研究具有重要的意义。
蛋白质是由氨基酸组成的,它们可以通过共价键和非共价键与其他分子相互作用。
药物通常是小分子有机化合物或生物大分子。
在药物分子与蛋白质分子相互作用的过程中,药物分子会与蛋白质中的氨基酸残基发生相互作用。
药物与蛋白质相互作用的主要方式包括静电相互作用、范德华相互作用和氢键相互作用。
静电相互作用通常发生在药物分子与蛋白质分子电荷相反的残基之间,例如药物分子的正电荷与蛋白质分子的负电荷相互作用。
范德华相互作用是指药物分子与蛋白质分子之间存在的非共价相互作用,其中的分子通常是疏水性的,并且药物分子通常含有烷基、苯环等疏水性残基。
氢键相互作用则是指药物分子与蛋白质分子之间形成的氢键,药物分子中通常含有带有氢键作用的官能团。
药物分子与蛋白质分子之间的相互作用通常会导致药物分子的构象发生变化,从而影响药物分子的生物活性和选择性。
大多数药物通常会优先与某些特定的蛋白质分子结合,从而发挥生物学效应。
这些蛋白质分子通常被称为药物靶标。
药物靶标与药物之间的相互作用可以通过分子对接等计算方法进行模拟和预测。
药物与蛋白质之间的相互作用不仅会影响药物分子的体内代谢和排泄,也可能会导致药物分子的毒副作用。
因此,了解药物与蛋白质之间的相互作用机理具有重要的医学和药理学意义。
对于研究新型药物的发现和开发、药物代谢和安全性评估等领域都有着重要的意义。
总之,蛋白质与药物的相互作用机理对于药物发现和生命科学研究具有重要的意义。
药物与蛋白质的相互作用通常通过静电相互作用、范德华相互作用和氢键相互作用实现。
药物可以选择性地结合到特定的蛋白质靶标上,从而影响药物的生物活性和选择性。
化学生物学期末考试问答题

化学生物学期末考试问答题化学生物学导论期终复习题11.化学物质与生物大分子相互作用的化学本质是什么?即主要作用力是什么?本质,化学物质与生物大分子(蛋白质、酶和核酸)之间作用力。
分子间相互作用力分为两类,即强相互作用(主要指共价键)和弱相互作用(又称分子间力,包括范德华力、氢键等)。
前者通常维持分子的基本结构,它是使分子中或分子间的原子之间结合的主要相互作用,这些作用决定着生物大分子的一级结构。
也有部分药物是通过强相互作用起作用的,其结合能远远超过分子的平均热动能。
弱相互作用在数值上虽比强相互作用小得多,但它在维持生物大分子的二级、三级、四级结构中以及在维持其功能活性中起着相当重要的作用,也是药物与生物大分子相互作用的重要识别方式非共价键的相互作用:离子键,离子-偶极作用和偶极-偶极作用,氢键,电荷转移,疏水性相互作用,范德华力,螯合作用。
2.如何通过诱导契合理论解释不同蛋白质与同一种化合物的相互作用。
构象的改变和生物活性的呈现密切相关。
诱导契合学说就是指,酶在与底物相互作用下,具有柔性和可塑性的酶活性中心被诱导发生构象变化,因而产生互补性结合。
这种构象的诱导变化是可逆的,可以复原。
不同蛋白质,对于同一种化合物,各自产生不同的诱导契合变化从而发生各自的相互作用。
构象因素,同一种化合物与不同蛋白质相互作用,有可能发生离子配位或(受体学说)化合物不同的构象可以与不同的蛋白质结合产生不同的效果(当然结合部位不同),蛋白质有诱导契合作用,令化合物的构象发生改变,两个构象都发生改变。
3.化学物质的立体化学因素如何影响与生物大分子的相互作用?药物与底物契合程度的好坏,直接影响药物的生物活性。
几何异构:由于化合物分子中存在刚性或半刚性结构部分,如双键或脂环,使分子内部分共价键的自由旋转受到限制而产生的顺(Z)反(E)异构现象称为几何异构。
几何异构体中的官能团或与受体互补的药效基团的排列相差极大,理化性质和生物活性也都有较大差别。
化学物质与蛋白质的相互作用总结

化学物质与蛋白质的相互作用总结化学物质与蛋白质的相互作用是生物化学领域中重要的研究课题之一、蛋白质是生物体中最重要的类别之一,其在生物过程中发挥着至关重要的作用。
与蛋白质的相互作用可以帮助我们理解生物体内的生物化学机制,并为药物设计和疾病治疗提供新的思路和方法。
静电相互作用是蛋白质与药物分子之间最常见的相互作用之一、当蛋白质的表面带有正电荷或负电荷时,可以与带有相反电荷的药物分子形成静电相互作用。
这种相互作用可以增强药物分子与蛋白质的结合力,从而影响药物的药理活性和生物利用度。
氢键是另一种重要的非共价相互作用方式。
氢键是指在一个分子内或不同分子之间,通过一个氢原子与一个电负原子(如氧、氮、氟等)形成的共价键。
蛋白质通常含有氢键供体和受体位点,药物分子可以与这些位点形成氢键相互作用。
氢键的强度和方向性较强,对于蛋白质的结构稳定性和药物的结合亲和力起到关键作用。
疏水作用也是影响化学物质与蛋白质相互作用的重要因素。
蛋白质分子通常由极性氨基酸残基和非极性氨基酸残基组成,而非极性残基对水有亲和力,这就使得蛋白质分子更倾向于将非极性残基排斥到溶液中,从而使其折叠形成较稳定的三维结构。
药物分子也可以通过疏水作用与蛋白质分子中的非极性残基发生相互作用,影响药物在生物体内的分布和代谢。
范德华力是一种非常微弱的相互作用力,但在大量分子之间的累积效应下,可以对化学物质与蛋白质的相互作用产生显著影响。
范德华力是由于分子之间的瞬时感应偶极引起的,可以通过作用于分子间的电子分布来增加分子之间的吸引力。
蛋白质与药物分子之间的范德华力作用可以增强药物的亲和力和稳定性。
与非共价相互作用相比,共价相互作用在蛋白质与化学物质之间相互作用中较为罕见,但却有着重要的意义。
共价结合通常是通过化学反应中的酯化、酰胺化或硫醚化等反应形成的。
化学物质与蛋白质之间的共价结合可以引发一系列的生物响应,例如药物与蛋白质的共价结合可以导致药物失活或出现新的活性。
南开大学结构生物学第五讲-2-核酸-蛋白质的相互作用研究方法的新进展

2.2 核苷酸-氨基酸相互作用数据库
核苷酸-氨基酸相互作用数据库搜集核苷酸和氨基 酸间4 埃大小内的成对原子,能让使用者找到成对 的核苷酸和氨基酸。
使用者可以指定残基名称( 核苷酸或氨基酸)、原子 类型和侧链/ 骨干。
3 生物芯片技术
生物芯片技术是基于生物大分子间相互作用 的大规模并行分析方法,使得生命科学研究 中所涉及的样品反应、检测、分析等过程得 以连续化、集成化和微型化,现已成为当今 生命科学研究领域发展最快的技术之一。
目前的生物芯片主要有核酸芯片、蛋白质芯 片和糖体芯片等几大类。
蛋白质芯片是依靠手工、压印或喷墨的方 法将探针蛋白点样在化学膜、凝胶、微孔 板或玻片上形成阵列,经过与样品的杂交 捕获靶蛋白,再用原子力显微镜、磷光成 像仪、光密度仪或激光共聚焦扫描仪进行 检测,获得靶蛋白表达的种类、数量及关 联等信息。
研究蛋白质/ 核酸相互作用近期采用的新技 术有:1.核酸适体技术、2.生物信息学方法、 3.蛋白质芯片技术以及4.纳米技术等。
蛋白质和核酸是构成生命体最为重要的两类 生物大分子。
蛋白质与核酸的相互作用是分子生物学研究 的中心问题之一,它是许多生命活动的重要 组成部分。
随着人类基因组计划的完成,大量基因被发 现和定位,基因的功能问题将成为今后研究 的热点。大多数基因的最终产物是相应的蛋 白质,因此要认识基因的功能,必然要研究 基因所表达的蛋白质。
通过准确检测DNA分子穿孔过程中引起的 电流阻塞效应,可将DNA与组蛋白的相互 作用的一些性质反映出来。
蛋白质的功能往往体现在与其他蛋白质及 (或)核酸的相互作用之中。
细胞各种重要的生理过程,包括信号的转导、 细胞对外界环境及内环境变化的反应等,都 是以蛋白质与其他物质的相互作用为纽带。
蛋白质和核酸相互作用的研究和应用

蛋白质和核酸相互作用的研究和应用蛋白质和核酸是生命体中不可或缺的两种分子。
蛋白质是生命体内众多生物分子中最为普遍的一类,同时也是功能最为多样化的一类生物分子。
核酸则是生命体内遗传物质的主要组成部分。
蛋白质和核酸之间的相互作用一直是生命科学领域中的一大研究热点。
本文将从生物学、化学、生物医学和生物技术等多个角度对蛋白质和核酸之间的相互作用进行探讨。
一、蛋白质和核酸之间的结合生命体内的大部分功能都是由蛋白质和核酸之间的相互作用完成的。
蛋白质和核酸之间的相互作用主要包括直接作用和间接作用两种形式。
直接作用是指蛋白质和核酸之间的物理力相互作用,如静电作用、范德华力、羟基和氨基间的氢键等力。
间接作用则是指蛋白质通过一些其他分子来与核酸进行相互作用,如转录因子、调节蛋白等。
直接作用和间接作用在生命体内的各种生物过程中都起着至关重要的作用。
蛋白质和核酸之间的作用与它们的结构密切相关。
大多数蛋白质和核酸都具有特定的三维结构,这种结构与生命体内各种生物过程的功能密切相关。
蛋白质和核酸的结构与它们之间的相互作用有着密不可分的联系,两者之间的作用会随着结构的改变而发生变化。
二、蛋白质和核酸相互作用的生物学意义蛋白质和核酸之间的相互作用在生物学上具有非常重要的意义。
这种相互作用常常被用来实现生物体内各种生物过程的调节和控制。
例如,许多转录因子是一类可以与DNA结合并实现基因转录调控的蛋白质。
这些蛋白质通过与DNA的结合,可以进而影响DNA上的相应基因的表达,实现对基因转录和表达的调节。
此外,蛋白质和核酸之间的相互作用也是DNA复制、DNA修复、RNA翻译等生物过程的重要组成部分。
三、蛋白质和核酸相互作用的化学基础蛋白质和核酸之间的相互作用在化学上的基础主要是它们在分子水平上的相互作用。
蛋白质和核酸分子之间的相互作用是由不同的化学基团之间的相互作用引起的。
这些化学基团包括胺基、羧基、磷酸基、硫醇基等。
在蛋白质和核酸之间的相互作用中,蛋白质分子通常会与DNA分子之间的磷酸二酯键进行相互作用。
生物大分子与药物相互作用

生物大分子与药物相互作用生物大分子和药物之间的相互作用一直以来都是生物科学研究的热点问题。
大分子是生命体系中的重要组分,包括核酸、蛋白质、多糖等,而药物是治疗和预防疾病的化学物质。
药物在人体内的作用是通过与生物大分子发生相互作用来实现的。
因此,了解生物大分子与药物之间的相互作用机制对于药物开发和药效评价至关重要。
一、药物与蛋白质的相互作用1. 非共价相互作用药物与蛋白质结合通常是非共价的相互作用。
其中最为常见的是氢键、离子键、疏水作用和范德华力等作用。
例如,药物阿司匹林和白蛋白结合时,阿司匹林分子的羧基部分与白蛋白上的氨基酸残基形成氢键,而阿司匹林与白蛋白的疏水作用也起到很重要的作用。
这种非共价相互作用形成的药物-蛋白质复合体是比较松散的,因此药物可以在短时间内与蛋白质结合和解离。
2. 共价相互作用共价相互作用通常指的是药物与蛋白质中的半胱氨酸、赖氨酸、组氨酸和色氨酸等含有活性官能团的氨基酸残基之间的化学键的形成。
共价相互作用有很高的亲和力和特异性,药物与蛋白质的结合比非共价相互作用更为牢固。
二、药物与核酸的相互作用药物与核酸之间的相互作用分为两类:一类是基于非共价相互作用如氢键、疏水作用、范德华力和离子键等;另一类是共价相互作用,通常是指药物直接与DNA或RNA中的核苷酸成键。
目前许多药物都是结合在核酸的主要组成部分如腺嘌呤、鸟嘌呤、胸腺嘧啶、胞嘧啶和尿嘧啶等上面,这些核苷酸残基的特异性可用于指导药物的分子设计与筛选。
三、药物与多糖的相互作用多糖包括天然多糖和化学合成多糖。
其中,药物和肝素、壳聚糖、甘露醇等多糖物质之间的相互作用被广泛研究,这些研究多在新型药物的研究及其负载纳米粒子,以及制备可控释放系统方面应用广泛。
药物与多糖之间的相互作用存在一些弱作用力,包括范德华力、水素键、离子键和疏水作用等,这些相互作用会影响到多糖的结构和功能,从而产生不同的生物效应。
四、药物与锁定在膜上的酶的相互作用很多酶比如膜质酶、细胞外酶、蛋白酶、磷酸酶等都被固定在细胞膜上,并具有膜上可翻滚功能。
两个蛋白质相互作用

两个蛋白质相互作用
蛋白质之间的相互作用可以通过多种方式实现。
其中,蛋白质
之间的结合是最为常见的一种方式。
蛋白质可以通过它们的结构中
的特定区域与其他蛋白质结合,形成蛋白质复合物。
这种相互作用
可以是暂时性的,也可以是持久的。
另一种蛋白质相互作用的方式是酶与底物之间的相互作用。
酶
是一种特殊的蛋白质,它们可以催化化学反应,而这种催化作用往
往需要与特定的底物结合。
这种结合是高度特异性的,酶只能与特
定的底物结合并催化特定的化学反应。
除了上述方式之外,蛋白质之间还可以通过信号传导途径进行
相互作用。
在细胞内,蛋白质可以通过与细胞膜上的受体蛋白结合,从而传递特定的信号。
这种相互作用对于细胞内的信号传导和调控
起着至关重要的作用。
总的来说,蛋白质之间的相互作用是生物体内各种生命活动的
基础。
对这些相互作用的深入研究不仅有助于我们更好地理解生命
的本质,也为新药物的研发和疾病的治疗提供了重要的理论基础。
因此,对蛋白质相互作用的研究具有极其重要的意义。
蛋白质 相互作用

蛋白质相互作用
蛋白质相互作用是指两种或以上的蛋白质结合的过程。
这种结合通常是为了执行其特定的生化功能,如DNA复制、信号传递等。
在细胞中,大量的蛋白质元件组成分子机器,通过蛋白质相互作用来执行细胞内多数重要的分子过程。
蛋白质复合体是蛋白质通过长时间交互作用形成的,它们负责携带另一个蛋白质,例如从细胞质至细胞核,或反之。
此外,短暂的交互作用可以修饰另一个蛋白质,例如蛋白激酶将磷酸盐转移到目标蛋白上。
蛋白质相互作用广泛参与了生物化学、量子化学、分子动力学、讯息传递等代谢或遗传学/表观遗传学过程。
它是所有活体细胞中整个交互作用组学系
统的核心,主宰了活体细胞内几乎所有的生化反应。
蛋白质相互作用的基础是它们表面的原子尺度特征,这些特征能够与其他物质的原子尺度特征产生吸引或排斥。
如果两种蛋白质的表面特征能够精确匹配并相互吸引,它们就可以结合在一起。
这种结合需要单个原子尺度上的空间位置能匹配,比钟表齿轮的啮合还要精密得多。
以上内容仅供参考,如需更多专业信息,建议查阅相关文献或咨询生物学家。
生物化学与分子生物学试题库及参考答案

生物化学与分子生物学试题库及参考答案一、单选题(共80题,每题1分,共80分)1、构建基因组DNA文库时,通常需分离细胞的核酸部分是()。
A、染色体DNAB、线粒体DNAC、总mRNAD、tRNAE、rRNA正确答案:A答案解析:基因组DNA代表一个细胞或生物体整套遗传信息的所有DNA 序列,因此构建基因组DNA文库需要首先分离组织或细胞的染色体DNA,然后利用限制性核酸内切酶将染色体DNA切割成基因水平的许多片段,将它们与适当的克隆载体拼结成重组DNA分子,继而转入受体菌扩增,使每个细菌内都携带一种重组DNA分子的多个拷贝,全部细菌所携带的各种染色体片段就代表了整个基因组。
2、长期饥饿时脑组织的主要能源是()。
A、核苷酸B、氨基酸C、葡萄糖D、脂肪酸E、酮体正确答案:E答案解析:长期饥饿时血糖下降,脂肪动员,大量乙酰CoA在肝合成酮体,后者可通过血脑屏障,成为脑组织的主要能源。
3、体内脱氧核苷酸生成的主要方式是()。
A、直接由核糖还原B、由二磷酸核苷还原C、由核苷还原D、由三磷酸核苷还原E、由一磷酸核苷还原正确答案:B答案解析:体内脱氧核苷酸生成的主要方式是在二磷酸核苷的水平上还原生成。
但例外的是,dTMP的生成主要是由dUMP甲基化生成。
4、胆固醇可以转变为()。
A、胆红索B、胆绿素C、甲状腺激素D、胆汁酸E、前列腺素正确答案:D答案解析:胆固醇在体内代谢的主要去路是在肝中转变为胆汁酸,随胆汁排入肠道。
5、对哺乳类动物DNA复制的叙述,错误的是()。
A、RNA引物较小B、冈崎片段较小C、DNA聚合酶δ和α参与D、仅有一个复制起始点E、片段连接时由ATP供给能量正确答案:D答案解析:哺乳类动物(真核生物)DNA复制的起始点是多个。
6、不通过胞内受体发挥作用的是()。
A、雌激素B、肾上腺素C、维生素DD、甲状腺激素E、肾上腺皮质素正确答案:B答案解析:B项,肾上腺素与质膜受体结合,通过cAMP-蛋白激酶途径转导信息;ACDE四项,是脂溶性激素,均可通过细胞膜与胞内受体作用。
化学物质与蛋白质的相互作用总结
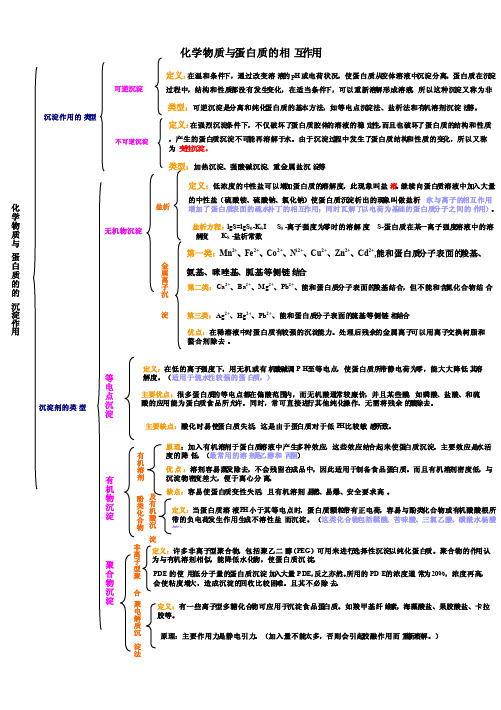
化学物质与蛋白质的相互作用化学物质与蛋白质的的沉淀作用 沉淀作用的类型 可逆沉淀 定义:在温和条件下,通过改变溶液的pH 或电荷状况,使蛋白质从胶体溶液中沉淀分离。
蛋白质在沉淀过程中,结构和性质都没有发生变化,在适当条件下,可以重新溶解形成溶液,所以这种沉淀又称为非变性沉淀。
类型:可逆沉淀是分离和纯化蛋白质的基本方法,如等电点沉淀法、盐析法和有机溶剂沉淀法等。
不可逆沉淀 定义:在强烈沉淀条件下,不仅破坏了蛋白质胶体的溶液的稳定性,而且也破坏了蛋白质的结构和性质,产生的蛋白质沉淀不可能再溶解于水。
由于沉淀过程中发生了蛋白质结构和性质的变化,所以又称为变性沉淀。
类型:加热沉淀、强酸碱沉淀、重金属盐沉淀等 沉淀剂的类型无机物沉淀 盐析 定义:低浓度的中性盐可以增加蛋白质的溶解度,此现象叫盐溶。
继续向蛋白质溶液中加入大量的中性盐(硫酸铵、硫酸钠、氯化钠)使蛋白质沉淀析出的现象叫做盐析(水与离子的相互作用增加了蛋白质表面的疏水补丁的相互作用;同时瓦解了以电荷为基础的蛋白质分子之间的作用)。
盐析方程:lgS=lgS 0-K S I S 0 -离子强度为零时的溶解度 S-蛋白质在某一离子强度溶液中的溶解度 K S -盐析常数 第一类:Mn 2+、Fe 2+、Co 2+、N i2+、Cu 2+、Zn 2+、Cd 2+,能和蛋白质分子表面的羧基、氨基、咪唑基、胍基等侧链结合 金属离子沉淀法第二类:Ca 2+、Ba 2+、Mg 2+、Pb 2+、能和蛋白质分子表面的羧基结合,但不能和含氮化合物结合 第三类:Ag 2+、Hg 2+、Pb 2+、能和蛋白质分子表面的巯基等侧链相结合 优点:在稀溶液中对蛋白质有较强的沉淀能力。
处理后残余的金属离子可以用离子交换树脂和螯合剂除去。
生命的化学基础——核酸和蛋白质的相互作用

生命的化学基础——核酸和蛋白质的相互作用在生命的起源和演化过程中,核酸和蛋白质是两个至关重要的生物大分子。
核酸是生命的遗传物质,负责传递和保存生物体内各种遗传信息;蛋白质则是生命的基本工具,负责生物体内的各项生物学过程和机能。
它们之间的相互作用,便决定了生命本身的运作和表现。
核酸的结构和功能核酸是由核苷酸连接而成的大分子,是生物体内储存遗传信息的基本分子。
核苷酸由糖、碱基和磷酸三部分组成,不同的碱基决定了核苷酸不同的信息载体。
核酸的主要类型有DNA(脱氧核糖核酸)和RNA(核糖核酸)两种,其中DNA是固有的遗传信息,而RNA则负责DNA的转录和翻译过程,将基因信息调控至蛋白质合成过程中。
核酸的信息特异性、精密的复制和传递,是生命活动不可或缺的基础。
它们在细胞分裂和有性繁殖过程中,以独特的方式进行遗传物质传递和变异,从而在物种演化和适应过程中发挥了重要的作用。
蛋白质的结构和功能蛋白质是由氨基酸连接而成的巨大分子,是生物体内各种工具酶、激素、抗体的基础,也是细胞内外的结构成分。
根据氨基酸的不同组合和排列方式,会形成不同的蛋白质结构和性质。
蛋白质在生命活动中的作用非常多样,包括催化、传输、调节、结构维持等等。
在蛋白质结构和功能的表达中,核酸则扮演了重要的导演角色。
在生物体内,核酸以基因形式储存蛋白质的信息,并通过转录和翻译过程,将这些信息转化为可读的蛋白质序列。
同时,在各种细胞生命活动中,蛋白质则作为各种生物学过程的重要实现物质,执行着各种不同的机能。
核酸和蛋白质的相互作用核酸和蛋白质之间的相互作用,是生命活动中至关重要的一个环节。
在生物体内,大部分核酸和蛋白质都相互作用着,形成了复杂的生物学网络。
这些相互作用的形式包括:核酸和蛋白质的组装、切换、传递、调控等等。
例如,在许多调控生物学过程的关键步骤中,核酸和蛋白质之间的相互作用是缺一不可的。
这些过程中,核酸等分子能够借助碱基序列的特异性,与蛋白质表面区域上的特定氨基酸残基发生结合作用,从而实现过程的调节和实现。
化学物质和生命之间的相互联系

化学物质和生命之间的相互联系化学物质和生命的关系是一个既复杂又神奇的话题。
从最基本的元素到复杂的有机分子,都为生物学提供了研究的基础。
我们可以通过了解生命的化学组成和生物学过程来更好地理解这个话题。
分子、元素和原子生命从分子开始,分子从元素开始。
地球上常见的元素有92种,其中26种被认为是生命所需的元素。
这些元素包括碳、氢、氮、氧、磷和硫等。
这些元素组成了生物体内的分子,例如蛋白质、核酸、脂质和多糖等。
所有元素都由原子组成。
原子是化学元素的最小单位,由质子、中子和电子组成。
质子和中子在原子核中,而电子绕着原子核运动。
原子中的电子数不同,就会产生不同的元素。
例如,碳原子有6个电子,氧原子有8个电子。
生命的化学组成生物体内最基本的单位是细胞。
细胞内有许多分子,这些分子通过复杂的化学反应网络实现细胞内的各种功能。
一些常见的生命有机分子包括:蛋白质:由氨基酸组成,它们形成了生物体内酶、肌肉、组织以及其他功能性蛋白质。
核酸:DNA和RNA是构成基因的核酸。
它们是由核苷酸组成的,由碱基、糖分和磷酸组成。
脂质:脂质包括脂肪酸和甘油。
它们是许多细胞膜和组织的重要成分。
多糖:多糖是由许多单糖分子组成的,例如葡萄糖等。
它们在生命过程中起到了储存能量以及提供结构支持的作用。
生物分子之间的相互作用生命中的每个分子都有对其他分子的特定相互作用。
这些相互作用可以是共价键、离子键、氢键、疏水作用等。
这些作用决定了分子之间的结构和相互作用方式。
蛋白质是细胞内最复杂的生物有机物之一。
蛋白质具有多种功能,包括催化化学反应、提供结构支持和在细胞信号传递中起作用。
蛋白质与其他分子的作用方式为“锁-键”,即只有特定的配体才能与蛋白质的激活位点结合。
DNA和RNA也是生物体内极其重要的生物有机物。
DNA保存了生命的遗传信息,RNA参与了蛋白质合成过程。
核苷酸与其他分子相互作用的方式为氢键。
脂质是生物体内结构和功能的重要成分。
细胞膜是脂质的一种重要形式,它由许多疏水作用强的脂质分子组成。
化学生物学复习题及答案

化学生物学复习题及答案 Prepared on 22 November 2020第一章蛋白质1.蛋白质的基本单位——氨基酸2.蛋白质的空间结构:一级结构:组成蛋白质的多肽链的数目,多肽链的氨基酸排列顺序以及多肽链内或链间二硫键的数目和位置。
维系一级结构的主要作用力:肽键二级结构:肽链主链折叠产生的有规则的几何走向。
蛋白质二级结构主要形式有α-螺旋、β-折叠、β-转角和无规则卷曲。
维系蛋白质二级结构的主要作用力:氢键三级结构:在二级结构基础上,肽链的不同区段的侧链基团相互作用在空间进一步盘绕、折叠形成的包括主链和侧链构象在内的特征三维结构。
维系蛋白质三级结构的力主要有氢键、疏水键、离子键和范德华力等。
尤其是疏水键。
四级结构:由多条各自具有一、二、三级结构的肽链通过非共价键连接起来的结构形式。
维持亚基之间的化学键主要是疏水力。
第二章酶1.酶的催化作用特性:高效性;选择性;条件温和;酶活力可调节控制。
酶催化作用的选择性表现在:反应专一性;底物专一性;立体化学专一性。
2.酶的组成可以分为两类:单纯蛋白酶和结合蛋白酶。
结合蛋白酶分为酶蛋白和辅助成分(辅酶和金属离子)3.常见的辅酶: NAD+ 、NADP+、 FAD、FMN、辅酶A(CoA)、四氢叶酸(FH4或THFA)、焦磷酸硫胺素(TPP)、磷酸吡哆素、生物素、维生素B12辅酶、硫辛酸、辅酶Q(CoQ)4.酶的活性部位或活性中心包括:结合部位和催化部位。
结合部位决定酶的专一性;催化部位决定酶所催化反应的性质5.酶作用专一性的机制:锁钥学说、“三点结合”的催化理论、诱导契合学说第三章核酸2. 核苷酸的衍生物: ATP (腺嘌呤核糖核苷三磷酸)、 GTP (鸟嘌呤核糖核苷三磷酸)。
ATP中磷酸键水解能高的分子结构特点:静电效应和共振稳定因素3. DNA双螺旋结构的特点:DNA分子由两条多聚脱氧核糖核苷酸链组成嘌呤碱基和嘧啶碱基位于螺旋的内侧,磷酸和脱氧核糖基位于螺旋外侧螺旋横截面的直径为2nm,每条链相邻碱基平面间隔为,每10个核苷酸形成一个螺旋,螺距为两条DNA链相互结合以及形成双螺旋的力是链间的碱基对所形成的氢键维持这种稳定性的因素:两条DNA链之间形成的氢键的分类及各自的结构特点与在遗传信息的传递与表达中的主要功能。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.染料探针
原理: 利用蛋白质与染料结合成沉淀或改变结合染料的光吸收特 性,借助染料颜色的减退或变化的程度来测定蛋白质的含量。
λ=600nm
考马斯亮蓝G-250测蛋白质含量
优点: 使用方便,反应时间短,染色 稳定,对显色时间不严格要求 ,抗干扰性强,为常用的蛋白
浓度测定方法。
该法线性范围1~2 μg/mL,是 灵敏度最高的染料探针分析方 法。 λ= 595nm
• 组氨酸的咪唑基 • 酪氨酸中的酚基 • 色氨酸的吲哚基
3.与白蛋白的共价结合
4.与血红蛋白共价结合
5.与细胞内蛋白共价结合
二、特定的氨基酸残基侧链基团的修饰
蛋白质侧链基团的修饰是通过选择性的试剂或亲和标记试剂与 蛋白质分子侧链上特定的功能基团发生化合反应而实现的
作用:探测活性质荧光探针
作为一个好的荧光探针应满足以下条件: ①探针分子与蛋白质分子的某一微区必须有特异性的结合 ,并且结合比较牢固。 ②探针的荧光必须对环境条件敏感。 ③蛋白质分子与探针结合后不影响其原来的结构和特性。 在满足这些条件的基础上可进行蛋白质的测定及与金属离
子结合的计量化学等。
常用的蛋白质荧光探针
优点:溶剂易蒸发除去,无残留 用途:适用于制备食品蛋白质 缺点:易使蛋白质变性失活, 且有机溶剂易燃、易爆,安全要求较高
最常用的溶剂是乙醇和丙酮
(2)酚类化合物及有机酸沉淀
鞣酸(又称单宁)、苦味酸(即2,4,6-三硝基苯酚)、 三氯乙酸、磺酰水杨酸
水解类单宁
缩合类单宁
单宁-蛋白质结合是分子识别的典型例子。要考虑作为供体的多酚 和作为受体的蛋白质的分子组成、结构和构型,也要考虑它们的 协同作用。Haslam等认为,可用“手-手套”(Hand-in-Glove)模型 说明此反应。蛋白质分子中疏水基团较集中的部位构成“疏水袋 ”,单宁分子进入“疏水袋”中并通过氢键加强结合。因此影响 单宁与蛋白质结合的因素有:单宁的分子尺寸,分子量大于500时 产生较牢固的结合;单宁的酚羟基和疏水基数量多者结合强;具 有柔性的分子构型者结合强;水溶性低者结合强。因此水解单宁 的收敛性与其所含疏水基多少有直接的关系,缩合单宁则与其聚 合程度有关,往往前者的收敛性大于后者。
苯乙二醛可以与精氨酸残基不可逆的结合
4-羟基-3-硝基苯乙二醛可使被修饰的精氨酸残基在405nm 处具有光吸收效应。 对硝基苯乙二醛修饰精氨酸残基可以得到具有旋光性的惟一产 物,在pH9.0的情况下可以用340nm处光吸收值来定量。
三、亲和性标记
亲和性标记试剂的优点: 能够选择性地结合在蛋白质分子的表面上的特定部位 具有饱和性,与底物或天然配体竞争蛋白质分子的结合位点。
阴离子的盐析效果 枸橡酸盐 > PO43- > SO42->CHCOO->Cl->NO3->SCN高价阳离子的效果不如低价阳离子 对于1价阳离子: NH + > K+ > Na+ 4 最常用的盐析剂是硫酸铵、硫酸钠、磷酸钾或磷酸钠
(2)金属离子沉淀法 ① Mn2+、Fe2+、Co2+、Ni2+、Cu2+、Zn2+、Cd2+ 与蛋白质分子表面的羧基、氨基、咪唑基、胍基等侧链结合 ② Ca2+、Ba2+、Mg2+、Pb2+ 与蛋白质分子表面的羧基结合,但不与含氮化合物相结合 ③ Ag2+、Hg2+ 与蛋白质分子表面的巯基相结合
底物、辅酶
金属离子
(3)化学修饰
第三节
化学物质对蛋白质侧链基团 的共价修饰作用
一、生物体内蛋白质加合物的形成
非共价结合 相互作用方式 共价结合
不可逆
1. 可与 蛋白 质发 生反 应的 化合 物
2.蛋白质分子中的可反应基团
• • • • 氨基酸的氨基和羧基 丝氨酸和苏氨酸所特有的羟基 半胱氨酸的巯基 精氨酸的胍基
第六章
化学物质与蛋白质的相 互作用
第一节 化学物质对蛋白质的沉淀作用
一、沉淀作用的类型
等电点沉淀法
1.可逆沉淀(非变性沉淀 )
条件温和
结构和性质不变化 分离和纯化蛋白质的基本方法 具有部分纯化、浓缩特点
盐析法 有机溶剂沉淀法
一、沉淀作用的类型
加热沉淀
2.不可逆沉淀(变性沉淀 )
强烈沉淀条件 破坏了蛋白质胶体溶液的稳定性
判断必需基团的性质和数目
1.巯基的化学修饰
烷基化试剂(碘乙酸、碘乙酰胺 ) 多肽链氨基酸顺序分析过程中防止半胱氨酸的氧化 N-乙基马来酰亚胺 有较强专一性和光吸收的变化,易于确定反应程度 5,5’-二硫-2-硝基苯甲酸(DTNB)
有机汞试剂(对氯汞苯甲酸 )
溶于水中形成羟基衍生物,与巯基相互作用时在255nm处光 吸收具有较大的增强效应
2.等电点沉淀
适用于疏水性较强 的蛋白质
优点:
(1)很多蛋白质的等电点都在偏酸性范围内,而无机酸通常较 廉价;
(2)某些酸,如磷酸、盐酸和硫酸的应用能为蛋白质类食品所 允许; (3)常可直接进行其他纯化操作,无需将残余的酸除去。 缺点: 酸化时易使蛋白质失活
3.有机物沉淀 (1)有机溶剂 主要效应是水活度的降低
1-苯氨基-8-萘磺酸(ANS)
与组合蛋白质在酸性条 件下结合时能产生很强 的荧光,激发峰位于 375nm,荧光峰位于
500nm,可用于组蛋白
含量的测定
常用的蛋白质荧光探针
αβγδ-四(对磺苯基)卟啉(TPPS4)
微量蛋白质对TPPS4 具有荧光猝灭作用, 可以测定纳克级的蛋 白质。
常用的蛋白质荧光探针
2.氨基的化学修饰
非质子化赖氨酸的ε-氨基是蛋白质分子中亲核反应活性很高的 基团
三硝基苯磺酸(TNBS)与赖氨酸残基反应,在420nm和 367nm能够产生特定的光吸收
2,4-二硝基氟苯(DNFD)法、丹磺酰氯(DNS)法和苯异硫 氰酸酯(PITC)法都是常用的氨基修饰方法。
3.羧基的化学修饰
水溶性的碳化二亚胺类化合物
复合物之后,体系的光谱性质发生变化,从而可以提供蛋白 质浓度或结构方面的信息。
一、蛋白质吸光探针
1.金属探针 (1)双缩脲法
双缩脲在碱性溶液中与铜离子(Cu2+) 生成紫红色化合 物的反应,可在540 nm测量吸光度
紫 红 色
(2)Folin-Lowry法 产物最大光吸收波长:640 nm
优点:比双缩脲法灵敏100倍
2-对甲苯氨基萘-6-磺酸(TNS) 1-(N-二甲胺)萘-5-磺酸(DNS) 荧光胺
αβγδ-四(对羧苯基)卟咻(TCPP)
铬天青S
吖啶橙
三、蛋白质光散射探针
共振光散射技术
研究小分子物质与蛋白质、核酸等生物大分子 发生作用并形成聚集体的灵敏的探测技术 光散射探针分析的基础是试剂分子或络合物与蛋白 质结合,导致体系的光散射信号明显增强。
强酸碱沉淀
重金属盐沉淀
破坏了蛋白质的结构和性质
3.抗体-抗原沉淀
二、沉淀剂的类型
1.无机物沉淀
(1)盐析 盐析方程
lgS=lgS0-KsI
So代表当离子强度为零时的溶解度; S为蛋白质在某一离子强度溶液中的溶解度; I为中性盐的离子强度; Ks为盐析常数,Ks值越大,该盐的盐析效果较好
阴离子对蛋白质盐析影响较显著,而阳离子影响次之。 含高价阴离子的盐,效果比1价的盐好
缺点:反应受多种因素干扰,在显色灵敏度方面存在差异。 应用范围:本法可测定范围是25~250μg/mL蛋白质
(3)二喹啉甲酸法(BCA,bicinchoninic acid ) 原理: 碱性条件下,蛋白质分子中的肽键与铜离子反应生成
Cu+,Cu+再与BCA反应形成紫色络合物,在565nm测量
吸光度。 优点: 试剂稳定,干扰少,各种蛋白质之间显色差异小
蛋白质光散射探针与蛋白质的吸收光谱探针相类似
三、蛋白质光散射探针
共振光散射技术
优点: 灵敏度较荧光分析法高, 可在普通荧光分光光度计上操作进行, 方便快速。
缺点:
干扰因素多, 精密度和重现性差, 实际运用效果不佳。
Thanks
4.聚合物沉淀
(1)非离子型聚合物沉淀法 聚乙二醇(PEG) (2)聚电解质沉淀法 羧甲基纤维素、海藻酸盐、果胶酸盐和卡拉胶 聚丙烯酸
第二节 化学物质对蛋白质的稳定作用
蛋白质变性: 某些物理或化学因素破坏了维持蛋白质结构的天然状态, 引起蛋白质理化性质改变并导致其生理活性丧失的现象
蛋白质不可逆失活的化学因素
4.咪唑基的化学修饰
组氨酸残基的咪唑基可以通过氮原子的烷基化或碳原子的 亲核取代来进行修饰。焦碳酸二乙酯(DPC)是最常用的修饰 组氨酸残基的试剂。
5.酚和脂肪族羟基的化学修饰
四硝基甲烷(TNM)是酪氨酸残基修饰最常用的修饰试剂
6.胍基的化学修 饰
丁二酮或1,2-环乙二酮与胍基反应可逆地生成精氨酸-丁二酮复合物
• 光亲和标记试剂
两种类型
• 自杀性抑制剂
第四节
蛋白质光谱探针
紫外吸收或荧光光谱进行蛋白质的定量分析的理论基础:
蛋白质含有色氨酸、酪氨酸和苯丙氨酸残基,在280nm附近有
最大光吸收,并且在340~350nm有荧光发射 。
蛋白质光谱探针:就是能与蛋白质发生相互作用的无机离子
、有机小分子或络合物,这些物质与蛋白质结合生成超分子
强酸和强碱
氧化剂:分子氧、H2O2、过氧化物(如过氧甲酸)、氧自由基 去污剂和表面活性剂 :十二烷基硫酸钠(SDS ) 变性剂:8~10mol/L脲、 6 mol/L盐酸胍、有机溶剂 、EDTA
重金属离子和巯基试剂:Hg2+、Cd2+、Pb2+、巯基乙醇
使蛋白质稳定的化学方法
(1)固定化 共溶剂
抗氧化剂和还原剂 (2)添加剂
