初中化学知识归纳:水的构成
人教版九年级第一学期初三化学第四单元课题3《水的组成:电解水及物质分类》导学案

第三单元自然界的水课题1 水的组成学习目标:1.知识与技能:认识水的组成,氢气的性质,了解单质、化合物、氧化物等概念的区别。
2.过程与方法从人类认识水的组成的过程体会科学研究和思维的方法,学习对实验现象的观察、分析、归纳和总结。
3.情感态度与价值观培养实事求是的学习态度,保持对生活中化学现象的好奇心和探究欲,发展学习化学的兴趣。
【课前预习】1.氧气的检验方法:2.查阅资料获取有关氢气的知识并完成下表。
(1).物理性质颜色气味状态密度溶解性比空气于水氢气的收集方法:①排空气法(因为氢气密度比空气);②排水集气法(因为氢气于水)【课堂探究】一、氢气的化学性质1、可燃性:在空气中点燃(1)现象:在空气中燃烧,火焰为色,有生成,放出大量的热。
(2)反应的符号表达式(3)作燃料的优点:①;②燃烧产物是;③是理想的能源。
(4)验纯:①原因:当氢气不纯时,点燃时可能会发生。
②方法:收集一试管氢气→用拇指堵住管口→移近火焰点火若听到→氢气不纯(若声音很小→氢气较纯)。
二、水电解实验符号表达式(反应)水的导电性较弱,为了,需要在水中加入少量的稀硫酸或氢氧化钠。
正极负极现象1现象2正、负极产生气体的体积比结论:①正极产生的是,负极产生的是,它们的体积比为②水通电生成和。
③水是由和组成的。
④电解水是变化⑤每个水分子是由和构成,水可以表示为H2O思考:(1).由电解水的实验得到结论:水是由氢气和氧气组成的,这种理解对吗?(2).水通电分解产生的氢气与氧气的体积比为2﹕1,但实验中氢气的体积往往大于氧气体积的2倍,为什么?【即学即练】1.下列变化属于化学变化的是()A.水氧化B.水结冰C.水电解D.水沸腾2. 有关水的叙述中,错误的是()A.在通常状况下,水是无色无味的液体B.水在通常状况下很稳定C.在0 ℃时,水会形成冰和水组成的混合物D.纯水几乎不导电,电解时加少许硫酸或氢氧化钠3.请判断正误1、水是由水分子构成的;2、氧分子是由氧原子构成的,氢分子是由氢原子构成的;3、水由氢元素和氧元素组成;4、分子可以分成原子,而原子不能再分。
初中知识点归纳汇总

初中知识点归纳汇总【知识归纳】初中化学知识要点——水1.水、蒸馏水是纯净物、化合物和氧化物。
矿泉水、海水、河水、糖水和盐水都属于混合物2. 污染水质的因素:工业生产中的废渣、废水、废气(即“三废”)和生活污水的劝斥排放,农业生产中施用的农药、化肥随雨水流入河流。
3.电解水实验(水中加少量硫酸或NaOH,增强水的导电性)①水通电(正极O2负极H2,体积比1:2)2H2O2H2↑ +O2↑②证实物质里是否含水方法:白色的无水硫酸铜遇水变蓝色③除去混合气体中的水蒸气,通常放在最后除,如除去氢气中含有(HCl、水蒸气、CO2),先通过再通过④要验证混合气体中是否含有水蒸气,通常应先检验,如证实氢气中含有HCl、水蒸气、CO2,应先让混合气体通过(填仪器和其中的药品),观察到时,则说明含有;再通过,当观察到,则含有,接着通过,当观察到,则说明含有。
【知识归纳】初中化学知识要点——空气1.空气的成分按体积分数计算:氮气78%,氧气21%,稀有气体0.94%,CO2 0.03%2.环境污染知识:排放到空气中的气体污染物较多的是二氧化硫、二氧化氮、一氧化碳。
二氧化硫——大气污染物、酸雨——来自于含硫燃料的燃烧。
3.测定空气成份或除去气体里的氧气,要用易燃的磷,磷燃烧后生成固体,占体积小易分离。
不可以用碳、硫代替磷。
碳、硫跟氧气反应生成气体,难跟其他气体分离。
【知识归纳】初中化学知识要点——氧气的性质和用途1.氧气的物理性质:不易溶于水,密度比空气的略大。
液氧、固态氧淡蓝色。
工业上制取氧气的方法:分离液态空气——物理变化。
2.氧气的用途:气焊、航天、潜水、登山、医疗、液氧炸药、炼铁、炼钢3.氧气的化学性质:支持燃烧,有助燃性。
可供呼吸用,是常用的氧化剂。
⑴木炭在氧气中燃烧(O2可使带火星的木条的木条复燃)生成CO2现象:发出白光,放出热量,生成使石灰水变浑浊的气体⑵硫在空气中燃烧,硫在氧气中燃烧生成SO2现象:硫在空气里燃烧发出微弱的淡蓝色火焰,产生有刺激性气味的气体,放出热量;在氧气里燃烧发出蓝紫色火焰,产生有刺激性气味的气体;放出热量⑶磷在空气中燃烧现象:产生大量的白烟,放出热量白磷着火点低,易自燃,要放在水中密封保存,可隔绝空气,防止它自燃。
【初中化学】初中化学知识点总结:水的组成

【初中化学】初中化学知识点总结:水的组成
1.理论上与正、负两极相连的试管内汇集的气体体积比应是1∶2,但在实验操作中两试管汇集的气体体积比往往小于l∶2。
这是因为:
(1)氧气在水中溶解性比氢气稍大。
(2)氧气水解性很强
初三
,有时在电极上就与电极出现了水解反应。
2.电解时通常在水中加入少量氢氧化钠(或稀硫酸)是为了增强水的导电性。
它们本身并未参加反应。
3.水就是由氢、氧两种元素共同组成,无法说道水就是由氢气和氧气共同组成。
因为水中没氢气,也没氧气,就是一种物质共同组成的清澈物。
4.电解水所用电源为直流电。
【典型例题】
例析:
阿伏加德罗曾经总结出来这样一条规律:在同温同压下,同体积的气体都所含相同的分子数。
图7-7就是电解水的轻便装置:
(1)电源的a为______极,b为______极。
(2)c试管中搜集至的气体就是______,可以用______检验;d试管中搜集至的气体就是______,可以用______检验;c、d两种气体的分子个数比为______。
(3)根据上述实验事实可以得出:水是由______组成的。
解析:
观察图示知d试管中收集气体的体积大约是c试管中的2倍,可推知:d试管中收集到的气体是氢气,c试管中是氧气。
由此可判断a为正极,b为负极。
因c、d试管中两种气体的体积比为1:2,且在相同状况下,气体的体积比等于分子个数比,所以c、d中两种气体的分子个数比也为1:2。
答案:
(1)正,负
(2)氧气,拎火星的木条;氢气,熄灭的木条,1:2(3)氢元素和氧元素。
化学水的组成知识点总结

化学水的组成知识点总结
化学水的组成主要包括以下几个知识点总结:
1. 化学式:化学水的化学式是H2O,表示每个水分子由两个氢原子和一个氧原子组成。
2. 分子结构:水分子的分子结构是V形结构,氧原子位于中心,两个氢原子分别与氧
原子通过共价键连接。
3. 原子组成:水分子的原子组成为1个氧原子和2个氢原子。
氧原子的原子序数是8,氢原子的原子序数是1。
4. 原子间键结:水分子通过共价键将氧原子和氢原子连接在一起。
氧原子与两个氢原
子之间的键称为极性共价键。
5. 极性分子:由于氧原子比氢原子的电负性更高,共价键中的电子更加靠近氧原子。
因此,水分子是极性分子,氧原子带有部分负电荷,氢原子带有部分正电荷。
6. 氢键:水分子中的氧原子与其他水分子的氢原子之间可以形成氢键。
这种氢键的存
在使水分子具有一些特殊的性质和行为,例如高沸点、高熔点、高表面张力等。
7. 水的性质:水是一种无色、无味、无臭的液体。
它是一种普遍存在的溶剂,可以溶
解许多物质。
水的密度是1克/立方厘米,在常温下是液态。
水在0℃时凝固成冰,100℃时沸腾成水蒸气。
初中化学教案 水的组成、化学式与化合价

初中化学—水的组成、化学式与化合价一、考点、热点回顾考点一 水的组成 1、水的物理性质纯净的水是没有颜色、没有气味、没有味道的液体。
在101kPa 时,水的凝固点是0℃,沸点是100℃,4℃时密度最大,为1g/mL 。
2、水的电解实验(实验装置如右图) 【实验现象】① 通电后,电极上有气泡产生。
通电一段时间后,两个试管内汇集了一些气体,与正极相连的试管内的气体体积小,与负极相连的试管内的气体体积大,体积比约为1:2,质量比约为8:1。
② 与正极相连的试管内的气体可以使带火星的木条复燃;与负极相连的试管内的气体移近火焰时,气体能够燃烧,火焰呈淡蓝色。
【实验结论】① 水在通电的条件下,发生了分解反应,生成氢气和氧气:2H 2O2H 2↑+O 2↑;② 水是由氢、氧两种元素组成的(在反应前后,参与反应的元素种类没有变化); ③ 化学反应中,分子可分,原子不可分。
【注意事项】① 通电时,必须使用直流电。
② 预先在水中加入少量氢氧化钠溶液或稀硫酸可以增强水的导电性。
③ 负极产生的是氢气,正极产生的是氧气。
3、氢气(1)物理性质:无色无味的气体,难溶于水。
密度比空气小,是相同条件下密度最小物质 混合物 纯净物 单质(由同种元素组成的纯净物)化合物(由不同种元素组成的纯净物)氧化物(由两种元素组成的化合物中,其中一种元素是氧元素的是氧化物)酸、碱、盐、有机物的气体。
(2)化学性质:a)可燃性错误!未找到引用源。
:2H2+O22H2O氢气燃烧时发出淡蓝色火焰,放出热量,并有水珠产生。
b)还原性:H2+CuO Cu+H2O注意事项:黑色的氧化铜在氢气中加热逐渐变成红色,并有水珠产生。
在点燃氢气前,一定要检验氢气的纯度。
(检验:点燃。
纯净的氢气能够安静地燃烧,发出淡蓝色火焰;而不纯的氢气在燃烧时会发出尖锐的爆鸣声。
)考点二化学式与化合价1、化学式:用元素符号和数字组合来表示物质组成的式子。
2、化学式(如H2O)的意义:表示一种物质(宏观意义)——表示水这种物质;表示一个分子(微观意义)——表示1个水分子;表示某物质是由什么元素组成的(宏观意义)——表示水是由氢元素、氧元素组成;表示某物质是由什么粒子构成(微观意义)——表示水由水分子构成;表示某物质的分子由什么粒子构成(微观意义)——表示1个水分子由2个氢原子和1个氧原子构成;3、化学式的写法:书写化合物的化学式时,首先要弄清以下两点:①这种物质由哪种物质组成;②化合物中各元素的原子个数比是多少。
初中化学“化学水”知识点整理(常考)
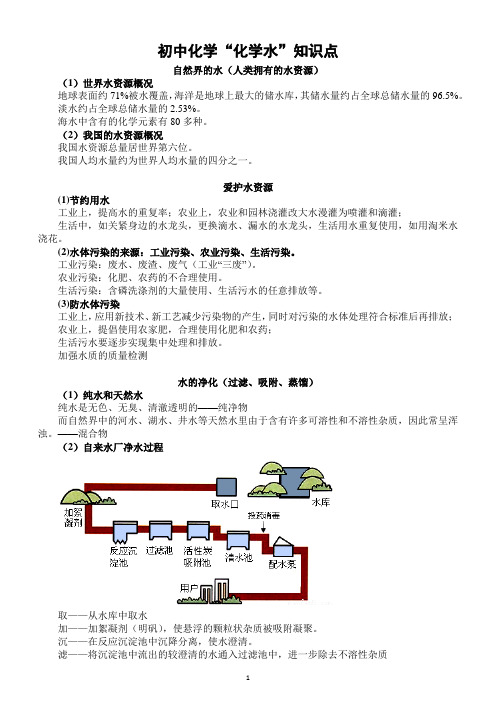
初中化学“化学水”知识点自然界的水(人类拥有的水资源)(1)世界水资源概况地球表面约71%被水覆盖,海洋是地球上最大的储水库,其储水量约占全球总储水量的96.5%。
淡水约占全球总储水量的2.53%。
海水中含有的化学元素有80多种。
(2)我国的水资源概况我国水资源总量居世界第六位。
我国人均水量约为世界人均水量的四分之一。
爱护水资源(1)节约用水工业上,提高水的重复率;农业上,农业和园林浇灌改大水漫灌为喷灌和滴灌;生活中,如关紧身边的水龙头,更换滴水、漏水的水龙头,生活用水重复使用,如用淘米水浇花。
(2)水体污染的来源:工业污染、农业污染、生活污染。
工业污染:废水、废渣、废气(工业“三废”)。
农业污染:化肥、农药的不合理使用。
生活污染:含磷洗涤剂的大量使用、生活污水的任意排放等。
(3)防水体污染工业上,应用新技术、新工艺减少污染物的产生,同时对污染的水体处理符合标准后再排放;农业上,提倡使用农家肥,合理使用化肥和农药;生活污水要逐步实现集中处理和排放。
加强水质的质量检测水的净化(过滤、吸附、蒸馏)(1)纯水和天然水纯水是无色、无臭、清澈透明的——纯净物而自然界中的河水、湖水、井水等天然水里由于含有许多可溶性和不溶性杂质,因此常呈浑浊。
——混合物(2)自来水厂净水过程取——从水库中取水加——加絮凝剂(明矾),使悬浮的颗粒状杂质被吸附凝聚。
沉——在反应沉淀池中沉降分离,使水澄清。
滤——将沉淀池中流出的较澄清的水通入过滤池中,进一步除去不溶性杂质吸——再将水引入活性炭吸附池,除去水中臭味和残留的颗粒较小的不溶性杂质投——投药消毒(通常通入氯气的方法)除去细菌,杀菌后的水就是可以饮用的自来水,通过配水泵供给用户。
但水中仍然含有可以溶于水的一些杂质,所以还是混合物。
【它是一个化学变化过程,因为除去病菌的过程.就是把病菌变成其他物质的过程。
】(3)常用的净水方法Ⅰ.沉淀——除去不溶性杂质使不溶性的沉淀沉降下来,并与水分层。
初中化学知识点归纳第四单元自然界的水

初中化学知识点归纳第四单元自然界的水1.水的组成与性质:-水的分子由两个氢原子和一个氧原子组成,化学式为H2O。
- 水是一种无色、无味、无臭的液体,密度为1g/cm³。
-水的三态:固态(冰)、液态(水)、气态(水蒸气)。
-水的冰点为0℃,沸点为100℃,在常温常压下呈液态状态。
2.水的循环与地球上的水资源:-水的循环包括蒸发、凝结、降水、地表径流和地下水。
-水在地球上以各种形式存在,其中97%存在于海洋中,只有3%为淡水资源。
-地球上的淡水资源包括河流、湖泊、地下水和冰川。
3.水的净化与利用:-饮用水的净化包括除杂和消毒两个步骤。
-除杂方法包括自然沉淀、过滤和加药净化等。
-消毒方法包括加氯、加臭氧和紫外线照射等。
-工业上利用水进行冷却、洗涤、溶解、合成等。
4.酸碱与中和反应:-酸是指能溶解在水中产生氢离子(H+)的物质,酸性溶液的pH值小于7-碱是指能溶解在水中产生氢氧根离子(OH-)的物质,碱性溶液的pH值大于7-中和反应是指酸与碱相互反应,产生盐和水的化学反应。
5.水的酸碱性:-纯水中,H2O分解为H+和OH-,即[H2O]=[H+]=[OH-]。
-酸性溶液中,H+浓度大于OH-浓度,[H+]>[OH-]。
-碱性溶液中,OH-浓度大于H+浓度,[OH-]>[H+]。
-酸性和碱性溶液中,水的电离程度有所不同。
6.酸碱指示剂:-酸碱指示剂是根据溶液酸碱性的变化,通过颜色的改变来判断的物质。
-通常使用的指示剂有酚酞、甲基橙、红色石蕊等。
-不同的酸碱指示剂在不同的pH范围内显示不同的颜色。
7.水的pH值和酸碱中和:- pH值是表示溶液酸碱度的指标,pH = -log[H+]。
-酸性溶液的pH值小于7,碱性溶液的pH值大于7,中性溶液的pH 值为7-酸和碱进行中和反应时,会生成盐和水。
-中和反应是根据酸和碱的化学方程式来计算的。
以上是关于初中化学第四单元的知识点归纳,对于理解水的组成与性质、水的循环与地球上的水资源、水的净化与利用、酸碱与中和反应、水的酸碱性、酸碱指示剂、水的pH值和酸碱中和等方面的内容进行了总结。
初中化学《水的组成》教案设计(通用10篇)

初中化学《水的组成》教案设计(通用10篇)初中化学《水的组成》教案设计 1一、学习目标1、认识水的组成。
2、了解单质、化合物的区别。
3、了解人类认识物质世界的过程和方法。
二、教学重点、难点通过实验活动分析水的组成单质、化合物、氧化物的定义三、课时安排1课时四、教学准备电解水实验装置、火柴、图片五、教学过程导入新课(电脑显示图片资料或录像资料)素材(与水有关的风景图片如水电站、喷灌图、水产养殖、海滨浴场、教材第三单元的封面、太空中看地球的照片)提问:我们欣赏到的资料的主题是什么?了解水的分布及作用[提问]你们知道哪些地方存在水吗?[追问]还有什么地方有水?结合教材P46的资料谈谈你的看法。
提问:(1)水对于我们人类重要吗?想象一下如果没有水世界会变成什么样子?(2)水除了可以孕育和维系生命,还有什么作用?总结水的用途:指导学生阅读教材P46第2自然段。
内容1:实验探究水的组成[过渡语]水如此重要,今天我们就来探究它的组成。
(1)水在化学中用H2O表示,大胆猜测水是由哪些元素组成的。
(2)如何来证明一种物质是由不同种元素组成的呢?提供资料:氧汞→汞+氧气告知学生:水在通电的条件下能分解生成氢气和氧气。
提问:回忆如何检验氧气?指导学生自学教材P47第2自然段学习氢气的性质及检验方法。
(3)展示电解水装置,开始实验。
引导学生观察实验。
(由于此实验速度较慢,反应开始一会后,可配合此实验的录像课件,让学生观察)引导学生总结实验:正氧负氢,体积比1:2,写出此反应文字表达式,说出属于什么基本反应类型。
内容2:(电解水的过程中)学习研究水的组成的思路。
从上述思路中我们整理出科学探究过程提出假设→设计方案→探究实验→现象论证→结论推理内容6:体验感悟,形成概念:提问:自然界中的'水如:河水,矿泉水…等属于纯净物还是混合物?水,氢气,氧气属于纯净物还是混合物?强调:如果只说水就指的是纯净物。
以水、氢气、氧气为例让学生说出它们组成上的不同,引出单质、化合物的概念。
初三化学水的组成

水的组成一、水的电解实验:(1)反应表达式:水→氢气 + 氧气(2)实验现象:两极上都有气泡产生,并且产生的体积不一样。
(3)正、负极气体的检验:①带火星的木条放到正极方试管口,木条复燃,结论:氧气②用大拇指盖住负极所对试管口,对准酒精灯火焰放开,有“噗”的一声。
结论:氢气③正负极气体体积比为1:2,质量比为8:1(4)结论:水是由氢元素和氧元素组成的。
二、氢气(H)21.物理性质:无色无味的气体;密度最小(可用向下排气法收集);难溶于水(可用排水法收集)。
2.化学性质:可燃性纯净氢气燃烧的现象:安静地燃烧,发出淡蓝色的火焰,产物只有水。
不纯氢气点燃将可能发生爆炸,所以点燃氢气前要验纯,方法:收集一试管氢气,用大拇指堵住试管口,移近酒精灯的火焰,松开大拇指。
如果听到尖锐的爆鸣声,表示氢气不纯;如果声音很小,则表示氢气较纯。
三、物质的分类:物质分为混合物和纯净物,其中纯净物又可以分为化合物和单质,化合物中又包含氧化物。
①混合物:是由不同种物质组成的物质。
②纯净物:是由同种物质组成的物质。
③化合物:是由不同种元素组成的纯净物。
④单质:是由同种元素组成的物质⑤氧化物:是由两种元素组成的化合物(当然里面有一种是氧元素了)。
注意:单质和化合物,比较的对象是元素。
知识点一:水的电解实验例1. (双选)图1、2是电解水的实验及电解时水分子分解的示意图。
有关叙述正确的是( )A.a试管中产生的气体是O2B.a、b试管中产生气体的质量比为2∶1C.由图2看出,水分解的过程中,氢原子和氧原子数都没发生变化D.由图2看出,水分解得到的生成物为两种单质例2.图中甲、乙两图都是电解水的简易装置,回答下列问题:(1)装置甲比装置乙有一个明显的优点,这个优点是______________________________。
(2)装置乙比装置甲有一个明显的优点,这个优点是______________________________。
新科粤版九年级上册初中化学 4.2 水的组成 教案(教学设计)

第四章生命之源——水4.2 水的组成一、知识与技能1.了解水的物理性质。
2.了解氢气的性质。
3.认识水的组成。
4.了解化合物、氧化物和单质的概念及区别。
二、过程与方法1.结合资料,从人类认识水的组成的过程中体会科学探究和思维的方法,认识实验探究和创新思维的重要性。
2.充分利用讨论,培养学生观察、分析、归纳实验现象的能力和习惯。
电解水实验;水的组成。
1.对化合物、氧化物和单质概念的理解。
2.研究化合物组成的基本方法。
[展示图片]湛蓝的大海、奔腾的长江、巍巍的雪山、清澈的山泉、洁白的云朵、多彩多姿的水世界;自来水、纯净水、矿泉水……各种不同的饮用水。
[设问]自然界中以不同形式存在的水,是否都有相同的组成?如何探究水的组成?[设置情景]水是地球上最普通、最常见的物质之一,不仅江河湖海中含有水,各种生物体内也都含有水,一般都在60%以上。
水这么常见,你们了解它吗?今天我们就来学习一下“水的组成”。
[简史导入]在很长一段时间内,水都被看成是一种元素,直到18世纪,科学家通过对水的生成和分解实验的研究,才最终认识了水的组成。
我们就沿着科学家的研究足迹一起揭示水的组成的奥秘吧!1.氢气的燃烧实验[演示]教师展示预先收集的一瓶氢气,让学生观察并归纳氢气的物理性质。
[学生]氢气是一种无色、无臭的气体。
[教师补充]氢气难溶于水,密度比空气的小。
[讲解]氢气是一种能燃烧的气体,但若氢气不纯,在空气中点燃后会发生爆炸,因此在点燃氢气前一定要检验氢气的纯度。
[演示实验]氢气纯度的检验及氢气在空气里燃烧。
[教师]让学生观察并描述实验现象。
[学生]氢气能够在空气中安静地燃烧,发出淡蓝色的火焰,在火焰上方罩一个冷而干燥的烧杯,烧杯内壁有小水珠生成,触摸烧杯外壁,感到发烫。
[补充]氢气燃烧产物是水,所以被认为是最清洁的燃料。
如果氢气不纯,混有空气(或氧气),点燃时就有可能会发生爆炸。
氢气可以燃烧,所以氢气可以用点燃气体来检验,若气体燃烧则生成的气体为氢气。
初中化学《自然界的水》知识点总结

初中化学《自然界的水》知识点总结1、水的组成(1)电解水实验:正极得到的气体能使带火星的木条复燃,它是氧气;负极得到的气体能够燃烧,产生淡蓝色火焰,它是氢气,它们的体积比为1:2,质量比为8:1。
(2)化学方程式(3)由电解水实验可知:水是由氢元素、氧元素组成的。
2、水的净化(1)自然界的河水、湖水、井水、海水等天然水都不是纯水,都含有许多可溶性和不溶性杂质,都属于混合物。
(2)天然水通过沉淀、过滤、吸附、蒸馏等不同途径可以得到不同程度的净化。
(3)水有硬水、软水之分。
①含有较多可溶性钙、镁化合物的水叫硬水;不含或少含可溶性钙镁化合物的水叫软水。
②可用肥皂水来区分硬水和软水。
产生泡沫较多的水是软水,产生泡沫较少易起浮渣的水是硬水。
③使用硬水会给生活和生产带来许多麻烦。
洗衣服不净、变硬,锅炉浪费燃料、损坏过热爆炸。
④硬水可软化。
蒸馏,煮沸。
3、爱护水资源(1)地球上的水储量是丰富的,但可利用的淡水资源是有限的(2)节约用水,防止水体污染(从工业、农业、生活三方面考虑)4、物质的组成与构成(1)物质组成。
混合物、纯净物(单质、化合物)(2)物质构成(构成物质的粒子有分子、原子等)①分子是保持物质化学性质的最小粒子;②分子的质量、体积很小,分子在不断地运动,分子间存在着一定的间隔;③原子是化学变化中的最小粒子;④分子与原子的本质区别:在化学变化中,分子可以再分,原子不可以再分。
(如,在电解水实验中,水分子可以分成氢原子和氧原子,而氢原子和氧原子不可以再分,只是重新组合成氢分子、氧分子。
)1、水可以造福人类,但水被污染后会给人类生存造成危害,为了防止水体污染,保护水资源,下列措施中可行的是(B)①减少向空气中排放硫氧化物和氮氧化物的数量,防止形成酸雨②抑制水中所有动植物的生长③禁止使用农药和化肥④生活汗水经净化处理达标后再排放⑤任意排放工业废水A、全部B、①④C、③④⑤D、②③④2、下列方法中可明显降低水的硬度的是(C)A、过滤B、静置C、煮沸D、混合3、过滤操作中,不必使用的仪器是(D)A、漏斗B、烧杯C、玻璃棒D、量筒4、下列各组物质中,前者是化合物,后者是单质的(C)A、空气、铁粉B、水银、氧化汞C、二氧化硫、氧气D、冰、干冰5、下列叙述不正确的是(A)A、同种原子可以结合成分子,不同种原子不可以结合成分子B、“墙内开花墙外香”,说明分子在不断地运动C、将50毫升水和50毫升酒精混合后体积小于100毫升,说明分子间有间隔D、分子和原子都是构成物质的粒子6、能保持氯气化学性质的最小粒子是(C)A、ClB、2ClC、Cl2D、4Cl7、一个装有开水的热水瓶有时瓶塞会被顶开的原因是(D)A、水分解成氧气和氢气B、水分子中氢原子和氧原子数目增多C、水分子变大了D、水分子间间隔受热变大体积膨胀8、右边方框中,表示2个氢分子的示意图是(D)9、经实验测定,某物质中只含有一种元素,下列判断正确的是(D)(金刚石和石墨的混合物里面也只有一种元素)A、该物质一定是单质B、该物质一定是纯净物C、该物质一定是混合物D、该物质一定不是化合物10、点燃下列各组混合物时,不可能发生爆炸的是(C)(可燃性气体或粉尘与空气或氧气混合燃烧才有可能爆炸)A、氢气和氧气B、天然气和空气C、氮气和氧气D、面粉粉尘和空气11、构成物质的粒子有分子、原子等,如二氧化碳是由二氧化碳分子构成,金由金原子构成,氯化钠由氯离子和钠离子构成。
九年级化学中考第一轮复习—身边的化学物质(二)水人教实验版知识精讲

九年级化学中考第一轮复习—身边的化学物质(二)水人教实验版【本讲教育信息】一、教学内容中考第一轮复习——身边的化学物质(二)水二、考点清单1、知道水是最常用的溶剂。
2、认识水的组成3、知道纯水与矿泉水的区别、净化水的方法4、认识水是宝贵的自然资源、水污染的来源及危害5、知道六大营养素6、学会构建水的知识网络。
了解与水有关的实验三、全面突破知识回顾:(一)水的分类与净化:1、常见水的分类:(1)蒸馏水、纯水——纯净物(2)自然界中的水、各种饮品、矿泉水、有色水、石灰水等——混合物水属于纯净物中的化合物,化合物中的无机化合物,氧化物.2、水的净化:软水和硬水的鉴别与转化:(1)鉴别:肥皂水、蒸发(2)转化:煮沸、蒸馏(二)水的组成和构成:1、水的组成:1)实验现象?试管中有无色气泡冒出,电源正、负极所连试管中产生气体体积比为1:2 2)各极产生什么气体?如何验证?氧气:带火星的木条氢气:点燃,罩一干燥烧杯3)化学方程式?2H2O 通电2H2↑+ O2↑4)实验结论?元素知识?水是由氢元素和氧元素组成化学变化微观实质:分子分为原子,原子重新组合成新分子2、“H2O”的含义:表示(1)水(2)水是由氢元素和氧元素组成的(3)一个水分子(4)一个水分子由2个氢原子和1个氧原子构成。
(三)水的应用:1、水能灭火2、水是人类重要的6大营养素之一。
组成水的H和O元素都是人体的常量元素3、实验中的水:(1)基本实验操作:(2)水的电解(3)过滤、蒸发、配制溶液(4)铁的生锈(5)水在实验中的用途:溶于水放出大量的热的物质;溶于水吸收大量的热的物质与水反应放出大量的热的物质(6)探究蜡烛燃烧后的产物:(7)对人体吸入的空气和呼出的气体的探究(8)二氧化碳的性质:4、水是重要的资源(1)水污染的危害:影响工、农、渔业的生产。
破坏水生生态系统,还会直接危害人体健康。
(2)保护水资源:防止水体污染;(工业、农业、生活污水);节约用水.(四)与水有关的化学反应1、有水参加的化学反应:(1)分解反应:水电解(2)化合反应:生石灰与水,反应后溶液呈碱性,pH值大于7;二氧化碳与水,反应后溶液呈酸性,pH值小于7。
初中化学自然界的水知识点归纳

初中化学自然界的水知识点归纳水是地球上最常见的物质之一,也是人类生命所必需的。
化学中,水是一种无机物质,由氢和氧原子组成。
初中化学中,水是一门重要的学科,本文将对初中化学中关于自然界的水方面的知识点进行归纳和总结。
水的性质物理性质•无色、无味、无臭:在常温下,水是一种无色、无味、无臭的液体。
•密度大:水在4℃时密度最大,为1.0 g/cm³,而在0℃时密度为0.917 g/cm³。
•熔点和沸点高:水的熔点为0℃,沸点为100℃。
相比较其他同类分子来说,水的熔点和沸点都相对较高。
•具有高粘度:水的黏度大,易使一些细小的物质溶解在水中,不易挥发。
化学性质•酸碱性质:水有弱的酸碱性质。
纯水的pH值为7,为中性溶液,如果加入弱酸或弱碱,它的酸碱性质会发生变化。
•具有溶解性和氧化性:水具有很高的溶解性和一定的氧化性。
在生物体内具有缓冲作用,可与物质发生氧化反应,如生物中的呼吸作用。
水的自然界分布地球上的水全球水分布不平衡,一般分为地表水和地下水两种。
•地表水:地表水是指地表上凝聚成为湖、河、湿地等的水,也包括地球表面的雪、冰川融水等。
地表水是人们生产和生活中重要的水源。
•地下水:地下水指地下深处含水岩石层中的地下水体,地下水是一个重要的水资源,也是地表水补给的重要来源。
生物体内的水水是维持生物体生命活动的一种重要物质,在人和其他生物体内部都有分布,例如:•人体内的水:成年人平均体内水分含量为60-70%。
人体内的水分为细胞内液、细胞外液和血浆等。
•植物体内的水:植物的水分主要在细胞膜内,它是植物生长发育的重要条件之一。
植物根部吸收土壤中的水分,通过导管输送到各个部位。
水的循环水的循环过程地球上的水不断地进行循环,这是一个循环过程,称为水循环。
水循环可以分为3个阶段:•蒸发(蒸发和升华):水面上和陆地上的水受到太阳的照射,导致水分子渐渐蒸发到空气中,并以水汽的形式升到高空。
•降水(凝结和降水):大气中的水汽发生凝结,形成云,云的水滴或冰晶或雨滴成为降水,返回地面。
人教版初中九年级化学第4单元课题3《水的组成》精品教学课件

新知探究
注意:
1、氧化物必须满足三个条件:①两种元素组成;②是化合物; ③有一种元素是氧元素。这三个条件缺一不可。 2、“氧化物”的定义是建立在化合物基础之上的。 3、氧化物概念的另一种表述:由氧元素和另一种元素组成的化 合物叫氧化物。 4、含有氧元素的化合物称为含氧化合物,氧化物一定是含氧化 合物,但含氧化合物不一定是氧化物。
水是生命的源泉,哪里有水, 哪里就有生命。对于我们熟 悉的水,你知道它的组成吗?
新知探究
知识点一、氢气
氢气的性质 1 物理性质:氢气是无色、无味的气体,难溶于水,密度比空气的小。 2 化学性质:氢气具有可燃性,燃烧时火焰呈淡蓝色,不纯的氢气遇明火可能
会发生爆炸,因此点燃前必须验纯。 3 氢气验纯方法
解析:电解水实验“正氧负氢,氢二氧一”,产生的气体比 例指的是体积比;氢气具有可燃性;水是由氢元素和氧元素 组成的。
(2019·葫芦岛中考)
课堂达标
3 水是一种重要的资源,爱护水资源,人人有责。
(1)如图所示,电解水的实验中,通电一段时间后,玻璃管a中收集到的 气体是 氢气 ;通过实验可以得出水是由 氢氧元素 组成的。
解析:混合物由两种或两种以上的物质组成,臭氧由一种物质组成,属于纯净 物;臭氧中只有一种元素,所以臭氧属于纯净物中的单质。
课堂达标
2 电解水实验如图所示,下列说法正确的是( B )
A.正极得到的气体是氢气 B.负极得到的气体具有可燃性 C.该实验说明水由氧气和氢气组成 D.实验结束时产生的氢气和氧气的质量比为2:1
。
新知探究
单质和化合物
单质
化合物
概念
共同点
宏观 组成 区 别 微观 构成
由同种元素组成的纯净物
九年级化学全册 2.2《水的分解与合成》知识梳理 鲁教版

第二节 水的分解与合成知识梳理1.水的分解(1)实验现象:通电后电极上产生________,与电源正极相连的玻璃管内气体体积较小,与电源负极相连的玻璃管内气体体积较大,二者的体积比是________。
(2)气体的检验:体积较小的气体能使带火星的木条复燃,这种气体是________。
体积较大的气体接近火焰时能燃烧,火焰呈淡蓝色,这种气体是________。
(3)反应的文字表达式为:________________________。
(4)通常状况下,水是________、________的液体,密度是________,在101 kPa 下,水的凝固点是________,沸点是________。
答案:(1)气泡 2∶1 (2)氧气 氢气 (3)水−−→−通电氢气+氧气 (4)无色 无味 1.0 g ·cm -3 0 ℃ 100 ℃2.分解反应是指________________________________。
答案:一种物质生成两种或两种以上的物质的反应3.分子、原子的本质区别在化学变化中分子可分,而原子________,有的物质是由分子构成的,如 ________;有的物质是由原子构成的,如________。
答案:不可再分 氧气 铜4.水的合成在空气中点燃氢气,并在火焰上方罩一个冷而干燥的烧杯。
(1)现象:氢气在空气中燃烧,产生________火焰,烧杯内壁有________,用手触摸烧杯壁感觉非常烫,说明反应放出了大量的热,该实验说明氢气具有的化学性质是氢气具有________。
(2)氢气作为一种新型燃料,是未来最理想的能源,这是因为________、________、________。
答案:淡蓝色 水珠 可燃性 来源广泛 燃烧热值高 无污染5.化合反应是指________________。
答案:两种或两种以上的物质生成一种物质的反应6.物理性质和化学性质物质在化学变化中表现出来的性质叫做________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学知识归纳:水的构成
以下是###整理的《初中化学知识归纳:水的构成》,希望大家喜欢!
第一节运动的水分子
一、水的三态变化:
1、三态变化的实质:水的三态变化就是因为水分子的运动导致了水的状态变化。
水分子获得能量时,运动加快,分子间的间隔增大,水由液态变成了气态(或由固态变为了液态);失去能量时,运动减慢,分子间的间隔减小,水由气态又变回了液态(或由液态变为固态)
2、现象解释:能量—运动—间隔—状态
二、分子:
1、定义:保持物质化学性质的最小微粒。
2、性质:(1)分子的体积、质量小
(2)分子在持续的运动
(3)分子间存有间隔
(4)同种物质的分子,性质相同;不同种物质的分子,性质不同
(5)化学变化中,分子能够再分,原子不能再分子
水的天然循环
太阳为水提供能量,水通过三态变化,实现自身的天然循环。
既实现了水的自身净化,又完成了水资源的重新分配。
三、水的净化方法(重点、难点)
1、水的净化方法过程:
①沉降(除去水中颗粒较大的不溶性杂质),(明矾:絮凝剂,促动悬浮物质的沉降)
②过滤(除去水中不溶性固体杂质)
③吸附(除去水中的有色或有气味的物质)、(活性炭:表面疏松多孔)
④蒸馏(除去水中可溶性杂质,净化水准---得到的是蒸馏水)、
⑤消毒杀菌。
(氯气)
2、分离物质的方法:
①过滤:分离不溶性固体和液体
②蒸发:分离可溶性固体和液体
③蒸馏:分离沸点不同的液体
四、硬水和软水:
(1)硬水:含有可溶性钙、镁化合物较多的水;软水:含有可溶性钙、镁化合物较少的水
(2)判断方法:加入肥皂水搅拌,产生泡沫多的为软水,反之为硬水。
(3)转化方法:煮沸、蒸馏等
(4)硬水的危害:用硬水洗涤衣物既浪费肥皂,又不易洗净,时间长还会使衣物变硬。
锅炉长期用硬水,易形成水垢,不但浪费燃料,严重者可引起爆炸。
长期饮用硬水有害身体健康。
第二节水分子的变化
4、实验结论:
①水在通电的条件下分解成氢气和氧气。
化学反应为:2H2O通电2H2↑+O2↑
②水是由氢元素和氧元素组成的。
5、反应的微观过程:
由电解水微观过程可知:
①化学反应的实质是:分子分解成原子,原子又重新结合成新的分子。
②分子与原子的关系:分子是由原子构成的,即分子能够分解成原子,原子能够结合成分子。
③在化学反应中,分子能够分解成原子,而原子不可再分。
④化学反应前后,发生改变的是分子的种类;化学反应前后,元素的种类,原子的种类、数目、质量都不变。
6、注意事项:
①为了增强水的导电性,常在水中加入少量的氢氧化钠溶液或稀硫酸。
②现象要点:“正氧负氢”—争养父亲;“氢二氧一”—V氢气:V
氧气=2:1。
描述体积比时要注意比例顺序。
③在实验中,氢气与氧气的体积比略大于2:1。
主要原因是:a.因为氢气与氧气在水中的溶解度不同,在相同条件下,氧气在水中的溶解度比氢气大;b.在电解水过程中会有副反应发生,消耗了氧气,使氧气的体积比理论值低。
二、水的合成—氢气燃烧
1、氢气燃烧的化学方程式:2H2+O2点燃2H2O。
