尿素检测试剂盒(脲酶波氏微板法)
刺苋根提取物化学成分分析及其排石活性初探

刺苋根提取物化学成分分析及其排石活性初探作者:陈兰妹唐灵芝吴雅茗林小华来源:《中国民族民间医药·上半月》2016年第03期【摘要】目的:对刺苋根分部位成分进行分析及对正丁醇提取部分进行排石活性研究。
方法:采用不同极性溶剂对刺苋根提取后进行成分分析;选取正丁醇提取部位,对乙醛酸诱导的C57BL/6小鼠连续灌胃5d后,取心脏血测血浆肌酐(CRE)及血浆尿素氮(BUN)浓度;取左侧肾脏测肾组织钙含量。
结果:刺苋的正丁醇部位提取物,在25mg/ml及50mg/ml两个剂量水平均能明显降低肾脏组织的钙含量,确实具有明确的排石效果;同时能明显降低血浆CRE 及BUN含量,能够明显恢复肾脏排泄功能。
结论:刺苋对乙醛酸所致的小鼠草酸钙结石模型有明确的排石活性。
【关键词】刺苋根;乙醛酸;C57BL/6小鼠;排石【中图分类号】R284.1 【文献标志码】 A 【文章编号】1007-8517(2016)05-0006-03Abstract:Objecive: This study was aimed to analyze the chemical compositions of Amaranthus spinosus Linn. extracts obtained using various solvent systems. N-butanol extract was further evaluated for the discharging effect of kidney calculus. Methods: Amaranthus spinosus Linn. extracts were obtained with solvent systems of different polarity and subject to chemical composition analysis. N-butanol extract was selected and administered daily by oral gavage to C57BL/6 mice for five continuous days. At the time mice were removed from the study, the heart blood plasma was collected for creatinine (CRE) and blood urea nitrogen (BUN) level, and the left kidney tissue was collected for Ca2+ concentration. Results: N-butanol extract of Amaranthus spinosus Linn. clearly decrease the calcium level in kidney tissue at 25mg/ml and 50mg/ml doses, demonstrating the calculus discharging effect. Meanwhile, the creatinine (CRE) and blood urea nitrogen (BUN) levels were also clearly decreased, indicating the recovery of kidney function. Conclusion: The result clearly indicates n-butanol extracts of Amaranthus spinosus Linn. demonstrate discharging effect of kidney calculus in glyoxylic acid-induced calcium oxalate calculus mice model.Keywords:Amaranthus spinosus Linn.; glyoxylic acid; C57BL/6 mice; discharging effect of urinary calculus刺苋为苋科苋属植物刺苋(Amaranthus spinosus L)的全草,分布于华东、中南、西南、陕西等地。
尿素(Urea) 脲酶UV法

目录1. 检测原理2. 标本采集与处理2.1 受检者的准备2.2 静脉采血2.3 抗凝剂2.4 标本处理3. 试剂3.1 试剂3.2 校准血清3.3 试剂与校准血清的稳定性4. 仪器5. 操作6. 计算7. 操作性能7.1 精密度7.2 准确度7.3 灵敏度7.4 可报告范围7.5 特异性7.6 干扰8. 参考值9. 临床意义附录A: 参数1. 检测原理脲酶催化尿素水解产生氨和CO2。
在谷氨酸脱氢酶催化下, NH3与α-酮戊二酸和NADH反应生成NA D+。
NADH在340nm处有特异吸收,通过测定NADH在340nm 处反应速度与同样处理过的标准比较计算出尿素含量。
脲酶尿素+H2O ----------- NH3 +CO2GLDHNH3 +α-酮戊二酸+NADH ------------- L-谷氨酸+NAD+ +H2O2.标本采集与处理2.1 受检者的准备:病人空腹12h,不饮酒24h后采集血样。
体检对象抽血前应有两周的的正常状况记录。
注意有无应用影响测试项目的药物。
此外,对于体检者,采血的季节都应做相关记录,因为样本中各项目的含量有季节性变动,为了前后比较应在每年同一季节检验。
应嘱体检对象在抽血前24小时内不做剧烈运动。
2.2 静脉采血:除非是卧床的病人,一般在采血时取坐位。
体位影响水分在血管内外的分布,会影响测试项目的浓度。
在采血前至少应静坐5分钟,一般从肘静脉取血,使用止血带的时间不超过1分钟,穿刺成功后立即松开止血带。
2.3 抗凝剂:血浆使用EDTANa2(1.8mg/mL)或肝素(0.1mg/ml)作为抗凝剂。
2.4 标本处理:血标本室温放置30min~45min后离心分离血清或血浆,在两小时内检测完毕;如两小时内不能检测完毕,将离心分离血清或血浆置洁净试管加盖2-8℃保存。
3.试剂3.1 试剂:本科使用湖南永和阳光科技责任公司Urea试剂盒,为液体双试剂,各组分如下:试剂组成:尿素标准液7.14 mmol/L3.2:校准血清使用湖南永和阳光科技责任公司提供的40项校准血清。
脲酶的测定方法

一、脲酶测定(比色法)脲酶是对尿素转化起关键作用的酶,它的酶促反应产物是可供植物利用的氮源,它的活性可以用来表示土壤供氮能力。
1、试剂配制:(1)pH6.7柠檬酸盐溶液:取368g柠檬酸溶于600mL蒸馏水中,另取295g 氢氧化钾溶于水,再将两种溶液合并,用1N氢氧化钠将pH调至6.7,并用水稀释至2L。
(2)苯酚钠溶液:称取62.5g苯酚溶于少量乙醇中,加2mL甲醇和18.5mL 丙酮,后用乙醇稀释至100mL(A液),保存再冰箱中。
称取27g氢氧化钠溶于100mL水中(B液),保存于冰箱中。
使用前,取A、B两液各20mL混和,并用蒸馏水稀释至100mL备用。
(3)次氯酸钠溶液:用水稀释制剂至活性氯的浓度为0.9%,(1.9g次氯酸钠溶于1L水中)溶液稳定。
(4)10%尿素溶液:10g尿素溶于100mL水中。
(5)N的标准溶液:精确称取0.4717g硫酸铵溶于水稀释至1L,则得1mL 含0.1mgN的标液,再将此液稀释10倍制成氮工作液(0.01mg/mL)。
2、操作步骤称取5g土置于50mL容量瓶中,加1mL甲苯处理,加塞塞紧轻摇15min;往瓶中加入5mL10%尿素液和10mL的柠檬酸盐缓冲液(pH6.7),仔细混匀。
在37℃恒温箱中培养24h。
然后用热至38℃的蒸馏水稀释至刻度(甲苯应浮在刻度以上),摇荡,将悬液过滤。
取滤液1mL置于50mL容量瓶中,用蒸馏水稀释至10mL,然后加入4mL苯酚钠溶液,并立即加入3mL次氯酸钠溶液,加入每一试剂后,立即将混合物摇匀,20min后,将混合物稀释至刻度,在波长578nm处测定吸光值。
脲酶活性以样品所得的吸光值减去对照样品吸光值之差,根据标准曲线求出氨态氮量。
标准曲线绘制:分别取0、1、3、5、7、9、11、13mL氮工作液置于50mL容量瓶中,加蒸馏水至20mL,再加4mL苯酚钠溶液和3mL次氯酸钠溶液,随加随摇匀,20min后显色,定容。
1h内再分光光度计上于578nm处比色。
酶标仪测脲酶实验报告

摘要:本实验旨在利用酶标仪检测脲酶活性,通过酶联免疫吸附测定(ELISA)技术,研究不同条件下脲酶的活性变化。
实验结果表明,酶标仪能够准确、快速地测定脲酶活性,为相关研究提供有力工具。
关键词:酶标仪;脲酶;ELISA;活性测定一、引言脲酶是一种广泛存在于生物体内的酶,主要催化尿素分解为氨和二氧化碳。
脲酶在生物体内具有重要作用,如参与氮代谢、氮循环等。
近年来,脲酶的研究在农业、医药、环保等领域具有重要意义。
为了准确、快速地测定脲酶活性,本研究采用酶标仪进行ELISA实验,探讨不同条件下脲酶活性的变化。
二、实验材料与仪器1. 实验材料:- 脲酶试剂盒(包括标准品、酶联试剂、洗涤剂等)- 样品(如尿液、组织等)- 0.05 mol/L磷酸盐缓冲液(pH 7.4)2. 实验仪器:- 酶标仪- 洗板机- 移液器- 低温离心机- 培养箱三、实验方法1. 样品处理:- 将样品按照试剂盒说明书进行稀释和预处理。
- 将预处理后的样品置于低温离心机中,离心5分钟,取上清液。
2. ELISA实验:- 将酶联试剂按照说明书进行配制,加入待测样品,进行酶联反应。
- 加入底物,进行显色反应。
- 加入终止液,终止反应。
- 使用酶标仪在450 nm波长下测定吸光度。
3. 数据处理:- 将实验数据与标准曲线进行拟合,计算脲酶活性。
四、实验结果与分析1. 标准曲线绘制:- 以酶联试剂的浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
- 标准曲线线性良好,相关系数R²>0.99。
2. 不同条件下脲酶活性变化:- 在不同pH、温度、酶浓度等条件下,脲酶活性存在显著差异。
- 在pH 7.4、温度37℃、酶浓度1 U/mL的条件下,脲酶活性最高。
3. 实验结果分析:- 本实验采用酶标仪进行ELISA实验,能够准确、快速地测定脲酶活性。
- 不同条件下脲酶活性存在显著差异,可能与酶的稳定性、活性位点暴露程度等因素有关。
五、结论本实验通过酶标仪ELISA技术,成功测定了不同条件下脲酶的活性。
尿素检测标准操作规程SOP

还原型辅酶I(NADH)
0.3mol/l
α-酮戊二酸
13.0mol/l
不同批次的试剂不推荐混合使用
7.4储存条件有效期
试剂在2-8℃保存可稳定1年,试剂开瓶后于2-8℃可稳定1个月。
7.5参数设置
主波长
340nm
辅助波长
405nm
反应方法
速率法
反应温度
37℃
反应方向
向下
试剂1
200ulቤተ መጻሕፍቲ ባይዱ
样本
2.5ul
4.1生理性:高蛋白饮食可引起血尿素浓度和尿液排出量显著增高。成人血清尿素浓度男性比女性平均高出0.3-0.8mmol/l,并随着年龄增加有增高倾向。妊娠妇女由于血容量增加,尿素浓度比非孕妇低。
4.2病理性:分为肾前性、肾性、肾后性。①肾前性:主要是严重失水引起的血液浓缩,肾血流量減少及肾小球滤过率降低,从而使尿素潴留,可见于剧烈呕吐、肠梗阻和长期腹泻;②肾性:为最常见的因素,可见于急性肾小球肾炎、肾功能衰竭、慢性肾盂肾炎及中毒性肾炎等,在肾功能不全的代偿期可见尿素轻度升高(>8.0mmol/L),肾功能衰竭失代偿期,尿素可中度升高(17.9~21.4mmol/L),肌酐也中度升高(442.0umol/L);尿毒症时尿素>21.4mmol/L,肌酐也可达1800umol/L,为尿毒症的诊断标准之一;③肾后性:如前列腺肥大、尿路结石、尿道狭窄、膀胱肿瘤等都可能使尿路阻塞引起血尿素升高。血液尿素减少较为少见,除了妊娠、蛋白质营养不良等情況外。常表示有严重的肝病、肝坏死。
12.2尿素氮测定只是临床医师对患者进行诊断的指标之一,临床医师还要根据患者的体征、病史及其他的诊断项目、诊断手段进行综合判断。
13.性能指标
13.1线性范围:在(0.3-35.7)mmol/L范围内:a)线性相关系数(r)应>0.995;b)(0.3-10.0)mmol/L范围内,线性偏差应≦2.0mmol/L;(10.0-35.7)mmol/L范围内,线性偏差应该≦10.0%。
高中生物-分离以尿素为氮源的微生物

高中生物-分离以尿素为氮源的微生物1.菌种特点含有脲酶,可以通过降解尿素作为其生长的氮源。
2.培养基用以尿素为唯一氮源的培养基培养,以3.实验原理(1)筛选以尿素为氮源的微生物,可使用以尿素为唯一氮源的选择培养基进行培养选择。
(2)细菌合成的脲酶能将尿素分解成氨气3,致使pH升高,使酚红指示剂变红。
4.实验步骤5.反应的鉴定在配制培养基时,加入指示剂酚红,培养时细菌将尿素分解并产生碱性的氨,使培养基上菌(1)分离以尿素为氮源的微生物时,配制的培养基中加入酚红作为酸碱指示剂,加入琼脂作为凝固剂(❌)(2)选择培养基可以鉴定某种微生物的种类(错误)(3)从物理性状的角度看,选择培养基多属于固体培养基(正确)(4)对细菌进行计数只能采用涂布分离法,而不能用划线分离法(❌)精确——涂布(5)筛选能分解尿素的细菌所利用的培养基中,尿素是唯一的氮源(正确)(6)分解尿素的细菌在分解尿素时,可以将尿素转化为氨,使得培养基的酸碱度降低(错误)如图为分离以尿素为氮源的微生物的实验,思考回答下列问题:(1)实验目的是使用含有尿素的培养基分离能产生脲酶的细菌,使用酚红指示剂作为指示剂。
(2)有脲酶的细菌菌落周围出现有色环带的原因是什么?细菌分泌脲酶,可以将尿素分解为氨气改变酸碱度,使酚红指示剂变红(3)制备尿素固体培养基的过程中采用的灭菌方法有高压蒸汽灭菌法、G6玻璃砂漏斗过滤法。
(4)从上图所示实验过程中可判断出细菌悬液C的稀释度为10^-4 。
1.幽门螺杆菌(Hp)感染是急慢性胃炎和消化性溃疡的主要致病因素。
在患者体内采集样本并制成菌液后,进行分离培养。
实验基本步骤如下:配制培养基→灭菌、倒平板→X→培养→观察请回答下列问题:(1)在配制培养基时,要加入尿素和酚红指示剂,这是因为Hp含有___脲酶_____,它能以尿素作为氮源;若有Hp,则菌落周围会出现___红___色环带。
(2)下列对尿素溶液进行灭菌的最适方法是______D____灭菌。
脲酶活力测定(纳氏试剂比色法)
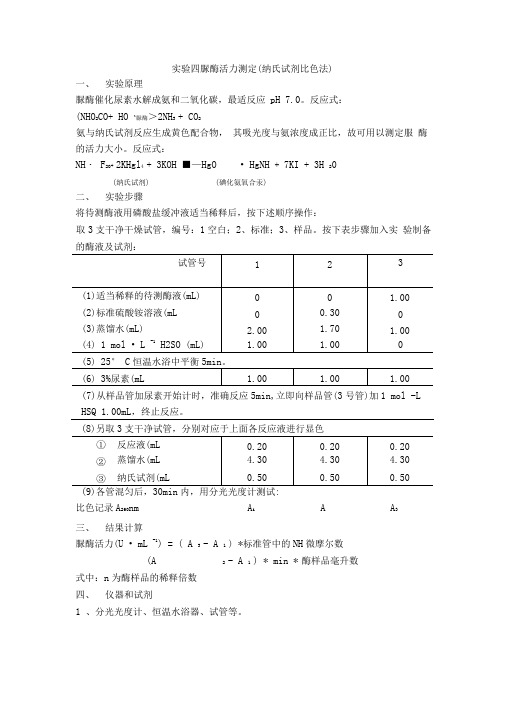
实验四脲酶活力测定(纳氏试剂比色法)一、实验原理脲酶催化尿素水解成氨和二氧化碳,最适反应pH 7.0。
反应式:(NHO2CO+ HO ^脲酶>2NH3 + CO2氨与纳氏试剂反应生成黄色配合物,其吸光度与氨浓度成正比,故可用以测定服酶的活力大小。
反应式:NH・ F2O+ 2KHgl4 + 3KOH ■—HgO • HgNH + 7KI + 3H 20(纳氏试剂) (碘化氨氧合汞)二、实验步骤将待测酶液用磷酸盐缓冲液适当稀释后,按下述顺序操作:取3支干净干燥试管,编号:1空白;2、标准;3、样品。
按下表步骤加入实验制备的酶液及试剂:(7)从样品管加尿素开始计时,准确反应5min,立即向样品管(3号管)加1 mol -L HSQ 1.00mL,终止反应。
(8)另取3支干净试管,分别对应于上面各反应液进行显色(9)各管混匀后,30min内,用分光光度计测试:比色记录A260nm A i A A3三、结果计算脲酶活力(U • mL -1) = ( A 3 - A 1 ) *标准管中的NH微摩尔数(A 2 - A 1 ) * min * 酶样品毫升数式中:n为酶样品的稀释倍数四、仪器和试剂1 、分光光度计、恒温水浴器、试管等。
2、“有机溶剂沉淀法制备大豆脲酶”实验中制备的脲酶提取液和粗酶液,用磷酸盐缓冲液适当稀释。
3 、3 %尿素底物溶液:3g 高纯尿素用磷酸盐缓冲液溶解,并定容至100mL 。
4、磷酸盐缓冲液(pH7.0): 6.70 g Na2HPO4 • 2 H2O , 3.25 g KH2PO4,溶于蒸馏水并定容至100 mL 。
5、 1 mol • L -1 HSQ溶液:56mL浓硫酸,缓慢加入盛有约600 mL蒸馏水的容量瓶中,冷却后加水定容至1000mL。
6、硫酸铵标准溶液:称取在60° C干燥至恒重的分析纯硫酸铵1.322g,蒸馏水溶解,并定容至100mL。
此溶液含NH3为40卩mol • mL-1。
脲酶、蛋白酶和L-天冬酰胺酶活性测定方法

一、脲酶活性测定方法(苯酚钠-次氯酸钠比色法)1.称取5g过100目筛的风干土样于50ml容量瓶中,加入1ml甲苯使其与土样充分混匀静置15min,使土壤中微生物被完全杀死;2.往瓶中加入10ml 100g/L的尿素溶液和20ml柠檬酸盐缓冲液,仔细混匀后置于37℃恒温下培养24h;3.用加热至38℃的蒸馏水稀释至刻度线(甲苯应浮在刻度线之上),摇匀,过滤;4.每一土样都设置用水代替基质的对照;对整个实验,设置无土壤的对照,以检验试剂的纯度;5.吸取3ml滤液到50ml容量瓶中,用水稀释至15ml,然后加入4ml苯酚钠溶液,并加入3ml次氯酸钠溶液,每次加完试剂都要摇匀;6.静置20min后,使其充分显色,定容显色液,于分光光度计578nm处比色,脲酶活性以24h后1g土壤中铵态氮的mg数表示。
1.取25ml酪氨酸基质溶液于100ml三角瓶中,于30℃水浴保温;2.加入5g鲜土,1ml甲苯,混匀后,30℃恒温箱中培养48h;3.取出三角瓶,加入25ml蛋白质沉淀剂,静置30min,待蛋白质沉淀后用干滤纸过滤;4.取2ml滤液于试管中,加入0.55mol/L Na2CO35ml,33% Folin试剂1ml,立即振荡;5.将试管放入30℃恒温水浴中,显色30min;6.用分光光度计在波长680nm处测定光密度,由标准曲线查出酪氨酸含量。
1.称取5g鲜土(过10目)于50ml刻度试管中,加0.2ml甲苯和9ml Tris缓冲液,混匀后加入1ml 0.05mol/L L-天冬酰胺溶液,混匀,37℃下培养2h后,加入35ml KCl-Ag2SO4混合溶液,混合均匀,静置冷却至室温(约5min),用KCl-Ag2SO4混合溶液定容,混匀;2.吸取20ml L-天冬酰胺溶液前,加入KCl-Ag2SO4混合溶液。
高中生物 课时跟踪检测(二)分离以尿素为氮源的微生物(含解析)浙科版选修1-浙科版高中选修1生物试题

课时跟踪检测(二)分离以尿素为氮源的微生物1.从土壤中分离以尿素为氮源的细菌,实验过程如图所示:(1)图中物质A为________________,若要统计每克土壤样品中以尿素为氮源的细菌的活菌数目,宜采用________________法接种到尿素培养基上,对照组配制的培养基为____________培养基,若用同浓度的土壤稀释液接种,实验组培养皿中菌落数____________(填“大于”“等于”或“小于”)对照组。
在能利用尿素的细菌菌落周围,有红色环带出现的原因是_______________________________________________。
(2)下列培养基中,能分离出分解尿素的细菌的是( )A.葡萄糖、NaCl、K2HPO4、酚红、琼脂糖、水B.葡萄糖、NaCl、K2HPO4、酚红、琼脂糖、水、尿素C.NaCl、琼脂糖、水、蛋白胨、酵母提取物、尿素D.葡萄糖、NaCl、K2HPO4、酚红、琼脂糖、水、蛋白胨、酵母提取物(3)欲将分离得到的以尿素为氮源的细菌进行扩大培养,应使用________培养基。
答案:(1)无菌水涂布分离LB全营养小于能利用尿素的细菌产生的脲酶,将培养基中的尿素分解,产生的氨使指示剂呈红色(2)B (3)LB液体2.苯酚是工业生产排放的有毒污染物质,自然界中存在着降解苯酚的微生物。
某工厂产生的废水中含有苯酚,为了降解废水中的苯酚,研究人员从土壤中筛选获得了只能降解利用苯酚的细菌菌株,筛选的主要步骤如图所示,①为土壤样品。
请回答下列问题:(1)②中培养目的菌株的选择培养基中应加入______作为碳源,②中不同浓度碳源的培养基________(填“影响”或“不影响”)细菌的数量,如果要测定②中活细菌数量,常采用____________________法。
(2)④为对照,微生物在④中不生长,在⑤中生长,④与⑤培养基的主要区别在于__________________________________;使用________________________________法可以在⑥上获得单菌落。
尿素测定标准操作规程

尿素测定标准操作规程1.检验原理:(酶偶联检测法)尿素经脲酶催化水解生成氨与二氧化碳,在谷氨酸脱氢酶催化下,氨与α-酮戊二酸、还原型辅酶Ⅰ(NADH )作用生成谷氨酸与氧化型辅酶Ⅰ(+NAD ),还原型辅酶Ⅰ在340nm 波长处有吸收峰,而氧化型辅酶Ⅰ几乎无吸收峰,还原型辅酶Ⅰ在340nm 吸光度的下降速率与样品中尿素含量成正比。
尿素+2O H 2−−→−脲酶2+4NH +-23CO Α-酮戊二酸++4NH +NADH++H −−−−→−谷氨酸脱氢酶L-谷氨酸++NAD +O H 2 2.试剂主要组成成分3.样本要求:新鲜无溶血血清。
在22~25℃保存8小时,2~8℃保48小时,-20℃保存7天,样本不可反复冻融!样本中抗坏血酸含量≤0.3g/L 、胆红素含量≤0.4g/L 、血红蛋白含量≤5.0g/L 、脂血含量≤5.0g/L 对检测结果基本无影响。
4.检验方法;仪器法(详见DF-603/DI-600标准操作规程)5.参考范围:6.检验结果的解释:6.1样本含量超出线性范围时,建议用0.9%(W/V )的氯化钠溶液稀释样本,最大稀释不超过10倍。
6.2.单位换算:mg/dl=mmol/L×6.027.检验方法的局限性7.1结果的准确性依赖于仪器的校正和测定温度、时间的控制。
7.2若试剂浑浊,或以水空白在340nm处吸光度小于1.000时不能使用。
7.3检验结果仅供参考,不作为临床诊断的唯一依据。
8.试剂性能指标8.1试剂外观:无色透明液体,无悬浮物及沉淀。
8.2装量:不低于标识值。
8.3试剂空白8.3.1试剂空白吸光度:在340nm处,光径1cm时,空白吸光度A≥1.0008.3.2试剂空白吸光度变化率:在340nm处,光径1cm时,△A/min≤0.004.8.4线性区间:试剂的线性区间为[0.9-35.7]mmol/L,在此线性区间内:a)线性相关系数r应不小于0.9900;b)[0.9-4.0]mmol/L区间内,线性绝对偏差不超过±0.4mmol/L;[4.0-35.7]umol/L区间内,线性相对偏差不超过±10%。
实验03土壤中分解尿素的细菌的分离与计数

专题03土壤中分解尿素的细菌的分离与计数一、实验原理:(1)土壤中的细菌之所以能分解尿素是因为它们能合成尿酶。
(2)配置以尿素为唯一氮源的培养基,能够在这个培养基上生长的细菌就是能分解尿素的细菌。
二、操作步骤:(1)土壤取样①土壤要求:酸碱度接近中性且潮湿。
②取样部位:距地表约3~8 cm的土壤层。
(2)样品的稀释测定土壤中细菌的数量,一般选用1×104、1×105和1×106倍稀释的稀释液进行平板培养,当第一次做这个实验时可以将稀释的范围放宽一点。
(3)微生物的培养与观察①培养:根据不同微生物的需要,控制适宜的培养温度和培养时间。
细菌一般在30~37 ℃的温度下培养1~2 d。
②观察a.观察方法:每隔24 h统计一次菌落数目,选取菌落数目稳定时的记录作为结果。
b.记录菌落的特征:包括菌落的形状、大小和颜色等。
2、灭菌培养基:高压蒸汽灭菌法3、培养皿灭菌:干热灭菌法三、操作提示(1)无菌操作①取土样的用具在使用前都需要灭菌。
②实验操作均应在酒精灯火焰旁进行。
(2)做好标记:本实验使用的平板和试管较多,为避免混淆,最好在使用前做好标记。
例如,在标记培养皿时应该注明组别、培养日期和平板上培养样品的稀释度等。
(3)制定计划:对于耗时较长的生物实验,需要事先规划时间,以便提高实验效率,在操作时有条不紊。
土壤中分解尿素的细菌的分离与计数操作中需注意的问题(1)为了保证结果准确,一般选择菌落数在30~300的平板进行计数。
(2)恰当的稀释度是成功统计菌落数目的关键。
(3)为增强实验说服力与准确性,设计实验时,需要涂布至少三个平板作为重复组,目的是排除实验中偶然因素对实验结果的影响。
(4)分析实验结果时,要考虑重复组结果是否接近,如果相差太大,意味着操作有误,需重新实验。
(5)为防止培养时间不足导致菌落遗漏,在菌落计数时,每隔24 h统计一次菌落数目,选取菌落数目稳定时的记录作为结果。
幽门螺杆菌培养、测定、药敏检测试剂盒(微生物检验法)产品技术要求益民

幽门螺杆菌培养、测定、药敏检测试剂盒(微生物检验法)2.性能指标2.1外观与结构2.1.1Hp培养液应透明、呈淡黄色、清亮,无沉淀、无凝块、无絮状物。
2.1.2Hp药敏微孔板应透明,无明显裂纹、气泡、锋棱及毛刺。
板盖与板体嵌接应紧密。
2.1.3CAT反应液应为无色清亮液体。
2.1.4无菌滤纸片无菌滤纸片应干净、平整、边角分明。
2.1.5试剂盒的文字和标记应清晰、准确、牢固。
2.2性能2.2.1酸碱度:分离培养液、药敏培养液在25℃时的 pH 值应为6.0±0.8。
2.2.2培养灵敏度:分离培养液、药敏培养液接种终浓度为 103CfU/ml 的目的菌株应可生长。
2.2.3培养选择性:分离培养液接种终浓度为 104CfU/ml 的非目的菌株不应生长。
2.2.4培养鉴定药敏重复性2.2.4.1批内重复性2.2.4.1.1Hp 分离培养型:Hp 质控菌株培养重复率应达 100%;2.2.4.1.2Hp 测定药敏型:Hp 质控菌株鉴定重复率应达 100%,药敏重复率应达 95%。
2.2.4.2批间重复性2.2.4.2.1Hp 分离培养型:Hp 质控菌株培养重复率应达 100%;2.2.4.2.2Hp 测定药敏型:Hp 质控菌株鉴定重复率应达 100%,药敏重复率应达 95%。
2.3微生物污染培养液应无微生物污染。
2.4装量最大允许偏差2.4.1Hp分离培养液Ⅰ型装量允许最大偏差为1.5ml+0.1ml,Ⅱ型装量允许最大偏差为1.0ml+0.1ml。
2.4.2Hp药敏培养液装量允许最大偏差为3.6ml+0.2ml。
2.4.3CAT 反应液装量允许最大偏差为 1.2ml+0.1ml。
尿素快速测定实验报告

一、实验目的1. 掌握尿素快速测定方法的基本原理和操作步骤。
2. 学习使用尿素检测试剂盒进行尿液中尿素含量的快速测定。
3. 熟悉实验数据的处理和分析方法。
二、实验原理本实验采用尿素酶法进行尿液中尿素含量的快速测定。
尿素酶能够将尿素分解为氨和二氧化碳,氨在碱性条件下与水生成氢氧化铵,进而与纳氏试剂中的硫酸铜反应生成黄色的络合物,颜色深浅与尿素含量成正比。
三、实验材料与仪器1. 实验材料:- 尿液样本- 尿素检测试剂盒(包括试剂A、试剂B、纳氏试剂、pH缓冲液等)- 试管、移液管、滴定管、量筒等2. 实验仪器:- 酶标仪- 移液器- 恒温水浴锅四、实验步骤1. 样本准备:取适量尿液样本,加入试剂A,混匀后静置5分钟。
2. 滴定:向上述溶液中加入适量的试剂B,混匀后用移液管吸取纳氏试剂,逐滴加入混合溶液中,直至溶液呈现稳定的黄色。
3. 测定:将混合溶液置于酶标仪中,在特定波长下测定吸光度值。
4. 数据处理:根据吸光度值和标准曲线,计算尿液样本中的尿素含量。
五、实验结果与分析1. 标准曲线绘制:使用已知浓度的尿素标准溶液,按照上述实验步骤进行测定,绘制标准曲线。
2. 尿素含量测定:根据尿液样本的吸光度值,从标准曲线上查得对应的尿素浓度。
六、实验讨论1. 实验结果与理论值的一致性:本实验测定的尿素含量与理论值基本一致,说明实验方法可靠。
2. 影响实验结果的因素:尿液样本的保存、试剂的浓度、操作步骤等均可能影响实验结果。
3. 改进措施:为提高实验结果的准确性,可以采取以下措施:- 严格控制尿液样本的保存条件,避免细菌污染。
- 精确配制试剂,确保试剂浓度准确。
- 严格按照实验步骤进行操作,避免人为误差。
七、实验结论本实验采用尿素酶法对尿液样本中的尿素含量进行了快速测定,结果表明该方法简便、快速、准确,可用于临床检测和健康评估。
八、实验报告(以下为实验报告的详细内容,可根据实际情况进行修改和补充)1. 实验目的:掌握尿素快速测定方法的基本原理和操作步骤,学习使用尿素检测试剂盒进行尿液中尿素含量的快速测定。
尿素测定试剂盒(尿素酶-谷氨酸脱氢酶法)产品技术要求meigaoyi

尿素测定试剂盒(尿素酶-谷氨酸脱氢酶法)适用范围:用于体外定量测定人血清中尿素的浓度。
1.1.包装规格a) 试剂1:2×60ml,试剂2:2×15ml;b) 试剂1:4×60ml,试剂2:4×15ml;c)试剂1:2×80ml,试剂2:2×20ml;d) 试剂1:2×40ml,试剂2:2×10ml;e)试剂1:2×400ml,试剂2:2×100ml;f) 试剂1:2×72ml,试剂2:2×18ml;g)试剂1:1×40ml,试剂2:1×10ml;h)试剂1:12×16ml,试剂2:12×4ml。
1.2.试剂主要组成成分试剂1主要组成成分Tris缓冲液(PH 6.0-9.0) 115mmol/Lα-酮戊二酸 8mmol/L腺苷二磷酸(ADP) 2mg/L谷氨酸脱氢酶(GLDH)≥0.8KU还原型辅酶I(NADH) 0.35mmol/L试剂2主要组成成分Tris缓冲液(PH 6.0-9.0) 115mmol/Lα-酮戊二酸 8mmol/L 尿素酶(URH)≥40K2.1外观和性状2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;外包装完好、无破损,标签完好、字迹清晰。
2.1.2 试剂1应为无色或淡黄色透明溶液;试剂2应为无色或淡黄色透明溶液。
2.2净含量应不低于试剂瓶标示装量。
2.3试剂空白2.3.1 试剂空白吸光度测定试剂空白吸光度,应≥1.0;2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率△A/min≤0.04。
2.4分析灵敏度测试30mmol/L的被测物时,吸光度变化率(△A/min)应不低于0.025。
2.5准确度测定值与靶值相对偏差不超过±15%。
2.6精密度2.6.1批内精密度变异系数(CV)应不超过5%。
2.6.2批间精密度批间相对极差应不大于10%。
脲酶说明书(分光光度法)
货号:MS1814 规格:100管/48样脲酶(Urease,UE)测定试剂盒说明书微量法注意:正式测定之前选择 2-3个预期差异大的样本做预测定。
测定意义:UE能够水解尿素,产生氨和碳酸。
UE活性与有机物质含量、全氮和速效氮含量呈正相关,反应了氮素状况。
测定原理:-N。
利用靛酚蓝比色法测定脲酶水解尿素产生的NH3自备实验用品及仪器:可见分光光度计/酶标仪、水浴锅、可调式移液器、微量石英比色皿/96孔板、研钵、冰、甲苯(不允许快递)和蒸馏水。
试剂的组成和配制:提取液:液体50mL×1瓶,4℃保存;试剂一:粉剂×1瓶,临用前加入9mL蒸馏水,充分溶解待用,4℃保存;用不完的试剂4℃保存;试剂二:液体19mL×1瓶,4℃保存;试剂三A液:液体×1支,4℃保存;试剂三B液:液体×1瓶,4℃保存;临用前将A液倒入B液中混合,待用;用不完的试剂4℃保存一周;试剂四:液体2mL×1瓶,4℃保存;样本的前处理:1、细菌、细胞或组织样品的制备:细菌或培养细胞:先收集细菌或细胞到离心管内,离心后弃上清;按照细菌或细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细菌或细胞加入1mL提取液),超声波破碎细菌或细胞(冰浴,功率20%或200W,超声3s,间隔10s,重复30次);8000g 4℃离心10min,取上清,置冰上待测。
组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液),进行冰浴匀浆。
8000g 4℃离心10min,取上清,置冰上待测。
2、血清(浆)样品:直接检测。
测定步骤:1、分光光度计或酶标仪预热30min以上,调节波长至578nm,蒸馏水调零。
2、将上清液稀释10倍(取0.1mL上清液,加入0.9mL蒸馏水)。
个对照管。
UE活力计算a.用微量石英比色皿测定的计算公式如下标准条件下测定的回归方程为y = 0.0915x +0.0373;x为标准品浓度(μg/mL),y为吸光值A。
辅酶 Q10(CoQ10)检测试剂盒说明书

注意事项: 1、待测样品中不能含有 CoQ10 抑制剂,同时需避免反复冻融。 2、在皂化过程中,震荡不要剧烈,以免形成乳化层。 3、CoQ10Assaybuffer 如果出现浑浊或絮状物,应弃用。 4、CoQ10 标准梯度应准确,尽量减少不必要的误差。 5、ECsolution 有一定毒性,请小心操作。 6、检测标准品时,按步骤 3 表格混合后,2min 内即出现明显的蓝色变化并逐渐加深,20min 后蓝色开始变浅,30min 后逐渐呈黄绿色。630nm 检测数据表明,随着时间的延长,OD 值 在不断的下降,对应的颜色也已发生变化,特别是高浓度的标准品变化比较大。因此,应在 出现最深的蓝色结果且稳定的时间段内尽快检测,而且建议每次同时检测标准品 (0.3~0.5mg/ml)和样品。如有条件,最好用酶标仪检测,减少因检测时间导致的误差。 7、为了您的安全和健康,请穿实验服并戴一次性手套操作。
辅酶 Q10(CoQ10)检测试剂盒(微板法)说明书
本产品仅供体外研究使用,不得用于临床诊断
产品简介: 辅酶 Q(CoenzymeQ,CoQ)是一种生物体内广泛存在的脂溶性醌类化合物,故又称泛醌,在 体内呼吸链中质子移位及电子传递中起重要作用,是呼吸链中重要的递氢体,它是细胞呼吸 和细胞代谢的激活剂,也是重要的抗氧化剂和非特异性免疫增强剂。对多种酶有激活作用。 不同生物体来源的辅酶 Q 其侧链异戊烯单位的数目不同,人类和哺乳动物是 10 个异戊烯单 位,故称辅酶 Q10。辅酶 Q10 是辅酶 Q 类的重要成员之一,它们与线粒体内膜相结合,广 泛参与体内的生物代谢过程。
相关产品: 氨苄青霉素溶液(Ampicillin,50mg/ml) 苏木素伊红(HE)染色液 SDS-PAGE 凝胶配制试剂盒 尿素(Urea)检测试剂盒(脲酶波氏比色法) 丙二醛(MDA)检测试剂盒(TBA 比色法) 附一:参考标准曲线范围:测定 CoQ10 标准 0.04、0.1、0.3、0.5、1、2、5mg/ml 在 630nm 的吸光度,据此做出其标准曲线如下:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
尿素(Urea)检测试剂盒(脲酶波氏微板法)
简介:
尿素(Urea)又称碳酰胺(carbamide),是哺乳动物和某些鱼类体内蛋白质代谢分解的主要含氮终产物,也是目前含氮量最高的氮肥。
尿素检测方法大致分为化学方法和酶学方法,后者被认为是间接方法,先经尿素酶分解尿素为铵离子,然后根据波氏反应,检测铵离子的生成量。
该试剂盒可用于检测人体、动物的血浆、血清、尿液等样品中尿素(旧称尿素氮,BUN)含量,但尿液最好经过处理后再行检测。
该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
组成:
操作步骤(仅供参考):
1、 准备样品:血浆、血清样品:血浆、血清按照常规方法制备后可以直接用于本试剂盒的
测定,-20℃冻存。
如为尿液样品,最好处理后检测,方法如下。
2、 配制标准品工作液:取尿素标准(100mmol/L),按尿素标准(100mmol/L):
ddH 2O=1:19的比例混合,使浓度达到5mmol/L ,即为标准品工作液-尿素标准(5mmol/L)。
3、 Urea 比色操作:按照下表设置空白孔、标准孔、测定孔,溶液应按照顺序依次加入,
并注意避免产生气泡。
如果样品中的Urea 浓度过高,可以减少样品用量或适当稀释后再进行测定。
编号 名称
TC1165 100T Storage
试剂(A): 尿素标准(100mmol/L) 1ml 4℃ 避光 试剂(B): 脲酶溶液 0.2ml -20℃ 避光 试剂(D): 酚显色液 10ml -20℃ 避光 试剂(E): Urea assay buffer 10ml -20℃ 避光 试剂(F): ddH 2O 10ml
RT 使用说明书
1份
加入物
空白孔 标准孔 测定孔 ddH 2O/μl
10 — — 尿素标准(5mmol/L)/μl — 10 — 待测样品/μl — — 10 脲酶工作液/ml
0.02
0.02
0.02
充分混匀,37℃水浴15min。
酚显色液/ml 0.1 0.1 0.1
Urea assay buffer/ml 0.1 0.1 0.1
5、Urea检测:充分混匀,水浴分光光度计检测560nm吸光度,比色杯光径1.0cm,空白管调零,读取各管吸光度,分别为A标准、A测定。
计算:
尿素(mmol/L)=(A测定/A标准)×5mmol/L
参考区间:
成年人血清尿素 2.9-8.2mmol/L
注意事项:
1、最好测定560nm处吸光度,如无560nm,也可检测630nm处吸光度值。
2、如果没有分光光度计,也可以使用酶标仪测定。
3、避免使用铵盐抗凝剂,否则会使结果偏高。
4、高浓度氟化物可抑制尿素酶,引起结果假性偏低。
5、为了您的安全和健康,请穿实验服并戴一次性手套操作。
