第七章、紫外可见吸收光谱法
第7章紫外吸收光谱分析

第七章紫外吸收分析法一、判断题(对的打√, 错的打×)1、紫外吸收光谱法只适合分子中含共轭结构的化合物的分析。
(√)2、电磁波的波长越大,能量越大。
()3、紫外吸收是由外层价电子能级跃迁所致,其能级差的大小,决定了其吸收峰的位置。
(√)4、根据朗伯-比耳定律,如果入射光的波长相同,被测物质的浓度不同,则摩尔吸光系数不同。
()5、根据朗伯-比耳定律,被测物质的浓度越大,测定的吸光度值越大,测量结果越准确。
()6、极性溶剂一般使π→π*跃迁发生红移,使n→π*跃迁发生蓝移。
(√)7、当分子中的助色团与生色团直接连接时,将使n→π*跃迁发生红移。
()8、在紫外-可见光度分析中极性溶剂会使被测物吸收峰精细结构更明显。
()9、在紫外吸收光谱测定中,应尽量选择弱溶剂或非极性的溶剂。
(√)二、选择题1、光量子的能量正比于幅射的(A)A、频率B、波长C、波数D、传播速度2、在一些含有>C=O、—N=N等基团的分子中,由n→π*跃迁产生的吸收带称为(D)A、K吸收带B、E吸收带C、B吸收带D、R吸收带3、苯胺的紫外光谱中,λmax=230nm,εmax=8600的吸收带是(C)A、K带B、R带C、E2带D、B带4、丙酮在已烷中的紫外吸收λmax=279nm,ε=14.8,该吸收带是由哪种跃迁引起的?(C)A、σ→σ*B、n→σ*C、n→π*D、π→π*5、紫外吸收光谱曲线中,能用来定性的参数是( D )A、最大吸收峰的吸光度B、最大吸收峰处的摩尔吸收系数C、最大吸收峰的波长D、最大吸收峰的波长和其摩尔吸收系数6、在下面四种溶剂中测定化合物CH3COCH=C(CH3)2的n→π*跃迁,吸收带波长最短的是( D )A、环己烷B、氯仿C、甲醇D、水7、区别n→π*和π→π*跃迁类型,可以用吸收峰的( C )A、最大波长B、形状C、摩尔吸光系数D、吸光度8、在光学分析法中, 采用钨灯作光源的是( C )A、原子光谱B、紫外光谱C、可见光谱D、红外光谱9、摩尔吸光系数与下列哪个因素无关( A )A、溶液的浓度B、溶液的性质C、溶液的温度D、入射光波长10、某化合物在紫外光谱的220~280nm范围内没有吸收,该化合物可能属于以下化合物中的哪一类? ( D )A、芳香族化合物B、含共轭双键化合物C、醛类D、醇类11、某化合物分子式为C5H8O,在紫外光谱上有两个吸收带:λmax=224 nm 时,εmax =9750;λmax=314 nm时,εmax =38;以下可能的结构是(A)A、CH3COCH=CHCOCH3 B、CH3CH=CHCH2CHOC、CH2=CHCH2CH2CHOD、CH≡CCH2CH2CH2OH12、在300nm波长进行分光光度测定时,应选用何种比色皿( C)A、硬质玻璃B、软质玻璃C、石英D、透明有机玻璃13、伍德沃德提出了计算共轭二烯、多烯烃及共轭烯酮类化合物哪类跃迁最大吸收波长的经验规则( D )A、σ→σ*B、n→σ*C、n→π*D、π→π*14、在可见-紫外分光光度计中,用于紫外波段的光源是:(B)A、钨灯B、氘灯C、卤钨灯D、能斯特光源15、按一般光度法用空白溶液作参比溶液,测得某试液的透射比为10%,如果更改参比溶液,用一般分光光度法测得透射比为20% 的标准溶液作参比溶液,则试液的透光率等于( C)A、8%B、40%C、50%D、80%16、如果显色剂或其他试剂在测定波长有吸收,参比溶液应采用(B )A、溶剂参比;B、试剂参比;C、试液参比;D、褪色参比。
第七章 分子发光-荧光与磷光解读

激发光谱
发射光谱
l
荧光激发光谱
荧光发射光谱
200
250
300
350
400
450
蒽的激发光谱和荧光光谱
500 nm
三、荧光光谱的特征—激发光谱与发射光谱的关系
1、Stokes位移 在溶液中,分子的荧光发射波长总是比其相应的吸收(或激 发)光谱的波长长,荧光发射这种波长位移的现象称为Stokes 位移。 处于激发态的分子一方面由于振动弛豫等损失了部分能量,
T1
紫 外 可 见 吸 收 光 谱
紫 外 可 见 共 振 荧 光 S0 光 谱
S1
迟 滞 荧 光
振动弛豫: Vr 10-12sec 外 转 移:无辐射跃迁 回到基态 内 转 移:S2~S1能级 之间有重叠 系间窜跃: S2~T1能级 之间有重叠 反系间窜跃:由外部获 取能量后 T1 ~ S2
磷 光
外转移
蒽的发射光谱
蒽的三维等高线光谱图
蒽的三维等荧光强度光谱
VB1和VB2的三维荧光光谱
3.三维共振光散射光谱
ADS ATS ADS ATS RLS DS TS
RLS
DS
TS 散射片三维共振光散射光谱
固定lex=270nm
共振光散射 瑞利散射 拉曼光 二级共振光散射 三级共振光散射
500 550 600 650 700 750 800 850 900
2.电子激发态的多重度
电子激发态的多重度:M=2S+1 S为电子自旋量子数的代数和(0或1); 平行自旋比成对自旋稳定(洪特规则),三重态能级比相应单 重态能级低;
大多数有机分子的基态处于单重态;
S0→T1 禁阻跃迁;
通过其他途径进入
第七章 吸光光度法 (1)

2 一些基本名词和概念
吸收光谱曲线:物质在不同波长下吸收光的强度大小
A~ 关系
最大吸收波长 max:光吸收最大处的波长
Δ
对比度(Δ ):络合物最大吸 收波长( MRmax)与试剂最大 吸收波( Rmax)之差
max
吸收曲线的讨论:
(1)同一种物质对不同 波长光的吸光度不同。吸 光度最大处对应的波长称 为最大吸收波长λmax
ΔE=E2-E1=hν
不同的物质微粒由于结构不同而具有不同的量子化能级, 其能量差也不相同。仅当照射光光子提供的能量(hν)与被照物 质的基态与激发态能量之差ΔE相等时才能发生吸收。所以物 质对光的吸收具有选择性。
h
S3 S2
E3 E2 E1
A
S1
S0
纯电子能态 间跃迁
S2 h
E0
锐线光谱
A
光的互补
若两种不同颜色的单色光按一定的 强度比例混合得到白光,那么就称 这两种单色光为互补色光,这种现 象称为光的互补。
10-2 nm 10 nm
射 线 x 射 线
102 nm 104 nm
紫 外 光 红 外 光
0.1 cm 10cm
微 波
103 cm
105 cm
无 线 电 波
可
绿 蓝绿 绿蓝 蓝 红
2、化学反应引起的偏离 L-B中浓度(c) 应指吸光物质的平衡浓度, 即吸光型体的平衡浓度。 实际常用吸光物质的分析浓度。只有当平衡 浓度等于或正比于分析浓度时,其吸光度符合 比尔定律。但溶液中吸光物质常因缔合、离解、 互变异构,络合物的逐级形成,以及与溶剂的 相互作用等而形成新的化合物或改变吸光物质 浓度,这些都将导致偏离比尔定律。如
吸光光度法

(1)棱镜的色散
棱镜有玻璃和石英两种材料.它们的色散原理是依 据不同的波长光通过棱镜时有不同的折射率而将不 同波长的光分开. 由于玻璃可吸收紫外光,所以玻璃棱镜只能用于 350 ~ 3200 nm的波长范围,即只能用于可见光域 内.石英棱镜可使用的波长范围较宽,可从185 ~ 4000nm,即可用于紫外、可见和近红外三 个光 域.
目视比色法特点: 目视比色法的主要缺点是准确度不高,如 果待测液中存在第二种有色物质,甚至会 无法进行测定。 由于许多有色溶液颜色不稳定,标准系列 不能久存,经常需在测定时配制,比较麻 烦。 但设备简单,操作简便,比色管内液层厚 使观察颜色的灵敏度较高,且不要求有色 溶液严格服从比耳定律,因而它广泛应用 于准确度要求不高的常规分析中。
(2)光栅的色散
光栅是利用光的衍射与干涉作用制成的,它可用 于紫外、可见及红外光域,而且在整个波长区具有 良好的、几乎均匀一致的分辨能力.它具有色散波
1. 光色的互补关系
单色光; 复合光; 人眼能感觉到的光称为可见光(其波长范围大约 在400~750nm之间)。 日光、白炽灯光等可见光都是复合光。
如果把两种适当颜色的单色光按一定强度比例混 合后,就能得到白光。我们便称这两种单色光为 互补色光。
2. 物质对光的选择吸收
7.5目视比色与分光光度计
定义:用眼睛观察,比较待测 物质溶液颜色深浅以测定其含 量的方法 标准系列 应用: 准确度要求不高的中间 控制 限界分析:要求确定样品 中待测组分含量是否在规定的 最高含量限界以下 特点: 未知样品 1. 优点:仪器简单、操作方 便、适于大批样品的分析 2.缺点: 主观性大、准确度差
当一束白光(强度为I0 )通过下列几种溶液,溶 液呈现的颜色和吸收光的关系如下图:
华中师范大学等六校合编《分析化学》(下册)笔记和课后习题(含考研真题)详解(紫外-可见吸收光谱法)

3 / 27
圣才电子书 十万种考研考证电子书、题库视频学习平台
NH3<乙二胺<联吡啶<邻二氮菲<NO2<CN- ③d-d 配体场跃迁的特点 跃迁概率较小,摩尔吸收系数丌大,在定量分析中没有多大价值。 (2)电荷转移跃迁 ①电荷转移跃迁的原因 配合物中配体和金属离子乊间,一方的电子向主要属于另一方的轨道的跃迁。 ②产生电荷转移跃迁的必要条件 配合物的组分乊一能够给电子,而另一个能够接叐电子。 ③丼例
4 / 27
圣才电子书
(2)单色器
十万种考研考证电子书、题库视频学习平台
①作用:从连续光谱中获得所需单色光的装置。
②类型:棱镜、光栅。
(3)吸收池
①作用:用于盛放溶液并提供一定吸光厚度的器皿。
②类型:玱璃吸收池(可见光)、石英吸收池(紫外和可见光)。
(4)检测器
①作用:检测光信号。
6 / 27
圣才电子书 十万种考研考证电子书、题库视频学习平台
将未知纯化合物的吸收光谱特征不已知纯化合物的迚行比较。 ②光谱比较法的局限性 a.谱带宽且缺乏精细结构,特征性丌明显; b.很多生色团的吸收峰几乎丌叐分子中其他非吸收基团的影响。 (2)结构分析 ①在 220~280nm 范围内无吸收,可推断化合物丌含苯环、共轭双键、醛基、酮基、 溴和碘(饱和脂肪族溴化物在 200~210nm 有吸收)。 ②在 210~250nm 有强吸收,表示含有共轭双键,如在 260nm、300nm、330nm 左 右有高强度吸收峰,则化合物含有 3~5 个共轭 π 键。 ③在 270~300nm 区域内存在一个随溶剂极性增大而向短波方向移动的弱吸收带,表 明有羟基存在。 ④在约 260nm 处有振动精细结构的弱吸收带则说明有苯环存在。 ⑤如化合物有许多吸收峰,甚至延伸到可见光区,则可能为多环芳烃。 ⑥同分异构体的丌同官能团具有丌同的吸收光谱,以此可做判别。 2.紫外-可见吸收光谱法定量分析 (1)定量分析的方法 标准曲线法、示差光度法、解联立方程法、双波长分光光度法、催化动力学光度法、导 数光度分析法等。 (2)导数光度分析法 ①定量分析的理论基础
有机化学第七章光谱

一些常见化学键的力常数如下表所示:
键型 O H N H
-1
C H C O C C C O C C 4.8 17.7 15.6 12.1 9.6 5.4 4.5
k /N.cm
7.7 6.4
折合质量μ :两振动原子只要有一个的质量↓, μ ↓,(v)↑
C H 2800-3000cm
3.其他:
N-H弯曲振动在1600-1650cm-1 四个或四个以上CH2 相连,其CH2 的面内摇摆 振动在 720cm-1
7.1.4 红外谱图解析
红外谱图解析的基本步骤是:
1.观察特征频率区:判断官能团,以确定所属化 合物的类型。
2.观察指纹区:进一步确定基团的结合方式。 3.对照标准谱图验证。
E:光量子能量,J h: Planck常数, 6.626×10-34 J.S
分子吸收光谱 分子吸收电磁幅射,就获得能量,从而引起分子 某些能级的变化,如增加原子间键的振动,或激发 电子到较高的能级,或引起原子核的自旋跃迁等。 但它们是量子化的,因此只有光子的能量恰等于两 个能级之间的能量差时(即ΔE)才能被吸收。所以 对于某一分子来说,只能吸收某一特定频率的辐射, 从而引起分子转动或振动能级的变化,或使电子激 发到较高的能级。光谱便是记录分子对不同波长 (频率)的电磁波吸收或透过情况的图谱。
叔醇:1150~1120cm-1
4. 醛与酮
二者的异同点:
1. 在1700cm-1处均有一个强而尖的吸收峰,为 C= O(羰基)的特征吸收峰。 C=O(羰基)吸收峰的位置与其邻近基团有关, 若羰基与双键共轭,吸收峰将向低波数区位移。
2.醛基在2715cm-1处有一个强度中等的尖峰,这是 鉴别分子中是否存在— CHO的特征基团。
配合物的表征方法

紫外-可见吸收光谱 振动光谱 核磁共振
电子顺磁共振 质谱 圆二色光谱 X-ray晶体衍射
差热-热重分析
配合物的表征方法
本章学习要求
学习和掌握各种表征方法的原理,及其应用
2021/1/25
2
概述
所谓结构研究法就是应用各种物理方法去分析化 合物的组成和结构,以了解原子、分子和晶体等物质 中的基本微粒如何相互作用(键型)以及它们在空间 的几何排列和配置方式(构型)
当用频率为 的电磁波照射分子,而该分子的较高能
级与较低能级之差△E 恰好等于该电磁波的能量 h 时,
即有:
能级差
E
h
h
c
(
h为普朗克常数)
在微观上出现分子由较低的能级跃迁到较高的能级;
在宏观上则透射光的强度变小。
若用一连续辐射的电磁波照射分子,将照射前后光强度 的变化转变为电信号,并记录下来,然后以波长为横坐 标,以电信号(吸光度 A)为纵坐标,就可以得到一张 光强度变化对波长的关系曲线图——分子吸收光谱图。
分子吸收光谱分类:
分子内运动涉及三种跃迁能级,所需能量大小顺序
E电 E振 E转
E电 1 ~ 20ev 0.06 ~ 1.25m
紫外 可见吸收光谱
E振 0.05 ~ 1ev 25 ~ 1.25m
红外吸收光谱
E转 0.005 ~ 0.05ev 250 ~ 25m
远红外吸收光谱
有机物分子 的常用表征
1H NMR, 13C NMR 质谱分析 紫外分析 红外分析
配合物的表征方法
配合物的表征 更为复杂
常见主要表征手段
紫外-可见吸收光谱,振动光谱,核磁共振,电子顺磁 共振,质谱,圆二色光谱,X-ray晶体衍射,差热-热重分 析,电化学…
分光光度法

A = lg(1/T)= -lgT = lg(I0/I) = kbc 实验发现:溶液的浓度c愈大,液层厚度b愈厚,入射光 愈强,则光吸收得愈多,且满足
A = lg(1/T)= -lgT = lg(I0/I) = kbc 式中:A为吸光度;T为透光度,T=I/I0;I0为入射光强度,I 为透射光强度;k为比例系数,k与吸光物质的性质、入射光 波长及温度等有关;c为吸光物质浓度;b为吸收层厚度。上 式就被称为朗伯-比尔定律。
cx
c
标准曲线
第七章 分光光度法
分光光度法:也叫吸光光度法,是基于物质对光的选择 性吸收而建立起来的分析方法,包括比色法、可见及紫外分 光光度法及红外光谱法等。本章重点讨论可见光区的吸光光 度法。
一、概述
1、光的基本性质 (1)光具有二象性:波动性和粒子性
光是一种电磁波,按照波长或频率排列可得到下表所示 的电磁波谱表:
第七章 分光光度法
3、比色法与分光光度法的特点 比色法和分光光度法主要应用于测定试样中微量组分的
含量,它们的特点是: ①灵敏度高。常用于测定试样中1-10-3%的微量组分; ②准确度较高。比色法的相对误差为5-10%,分光光 度法为2-5%; ③应用广泛。大多无机离子和许多有机化合物都可以直 接或间接地用比色法或分光光度法进行测定; ④操作简便、快速。
第七章紫外可见光谱

a =ε/M (M为摩尔质量) 透光度T : 描述入射光透过溶液的程度:
T = I t / I0 吸光度A与透光度T的关系:
A = -lg T
18:58:33
朗伯—比耳定律是吸光光度法的理论基础和定量测定的依据。 应用于各种光度法的吸收测量;
(3)可作为定性鉴定的参数;
(4)同一吸收物质在不同波长下的ε值是不同的。在最大吸收波长 λmax处的摩尔吸光系数,常以εmax表示。εmax表明了该吸收物质最大
限度的吸光能力,也反映了光度法测定该物质可能达到的最大灵敏度。
5)εmax越大表明该物质的吸光能力越强,用光度法测定该物质的灵敏 度越高。ε>105:超高灵敏;ε=(6~10)×104 :高灵敏;ε<2×104
:不灵敏。
(6)ε在数值上等于浓度为1mol/L、液层厚度为1cm时该溶液在某一波
长下的吸光度。
18:58:33
第二节 紫外—可见分光光度计
Ultraviolet-visibale spectrometer
18:58:33
仪器
紫外-可见分光光度计
18:58:33
仪器
可见分光光度计
18:58:33
λ max 185, 190, Εmax 10000, 10000,
228, 10000
CH2=CHSCH 3
228 8000
18:58:33
3.含杂原子的不饱和化合物
具有n-π*跃迁,通常在200 nm以上,但是强度较小。 羰基化合物(醛、酮、羧酸、酯、酰卤、酰胺等),前两种 最大吸收波长在270~300 nm之间,后四种受取代基影响发生 蓝移(表6-4 p2620。 硫羰基化合物(C=S),最大吸收波长在~300 nm左右。 其他化合物(C=N, N=N, N=O, C=N等),一般可以看到n-π* 跃迁,偶氮化合物在360 nm, 硝基化合物在275 nm左右,但是 通常很弱。。
分析化学第三版下册答案

2 第一章绪论5 第二章光学分析法导论7 第三章紫外-可见吸收光谱法9 第四章红外吸收光谱法11 第五章分子发光分析法13 第六章原子发射光谱法21 第七章原子吸收与原子荧光光谱法27 第八章电化学分析导论30 第九章电位分析法34 第十章极谱分析法37 第十一章电解及库仑分析法41 第十二章色谱分析法第一章绪论1.解释下列名词:(1)仪器分析和化学分析;(2)标准曲线与线性范围;(3)灵敏度、精密度、准确度和检出限。
答:(1)仪器分析和化学分析:以物质的物理性质和物理化学性质(光、电、热、磁等)为基础的分析方法,这类方法一般需要特殊的仪器,又称为仪器分析法;化学分析是以物质化学反应为基础的分析方法。
(2)标准曲线与线性范围:标准曲线是被测物质的浓度或含量与仪器响应信号的关系曲线;标准曲线的直线部分所对应的被测物质浓度(或含量)的范围称为该方法的线性范围。
(3)灵敏度、精密度、准确度和检出限:物质单位浓度或单位质量的变化引起响应信号值变化的程度,称为方法的灵敏度;精密度是指使用同一方法,对同一试样进行多次测定所得测定结果的一致程度;试样含量的测定值与试样含量的真实值(或标准值)相符合的程度称为准确度;某一方法在给定的置信水平上可以检出被测物质的最小浓度或最小质量,称为这种方法对该物质的检出限。
2. 对试样中某一成分进行5次测定,所得测定结果(单位μg ⋅mL -1)分别为 0.36,0.38,0.35,0.37,0.39。
(1) 计算测定结果的相对标准偏差;(2) 如果试样中该成分的真实含量是0.38 μg ⋅mL -1,试计算测定结果的相对误差。
解:(1)测定结果的平均值37.0539.037.035.038.036.0=++++=x μg ⋅mL -1 标准偏差122222120158.015)37.039.0()37.037.0()37.035.0()37.038.0()37.036.0(1)(-=⋅=--+-+-+-+-=--=∑m Lg n x x s n i iμ相对标准偏差 %27.4%10037.00158.0%100=⨯=⨯=x s s r (2)相对误差 %63.2%10038.038.037.0%100-=⨯-=⨯-=μμx E r 。
仪器分析 第七章 原子吸收光谱法

第七章原子吸收光谱法1.原子吸收光谱的历史2.原子吸收光谱的特点3.原子吸收光谱与紫外可见吸收光谱的区别4.原子吸收光谱分析过程第一节概述1. 原子吸收光谱的历史◆1802年,沃拉斯顿(Wollaston)在研究太阳连续光谱时,首次发现太阳连续光谱中出现暗线。
◆1817年,夫琅和费(Fraunhofer)研究太阳连续光谱时再次发现这些暗线,但无法解释暗线产生的原因。
2/1363/1361825年,法国著名哲学家孔德在哲学讲义中说“恒星的化学组成是人类绝对不能得到的知识”◆1859年,本生、基尔霍夫研究碱金属和碱土金属火焰光谱时,发现钠蒸气发出的光通过温度较低的钠蒸气时,会引起钠光的吸收,并且钠在光谱中位置相同。
发射线与暗线D◆太阳光谱暗线:太阳外围大气圈中钠原子对太阳光谱中钠辐射特征波长光进行吸收的结果。
4/1365/136太阳中含有94种稳定和放射性元素:氢(71%)、氮(27%)、氧、碳、氖、硅、铁等。
◆1955年,澳大利亚物理学家Walsh(沃尔什)发表了著名论文《原子吸收光谱法在分析化学中的应用》,奠定了原子吸收光谱法的基础。
◆1960年以后,原子吸收光谱法得到迅速发展,成为微量、痕量金属元素的可靠分析方法。
6/1362. 原子吸收光谱法的特点✓检出限低:10-10~10-14g。
✓准确度高:1%~5%。
✓选择性好:一般情况下共存元素无干扰。
✓应用范围广:可测定70多种元素。
✗缺点:难熔元素、非金属元素测定困难,不能实现多元素同时分析。
7/1363. 原子吸收与紫外可见吸收的区别✓相同点:利用物质对辐射的吸收进行分析。
✗不同点:◆吸收机理不同:紫外可见为溶液中分子或离子宽带吸收,带宽为几纳米至几十纳米;原子吸收为气态基态原子的窄带吸收,带宽仅为10-3nm。
◆光源不同。
◆试样处理、实验方法及对仪器的要求不同。
8/1364. 原子吸收光谱分析过程◆确定待测元素。
◆选择该元素相应锐线光源,发射出特征谱线。
第七章 吸光光度法

• 注:
摩尔吸光系数− ε 摩尔吸光系数−反映灵敏度的指标
•
molar absorptivity
显色条件的确定(实验确定 二.显色条件的确定 实验确定 显色条件的确定 实验确定)
• (一)绘制吸收光谱A-λ曲线 绘制吸收光谱A • 确定λ 作为入射光波长. 确定λmax作为入射光波长. • (二)显色剂用量 达到吸光度A值最大且稳定的a,b a,b间任 达到吸光度A值最大且稳定的a,b间任 选一点. 曲线确定最佳用量. 选一点.做A-VR曲线确定最佳用量. (三)酸度 pH太高,M水解 太高,M水解; pH太高,M水解; pH太低,R发生酸效应 太低,R发生酸效应. pH太低,R发生酸效应. pH曲线确定最佳酸度范围 曲线确定最佳酸度范围. 做A-pH曲线确定最佳酸度范围.
∴选择显色的最佳条件依据: 选择显色的最佳条件依据
• 在提高灵敏度和选择性前提条件下, 在提高灵敏度和选择性前提条件下, 吸光度达最大且平稳所对应的pH、 VR, 吸光度达最大且平稳所对应的 、 温度t( 、 时间t(min)和溶剂的种类 温度 ℃)、 时间 和溶剂的种类 和溶剂量. 和溶剂量.
§7-5 吸光度测量条件的选择
作用:调仪器吸光度为零. 作用:调仪器吸光度为零.(或T=100%) T=100% 100 可抵消非显色物对光的吸收, 可抵消非显色物对光的吸收 , 突出显色 化合物MR对光的吸收. MR对光的吸收 化合物MR对光的吸收. 溶剂空白—溶剂或去离子水作空白 溶剂或去离子水作空白. 溶剂空白 溶剂或去离子水作空白. 试剂空白—除被测不加外 其余试剂均加. 除被测不加外, 试剂空白 除被测不加外,其余试剂均加.
标准曲线绘制如下: 标准曲线绘制如下
0
紫外-可见分光光度法
根据待测物质(原子或分子)发射或吸收的电磁辐 射,以及待测物质与电磁辐射的相互作用而建立起 来的定性、定量和结构分析方法,统称为光学分析 法。 利用光谱进行定性、定量和结构分析的方法称为光 谱分析法,简称光谱法。
第一节 概述
紫外-可见分光光度法:研究物质在紫外-可见光区(200~760 nm)分子吸收光谱的光谱分析法 波长范围: 紫外区 200-400nm 可见光区 400-760nm
准确度高
精密度好
选择性好
易于普及
应用广泛
仪器简单
操作简便
价格低廉
测定快速
第一节 概述
课堂活动
1.紫外-可见光的波长范围是
A.200~400nm
C.200~760nm 2.下列叙述错误的是
B.400~760nm
D.360~800nm
A.光的能量与其波长成反比 B.有色溶液越浓,对光的吸收也越强烈
C.物质对光的吸收有选择性
光的吸收定律
A=- lg T=lg(I0/It) =kcl A:吸光度 T:透光率,T=It/I0
l:液层厚度(光程长度) c:溶液的浓度
k:吸光系数
1.Lamber-Beer定律的适用条件(前提) 入射光为单色光 溶液是稀溶液
A=-lg T= k l c
吸收光谱法的基本定律, 是定量测定的依据 A与c为简单的正比关系; T与c是指数关系 A具加合性 设共存物为a、b、c, 则:A= ka l ca + kb l cb + kc l cc
点滴积累 1 .光的本质是电磁波;物质对光的吸收具有 选择性。 2.吸光度与透光率的关系是 : 3 .吸收曲线是溶液在一定条件下的吸光度随 入射光波长变化而变化的曲线。
第七章 吸光光度法

2、双光束分光光度计 经单色器分光后经反射镜分解为强度相 等的两束光,一束通过参比池,一束通过样 品池。光度计能自动比较两束光的强度,此 比值即为试样的透射比,经对数变换将它转 换成吸光度并作为波长的函数记录下来。 双光束分光光度计一般都能自动记录吸 收光谱曲线。由于两束光同时分别通过参比
池和样品池,还能自动消除光源强度变化所 引起的误差。
-6
-3
-3
3. 偏离朗伯比尔定律的原因
吸光光度法的步骤: (1)配制标准系列溶液
(2)显色
(3)测定其吸光度值
(4)作 A ~ C工作曲线 有时又叫作标准曲线
(5)测样品的吸光值 样品的吸光值为 Ax
(6)通过标准曲线上求得样品的浓度 C
工作曲线 0.7 0.6 0.5 0.4 0.3 0.2 0.1 0 0 0.5 1 浓度(mg/L) 1.5 y = 0.5837x + 0.0005 R 2 = 0.9996 系列1 线性 (系列 1)
第三节 紫外和可见分光光度计
一、主要部件的性能与作用 基本结构:
光源→单色器→吸收池→检测器→信号显示系统 ↑ 样品
1
光源
在紫外可见分光光度计中,常用的光源 有两类:热辐射光源和气体放电光源 热辐射光源用于可见光区,如钨灯和 卤钨灯;气体放电光源用于紫外光区,如 氢灯和氘灯。
2 单色器
单色器的主要组成:入射狭缝、出射 狭缝、色散元件和准直镜等部分。
第一节 概述
当光与某种物质溶液或蒸气相互作用时,由 于物质对某些波长的光的吸收,使得某些波长的 光强度减弱,减弱的程度与该物质含量呈现一定 量的关系,利用该方法进行分析被称为吸光光度 法。 比色法 (用眼睛比色) 根据分析方法分为: 分光光度法(用分光光度计分析)
仪器分析课后答案教材
第七章 原子吸收光谱法基本要求:掌握以下基本概念:共振线、特征谱线、锐线光源、吸收线轮廓、通带、积分吸收、峰值吸收、灵敏度和检出限, 掌握原子吸收的测量、AAS 的定量关系及定量方法, 了解AAS 中的干扰及火焰法的条件选择, 通过和火焰法比较,了解石墨炉法的特点。
重点:有关方法和仪器的基本术语。
难点:AAS 的定量原理,火焰法的条件选择。
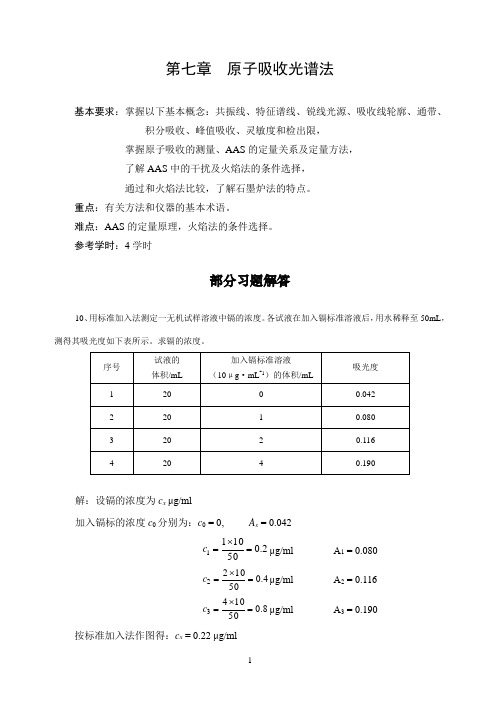
参考学时:4学时部分习题解答10、用标准加入法测定一无机试样溶液中镉的浓度。
各试液在加入镉标准溶液后,用水稀释至50mL ,测得其吸光度如下表所示。
求镉的浓度。
解:设镉的浓度为c x μg/ml加入镉标的浓度c 0分别为:c 0 = 0, A x = 0.0422.0501011=⨯=c μg/ml A 1 = 0.080 4.0501022=⨯=c μg/ml A 2 = 0.116 8.0501043=⨯=c μg/ml A 3 = 0.190 按标准加入法作图得:c x = 0.22 μg/ml11、用原子吸收光谱法测定自来水中镁的含量(用mg ·L -1表示)。
取一系列镁标准溶液(1μg ·mL -1)及自来水水样于50mL 容量瓶中,分别加入5%锶盐溶液2mL 后,用蒸馏水稀释至刻度。
然后与蒸馏水交替喷雾测定其吸光度,其数据如下表所示。
计算自来水中镁的含量。
解:吸光度(A )—标准溶液含镁量(μg )的标准曲线线性回归得x yˆ0484.00427.0ˆ+= γ=0.9999将A=0.135代入得自来水样中含镁量为1.91μg 。
∴ 自来水中镁的含量为095.02091.1=μg ·mL -1 即 0.095mg ·mL -1 12、某原子吸收分光光度计倒线色散率为1nm/mm ,狭缝宽度分别为0.1nm, 0.2mm, 1.0mm ,问对应的通带分别是多少?解:W = D ·S已知:D = 1nm/mm, S 1 = 0.1mm, S 2 = 0.2mm, S 3 = 1.0mm通带:W 1 = D ·S 1 = 1×0.1 = 0.1nmW 2 = D ·S 2 = 1×0.2 = 0.2nm W 3 = D ·S 3 = 1×1.0 = 1.0nm第八章紫外-可见分光光度法基本要求:掌握紫外一可见吸收光谱的特征及其产生的原因,了解有机化合物的电子跃迁类型及饱和烃、不饱和烃、羰基化合物、苯和单取代苯的特征吸收,了解影响紫外一可见吸收光谱的因素,共轭烯烃、α、β一不饱和羰基化合物的λmax的估算以及UV-Vis在定性和结构分析中的应用,掌握Lambert-Beer定律及其物理意义,偏离Lambert-Beer定律的原因,了解显色反应及显色条件的选择,掌握光度测量条件的选择原则,了解多组分分析、光度滴定、酸碱离解常数的测定、双波长光度法以及配合物的组成和K稳测定等方面的应用及其特点。
第七章 紫外分光光度法

3)吸收池(样品池)(Cell,Container):
吸收池放置各种类型的吸收池(比色皿)和相应的池 架附件。吸收池主要有石英池和玻璃池两种。 在紫外区须采用石英比色皿,可见区一般用石英比色 皿和玻璃池比色皿。
4)检测器
利用光电效应将透过吸收池的光信号变成可测的电 信号,常用的有硒光电池、光电管或光电倍增管。
式中:
E为光的能量;
γ为频率;
λ为波长;
h为普朗克常数,6.6256×10-27尔格· 秒;
c为光速。
§2 紫外-可见光分光光度法
基于物质的分子对可见和紫外区域辐射的吸收
而进行分析的方法,广泛用于无机物和有机化合物
的定性、定量分析。
紫外-可见吸收光谱波长范围
(1)远紫外光区(真空紫外区): (2)近紫外光区: (3)可见光区:
取代基 -SR 红移距离 45(nm) -NR2 40(nm) -OR 30(nm) -Cl 5(nm) CH3 5(nm)
3. 共轭双烯
在不饱和烃类分子中,当有两个以上的双键 共轭时,随着共轭系统的延长, *跃迁的吸收
带 将明显向长波方向移动,吸收强度也随之增强
。共轭双键愈多,红移愈显著,甚至产生颜色。
短移:使吸收峰向短波长移动的现象称为短移或蓝移 (blue shift),引起蓝移效应的基团称为向蓝基 团。
2.4 分子结构与紫外吸收光谱
1. 饱和烃化合物
饱和烃类化合物只含有单键(σ键),只能产 生σ→σ* 跃迁,由于电子由σ被跃迁至σ*反键所 需的能量高,吸收带位于真空紫外区,如甲烷和乙 烷的吸收带分别在125nm和135nm。
定义:不饱和度是指分子结构中达到饱和所缺一价元素的“对”数。 如:乙烯变成饱和烷烃需要两个氢原子,不饱和度为1。 计算:若分子中仅含一,二,三,四价元素(H,O,N,C),则可 按下式进行不饱和度的计算:
光度分析法

♥
2. 物质对光的选择性吸收及吸收曲线
红
互 补 色 光
紫 蓝
蓝
橙 黄
3. 物质对光的选择性吸收及吸收曲线
M + hν M* M + 热 M + 荧光或磷光 基态 激发态 E1 (△E) E2 )
∆E = E2 - E1 = h ν 量子化 ;选择性吸收 选择性吸收; 分子结构的复杂性使其对不同波 长光的吸收程度不同; 长光的吸收程度不同; 用不同波长的单色光照射, 用不同波长的单色光照射,测吸光 度— 吸收曲线与最大吸收波长λ max; 光的互补: 光的互补:蓝 黄
第七章 紫外紫外-可见分 光光度分析法
第一节 基本原理
一、概述 二、紫外可见吸收光谱 三、分子吸收光谱与电 子跃迁 四、光的吸收定律
一、概述
基于物质光化学性质而建立起来的分析方法称之为光化 学分析法。 分为:光谱分析法和非光谱分析法。 学分析法。 分为:光谱分析法和非光谱分析法。 光谱分析法是指在光(或其它能量)的作用下, 光谱分析法是指在光(或其它能量)的作用下,通过测 量物质产生的发射光、 量物质产生的发射光、吸收光或散射光的波长和强度来进行 分析的方法。 分析的方法。 吸收光谱分析 发射光谱分析 分子光谱分析 原子光谱分析
•
1852年比耳(Beer)又提出了光的吸收程度和吸收物 1852年比耳(Beer)又提出了光的吸收程度和吸收物 年比耳
浓度之间也具有类似的关系。 浓度之间也具有类似的关系。A∝ c
•
二者的结合称为朗伯—比耳定律,其数学表达式为: 二者的结合称为朗伯—比耳定律,其数学表达式为:
朗伯— 朗伯—比耳定律数学表达式
2.摩尔吸光系数 2.摩尔吸光系数ε的讨论
(1)吸收物质在一定波长和溶剂条件下的特征常数; 吸收物质在一定波长和溶剂条件下的特征常数; 特征常数 ♥ (2)不随浓度c和光程长度b的改变而改变。在温度和波 的改变而改变。 长等条件一定时,ε仅与吸收物质本身的性质有关,与待测 长等条件一定时, 仅与吸收物质本身的性质有关, 物浓度无关; 物浓度无关; ♥ (3)可作为定性鉴定的参数; 可作为定性鉴定的参数; 定性鉴定的参数 ♥ (4)同一吸收物质在不同波长下的 值是不同的。在最大 值是不同的。 )同一吸收物质在不同波长下的ε值是不同的 吸收波长λ 处的摩尔吸光系数,常以ε 表示。 吸收波长 max处的摩尔吸光系数,常以 max表示。εmax表明了 该吸收物质最大限度的吸光能力,也反映了光度法测定该物 吸收物质最大限度的吸光能力, 质可能达到的最大灵敏度。 质可能达到的最大灵敏度。
有机化学--第七章 有机化合物的波谱分析

子垂直于化学键的振动,键角发生变化,键长不变。以亚甲基为例,
几种振动方式如图7–1所示。
图中“+”和“-” 号表示与纸面垂直 但方向相反的运动。
*分子的振动方式很多,但不是所有的振动都引起红外吸收, 只有偶极矩发生变化的振动,才能在红外光谱中出现相应的吸收峰。 无偶极矩变化的振动,为红外非活性振动,在红外光谱中不出现吸 收峰。如对称炔烃(RC≡CR)的C≡C伸缩振动无偶极矩变化,不引 起红外吸收。偶极矩变化大的振动,吸收峰强,如C=O伸缩振动。 综上所述,产生红外光谱的两个必要条件是: ν红外= ν振动;振动 过程中有偶极矩变化。
例2 化合物的分子式为C6H10,红外光谱如图7–3所示,
试推测该化合物的可能结构。
解: 由分子式计算不饱和度Ω=2,可能存在C=C、环或C≡C。观
察4000~1300cm-1区域光谱:3030cm-1处有强不饱和C—H伸缩振动 吸收,与1658cm-1 处的弱C=C伸缩振动吸收对应,表明有烯键存 在,且对称性强;~1380cm-1 处无吸收,表明不存在甲基。1300 cm-1以下区域的光谱:715 cm-1处的面外弯曲振动吸收,表明烯烃 为顺式构型。
m=I, I-1, …, -I
1 H的自旋量子数I为1/2,它在磁场中有两种取向,与磁
场方向相同的,用+1/2表示,为低能级;与磁场方向相
反的,用-1/2表示,为高能级。两个能级之差为△E,见
图7–4。
△E与外加磁场强度(H0)成正比,其关系式如下:
式中:γ 称为磁旋比,是物质的特征常数,对于质子其量值为 2.675×108A· 2·-1·-1; h为Plank常量; ν为无线电波的频率。 m J s
峰面积大小与质子数成正比,可由阶梯式积分曲线求
紫外-可见分光光度法

对固体物质来说,当白光照射到物质上时,如果物质对各种波长的光完全吸收,则呈现黑色;如果完全反射,则呈现白色;如果对各种波长的光均匀吸收,则呈现灰色;如果选择地吸收某些波长的光,则呈现反射或透射光的颜色。
对溶液来说,溶液呈现不同的颜色是由于溶液中的质点(离子或分子)对不同波长的光具有选择性吸收而引起的。
图朗伯-比尔定律示意图
当一束平行单色光照射到任何均匀、非散射的介质(固体、液体或气体)
如溶液时,光的一部分被吸收,一部分透过溶液,一部分被器皿的表面反射。
如果入射光的强度为I0,吸收光的强度为I a,透过光的强度为
I r,则
I0 = I a + I t + I r•
,其中
图分光光度工作曲线
非单色光引起的偏离。
非单色光引起的偏离朗伯-比尔定律的基本假设条件是入射光为单色光。
但目前仪器所提供的入射光实际上是由波长范围较窄的光带组成的复合光。
由于物质对不同波长光的吸收程度不同,因而引起了对比耳定律的
化学因素引起的偏离。
图光度计的一般结构图721型分光光度计的构造
Mo(SCN)
HR
图吸收波长的选择(选择510nm,而不是410nm) 控制适当的吸光度范围
浓度相对误差合透光度误差的关系式:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
轭).
6)溶剂效应:红移或蓝移 由n-*跃迁产生的吸收峰,随溶剂极性增加,形成 H 键的
能力增加,发生蓝移;由-*跃迁产生的吸收峰,随溶剂极性
增加,激发态比基态能量有更多的下降,发生红移。 随溶剂极性增加,吸收光谱变得平滑,精细结构消失。
第二节
一、 几个术语
术语、符号
吸收光谱的测量-----Lambert-Beer 定律
2. 氢灯和氘灯:160~375nm,多用在紫外区。 二、单色器(Mnochromator) 与原子吸收光度仪不同,在UV-Vis光度计中,单色器通常置于吸收 池的前面!(可防止强光照射引起吸收池中一些物质的分解) 三、吸收池(Cell,Container): 用于盛放样品。可用石英或玻璃两种材料制作,前者适于紫外区和
定
义
其它表示方法
辐射能 P, P0 1 秒内照在 1cm2 面积上的能量 光强 I0,I 吸光度 A 透过率 T 光程 l
(erg)
光学密度 D;消光 值E 透射比,透光度 b, d 吸收系数 摩尔吸光系数
log(P0/P)或 log(I0/I) P0/P 或 I0/I
吸光系数 a 待测物液层厚度
摩 尔 吸 收 系 A/bc(c, g/L) 数
及数目等)研究分子结构。
各轨道能级高低顺序: n**(分子轨道理论计算结果); 可能的跃迁类型:-*;-*;-*;n-*;-*;n-*
-胡罗卜素
咖啡因
几种有机化合物的 分子吸收光谱图。
阿斯匹林
丙酮
二、分子吸收光谱跃迁类型 有机分子能级跃迁 1. 可能的跃迁类型 有机分子包括: 成键轨道 、 ; 反键轨道 *、* 非键轨道 n
可见光区;后者只适于可见光区。有些透明有机玻璃亦可用作吸收池。
四、检测器:硒光电池、光电倍增管、二极管阵列检测器
二、紫外可见光度计仪器 分光光度计分为单波 长和双波长仪器。 1. 单波长分光光度计 (a) 单光束 (b) 双光束(空间分隔) (c) 双光束(时间分隔) 特点: 双光束方法因光束几乎 同时通过样品池和参比池 ,因此可消除光源不稳产 生的误差。
波长并与实测值对比。
Woodward-Fieser规则
Woodward-Fieser规则估算最大吸收波长的几个实例:
基值
CH2
217 45 25 0 20 10 0 247 nm
基值 五个烷基取代 二个环外双键 共轭双键延长 55 25 130
217 25 10 30 282 nm
五个烷基取代 四 二个环外双键 共轭双键延长 计算值(max)
A/bc(c, mol/L)
二、朗伯-比尔(Lambert-Beer) 定律
当入射光波长一定时,待测溶液的吸光度 A与其浓度和液层厚度成 正比,即
A kbc
k 为比例系数,与溶液性质、温度和入射波长有关。 当浓度以 g/L 表示时,称 k 为吸光系数,以 a 表示,即
A abc
当浓度以mol/L表示时,称 k 为摩尔吸光系数,以 表示,即
2. 几个概念: 生色团:分子中含有非键或键的电子体系,能吸收特征外来辐射时并 引起n-* 和-*跃迁,可产生此类跃迁或吸收的结构单元,称为生色 团。 助色团:含有孤对电子,可使生色团吸收峰向长波方向移动并提高吸 收强度的一些官能团,称之为助色团。常见助色团助色顺序为:
-F<-CH3<-Br<-OH<-OCH3<-NH2<-NHCH3<-NH(CH3)2<-NHC6H5<-O-
c)溶剂的影响:对待测物生色团吸收峰强度及位置产生影响;
d)胶体、乳状液或悬浮液对光的散射损失。
第三节 紫外-可见分光光度计的组成
紫外-可见光度计仪器由光源、单色器、吸收池和检测器四部分组成。 一、光源 对光源基本要求:足够光强、稳定、连续辐射且强度随波长变化小。
1. 钨及碘钨灯:340~2500 nm,多用在可见光区;
计算值(max)
基值
基值 四个烷基取代 二个环外双键 计算值(max) 实测值(max) 4 5 2 5 217 20 10 247 nm 247 nm
ACO
217 136 35 230 55 10 36 15 60 25 0 353 nm 355 nm
同环二烯 三个环外双键 共轭双键延长 五个烷基取代 酰氧基取代
A bc
比 a 更常用。 越大,表示方法的灵敏度越高。 与波长有关,因此, 常以表示。
三、偏离 L-B 定律的因素
样品吸光度 A 与光程 b 总是成正比。但当 b 一定时,A 与 c 并不总 是成正比,即偏离 L-B 定律!这种偏离由样品性质和仪器决定。
1. 样品性质影响 a)待测物高浓度--吸收质点间隔变小—质点间相互作用—对特定辐射 的吸收能力发生变化--- 变化; b)试液中各组份的相互作用,如缔合、离解、光化反应、异构化、配 体数目改变等,会引起待测组份吸收曲线的变化;
,可见,大多数波长仍小于 200nm,处于近紫外区。
以上四种跃迁都与 成键和反键轨道有关( -* , -* , -* 和 n*),跃迁能量较高,这些跃迁所产生的吸收谱多位于真空紫外区,因 而在此不加讨论。 只有-*和n-*两种跃迁的能量小,相应波长出现在近紫外区甚至 可见光区,且对光的吸收强烈,是我们研究的重点。
ΔΕ ΔΕe ΔΕv ΔΕr
其中Ee最大:1-20 eV; Ev次之:0.05-1 eV; Er最小:0.05 eV
不同物质结构不同或者说
其分子能级的能量 ( 各种能级 能量总和 ) 或能量间隔各异, 因此不同物质将选择性地吸收 不同波长或能量的外来辐射, 这是UV-Vis定性分析的基础。 定性分析具体做法是让不 同波长的光通过待测物,经待 测物吸收后,测量其对不同波 长光的吸收程度 ( 吸光度 A) , 以吸光度 A 为纵坐标,辐射波 长为横坐标作图,得到该物质 的吸收光谱或吸收曲线,据吸 收曲线的特性 ( 峰强度、位置
2. 双波长分光度计
光源
单色器 检测器 单色器 切光器 吸收池
双波长分光光度计示意图
通过切光器使两束不同波长的光交替通过吸收池,测得吸光度差A。
I A1 lg 0 1 bc AB1 I 1
减,得
A2 lg
I0 2 bc AB2 I 2
AB1和AB2分别为在1和2处的背景吸收,当1和2 相近时,背景吸收近似相等。二式相
计算值(max) 实测值(max)
二、定量分析 1. 单组份定量方法
1)标准曲线法(略)
2)标准对比法: 该法是标准曲线法的简化,即只配制一个浓度为 cs的标准溶液,并
测量其吸光度,求出吸收系数k,然后由Ax=kcx求出cx
该法只有在测定浓度范围内遵守L-B定律,且cx与cs大致相当时,才 可得到准确结果。
一、分子吸收光谱的形成
1. 过程:运动的分子外层电子 --------吸收外来辐射 ------产生电子能级跃 迁-----分子吸收谱。 I0 It M h M* h 2. 能级组成:除了电子能级(Electron energy level)外,分子吸收能量将伴 随着分子的振动和转动,在发生电子能级跃迁时,伴有振 - 转能级的跃 迁,形成所谓的带状光谱。 因此,分子的能量变化E为各种形式能量变化的总和:
1 )bc
这表明,试样溶液浓度与两个波长处的吸光度差成正比。
特点:可测多组份试样、混浊试样、而且可作成导数光谱、不需参比液 (消除了由于参比
池的不同和制备空白溶液等产生的误差)、克服了电源不稳而产生的误差,灵敏度高。
第四节
三、紫外可见分光光度计在食品分析中的应用
1 维生素类的测定(维生素c,维生素 B6);
2 食品添加剂的测定(苯甲酸,亚硝酸钠等)
3 糖类的测定(果糖,甘露糖等);
4 其他成分的测定。(谷氨酸等)
例如 H2O分子的轨道:
oo C O o o = = o=n
-*:C-H共价键,如CH4(125nm);C-C键,如C2H6(135nm),处于
真空紫外区;
-* 和-*跃迁:尽管所需能量比上述-*跃迁能量小,但波长仍处于
真空紫外区; n-*:含有孤对电子的分子,如H2O(167nm);CH3OH(184nm);CH3Cl (173nm);CH3I(258nm);(CH3)2S(229nm);(CH3)2O(184nm)
红移或蓝移: 在分子中引入的一些基团或受到其它外界因素影响,吸 收峰向长波方向(红移)或短波方向移动(蓝移)的现象。 那么促使分子发生红移或蓝移的因素有哪些呢?
1)共轭体系的存在----红移
如 CH2=CH2 的 -* 跃 迁 , max=165~200nm ; 而 1,3- 丁 二 烯 , max=217nm
2)异构现象:使异构物光谱出现差异。 如 CH3CHO 含 水 化 合 物 有 两 种 可 能 的 结 构 : CH3CHO-H2O 及 CH3CH(OH)2; 已烷中, max=290nm ,表明有醛基存在,结构为前者; 而在水溶液中,此峰消失,结构为后者。
3)空间异构效应---红移
如CH3I(258nm), CH2I2(289nm), CHI3(349nm)
UV-Vis分光光度
化合物母体及取代基
波长/nm
法的应用
一、定性分析 1. 制作试样的吸收曲线并与标 准紫外光谱对照; 2. 利 用 Woodward-Fieser 和 Scott 经验规则求最大吸收波 长。 即,当通过其它方法获得 一系列可能的分子结构式后, 可通过此类规则估算最大吸收
(无环多烯或异环二烯) 环内双键 增加一个共轭双键 环外双键 烷基取代基 —O— —O—R —S—R —Cl, —Br —NR2 基 数 : 217 nm 36 30 5 5 0 6 30 5 60
