胡宏纹第四版有机化学-第三章 环烷烃(上下)
3环烷烃

环已烷及其衍生物的构象
平面结构中相邻碳形成全重叠式构象 键角为120
环己烷的椅式构象
(1) 环己烷椅式构象的画法
H 1 H H 2 H H
H
3 H H 4 H H
H 5 H 6
4 CH2 CH2 1
H H 2 3 H
H 6 H H
5
H
H
环已烷的六个碳原子都保持正常键角109°28′
a键
e键
a键转变成e键,e键转变成a键; 环上原子或基团的空间关系保持。
H3C
有二个不同取代基的环己烷衍生物
CH3 (CH3)2CH CH(CH3)2 CH3
两个规则
带有相同基团的多取代环己烷,那末在两个构象异 构体之间,总是有较多取代基取e键向位的构象为优势构 象。
带有不同基团的多取代环己烷,其优势构象总是体积 较大的基团取e键的向位。
8 7 6 5
9 10
1 2 3 4
(95%)
(5%)
4
3 5 H H 6
2 1
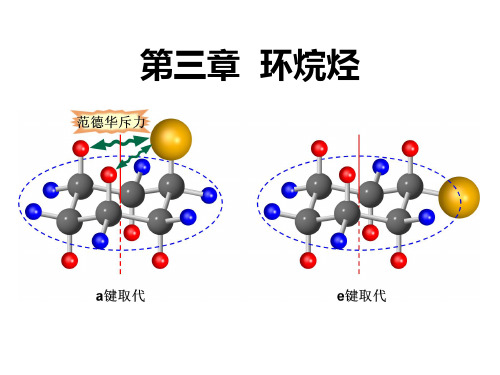
CH3与C3-H、C5-H有相互排斥 力,这称为1,3-二直立键作用。
CH3
(2)二取代环己烷的构象
1,2-二甲基环己烷
CH3 CH3 CH3
CH3
CH3
CH3 CH3
CH3
1,2-二甲基环己烷的平面表示法
CH3 CH3
CH3 CH3
CH3
CH3 CH3
Br
离子型 机理
+
Br2
Br
(3) 加HX:
室 温
+
HBr
CH3 CH2 CH2 Br
CH3
CH CH2 CH2
+
胡宏纹版《有机化学》课件及习题答案

子数,用正、异、新表示同分异构体。
例如:CH3-CH2-CH2-CH2-CH3
CH3 CH CH2-CH3
CH3 CH3 C CH3
正戊烷
CH3
异戊烷
CH3
新戊烷
南京大学基础学科教育学院 南京大学化学化工学院
基础有机化学
二、 烷基 烷基:烷烃分子中去掉一个氢原子而剩下的原子团称为烷基。
烷基
名称
CH3CH3CH2CH3CH2CH2(CH3)2CHCH3CH2CH2CH2(CH3)2CHCH2CH3CH2CH(CH3)-
CH3 CH2
CH3 选择正确
CH2 CH3 选择错误
(1)从最接近取代基的一端开始,将主链碳原子用1、2、3……
南京大学基础学科教育学院 南京大学化学化工学院
基础有机化学
有机化学是一门迅速发展的学科
有机合成化学 天然有机化学 生物有机化学 金属与元素有机化学 物理有机化学 有机分析化学
药物化学 香料化学 农药化学 有机新材料化学 ...... 等学科
生命科学 材料科学 环境科学 化学生物学 能源、工业、农业 ...... 等方面
1. 选择主链(母体)
(1)选择含碳原子数目最多的碳链作为主链,支链作为取代基。
(2)分之中有两条以上等长碳链时,则选择支链多的一条为主
链。
例如:
CH3
CH3-CH2 CH CH CH2-CH3
CH3-CH2-CH CH CH CH-CH 3
CH2 CH CH3 选择错误 CH3 CH3
选择正确
2. 碳原子的编号
三、 伯、仲、叔、季碳原子
在烃分子中仅与一个碳相连的碳原子叫做伯碳原子(或
一级碳原子,用1°表示)
胡宏纹《有机化学》章节题库(环烷烃)【圣才出品】

第3章环烷烃
一、选择题
1.两环烷烃的分子式均为C5H10,燃烧热较大的是()。
【答案】(a)
2.下列自由基中最稳定的是()。
【答案】B
【解析】p-π共轭使自由基稳定。
二、简答题
1.用系统命名法命名下列化合物。
答:(1)1-甲基-4-乙基-2-氯环己烷
(2)2-甲基螺[4.5]癸烷
(3)1,5-二(2-甲基环戊基)戊烷(4)1-甲基-3-溴二环[4.2.2]癸烷(5)2,9-二甲基二环[3.3.2]癸烷(6)二环[4.3.0]壬烷
2.写出符合下列名称的化合物的结构式。
(1)乙基环丙烷
(2)1,2-二甲基环丙烷
(3)反-1-氯-2-溴环丁烷
(4)二环[1.1.0]丁烷
(5)二环[3.1.1]庚烷
(6)顺二环[3.3.0]辛烷
(7)2-乙基-7-碘二环[2.2.1]庚烷(8)1,4-二甲基二环[2.2.2]辛烷(9)螺[2.5]辛烷
(10)5-甲基螺[3.4]辛烷
答:
3.写出下列化合物最稳定的构象式。
(1)异丙基环己烷(2)1,3-二甲基环己烷(3)1-甲基-4-叔丁基环己烷答:环己烷分子的最稳定构象式是椅型构象。
对于一取代环己烷分子,一般是取代基处于平伏键(e键)的构象最稳定。
对于多取代环己烷分子,通常是取代基(尤其是较大的取代基)处于e键的越多越稳定。
6.写出下列化合物的构象式。
(1)
(2)
(3)
(4)
(5)
(6)
答:。
环烷烃1ppt课件

环辛烷 环壬烷 环癸烷
663.8 664.6 663.6
环十四烷 658.6 环十五烷 659.0
对比:开链烷烃每个CH2的燃烧热:658.6 KJ/mol
稳定性: 普通环 > 中环:> 小环
环的张力越小,相应的环烷烃越稳定。
环丙烷的结构: CH3
H
H
C
C H 2 1 0 9 .5 ° CH3
HC H
➢ 相同环连结时,可 用词头“联”开头。
顺反异构体:
由于环状结构,环烷烃有两个侧面:“上”方和“下” 方。因此,取代环烷烃可能存在同分异构现象。例如,有两 个1,3-二甲基环戊烷同分异构体:一个异构体的两个甲基在 环的同侧,另一个异构体的两个甲基在环的两侧。两个异构 体都是稳定的化合物。
CH3 CH3
➢ 了解三元和四元环化合物的活性,掌握相应的特殊化学性质。 ➢ 掌握环丙烷和环丁烷的结构特点(有角张力)和构象。 ➢ 了解并掌握环戊烷的构象。
➢ 掌握几种类型环烷烃(普通环烷烃、桥环烃和螺环烃)的命名
方法。
课后练习:p61 (一)、(十)
3 CH3CHCH2CH3
1
主要产物
H2 / Pt, 120oC or Ni, 200oC
CH3CH2CH2CH3
支链多 较稳定
➢ 小环化合物与卤素的反应
Br2 / r.t. Cl2 / FeCl3
Br2 / r.t.
Br Br CH2CH2CH2CH2
(离子型) 加成反应
不反应(难开环)
C H 4 + 2 O 2 C O 2 + 2 H 2 O + 燃 烧 热
环烷烃的燃烧热数据
小 C3 环 C4
普 C5 通 环 C7
有机化学课件-3-环烷烃

105.5o,H-C-H键角114º:
HH
C
H
H
CC
H
H
C-C弯曲键电子云重叠面积较链状烷烃的小,故键的稳定性
较低。
(二)环丁烷和环戊烷:
环丁烷与环丙烷相似,C-C键也是弯曲的,C-C-C键角约111.5º, 其中四个C不在同一平面。呈信封式结构。
十氢萘有两种顺反异构体:
H
顺式:
或
H
H
反式:
或
H
Bp(0C) 187.3
195.7
顺式的构象: 反式的构象:
a
H
e
H H
e
e
H
反式的十氢萘内能更低一些;
H
H
Pd
500oC
H
H
9%
91%
4
5
6
7
8
△ H[(CH2)n]
n
-697.1 -686.2 -664 -658.6 -662.4 -663.6
(kJ/mol)
从环烷烃的开环反应条件(见本章§2)及燃烧热数据可以看出: 环丙烷最不稳定,环丁烷次之,环戊烷比较稳定,环己烷以上的 大环都稳定,这反映了环的稳定性与环的结构有着密切的联系。
H
H
HH
H
HH
H
环戊烷分子中,C-C-C夹角为108°,接近sp3杂化轨道间夹角
109.5°,环张力甚微,是比较稳定的环。因此,环戊烷的化学性
质稳定。
H
H H
H
H
H H
H HH
(三)环己烷
所有键的键角都接近于理想sp3杂化的109.50,故最稳定;
胡宏纹第四版有机化学-第三章 环烷烃(上下)(完整版)
1,5-二甲基螺 [3,5]壬烷
7
6
12
2
54
3
2,7,7-三甲基二环[2,2,1]庚烷
CH3
1
56
4
3
9
7 8
2,8-二甲基-1-乙基二环[3,2,1]辛烷
1,8-二甲基-2-乙基-6-氯-双环[3,2,1]辛烷
8
1
7
2
8
71
6
2
1 8
2 10
97
3
Cl 6 5 4
3
5
43
65 4
三环[3,3,11,5 ,13,7 ]癸烷
Br
Br + HBr
CH2CH2Br
+ Br2
rt
Br
FeBr3
C: 与卤化氢加成
+ HBr
CH3CH2CH2Br
+ HBr
CH3CHCH2CH3
Br
规律:环丙烷衍生物与HX加成时,环的破裂处发生在
连接烷基最多的和最少的碳原子间,加成时产
物符合马氏规则,卤素加在含H较少的C上,H
加
在含H较多的C上。
7
6
1
5
32
4
9 10 1
2 8
5
3
7
64
CH3
螺[2, 4]庚烷
7-甲基螺[4, 5]癸烷
9 10 1
5 8
母体为:螺[3,4]辛烷
65 3
5-甲基螺[3,4]辛烷
7 8
4 2
1 9
CH3
2
1-甲基螺[3,5]-5-壬烯
螺[4,5]-1,6-癸二烯
3
76 4
《有机化学》胡宏纹版

基础有机化学南京大学基础学科教育学院南京大学化学化工学院第一章绪论基础有机化学南京大学基础学科教育学院南京大学化学化工学院1.1 有机化合物和有机化学1.有机化合物:碳化合物、碳氢化合物及其衍生物。
C、H(O、N、X、P、S)2. 有机化学:研究有机化合物来源、制备、结构、性能、应用以及有关理论、变化规律和方法学科学。
•三项内容:分离、结构、反应和合成[分离] 从自然界或反应产物通过蒸馏、结晶、吸附、萃取、升华等操作孤立出单一纯净的有机物。
[结构] 对分离出的有机物进行化学和物理行为的了解,阐明其结构和特性。
[反应和合成] 从某一有机化合物(原料)经过一系列反应转化成一已知的或新的有机化合物(产物)。
基础有机化学南京大学基础学科教育学院南京大学化学化工学院3. 有机化学的发展及其研究热点。
“有机”(Organic) “有机体”(Organism) 的来源1828年,德国化学家魏勒(W öhler,F.)制尿素:1845年,柯尔伯(H.kolber) 制得醋酸;1854年,柏赛罗(M.berthelot)合成油脂类化合物;尔后,布特列洛夫合成了糖类化合物;.…...有机物可来源于生物体也可由无机物转化而来。
迄今已知的化合物超过2000万(主要通过人工合成),其中绝大多数是有机化合物。
N H 4O C NH 2NCN H 2O基础有机化学南京大学基础学科教育学院南京大学化学化工学院1901~1998年,诺贝尔化学奖共90项,其中有机化学方面的化学奖55项,占化学奖61%有机化学是一门迅速发展的学科有机合成化学天然有机化学生物有机化学金属与元素有机化学物理有机化学有机分析化学药物化学香料化学农药化学有机新材料化学等学科生命科学材料科学环境科学化学生物学能源、工业、农业等方面............基础有机化学南京大学基础学科教育学院南京大学化学化工学院当代有机化学发展的一个重要趋势:与生命科学的结合。
有机化学竞赛课件第3章 环烷烃

C3 对称轴
H
H H
H H
H
H
H H
H H
H
第一类:6个C—H键与分子的 对称轴C3平行,与环的平均 a键(直立键) 平面垂直,叫做axial bond e键(平伏键) (轴向键),简称a键,中文 形象地称为直立键(其中3个 向环平面上方伸展,另外3个 向环平面下方伸展)。
第二类:6个C—H键与直立键形成接近109.5°的夹角, 平伏向环外伸展,叫做equatorial bond(赤道键),简 称e键,中文形象地称为平伏键(其中3个斜朝向环平面上 方伸展,另外3个斜朝向环平面下方伸展)。
难
H2
Pd >300℃
CH3CH2CH2CH2CH3
b. 加卤素
+ Br2 + Br2
CCl4
CCl4
CH2 CH2 CH2
Br
Br
CH2 CH2 CH2 CH2
Br
Br
溴褪色 可用于 鉴别环 烷烃
Br2/CCl4 不起加成,而是取代反应
c. 加HX,H2SO4/H2O
+ HBr
CH3CH2CH2Br
椅式构象的翻转
室温时,椅式构象可通过C—C键的转动(而不经过碳碳键的断 裂),由一种椅式构象变为另一种椅式构象,在互相转变中,原 来的a键变成了e键,而原来的e键变成了a键。原来位于上面的碳 原子(1、3、5)翻转到下面,而原来位于下面的碳原子(2、4、6)
翻转到上面;但C-H键的伸展方向不变。两变一不变
桥头碳
1
6
2
7
5
3
4
桥头碳
二环[2.2.1]庚烷 二环[4.4.0]癸烷
稠环可以 看成桥环 的一个特
第三章 环烷烃

有机化学中的同分异构现象
碳架异构体
位置异构体
( 结同 构分 异异 构构 体体 )
构造异构体
官能团异构体 互变异构体 价键异构体 构型异构体
几何异构体(不能旋转)
旋光异构体
立体异构体
构象异构体
交叉式构象 重叠式构象
电子互变异构体
* 分子式相同, 结构不同的化合物称为同分异构体, 也叫结构异构体
互变异构体: 因分子中某一原子在两个位置迅速移动而产生的 官能团异构体
那么,1,3和1,4二取代物呢?
结论:
(1)环己烷多元取代物中, e-取代基最多的构 象最稳定 (2)环己烷多元取代物中,大体积的取代基在 e-位的构象最稳定
3.环己烷环的平面表示法
3.6
多环烷烃的命名
① 螺环烃:两碳环共用一个碳原子(螺原子)
② 桥环烃:分子内环与环之间有两个或两个以上 共用碳原子的多环烃。
*若环上有取代基,则取代基的编号,名称放在母体前。若有 多个取代基:中文命名时,取代基的位次按顺序规则由小到 大排列;英文命名时,取代基的位次按英文字母排列; *编号的方式若有各种选择时, 要使取代基的号码尽可能小。
练
7 4 5 6 1 3 2
习
三环[2.2.1.02,6]庚烷
H3C
CH3
1,2,4-三甲基二环[4.3.0]壬烷
1、螺环烷烃的命名步骤
(1) 确定母体烃的名称:根据成环碳原子的数目确定母体烃的名称。
(2) 确定螺数:根据螺原子的个数分为单螺,二螺,三螺等。
(3) 编号: 编号从与端螺原子相邻的一个碳原子开始,沿多环的 边使所有的螺原子位号都尽可能小的路径编号。 (4) 标明结构:确定方括号内的数字,顺着环的编号次序,用数字 表明螺原子之间的碳原子数目,依次写在方括号内。 (5) 写出母体的名称:螺数、带有数字的方括号、母体烃的名称 三部分共同组成母体的名称; (6) 若有取代基,取代基的编号和名称放在母体前。若有多个取代 基,中文命名时,取代基的位次按顺序规则由小到大排列。英 文命名时,取代基的位次按英文字母排列。编号的方式若有各 种选择时, 要使取代基的号码尽可能小。
【有机化学】第三章 环烷烃【配套胡宏纹教材】

+ O2
环烷酸钴
140~180℃ 1-1.25MPa
OH
O
+
60%HNO3
90-120℃ 1.5MPa
CH2 CH2 COOH CH2 CH2 COOH
合成锦纶-66的单体
O
O
O2
+
O
§3.3 环烷烃的结构—环的张力 (Strain Theory)
三、四元环不稳定,易开环, 加成。五元、六元环较稳定,取代。
3.1.1 环烷烃的异构
碳骨异构
官能团位置异构
顺反异构(cis-trans-isomerism) cis (Latin, meaning on
this side); trans (Latin, meaning across)
3.1.2 环烷烃的命名
1)以碳环为母体,侧链为取代基。根据构成环碳原子数称 为环“某”烷。
2)当取代基≥2个,给环编号, 使取代基位次尽可能小。并 使简单取代基位次最小(即次序规则中优先基团后编号)。
3)若要指出之间的空间结构,则取代基在环同侧的为顺式, 取代基在环异侧的为反式结构。
9
10
11
12
9
10
11
12
§3.2 环烷烃的物理性质和化学反应
3.2.1 环烷烃的物理性质 m.p., b.p., d都比同碳数的直链烃高。
3.2.2 环烷烃的反应
3.2.2.1 氢解
3.2.2.2 加溴
3.2.2.3 加溴化氢
带有取代基的环烷烃加成HX或Br2时,环的断裂是在取代基最多与最 少的两个环碳原子之间,且H加到含H多的碳上。
HBr
CH3 CH3
CH3 CH C CH3 Br
有机化学第三章讲义

第三章环烷烃【基本要求】掌握环烷烃的通式、异构体和命名理解环烷烃的物理性质和化学性质理解环烷烃的Bayer张力掌握环己烷的构象以及取代环己烷的优势构象 熟悉其它环烷烃的构象,理解三元环的成键方式 掌握螺环烃和桥环烃的结构和命名【重点难点】环烷烃的Bayer张力与化学性质的关系环己烷的构象以及取代环己烷的优势构象三元环的成键方式❑环烷烃的通式:烷 环烷烃的通式: C n H 2n取代环烷烃的通式:C n H 2n这个化合物的分子式?❑环烷烃的异构:顺反异构体构造异构:原子的排列顺序不同产生的异构现象构象异构:化合物围绕单键在空间旋转产生的异构现象的不一样产生的异构现象 立体异构:原子或则基团在空间排列方式的不样产生的异构现象❑构型vs构象构型:原子在空间的排布方式称为化合物的构型,其中因为键的旋转而产生的异构体称为构象。
C6H12的环丁烷思考题:C6H12有哪些四元环构造异构体?同时请写出每个构造异构体可能的顺反异构体。
环烷烃的异构:C6H12的环丙烷CH3CH3CH3CH3CH3CH3CH3CH3CH3❑环烷烃的命名:烷根据环中的原子称为环某烷烃如果有取代基,则在母体环烃的名字前加上取代基的名称和位置如果有取代基则在母体环烃的名字前加上取代基的名称和位置如果有多个取代基,遵循取代基之和最小原则,优先的基团次序在后如果取代基为长碳链,则将环最为取代基,把烷烃作为母体来命名则将环最为取代基把❑环烷烃的命名:对于有顺反异构体的化合物,要在化合物的名称前加上顺反构型顺-1,4-二甲基环己烷反-1,4-二甲基环己烷烷烃的键线式键线式是一种常用的简便表达方法表示一个与之相连的❑烷烃的键线式: 顶点表示个碳,与之相连的氢常省略不写用加粗的实线表示伸向纸面前方键线式末端的点表示甲基❑命名下列化合物或者写出相应的结构:1141,1-二甲基-4-异丙基环癸烷1,2-二环丙基丁烷3-2 环烷烃的物理性质和化学性质:❑环烷烃的物理性质:与烷烃相似,环烷烃的熔点沸点随着分子量增大逐渐增加 环烷烃的熔点比相应分子量的链状烷烃高❑环烷烃的化学性质:三元环和四元环不太稳定,容易开环发生化学反应氢解(还原反应):)❑环烷烃的化学性质:加溴:三元环:开环取代反应❑环烷烃的化学性质:加溴化氢:Why?h?氧化:三元环对氧化剂比较稳定3-3 环的张力:环烃由于偏离了正常的成键角度,而像被压缩的弹簧一样,具有恢复形变的张力,这种张力即Bayer张力。
有机化学第三章环烷烃读书笔记

读书笔记有机化学
第三章碳环烃
第一节环烷烃
1、环烷烃简介
分子通式为C n H2n
环烷烃是具有链烃性质的环烃,环烷烃及其衍生物广泛存在于自然界中,石油中含多种环烷烃,一些植物中所含精油其成分大多是环烯烃及其含氧衍生物。
精油是中草药中重要的有效成分,有的可做香料。
在自然界广泛存在的甾族化合物都是环烷烃的衍生物,在人体起重要作用。
环烷烃是由碳和氢构成的环状化合物,并且分子中不含双键或三键结构2、环烷烃的物理性质
环烷烃的物理性质及其变化规律与烷烃相似,沸点和熔点随着成环的碳原子数的增加而升高。
在室温和常压下,环丙烷和环丁烷为气体,环戊烷至环十一烷为液体,环十二烷以上为固体。
环烷的熔点、沸点和相对密度都比含同数碳原子的直链烷高。
环戊烷、环己烷及其烷基取代物存在于某些石油中。
环己烷是重要的化工原料。
溶解性:微溶于乙醇,溶于丙酮、氯仿、苯。
3、环烷烃的化学性质
(1)加成:环烷烃发生加成反应,碳环会被打开,转变为开链烃及其衍生物。
(2)氧化:环烷烃在通常情况下不易发生氧化反应,在室温下它不与高锰酸钾水溶液反应。
因此这可作为环烷烃与炔烃的鉴别反应。
(3)卤化:在高温与紫外线的作用下,环烷烃上的氢原子可被卤素取代而生成卤代环烃。
《chapter3环烷烃》PPT课件

22
Br Br2
Br
精选课件ppt
23
(3) 与卤化氢反应
主要产物为:溴加到含氢少的碳上
精选课件ppt
24
(4) 氧化反应(小环对氧化剂相当稳定)
O
O
O2
+
O
? 原因:
(考虑羰基碳的杂化)
精选课件ppt
25
3.4 环的张力
3.4.1 拜尔张力学说
1880年以前,只知道有五元环,六元环。 1883年,W.H.Perkin合成了三元环,四元环。 1885年,A.Baeyer提出了张力学说。
精选课件ppt
11
H3C H
CH3 H
顺-1,2-二甲基环丙烷
实
cis-1,2-dimethylcyclopropane
例
三
H
CH3
H3C
H
反-1,2-二甲基环丙烷 trans-1,2-dimethylcyclopropane
精选课件ppt
带有二 个或二 个以上 取代基 时,构 型用顺 反表示 。
从现在的角度看,三员环的张力能是由以下几种因素造成的:
1 由于二个氢原子之间的距离小于范德华半径之和,所以产生
非键连作用,造成内能升高;Enb 2 轨道没有按轴向重迭,导致键长伸长或缩短,电子云重叠
减少,造成内能升高;El 3 E是由于偏转角引起的张力(即角张力)能。 4 E是由全重叠构象引起的。
张力能 = Enb(非键连作用) + El(键长) + E(键角) + E(扭转角)
45 3
6 7
2 19 8
二环[ 4.3.2]十一烷
8 CH3 Cl 6 5
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大环,排列于方括号中,放在“螺”后。
若遇到重键时,使之尽可能小。
c:编号从小环中与螺原子相邻的C开始,经螺原子到大环。
7 6 5 4 3
9 1 2 8
10
1 2 5 3
7 CH3
6
4
螺[2, 4]庚烷
7-甲基螺[4, 5]癸烷
6 7 8 9 1 CH3 5 4 3 2
母体为:螺[3,4]辛烷 5-甲基螺[3,4]辛烷
+ H2 40 C Ni 110 C Pt 330 C以上
0 0 0
CH3CH2CH3
+ H2
CH3CH2CH2CH3
+ H2
CH3(CH2)3CH3
B:与卤素加成
三元环与X2, HX在常温下即可发生开环反应, X2, HX于常温下不 使四,五员环开环,但加热后,可发生取代反应。
CH2CH2CH2 Br Br + HBr Br + Br2 3000C Br + HBr + Br2 rt FeBr3 + Br2 光照
23kJ· mol-1
半椅式构象:
H H H H H H H
H H H HH
5个碳在同一平面上;
C-C键角接近120º ,有角张力;
平面碳上的C-H键为重叠式构象,有较大的扭转张力。
扭船式构象:
4 3 6 2
1
4
3
6 1
H H H H H H
H H H H H
5
4
5
2
H
1 5 2
4
5
2 1
3
桥:两个桥头碳间的碳链或键。
全部环上碳原子数
8 7 1 2 5 3 4
[3.2.1] 辛烷bicyclo[3.2.1]octane 母体为 二环
全名:2,8,8-三甲基二环[3.2.1]辛烷 2,8,8-trimethylbicyclo[3.2.1]octane
命名规则:
6
a:用“双环”“三环”作词头,按所含碳原子总数称某烃。 b:方括号中,按由大到小的次序,注明各桥环的碳原子数。 两个桥头碳原子除外。 c:编号从桥头碳开始,沿最长的桥编号至另一桥头碳,再 沿次长桥编号到开始的桥头碳,最短的桥最后编。 d:可能的情况下给取代基以尽可能小的编号
环己烷分子中6个碳原子不在同一平面上,碳原子之间的
键角为109º 28',分子中没有张力。
椅式构象
船式构象
大环原子在不同的平面内,键角接近正常的键角,为
无张力环。
环三十烷
脂环烃的稳定性顺序(由小到大):
三元环 < 四元环 < 五元环~六元环及以上的脂环烃
环己烷的构象
1890年,H. Sachse 对拜尔张力学说提出异议。
二、化学性质
结构分析:C-C,C-H σ键牢固,化性稳定,似烷烃;
但C3—C4环易破,环可以加成,似烯烃。
1、取代反应
+ Cl2 光照 Cl 加热 3000C + HCl Br + Br2 + HBr
反应条件加强, 反应程度减弱
2、加成反应
小环烷烃,特别是环丙烷,和一些试剂作用时易发生开环。 A: 加氢(随碳原子数增加,环的稳定性增加;加氢反应 条件也愈苛刻) Ni
环丙烷 cyclopropane 环丁烷 cyclobutane 环戊烷 cyclopentane
CH3 CH3
CH2CH2CH2CH2CH3
A:Isopropylcyclopentane B:1-Cyclobutylpentane
1-甲基-2-异丙基环戊烷
C3
2
4
D
1
5 4 3 2
E
CH3
CH3 CH CH3
螺环烃
桥环烃
稠环烃
二、异构
构造异构:
CH3 CH2CH3
立体异构(顺反异构):相同的基团在环的同侧为顺,异侧
CH3
为反。 CH3 CH
3
CH3
(顺)
CH3 CH3
(反)
CH3 CH3 (反)
(顺)
三、命名
a:与相应的开链烃基相同,名称前加一“环”字。 b:编号使取代基位置最小,有取代基及不饱和键时,不饱 和键以最小的号数表示(用较小的数字表示较小的取代基) c:取代基为较长的碳链,则将环当作取代基,作为烷烃的衍 生物命名. d:顺反异构体的命名是假定环中碳原子在一个平面上,以 此为参考,两个取代基在同侧的为顺式(cis-),反之 为反式(trans-).
1918年,E. Mohr 提出非平面、无张力环学说。指
出用碳的四面体模型可以组成两种环己 烷模型。
椅式构象
船式构象
环己烷的构象
椅式构象和船式构象 六个碳原子均为sp3杂化,在保持键角109º 28'不变的情
况下,能以两种不同的空间形式组成六员环。
透视式:
椅式
船式
纽曼投影式:
H H H H
H
H H H
香蕉键
环丙烷分子中 轨道部分重叠 开链或较大脂环化合物 中轨道可达到最大重叠
环丙烷分子相邻碳上的碳氢键都是重叠式构象。
扭转张力:试图恢复交叉式构象的力。
2 其他环烷烃
环丁烷四个碳原子不在一个平面上,但仍存在角张力
和扭转张力。
环戊烷分子中,碳碳键的夹角为108º ,接近sp3杂化轨道
间夹角,角张力很小,是比较稳定的环。
CH2CH2Br + Br2 rt FeBr3 Br
C: 与卤化氢加成
+ HBr
CH3CH2CH2Br CH3CHCH2CH3 Br
+ HBr
规律:环丙烷衍生物与HX加成时,环的破裂处发生在 连接烷基最多的和最少的碳原子间,加成时产 物符合马氏规则,卤素加在含H较少的C上,H加 在含H较多的C上。
6
3
6
将船式构象扭动,使两个船头碳原子错开,当所有的扭 转角都达到30º 时,张力减小最大,就是扭船式构象。
9 8 7 6 4 10 5 3 1
2
1-甲基螺[3,5]-5-壬烯 螺[4,5]-1,6-癸二烯
2、桥环烷烃
(1)桥 (2)桥 桥(3) 桥头碳 母体名-几环[n1,n2,n3…]某烷 环的数目 各桥上碳数 由小到大排 桥头碳
两个环ห้องสมุดไป่ตู้用两个或两个以上碳原子的化合物称桥环化合物。
桥头碳:共用的C;
O + O3 + O
O
H + O3
OH
c)在强烈条件下,环也可破裂。
Co+ /P COOH COOH
第四节
环的张力
-----环烷烃的结构与稳定性
烷烃分子的形成 以甲烷为例: 甲烷分子中碳原子为sp3 杂化 ,四个 C-H 键都 是sp3 – s。当氢原子的 1s 轨道分别与 sp3 轨道的对 称轴的方向相接近,它们之间的吸引力与排斥力平 衡时,轨道达到最大重叠,形成四个等同的C-H键, 。 ′ 其键长为109.1pm,键角为 。 109 28 在烷烃分子中,所有碳原子均为 sp3 杂化 ,其 C-C 键平均键长为154 pm ,C-H 键平均键长为107 pm 。无论 C-C 单键,还是 C-H 键,我们均称为σ 键。
7 6 1 2
1,5-二甲基螺 [3,5]壬烷 CH3
1 2 5 6 7 3 4 9 8
5
4
3
2,7,7-三甲基二环[2,2,1]庚烷
2,8-二甲基-1-乙基二环[3,2,1]辛烷
1,8-二甲基-2-乙基-6-氯-双环[3,2,1]辛烷
8 1 7 2
8 7 1 2 4 3
9 6
8 7 5
1 2 10 3 4
构象异构的能量分析
船式(模型) 空间张力
183pm H 4 H H 透视式 H H
5 H 3 6
H
重叠式的H
1 6
H
H H H
2
H H
1
H H H
2 3
H
4 5
H
H H
H
H
H
H
Newman 投影式
重叠式(扭转张力)
椅式(模型)
1,3-二竖键的相互作用力
交叉式的 H
H H
5 4 3 6 2 1
H
1 6 5 4
H H HH
HH H H HH
船式
H
椅式
H
分子模型:
椅式构象
船式构象
椅式构象较稳定的原因:
船式构象中相邻碳上的碳氢键全部为重叠式构象,存在
扭转张力,而椅式构象中相邻碳上的碳氢键全部为交叉
式构象,没有扭转张力。
椅式构象
船式构象
船式构象中船头碳原子C1和C4上的氢原子距离较近, 斥力较大。而椅式构象中C1和C4上的氢原子距离较远, 斥力较小。
Enb> E1> Eθ > EΦ
1 环丙烷
环丙烷上的碳原子都是饱和碳原子,为sp3杂化。
105.5° 114°
60°
H H
角张力:分子内部试图恢复正常键角的力。
由于几何形状上的限制,环丙烷分子虽是平面结构,但成 键的电子云并不沿轴向重叠, 而是形成一种弯曲键。 键 角 与 轨 道的正常夹角有偏差, 造成重叠程度小, 键能下降,产生角张力。
CH3 + HBr CH3CCH Br CH3 CH3
3、氧化反应
a)小环不被高锰酸钾,臭氧所氧化 +
+ KMnO4 + O3 H+
×
H
×
COOH H3C H3C O + H3C C CH3
应用:鉴别小环与不饱和烃类化合物
