新版GMP认证数据(疫苗篇)
新版GMP认证情况及解读

新版GMP认证情况及解读一、现场发现情况举例及检查员解读滥用洁净走廊的概念有些无菌制剂企业盲目设置洁净走廊。
洁净走廊通常是用在固体制剂的生产车间里,它的目的是在一些多品种或者产粉尘的车间,防止产生粉尘污染,如果操作间压差大于走廊的压差,那么操作间的粉尘就会流入到走廊,这样会污染其它的区域。
于是对这样的车间要求操作间相对于走廊要形成一定的负压,这样就可以控制固体制剂的粉尘污染。
反而无菌制剂生产中,这个洁净走廊并不是必须的,只在部份的环节,如称量系统等会产生粉尘的环节,需要洁净走廊,但并不是所有的操作间都需要设置洁净走廊。
不了解设置压差梯度的核心:新版GMP对固体制剂提出这个概念,压差梯度设置的核心是控制污染和交叉污染。
我们国家早期的洁净车间设计时是不太合理的,空调系统设计中往往没有考虑压差梯度。
过去仅规定哪个地方要有压差表,那么企业就会按照这个规定,在这里安上压差表;你说要大于10P,我就大于10P了,别的没有规定我也就不用管了。
企业不是从压差梯度防止污染这个根本的核心去考虑的,只是为了符合当时GMP的根本条款规定来放置。
但是这种情况现在还是存在。
我们在检查中发现有固体制剂企业对此的理解不到位。
他放个压差表仍然不理解意义何在,GMP规定洁净区比非洁净区大10P,他就调高压差,数字上大于10P 。
但是在洁净区的空气的流向他不去关注。
检查员解读:要真正理解GMP要求的目的是什么,再选择要不要做,怎么做,这是很重要的。
无菌保障的实质是全过程质量管理在对药品GMP证书有效期延期中检查中,曾遇到有注射剂的生产企业,在洗瓶的初洗、精洗过程,对洗瓶的水量是没有考查和控制的。
即便是初洗,如果达不到要求,也会影响下一步的精洗甚至影响整过过程。
如这一批洗5000个瓶,瓶子的污染程度如何?应该用多大的水量?这些水初洗后,什么时候需要重新更换新的水?有些企业甚至循环使用精洗的水再返回用来初洗,这都是不行的,因为水已经污染了。
生物制品GMP认证检查项目

生物制品GMP认证检查项目
一、药品GMP认证检查项目共217项,其中关键项目(条款号前加“*”)82项,一般项目135项。
二、药品GMP认证检查时,应根据申请认证的范围确定相应的检查项目,并进行全面检查和评定。
三、检查中发现不符合要求的项目统称为“缺陷项目”。
其中,关键项目不符合要求者称为“严重缺陷”,一般项目不符合要求者称为“一般缺陷”。
四、缺陷项目如果在申请认证的各剂型或产品中均存在,应按剂型或产品分别计算。
五、在检查过程中,企业隐瞒有关情况或提供虚假材料的,按严重缺陷处理。
检查组应调查取证并详细记录。
六、结果评定
(一)未发现严重缺陷,且一般缺陷≤20%,能够立即改正的,企业必须立即改正;不能立即改正的,企业必须提供缺陷整改报告及整改计划,方可通过药品GMP认证。
(二)发现严重缺陷1项以上(含1项)或一般缺陷>20%的,不予通过药品GMP认证。
生物制品GMP认证检查项目。
疫苗管理规范标准最新版

疫苗管理规范标准最新版疫苗管理规范标准是确保疫苗安全、有效和质量的重要指南。
以下是最新版的疫苗管理规范标准内容:一、总则1. 本规范旨在规范疫苗的研制、生产、流通、使用和监管活动,确保疫苗的安全性、有效性和质量可控。
2. 所有涉及疫苗的单位和个人必须遵守本规范,并接受相关监管部门的监督检查。
二、疫苗研制1. 疫苗研制应遵循科学、规范的原则,确保疫苗的安全性和有效性。
2. 研制过程中应进行充分的临床前研究和临床试验,确保疫苗的安全性和有效性得到验证。
三、疫苗生产1. 疫苗生产单位应具备相应的生产资质,生产环境和设备应符合国家规定标准。
2. 生产过程中应严格控制原料、工艺和质量,确保疫苗质量稳定可靠。
四、疫苗流通1. 疫苗的储存和运输应符合冷链管理要求,确保疫苗在适宜的温度条件下储存和运输。
2. 疫苗的流通应实行严格的追溯制度,确保疫苗的来源和流向可追溯。
五、疫苗使用1. 疫苗使用单位应具备相应的资质,严格按照疫苗使用指南进行接种。
2. 接种人员应接受专业培训,确保接种操作规范、安全。
六、疫苗监管1. 监管部门应加强对疫苗研制、生产、流通和使用的监督检查,确保疫苗管理规范得到有效执行。
2. 对违反疫苗管理规范的行为,监管部门应依法予以查处。
七、信息公开与透明度1. 疫苗相关信息应向社会公开,包括疫苗的研制、生产、流通和使用情况。
2. 公开信息应真实、准确、及时,保障公众的知情权和监督权。
八、应急处理与事故调查1. 一旦发现疫苗安全问题或疑似不良反应,应立即启动应急预案,采取有效措施控制风险。
2. 对疫苗安全事故应进行彻底调查,查明原因,采取必要措施防止类似事件再次发生。
九、附则1. 本规范自发布之日起实施,原有相关规定与本规范不一致的,以本规范为准。
2. 本规范由国家卫生健康委员会负责解释。
本规范标准的制定旨在提高疫苗管理的科学性和规范性,确保公众健康安全,促进疫苗行业的健康发展。
2020年新生物制品GMP解析

2020年《生物制品》GMP附录属解析本文来自网络在本次修订之前,《生物制品》GMP附录属于在2011年3月发布的中国GMP 附录3。
在实施《疫苗管理法》和新冠肺炎疫情爆发的综合局面下诞生的这部GMP 修订稿到底有哪些变化呢?笔者根据自己的工作经验和行业认知,为各位解析如下。
变化一:生物制品分类范围进行了调整解析:新版文件对于生物制品分类中的疫苗内容进行了修订,使用疫苗来统一描述,而不是再采用细菌类疫苗和病毒类疫苗分开介绍。
2010版文件2020版文件具体要求第五条从事生物制品生产、质量保证、质量控制及其他相关人员(包括清洁、维修人员)均应根据其生产的制品和所从事的生产操作进行专业知识和安全防护要求的培训。
第六条生产管理负责人、质量管理负责人和质量受权人应当具有相应的专业知识(微生物学、生物学、免疫学、生物化学、生物制品学等),并能够在生产、质量管理中履行职责。
第七条应当对所生产品种的生物安全进行评估,根据评估结果,对生产、维修、检验、动物饲养的操作人员、管理人员接种相应的疫苗,并定期体检。
第八条患有传染病、皮肤病以及皮肤有伤口者、对产品质量和安全性有潜在不利影响的人员,均不得进入生产区进行操作或质量检验。
未经批准的人员不得进第六条应当加强对关键人员的培训和考核,培训内容至少包括相关法律法规、安全防护、技术标准等,并应当每年对相关人员进行专业考核。
从事生物制品生产、质量保证、质量控制及其他相关人员(包括清洁、维修人员)均应根据其生产的制品和所从事的生产操作进行专业知识和安全防护要求的培训。
第七条生产管理负责人、质量管理负责人和质量受权人应当具有相应的专业知识(微生物学、生物学、免疫学、生物化学、生物制品学等),并能够在生产、质量管理中履行职责。
疫苗生产企业生产管理负责人、质量管理负责人和质量受权人应当具有药学、医学等相关专业本科及以上学历(或中级以上职称),并具有5 年以上从事相关领域生产质量管理经验,以保证能够在生产、质量管理中履行职责,并承担相关责任。
2019版GMP认证新版GMP认证70页word文档

药品生产质量管理规范(2010年修订)历经5年修订、两次公开征求意见的《药品生产质量管理规范(2010年修订)》(以下简称新版药品GMP)将于2011年3月1日起施行。
《药品生产质量管理规范》(以下简称药品GMP)是药品生产和质量管理的基本准则。
我国自1988年第一次颁布药品GMP至今已有20多年,其间经历1992年和1998年两次修订,截至2004年6月30日,实现了所有原料药和制剂均在符合药品GMP的条件下生产的目标。
新版药品GMP共14章、313条,相对于1998年修订的药品GMP,篇幅大量增加。
新版药品GMP吸收国际先进经验,结合我国国情,按照“软件硬件并重”的原则,贯彻质量风险管理和药品生产全过程管理的理念,更加注重科学性,强调指导性和可操作性,达到了与世界卫生组织药品GMP的一致性。
新版药品GMP修订的主要特点:一是加强了药品生产质量管理体系建设,大幅提高对企业质量管理软件方面的要求。
细化了对构建实用、有效质量管理体系的要求,强化药品生产关键环节的控制和管理,以促进企业质量管理水平的提高。
二是全面强化了从业人员的素质要求。
增加了对从事药品生产质量管理人员素质要求的条款和内容,进一步明确职责。
如,新版药品GMP明确药品生产企业的关键人员包括企业负责人、生产管理负责人、质量管理负责人、质量受权人等必须具有的资质和应履行的职责。
三是细化了操作规程、生产记录等文件管理规定,增加了指导性和可操作性。
四是进一步完善了药品安全保障措施。
引入了质量风险管理的概念,在原辅料采购、生产工艺变更、操作中的偏差处理、发现问题的调查和纠正、上市后药品质量的监控等方面,增加了供应商审计、变更控制、纠正和预防措施、产品质量回顾分析等制新制度和措施,对各个环节可能出现的风险进行管理和控制,主动防范质量事故的发生。
提高了无菌制剂生产环境标准,增加了生产环境在线监测要求,提高无菌药品的质量保证水平。
相关讨论见药家网GMP认证讨论区:/forum-forumdisplay-fid-72-filter-typeid-typeid-42.html 原文查看:见本文档尾页,您也可以到药家网下载:/forum-viewthread-tid-18489-fromuid-617.html中华人民共和国卫生部令第 79 号《药品生产质量管理规范(2010年修订)》已于2010年10月19日经卫生部部务会议审议通过,现予以发布,自2011年3月1日起施行。
2020年新生物制品GMP解析

2020年《生物制品》GMP附录属解析本文来自网络在本次修订之前,《生物制品》GMP附录属于在2011年3月发布的中国GMP 附录3。
在实施《疫苗管理法》和新冠肺炎疫情爆发的综合局面下诞生的这部GMP 修订稿到底有哪些变化呢?笔者根据自己的工作经验和行业认知,为各位解析如下。
变化一:生物制品分类范围进行了调整解析:新版文件对于生物制品分类中的疫苗内容进行了修订,使用疫苗来统一描述,而不是再采用细菌类疫苗和病毒类疫苗分开介绍。
2010版文件2020版文件具体要求第五条从事生物制品生产、质量保证、质量控制及其他相关人员(包括清洁、维修人员)均应根据其生产的制品和所从事的生产操作进行专业知识和安全防护要求的培训。
第六条生产管理负责人、质量管理负责人和质量受权人应当具有相应的专业知识(微生物学、生物学、免疫学、生物化学、生物制品学等),并能够在生产、质量管理中履行职责。
第七条应当对所生产品种的生物安全进行评估,根据评估结果,对生产、维修、检验、动物饲养的操作人员、管理人员接种相应的疫苗,并定期体检。
第八条患有传染病、皮肤病以及皮肤有伤口者、对产品质量和安全性有潜在不利影响的人员,均不得进入生产区进行操作或质量检验。
未经批准的人员不得进第六条应当加强对关键人员的培训和考核,培训内容至少包括相关法律法规、安全防护、技术标准等,并应当每年对相关人员进行专业考核。
从事生物制品生产、质量保证、质量控制及其他相关人员(包括清洁、维修人员)均应根据其生产的制品和所从事的生产操作进行专业知识和安全防护要求的培训。
第七条生产管理负责人、质量管理负责人和质量受权人应当具有相应的专业知识(微生物学、生物学、免疫学、生物化学、生物制品学等),并能够在生产、质量管理中履行职责。
疫苗生产企业生产管理负责人、质量管理负责人和质量受权人应当具有药学、医学等相关专业本科及以上学历(或中级以上职称),并具有5 年以上从事相关领域生产质量管理经验,以保证能够在生产、质量管理中履行职责,并承担相关责任。
2价脊灰疫苗介绍 (1)

两价OPV产品临床数据
wIPV+2bOPV n/N Ⅰ型 40/40 47/61 77/78 45/46 1/25 8/8 85/86 48/86 85/86 % 100.00 77.05 98.72 97.83 4.00 100.00 98.84 55.81 98.84 wIPV+2tOPV n/N 55/55 60/60 70/72 29/31 22/26 12/14 84/86 82/86 82/86 % 100.00 100.00 97.22 93.55 84.62 85.71 97.67 95.35 95.35 2wIPV+bOPV n/N 41/41 63/63 68/68 40/45 8/23 16/18 81/86 71/86 84/86 % 100.00 100.00 100.00 88.89 34.78 88.89 94.19 82.56 97.67 2wIPV+tOPV n/N 41/41 56/56 76/76 40/45 25/30 10/10 81/86 81/86 86/86 % 100.00 100.00 100.00 88.89 83.33 100.00 94.19 94.19 100.00 3剂wIPV n/N 39/39 54/54 68/68 36/43 16/28 12/14 75/82 70/82 80/82 % 100.00 100.00 100.00 83.72 57.14 85.71 91.46 85.37 97.56 3剂tOPV n/N 37/37 41/41 67/67 38/41 35/37 11/11 75/78 76/78 78/78 % 100.00 100.00 100.00 92.68 94.59 100.00 96.15 97.44 100.00
GMP试题(疫苗类)

GMP试题(疫苗)1.广义的生物制品包括()A. 血液类制品、疫苗类制品、抗体类制品、细胞因子类制品B. 主动免疫制剂、被动免疫制剂C. 血制品、疫苗D. 血制品、诊断试剂2. 20世纪70年代以来,疫苗类的制品除了细菌性和病毒性两大类,又增加了()。
A. 结合疫苗、核酸(DNA)为基础的疫苗等B. 细菌多糖类抗原的疫苗、核酸(DNA)为基础的疫苗等C. 联合疫苗、核酸(DNA)为基础的疫苗等D. 细菌多糖类抗原的疫苗、灭活疫苗等3. 国内已经批准生产的:口服双歧杆菌类制品、地衣芽孢杆菌类制品、蜡样芽孢杆菌类制品、酪酸梭菌类制品、枯草杆菌类制品、肠球菌类制品等,属()。
A. 预防用生物制品B. 微生态制品C. 血液制品D. 治疗用免疫制品4. 细菌和细胞的培养工艺有了显著改进。
细胞培养从传统的转瓶工艺,逐渐转化成生物反应器培养工艺。
采用这类技术的疫苗有()。
A. 百日咳疫苗B. 伤寒疫苗C. 卡介苗D. 狂犬病疫苗5. 培养基模拟灌装试验灌装数量少于5000支时,应达到( )A.可以有1支污染品B.可以有2支污染品C.有3支污染品D.不得检出污染物6.培养基模拟灌装试验灌装数量在5000至10000支时,应达到( )A.可以有1支污染品B.有1支污染,需调查,可考虑重复试验C.有2支污染品,需调查D.有2支污染品,需调查7.用于疫苗生产的动物应是A.清洁级以上的动物B.普通级以上动物C.SPF级别的动物D.无特殊要求,只要能够用于生产即可。
8.菌毒种的验收、贮存、保管、使用、销毁应执行()规定.A. 国家有关微生物菌种保管的规定B. 企业内部有关微生物菌种保管的规定C. 国家有关医学微生物菌种保管的规定D. 当地卫生监督部门有关微生物菌种保管的规定9. 生物制品用动物源性的原材料使用时应详细记录,内容至少包括()A. 动物来源B. 动物来源、动物繁殖和饲养条件、动物的健康情况C. 动物来源、动物品种及级别、动物体重等D. 动物来源、动物饲养10 .生物制品生产用菌毒种应建立()。
常见疫苗数据库
预防接种疫苗 预防接种疫苗 预防接种疫苗 预防接种疫苗 预防接种疫苗 预防接种疫苗
药品剂型* 冻干粉针 冻干粉针 注射剂 口服溶液剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂 注射剂
1324
冻干人用狂犬病疫苗(VERO细胞) 冻干人用狂犬病疫苗(VERO细胞)
XJ07BGR030B01401010
1246
冻干人用狂犬病疫苗(Vero细胞) 冻干人用狂犬病疫苗(Vero细胞)
XJ07BBS266B00101028 1529
四价流感病毒裂解疫苗
四价流感病毒裂解疫苗
XJ07BGR032B00101010
批发价
国家限价
151 810 153 187 339 339
费用分类* 国药准字 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费 预防接种费
公司代码
产地
1盒 1盒 1盒 1盒 1盒 1瓶
是否基本药物 基本药物类型
来源分类(1国产2进 口)
有效标识* 零售价* 100
272
1310
293
37.3
60
59
141
81.4
569
213
210
224
95
136
86
127
流感裂解疫苗GMP认证检查技术指导原则2009813[1].
![流感裂解疫苗GMP认证检查技术指导原则2009813[1].](https://img.taocdn.com/s3/m/aaab2c2f647d27284b735122.png)
流感裂解疫苗GMP检查技术指导原则流感疫苗是预防流行性感冒的有效措施之一,该疫苗能刺激机体产生特异性免疫学反应而达到预防流行性感冒的目的。
流感灭活疫苗在世界范围内已经广泛使用五十多年,目前最常用的是流感裂解疫苗。
流感裂解疫苗系用世界卫生组织(WHO)推荐,并经国家药品监督管理当局批准的甲型(H1N1、H3N2)和乙型流行性感冒病毒当年流行株或相似株,分别接种鸡胚蛋培养、收获的病毒液经浓缩、裂解和纯化后而制成的裂解疫苗。
本指导原则是在执行国家《药品生产质量管理规范》、《药品GMP认证检查评定标准》和国家药品监督管理当局批准的工艺和质量标准前提下,根据流感裂解疫苗的特殊性为便于GMP认证检查提供的一个基本指导原则。
流感裂解疫苗管理方面除在厂房与设施、物料、生产管理、质量管理等方面存在特殊要求外,其余项目均应符合国家《药品生产质量管理规范》、《药品GMP认证检查评定标准》和国家药品监督管理当局批准的工艺和质量标准的要求,以下主要就流感的特殊性方面对检查技术提出基本指导原则。
(一)厂房与设施1.胚蛋预孵孵房与接种病毒后孵房应分开,接种后不同批号的胚蛋应分开,如不同批号的胚蛋在同一孵房中应有防止混淆措施,避免差错。
2.流感生产用孵房(包括预孵孵房)应有洁净级别,至少应达到100,000级。
3.病毒收获、病毒裂解(使用的裂解剂为易燃易爆化学品的)等区域(在生产期间)应保持相对负压。
4.病毒裂解使用裂解剂为易燃易爆化学品的,应在设施、设备选用中充分考虑安全性因素。
(二)物料1. 流感毒株:由于流感病毒容易变异,流感流行的毒株会经常改变,因此WHO 每年要发布当年疫苗生产用毒株的建议。
1.1 流感毒株的来源1.1.1 当年生产用流感毒株的确定——由WHO推荐,来源清楚,应由WHO合作实验室提供。
1.1.2 当年生产用流感毒株相关资料齐全:毒种来源的机构、毒株相关的背景资料、来源的代次、相关购买协议、购买数量等相应的证明性材料。
中国新版GMP认证

中国新版GMP认证根据中华人民共和国卫生部部长签署的2011年第79号令,《药品生产质量管理规范(2010年修订)》(下称新版GMP)已于2010年10月19日经卫生部部务会议审议通过,自2011年3月1日起施行。
中国新版GMP与98版相比从管理和技术要求上有相当大的进步。
特别是对无菌制剂和原料药的生产方面提出了很高的要求,新版GMP以欧盟GMP 为基础,考虑到国内差距,以WHO2003版为底线。
新版GMP认证有两个时间节点:药品生产企业血液制品、疫苗、注射剂等无菌药品的生产,应在2013年12月31日前达到新版药品GMP要求;其他类别药品的生产均应在2015年12月31日前达到新版药品GMP要求。
未达到新版药品GMP要求的企业(车间),在上述规定期限后不得继续生产药品。
一、新版GMP认证资料有哪些?药品 GMP 认证申请书(一式四份);《药品生产企业许可证》和《营业执照》复印件;药品生产管理和质量管理自查情况(包括企业概况及历史沿革情况、生产和质量管理情况、前次认证缺陷项目的改正情况);药品生产企业组织机构图(注明各部门名称、相互关系、部门负责人);药品生产企业负责人、部门负责人简历;依法经过资格认定的药学及相关专业技术人员、工程技术人员、技术工人登记表,并标明所在部门及岗位;高、中、初级技术人员占全体员工的比例情况表;药品生产企业生产范围全部剂型和品种表;申请认证范围剂和品种表(注明常年生产品种),包括依据标准、药品批准文号;新药证书及生产批件等有关文件资料的复印件;药品生产企业周围环境图、总平面布置图、仓储平面布置图、质量检验场所平面布置图;药品生产车间概况及工艺布局平面图(包括更衣室、盥洗间、人流和物流通道、气闸等,并标明人、物流向和空气洁净度等级);空气净化系统的送风、回风、排风平面布置图;工艺设备平面布置图;申请认证型或品种的工艺流程图,并注明主要过程控制点及控制项目;药品生产企业(车间的关键工序、主要设备、制水系统及空气净化系统的验证情况;检验仪器、仪表、衡器校验情况;药品生产企业(车间)生产管理、质量管理文件目录。
价脊灰疫苗介绍

.
13
两价OPV产品使用说明
临床试验不良反应: 本品国内注册临床试验中共200名2月龄健康婴儿接种本疫苗,其中100名婴儿首剂 接种IPV后口服两剂本疫苗;另外100名婴儿接种两剂IPV后口服一剂本疫苗。本疫苗 接 种 后 , 全 身 不 良 反 应 总 发 生 率 为 37.5%~43.62% , 主 要 为 发 热 , 发 生 率 为 35.11%~39.36%,其次为腹泻,发生率为4.17%~10.64%,此外常见的不良反应有烦躁 (易激惹)2.08%~4.26%,呕吐1.06%~3.19%。上述不良反应多为轻度,持续时间不超 过3天,可自行缓解。无局部不良反应发生。未出现与疫苗相关的严重不良反应。 本品使用中若出现上述未提及的任何不良反应,请及时告知医师。
.
14
两价OPV产品使用说明
【禁忌】 下列情况严禁使用本疫苗: (1) 已知对该疫苗的任何组分,包括辅料及硫酸庆大霉素过敏者。 (2) 患急性疾病、严重慢性疾病、慢性疾病的急性发作期、发热者。 (3) 免疫缺陷、免疫功能低下或正在接受免疫抑制剂治疗者。 (4) 妊娠期妇女。 (5) 患未控制的癫痫和其他进行性神经系统疾病者。
.
16
两价OPV产品临床数据
易感 人群
Ⅰ型
wIPV+2bOPV
n/N
%
40/40 100.00
wIPV+2tOPV
n/N
%
55/55 100.00
2wIPV+bOPV
n/N
%
41/41 100.00
2wIPV+tOPV
n/N
%
41/41 100.00
3剂wIPV
n/N
%
39/39 100.00
GMP认证检查评定标准
《药品GMP认证检查评定标准》
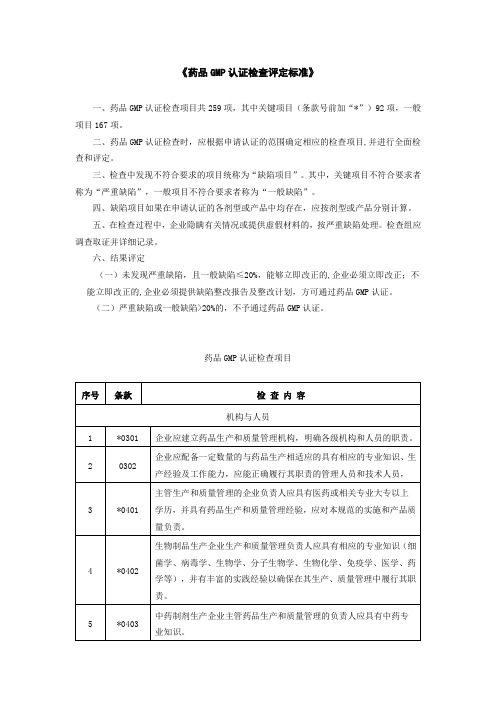
一、药品GMP认证检查项目共259项,其中关键项目(条款号前加“*”)92项,一般项目167项。
二、药品GMP认证检查时,应根据申请认证的范围确定相应的检查项目,并进行全面检查和评定。
三、检查中发现不符合要求的项目统称为“缺陷项目”。
其中,关键项目不符合要求者称为“严重缺陷”,一般项目不符合要求者称为“一般缺陷”。
四、缺陷项目如果在申请认证的各剂型或产品中均存在,应按剂型或产品分别计算。
五、在检查过程中,企业隐瞒有关情况或提供虚假材料的,按严重缺陷处理。
检查组应调查取证并详细记录。
六、结果评定
(一)未发现严重缺陷,且一般缺陷≤20%,能够立即改正的,企业必须立即改正;不能立即改正的,企业必须提供缺陷整改报告及整改计划,方可通过药品GMP认证。
(二)严重缺陷或一般缺陷>20%的,不予通过药品GMP认证。
药品GMP认证检查项目。
药品GMP认证检查评定标准

1.药品G M P认证检查评定标准一、药品GMP认证检查项目共259项,其中关键项目(条款号前加“*”)92项,一般项目167项。
二、药品GMP认证检查时,应根据申请认证的范围确定相应的检查项目,并进行全面检查和评定。
三、检查中发现不符合要求的项目统称为“缺陷项目”。
其中,关键项目不符合要求者称为“严重缺陷”,一般项目不符合要求者称为“一般缺陷”。
四、缺陷项目如果在申请认证的各剂型或产品中均存在,应按剂型或产品分别计算。
五、在检查过程中,企业隐瞒有关情况或提供虚假材料的,按严重缺陷处理。
检查组应调查取证并详细记录。
六、结果评定(一)未发现严重缺陷,且一般缺陷≤20%,能够立即改正的,企业必须立即改正;不能立即改正的,企业必须提供缺陷整改报告及整改计划,方可通过药品GMP认证。
(二)严重缺陷或一般缺陷>20%的,不予通过药品GMP认证。
2.GMP概述提纲一、GMP简史二、GMP概念三、法律依据四、性质五、目的六、控制要求七、中心思想八、目标九、特点十、GMP的的对象十一、解释权十二、施行日期一、GMP简史20世纪50年代初(新中国成立不久)联邦德国格仑南苏制药厂生产一种叫做沙立度胺(反应停)的药品。
当时用于治疗孕妇妊娠呕吐,上市6年,先后在28个国家使用,出现畸胎12000余例。
经调查发现。
服用该药品的100%的致畸胎。
此次事件的严重后果在美国引起不安,美国公众强烈关注药品监督和药品法规。
1963年美国是颁布了世界上第一个GMP。
1973年日本颁布GMP,1974年WHO(联合国世界卫生组织)公布GMP。
1988年日本制订原料药GMP。
目前已有100多国家实行GMP制度。
我国,1982年中国医药工业公司制订了《药品生产质量管理规范》(GMP)(试行),1984年由第六届全国人民代表大会常务委员会通过,1988.3卫生部颁布《药品生产质量管理规范》,1992.12进行了修订,1995年开展GMP认证。
新版GMP认证检查思路

包括跟踪、飞行、举报核查:现场检查方案的制定原则,需要 输出的记录形式和内容基本要求。
SOP-201-201-00 SOP-201-202-00 SOP-201-203-00
SOP-201-204-00
SOP-201-205-00
SOP-201-206-00 SOP-201-207-00 SOP-201-209-00 SOP-201-210-00 SOP-201-211-00 SOP-201-212-00 SOP-201-213-00 SOP-201-214-00 SOP-201-215-00 SOP-201-217-00 SOP-201-218-00
1)治疗窗窄的药品
2 )高活性、高毒性、高致敏性药品 (包括微量交叉污染即能引发健康风 险的药品,如青霉素类、细胞毒性药 品、性激素类)
3)无菌药品
4)生物制品
5)血液制品
6)生产工艺复杂的药品(指参数控 制的微小偏差即可造成产品不均一或 不符合质量标准的工艺,如长效或缓 释产品)
其他类别药品的生产应在2015年12 月31日前通过《药品生产质量管理规 范》(2010年修订)检查认证。
对骨干企业和实施情况难以把握的 企业,要组织现场调查和督导。
新版认证情况
(2011.3.1-2012.11)
1全国:接收259份申请,238次共200家现场检 查 196家认证通过
2我省:无菌药品生产企业10家 非无菌药品生产企业13家
二、新版认证重点关注
1 真实性 2 一致性 3 基于风险管理方法综合评定检查结
(一)只有一般缺陷,或者所有主要 和一般缺陷的整改情况证明企业能够 采取有效措施进行改正的,评定结果 为“符合”;
新版GMP认证通过药企汇总(共1186家次)

323家次序号受理号企业名称1GMP120081华润双鹤药业股份有限公司2GMP120194苏州第壹制药有限公司3GMP120195山东鲁抗医药股份有限公司4GMP120204黑龙江珍宝岛药业股份有限公司5GMP120207汕头市亚联药业有限公司6GMP120211哈药集团制药总厂7GMP120214黑龙江科伦制药有限公司8GMP120215湖南科伦制药有限公司9GMP120219宜昌三峡制药有限公司10GMP120239上海恒瑞医药有限公司11GMP120240上海长征富民金山制药有限公司12GMP120241山东金朗制药有限公司13GMP120242北京智博高科生物技术有限公司14GMP120247成都康华生物制品有限公司15GMP120248江苏恒瑞医药股份有限公司16GMP120252金陵药业股份有限公司南京金陵制药厂17GMP130002南京恒生制药有限公司18GMP130004宜昌人福药业有限责任公司19GMP130005石药银湖制药有限公司20GMP130008山东健民晁氏药业有限公司21GMP130009江苏吴中医药集团有限公司苏州中凯生物制药厂22GMP130012青岛首和金海制药有限公司23GMP130017河北天成药业股份有限公司1GMP120054江苏先声卫科生物制药有限公司2GMP120173武汉滨湖双鹤药业有限责任公司3GMP120179广东丹霞生物制药有限公司4GMP120189重庆福安药业集团庆余堂制药有限公司5GMP120196吉林省博大制药有限责任公司6GMP120197贵州科伦药业有限公司7GMP120199芜湖康奇制药有限公司8GMP120205广州白云山天心制药股份有限公司9GMP120206武汉生物制品研究所有限责任公司10GMP120208海南通用三洋药业有限公司11GMP120210国药一心制药有限公司12GMP120213扬子江药业集团四川海蓉药业有限公司13GMP120216常熟雷允上制药有限公司14GMP120218协和发酵麒麟(中国)制药有限公司15GMP120220江苏淮安双鹤药业有限责任公司16GMP120221武汉恒信源药业有限公司17GMP120226齐鲁天和惠世制药有限公司18GMP120227广东大冢制药有限公司19GMP120229贝朗医疗(苏州)有限公司20GMP120230唐山吉祥药业有限责任公司21GMP120231润泽制药(苏州)有限公司22GMP120232安徽丰原淮海制药有限公司23GMP120233安徽城市药业有限责任公司24GMP120234齐鲁制药(海南)有限公司25GMP120235苏州二叶制药有限公司26GMP120237江西青峰药业有限公司27GMP120243江西赣南海欣药业股份有限公司28GMP120253广东嘉博制药有限公司GMP120119山西晋新双鹤药业有限责任公司2GMP120150连云港杰瑞药业有限公司3GMP120161昆明积大制药股份有限公司4GMP120164阿斯利康制药有限公司5GMP120165天津红日药业股份有限公司6GMP120167昆明南疆制药有限公司7GMP120171浙江医药股份有限公司新昌制药厂8GMP120181北京民海生物科技有限公司9GMP120184济南利民制药有限责任公司10GMP120185长春金赛药业有限责任公司11GMP120187哈药集团中药二厂12GMP120188石药集团欧意药业有限公司13GMP120201浙江康莱特药业有限公司14GMP120238石家庄鹏海制药有限公司1GMP120101山东科伦药业有限公司2GMP120120武汉福星生物药业有限公司3GMP120123芜湖杨燕制药有限公司4GMP120131百正药业股份有限公司5GMP120133上海联合赛尔生物工程有限公司6GMP120137华瑞制药有限公司7GMP120139北京祥瑞生物制品有限公司8GMP120143哈高科白天鹅药业集团有限公司9GMP120144河南福森药业有限公司10GMP120145哈尔滨誉衡药业股份有限公司11GMP120146哈药集团生物工程有限公司12GMP120147天津天士力之骄药业有限公司13GMP120148安徽双鹤药业有限责任公司14GMP120149江苏恩华药业股份有限公司15GMP120151湖南五洲通药业有限责任公司16GMP120152常州金远药业制造有限公司17GMP120153浙江天元生物药业有限公司18GMP120154江苏奥赛康药业股份有限公司19GMP120155石家庄四药有限公司20GMP120156天津百特医疗用品有限公司21GMP120157佛山双鹤药业有限责任公司22GMP120158邯郸康业制药有限公司23GMP120159河南科伦药业有限公司24GMP120160锦州九泰药业有限责任公司25GMP120163浙江普康生物技术股份有限公司26GMP120166河北天成药业股份有限公司27GMP120168四川科伦药业股份有限公司28GMP120169江苏亚邦生缘药业有限公司29GMP120170成都圣诺生物制药有限公司30GMP120175南京正大天晴制药有限公司31GMP120176山东威高集团医用高分子制品股份有限公司32GMP120177青岛华仁药业股份有限公司33GMP120178海口市制药厂有限公司34GMP120180安徽环球药业股份有限公司35GMP120186上海市第一生化药业有限公司36GMP120191江苏恒瑞医药股份有限公司37GMP120192江苏豪森药业股份有限公司38GMP120193扬子江药业集团有限公司39GMP120198贵州天地药业有限责任公司40GMP120203上海丽珠制药有限公司1GMP120060西安京西双鹤药业有限公司2GMP120084北京凯因科技股份有限公司3GMP120088大连美罗大药厂4GMP120105正大青春宝药业有限公司5GMP120118丽珠集团丽珠制药厂6GMP120122山西振东制药股份有限公司7GMP120125辽宁成大生物股份有限公司8GMP120126多多药业有限公司9GMP120127大同长兴制药有限责任公司10GMP120129山东齐都药业有限公司11GMP120130长春祈健生物制品有限公司12GMP120132山东康宁药业有限公司13GMP120134山西诺成制药有限公司14GMP120135江苏正大天晴药业股份有限公司15GMP120136杭州民生药业有限公司16GMP120138辽宁海思科制药有限公司17GMP120140西藏林芝宇拓藏药有限责任公司18GMP120141华北制药股份有限公司1GMP120045深圳迈瑞生物医疗电子股份有限公司2GMP120085悦康药业集团有限公司3GMP120102山东罗欣药业股份有限公司4GMP120103安徽金蟾生化股份有限公司5GMP120104百泰生物药业有限公司6GMP120106上海凯宝药业股份有限公司7GMP120108山西仟源制药股份有限公司8GMP120109武汉生物制品研究所有限责任公司9GMP120110中国大冢制药有限公司10GMP120115常州四药制药有限公司11GMP120116神威药业集团有限公司1GMP120046宁波人健药业集团有限公司2GMP120078海南锦瑞制药股份有限公司3GMP120082上海旭东海普药业有限公司4GMP120094宜昌人福药业有限责任公司5GMP120095海南中玉药业有限公司6GMP120097成都康华生物制品有限公司7GMP120107扬子江药业集团南京海陵药业有限公司8GMP120112浙江京新药业股份有限公司9GMP120113厦门特宝生物工程股份有限公司10GMP120114上海复星长征医学科学有限公司11GMP120117山东绿叶制药有限公司12GMP120121哈尔滨三联药业有限公司13GMP120142河南科伦药业有限公司1GMP120035辽宁民康制药有限公司2GMP120037福州海王福药制药有限公司3GMP120059江苏恒瑞医药股份有限公司4GMP120061六安华源制药有限公司5GMP120062成都通德药业有限公司6GMP120065安徽双鹤药业有限责任公司7GMP120066浙江国镜药业有限公司8GMP120071浙江海正药业股份有限公司9GMP120073辰欣药业股份有限公司10GMP120075广州百特医疗用品有限公司11GMP120080山东威高药业有限公司12GMP120083北京四环科宝制药有限公司13GMP120089北京民海生物科技有限公司14GMP120090杭州普济医药技术开发有限公司15GMP120091江苏正大丰海制药有限公司16GMP120092齐鲁制药有限公司17GMP120093浙江亚太药业股份有限公司18GMP120096南京圣和药业有限公司19GMP120098长春长生生物科技股份有限公司20GMP120099石药集团欧意药业有限公司21GMP120100上海市第一生化药业有限公司1GMP120050河南科伦药业有限公司2GMP120053哈尔滨三联药业有限公司3GMP120067深圳市海滨制药有限公司4GMP120068上海创诺制药有限公司(原:上海希迪制药有限公司)5GMP120070辉瑞制药有限公司6GMP120072海南紫杉园制药有限公司7GMP120076华兰生物工程股份有限公司8GMP120077山东泰邦生物制品有限公司1GMP120034齐鲁制药有限公司2GMP120038蚌埠丰原涂山制药有限公司3GMP120040玉溪沃森生物技术有限公司4GMP120041玉溪沃森生物技术有限公司5GMP120069哈尔滨誉衡药业股份有限公司6GMP120074杭州澳亚生物技术有限公司1GMP120022科兴(大连)疫苗技术有限公司2GMP120023广东瑞昇药业有限公司3GMP120032海南海灵化学制药有限公司4GMP120039山西康宝生物制品股份有限公司5GMP120042天津天安药业股份有限公司6GMP120043武汉人福药业有限责任公司7GMP120048浙江天元生物药业有限公司8GMP120049深圳市中核海得威生物科技有限公司9GMP120051福建天泉药业股份有限公司10GMP120058石药集团中诺药业(石家庄)有限公司1GMP120010上海乔源生物制药有限公司2GMP120033扬子江药业集团四川海容药业有限公司3GMP120047湖北科伦药业有限公司4GMP120055江西博雅生物制药股份有限公司5GMP120056浙江华津依科生物制药有限责任公司6GMP120057海南斯达制药有限公司7GMP120064北京绿竹生物制药有限公司1GMP120024海南伊顺药业有限公司2GMP120025齐鲁制药(海南)有限公司3GMP120028瑞阳制药有限公司4GMP120029海南合瑞制药股份有限公司5GMP120030辽宁科泰生物基因制药股份有限公司6GMP120036深圳致君制药有限公司7GMP120044北京民海生物科技有限公司8GMP120052菏泽步长制药有限公司1GMP110069江苏安格药业有限公司2GMP110091上海长征富民药业铜陵有限公司3GMP120002厦门万泰沧海生物技术有限公司4GMP120008南阳利欣药业有限公司5GMP120012成都市海通药业有限公司6GMP120014山东北大高科华泰制药有限公司7GMP120016武汉滨湖双鹤药业有限责任公司8GMP120018辰欣药业股份有限公司9GMP120019辰欣药业股份有限公司10GMP120026郑州永和制药有限公司11GMP120031昆明南疆制药有限公司1GMP110145华兰生物工程重庆有限公司1GMP110155上海葛兰素史克生物制品有限公司2GMP120003华北制药股份有限公司3GMP120006北京绿竹生物制药有限公司4GMP120007湖南科伦制药有限公司5GMP120011通用电气药业(上海)有限公司6GMP120013安徽双鹤药业有限责任公司7GMP120017梅河口丰舜制药有限公司8GMP120020浙江万马药业有限公司9GMP120021南京正大天晴制药有限公司10GMP120027齐鲁天和惠世制药有限公司GMP110130西安汉丰药业有限责任公司2GMP110135上海赛伦生物技术有限公司3GMP110150沈阳神龙药业有限公司4GMP110153金陵药业股份有限公司福州梅峰制药厂5GMP110156福建省闽东力捷迅药业有限公司6GMP110157上海禾丰制药有限公司7GMP120005哈药集团生物工程有限公司8GMP120009丽珠集团丽珠制药厂1GMP110105焦作福瑞堂制药有限公司2GMP110132深圳立健药业有限公司3GMP110141石药集团百克(济南)生物制药有限公司4GMP110147石药集团远大(大连)制药有限公司5GMP110148梅河口丰声制药有限公司6GMP110149扬子江药业集团有限公司7GMP110151神威药业有限公司8GMP110152北京韩美药品有限公司9GMP110154江苏恒瑞医药股份有限公司10GMP120001深圳九新药业有限公司1GMP110106海南康芝药业股份有限公司2GMP110128河南天方药业股份有限公司3GMP110131石家庄四药有限公司4GMP110133上海华源安徽锦辉制药有限公司5GMP110138湖北荆江源制药股份有限公司6GMP110139湖南科伦制药有限公司7GMP110140贵州景峰注射剂有限公司8GMP110143江苏振国药业有限公司9GMP110146浙江海正药业股份有限公司1GMP110099宜昌人福药业有限责任公司2GMP110119石药集团欧意药业有限公司3GMP110120杭州澳亚生物技术有限公司4GMP110121无锡台裕制药有限公司5GMP110122原子高科股份有限公司6GMP110137邯郸市拥军制药有限公司7GMP110136黑龙江哈尔滨医大药业有限公司8GMP110142广州白云山天心制药股份有限公司9GMP110144*广州白云山制药股份有限公司广州白云山制药总厂1GMP110067深圳塞诺菲巴斯德生物制品有限公司2GMP110107北京托毕西药业有限公司3GMP110111甘肃大得利制药有限公司4GMP110113成都蓉生药业有限责任公司5GMP110123石药银湖制药有限公司6GMP110124哈药集团生物工程有限公司7GMP110125深圳华药南方制药有限公司8GMP110126江苏奥赛康药业股份有限公司1GMP110078湖南康源制药有限公司2GMP110090陕西宏府怡悦制药有限公司3GMP110097武汉福星生物药业有限公司4GMP110102山东齐都药业有限公司5GMP110110四川科伦药业股份有限公司6GMP110112齐鲁制药有限公司7GMP110134郑州永和制药有限公司8GMP110127*广东倍康制药有限公司1GMP110098江苏恒瑞医药股份有限公司2GMP110101通化万生联合制药有限公司3GMP110104吉林省西点药业科技发展股份有限公司4GMP110108大连天宇制药有限公司5GMP110109辽宁诺维诺制药有限公司6GMP110115苏州天马医药集团天吉生物制药有限公司7GMP110117扬子江药业集团有限公司8GMP110118石药集团中奇制药技术(石家庄)有限公司1GMP110082山西康源堂生物科技有限公司2GMP110084大连美罗大药厂3GMP110100吉林敖东药业集团延吉股份有限公司4GMP110116昆明制药集团股份有限公司5GMP110095*北京协和药厂1GMP110088华北制药股份有限公司2GMP110089广东天普生化医药股份有限公司3GMP110093河南福森药业有限公司4GMP110096深圳万乐药业有限公司5GMP110103上海凯宝药业股份有限公司1GMP110076海南合瑞制药股份有限公司2GMP110083成都生物制品研究所3GMP110086河南太龙药业股份有限公司4GMP110087成都苑东药业有限公司1GMP110092石药银湖制药有限公司2GMP110085上海天士力药业有限公司3GMP110081华兰生物疫苗有限公司4GMP110080华兰生物疫苗有限公司5GMP110079山西仟源制药股份有限公司6GMP110077上海中信国健药业股份有限公司7GMP110075辽宁药联制药有限公司1GMP110061深圳市天道医药有限公司2GMP110065开开援生制药股份有限公司3GMP110066河南华利制药股份有限公司4GMP110072华北制药河北华民药业有限责任公司5GMP110074武汉普生制药有限公司1GMP110057武汉生物制品研究所2GMP110058齐鲁制药有限公司3GMP110059南昌立健药业有限公司4GMP110060江苏恒瑞医药股份有限公司5GMP110062江苏正大天晴药业股份有限公司6GMP110063广东星昊药业有限公司7GMP110064上海赛金生物医药有限公司8GMP110068北京泰德制药股份有限公司认证范围现场检查时间大容量注射剂(玻璃输液瓶、多层共挤输液袋ACDEF2012年08月18日-08月22日线)、小容量注射剂冻干粉针剂、粉针剂2013年01月10日-01月14日粉针剂(105车间、青霉素类206车间、头孢菌素类2042013年01月22日-01月26日车间)小容量注射剂(含中药提取)2013年01月10日-01月13日大容量注射剂2013年01月10日-01月13日粉针剂(头孢菌素类)2013年01月15日-01月18日大容量注射剂2013年01月16日-01月19日大容量注射剂(多层共挤输液用袋、玻璃输液瓶)2013年01月15日-01月18日大容量注射剂(玻瓶生产线、软袋生产线、塑瓶生产线2013年01月15日-01月18日各一条)冻干粉针剂2013年01月24日-01月27日大容量注射剂,冲洗剂(腹膜透析液、冲洗液用聚氯2013年01月16日-01月19日乙烯塑料袋)大容量注射剂(含多层共挤膜软袋)2013年01月18日-01月21日放射性药品(体内植入剂,密封源)2013年01月15日-01月17日疫苗【冻干人用狂犬疫苗(人二倍体细胞)】2013年01月10日-01月13日小容量注射剂(抗肿瘤药、非最终灭菌)、冻干粉针2013年01月22日-01月24日剂(抗肿瘤药)小容量注射剂[(非最终灭菌产品(含激素类)、最终2013年01月22日-01月26日灭菌产品(含中药前处理及提取)]小容量注射剂2013年01月27日-01月30日小容量注射剂(一线)2013年01月19日-01月22日大容量注射剂(聚丙烯输液瓶、三层共挤输液用2013年01月22日-01月25日袋),小容量注射剂四线、五线(含中药提取)小容量注射剂(含中药提取)2013年01月22日-01月25日重组人粒细胞刺激因子注射液(小容量注射剂)2013年01月28日-01月31日大容量注射剂2013年01月22日-01月26日大容量注射剂(聚丙烯输液瓶一线、聚丙烯输液瓶二线、共挤膜输液袋线、玻璃输液瓶第三条生产线)、2013年01月31日-02月03日冲洗剂(聚丙烯输液瓶一线、聚丙烯输液瓶二线、共挤膜输液袋线、玻璃输液瓶第三条生产线)疫苗(流感病毒裂解疫苗小容量注射剂)2012年10月24日 - 10月28日大容量注射剂(聚丙烯输液瓶)2012年12月12日 - 12月16日血液制品:人血白蛋白人免疫球蛋白2012年12月23日 - 12月27日粉针剂(头孢菌素类)(Z5车间)2013年01月10日 - 01月13日小容量注射剂2013年01月15日 - 01月18日大容量注射剂(C线、D线)2013年01月10日 - 01月13日小容量注射剂I车间(非最终灭菌)2013年01月15日 - 01月18日小容量注射剂(含激素类)2013年01月10日 - 01月14日A群脑膜炎球菌多糖疫苗(注射剂),伤寒Vi多糖疫2013年01月10日 - 01月14日苗(注射剂),吸附无细胞百白破联合疫苗(注射剂,西林瓶),注射用磷酸盐缓冲盐水(注射剂)粉针剂(青霉素类)2013年01月10日 - 01月13日冻干粉针剂、小容量注射剂(非最终灭菌)2013年01月10日 - 01月14日小容量注射剂2013年01月14日 - 01月17日小容量注射剂、大容量注射剂、含中药提取及前处理2013年01月15日 - 01月19日生物工程产品(重组人粒细胞刺激因子注射液);进口2013年01月15日 - 01月19日药品分包装(小容量注射剂、生物工程产品)大容量注射剂(B、C线)(聚丙烯输液瓶)2013年01月15日 - 01月18日小容量注射剂2013年01月10日 - 01月13日冻干粉针剂 (青霉素类、六车间)2013年01月14日 - 01月17日大容量注射剂(塑料输液瓶、冲洗剂)生产线1、大2013年01月15日 - 01月19日容量注射剂(多层共挤输液用袋)大容量注射剂(直立式低密度聚乙烯输液袋)2013年01月10日 - 01月12日大容量注射剂(三层共挤膜输液袋)2013年01月14日 - 01月17日粉针剂(青霉素类)2013年01月10日 - 01月13日大容量注射剂[聚丙烯输液瓶,聚丙烯共混输液袋(直2013年01月14日 - 01月17日立式)]冻干粉针剂2013年01月10日 - 01月13日小容量注射剂(抗肿瘤类、非最终灭菌)、冻干粉针2013年01月14日 - 01月18日剂(抗肿瘤类)粉针剂(青霉素类,206)、粉针剂(头孢菌素类,2013年01月14日 - 01月17日202)、冻干粉针剂(203)小容量注射剂(B线)(非最终灭菌、含中药提取)2013年01月10日 - 01月13日小容量注射剂(B线)(非最终灭菌)2013年01月14日 - 01月17日小容量注射剂2013年01月15日 - 01月18日小容量注射剂[一车间(含激素类)、二车间(含中药2012年10月26日-10月30日提取)]冻干粉针剂(抗肿瘤药)2012年12月17日-12月21日小容量注射剂[激素类(非最终灭菌)]、粉针剂(头孢2012年12月17日-12月21日菌素类)、冻干粉针剂冻干粉针剂2012年12月12日-12月16日小容量注射剂[非最终灭菌中药制剂生产线(含中药提2012年12月21日-12月25日取)]大容量注射剂(直立式聚丙烯输液袋)2012年11月22日-11月26日大容量注射剂(软袋、玻璃瓶)2012年12月12日-12月16日生物制品(麻疹风疹联合减毒活疫苗,注射剂)2012年12月23日-12月27日小容量注射剂(最终灭菌1号线,非最终灭菌2号线)2012年12月12日-12月16日生物制品(注射用重组人生长激素,冻干粉针剂;重2012年12月23日-12月27日组人粒细胞刺激因子注射液,小容量注射剂)粉针剂、冻干粉针剂(含中药提取)2012年12月12日-12月16日小容量注射剂[四车间(含激素类)]2012年12月17日-12月21日大容量注射剂2013年01月10日-01月13日大容量注射剂[102车间(聚丙烯输液瓶)]2013年01月10日-01月13日大容量注射剂(聚丙烯共混输液袋B、C、D线)2012年10月26日-10月30日大容量注射剂2012年11月03日-11月07日小容量注射剂(中药)2012年11月03日-11月07日大容量注射剂、小容量注射剂、(含激素类)2012年11月03日-11月07日注射用重组人生长激素[(冻干粉针剂)Ⅲ车间]2012年11月03日-11月07日冻干粉针剂、小容量注射剂(含一条改扩建生产线)、大容量注射剂、西安外租中转库(面积:400平方2012年11月03日-11月07日米;地址:西安市东元路7号)结核菌素纯蛋白衍生物(注射剂)2012年11月03日-11月07日冻干粉针剂2012年11月03日-11月07日小容量注射剂一车间(含中药提取)2012年11月22日-11月26日冻干粉针剂(108车间)2012年11月22日-11月26日小容量注射剂、冻干粉针剂、重组人促红素注射液2012年11月22日-11月26日(CHO细胞)冻干粉针剂2012年11月22日-11月26日大容量注射剂(聚丙烯输液瓶,G、Q、D、T线)2012年11月22日-11月26日小容量注射剂2012年11月22日-11月26日冻干粉针剂2012年11月22日-11月26日小容量注射剂(抗肿瘤药)2012年11月22日-11月26日疫苗【A群C群脑膜炎球菌多糖疫苗(冻干粉针剂);2012年11月22日-11月26日ACYW135群脑膜炎球菌多糖疫苗(冻干粉针剂)】小容量注射剂(201车间),冻干粉针剂(101车间)2012年11月23日-11月27日大容量注射剂(聚丙烯输液瓶)2012年11月22日-11月26日大容量注射剂(3、4号线)2012年11月22日-11月24日大容量注射剂(A、C、D线)2012年12月12日-12月16日小容量注射剂、人胎盘组织液2012年11月22日-11月26日大容量注射剂(聚丙烯输液瓶,A、B、C线)2012年11月22日-11月26日冻干粉针剂2012年11月22日-11月26日冻干甲型肝炎减毒活疫苗(冻干粉针剂)2012年11月22日-11月26日小容量注射剂(玻璃安瓿,三分厂一车间)2012年11月22日-11月26日大容量注射剂(多层共挤输液袋)(D、P、R线)2012年11月22日-11月26日大容量注射剂(含多层共挤输液袋)2012年12月12日-12月16日小容量注射剂2012年11月22日-11月26日大容量注射剂(非PVC多层共挤膜)2012年11月26日-11月30日大容量注射剂(含血液保养液)2012年12月12日-12月16日大容量注射剂[非PVC软袋,三、四(2154线)、五车2012年12月12日-12月16日间]、冲洗剂(2154线)C01粉针剂、C10粉针剂(头孢菌素类)2012年12月12日-12月16日大容量注射剂(聚丙烯输液瓶,A、B线)2012年12月12日-12月16日小容量注射剂(非最终灭菌)2012年12月12日-12月16日小容量注射剂(最终灭菌)、冻干粉针剂、小容量注射2012年12月18日-12月21日剂(非最终灭菌)大容量注射剂2012年12月18日-12月22日冻干粉针剂、粉针剂(头孢菌素类)2012年12月17日-12月21日大容量注射剂(聚丙烯输液瓶H线)2012年12月17日-12月21日小容量注射剂(非最终灭菌)2012年12月17日-12月21日大容量注射剂(多层共挤输液袋)2012年06月15日 - 06月19日小容量注射剂2012年08月18日 - 08月22日冻干粉针剂2012年11月03日 - 11月07日非最终灭菌小容量注射剂(含中药提取)2012年09月21日 - 09月25日冻干粉针剂(激素类)、粉针剂2012年10月26日 - 10月30日小容量注射剂(含中药提取)2012年10月26日 - 10月30日人用狂犬病疫苗(Vero细胞);冻干人用狂犬病疫苗2012年11月03日 - 11月07日(Vero细胞)小容量注射剂三车间(含中药提取)2012年11月03日 - 11月08日小容量注射剂2012年10月26日 - 10月30日大容量注射剂(聚丙烯输液瓶205车间)2012年11月03日 - 11月07日水痘减毒活疫苗、麻疹减毒活疫苗2012年11月03日 - 11月07日大容量注射剂2012年11月03日 - 11月07日大容量注射剂(聚丙烯瓶,输液一车间)2012年10月26日 - 10月30日冻干粉针剂(抗肿瘤药)2012年11月03日 - 11月07日大容量注射剂(多层共挤输液袋)2012年11月03日 - 11月07日大容量注射剂(101车间)2012年10月24日 - 10月29日丸剂、散剂2012年10月21日 - 10月25日粉针剂(青霉素类,114车间5-8楼)2012年11月03日 - 11月07日体外诊断试剂(乙型肝炎病毒表面抗原诊断试剂盒(酶联免疫法)、人类免疫缺陷病毒抗体诊断试剂盒(酶联免疫法)、丙型肝炎病毒抗体诊断试剂盒(酶联免疫法))2012年05月21日 - 05月25日粉针剂(头孢菌素类)六车间2012年08月18日 - 08月22日粉针剂(头孢菌素类)1301、冻干粉针剂(抗肿瘤类)15012012年09月21日 - 09月25日小容量注射剂 (含中药提取)2012年09月21日 - 09月25日生物工程产品(尼妥珠单抗注射液)2012年09月21日 - 09月25日小容量注射剂(含中药提取)2012年09月21日 - 09月25日粉针剂(青霉素类)2012年09月21日 - 09月25日乙型脑炎减毒活疫苗(注射剂)、吸附无细胞百白破联合疫苗(注射剂、安瓿)、吸附百白破联合疫苗(注射剂)、吸附白喉破伤风联合疫苗(注射剂)、吸附破伤风疫苗(注射剂)、吸附白喉疫苗(注射剂)、钩端螺旋体疫苗(注射剂)2012年09月21日 - 09月25日大容量注射剂、冲洗剂、小容量注射剂2012年09月21日 - 09月25日冻干粉针剂(含激素类)、小容量注射剂(含非最终灭菌)2012年09月21日 - 09月25日非最终灭菌小容量注射剂(含中药提取车间);小容量注射剂2012年09月21日 - 09月26日小容量注射剂2012年05月21日-05月25日冻干粉针剂(抗肿瘤药)2012年08月18日-08月22日小容量注射剂(最终灭菌1-7号线,非最终灭菌8号线)2012年09月21日-09月25日小容量注射剂2012年08月25日-08月29日冻干粉针剂2012年08月25日-08月29日ACYW135群脑膜炎球菌多糖疫苗(冻干粉针剂)2012年08月25日-08月29日大容量注射剂(不含F0值<8品种)、小容量注射剂2012年09月14日-09月20日地衣芽孢杆菌活菌胶囊2012年09月21日-09月25日生物制品[注射用重组人粒细胞巨噬细胞刺激因子(冻干粉针剂)、注射用重组人白细胞介素-11(冻干粉针剂)、重组人粒细胞刺激因子注射液(小容量注射剂)]2012年09月21日-09月25日体外诊断试剂【丙型肝炎病毒抗体诊断试剂盒(酶联免疫法)、乙型肝炎病毒表面抗原诊断试剂盒(酶联免疫法)2012年09月21日-09月24日冻干粉针剂2012年09月21日-09月25日大容量注射剂(聚丙烯输液瓶、多层共挤膜输液用袋)2012年05月21日-05月25日大容量注射剂2012年05月21日-05月25日大容量注射剂(聚丙烯输液瓶)2012年05月21日-05月25日大容量注射剂(三层共挤输液用袋、五层共挤输液用袋)2012年05月15日-05月19日大容量注射剂(多层共挤输液袋)2012年06月14日-06月18日大容量注射剂(聚丙烯输液瓶)2012年06月15日-06月19日冻干粉针剂2012年06月15日-06月19日大容量注射剂(多层共挤输液袋、聚丙烯输液瓶)生2012年06月15日-06月19日产线(N线、F、J线)大容量注射剂(聚丙烯输液瓶、直立式聚丙烯输液袋)2012年06月15日-06月19日冻干粉针剂2012年07月23日-07月29日小容量注射剂(106车间),大容量注射剂(201车2012年07月14日-07月18日间,玻璃输液瓶)大容量注射剂(4号、5号线)2012年07月14日-07月18日大容量注射剂(三层共挤输液用袋)2012年08月18日-08月22日冻干粉针剂2012年08月25日-08月29日生物制品(无细胞百白破b型流感嗜血杆菌联合疫苗,2012年08月18日-08月22日小容量注射剂)生物制品(猪源纤维蛋白粘合剂)2012年08月18日-08月22日大容量注射剂(含多层共挤膜输液袋)2012年08月18日-08月22日济南市高新区新泺大街317号:小容量注射剂(含抗肿瘤类)济南市工业北路243号:冻干粉针剂、小容量注2012年08月18日-08月22日射剂、冻干粉针剂(抗肿瘤类)、粉针剂(抗肿瘤类)、小容量注射剂(抗肿瘤类)冻干粉针剂2012年08月18日-08月22日冻干粉针剂、大容量注射剂2012年08月25日-08月29日疫苗:冻干人用狂犬病疫苗(Vero细胞)(注射剂)2012年08月25日-08月29日、A群C群脑膜炎球菌多糖疫苗(注射剂)冻干粉针剂(开发区新建十一车间)2012年08月25日-08月29日冻干粉针剂、小容量注射剂2012年08月25日-08月29日小容量注射剂(含激素类)2012年05月21日-05月25日大容量注射剂(310玻璃输液瓶车间)2012年05月21日-05月25日粉针剂2012年07月14日-07月18日小容量注射剂(抗肿瘤药)2012年07月14日-07月18日粉针剂(头孢菌素类)2012年07月14日-07月18日小容量注射剂(非最终灭菌抗肿瘤类)2012年07月14日-07月18日生物制品(血液制品)[人血白蛋白、静注人免疫球蛋白(pH4)、人免疫球蛋白、破伤风人免疫球蛋白、2012年07月14日-07月18日乙型肝炎人免疫球蛋白、狂犬病人免疫球蛋白、人凝血酶原复合物、人凝血因子Ⅷ、人纤维蛋白原、外用冻干人凝血酶,外科用冻干人纤维蛋白胶]生物制品(人凝血因子Ⅷ、冻干注射剂)2012年07月14日-07月18日济南市高新区新泺大街317号:粉针剂、小容量注射剂(非最终灭菌);济南市历城区董家镇849号:重组人2012年05月21日 - 05月25日粒细胞刺激因子注射液(安瓿包装、预装式注射器包装)、注射用重组人白介素-11粉针剂(头孢菌素类)2012年05月15日 - 05月19日疫苗(A群C群脑膜炎球菌多糖疫苗)疫苗 (ACYW135群2012年05月21日 - 05月25日脑膜炎球菌多糖疫苗)分包装中心(b型流感嗜血杆菌结合疫苗,冻干A、C2012年05月21日 - 05月25日群脑膜炎球菌多糖结合疫苗,A群C群脑膜炎球菌多糖疫苗,ACYW135群脑膜炎球菌多糖疫苗)小容量注射剂2012年07月14日 - 07月18日冻干粉针剂2012年07月14日 - 07月18日。
药品GMP认证检查评定标准

药品GMP认证检查评定标准一、药品GMP认证反省项目共266项,其中关键项目〔条款号前加〝*〞〕101项,普通项目165项。
二、药品GMP认证反省时,应依据央求认证的范围确定相应的反省项目,并停止片面反省和评定。
三、反省中发现不契合要求的项目统称缺陷项目,其中关键项目不契合要求者称为严重缺陷,普通项目不契合要求者称为普通缺陷。
四、发现的缺陷,假设在央求认证的各剂型或产品中均存在,应按剂型或产品区分计算。
五、在反省进程中,发现企业隐瞒有关状况或提供虚伪资料的,按严重缺陷处置。
反省组应调查取证,详细记载。
六、结果评定〔一〕未发现缺陷的,经过药品GMP认证。
〔二〕未发现严重缺陷,且普通缺陷≤10项,企业矫正并经所在地省级药品监视管理部门反省确认后,方可经过药品GMP认证。
省级药品监视管理部门应出具反省确认报告,并附企业缺陷矫正状况或说明。
〔三〕发现严重缺陷或普通缺陷≥11项的,不予经过药品GMP认证。
药品GMP认证反省项目«药品GMP认证反省评定规范»修订说明一、为完善药品GMP认证反省制度,依据«药品管理法»规则及«药品消费质量管理规范»〔1998年修订〕,国度局于1999年11月印发了«药品GMP认证反省评定规范〔试行〕»。
药品GMP认证反省评定规范,是药品监视管理部门对药品消费企业停止GMP认证现场反省和认证审批的评定规范。
二、«药品GMP认证反省评定规范〔试行〕»于1999年11月9日发布试行,迄今已近8年,为了更好地顺应以后药品监管的情势需求,进一步提高药品GMP认证质量,需对«药品GMP认证反省评定规范»停止修订。
三、国度局药品平安监管司从2006年末尾组织有关单位和专家,对«药品GMP认证反省评定规范»停止修订,并于2006年9月30日发布征求意见稿。
小药说药生物制剂篇-疫苗

小药说药生物制剂篇-疫苗自新冠肺炎暴发以来,疫情的“防”和“治”一直是全球的焦点,而疫苗一直被认为是病毒防控最有效、最实用的措施。
正因如此,才有了前一阵子美国总统特朗普与美国国立卫生研究院(NIH)下属过敏与传染病研究所所长托尼·福西博士的一段对话:特朗普表示:“我更希望听到的是几个月。
”托尼·福西反复强调:“至少需要1年!”这段对话遭到众多网友吐槽,但却反映了一个真实的问题:很多人对疫苗的研发、生产、上市过程并不了解,认为这是一蹴而就的过程。
今天,小药就来和大家聊一聊关于疫苗的那些事儿。
疫苗的历史疫苗这个概念的雏形,最早可以追溯到中国古代“以毒攻毒”的记载,在与疫病作斗争的过程中,人们发现可以通过有限度的主动感染方式,使人体对某种传染病产生特异性免疫功能,从而避免疫病的发生。
这种治疗思想在中国最早的医学著作《黄帝内经》中就有阐述。
最早的文字记载出现在东晋葛洪所著的《肘后方》中,该书又名《肘后备急方》,是中国第一部临床急救手册,书中记述了一种治疗狂犬咬伤的方法,即“治卒有猘犬凡所咬毒方”有云:“仍杀所咬犬,取脑傅之,后不复发。
”也就是说,将咬人的狂犬杀死,将其脑捣碎成浆,敷于患处可以治疗狂犬病。
当然这种近似于神秘主义的方法在后来的实践中鲜有奏效,但其做法却无意中契合了疫苗的原理。
对这种理念成功的应用,应该出现在人们对“天花”这种疾病的抗争中。
在古代的各类传染病中,天花是一种令人谈虎色变的病种,它是由感染天花病毒后引起的,感染后会出现严重的寒战、高热、乏力、头痛、四肢及腰背部酸痛等症状,皮肤上成批地依次出现斑疹、丘疹、疱疹、脓疱等,有较高的致死率。
针对天花,人们逐渐探索出了接种“人痘”来阻止其传染的手段。
所谓“人痘”,就是用人所感染的天花病毒为材料,主动地让未感染的人接触这种毒素,以达到产生天花病毒抗原体的目的。
在明末清初,中国很多医生为儿童接种人痘。
分为两种方法,其一是将天花病人穿过的衣服给儿童穿,其二是将天花病人的痘痂风干研成粉末,用小管吹入儿童鼻孔。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
新版GMP认证数据(疫苗篇)
——GMP行业新闻
疫苗受影响大于血液制品,其批签发量下降幅度较大。
《药品生产质量管理规范(2010年修订)》(新版GMP)自2010年10月19日经卫生部部务会议审议通过,2011年3月1日起施行。
无论是在生产设备、技术要求还是人员管理方面,与1998年版GMP相比,新版GMP都有相当大的改进。
两个“最后期限”
新版GMP有两个“最后期限”,分别对应生产无菌药品企业的2013年12月31日与生产其他类别药品企业的2015年12月31日。
也就是说,今年12月31日,将会是新版GMP认证的“大限”。
届时,未达到新版GMP要求的企业将不得继续生产药品。
从1988年国家卫生部颁布中国第一部《药品生产质量管理规范》(1988年版)开始,此后的27年间,一系列GMP规范与执行工作影响着中国几千家制药企业的发展与命运。
2004年之前,GMP认证并不属于强制执行,企业通过GMP认证的积极性并不高,GMP发证数量处于平稳偏低状态。
直至CFDA表示从2004年7月1日起,未取得药品制剂或原料药GMP证书的生产企业将撤销《药品生产许可证》或禁止生产相应剂型的药品,同时撤销相应药品的生产批准文号,并责令其停止生产,GMP认证由此转变为强制认证。
因而,GMP发证数量在2004年呈现爆发式增长,该年GMP发证数量与2003年相比增长了134.15%。
其后趋于平稳。
疫苗批签发量降幅较大
对于疫苗和血液制品企业来说,其在2013年12月31日前生产的产品可继续销售;2013年12月31日前已完成最终包装但尚未完成检验的产品,可继续进行检验,合格后方可销售;2014年1月1日起,未达到新版GMP要求的血液制品、疫苗、注射剂等无菌药品的生产企业将一律停止生产。
米内网中国生物制品批签发数据库显示:2008~2013年,国内企业生物制品批签发数量一直处于平稳上升趋势。
受新版GMP政策影响,部分未达到新版GMP标准的无菌药品生产企业于2014年停产,其国产疫苗及血液制品批签发量有所下降。
疫苗受到的影响大于血液制品,其批签发量下降幅度大于血液制品。
本文选取了在国产疫苗总体批签发数量中占较大份额的乙肝疫苗和流感疫苗进行对比分析。
乙肝疫苗批签发量变化
米内网中国生物制品批签发数据库显示,2013年1月至2014年12月期间,乙肝疫苗总体批签发量呈现逐步减少的趋势,2013年乙肝疫苗总体批签发量明显高于2014年。
2013年,乙肝疫苗生产企业中仅有华北制药金坦生物技术股份有限公司与华兰生物疫苗有限公司通过了新版GMP认证。
而2014年间,则有深圳康泰生物制品股份有限公司、北京天坛生物制品股份有限公司以及大连汉信生物制药有限公司3家生产企业通过了新版GMP认证。
本文分别选取了2013年乙肝疫苗生产线
通过新版GMP认证的华兰生物疫苗有限公司以及在2014年通过新版GMP认证的大连汉信生物制药有限公司进行分析。
大连汉信生物制药有限公司姚姓副总表示,公司从2013年11月下旬开始停产疫苗,进行生产车间装修、改造,以迎接2010年版GMP验证。
据米内网中国生物制品批签发数据库数据,2013、2014两年间,大连汉信生物制药有限公司乙肝疫苗批签发量全部集中在2013年2月至2014年1月期间。
而华兰生物疫苗有限公司在2013年9月30日通过了乙肝疫苗生产线新版GMP认证。
米内网中国生物制品批签发数据库数据显示,华兰生物疫苗有限公司2013年乙肝疫苗批签发量主要集中在2013年1月至2013年4月期间。
其后直至2014年1月才重新开始了乙肝疫苗的批签发检验。
流感疫苗批签发量分析
流感疫苗中,2013年总体批签发量略高于2014年。
其中峰值出现在2013年9月,受长春生物制品研究所2013年4月17日通过2010年版GMP认证并投入生产的影响,2013年9月份流感疫苗批签发量中,长春生物制品研究所占据了最大份额。
本文选取了2013年12月30日通过流感疫苗生产线2010年版GMP认证的大连雅立峰生物制药有限公司以及2014年3月6日通过的兰州生物制品研究所2013年至2014年期间流感疫苗批签发量进行分析。
两家企业的流感疫苗批签发量趋势相差不大,主要集中在2013年8月至2013年11月以及2014年6月至2014年9月这两个时期。
主要受到两家企业停产准备生产车间升级以迎接新版GMP认证以及通过认证后重新投入生产两方面的影响。
监管方式变革值得期待
保证消费者用药安全有效,使药品生产企业有法可依、有章可循是GMP认证的主要目的。
在2014年11月举行的第26届全国医药经济信息发布会上,CFDA法制司吴莉雅作的题为《药品管理法修订情况介绍》的报告中提及,新的药品监管思路将会在原有监管方式上进行改进。
新药品监管方式会将GMP和GSP认证制度和药品企业准入标准以及日常生产、经营行为的监管结合起来。
减少审批监管,加强日常监督检查力度,并加大飞行检查的密度和力度。
从以上药品监管方式的转变来看,CFDA正试图通过结合《药品管理法》的修订,以实现从以往重审批、轻监管的管理模式过渡到高强度、有实效的日常监管模式。
此举将有利于引导医药行业更健康的发展。
可见,2015年CFDA监管模式或将变革,GMP认证或将取消。
随着新版GMP的不断更新,配套纯化水也应该满足相应要求,如需最新技术,欢迎来电索取。
如果您有更多的疑问,王晓强愿意为您解答,您可以及时与我联系,电话:17001215999,QQ:17001215999。
标注:发布时请加上原创作者名称“王晓强”,否则视为侵权。
