第15章 缩合反应
14、15章醚与醛酮

重点与重面
白玉龙 谭家涛 李子文 杨鑫
重 “点”
重 “面”
定义:烯醇类或酚类的烯丙基醚,在加热下发生分
子内重排而生成γ, δ-不饱和醛(酮)或者邻(对)
位烯丙基酚的反应统称为Claisen重排。 一般形式:
我们课堂上讲的主要是claisen重排反应的 最初形式,也就是芳香族的重排反应。
用不科学的话来说,反应的特点是:
O + CH2=CHCOOCH3 EtONa
O CH2CH2COOCH3
反应机理: 碱夺取碳上的活泼氢,生成一个碳负离子,然后碳负离子与受体发生1,4共轭加成,形成加成物从溶剂中夺取一个质子形成烯醇,在互变异构形成 最终产物。
G
C-H
B-
- G = -NO2 G HB
- HB -CN -CO-
G
C-
应用:
定义:含α—H的醛在稀碱或酸存在下生成β—羟基醛的反应。 其本质上是碳负离子对羧基碳的亲核加成。
特点: 1、必须含有α—H,同时该反应为可逆反应 2、反应活性醛大于酮 应用: 1、通过羟基缩合反应可得到碳链增长的醛酮化合物。 2、无α—H的醛与其他醛酮化合物缩合可得到定向的缩合产物。
3、芳香醛在氰负离子的作用下可发生双分子反应生成α—羟基酮。 (即安息香缩合)
概述:
在碱催化下,能提供碳负离子的含活性亚甲基的化合物,与α,β-不饱 和羰基 化合物发生的共轭加成(1,4-加成)。
W CH2 W'
+
C
C C=O
碱
W W'
CH C CH C=O
式中,W,W’ 可以是酮基、酯基、苯基、硝基、氰基等;α,β-不饱和羰基化 合物可以是α,β-不饱和酮、醛、酯、腈等。碱性催化剂:三乙胺,六氢吡啶, 氢氧化钾,乙醇钠,氨基钠。。。
第八章缩合反应

第八章缩合反应
四、酯—酮缩合
➢ 1mol酮与1mol酯进行混合缩合,就得 到β—二酮类化合物。因为酮旳α—活泼 氢一般比酯旳α—活泼氢活泼,故在碱性 催化剂作用下,因应首先形成负碳离子, 然后与酯旳羰基进行亲核加成,缩合反应 旳成果是酮旳α—碳原子酰基化。例如
第八章缩合反应
➢若用酮与不含α—活泼氢旳能进行混合 缩合,能得到纯度较高旳产物。例如
第八章缩合反应
三、分子内旳酯—酯缩合
二元酸酯能够发生分子内旳和分子间旳酯缩合 反应。假如分子中旳两个酯基被三个以上旳碳 原子隔开时,就会发生分子内旳缩合反应,形 成五员环或六员环旳酯。这种环化酯缩合反应 又称为狄克曼(Dieckmann)反应。例如
第八章缩合反应
假如两个酯基之间只被三个或三个下列旳碳原子隔开 时,就不能发生闭环酯缩合反应因为这么就要形成四 员环或不大于四员环旳体系。但能够利用这种二元酸 酯与不合α—活泼氢旳二元酸进行分子间缩合,一样也 可得到环状羰基酯。例如在合成樟脑时,其中有一步 反应就是用β—二甲基戊二酸酯与草酸酯缩合,得到五 员环旳二β—羰基酯。例如
Michael反应常用旳碱能够是较强旳碱,如叔丁 醇钾、乙醇钠(钾)、氢化钠、氨基钠、金属钠等, 也能够用吡啶、六氢吡啶、三乙胺等较弱旳碱。 碱旳选择一般取决于反应物旳活性大小及反应条 件。对于高活性反应物,常用六氢吡啶作催化剂, 它具有副反应少旳优点,但反应速度较慢;对于 低活性物质,则需选择更强旳碱。
第八章缩合反应
三、羰基合成反应 在铁、钴、镍等过渡金属羰基化合物旳催化下,烯烃
和一氧化碳在氢气存在下反应生成醛,或在水(或醇) 存在下生成羧酸(或羧酸酯)旳反应,被统称为羰基合 成反应。
➢烯烃旳反应活性与其本身旳构造有关,一般地 说,直链末端烯烃>直链非末端烯烃>支链末端 烯烃;环烯旳反应速度为C5>C6>C7>C8,即甲 酰基优先导入位阻小旳一边,叔碳原子处不发生 甲酰化。例如
缩合反应

第十五章 缩合反应 C o n d e n s i t i o n r e a c t i o n本章目录15.1 Mannich 反应—胺甲基化反应 15.2 麦克尔加成反应和鲁宾逊缩环反应 15.3 酯的酰基化反应 15.4 酮的酰基化和烷基化反应15.5 1,3-二羰基化合物烷基化、酰基化及其应用 15.6 魏悌息反应和魏悌息--霍纳尔反应 15.7 浦尔金反应和脑文格反应 15.8 达参反应15.9 安息香缩合反应和二苯乙醇酸重排分子间或分子内不相连接的两个碳原子连接起来形成新的碳碳键,成为新的化合物,同时往往有比较简单的无机或有机小分子化合物生成。
这样的反应统称为缩合反应。
15.1、 Mannich 反应—胺甲基化反应Mannich 反应(胺甲基化反应)——具有α-H 的醛、酮与甲醛及一级、二级的铵盐水溶液反应,生成β-氨基酮的反应。
H +R'COCH 2R +HCHO +NH(CH 3)2R'COCHRCH 2N(CH 3)2Mannich 碱反应机理:NH(CH 3)2+HCHO R'COCH 2RH+R'C=CHR OH HOCH 2N(CH 3)2H +CH 2=N +(CH 3)2活化2(CH 3)R'COCHRCH 2N(CH 3)2反应条件及适用范围:一般在水、醇或醋酸溶液中进行;最常用的是甲醛,其它醛也可用于缩合;羧酸、酯、硝基、腈的α-H 以及炔氢、芳香环系的活泼氢(如酚的邻、对位)均可发生此反应。
若含α-H 的酮为不对称酮,则产物为混合物。
应用实例:1 、制备β-氨基酮OCH 3CCH 2CH 3 + CH 2O + Me 2NH HClCH 3CCHCH 2NMe 2 HClOCH 3αβ不对称酮反应时,亚甲基比甲基优先反应。
OCH 3CH 2O + (CH 3)2NH+OCH 3CH 2N(CH 3)2OCH 3(CH 3)2NCH 267 %+33 %2、 在芳、杂环上引入胺甲基 含活泼氢的化合物也可发生该类反应:+ CH 2O +N H2N草绿碱的合成:N HN+ CH 2O + HN(CH )2NH CH 2N(CH 3)2H 2O 95 %草绿碱——合成色氨酸3、 制备仿生及合成杂环化合物如:颠茄醇是1903年由极难得的原料环庚酮经过14步合成出来的,但后来巧妙地用胺甲基化反应,选用适当的原料,在仿生条件下,只用一步反应,就合成出来。
第15章_含氮有机化合物

CH3 CH2 OH
μ= 4.00×10-30 C· m
μ= 5.67×10-30 C· m
芳香胺的偶极矩方向与脂肪胺的方向相反,大小相近,说明 芳胺中氮原子上的孤电子对与芳环中的π电子组成共轭体系, 有p-π共轭作用。
NH2
μ= 4.33×10-30 C· m
2 .光谱特性
NO2 NaHS CH3OH, △ NO2
NO2
OH NO2
NH2
OH
Na2S C2H5OH, △ NO2
NH2
NO2
15.1.4 芳香族硝基化合物的反应
1. 还原反应
在碱性介质中,硝基苯被还原成两个分子缩合的产物。
O 葡萄糖, NaOH 100℃ NO2 2 Zn(2mol), NaOH CH3OH N N 氧化偶氮苯 N N 偶氮苯 Zn(3mol), NaOH CH3OH N N H H 氢化偶氮苯
RR'R''N 叔胺 tertiary amine
R4NCl 季胺盐 quaternary ammonium salt
R4NOH 季胺碱 quaternary ammonium base
15.2.1 胺的分类和命名
1. 分类
胺分子中的氮原子与脂肪烃相连的称为脂肪胺;与芳香烃相 连的称为芳香胺。
CH 3CH 2NH 2 乙胺(脂肪胺) ethylamine (aliphatic amine) H3C NH 2
硝基烷最显著的化学性质是其酸性,容易与强碱反应。且α-H 失去后又能形成较稳定的碳负离子,进而发生碳负离子的反应。
1.与氢氧化钠反应(酸性)
一些硝基化合物的pKa值如下, CH3NO2 CH3CH2NO2 pKa 10.2 8.5
药物合成反应(全)

O
O
C2H5 C2H5
NH ONa
HCl
C2H5
NH
C2H5
NH O
NH
O
O
盐酸普鲁卡因(ProcaineHydrochloride)的合成
➢ 盐酸普鲁卡因为局部麻醉药,作用强,毒性低 ➢ 临床上主要用于浸润、脊椎及传导麻醉 ➢ 化学名为对氨基苯甲酸2-二乙胺基乙酯盐酸盐 ➢ 化学结构式为:
H2N
化学选择性 化学选择性
区域选择性
化学选择性
我国抗癌药物紫杉醇合成成功
文章来源: 健康报
第四军医大学化学教研室张生勇教授课题组经过9年攻关, 在国内首次利用手性催化技术合成出抗癌药物紫杉醇。
紫杉醇和多烯紫杉醇是高效、低毒、广谱的抗癌药,广 泛用于治疗乳腺癌、卵巢癌、子宫癌等妇科肿瘤,对于某些 晚期肿瘤也有明显疗效。
Br2 CH3 COOH
P
O BrCH2 C-Br
X
溴乙酰溴
Br2 PCl3
BrCH2COOH
NH3 NH2-CH2COOH
第三节 醇、醚的卤素置换反应
一、醇的卤素置换反应
1 与HX反应 HI﹥HBr﹥HCl﹥HF 叔﹥仲﹥伯
2 与氯化亚砜、氯化砜的反应
S O2Cl
o C2O H H P y
o C2C H l
1S,2S (+)
仅1R,2R(-)型有抗菌活性, 临床使用
合成路线如下
O2N
Br2 , C6H5Cl COCH3
O2N
COCH2Br (CH2)6N4 , C6H5Cl O2N
COCH2Br(CH2)6N4
C2H5OH HCl , H2O O2N
(CH3CO)2O COCH2NH2 . HCl CH3COONa O2N
缩合反应

第15章 缩合反应概述在前面的章节内容中,已经讨论过一些缩合反应,如羟醛缩合反应,酮的α-烷基化反应等。
本章将继续讨论羰基化合物的缩合反应。
在亲核加成和酰基化合物的亲核加成-消除反应中,羰基表现为亲电试剂接受进攻试剂的电子,而在羰基化合物的α-取代反应中,羰基化合物通过转变为烯醇负离子扮演亲核试剂的角色,因此,在本章中主要讨论以下两种类型的反应。
15.1.1 Claisen酯缩合乙酸乙酯的α-氢原子酸性是很弱的(pKa ~24.5),而乙醇钠相对而言是一个较弱的碱(乙醇,pKa ~15.9),因此,可以想到乙酸乙酯形成的负离子在平衡体系中是很少的。
这也就是说,用乙氧负离子把乙酸乙酯变为 -CH2COOC2H5 是很困难的,但为什么这个反应会进行得如此完全呢?其原因就是最后产物乙酰乙酸乙酯是一个相对比较强的酸,形成较稳定的负离子,可以使平衡朝产物方向移动。
体系中乙酸乙酯负离子浓度虽然很低,但一形成后,就不断地反应,结果使反应完成,这个反应的平衡体系的彼此关系如下式所示:反应(4)是关键的一步,假若乙酰乙酸乙酯是一个很弱的酸,乙氧负离子不能从它夺去质子,其结果随着乙酰乙酸乙酯浓度的增加,反应(4)就不能朝右方进行,而促使反应朝逆方向进行,因此就得不到产物。
但事实上,乙酰乙酸乙酯是一个较强的酸,可以形成稳定的负离子,同时还产生更弱的“酸”——乙醇,这都有利于反应朝产物方向进行,在反应中产生的乙醇,不断地蒸出,更迫使反应朝右方进行,可以得到产率更高的产物。
如单独考虑每一个反应的平衡方向,反应(1)的箭头应写为,反应(2)及(3)取决于(1),所以也是逆向的,而反应(4)则应写为是顺向的。
在进行这类反应时,首先必须选择一个强度适当的碱,以便在平衡体系中,能产生足够浓度的碳负离子,其次要考虑的是在反应中使用的溶剂。
假若溶剂的酸性比原来化合物强得多的话,那时就不能产生很多的碳负离子,因为溶剂的质子被碱性很强的碳负离子夺去了,变为原来的化合物。
药物分析重点整理

药物分析重点整理绪论1、药物分析:利用分析测定手段,发展药物的分析方法,研究药物的质量规律,对药物进行全面检验与控制的科学。
2、药物分析任务:对药物进行全面的分析研究,确立药物的质量规律,建立合理有效的药物质量控制方法和标准,保证药品的质量稳定与可控,使用安全和有效。
3、药品四大管理规范:①GLP:药物非临床研究质量管理规范②GCP:药品临床试验质量管理规范③GMP:药品生产质量管理规范④GSP:药品经营质量管理规范第一章药品质量研究的内容与药典概况1、药品制定的标准基础:对药物的研制、开发、生产的全面分析研究的结果2、国家药品标准构成:①凡例:共性问题的统一规定(称为药品标准术语)②正文③通则:制剂通则、通用检测方法、指导原则3、溶解度:P14(易溶:1-不到10ml,微溶:100-不到1000ml,不溶:10000ml)4、药品检查项目:安全性、有效性、均一性、纯度5、标示量:每一支、片或其他每一个单位制剂中含有主药的重量或含量或装量6、称重与量取:①精密称定:千分之一;②称定:百分之一;精密量取:对该体积移液管的精度的要求7、恒重:指供试品连续2次干燥后称重的差异在0.3mg以内的重量8、药品的原则:科学性、先进性、规范性、权威性9、中药材名称:中文名称+拉丁名称10、熔点:①初熔:供试品在毛细管内开始局部液化出现明显液滴的温度②全熔:供试品全部液化时的温度③药物含有杂质时,熔点低于纯品,熔程增大11、比旋度:在一定波长与温度下,偏振光透过每1ml中含有1g旋光性物质的溶液且光路长为1dm时,测得的旋光度12、百分吸收系数:当溶液浓度c为1%(g/ml)、液层厚度l为1cm时的吸光度A(A=Ecl)13、药物含量测定方法选择标准:①化学原料药:容量分析法②药物制剂:色谱法14、稳定性实验:影响因素试验、加速试验、长期试验15、《中国药典》的内容:一部中药、二部化学药品、三部生物制品、四部通则和药用辅料16、假药、劣药:P66第二章药物的鉴别试验(鉴别真伪)1、有机氟化物鉴别原理:经氧瓶燃烧法破坏,被碱性溶液吸收成为无机氟化物,与茜素氟蓝、硝酸亚铈在pH4.3溶液中形成蓝紫色络合物2、无机酸根:P753、专属性鉴别试验:是证实某一种药物的依据,根据每一种药物化学结构的差异及其所引起的物理化学特性不同,选用某些特有的灵敏的定性反应来鉴别药物的真伪4、影响鉴别试验的条件:溶液浓度、溶液温度、溶液pH 、试验时间、试剂用量、干扰物质5、对照试验:为了阐明某种因素的影响、效应或意义时,常改变此因素而保持其它因素不变进行试验,并把试验结果进行比较,这种试验叫对照试验第三章 药物的杂志检查1、杂质来源:①生产过程中引入的杂质;②贮藏过程中引入的杂质2、杂质分类:①来源:一般杂质(信号杂质)、特殊杂质(有关物质)②毒性:毒性杂质、信号杂质(一般无毒)③性质:无机杂质、有机杂质(特定杂质、非特定杂质)3、杂质限量:①定义:药物中所含杂质的最大允许量②杂质限量=%100*供试品量杂质最大允许量 ③限量检查法:A 、对照法:需要供试品%100**SV C L 供试品量杂质标准溶液 B 、灵敏法:不需要对照品C 、比较法:需要待测杂质的参数4、检查方法:①化学方法:显色反应法、沉淀反应法、生成气体法、滴定法②色谱法:A 、薄层色谱法B 、HPLC :(1)外标法:(2)加校正因子法R R s C A C A f //s = x''s //C A C A f x s = C 、GC③光谱法:紫外-可见光光度法、红外分光光度法、原子吸收分光光度法 ④热分析法:(1)热重分析法TG :利用热天平在程序控制温度的条件下,测量物质的重量随温度变化的曲线(2)差热分析法DTA :测试品与参比物之间温度差与温度(或时间)关系的技术(3)差示扫描量热分析DSC :测量传送给供试品与参比物的热量差与温度(或时间)关系的技术(4)TG 、DTA (纵坐标T )、DSC (纵坐标dQ/dT )曲线图P1125、氯化物检查法: ①原理:白色浑浊药物:AgCl AgNO Cl 3HNO 3−−→−+-白色浑浊)(对照:AgCl AgNO ,NaCl 3HNO 3−−→−+V c②注意事项:(1)纳氏比色管刻度线高度差不超过2mm(2)放置在黑色背景上,从上向下观察(3)标准氯化物的浓度以50ml 中含50-80ug 的CI(4)加硝酸的目的:加速氯化银沉淀、产生较好浑浊、避免弱酸银盐形成(5)滤纸可预先用硝酸的水洗净后使用(6)暗处放置是为了避免Ag 单质析出6、硫酸盐检查法:①原理:白色浑浊药物:4HCl224BaSO BaCl SO −−→−+-白色浑浊)、(对照:4HCl 242BaSO BaCl SO K −−→−+V c ②注意事项:(1)标准K2SO4溶液0.1mg/ml ,50ml 溶液中含2ml 盐酸为好(2) 盐酸酸性条件下进行,防止碳酸钡等弱酸形成钡盐沉淀对比浑浊的影响7、铁盐检查法:①原理: []{()[]红色药物:--−→−−→−++++36HCl Fe Fe Fe SCN Fe 6SCN 3o 23()()[]红色、对照:--+−→−+36HCl 3SCN Fe 6SCN Fe V c②注意事项:(1)显色剂:硫氰酸铵溶液(2)氧化剂:过硫酸铵:二价铁氧化为三价铁;防止硫氰酸铁还原褪色(3离子,以免在氨碱性溶液中产生氢氧化铁沉淀8、重金属检查法:①重金属:在实验条件下能与硫代乙酰胺或硫化钠作用显色的金属②硫代乙酰胺法:(1)原理:硫代乙酰胺在弱酸性pH3.5条件下水解,产生硫化氢,与重金属粒子生成黄色到棕黑色硫化物混悬液,与一定量标准铅溶液经同法处理后颜色比较(2)适用于溶于水、稀酸和乙醇的药物(3)注意事项:置于白纸,自上而下观察;标准铅浓度为10ug/ml;标准铅溶液1-2ml;硫代乙酰胺为显色剂;酸为醋酸铅缓冲液③炽灼后的硫代乙酰胺法④硫化钠法:(1)原理:在碱性介质中,以硫化钠为沉淀剂,使Pb2+生成PbS微粒的混悬液,与一定量标准铅溶液同法处理后颜色比较(2)适用于溶于碱而不溶于稀酸或在稀酸中生成沉淀的药物。
精细有机合成13第十三章缩合

2CH3CHO
-HOH
CH3CHCH2CHO
CH3CH=CHCHO
OH
Raney Ni
Raney Ni
CH3CH=CHCHO
H2
CH3CH2CH2CHO H2 CH3CH2CH2CH2OH
LiAlH4
CH3CH=CHCH2OH
1
• 其反应历程为亲核取代反应。 • 醛的自身缩合在有机合成上的特点是可使产物的
• 因此,胺甲基化反应必须严格控制配料和反应条 件。
2
• 3.Mannich碱的反应
• 胺甲基反应在精细有机合成反应方法上的意义, 不仅在于制备众多C-氨甲基化产物,并可作为 中间体,通过消除、加成/氢解和置换等反应而 制备一般难以合成的产物。
• Mannich碱或其盐不太稳定,加热可消除胺分子 形成烯键,发生消除反应。例如药物利尿酸的合 成:
反应类型。
8
• 1.醛醛缩合反应
• 醛醛缩合反应可分为醛的自身缩合和不同醛间的 交叉缩合反应两类。醛醛缩合后可得到β -羟基 醛,β -羟基醛经脱水后得到α 、β -不饱和醛。
9
• ★(1)醛的自身缩合反应
• 醛的自身缩合是指在碱的催化下,两分于相 同的含α -H的醛发生自身缩合反应,得到β - 羟基醛,经脱水后最终得到α 、β -不饱和醛的 反应。在碱的催化下,乙醛的自身缩合反应式如 下式所示:
在甲醛和氨(胺)过量时,易发生如下反应。
O
O
O
O
. . . R C C H 3 H N H C H C O 4l R C C H C 2 H N 2 H 2 H C l H N C H H C O 4lR C C H C ( H N 2 H 2 ) 2 H 2 C H N l C H H C O 4lR C C C ( H N 2 H 2 ) 3 H 3 C l
缩合反应

第十五章 缩合反应 C o n d e n s i t i o n r e a c t i o n本章目录15.1 Mannich 反应—胺甲基化反应 15.2 麦克尔加成反应和鲁宾逊缩环反应 15.3 酯的酰基化反应 15.4 酮的酰基化和烷基化反应15.5 1,3-二羰基化合物烷基化、酰基化及其应用 15.6 魏悌息反应和魏悌息--霍纳尔反应 15.7 浦尔金反应和脑文格反应 15.8 达参反应15.9 安息香缩合反应和二苯乙醇酸重排分子间或分子内不相连接的两个碳原子连接起来形成新的碳碳键,成为新的化合物,同时往往有比较简单的无机或有机小分子化合物生成。
这样的反应统称为缩合反应。
15.1、 Mannich 反应—胺甲基化反应Mannich 反应(胺甲基化反应)——具有α-H 的醛、酮与甲醛及一级、二级的铵盐水溶液反应,生成β-氨基酮的反应。
H +R'COCH 2R +HCHO +NH(CH 3)2R'COCHRCH 2N(CH 3)2Mannich 碱反应机理:NH(CH 3)2+HCHO R'COCH 2RH+R'C=CHR OH HOCH 2N(CH 3)2H +CH 2=N +(CH 3)2活化2(CH 3)R'COCHRCH 2N(CH 3)2反应条件及适用范围:一般在水、醇或醋酸溶液中进行;最常用的是甲醛,其它醛也可用于缩合;羧酸、酯、硝基、腈的α-H 以及炔氢、芳香环系的活泼氢(如酚的邻、对位)均可发生此反应。
若含α-H 的酮为不对称酮,则产物为混合物。
应用实例:1 、制备β-氨基酮OCH 3CCH 2CH 3 + CH 2O + Me 2NH HClCH 3CCHCH 2NMe 2 HClOCH 3αβ不对称酮反应时,亚甲基比甲基优先反应。
OCH 3CH 2O + (CH 3)2NH+OCH 3CH 2N(CH 3)2OCH 3(CH 3)2NCH 267 %+33 %2、 在芳、杂环上引入胺甲基 含活泼氢的化合物也可发生该类反应:+ CH 2O +N H2N草绿碱的合成:N HN+ CH 2O + HN(CH )2NH CH 2N(CH 3)2H 2O 95 %草绿碱——合成色氨酸3、 制备仿生及合成杂环化合物如:颠茄醇是1903年由极难得的原料环庚酮经过14步合成出来的,但后来巧妙地用胺甲基化反应,选用适当的原料,在仿生条件下,只用一步反应,就合成出来。
化学竞赛PPT-第十五章 羧酸衍生物-第15章取代2

四、 醇酸
1、β-醇酸加热时容易脱水生成α, β-不饱和酸,往往还生成 β, γ-不饱和酸:
O
O
RCHCH2COH
RCH CHCOH + H2O
OH
2、γ-醇酸极易脱水而转变为内酯:
五元环内 酯相对稳
定
3、δ-醇酸生成内酯较难,生成的δ-内酯也容易开环。
4、α-醇酸的降解
与浓硫酸一起加热时,分解为醛酮,CO和水; 如与稀硫酸一起加热,分解为醛酮和甲酸:
2、在酸碱催化剂下,则迅速进行。
化合物
OO
OEt OO
OEt CH3 OO
OEt C2H5 OO
OEt CH(CH3)2 OO
OEt CF3
pKa 10.65 12.25 12.50 13.50
烯醇含量/%
8(液态) 0.39(水溶液)
5 (液态) 0.29(水溶液)
1(液态) 0.17(水溶液)
OH CO2H
苯酚钠
水杨酸钠
水杨酸
科尔伯将无水苯酚钠与CO2在180~200℃下加热, 除了水杨酸二钠外,还生成苯酚:
OH CO2Na C6H5ONa
ONa
OH
CO2Na +
施密特发现在较低温度下,苯酚钠吸收二氧化碳,生成碳
酸苯酯的钠盐,后者在120~145℃下加热即转变为水杨酸钠,
产率接近100%。
CO2CH3
+
CO2CH3
1,3-丁二烯 丙烯酸甲酯
3-环己烯基甲酸甲酯
三、卤代酸
1、α-卤代酸及其衍生物中卤原子在羰基的影响 下,活性增强,容易与各种亲核试剂起SN2反应,生 成α-取代羧酸。
2、β-卤代酸容易消去卤化氢得到α,β-不饱和羧酸。 3、γ-,δ- 和ε-卤代酸在碱的作用下,容易生成内酯:
大学有机化学15、硝基化合物和胺
CH3 NO2 NH2
② 其它含氮化合物的还原
H2 / Ni 或LiAlH4
R-CN 腈
R-CH2NH2
R-CH=N-OH 肟
O R-C-NH2 酰(氨)胺
H2 / Ni 或LiAlH4 LiAlH4
R-CH2NH2
R-CH2NH2
3.还原氨化
醛、酮与氨或伯氨缩合生成亚氨,继而进行催化加 氢最终生成胺
• 由于硝基的钝化影响,硝基苯不能发生傅-克反应。
4. 硝基对苯环上其它取代基的影响
a)对卤素
氯苯分子中氯原子并不活泼,很难水解成酚,但在 Cl的邻位或对位引入硝基后,氯原子就比较活泼。
硝基对其邻位和对位上的卤素取代基有活化作用。
4. 硝基对苯环上其它取代基的影响
a)对卤素
硝基对其邻位和对位上的卤素取代基有活化作用。
-NO2
三、硝基化合物的化学性质
1. α―H的酸性
在脂肪族硝基化合物中,由于硝基有较强的―I和―C效应, 使硝基负离子较为稳定。
与碱反应 (酸性) O R-CH2-N R-CH=N O
酸式 硝基式(假酸式)
—— 指含有α-H 的伯、仲硝基化合物能慢慢 溶于NaOH等强碱溶液。
OH O
NaOH
ONa R-CH=N + H 2O O
NO2
4
0.38
§15-2 胺
一、胺的分类与命名
1. 分类
R-NH2 (伯胺或一级胺) R-N-H (仲胺或二级胺) R
按氨所连烃基数目分
R (叔胺或三级胺) R-N R + R4N X (季铵盐)
脂肪胺 R-NH2 按烃基不同分 芳香胺
NH 2
2. 命名
简单胺:
15-第十五章 硝基化合物及胺

第十五章 硝基化合物及胺学习要求1.握硝基化合物及胺的分类、命名法和结构。
2.掌握胺的化学性质:碱性(结构和溶剂化效应),胺的鉴别,季铵盐的性质及霍夫曼规则。
3.掌握硝基化合物的性质。
4.理解三种分子重排反应的实例。
5. 了解腈和异腈的性质。
6.了解硝基化合物的性质、制法以及重要代表物。
7.了解硝基化合物及胺的制法。
8.了解相转移原理作为有机合成新方法的原因。
9. 了解表面活性剂。
计划课时数 4课时重点:胺的化学性质:碱性(结构和溶剂化效应),胺的鉴别,季铵盐的性质及霍夫曼规则。
难点:分子重排反应教学方法 采用多媒体课件、模型和板书相结合的课堂讲授方法。
引言:分子中含有C-N 键的有机化合物称为含氮有机化合物。
含氮有机化合物种类很多,本章简单讨论硝基化合物,重点讨论胺、重氮盐和分子重排反应。
硝基化合物硝基化合物一般写为R-NO 2 ,Ar-NO 2 ,不能写成R-ONO (R-ONO 表示硝酸酯)。
§15.1 硝基化合物分类、命名、结构1. 分类 (略)2. 命名 (与卤代烃相次似)硝基乙烷对硝基甲苯3. 硝基的结构 一般表示为(由一个N=O 和一个N →O 配位键组成)物理测试表明,两个N —O 键键长相等,这说明硝基为一P-π共轭体系(N 原子是以sp2杂化成键的,其结构表示如下:共振结构式:NOOR氮带一个正电荷,每个氧各带½负电荷,这与硝基化合物高的偶极矩相联系。
根据R的不同,偶极矩在3.5D和4.0D之间,由于硝基化合物的偶极特征,结果比相同分子量的酮沸点高(挥发慢)。
如硝基甲烷(MW61)沸点101℃,丙酮(MW58)沸点56℃。
意外地,在水中溶解度低,在水中硝基甲烷的饱和溶液,以重量计少于10%,而丙酮完全溶于水。
§15.2硝基化合物的制备1.烷烃的硝化:烷烃可与硝酸进行气相或液相硝化,生成硝基烷烃。
其中以气相硝化更具有工业生产价值.烷烃的硝化是以游离基历程进行的:烷烃的碳骼对硝化速度具有一定的影响,活性次序为:叔C-H > 仲C-H > 伯C-H 。
缩合反应

O Ar C
H + CN
中间体
OH C
O Ar C CN H
OH H2 O Ar C CN H
OH
-
HO Ar C CN
H
亲核加成
R
CN
HO A Ar C NC
O C
H
H2 O
HO HO A Ar C C A Ar
-CN
OH OH A Ar C C H A Ar
-H+
A Ar
Ar
O C
OH C Ar H
' H2 R R C C C OH H O C R' - H 2O
机理
CH3
a:碱催化
无机碱: NaOH, Na2CO3 有机碱: EtONa
定义:两个及两个以上有机化合物通过反
应形成一个新的较大分子或同一分 子内部发生分子内的反应形成新分 子的反应称为缩合反应。 子的反应称为缩合反应
O C H + OH O + H2O 快 O
CH3
RO RO H RO RO
R'CHO NH2
RO RO N HC R'
是Mannich氨甲基化反应的特殊例子。
NH R'
Strecker氨基酸合成反应
醛或酮用氰化钠及氯化铵处理可一步 得到-氨基腈,水解生成-氨基酸的反应 称为Strecker St k 氨基酸合成反应。该反应是 氨基酸合成反应 该反应是 制备-氨基酸的方便方法。
及延长碳链
CH2CH(COOC2H5)2
•Strecker反应
Mannich氨甲基化反应 氨 基化反应
含有活泼氢原子的化合物和甲醛 及胺进行缩合作用,结果活泼氢原子 被-氨甲基取代,得到-氨基酮类化 合物(常称为Mannich碱)的反应称为 Mannich氨甲基化反应。
邢其毅《基础有机化学》笔记和课后习题(含考研真题)详解(碳负离子 缩合反应)

第15章碳负离子缩合反应15.1 复习笔记一、氢碳酸的概念和α氢的酸性氢碳酸的酸性强弱可用碳上的氢以正离子解离下来的能力表示,用pK a值来表示,值越小,酸性越强。
烷烃的酸性很弱。
烯丙位和苯甲位碳上的氢的酸性比烷烃强。
末端炔烃的酸性更强一些,环戊二烯亚甲基上的氢相对更活泼一些。
1.α氢的酸性与官能团直接相连的碳称为α碳,α碳上的氢称为α氢。
α氢以正离子解离下来的能力即为α氢的活性(酸性)。
通过测定α氢的pK a值或其与重氢的交换速率可以确定α氢的酸性强弱。
(1)α氢的酸性强弱取决于与α碳相连的官能团及其它基团的吸电子能力。
总的吸电子能力越强,α氢的酸性就越强。
一些常见基团的吸电子能力强弱次序排列如下:(2)α氢的酸性还取决于氢解离后的碳负离子(carbanion)结构的稳定性。
碳负离子的离域范围越大越稳定。
(3)分子的几何形状会影响α氢的酸性。
(4)与α氢的解离和介质的介电常数及溶剂化有关。
2.羰基化合物α氢的活性分析羰基的吸电子能力很强,因此羰基化合物的α氢都很活泼。
例如在NaOD—D20中,2-甲基环己酮的α氢均可被氘取代。
(1)羰基使α碳原子上的氢具有活泼性,是因为:①羰基的吸电子诱导效应;②羰基α碳上的碳氢键与羰基有超共轭作用。
(2)羰基旁所连的基团的不同导致了它们的α氢的活性也有差异。
可以从这些化合物本身的结构以及它们形成烯醇式后的结构来认识:含羰基化合物的α氢的酸性从大到小顺序:酰氯>醛>酮>酯>酰胺①在酰氯中,氯的存在增强了羰基对α碳的吸电子能力,从而也增强了α氢的活性。
同时氯的吸电子效应也使形成的烯醇负离子因负电荷分散而趋于稳定。
②在酯和酰胺中,烷氧基氧的孤电子对和氨基氮的孤电子对均可与羰基共轭而使体系变得稳定。
③酰胺氮上的孤电子对碱性较强,使共轭体系更加稳定,要解离α氢,形成烯醇负离子需要的能量更多,故酸性比酯还弱。
④当醛基中的氢被烷基代替后,由于烷基的空阻比氢大,从某种程度上讲阻碍了碱和氢的反应;另外,由于烷基对羰基具有给电子的超共轭作用,因此醛的α氢比酮的α氢活泼。
第十五章-胺

(3)芳胺:PhNH2>Ph2NH>Ph3N )芳胺: (4)取代胺:取代基为吸电子基,碱性减弱,如 )取代胺:取代基为吸电子基,碱性减弱, (F3C)3N几乎无碱性 ) 几乎无碱性 二、胺的酸性(氨、伯胺、仲胺含活性H) 胺的酸性( 伯胺、仲胺含活性 )
[(CH3)2CH]2NH + n-C4H9 Li
三、烃化 胺 + 卤代烃 RNH2 伯胺
R’X SN2
铵盐
R’X
RNHR’ 仲胺
RR’2N 叔胺
R’X
RR’3N+X季铵盐
+
CH2NH2 + 3 CH3I
CH3OH
CH2N(CH3)3I
-
注 胺作为Nu:,可与活性烯键起共轭加成反应 , 意 b. 胺作为
a. 胺与叔卤代烷主要生成消去产物(胺有碱性) 胺与叔卤代烷主要生成消去产物(胺有碱性)
不反应
酸
现象: 现象:3O胺 + TsCl 五、亚硝化
:O ..
3O胺油状物
:N
+
消失
.. + - H2 O N O H+ H .. ..
O: ..
11
反应胺 脂肪1 脂肪 胺 RNH2
O
反应式
NaNO2,HCl 0~5OC
+
现象
N Cl -
应用 a.根 a.根 据实 验现 象可 鉴别 伯、 仲、 叔胺
Chap.15
胺
1
15.1 胺的结构和命名
一、胺的分类 NH3 氨 RNH2 伯胺 RR’NH 仲胺 RR’R2N 叔胺 RR’R2R3N+X季铵盐
二、胺的命名 •简单的胺:用“胺”作官能团,把它所含烃基的名 简单的胺: 简单的胺 作官能团, 称和数目写在前面,按简单到复杂先后列出, 称和数目写在前面,按简单到复杂先后列出,后面 加上“ 加上“胺”字
【精品课件】有机化学第十五章缩合反应CondensationReactions

15
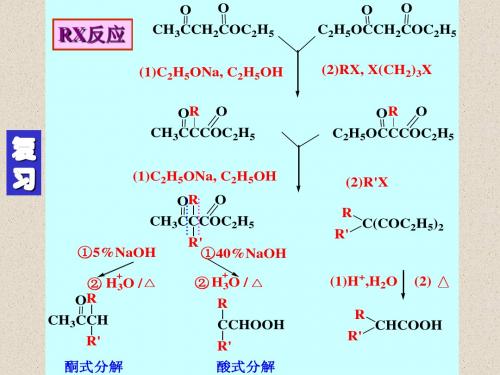
2.1 Claisen Ester Condensation
O 2 CH3CH2COC2H5
1) C2H5ONa, EtOH
2) HOAc, H2O
O
O
CH3CH2C CH C OC2H5
CH3
81%
O (1) NaOR
2 RCH2COC2H5 (2) H+
OO RCH2CCHCOC2H5
R
β-酮酸酯
+
C2H5OH
C2H5ONa 180 oC
催化量的C2H5ONa
O 2 CH3COC2H5
其它含有活泼氢的化合物也可发生类似的反应
O RCA (I) +
I: 酰氯、酐、酯
O C C (II) H
O
O
RC C C
II: 含活泼氢的羰基化合物
18
2.2 Crossed Ester Condensation
O
CH2CO2H
CH2CHO CH2CHO
+
NH2CH3
+
C
O
N CH3
CH2CO2H
CH3 N
-CO2
H2/Ni
pH = 5
N CH3 CO2H
O CO2H
O
OH
9
Mannich Reaction
H NHCH3 O HCH
CH3 N+ H2C
H
CH3 N
O H
O
H
H
O
应用:(2) 用作合成中间体
O
+
C6H5CCHCH2NMe2
CH3 CHCH2NMe2
+ CH3
MgX
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
成
O
O
CO2Et
路
C2H5OH H+
C2H5OCCH(CH 2CH2COOEt) 2
CO2Et
线
CO2Et
COOC2H5
COOH
EtONa
OH-
H+
-CO 2
COOC2H5
O
O
eg 4. 选用合适的原料合成
OH O
剖析
O
O
O
OH
C2H5OC
O
C=O
CH3
C=O CH3
O C2H5OC
O COC2H5
CH3 + CH2=CH-C-CH 3 EtO-
O
+ O
64 %
O
O
36 %
2 用β-卤代乙烯酮或β-卤代乙烯酸酯作为麦克尔 反应的受体时,反应后,双键保持原来的构型。
O CH3 C2H5O-
OCH3
Cl
β C
αC H
H
COCH3
O
O CH3
CH-CH=C-OCH 3
Cl
O-
O
H
CC
H
COCH3
O
第一节 曼尼期反应——氨甲基化反应 一 定义
具有活泼氢的化合物、甲醛、胺同时缩合,活 泼氢被氨甲基或取代氨甲基取代的反应,称为曼尼 期 (Mannich, C.)反应,生成的产物称为曼氏碱。
O
R H+
CH3-C-CH2-H + CH2O + HN
R'
O
R
CH3-C-CH2-CH2N R'
取代的氨甲基
CH(COOC2H5)2
45
1,4-加成产物 (8 %)
1,6加 成 的 反 应 机 理 如 下
CH=CH-CH=CH-C=O
(C2H5OOC)2CH2 碱 (C2H5OOC)2CH CH3
CH3
(C2H5OOC)2CHCH-CH=CH-CH=C-O -
CH3
CH3
EtOH
(C2H5OOC)2CH-CH-CH=CH-CH=C-OH
反应规律
*1 H3CO
O
O
CCH2CH2COCH3 + Ph3P-CH2
H3CO
CH2
O
CCH2CH2COCH3
①醛最快,酮次之。 酯最慢。所以可进行 选择性反应。
*2 PhCHO + Ph3P+-CH2C6H5Cl-
NaOEt EtOH, 25℃
Ph H
C
C
Ph H
+
Ph H
C
C
H Ph
41 %
使用原料的范围
1. 具有α-H的醛、酮、酸、酯、硝基化合物、腈、末端炔烃、含 有活泼氢的芳香环系化合物。
H H
HO
H
N CH3
N H
2. 二级胺。
二、 反应机制
R
H+
CH2=O
CH2=OH
NH R'
R
H+转移
R' N-CH2OH
H
R N-CH2-OH2 -H2O R'
R R' N=CH2
活化的C=N
CH3
合成
O
CH3 O
O + CH2=CHCCH 3
C2H5OC2H5OH
CH3 OO
CH3
OH-
-H2O
CH3
OH O
H+ or OH-
O
50 %
Eg 2. 选用合适的原料合成
O
剖析
O
O
O
CH3CCH2 CH2 CH2COC2H5
O O
① *1 ② *2 ③
O
O
CH3CCH=CH 2 + CH 3COC2H5 活泼
CH3CCH2CH2NR2 I
CH3
OH -
o
CH3CCH=CH2 + R2NCH3 + I- + H+
H2NR
(2) CHO H+
LDA
CH=NR
COOEt
COOEt 水解
CH=NR
H+
O
COOEt OH- EtOOC
COOEt NaOEt, CH2=CHCCH3 CHO
CHO COCH3
O
eg 6. 选用合适的原料合成
C=O CH3
2CH2=CH-COOC2H5
+ OO CH3CCH2COC2H5
合成
OO CH3CCH2COC2H5 + CH2=CH-COOC2H5 C2H5ONa
OO CH3CCHCOC2H5
CH2-CH-COOC2H5
CH2-CH-COOC2H5
OO CH2=CH-COOC2H5 CH3CCCOC2H5
魏悌息试剂制备
3PhH + PCl3
Ph3P
Ph3P + CH3X
C6H5Li
Ph3P+-CH2-
Ph3P+-CH3X-
Ph3P + XCH2COOC2H5
Ph3P+-CH2COOC2H5 X-
K2CO3
Ph3P+
CHCOOC2H5
Na2CO3, NaOH, NaOR, NaNH2, NaH, RLi
HAc
N H 95 %
草绿碱
3 制备杂环化合物
eg 5 CH2 CH CH2 NCH3 C=O CH2 CH CH2
eg 6 CH3 N
O
4 制α,β-不饱和酮、α,β-不饱和酯
O R-C-CH2CH2NMe2 △ ,蒸馏
O R-C-CH=CH 2
CH3I
O R-C-CH2CH2NMe3
OH △
CH3
CH3
互变异构
O (C2H5OOC)2CH-CH-CH=CH-CH 2CCH3
CH3
四 制备α,β-不饱和醛酮的方法 α,β-不饱和醛酮是麦克尔加成反应的重要原料,
下面归纳了制备α,β-不饱和醛酮的几种方法。
1 曼尼希碱热消除法
O
O
CH3CCH3 + CH2O + Me2NH HCl 曼尼希反应 CH3CCH2CH2N(CH3)2 HCl
EtONa EtOH
O
O
CH3C CHCH 2CH2COC2H5 OHCH3OC
O
O H+ CH3C
HOC CHCH 2CH2COOH
O
O
O
-CO2 CH3CCH2CH2CH2COH
~160oC
O
O
EtONa
CHቤተ መጻሕፍቲ ባይዱ3CCH 2CH2CH2COC2H5
EtOH H+
O O
eg 3. 选用合适的原料合成 剖析一:
EtO2C CO2Et
HO2C
CO2H
EtO2C CO2Et
NC
CN
Et2O2CCH2CO2Et +
2 CH2=CH-CN
合成
OO C2H5OCCH2COC2H5 + 2 CH2=CH-CN
EtONa EtOH
O
合
EtOC EtOC
CH2CH2CN OHCH2CH2CN
H+
-CO2
O
HOCCH(CH 2CH2COOH)2
COOH O
1COOH
2 3
4 5
O
COOH O
α-H不够活泼
+ CH3COOH O
O
O
CH2=CH-CCH 3 + CH2=CHCOH
产物为混合物
剖析二:通过添加适当基团,克服上述剖析中的问题
COOH O
COOH CO2C2H5
O
COOH CO2Et
CO2Et
EtO2C CO2Et
EtO2C
CO2Et
反应式
OO
CH3CCH2CCH3 + CH2=CH-CH=O
给体
受体
EtOEtOH
O
βα
(CH3C5 )2C4H
CH
3
2C2 H 2C1HO
1,5-二羰基化合物
常用碱性催化剂:
N , Et3N, KOH, EtONa, (CH 3)3COK, R 4N+OH-
H
二 反应机制
O (CH3C)2CH2
O Ph
剖析
O Ph
O
Ph O
O
O
+
Ph
COOC2H5
O
+
CH2NR3
I
-
O + CH2O + HNR2
O COOC2H5
+
ClCH2Ph
第四节 魏悌息反应和魏悌息-霍纳尔反应 一 魏悌息试剂:
Ph3P-CH2
(I)
Ph3P=CH 2
(II)
贡献大
在相邻位置上带有相反电荷的两性离子称为叶利德 (ylide)。磷叶利德也称为魏悌息试剂(德1953,1973)。
EtO
-
O
(CH3C)2CH
CH2=CH-CH=O
O (CH3C)2CH-CH2-CH=CH-O -
EtOH
O
互变异构
(CH3C)2CH-CH 2-CH=CH-OH
O (CH3C)2CHCH 2CH2CHO
三 麦克尔加成反应的规律
1 不对称酮进行麦克尔加成时,反应总是在多取代的 -C上发生。
O
O
二 魏悌息反应
