有机硅化学反应ppt-课件
合集下载
学习课件(有机硅)

05
有机硅的未来发展与挑战
有机硅的发展趋势
01
02
03
环保化
随着环保意识的提高,有 机硅行业将更加注重环保 生产,减少对环境的污染。
高性能化
有机硅材料不断向高性能 化发展,提高其耐温、耐 腐蚀、抗氧化等性能。
多元化
有机硅产品种类不断增多, 应用领域不断拓展,以满 足不同行业的需求。
有机硅面临的挑战与问题
有机硅在汽车制造领域的应用
总结词
提高汽车性能
详细描述
总结词
有机硅在汽车制造中主要用于 生产高性能的密封件、减震件 和涂层。这些产品可以提高汽 车的舒适性、稳定性和耐久性 ,并增强汽车的外观效果。
轻量化材料
详细描述
有机硅材料相对较轻,可以替 代部分金属材料,降低汽车的 整体重量。轻量化设计是汽车 节能减排的重要手段之一,有 利于提高汽车的燃油经济性和 排放性能。
学习课件(有机硅)
• 有机硅简介 • 有机硅的种类与合成 • 有机硅材料的性能与改性 • 有机硅在各领域的应用 • 有机硅的未来发展与挑战
01
有机硅简介
有机硅的定义
有机硅
是指含有硅元素的有机化合物, 也称为硅基有机化合物。
定义解释
有机硅由碳和硅两种元素组成, 其分子结构中碳-硅键的键能高, 使其具有独特的物理和化学性质 。
19世纪
有机硅化合物的研究开始起步。
20世纪40年代
出现商业化的有机硅产品,如 硅橡胶和硅树脂。
21世纪
有机硅材料在各领域的应用更 加广泛,成为现代工业和科技 发展的重要支撑材料之一。
02
有机硅的种类与合成
有机硅单体的合成
01
02
03
有机硅化学反应PPT课件

组分名称
分子式
沸点(kpa)/℃ 质量分数(%)
甲基三氯硅烷
CH3SiCl3
66.4
三甲基氯硅烷 (CH3)3SiCl
57.9
5~15 3~5
甲基二氯硅烷 CH3SiHCl2
41.8
3~5
二甲基氯硅烷 (CH3)2SiHCl
35.0
~1
四甲基硅烷
(CH3)4Si
26.2
<1
四氯化硅
SiCl4
57.6
l339
Si-Br
309
C-Br
284
Si-I
234
C-I
213
21
1.硅键类型以及特性
硅键的离子化特征及键能
键型 Si-C Si-O Si-Cl Si-N Si-H
离子化 12% 50 % 30 % 30 % 2%
离子化键能(KJ/mol-1) 932
1014.2 796.2
1045
硅与非金属元素的原子形成共价键,而这些共价键具有一 定的离子化特征。讨论硅键活性时,要考虑反应机理以及两种 键能的大小。
二甲基二氯硅烷的分子式:
(CH3)2SiCl2 (或Me2SiCl2) 分子量:129.06 沸点:70.2℃
熔点:-76℃
d420: 1.0637 nD20: 1.4055 毒性: LC50. 930ppm/4H
闪点:-10℃
【火灾危险】易燃.遇水或水蒸汽迅速分解发热,产生有毒的腐蚀性烟雾.遇明
火易燃.遇强氧化剂有燃烧的危险.
7
生命硅直饮机
生命硅美肤机
生命硅美颜液
生命硅外用液
硅与人类历史的发展 石器时代 封建时代
8
第二章 有机硅化合物的基本性质

实用文档
酸 PhCOOH
两种羧酸的电离常数
水中(在25℃)的电 60%(wt)乙醇-水中(25℃)
离常数Ka×104
的电离常数Ka×106
0.63
1.05
p-Me3SiC6H4COOH
0.54
1.11
实用文档
四、硅成键的类型和特征
(一)Si-O键
它是形成有机硅高聚物最基本、最主要的键。 1、特点: (1) Si-O键的键能很高。热稳定性好 (2) 键长、键角很大。分子柔顺。分子间作用力小,表面张力小. 2、Si-O-Si键的制备方法: (1)水解法。通过卤硅烷水解来制备。 (2)非水解法。通过缩合反应实用、文档开环聚合反应来制备。
实用文档
键能与热稳定性
共价键能愈大,热稳定性愈大。 C-C键能比C-Si键能大, 但四甲基硅烷(Me4Si)的热稳定性比新戊烷(Me4C)大得多, 其原因就是因为在四甲基硅烷中存在着dπ-pπ配键。而碳 没有d轨道,不能成为生成dπ-pπ配键的电子接受体,因此 新戊烷中不可能有这样的配键。
实用文档
键角 O-Si-O
— 115±5°
109° — —
C-Si-C 111±4°
— 106°
— —
实用文档
偶极矩
偶极矩是指分子中正电中心和负电中心间的距离(偶极长) 与正电荷或负电荷的电量的乘积,其单位为D( 德拜)。表 示分子极性的大小。
硅的电负性比碳小,按常规推测各种氯硅烷的偶极矩应 当比相应的氯甲烷大,但实际结果却相反。
实用文档
Me3Si-取代脂肪羧酸的有机基团的氢后,羧基中氧与氢 之间的电子对将偏向于氢,使氢不易质子化,而导致酸性 下降。
Me3Si-对酸类(在25℃下)表观电离常数的影响
酸 PhCOOH
两种羧酸的电离常数
水中(在25℃)的电 60%(wt)乙醇-水中(25℃)
离常数Ka×104
的电离常数Ka×106
0.63
1.05
p-Me3SiC6H4COOH
0.54
1.11
实用文档
四、硅成键的类型和特征
(一)Si-O键
它是形成有机硅高聚物最基本、最主要的键。 1、特点: (1) Si-O键的键能很高。热稳定性好 (2) 键长、键角很大。分子柔顺。分子间作用力小,表面张力小. 2、Si-O-Si键的制备方法: (1)水解法。通过卤硅烷水解来制备。 (2)非水解法。通过缩合反应实用、文档开环聚合反应来制备。
实用文档
键能与热稳定性
共价键能愈大,热稳定性愈大。 C-C键能比C-Si键能大, 但四甲基硅烷(Me4Si)的热稳定性比新戊烷(Me4C)大得多, 其原因就是因为在四甲基硅烷中存在着dπ-pπ配键。而碳 没有d轨道,不能成为生成dπ-pπ配键的电子接受体,因此 新戊烷中不可能有这样的配键。
实用文档
键角 O-Si-O
— 115±5°
109° — —
C-Si-C 111±4°
— 106°
— —
实用文档
偶极矩
偶极矩是指分子中正电中心和负电中心间的距离(偶极长) 与正电荷或负电荷的电量的乘积,其单位为D( 德拜)。表 示分子极性的大小。
硅的电负性比碳小,按常规推测各种氯硅烷的偶极矩应 当比相应的氯甲烷大,但实际结果却相反。
实用文档
Me3Si-取代脂肪羧酸的有机基团的氢后,羧基中氧与氢 之间的电子对将偏向于氢,使氢不易质子化,而导致酸性 下降。
Me3Si-对酸类(在25℃下)表观电离常数的影响
有机硅化学(全套课件286P)

80
40
Bayer AG (拜尔)
Leverkusen
130
65
与GE合资
德 国
Wacker Chemic Gmbh (瓦克化学)
Burghausen
180
90
Hü ls Silicone Gmbh (赫斯公司)
Rheinfelden Nü nchriz
大学课件
80
40
原为民德有机 硅厂,被Hul 收购后进行 整改扩建
中国氟硅协会技术培训中心培训班教学大纲——
有 机 硅 化 学
大学课件 1
一、有机硅化学及其工业的过去、 现在和将来
大学课件
2
1. 19世纪60年代——20世纪30年代末有机硅化 合物出现及其化学研究的开始
1.1 1863年弗里德尔/克拉夫茨首先合成有机硅化合物。
ZnEt2+SiCl4→SiEt4+ZnCl2
大学课件
3
2. 1938年—— 1970年有机硅化学基础理论和工 业化合成、材料加工方法和应用技术的创立,有机 硅产业的形成、壮大。
大学课件
4
2.1 有机硅化学及产业建立功勋的化学家
美国:海德(J.F.Hyde)
帕洛德(W.J.Patnode)
罗乔(E.G.Rochow) 苏联:多尔高夫(Б.Н.ДОЛГОВ)
⑤有机硅环体在表面活性剂存在下乳液聚合反应合成有机硅乳剂
⑥硅氢加成反应催化剂发明和碳官能团有机硅化合物合成方法的建 立。 ⑦有机硅烷偶联剂合成和应用开发。 ⑧有机硅产品在军事、航空、电子、电力、建筑、轻工等工业领域 应用。
大学课件 6
2.3 规模化生产有机硅产品公司纷纷建立。
①美国:道康宁公司(Dow-Corning,DC)1943年, 通用电气公司(General,Electric,GE)1947年 联合碳公司(Union Cabide,UC)1956年 ②德国:瓦卡公司(Wacker)1951年 戈特斯高特公司(Goldschidt) ③日本:信越化学公司、东京芝浦电气(1953年成立,后与GE合并)
有机硅试剂

•
另外,硅的电负性比碳低,所以 Si-C 键极化为: 烷基硅烷倾向于被亲核试剂进攻。
Si C
•
硅也有使α-碳负离子与 β-碳正离子稳定化的能力。
13.2 有机硅化合物的合成
• 有机硅试剂中比较容易得到的原料是氯代硅烷,如SiCl4、RSiCl3、 R2SiCl2 和 R3SiCl 。卤素容易进行亲核取代反应,生成有合成价值的 中间体,如下所示:
OTMS + Cl Cl O Cl Cl 67% Cl Cl O O Ph Cl OTMS + I H N
+ -
NH+ OTMS 1) HCl 2) OH-
O N 843;
H2O
-
KOH O 82% 14 15 O H2O, EtOH
O
13.3 碳碳键的形成反应
纳扎罗夫环合(Nazarov
cyclization) ,而无环α,β-不饱和酰 氯则观察不到这个反应。
46% yield
13.3 碳碳键的形成反应
13.3.2 有关乙烯基硅烷的反应
• 纳扎罗夫环合反应可以导致生成更拥稳定的烯烃 (即更加高度取代的烯烃, 然而要区域专一性获得 4, 5-环戊-2-烯酮则应通过含有硅基-取代基二烯酮 (12) 在路易斯酸催化下发生环化反应而完成。
O
+
Si
CO2Et CO2Et
TEA, PhH CHO + Et3SiCl
OTES 80 CO2Et
oC
OTES CO2 Et
87%
13.3 碳碳键的形成反应
13.3.5 有关硅氧丁二烯的反应
• Danishefsky‘ s diene: 1-甲氧基-3-(三甲基硅氧基)丁二烯 (20) ,一个具有多 种用途的合成试剂。 • 和缺电子的亲二烯体发生 D-A 反应,生成的环氧加成物经过温和酸水解后,伴 随着甲醇的消去则可以得到环己烯酮。 • 20 与炔基亲二烯体的反应则直接得到苯的衍生物。
硅及其化合物的性质课件

某些硅化合物在特定波长范围内 具有吸收或发射光谱的性质,可 用于制造荧光材料、染料和颜料
等。
04
CATALOGUE
硅化合物在日常生活中的应用
建筑业
硅酸盐水泥
硅酸盐水泥是建筑行业中 常用的材料,具有优良的 耐久性和强度。
防水材料
硅化合物如硅酮密封胶在 建筑防水工程中广泛应用 ,提高建筑物的防水性能 。
硅橡胶、硅树脂等绝缘材料广 泛应用于电子、电气和航空航 天领域,作为绝缘材料和密封 材料。
硅化合物在高温和低温环境下 仍能保持良好的绝缘性能,适 用于各种极端环境下的应用。
光学性质
硅化合物具有独特的光学性质, 如高折射率、低色散等。
硅玻璃和硅基光电子器件在光学 仪器、光纤通信和光电子技术等
领域有广泛应用。
开发潜力
硅化合物具有广泛的应用前景和开发潜力,未来随着研究的深入和技术的发展, 其在更多领域的应用将得到拓展。同时,新应用领域的探索和开发也将推动硅化 合物技术的不断创新和发展。
THANKS
感谢观看
硅酸盐
总结词
硅酸盐是由金属阳离子与硅酸根离子结合形成的化合物,是地壳中分布最广泛的矿物之 一。
详细描述
硅酸盐是由金属阳离子与硅酸根离子结合形成的化合物,通式为MO·nSiO2。硅酸盐矿 物是地壳中分布最广泛的矿物之一,许多岩石和矿物的主要成分都是硅酸盐。硅酸盐矿 物具有多种形态和颜色,如长石、云母、黏土矿物等。硅酸盐在陶瓷、玻璃、水泥等建
总结词
硅烷是一类由硅和氢元素组成的化合物 ,具有高度的化学稳定性和热稳定性。
VS
详细描述
硅烷是一类由硅和氢元素组成的化合物, 通式为SinH2n+2。硅烷在常温常压下为 气体,但在加压条件下可液化。硅烷具有 高度的化学稳定性和热稳定性,可在高温 和有氧条件下保持稳定。硅烷可用于制备 高纯度硅和其它硅化合物,也可用作化学 反应的中间体。
第二章 有机硅化合物的基本性质

氯硅烷类与相应的氯甲烷的偶极矩比较
硅化物 H3SiCl SiH2Cl2 SiHCl3 偶极矩(D) 1.28 1.17 0.85 碳化物 CH3Cl CH2Cl2 CHCl3 偶极矩(D) 1.87 1.56 1.00
是由于氯原子的p电子进入硅的 空轨道,形成dπ-pπ 是由于氯原子的 电子进入硅的3d空轨道,形成 电子进入硅的 空轨道 配键, 配键, 结构为
共价键的反应类型
均裂
1、取代反应 、 2、加成反应 、 3、消除反应 、 4、氧化还原反应 、
异裂
硅的电负性较小,非金属性比碳弱,因此, 硅的电负性较小,非金属性比碳弱,因此,在与各种非金属 元素成键时,硅键应当比相应的碳键强(见表2) 2)。 元素成键时,硅键应当比相应的碳键强(见表2)。 某些硅键和碳键的键能( 某些硅键和碳键的键能(kJ/mol) C
硅键
334-242
Si
188.3
334-242
H
303.8 413.3
O
422.5 344.4
F
560.6 426.7
Cl
368.2
Br
295.8
I
221.7
碳键 344.4
327.6
278.6
218
Si- 键强, C—C键比Si-Si键强,这是因为在同族元素中,共价键结合力 C键比Si Si键强 这是因为在同族元素中, 随原子量的增加而减弱。Si-Si键很容易破裂,除Si-F键外,以 随原子量的增加而减弱。Si-Si键很容易破裂, Si- 键外, 键很容易破裂 Si- 键最为最牢固。所以在硅化合物中,这种键最为普遍。 Si-O键最为最牢固。所以在硅化合物中,这种键最为普遍。
第二章 有机硅化合物的基本性质
有机硅表面活性剂PPT课件

CHENLI
2
1. 表面活性剂的分子模型
H H H H HH H H H H H
H C C HC H C C H
H
H
HC H
Si
Si
Si
O
O
HCH
CH H
HCH
HCH
表面活性由-CH2-体现 由-CH3来体现
表面能为30dyn/cm或更高 表面能约为20dynቤተ መጻሕፍቲ ባይዱcm
水面上一株茁壮的水草 一朵盛开的睡莲
有机硅表面活性剂
浙江大学化学系 陈关喜
2008.09
CHENLI
1
简介
有机硅表面活性剂
一个全甲基化的硅氧烷为亲油基团 一个或多个亲水基团
表面张力
烃类表面活性剂~30dyn/cm 有机硅表面活性剂仅为~20dyn/cm
有机硅表面活性剂能胜任普通表面活性剂 不能使用的场合 既能用于水性介质,也能用于非水介质
OH 来源 —聚醚的端基;游离聚乙二醇
CHENLI
12
直接开环聚合
Si H +
O O
Si
O
O
≡Si-H + CH2=CHCH2OH → ≡SiCH2CH2CH2OH
≡Si-H + CH2=CHCH2NH2 → ≡SiCH2CH2CH2NH2
上述含活性基团的硅氧烷起始EO, PO的开环聚合
CHENLI
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
R
R
R
CHENLI
6
A-B-A型嵌段共聚物
R H2CH2CH2C Si O Si O Si CH2CH2CH2 R
有机硅化合物作中间体合成反应
4、缩合反应
TiCl4催化下与醛酮缩合,具有良好的区域选择性和 立体选择性
OSiMe3 R1COR2
TiCl4 R
O TiCl3 H2O
O
R R1
R2
O
OH
R R1
R2
The Mukaiyama reaction
O Ph
Ph
Ph 1. Base
Me 2. Me3SiCl Ph
-Me3SiCl
Cl Cl Cl
Pr
Me3Si
O
Pr
Pr
Me3Si [H]
H
OH 苏式
Pr
Pr
H
Me3Si
H Pr
OH
Pr H
Pr KOH
H
BF3.Et2O
Pr
H
H +
Pr
Me3SiOH
Pr + Me3SiF
H
3、烃化反应
H
SiMe3 R2X
H
R
Li
R
SiMe3 1. [O]
R2
2. H2O
RCH2COR
H
SiMe3
R
Li
O RCH2C
NNHTs
1. n-BuLi
2. Me3SiCl SiMe3
OH Na2Cr2O7 H2SO4
SiMe3 O
三、烯丙基硅烷作中间体
1.制备
对称结构
Mg
Cl
Me3SiCl MgCl
BuLi
Me3SiCl Li
SiMe3 SiMe3
烯丙基金属化合物不对称
Cl Mg
SiMe3 +
- 取代 75%
有机硅2

2.
t
B u M e 2 S iC l
O S iM e 2 B u t
主要产物
(三)α, β-不饱和醛酮的共轭加成反应 1.1,4-氢硅化反应
4 3
E t 3 S iH CHO 2 1 (P h 3 P ) 3 R h C l
1 ,4 -加 成
H 2O O S iM e 3 C H 3 O H CHO
COOEt Na 甲苯 COOEt ONa O S iM e 3 ONa TM S Cl O S iM e 3
2、α,β-不饱和酮用金属锂/液氨/叔丁醇还原
1.
L i/N H 3 , t B u O H 2. T M S C l/E t N
3
O
M e 3 S iO
H
历程:
Li O O O Li
BuO H O O
C H 2P P h3 W ittig 反 应 P h3S i R C CH2
烷基α-羰基硅烷可以通过下面两类反应制烯醇硅醚:
①烷基α-羰基硅烷与乙烯基溴化镁反应:
O C H 3 (C H 2 ) C S iM e 3 M gBr C H 3 (C H 2 ) 2
OH C S iM e 3 R Li
A g2O DMSO
O S iM e 3
g
O
A g (0 )
O
O
3、制备α -乙酰氧基酮和α -羟基酮
O S iM e 3 P b (O A c ) 4 Cl Cl O S iM e 3 C H 2O A c OAc H 2O + H Cl O C H 2O A c
α-乙酰氧基 酮
CH3 O O S iM e 3 P b (O A c ) 4 CH3 O C H 3C O O O H3 O O
t
B u M e 2 S iC l
O S iM e 2 B u t
主要产物
(三)α, β-不饱和醛酮的共轭加成反应 1.1,4-氢硅化反应
4 3
E t 3 S iH CHO 2 1 (P h 3 P ) 3 R h C l
1 ,4 -加 成
H 2O O S iM e 3 C H 3 O H CHO
COOEt Na 甲苯 COOEt ONa O S iM e 3 ONa TM S Cl O S iM e 3
2、α,β-不饱和酮用金属锂/液氨/叔丁醇还原
1.
L i/N H 3 , t B u O H 2. T M S C l/E t N
3
O
M e 3 S iO
H
历程:
Li O O O Li
BuO H O O
C H 2P P h3 W ittig 反 应 P h3S i R C CH2
烷基α-羰基硅烷可以通过下面两类反应制烯醇硅醚:
①烷基α-羰基硅烷与乙烯基溴化镁反应:
O C H 3 (C H 2 ) C S iM e 3 M gBr C H 3 (C H 2 ) 2
OH C S iM e 3 R Li
A g2O DMSO
O S iM e 3
g
O
A g (0 )
O
O
3、制备α -乙酰氧基酮和α -羟基酮
O S iM e 3 P b (O A c ) 4 Cl Cl O S iM e 3 C H 2O A c OAc H 2O + H Cl O C H 2O A c
α-乙酰氧基 酮
CH3 O O S iM e 3 P b (O A c ) 4 CH3 O C H 3C O O O H3 O O
高等有机化学PPT课件

CH3CONHNH2 HNO2 CH3CON3
CH3NCO
X
O
C=NOH
CH3NCO
X
O
O
C N O C NHCH3
乃春在芳环邻位是不饱和支链时,极易环化成五元环,这一 性质对杂环的合成具有重要意义:
AX B
H N:
A BX
N
H
第三节:自由基
自由基是共价键发生均裂,每个碎片各保留一个电子,是带 单电子的三价碳的化合物。
2004年1版 6、洪琳编《有机反应活性中间体》高等教育出版社1999.6第一版 7、斯图尔特.沃伦著《有机合成――切断法探讨》丁新腾译,上海科学
技术文献出版社1986年1月第一版 8、黄宪、吴世晖、徐汉生《有机合成》(上、下)
第一章 有机反应活泼中间体及在合成上的应用
在有机反应中,经常出现的活泼中间体是卡宾、乃春、自由基、碳正离子、 碳负离子(包括苯炔、叶立德)
第一章 有机反应活泼中间体 及在合成上的应用
第一节:卡宾(碳烯)(Carbene) 第二节: 乃春 第三节:自由基 第四节:碳正离子 第五节、碳负离子(Carbenion)(活泼亚甲基
化合物)和叶立德
第二章 官能团的选择性互变
第一节 还原反应 第二节 氧化反应
第三章 官能团的保护
第一节: 羟基的保护(醇、酚羟基的保护) 第二节:烯键的保护 第三节:羰基的保护(用醇保护) 第四节:羧基的保护-酯化 第五节:胺基的保护-酰化或成盐
(六)生物有机化学( Bioorganic Chemistry) (七)元素和金属有机化学(Element and Metal Organic Compounds Chemistry) (八)有机化学中的一些重要应用研究
有机硅化合物

3.1.2 硅和碳与氢成键的性质比较
C—H ,Si—H 均比较稳定
1.离解能方面: C — H 438KJ/mol(CH4);367KJ/mol(Ph—CH3)
Si—H 303.8KJ/mol
2.电负性方面:Si—1.74 H—2.1 C—2.5
Si — HC— H来自1.74 2.1 小大
2.5 2.1 大小
3.3.3 有机硅商品以及有关的硅无机物
1.硅 2.二氧化硅 3.硅油 4.硅胶 5.硅树脂 6.硅塑料 7.硅溶胶 8.硅橡胶
3.4 有机硅化合物的分类,制备和 性质
3.4.1 四烷基硅烷
这类化合物,如果烷基是无取代基或无重键的,都 相当稳定.只有在强烈条件下才会分解.四甲基硅烷在 700℃以下比较稳定.四苯基硅烷在空气中,430 ℃时还能 蒸馏而无分解.这类化合物能用硫酸洗涤以除去杂质. 1.对称四烷基硅烷的制备
(1) Me3Si-的正常诱导效应
3个甲基的推电子作用较大,硅原子的电负性又较小, 所以三甲硅基的推电子能力很大,具有+I效应.
Me3Si-的推电子作用使碱性加强很多,使酸性减弱.
(2)在芳烃化合物中出现的复杂性
按照上述规律,
酸性应比
弱
Me3Si
COOH
的多,但事实上,在水中,前者只是比后者略弱一点,而在 乙醇-水中,前者比后者又略强一些.
其中:EI是亲电试剂.
Ⅰ.芳基硅烷中碳原子受亲电试剂进攻引起的硅碳单键断裂
例如:
Ⅱ.芳基硅烷中硅原子受亲核试剂进攻引起的硅碳单键断裂
这种反应的活性虽比前一类要差一些,但它生成碳烯 或碳负离子,避免了要用强碱性或强还原性的反应条件:
Ⅲ.烷基硅烷中碳原子受亲核试剂进攻引起的硅碳单键断裂 Ⅳ.烷基硅烷中硅原子受亲核试伎进攻引起的硅碳单键断裂
有机硅讲座PPT学习教案(2024版)

第16页/共86页
第一部分 二甲基二氯硅烷的水解
其水解反应的机理可表示为:
第17页/共86页
第一部分 二甲基二氯硅烷的水解
研究结果证明:Si-Cl键的水解发生的是亲核取代反应,是二级反应,即SN2反应。水分子从氯原子的背后进攻活性中心,Si原子形成五配位的过渡态:
第15页/共86页
第一部分 二甲基二氯硅烷的水解二、氯硅烷的水解反应机理及动力学
Si-Cl键是很活泼的键,其水解非常迅速,以至在正常的条件下难以监测水解反应,对研究其动力学及反应机理带来困难。 研究氯硅烷的水解速度通常是将其溶于溶剂(如二氧六环、二甲基乙二醇醚),在少量水的存在下,进行观察。
第7页/共86页
第一部分 二甲基二氯硅烷的水解
(1)可混溶于水的惰性溶剂
四氢呋喃、二氧六环等。
n=3、4、5…… 环硅氧烷(主)
第8页/共86页
第一部分 二甲基二氯硅烷的水解
(2)不溶于水或微溶于水的溶剂
甲苯、二甲苯、乙醚、二丁醚、三氯乙烯等。
(主) (少)
第10页/共86页
第一部分 二甲基二氯硅烷的水解
(3)非极性溶剂
庚烷等。
(主)
用MgCO3作酸吸收剂,可得高羟基含量的羟基硅油。为什么?
第11页/共86页
第一部分 二甲基二氯硅烷的水解
初级水解产物:
溶于水;不溶于庚烷
在高温下惰性气体中,端OH基聚硅氧烷,会发生硅氧烷分子主链的解扣式降解反应,形成小分子环硅氧烷:
在更高的温度下,会发生Si-O-Si主链的热重排降解:
第28页/共86页
第二部分 聚硅氧烷的裂解反应
另外在300℃以上,Si-C键也会断裂,同时产生CH4气体
第29页/共86页
第一部分 二甲基二氯硅烷的水解
其水解反应的机理可表示为:
第17页/共86页
第一部分 二甲基二氯硅烷的水解
研究结果证明:Si-Cl键的水解发生的是亲核取代反应,是二级反应,即SN2反应。水分子从氯原子的背后进攻活性中心,Si原子形成五配位的过渡态:
第15页/共86页
第一部分 二甲基二氯硅烷的水解二、氯硅烷的水解反应机理及动力学
Si-Cl键是很活泼的键,其水解非常迅速,以至在正常的条件下难以监测水解反应,对研究其动力学及反应机理带来困难。 研究氯硅烷的水解速度通常是将其溶于溶剂(如二氧六环、二甲基乙二醇醚),在少量水的存在下,进行观察。
第7页/共86页
第一部分 二甲基二氯硅烷的水解
(1)可混溶于水的惰性溶剂
四氢呋喃、二氧六环等。
n=3、4、5…… 环硅氧烷(主)
第8页/共86页
第一部分 二甲基二氯硅烷的水解
(2)不溶于水或微溶于水的溶剂
甲苯、二甲苯、乙醚、二丁醚、三氯乙烯等。
(主) (少)
第10页/共86页
第一部分 二甲基二氯硅烷的水解
(3)非极性溶剂
庚烷等。
(主)
用MgCO3作酸吸收剂,可得高羟基含量的羟基硅油。为什么?
第11页/共86页
第一部分 二甲基二氯硅烷的水解
初级水解产物:
溶于水;不溶于庚烷
在高温下惰性气体中,端OH基聚硅氧烷,会发生硅氧烷分子主链的解扣式降解反应,形成小分子环硅氧烷:
在更高的温度下,会发生Si-O-Si主链的热重排降解:
第28页/共86页
第二部分 聚硅氧烷的裂解反应
另外在300℃以上,Si-C键也会断裂,同时产生CH4气体
第29页/共86页
2024版《有机化学发展》ppt课件

功能材料分类
根据功能特性不同,可分为光、电、磁、热、声、 机械等功能材料;根据应用领域不同,可分为能源、 信息、生物、环境等功能材料。
功能材料在催化领域应用
催化剂载体
功能材料可作为催化剂载体,提高催化剂的分散性、稳定性和活 性。
光电催化
利用功能材料的光电性质,实现光能向化学能的转化,如光解水制 氢、光催化降解有机物等。
《有机化学发展》ppt课件
目录
• 有机化学概述 • 有机化学基本原理与反应类型 • 天然产物合成与结构鉴定方法 • 功能材料在有机化学中应用 • 生物活性物质与药物设计合成策略 • 绿色合成方法和技术在有机化学中应用 • 未来发展趋势和挑战
01
有机化学概述
Chapter
有机化学定义与特点
定义
有机化学是研究有机化合物结构、 性质、合成、反应机理及其应用的 科学。
药物设计原理和方法
药物设计原理
基于生物化学、分子生物学、结构生物学等原理,通过计 算机辅助设计、高通量筛选等方法进行药物设计。
药物设计方法
包括基于靶点结构的药物设计、基于配体的药物设计、基 于代谢途径的药物设计等。
药物设计流程
从靶点选择、药物设计、合成与筛选到临床前研究等步骤。
典型药物合成案例剖析
电催化
功能材料在电催化领域也有广泛应用,如燃料电池中的催化剂、电 解水中的电极材料等。
功能材料在光电领域应用
1 2
光电导材料 具有光电导性质的功能材料,可用于制作光电导 器件,如光电导鼓、光电导开关等。
发光材料 功能材料中的发光材料在显示、照明等领域有广 泛应用,如LED、OLED等发光器件。
3
光伏材料
核磁共振法
利用核磁共振现象研究化合物结构,包括1H NMR、13C NMR、31P NMR等
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
阿尔贝特·拉登堡
1872:(Albert Ladenburg,
1842年7月2日生于曼
合成功海能姆化,的1911年8月15日 硅烷卒 德单于 国体弗 化罗 学茨 家瓦。夫),
12
1885:(A. Polis)
钠缩合反应合成 SiPh4
有机硅的发展简史 成长期:1904-1937年
He pioneered the study of the organic compounds of silicon (organosilicon) and coined the term silicone. His research formed the basis for the worldwide development of the synthetic rubber and silicone-based lubricant industries.
2013国内有机硅单体厂家年产能统计(2013-12-23 ) 【全球有机硅网讯】:
新安化工:30万吨/年(28) 浙江合盛:18万吨/年 山东东岳:20万吨/年 浙江中天:8万吨/年 浙江恒业成:25万吨/年 四川硅峰:3万吨/年 山东鲁西:6万吨/年 合计:221万吨/年
蓝星星火:20万吨/年 唐山三友:10万吨/年 江苏弘博:10万吨/年 张家港基地:40万吨/年
交联反应类型
19
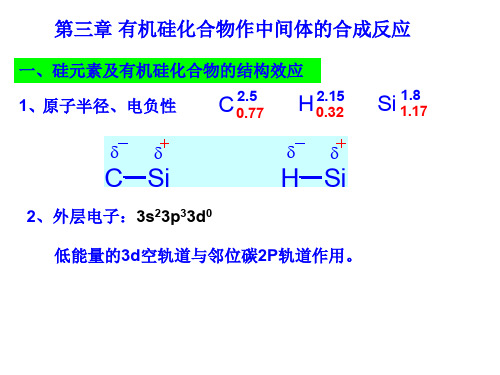
1.硅键类型以及特性
电负性以及离子性 硅和碳同属元素周期表ⅣA族,它们所形成化合物有类似
之处,它们各处于不同周期,所形成的化合物及其性质就有差 异。 ①电子构型不同
Si:
C:
20
1.硅键类型以及特性
硅或碳所形成化合物共价键能比较键 能(KJ/mol)
Si键
键能
C键
键能
Si-Si
222
1943年道化学与康宁玻璃公司合资成立道 康宁(Dow Corning)公司,专门从事有机硅生 产与研究。
1947年通用电气(General Electric)公司 成立有机硅部,并采用直接法生产的有机氯硅 烷制取聚硅氧烷产品。 1938-1965年期间有机硅化学是在飞跃地发展
14
有机硅的发展简史
7
生命硅直饮机
生命硅美肤机
生命硅美颜液
生命硅外用液
硅与人类历史的发展 石器时代 封建时代
8
硅与人类历史的发展 工业时代 现代社会
9
有机硅的发展简史
无机 硅
?
有机 硅
10
有机硅的发展简史
成熟期:1966-至今 发展期:1905-1965 成长期:1904-1937 创始期:1863-1903
有机硅的发展简史 创始期:1863-1903年
山东金岭:15万吨/年 山西三佳:8万吨/年 湖北兴发:8万吨/年
第一部分 有机硅基元反应
18
目录
1.硅键类型以及特性 2. 硅烷类单体
2.1有机氯硅烷单体 2.2硅官能有机硅烷 2.3硅烷偶联剂
3. 有机聚硅氧烷
3.1 二氯二甲基硅烷的水解反应 3.2 聚硅氧烷的裂解反应
4. 硅树脂以及硅橡胶
离子化 12% 50 % 30 % 30 % 2%
离子化键能(KJ/mol-1) 932
1014.2 796.2
1045
硅与非金属元素的原子形成共价键,而这些共价 键具有一定的离子化特征。讨论硅键活性时,要考虑反应机理 以及两种键能的大小。
22
有机硅基元反应
硅油
硅烷
有机 硅
硅橡 胶
硅树 脂
有机硅基元反应
目录
有机硅发展史 有机硅基元反应 硅氢加成反应
2
序幕:有机硅发展史
3
硅元素
4
生命硅
人们认识硅元素对生物界的重要性历史并不长。在上世纪70年代以前基 本上是一无所知的,因为没有任何方法能够测量出在动物体的硅含量。然而,自 从1952年CHARONT和AUSTN提出了硅元素在生物学上的重要性,并第一次提出“有 机硅元素”的概念。接着美国的CARLISLE.SCHWARZ和法国的 LOEPER.CHARNPT.PERES进行了一些重要的工作,然后是EISINGER.LEVRIER和 NENROTTE.BROWN.FREFERT也在这方面做出了重要的贡献。
在生物有机体内硅元素以烷基硅醇(aIKyISiano)的状态存在,主要是 单甲基硅烷醇和二甲基硅烷醇,含量的比例几乎是80/20。已经证明硅元素是生 物正常生存发展的必要元素,它的减少会引发结缔组织的变性,硅元素能够帮助 被破坏的组织再生。通过实验被证明,硅元素主要存在于细胞外间质中,是结缔 组织中的糖胺聚糖和相关的蛋白质复合物构成整体所需要的成分之一。后续实验 结果都证明,硅元素对人体健康与疾病预防是所必需的元素,也是不可替代的元 素之一。
5
自然界的硅元素 偏硅酸(H2SiO3)
6
自然界的硅元素 水溶性硅元素(不定形结晶体SiO32-)
1、物理特性:溶解性 结晶体,呈绿色、无色、 白色、透明或半透明 不定型晶体状。 2、化学特性:无放射 性,无爆炸性、无毒 性、无菌性。 3、超强的渗透性 4、超强的杀菌性 5、超强的消炎力 6、超强的洗净力 7、超强的再生力
C-Si
318
Si-C
318
C-C
345
Si-H
318
C-H
413
Si-O
451
C-O
357
Si-N
——
C-N
304
Si-F
564
C-F
485
Si-C
l380
C-C
l339
Si-Br
309
C-Br
284
Si-I
234
C-I
213
21
1.硅键类型以及特性
硅键的离子化特征及键能
键型 Si-C Si-O Si-Cl Si-N Si-H
德国化学家迪尔塞(W. Dilthey) 应用格利雅法合成有机硅化合物。 Ph2SiCl2水解成Ph2Si(OH)2,缩合得到六苯基环三硅氧烷 (Ph2SiO)3 。
13
有机硅的发展简史 发展期:1938-1965年
1941年Rochow发明了“直接法合成氯硅烷 单体”并申请了专利。
1942年美国道(Dow)化学公司建成了甲基 苯基硅树脂及二甲基硅油中间试验装置。
成熟期:1966年-至今 一方面:大力巩固、改进和发展已有的科研
及生产成果, 另一方面:又向更新更广的应用领域进军。
15
我国有机硅的发展
1952年:
中国的有机硅技术开发起步于 1952年。
1956年:
沈阳化工研究院建成有机硅中试 车间。
1958年:
16
上海树脂厂建成直接法合成有机
我国有机硅的发展
