细菌总蛋白的提取方法
细菌总蛋白的提取方法

细菌总蛋白的提取方法1.培养和收获细菌:首先,选择一种适合您研究目的的细菌株,并在含有适当的培养基的培养皿中培养。
培养温度和时间可以根据具体的细菌株来确定。
在培养到合适的生长期后,用无菌的锥形管或离心管收获细菌。
2. 细胞裂解:将细菌细胞分装到无菌的离心管中,然后通过使用裂解剂来破坏细胞膜并释放蛋白质。
常用的裂解剂有琼脂糖凝胶电泳缓冲液(Tris-HCl),盐溶液(如NaCl)、肌凝蛋白合成抑制剂(例如氯霉素)和酶抑制剂(如苯甲砜)。
可以根据具体实验要求进行调整。
3.细胞裂解方法:细胞裂解方法有多种,常用的有超声波法、冻融法、压力法和化学分解法等。
其中,超声波法是最常用的方法之一、将装有细胞的离心管放入冰桶中,使用超声波处理器将细胞破碎。
超声波处理时间和强度可根据具体细菌株的要求进行调整。
其他方法也可根据实验要求进行选择。
4.离心:将经过细胞裂解的混合物离心,以除去碎片、膜片和细胞碎片。
将裂解液转移到一个新的离心管中。
5.蛋白质沉淀:在裂解液中添加适当的蛋白质沉淀剂(如三氯醋酸、硫酸铵等),并在低温条件下静置一段时间,使蛋白质沉淀成块。
然后,使用离心将混合物分解为沉淀和上清液。
6.重悬和洗涤:将蛋白质沉淀用缓冲液或溶液重悬,并通过反复离心和洗涤步骤去除杂质和残留的蛋白质沉淀剂。
这可以通过溶剂中加入催化剂(如氯化铵)或重悬液进行移液或漩涡混合来实现。
7.可选的纯化步骤:根据研究需要,还可以对提取的细菌总蛋白进行进一步的纯化处理。
例如,可以使用离子交换层析、凝胶过滤、亲和层析和凝胶电泳等技术来获得纯化的蛋白质。
8.存储:最后,将提取的细菌总蛋白通过冷冻或冷冻干燥等方法进行储存,以便将来使用。
以上是一种常见的细菌总蛋白提取方法。
具体的步骤和条件可能会根据研究目的和细菌株而有所不同。
因此,在进行实验之前,建议参考相关文献以获取更准确的方法和条件。
总蛋白提取方法

Fish & Shellfish Immunology
2012
(IF=3.322)
● Pin Huan et al.
Comparative proteomic analysis of challenged Zhikong scallop (Chlamys
farreri): A new insight into the anti-Vibrio immune response of marine bivalves
分钟。
4. 将上清吸入另一预冷的干净离心管,即得到总蛋白。
5. 将上述蛋白提取物定量后分装于-80℃冰箱保存备用或直接用于下游实验。
参考文献:
● Pin Huan, Hongxia Wang et al.
Identification of differentially expressed proteins involved
有效期: 一年。
产品简介: 贝博总蛋白提取试剂盒适用于从各种原代或传代细胞和各种实体组织,如脑、脊髓、
神经结或纤维、脂肪、肝脏、消化道、肾脏、心脏、肌肉、血管、结缔组织等哺乳动物组织 中提取总蛋白。提取过程简单方便,可在 1 小时内完成。该试剂盒含有的蛋白酶抑制剂混合 物,阻止了蛋白酶对蛋白的降解,为提取高纯度的蛋白提供了保证。本试剂盒含有的独特配 方能够溶解细胞膜包括细胞质膜和核膜。提取的蛋白可用于 Western Blotting、蛋白质电 泳、免疫共沉淀等下游蛋白研究。
Fish & Shellfish Immunology
2011 Volume 31, Issue 6 , Pages 1186-1192 (IF=3.322)
● Liu Tao, Chen Suhua et al.
细菌蛋白提取方法(双向电泳用)

产品组成:
产品组成 规格
细菌蛋白提取液 A(2D) 细菌蛋白提取液 B
蛋白酶抑制剂混合物
BB-3182-1 50 assays
25ml 250ul 100ul
பைடு நூலகம்
BB-3182-2 100 assays
50ml 500ul 200ul
储存条件: 蛋白提取液 A 室温保存; 蛋白提取液 B 和蛋白酶抑制剂-20℃保存。
产品号 BB-3108 BB-3103 BB-3401 BB-3721 BB-3151 BB-3124
细菌蛋白提取试剂盒 酵母蛋白提取试剂盒 磷酸化蛋白提取试剂盒 SDS-PAGE 凝胶配制试剂盒
BB-3123 BB-3125 BB-3105 BB-3702
植物膜蛋白提取试剂盒 蛋白酶抑制剂混合物 磷酸酶抑制剂混合物 SDS-PAGE 上样 Buffer
有效期: 一年。
产品简介: 贝博细菌总蛋白提取试剂盒(双向电泳用)可以从各种原核细菌样本中提取总蛋白,
提取过程简单方便。该试剂盒含有蛋白酶抑制剂混合物,阻止了蛋白酶对蛋白的降解,为提 取高质量的蛋白提供了保证。
提取的蛋白用于双向电泳。如需要用于报告基因检测、SDS-PAGE 电泳检测、Western blotting、
BB-3152 BB-3301 BB-3311 BB-3703
凝胶阻滞实验、免疫共沉淀、酶活分析等下游实验的试剂盒,请联系本公司选购其他货号的试剂盒。
使用方法: 裂解液的准备:根据所需要提取的样本量,每 500ul 蛋白提取液中 A 加入 5ul 试剂 B 和 2ul 蛋白酶抑制剂混合物,充分混匀后置冰上备用。 在 4℃ 12000RPM 条件下将菌液离心 5min,弃上清,尽量吸干剩余液体,收集菌体, 用 PBS 洗菌体 2 次。若为冷冻菌体直接进行下面操作步骤即可。 按每 20mg 湿重菌体样本加入 500ul 裂解液,吹打混匀,冰上放置 30 分钟,间隔一 段时间振荡。(选做步骤:300w,10s 超声/10s 间隔条件下冰浴超声至菌液变清。 若不做,请延长裂解液作用时间至 2 小时。) 在 4℃ 12000RPM 条件下将提取液离心 5 分钟。 快速将上清吸入另一预冷的干净离心管,即可得到细菌总蛋白。 将上述蛋白提取物定量①后分装于-80℃冰箱保存备用或直接用于下游实验。
细菌总蛋白提取实验报告

电厂机械专业个人工作总结在过去的一年里,我在电厂机械专业工作中取得了许多成绩和进步。
在这段时间里,我主要负责电厂机械设备的维护和运行管理工作,下面是我的个人工作总结:一、技术能力提升:在这一年里,我不断学习和提升自身的技术能力,通过参加培训课程和自主学习,我对电厂机械设备的原理和运行技术有了更深入的理解。
我也学会了运用新的维修工具和设备,提高了维修效率和质量。
二、工作质量和效率:在工作中,我始终秉承着“质量第一,服务至上”的原则,认真负责地完成每一个维修任务。
在我的努力下,电厂机械设备的故障率得到了有效降低,设备的运行效率和稳定性有了明显提升,为电厂的正常运行提供了有力保障。
三、团队合作能力:在工作中,我善于和同事们进行合作,共同解决遇到的问题。
在日常维修和设备运行管理中,我和同事们相互协作,密切配合,提高了工作效率,也增强了团队的凝聚力和战斗力。
四、安全意识和责任心:在电厂机械工作岗位上,安全意识和责任心是至关重要的。
我时刻牢记安全生产第一,严格遵守操作规程和安全操作流程。
在工作中,我以高度的责任心对待工作,积极关注设备运行状态,及时发现问题并及时处理,努力做到“事前预防、事中控制”。
总的来说,这一年是我在电厂机械专业工作中不断进步、努力奋斗的一年,我的工作总结中也记录了这一年来的成果和收获。
在未来的工作中,我将继续不断提升自身的技术能力和综合素质,为电厂机械设备的安全运行和高效运行贡献自己的力量。
在电厂机械专业工作中,我深刻认识到自身在技术、责任、团队合作以及安全意识方面的不足,因此在过去的一年中,我不断加强学习,提高自身综合素质。
在接下来的工作中,我将进一步加强自身的学习,提高技术能力,丰富实践经验,不断改进并完善现有的维护和管理方案,实现更好的工作成果。
在提升技术能力方面,我将加强对电厂机械设备的系统性学习,深入了解各类设备的原理和结构,学习高级维修技术,提高对设备故障的诊断和处理能力。
细菌外膜蛋白提取方法
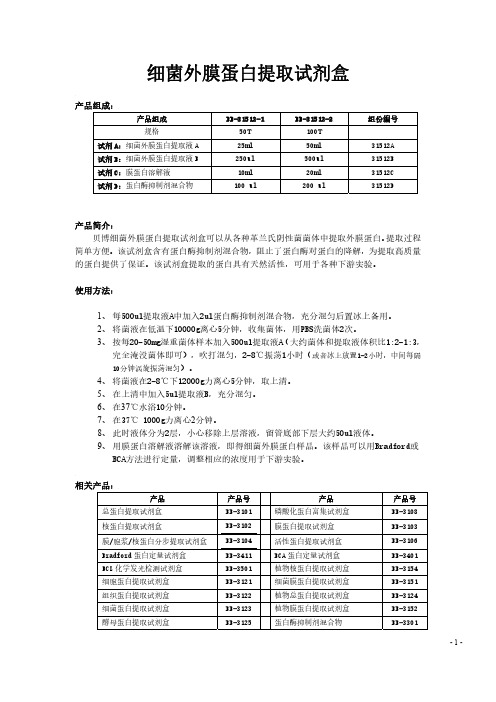
细菌外膜蛋白提取试剂盒产品组成:产品组成 BB-31512-1 BB-31512-2 组份编号规格 50T 100T试剂A:细菌外膜蛋白提取液A 25ml 50ml 31512A试剂B:细菌外膜蛋白提取液B 250ul 500ul 31512B试剂C:膜蛋白溶解液 10ml 20ml 31512C试剂D:蛋白酶抑制剂混合物 100 ul 200 ul 31512D产品简介:贝博细菌外膜蛋白提取试剂盒可以从各种革兰氏阴性菌菌体中提取外膜蛋白。
提取过程简单方便。
该试剂盒含有蛋白酶抑制剂混合物,阻止了蛋白酶对蛋白的降解,为提取高质量的蛋白提供了保证。
该试剂盒提取的蛋白具有天然活性,可用于各种下游实验。
使用方法:1、每500ul提取液A中加入2ul蛋白酶抑制剂混合物,充分混匀后置冰上备用。
2、将菌液在低温下10000g离心5分钟,收集菌体,用PBS洗菌体2次。
3、按每20-50mg湿重菌体样本加入500ul提取液A(大约菌体和提取液体积比1:2-1:3,完全淹没菌体即可),吹打混匀,2-8℃振荡1小时(或者冰上放置1-2小时,中间每隔10分钟涡旋振荡混匀)。
4、将菌液在2-8℃下12000g力离心5分钟,取上清。
5、在上清中加入5ul提取液B,充分混匀。
6、在37℃水浴10分钟。
7、在37℃ 1000g力离心2分钟。
8、此时液体分为2层,小心移除上层溶液,留管底部下层大约50ul液体。
9、用膜蛋白溶解液溶解该溶液,即得细菌外膜蛋白样品。
该样品可以用Bradford或BCA方法进行定量,调整相应的浓度用于下游实验。
相关产品:产品 产品号 产品 产品号 总蛋白提取试剂盒BB-3101 磷酸化蛋白富集试剂盒 BB-3108核蛋白提取试剂盒 BB-3102 膜蛋白提取试剂盒 BB-3103膜/胞浆/核蛋白分步提取试剂盒 BB-3104 活性蛋白提取试剂盒 BB-3106Bradford蛋白定量试剂盒 BB-3411 BCA蛋白定量试剂盒 BB-3401ECL化学发光检测试剂盒 BB-3501 植物核蛋白提取试剂盒 BB-3154细胞蛋白提取试剂盒 BB-3121 细菌膜蛋白提取试剂盒 BB-3151组织蛋白提取试剂盒 BB-3122 植物总蛋白提取试剂盒 BB-3124细菌蛋白提取试剂盒 BB-3123 植物膜蛋白提取试剂盒 BB-3152酵母蛋白提取试剂盒 BB-3125蛋白酶抑制剂混合物 BB-3301- 1 -昆虫蛋白提取试剂盒 BB-3126真菌蛋白提取试剂盒 BB-3127磷酸化蛋白提取试剂盒 BB-3105 磷酸酶抑制剂混合物 BB-3311SDS-PAGE凝胶配制试剂盒 BB-3702 SDS-PAGE上样Buffer BB-3703总蛋白提取试剂盒(2D电泳用) BB-3181 细菌蛋白提取盒(2D电泳用) BB-3182植物蛋白提取盒(2D电泳用) BB-3183 酵母蛋白提取盒(2D电泳用) BB-3185细菌膜蛋白提取盒(2D电泳用) BB-3187 线粒体蛋白提取盒(2D电泳用)BB-3191- 2 -。
细菌总蛋白的提取方法

细菌总蛋白的提取方法
提取细菌总蛋白的方法通常包括以下步骤:
1. 细菌培养和收获:选择合适培养基和条件培养目标细菌,使其达到适宜生长状态。
收获培养好的细菌,通常通过离心将菌体沉淀。
2. 细胞破碎:将细菌菌体溶解或破碎,以释放细胞内的蛋白质。
常用方法包括超声波破碎、机械破碎或酶解。
3. 蛋白质提取:将破碎的细菌溶液进行离心或超速离心,以去除细胞壁、细胞膜和细胞碎片。
收集上清液,即含有细菌总蛋白的提取物。
4. 蛋白质纯化:对提取物进行蛋白质纯化,以去除杂质和富集目标蛋白质。
常用方法包括离子交换层析、凝胶过滤层析、亲和层析等。
5. 蛋白质浓缩:对纯化后的蛋白质进行浓缩,以使其浓度增加并去除冗余缓冲液。
常用方法包括醋酸铵沉淀、凝胶浓缩或超滤。
6. 蛋白质分析和保存:对浓缩后的蛋白质进行测定和分析,如酶活性测定、SDS-PAGE凝胶电泳等。
将测定和分析完的蛋白质按照适当条件保存,如冻干、冷冻或低温保存。
需要注意的是,细菌总蛋白的提取方法可能因具体实验目的、所用细菌种类和设备条件等因素而有所不同,上述步骤仅为一般提取方法的参考。
在具体实验中应根据实际情况进行优化和调整。
细菌总蛋白和膜蛋白提取方法

[【生物化学与分子生物学】]细菌总蛋白和膜蛋白提取方法膜蛋白, 细菌膜蛋白, 细菌一、从新鲜样品中提取总蛋白(简易法)1、自配裂解液(pH 8.5-9.0):50 mM Tris-HCl,2 mM EDTA, 100 mM NaCl,0.5% Triton X-100,调pH值至8.5-9.0备用;用前加入100 μg/ml 溶菌酶,1μl/ml 的蛋白酶抑制剂PMSF。
该裂解液用量为10-50ml 裂解液/1g湿菌体。
2、将40ml 菌液在12000g,4℃下离心15分钟收集菌体,沉淀用PBS悬浮洗涤2遍,沉淀加入1ml裂解液悬浮菌体。
3、超声粉碎,采用300w,10s超声/10s间隔,超声20min,反复冻融超声3次至菌液变清或者变色。
4、1000g离心去掉大碎片,上清可直接变性后PAGE电泳检测,或者用1% SDS溶液透析后冻存。
缺点:Western blotting结果表明,疏水性跨膜蛋白提取效率有限。
二、从Trizol裂解液中分离总蛋白1、Trizol溶解的样品研磨破碎后,加氯仿分层,2-8℃下10000g离心15min,上层水相用于RNA提取,体积约为总体积的60%。
2、用乙醇沉淀中间层和有机相中的DNA。
每使用1ml Trizol加入0.3ml无水乙醇混匀,室温放置3min,2-8℃不超过2000g离心5min。
3、将上清移至新的EP管中,用异丙醇沉淀蛋白质。
每使用1ml Trizol加入1.5ml异丙醇,室温放置10min,2-8℃下12000g离心10min,弃上清。
4、用含有0.3M 盐酸胍的95%乙醇洗涤。
每1ml Trizol加入2ml洗液,室温放置20min,2-8℃下7500g 离心5min,弃上清,重复洗涤2次。
最后加入2ml无水乙醇,涡旋后室温放置20min,2-8℃下7500g离心5min,弃上清。
5、冷冻干燥5-10min,1%SDS溶液溶解,反复吹打,50℃温浴使其完全溶解,2-8℃下10000g离心10min去除不溶物。
血清总蛋白和蛋白检测方法综述

血清总蛋白和蛋白检测方法综述[摘要](1)阐明了双缩脲法是目前国内外检测血清总蛋白和白蛋白最常用的方法;(2)明确检测血清总蛋白和白蛋白的分析性能要求;(3)强调血清总蛋白和白蛋白检测时的标本采集和保存要求。
[关键词]血清总蛋白白蛋白检测方法综述蛋白质在所有生命活动过程中起着极其重要的作用,据估计,迄今为止,人体内大约有50000多种蛋白质,而一个人体细胞内的蛋白质就达3000~5000种。
目前能识别的蛋白质已超过1400种,就连单细胞的细菌蛋白也多达3000多种。
在诸多蛋白中,被用于样品检测和临床辅助诊断率最高的是血清总蛋白和白蛋白,其主要检测标本有:血液、尿液、脑脊髓液、羊水、唾液、胸腔积液、腹腔积液以及粪便等。
1.血清总蛋白(total protein)检测1.1检测总蛋白的主要方法1.1.1双缩脲法(biuret method)利用蛋白质分子中的肽键(一CONH一)能与双缩脲试剂(biuret teagent)中的CU2+结合产生紫色复合物,在波长540nm处检测吸收峰。
双缩脲法是检测血清蛋白的经典方法,经Doumas改良后的双缩脲试剂被美国临床化学协会标准化委员会和美国标准局(National Bureau of standards,即现在的美国标准计量研究所,NST)选用,作为血清蛋白检测标准化实验试剂,试剂在室内保存一年内不影响检测结果。
1.1.2直接光度检测法(direct photometric method)本法利用血清蛋白在一定紫外光波内有特异吸收峰(uv280nm)这一特点检测样品蛋白,此法常用于脑脊髓液蛋白的测定。
1.1.3染料结合法(dye-binding method)检测样品蛋白本法根据某些特殊染料(氨基黑10B和考马斯蓝Coomassic Br illiant blue CBB)能与多肽链中氨基酸残基的质子化基团结合,在460~595nm处有一光吸收峰的特点检测样品蛋白。
实验十聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质

实验⼗聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋⽩质实验⼗聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋⽩质【实验⽬的】1. 了解和掌握聚丙烯酰胺凝胶电泳的技术和原理;2. 掌握⽤此法分离蛋⽩质组分的操作⽅法。
【实验原理】在⽣物化学、分⼦⽣物学和基因(遗传)⼯程实验中,常常要进⾏蛋⽩质和核酸的分离⼯作。
聚丙烯酰胺凝胶电泳(Polyacrylamide Gel Electrophoresis, PAGE)是以聚丙烯酰胺凝胶作为⽀持介质进⾏蛋⽩质或核酸分离的⼀种电泳⽅法。
聚丙烯酰胺凝胶是由丙烯酰胺单体(acrylamide,简称ACR)和交联剂N,N-甲叉双丙烯酰胺(N,N-methylene bisacrylsmide 简称BIS)在催化剂的作⽤下聚合交联⽽成的三维⽹状结构的凝胶。
通过改变单体浓度与交联剂的⽐例,可以得到不同孔径的凝胶,⽤于分离分⼦量⼤⼩不同的物质。
聚丙烯酰胺凝胶聚合的催化体系有两种:(1)化学聚合:催化剂采⽤过硫酸铵,加速剂为N,N,N,N-四甲基⼄⼆胺(简称TEMED)。
通常控制这⼆种溶液的⽤量,使聚合在1⼩时内完成。
(2)光聚合:通常⽤核黄素为催化剂,通过控制光照时间、强度控制聚合时间,也可加⼊TEMED 加速反应。
聚丙烯酰胺凝电泳常分为⼆⼤类:第⼀类为连续的凝胶(仅有分离胶)电泳;第⼆类为不连续的凝胶(浓缩胶和分离胶)电泳。
⼀般地,不连续聚丙烯酰胺凝胶电泳有三种效应:①电荷效应(电泳物所带电荷的差异性);②凝胶的分⼦筛效应(凝胶的⽹状结构及电泳物的⼤⼩形状不同所致)。
③浓缩效应(浓缩胶与分离胶中聚丙烯酰胺的浓度及pH的不同,即不连续性所致)。
因此,样品分离效果好,分辨率⾼。
SDS即⼗⼆烷基硫酸钠(Sodium Dodecyl Sulfate,简称SDS)是阴离⼦表⾯活性剂,它能以⼀定⽐例和蛋⽩质结合,形成⼀种SDS-蛋⽩质复合物。
这时,蛋⽩质即带有⼤量的负电荷,并远远超过了其原来的电荷,从⽽使天然蛋⽩质分⼦间的电荷差别降低仍⾄消除。
细菌总蛋白的提取方法

细菌总蛋白和膜蛋白提取方法一、从新鲜样品中提取总蛋白(简易法)1、自配裂解液(pH ):50 mM Tris-HCl,2 mM EDTA, 100 mM NaCl,% Triton X-100,调pH 值至备用;用前加入100 μg/ml 溶菌酶,1μl/ml 的蛋白酶抑制剂PMSF。
该裂解液用量为10-50ml 裂解液/1g湿菌体。
2、将40ml 菌液在12000g,4℃下离心15分钟收集菌体,沉淀用PBS悬浮洗涤2遍,沉淀加入1ml裂解液悬浮菌体。
3、超声粉碎,采用300w,10s超声/10s间隔,超声20min,反复冻融超声3次至菌液变清或者变色。
4、1000g离心去掉大碎片,上清可直接变性后PAGE电泳检测,或者用1% SDS溶液透析后冻存。
缺点:Western blotting结果表明,疏水性跨膜蛋白提取效率有限。
二、从Trizol裂解液中分离总蛋白1、Trizol溶解的样品研磨破碎后,加氯仿分层,2-8℃下10000g离心15min,上层水相用于RNA提取,体积约为总体积的60%。
2、用乙醇沉淀中间层和有机相中的DNA。
每使用1ml Trizol加入无水乙醇混匀,室温放置3min,2-8℃不超过2000g离心5min。
3、将上清移至新的EP管中,用异丙醇沉淀蛋白质。
每使用1ml Trizol加入异丙醇,室温放置10min,2-8℃下12000g离心10min,弃上清。
4、用含有0.3M 盐酸胍的95%乙醇洗涤。
每1ml Trizol加入2ml洗液,室温放置20min,2-8℃下7500g离心5min,弃上清,重复洗涤2次。
最后加入2ml无水乙醇,涡旋后室温放置20min,2-8℃下7500g离心5min,弃上清。
5、冷冻干燥5-10min,1%SDS溶液溶解,反复吹打,50℃温浴使其完全溶解,2-8℃下10000g 离心10min去除不溶物。
6、替代方案:将3中的酚醇上清液移至小分子量透析袋中,在2-8℃的1% SDS溶液中透析3次,1000g离心10min去除沉淀,上清可直接用于蛋白实验。
蛋白提取方法

蛋白质提取的方法总汇 2005-4-15 23:00:00 来源:生命经1、植物组织蛋白质提取方法1、根据样品重量(1g样品加入3.5ml提取液,可根据材料不同适当加入),准备提取液放在冰上。
2、把样品放在研钵中用液氮研磨,研磨后加入提取液中在冰上静置(3-4小时)。
3、用离心机离心8000rpm40min4℃或11100rpm20min4℃4、提取上清夜,样品制备完成。
蛋白质提取液:300ml1、1Mtris-HCl(PH8) 45ml2、甘油(Glycerol)75ml3、聚乙烯吡咯烷酮(Polyvinylpolypyrrordone)6g这种方法针对SDS-PAGE,垂直板电泳!2、植物组织蛋白质提取方法三氯醋酸—丙酮沉淀法1、在液氮中研磨叶片2、加入样品体积3倍的提取液在-20℃的条件下过夜,然后离心(4℃8000rpm以上1小时)弃上清。
3、加入等体积的冰浴丙酮(含0.07%的β-巯基乙醇),摇匀后离心(4℃8000rpm以上1小时),然后真空干燥沉淀,备用。
4、上样前加入裂解液,室温放置30分钟,使蛋白充分溶于裂解液中,然后离心(15℃8000rpm以上1小时或更长时间以没有沉淀为标准),可临时保存在4℃待用。
5、用Brandford法定量蛋白,然后可分装放入-80℃备用。
药品:提取液:含10%TCA和0.07%的β-巯基乙醇的丙酮裂解液:2.7g尿素0.2gCHAPS溶于3ml灭菌的去离子水中(终体积为5ml),使用前再加入1M的DTT65ul/ml。
这种方法针对双向电泳,杂质少,离子浓度小的特点!当然单向电泳也同样适用,只是电泳的条带会减少!3、组织:肠黏膜目的:WESTERN BLOT检测凋亡相关蛋白的表达应用TRIPURE提取蛋白质步骤:含蛋白质上清液中加入异丙醇:(1.5ml每1mlTRIPURE用量)倒转混匀,置室温10min离心:12000 g,10min,4度,弃上清加入0.3M盐酸胍/95%乙醇:(2ml每1mlTRIPURE用量)振荡,置室温20min离心: 7500g,5 min,4度,弃上清重复0.3M盐酸胍/95%乙醇步2次沉淀中加入100%乙醇 2ml充分振荡混匀,置室温20 min离心: 7500g,5min,4度,弃上清吹干沉淀1%SDS溶解沉淀离心:10000g,10min,4度取上清-20度保存(或可直接用于WESTERN BLOT)存在的问题:加入1%SDS后沉淀不溶解,还是很大的一块,4度离心后又多了白色沉定,SDS结晶?测浓度,含量才1mg/ml左右。
细胞自噬诱导实验报告

细胞自噬诱导实验报告细胞自噬的实验观察,主要有四种方法。
1、提取总RNA,通过Real-time PCR 分析相关基因A TG4、A TG5和AT7G的表达;2、提取总蛋白,通过Western blotting 分析LC3的脂化;3、构建GFP-LC3表达载体,通过细胞转染利用荧光显微镜观察LC3颗粒的聚集;4、制备电镜样品,直接观察自噬体的形成。
一、pEGFP-C2-LC3质粒的提取与鉴定实验原理一、实验原理质粒(Plasmid)是一种染色体外的稳定遗传因子,为双链、闭环的DNA分子,并以超螺旋状态存在于宿主细胞中。
质粒主要发现于细菌、放线菌和真菌细胞中,它具有自主复制和转录能力,能在子代细胞中保持恒定的拷贝数,并表达所携带的遗传信息。
质粒的复制和转录要依赖于宿主细胞编码的某些酶和蛋白质,质粒的存在使宿主具有一些额外的特性,如对抗生素的抗性等。
质粒载体是在天然质粒的基础上为适应实验室操作而进行人工构建的。
与天然质粒相比,质粒载体通常带有一个或一个以上的选择性标记基因(如抗生素抗性基因)和一个人工合成的含有多个限制性内切酶识别位点的多克隆位点序列,并去掉了大部分非必需序列,使分子量尽可能减少,以便于基因工程操作。
大多质粒载体带有一些多用途的辅助序列,这些用途包括通过组织化学方法肉眼鉴定重组克隆、产生用于序列测定的单链DNA、体外转录外源DNA 序列、鉴定片段的插入方向、外源基因的大量表达等。
一个理想的克隆载体大致应有下列一些特性:(1)分子量小、多拷贝、松驰控制型;(2)具有多种常用的限制性内切酶的单切点;(3)能插入较大的外源DNA片段;(4)具有容易操作的检测表型。
1. 煮沸法提取质粒的原理一般分离质粒DNA的方法都包括3个步骤:①培养细菌,使质粒DNA大量扩增;②收集和裂解细菌;③分离和纯化质粒DNA。
分离制备质粒DNA的方法很多,其中常用的方法有碱裂解法、煮沸法、SDS法和羟基磷灰石层析法等。
细菌bca蛋白检测方法

细菌bca蛋白检测方法细菌BCA蛋白检测方法是一种常用的蛋白质定量方法,它基于巯基丙醇(2-ME)还原法和双巯基苯并啉磺酸钠(BCA)与蛋白质的络合反应。
本文将详细介绍细菌BCA蛋白检测方法的原理、实验步骤以及注意事项。
一、原理BCA法是一种基于碱式合心氢氧化物对蛋白质还原和鉴定的方法,这是一种低氧条件下的还原方法。
在还原体系中,BCA试剂可以和游离的双硫键反应生成紫色络合物,这种络合物在750 nm波长下有特征的吸光度。
而蛋白质在碱性条件下,通过与还原剂反应形成一定浓度的游离硫醇,与BCA试剂发生络合反应,从而产生紫色络合物。
通过比色光度测定该紫色络合物的吸光度,可以获得蛋白质的含量。
二、实验步骤1.样品制备将细菌样品经过预处理后提取总蛋白质。
一般可以通过打碎细菌细胞、离心、洗涤等方法获得细菌总蛋白质样品。
提取的蛋白质样品可以进行一定的前处理,如用酸性水解消化来去除部分细胞壁和膜上的干扰物质。
2.蛋白质还原与测定将蛋白质样品与含有2-ME的样品缓冲液混合,在高温下进行反应使蛋白质中的游离硫醇形成。
2-ME能够还原蛋白质中的二硫键,使之断裂并释放出游离硫醇。
然后将还原后的蛋白质样品转移到96孔板中,将BCA试剂加入各孔中与蛋白质样品反应,形成紫色络合物。
反应结束后,使用微孔板读板器在750 nm波长下测定吸光度。
3.组织蛋白质含量标准曲线将一系列不同浓度的已知浓度的蛋白质溶液制成一系列标准曲线样品,然后按照相同的方法测定它们的吸光度。
绘制标准曲线,并以标准曲线的形式计算未知样品中蛋白质的含量。
4.数据处理与结果分析根据标准曲线的结果,可以计算出细菌样品中的蛋白质含量。
根据实验设计,可以进一步分析细菌不同应激处理或不同基因突变下蛋白质含量的变化情况。
三、注意事项1.严格控制试剂的质量,避免发生重金属污染或其他干扰物质的存在。
2.实验过程中要注意消耗品的无菌操作和消毒处理,避免细菌污染的发生。
3.严格控制样品的保存和处理条件,避免蛋白质的降解和失活。
医学分子生物学原理-分子杂交和印迹技术

2020年3月4日1时8分
15
DNA切口平移标记法示意图
DNA 酶 Ⅰ : 在 双 链DNA上随机打开 若干个单链缺口, 产生3’-OH端。
大 肠 杆 菌 DNA 聚 合 酶 Ⅰ : 5’→3’ DNA聚合酶活性; 5’→3’ 外 切 核 酸 酶活性。
➢ 将这些菌落归并到一个琼脂主平板,第二个琼 脂平板表面铺一张硝酸纤维素滤膜。经培养一 段时间后,对菌落进行原位裂解。
2020年3月4日1时8分
6
核酸分子杂交应用
(1)特定基因序列的定性和定量分析 (2)基因克隆的筛选 (3)酶切图谱的制作 (4)基因突变分析 (5)疾病的诊断
2020年3月4日1时8分
7
二、探针的种类和制备
探针(probe)的概念: 用来检测某一特定核苷酸序列或基因序列
的DNA或RNA的互补标记片段:
5′ 3′ 5′
3′
53′′ 5′
3′
2020年3月4日1时8分
3′ 5′ 限制性内切酶
3′ 5′
Klenow DNA聚合酶
完整双链DNA
5 ′末端突出 的DNA
[α-32P]-dNTP 其他3 种dNTP
变性
35 ′′
3 ′末端标记的 DNA
3 ′ 32P-末端标记的
5′
单链DNA探针
21
标记探针的纯化
Luminol化学发光原理
1.曝光:用滤纸吸去杂交膜上多余底物,作好标记, 保鲜膜包裹,放在暗夹里,放上X光片,曝光1-5 分钟;
2.显影:取出X光片,按使用说明书显影和定影。
思考题:
2020年3月4日1时8分
29
Removed_细胞自噬诱导实验报告

细胞自噬诱导实验报告细胞自噬的实验观察,主要有四种方法。
1、提取总RNA,通过Real-time PCR分析相关基因ATG4、ATG5和AT7G的表达;2、提取总蛋白,通过Western blotting分析LC3的脂化;3、构建GFP-LC3表达载体,通过细胞转染利用荧光显微镜观察LC3颗粒的聚集;4、制备电镜样品,直接观察自噬体的形成。
一、pEGFP-C2-LC3质粒的提取与鉴定实验原理一、实验原理质粒(Plasmid)是一种染色体外的稳定遗传因子,为双链、闭环的DNA分子,并以超螺旋状态存在于宿主细胞中。
质粒主要发现于细菌、放线菌和真菌细胞中,它具有自主复制和转录能力,能在子代细胞中保持恒定的拷贝数,并表达所携带的遗传信息。
质粒的复制和转录要依赖于宿主细胞编码的某些酶和蛋白质,质粒的存在使宿主具有一些额外的特性,如对抗生素的抗性等。
质粒载体是在天然质粒的基础上为适应实验室操作而进行人工构建的。
与天然质粒相比,质粒载体通常带有一个或一个以上的选择性标记基因(如抗生素抗性基因)和一个人工合成的含有多个限制性内切酶识别位点的多克隆位点序列,并去掉了大部分非必需序列,使分子量尽可能减少,以便于基因工程操作。
大多质粒载体带有一些多用途的辅助序列,这些用途包括通过组织化学方法肉眼鉴定重组克隆、产生用于序列测定的单链DNA、体外转录外源DNA序列、鉴定片段的插入方向、外源基因的大量表达等。
一个理想的克隆载体大致应有下列一些特性:(1)分子量小、多拷贝、松驰控制型;(2)具有多种常用的限制性内切酶的单切点;(3)能插入较大的外源DNA片段;(4)具有容易操作的检测表型。
1.煮沸法提取质粒的原理一般分离质粒DNA的方法都包括3个步骤:①培养细菌,使质粒DNA大量扩增;②收集和裂解细菌;③分离和纯化质粒DNA。
分离制备质粒DNA的方法很多,其中常用的方法有碱裂解法、煮沸法、SDS法和羟基磷灰石层析法等。
煮沸法提取质粒的原理是:将细菌悬浮于含Triton X-100和溶菌酶的缓冲液中,再用沸水浴处理细胞,使宿主细胞细胞壁溶解、细胞膜破坏,蛋白质与染色体DNA变性。
提取细胞总蛋白的原理

提取细胞总蛋白的原理细胞总蛋白是指在细胞裂解液中含有的所有蛋白质的总和。
提取细胞总蛋白是生物学研究中非常基础且重要的实验操作,可以用于研究细胞生物学、分子生物学和生物化学等多个领域。
下面我将详细介绍细胞总蛋白提取的原理及其步骤。
细胞总蛋白提取的原理:细胞总蛋白提取的原理主要基于细胞膜的破裂和蛋白质的释放。
细胞膜是由脂质双层和蛋白质组成的,通过物理(如超声波、剪切力等)或化学(如洗涤剂、酸碱溶液等)方法可以破坏细胞膜的完整性,使细胞内的蛋白质释放到溶液中。
细胞总蛋白提取的具体步骤:1. 细胞培养和收获:首先需要选择合适的细胞种类,并将其培养在培养基中。
当细胞达到一定数量和生长状态时,使用适当的方法将细胞收获到离心管中。
2. 细胞裂解:将收获的细胞沉积物加入适量的细胞裂解缓冲液中,并进行细胞的破碎和破裂。
可以使用物理方法如超声波震荡、剪切力等,也可以使用化学方法如洗涤剂(如Triton X-100、NP-40等)或酸碱溶液来破坏细胞膜。
3. 离心:在细胞裂解液中存在着细胞碎片、细胞器和细胞核碎片等杂质。
通过高速离心将这些不溶性物质沉淀下来,得到澄清的上清液。
4. 蛋白质沉淀:将上清液中的蛋白质沉淀下来,有多种方法可以进行,如酒精沉淀法、醋酸沉淀法、盐析法等。
通常情况下,使用酒精沉淀法可以得到较高的蛋白质纯度。
5. 脱脂:将蛋白质沉淀通过洗涤去除各种杂质和溶解剂,以净化蛋白质。
6. 干燥:蛋白质沉淀溶于适量的蛋白溶液中,并将其沉淀沉淀,通过气体吹干或真空干燥的方法干燥蛋白质。
7. 储存:将干燥的细胞总蛋白保存在低温(-20或-80)条件下,以防止蛋白质的降解和氧化。
细胞总蛋白提取的注意事项:1. 在进行细胞裂解时,要选择适当的条件和方法,以保证细胞膜的完整性破裂,并确保蛋白质的完整释放。
2. 在提取过程中要避免发生蛋白质的降解和氧化,可以添加蛋白酶抑制剂和抗氧化剂等。
3. 在细胞提取过程中要注意无菌操作,避免细菌或其他污染物的存在。
细菌总蛋白的提取方法

细菌总蛋白和膜蛋白提取方法一、从新鲜样品中提取总蛋白(简易法)1、自配裂解液(pH 8.5-9.0):50 mM Tris-HCl,2 mM EDTA, 100 mM NaCl,0.5% Triton X-100,调pH值至8.5-9.0备用;用前加入100 μg/ml 溶菌酶,1μl/ml 的蛋白酶抑制剂PMSF。
该裂解液用量为10-50ml 裂解液/1g湿菌体。
2、将40ml 菌液在12000g,4℃下离心15分钟收集菌体,沉淀用PBS悬浮洗涤2遍,沉淀加入1ml裂解液悬浮菌体。
3、超声粉碎,采用300w,10s超声/10s间隔,超声20min,反复冻融超声3次至菌液变清或者变色。
4、1000g离心去掉大碎片,上清可直接变性后PAGE电泳检测,或者用1% SDS溶液透析后冻存。
缺点:Western blotting结果表明,疏水性跨膜蛋白提取效率有限。
二、从Trizol裂解液中分离总蛋白1、Trizol溶解的样品研磨破碎后,加氯仿分层,2-8℃下10000g离心15min,上层水相用于RNA提取,体积约为总体积的60%。
2、用乙醇沉淀中间层和有机相中的DNA。
每使用1ml Trizol加入0.3ml无水乙醇混匀,室温放置3min,2-8℃不超过2000g离心5min。
3、将上清移至新的EP管中,用异丙醇沉淀蛋白质。
每使用1ml Trizol加入1.5ml异丙醇,室温放置10min,2-8℃下12000g离心10min,弃上清。
4、用含有0.3M 盐酸胍的95%乙醇洗涤。
每1ml Trizol加入2ml洗液,室温放置20min,2-8℃下7500g离心5min,弃上清,重复洗涤2次。
最后加入2ml无水乙醇,涡旋后室温放置20min,2-8℃下7500g离心5min,弃上清。
5、冷冻干燥5-10min,1%SDS溶液溶解,反复吹打,50℃温浴使其完全溶解,2-8℃下10000g 离心10min去除不溶物。
细菌蛋白提取试剂盒使用说明书
北京索莱宝科技有限公司
第1页,共1页细菌蛋白提取试剂盒
货号:BC3750
规格:50T /100T
有效期:至少1年。
产品说明:
本试剂盒用于大肠杆菌提取可溶性蛋白,试剂盒中的裂解液含有蛋白酶抑制剂,作用较为强烈,可快速获得总蛋白,可用于免疫印迹实验等基础研究实验,由于含有上述的酶抑制剂,不能用于研究蛋白激酶的研究。
本品仅用于科研。
产品内容:名称
50T 100T Storage 裂解液
50ml 100ml 2-8℃蛋白酶抑制剂(100×)
0.5ml 1ml -20℃
PMSF(100×)0.5ml 1ml 操作方法:
1、细菌可溶性蛋白的提取
1)
在1ml 的冷裂解液中各加入10ul 的蛋白酶抑制剂和PMSF;混匀,放置在冰上备用;2)
将菌体湿重称重,然后按照比例(1g:10ml)加入的新配置的裂解液,混匀,过程注意冰上操作;3)将混匀液移入超声仪中,超声;
超声条件:总时间45min,超声时间3s,间隔时间3s,过程为冰浴环境;
超声结束,4度离心,10000rpm/min 20min;
2、吸取上清至新的管中,进行蛋白定量或者变性进行蛋白实验。
(提取好的蛋白建议保存于-80℃,即用即取,避免反复冻融,避免长时间储存。
)
注意事项:
1.实验过程,所有试剂都要需要预冷或者即融,保证操作过程中的低温环境;
2.PSMF(有毒)现用现加,因为PMSF 在水溶液中会快速降解;。
基因工程的下游技术重组蛋白的表达、纯化和分析

2. 亲和层析柱的安装 把层析柱固定在铁支架上,柱下端出 口封闭。加入少量的无离子水,排去下端 的空气泡。取出20%乙醇浸泡的螯合凝胶 4mL到烧杯中,加入少量的无离子水制成 糊状,沿着贴紧柱内壁的玻璃棒把糊状凝 胶倒进柱内,打开下端的排水口,让亲和 凝胶剂随水流自然沉下。亲和层析剂为 45mL。
3. 1#:接50μL空载工程菌(含pUC18)过夜培 养物,25-28℃培养10 h-12h; 2# :接 50μL 重组菌(含 pGFPuv )过夜培养 物,25-28℃培养10 h-12h; 3#:接50μL重组菌(含pGFPuv )过夜培养 物, 37℃培养至 O.D600 约为 0.5 (约 3h-4h) , 然后加入20%葡萄糖50μL至终浓度为0.2%, 及100mM IPTG 5μL至终浓度为0.1mM,2528℃培养8h-10h或过夜; 6#:接500μL重组菌(含pGFPuv)过夜培养 物, 37℃培养至 O.D600 约为 0.5 (约 3h-4h) , 然后只加入 100mM IPTG 50μL 至终浓度为 0.1 mM,25-28℃培养8h-10h或过夜。
一.实验目的 了解和掌握IPTG诱导表达的原理。 了解降解物阻遏的现象及其机理。
二.实验原理
操纵子是基因表达的协调单位。通常由2 个以上功能相关的结构基因以及一些调节 序列(如启动子序列、操纵序列等)组成。
乳糖操纵子由三个结构基因 Z 、 Y 、 A 和 操纵序列、启动子、 CAP 结合位点等调 节序列组成。
四.实验仪器
超净工作台、 恒温摇床、离心机等。
五.操作步骤 1. 挑取含pUC18质粒工程菌及含pGFPuv质 粒工程菌单菌落,分别接种于含氨苄青霉 (终浓度为100μg/mL,以下同)的5mL的 LB培养基中,于37℃、250rpm过夜培养 12h-14h至对数生长期。 2. 取 3 支已灭菌的大试管,分别加入 5mL 含 有氨苄青霉素的 LB 培养液,编号为 1# , 2#,3#,另取一个250mL的灭菌三角瓶, 编号为6#,加入50mL含氨苄青霉素的 LB 培养液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
细菌总蛋白和膜蛋白提取方法
一、从新鲜样品中提取总蛋白(简易法)
1、自配裂解液(pH 8.5-9.0):50 mM Tris-HCl,2 mM EDTA, 100 mM NaCl,0.5% Triton X-100,调pH值至8.5-9.0备用;用前加入100 μg/ml 溶菌酶,1μl/ml 的蛋白酶抑制剂PMSF。
该裂解液用量为10-50ml 裂解液/1g湿菌体。
2、将40ml 菌液在12000g,4℃下离心15分钟收集菌体,沉淀用PBS悬浮洗涤2遍,沉淀加入1ml裂解液悬浮菌体。
3、超声粉碎,采用300w,10s超声/10s间隔,超声20min,反复冻融超声3次至菌液变清或者变色。
4、1000g离心去掉大碎片,上清可直接变性后PAGE电泳检测,或者用1% SDS溶液透析后冻存。
缺点:Western blotting结果表明,疏水性跨膜蛋白提取效率有限。
二、从Trizol裂解液中分离总蛋白
1、Trizol溶解的样品研磨破碎后,加氯仿分层,2-8℃下10000g离心15min,上层水相用于RNA提取,体积约为总体积的60%。
2、用乙醇沉淀中间层和有机相中的DNA。
每使用1ml Trizol加入0.3ml无水乙醇混匀,室温放置3min,2-8℃不超过2000g离心5min。
3、将上清移至新的EP管中,用异丙醇沉淀蛋白质。
每使用1ml Trizol加入1.5ml异丙醇,室温放置10min,2-8℃下12000g离心10min,弃上清。
4、用含有0.3M 盐酸胍的95%乙醇洗涤。
每1ml Trizol加入2ml洗液,室温放置20min,2-8℃下7500g离心5min,弃上清,重复洗涤2次。
最后加入2ml无水乙醇,涡旋后室温放置20min,2-8℃下7500g离心5min,弃上清。
5、冷冻干燥5-10min,1%SDS溶液溶解,反复吹打,50℃温浴使其完全溶解,2-8℃下10000g 离心10min去除不溶物。
6、替代方案:将3中的酚醇上清液移至小分子量透析袋中,在2-8℃的1% SDS溶液中透析3次,1000g离心10min去除沉淀,上清可直接用于蛋白实验。
三、从新鲜样品中提取疏水性膜蛋白(Triton X-114去污剂法)
1、配制疏水性蛋白提取液(非裂解液):1% Triton X-114,150mM NaCl, 10mM Tris-HCl,1mM EDTA,调pH值至8.0备用。
2、菌液于4℃条件下15000g离心15min收集菌体;用1ml 含有5mM MgCl2 的PBS洗涤3次,最后于4℃条件下15000g离心15min收集菌体。
3、菌体沉淀加入1ml冷提取液,于4℃条件下放置2h,17000g离心10min,去除沉淀取上清。
4、将上述上清中的Triton X-114含量增加到2%,再加入20mM的CaCl2抑制部分蛋白酶活性,37℃条件下放置10min使其分层。
室温下1000g离心10min使液相和去污相充分分层。
5、将液相和去污相分开,分别用10倍体积的冷丙酮在冰上沉淀45min。
6、于4℃条件下17000g离心30min,用去离子水洗涤沉淀3次。
7、将沉淀溶解在1% SDS溶液中,测定蛋白浓度,比较液相和去污相中蛋白提取效率,一般是去污相中疏水性膜蛋白较多,适于进一步蛋白实验。
8、SDS-PAGE进一步分析液相和去污相的蛋白图谱。
