第六章酰基化反应
第六章 酰化

前页
后页
精细有机单元反应
第六章
酰 化
一、Friedel-Crafts酰基化反应
用酰化剂在Lewis酸或质子酸催化下直接对芳 环进行亲电取代反应生成芳酮的反应。 FriedelCrafts酰化反应是亲电取代反应。
+
RCOZ
lewis酸 或质子酸
C-R O
+
HZ
1.反应历程 以酰氯作酰化剂、无水三氯化铝为催化剂的反 应历程
么可以用作
酰化反应的 溶剂?
首页
前页
后页
精细有机单元反应
第六章
酰 化
2.C-酰化方法 (1)用酸酐的Friedel-Crafts酰基化 常用二元酸酐,如丁二酸酐、顺丁烯二酸酐、邻 苯二甲酸酐及其衍生物。 例如:邻苯甲酰基苯甲酸合成 反应时,将三氯化铝悬浮于苯中,55℃时加入溶 于苯中的邻苯二甲酸酐溶液,反应产物为邻苯甲酰基 苯甲酸与三氯化铝的络合物。将此络合物慢慢加到水 和稀硫酸中进行水解,用水蒸气蒸出过量的苯。冷却后 过滤、干燥。
O R C Cl + AlCl3 δ Cl : AlCl3 R C A O δ
+ _
_ δ O : AlCl3 δ+ R C Cl B
O
R C
+
+ AlCl4-
C
首页 前页 后页
精细有机单元反应
第六章
酰 化
B与芳环作用生成芳酮与三氯化铝的络合物。
R _ .. .. .. + . ... O : AlCl 3 + _ O AlCl 3 C R Cl H HCl O :AlCl 3 C R
首页 前页 后页
精细有机单元反应
酰基化反应详细资料大全

酰基化反应详细资料大全
酰基化反应是一种化学反应,在伯、仲胺与酰氯、酸酐或羧酸等酰基化试剂反应中,氨基的氢原子可被酰基取代,生成N―取代酰胺或N,N-二取代酰胺,这一过程称之为酰基化反应。
基本介绍
•中文名:酰基化反应
•适用条件:酰氯、酸酐
•被酰化物结构:芳核:呋喃>苯>吡啶
•溶剂:收率和引入位置
概况,套用,影响反应的主要因素,
概况
伯、仲胺与酰氯、酸酐或羧酸等酰基化试剂反应,氨基的氢原子可被酰基取代,生成N―取代酰胺或N,N-二取代酰胺。
叔胺不能进行酰基化反应。
另外,在无水氯化铝的催化下,芳烃与酰氯、酸酐或羧酸等酰基化试剂作用,环上的氢原子被酰基取代,也是酰基化反应。
套用
有重要意义N―取代酰胺是晶体,有确定的熔点,故酰基化反应可鉴定胺酰胺基不易被氧化,芳胺酰化反应在有机合成中用于氨基的保护或降低氨基对芳环的致活能力,反应结束后再使酰胺水解恢复为原来的胺引入永久性酰基。
是合成许多药物时常用的反应如:扑热息痛(对羟基乙酰苯胺)的合成(一种解热镇痛药),其制备经过乙酰基化反应异氰酸酯的合成及套用——合成芳香族伯胺与碳酰氯(俗称光气)依次进行酰化、脱氯化氢生成异氰酸酯 C-酰基化反应
影响反应的主要因素
(1)被酰化物结构——芳核:呋喃>苯>吡啶芳环上取代基:给电子基易,吸电子基难(2)酰化剂:酰卤>酸酐>羧酸(3)催化剂和溶剂催化剂:活性—Lewis>质子酸适用条件:酰氯、酸酐——Lewis酸(AlCl3 , BF3 ,ZnCl2) 羧酸——质子酸(HF , H2SO4 ,H3PO4) 溶剂:收率和引入位置。
酰基化反应

NH2
NH2HCl
N=C=O
RNH2
2010-9-20
3
——应用 异氰酸酯是合成树脂的重要原料。例:甲苯二异氰酸酯 (TDI)与二元醇作用,可得聚氨基甲酸酯(聚氨酯树脂)
CH 3 N CO
2
CH 3 O CN HO(CH )nOH 2
CH 3 N CO
+
N CO
NH COO(CH )nOO CNH 2 CH 3 CH 3 NH CO--
4 3 2
COOH CH3 S SO3H 2-噻 噻 噻 吡 或 噻 噻 α- 噻 吡 N 3-吡 吡 吡 吡 或 吡 吡 γ-吡 吡 OH 8-羟 羟 羟 羟
14
H3C
5
O
1
N
2,5-二 羟 二 吡 二 或 α,α ˊ 吡 二 -二 羟 二
2010-9-20
15.10.2 杂环化合物的结构
——在呋喃、噻吩、吡咯和吡啶中,成环的碳原子和杂原子都在 一个平面内,且每一个原子都是sp2杂化,未参与杂化的p轨道相互 平行,形成一个与苯环结构相似的六电子闭合共轭体系,具有芳香 性。具有代表性的三个杂环化合物的结构
4
磺酰化——兴斯堡反应(Hinsberg reaction)。
——伯、仲胺与芳磺酰化试剂(可引入芳磺酰基ArSO2-的试剂)作 用生成磺酰胺,叔胺无此反应。伯胺磺酰化产物可溶于碱,仲胺磺 酰化的产物不溶于碱、酸 ——应用 常用于鉴别或分离伯、仲、叔胺:使伯、仲、叔胺的混 合物与磺酰化试剂在碱溶液中作用,析出的固体为仲胺的磺酰胺, 叔胺可蒸馏分离,余液酸化后,可得伯胺的磺酰胺。伯、仲胺的磺 酰胺在酸中水解可分别得到原来的胺。此法称兴斯堡试验法
2010-9-20
16
精细有机合成技术:酰基化反应

用AlCl3作催化剂的C-酰化一般可以在不太高的温度下进行反应,温度太高会引起 副反应甚至会生成结构不明的焦油物。AlCl3的用量一般要过量10%~50%,过量太多 将会生成焦油状化合物。
3. 用其它酰化剂的C-酰化 对于芳香族化合物如果芳环上含有羟基、甲氧基、二烷氨基、酰氨基。在C酰化时会发生副反应,为了避免副反应的发生,通常选用温和的催化剂,例如无 水氯化锌,有时也选用聚磷酸等。如间苯二酚与乙酸的反应:
生成的2,4-二羟基苯乙酮是制备医药的中间体。
第三节 C-酰化
三、生产实例 1. 米氏酮的合成 米氏酮又称4,4-双(二甲氨基)二苯甲酮,由N,N-二甲基苯胺与光气反应制得。
③另外加入适当的溶剂。当不宜采用某种过量的反应组分作溶剂时, 就需要加入另外的适当溶剂。常用的有机溶剂有硝基苯、二氯乙烷、四 氯化碳、二硫化碳和石油醚等。
第三节 C-酰化
硝基苯能与三氯化铝形成络合物,该络合物易溶于硝基苯而呈均相。但是 该络合物的活性低,所以只用于对AlCl3催化作用敏感的反应。
二硫化碳不能溶解三氯化铝,因此是非均相反应。另外,二硫化碳不稳定 而且常含有其它的硫化物而有恶臭,因此只用于需要温和条件的反应。
第Hale Waihona Puke 节 C-酰化2.C-酰化的影响因素 (1)被酰化物结构的影响 C-酰化属于傅列德尔-克拉夫茨(Friedel-Crafts)
反应,该反应是亲电取代反应 。因此,当芳环上有供电子基(—CH3、— OH、—OR、—NR2、—NHAc)时反应容易进行。因为酰基的空间位阻比较大, 所以酰基主要进入芳环上已有取代基的对位。当对位已被占据时,才进入邻位。 氨基虽然也是活化基,但是它容易发生N-酰化,因此在C-酰化以前应该先 对氨基进行过渡性N-酰化加以保护。
酰基化反应精有机合成

RCH
CH2 + R'COCl
RCHCH2 COR' Cl
C-酰基化反应的类型
(3) 羰基的α-酰基化
O
• 3; CH3COOC2H5
O
O
CH3CCH2CCH3
O
O
• 酯的酰基化
2 CH3COOC2H5
CH3CCH2COC2H5
• 1,3-二羰基化合物的酰基化
Y
R
C
Y
+X
z
2、C-酰基化反应的类型
C—酰基化反应的类型
JPU
(1) 芳环的C—酰基化
• F-C酰基化反应 • 酚酯的弗里斯(Fris K)重排
+
O RCCl COR
OCOCH2CH3 AlCl3
OH
OH COCH2CH3
COCH2CH3
• Houben-Hoesch反应 等
C-酰基化反应的类型
+ CH3CH2COCl
酰基化反应不易发生串联反应、重排反应; 芳烃烷基化合物的合成一般用酰基化反应; 催化剂用量不同。
3、N-酰基化反应
R'NH2 + RCOCl
R'NHCOR + HCl
N-酰基化反应比C-酰基化反应容易进行,一般 不需要催化剂; N-酰基化反应的酰化剂可以是酸、酸酐、酰氯 和光气(三光气、碳酸二甲酯);产物都是酰 胺。
酚的酰化和醇的酰化比较
课后作业
JPU
1、总结F-C烷基化和F-C酰基化反应的异同点。
JPU
本节课结束!
谢谢!
质子酸质子酸hh22soso44hfhfpolypolyhh33popo44苯磺酸苯磺酸lewislewis酸酸znclzncl22feclfecl33snclsncl22alclalcl33rccl编辑ppt12clalclalclclalcl催化剂会和羰基络合因此催化剂的需求量要多于酰化剂的催化剂会和羰基络合因此催化剂的需求量要多于酰化剂的量如果是酸酐的话要多于其两倍的量
有机化学第六章(高职高专)

键体系。
α 8
β7
α 1
2β
β6 5 α
3β 4α
萘的一元取代物只有两种,二元取代物两取代 基相同时有10种,不同时有14种。
2.萘及衍生物的命名
C2H5
CH3
C2H5
SO3H
1,6-二乙基萘 ; 4-甲基-1-萘磺酸
Br Br
1-溴萘 2-溴萘 α-溴萘 β-溴萘
3.萘的性质
(1) 取代反应 萘的取代反应较易发生在α位。
⑤烷基化试剂也可是烯烃或醇。例如:
+ CH2 CH2 AlCl3 + CH2CHCH3 H+
OH
C2H5 CH(CH3)2
(2) 酰基化反应
O + CH3C
Cl
AlCl3
O CH3 + CH3 C O AlCl3
CH3 C O
C CH3 + HCl O
CH3
C CH3 + CH3COOH
O 甲基对甲苯基酮
环的α位。如:
NO2
混酸
ห้องสมุดไป่ตู้NO2 NO2
NO2
+
NO2
二、其它稠环芳烃
8 91
7
2
9 10
8
1
6
37
2
5 10 4
65 43
芘
3,4-苯并芘
蒽
菲
所以,也可用下式表示苯的结构:
第四节 单环芳烃的物理性质
苯和同系物一般为无色液体,不溶于水,易溶 于有机溶剂,相对密度大多为0.86~0.93。
熔点除与相对分子质量有关外,还与结构的对 称性有关,通常结构对称性高的化合物,熔点较高。 芳香烃一般都有毒性,长期吸入它们的蒸气,会损 害造血器官及神经系统。
第六章 酰化

OH
Zn Hg / HCl
OH
104~110℃
OH CO(CH2)4CH3
OH CH2(CH2)4CH3
பைடு நூலகம்
生产工艺: 想一想:
可以用间苯 二酚与1- 氯己烷进行 C-烃化反 应来制备 2,4-二羟基 己苯吗?
间苯二酚与过量的己酸 (同时用作溶剂) 在 氯化锌催化下,于120℃反应3h得缩合物,该缩
O + 2 CCl
AlCl3
CO + 2 HCl CO
首页
前页
后页
精细有机单元反应
第六章
酰 化
(3) 用羧酸的Friedel-Crafts酰基化 例如:邻苯甲酰基苯甲酸在浓硫酸中130~140℃ 脱水闭环得蒽醌。
O C COOH
98%H2SO4 130~140℃
O
O
想一想:
若要制备 还原染料 的中间体 2-甲基蒽 醌、2-氯 蒽醌,应选 用什么原 料?
例如:苯与丁二酸酐反应,经锌汞齐-盐酸还原 可得长链羧酸,接着进行分子内酰化可得萘满酮。
O + O O
AlCl3
O C CH2 CH2COOH
Zn Hg / HCl
CH2 CH2 CH2COOH
HF
O
羧酸作酰化剂,不宜用A1Cl3作催化剂,一般 用硫酸、磷酸,最好是氟化氢。
首页 前页 后页
精细有机单元反应
NH2 回流 + (CH3CO)2O COOH NHCOCH3 + CH3COOH COOH
本章重点介绍: 原理、方法和实例。 C-酰化、N-酰化和O-酰化的
首页 前页 后页
精细有机单元反应
有机化学 第六章 芳香烃

(一) 芳烃的构造异构和命名 (二) 苯的结构 (三) 单环芳烃的来源 (四) 单环芳烃的物理性质 (五) 单环芳烃的化学性质 (六) 苯环上取代反应的定位规则 (七) 稠环芳烃 (八) 芳香性 (九) 富勒烯
第六章 芳烃 芳香性
• 芳烃——芳香族碳氢化合物。含有苯环的一 大类C、H化合物。 “芳香”二字的含义:
1,2,4,5-四甲苯
(2) 命名
命名时,一般以芳环为取代基,也可以芳环为母体。具
体情况,具体对待:
CH=CH2
CH=CH2
苯乙烯
对二乙烯基苯 CH=CH2
CH2Cl
CH2OH
苯氯甲烷 氯苄
苯甲醇 苄醇
• C6H5- 苯基(Ph-) ;
C6H5CH2- 苄基 ;
Ar- 芳基(芳环上去掉一个氢后,所剩下的原子团);
O
慢
H
SO3-
快 HSO4-
+
σ-络合物
SO3- 快
H3O+
SO3H + H2O
(丁) 烷基化反应机理
苯环烷基化反应中,AlCl3的作用是与卤烷起反应, 加速R+的生成:
RCl + AlCl3
R+ + AlCl4-
亲电试剂
+ R+
R
+H
σ-络合物
AlCl4-
R + HCl + AlCl3
苯环烷基化反应时,产生异构化的原因:
Br
p-二溴苯
注意:第二个卤素原子进入第一个卤素原子的邻、对位。
(乙) 硝化
+ HNO3
浓H2SO。4
50-60 C
第06章 单环芳烃

6.5 单环芳烃的化学反应 6.5.1 取代反应
O
(5) 酰基化反应
R
F-C acylation
(1) 卤化反应
Halogenation
Cl
Br
I
n
Su
t io
lf o
al ky la
na tio
Nitration
C
n
F-
R
NO2
SO3H
(4) 烷基化反应
(3) 硝化反应
(2) 磺化反应
上述反应中,和芳烃起作用的试剂都是缺电子或带正 电的亲电试剂,因此这些反应都是亲电取代反应.
∴ 凯库勒式并不能代表苯分子的真实结构.
6.1.2 苯分子结构的近代概念
(1) 分子轨道理论
•六个碳均为sp2杂化,每个碳各有一个未杂化的p轨道, 彼此侧面重叠组成大键.六个离域的电子总能量较 低.苯中所有碳碳键都相等.键长也完全相等(0.139nm) H H H H
H
H
苯的p轨道交盖
离域 分子轨道组成 闭合共轭体系-大键
ni压力h2???120kjmol3h2???208kjmol理论值360kjmol???232kjmol理论值240kjmol苯的稳定性氢化热证明2h28kjmol152kjmol稳定化能离域能共振能?苯加氢生成环己烷苯的一元取代物只有一种说明苯环上的六个碳原子和六个氢原子的地位是等同的
第六章 单环芳烃
sp2
(3) 络合物是环状碳正离子中间体,共振结构式:
+ E
络合物
络合物
络合物四个电子离域分布在五个碳原子所形 成的(缺电子)共轭体系中,且取代基邻、对位带有较 多的正电荷.
放热反应
苯亲电取代反应的能量示意图
化学反应中的酰基化反应与酰基化机理

化学反应中的酰基化反应与酰基化机理化学反应是化学变化的过程,而其中一种常见的反应类型是酰基化反应。
酰基化反应是指通过酰基化剂将酰基基团引入到有机物中的化学反应。
在这篇文章中,我们将探讨酰基化反应的机理以及它在化学领域中的应用。
通过了解这一反应过程,我们可以更好地理解化学反应的原理和应用。
一、酰基化反应的机理1. 酰基化反应的定义酰基化反应是指通过酰基化剂将酰基基团(-CO-)引入到有机物中的化学反应。
在这种反应中,酰基化剂往往是一个含有活泼的酰基基团的化合物,如酸酐、酰氯等。
2. 酰基化反应的步骤酰基化反应通常由以下几个步骤组成:亲核试剂的攻击、酰基的转移、质子的转移和结构重排等。
在酰基化反应中,亲核试剂首先与酰基基团发生亲核加成反应,形成一个中间体。
接下来,酰基转移发生,原有酰基与亲核试剂中的有机基团发生取代反应,形成酰基化产物。
在这个过程中,质子转移和结构重排也可能发生,以促进反应进程的进行。
3. 酰基化反应的催化剂在酰基化反应中,通常需要催化剂来促进反应的进行。
常用的酰基化反应催化剂包括有机酸(如硫酸、磷酸等)和金属催化剂(如钯、铂等),它们可以提供适当的反应条件和促进反应的速率。
二、酰基化反应在化学领域中的应用1. 有机合成中的酰基化反应酰基化反应在有机合成中扮演着重要的角色。
通过酰基化反应,可以引入酰基基团,从而改变有机物的化学性质和功能。
例如,酰基化反应可以用于酯的合成,酯是一类重要的有机化合物,广泛应用于医药、香料、染料等领域。
2. 化学分析中的酰基化反应酰基化反应也在化学分析领域中得到了广泛应用。
通过酰基化反应,可以将样品中的有机物转化为易于检测的酰基化产物,从而实现对有机物的分析和检测。
例如,酰基化反应可以用于脂肪酸的测定,脂肪酸的酰基化产物易于分离和检测,有助于分析中的定量和准确性。
3. 药物研究中的酰基化反应酰基化反应在药物研究中也发挥着重要作用。
通过酰基化反应,可以合成具有特定功能和生物活性的有机化合物,用于药物的设计和开发。
大学有机化学第六章

第六章单环芳烃•要求深刻理解和熟练掌握的内容:苯的结构;单环芳烃的化学性质,苯环上的亲电取代反应机理及定位规律的理论解释。
•要求一般理解和掌握的内容:单环芳烃的来源和制法•难点:•苯环上亲电取代反应定位规律的理论解释第六章单环芳烃•大多数芳烃含有苯的六碳环结构,少数非苯芳烃的结构和性质与苯环相似,也称芳烃.•芳烃的性质特点:(1)不易发生加成反应,(2)不易氧化,(3)而容易起取代反应.(1)单环芳烃•芳烃可分为以下三类:(2)多环芳烃(3)非苯芳烃苯的分子式: (C6H6)一苯环的结构1. 凯库勒结构式性质特点:苯不易发生加成,不易氧化,但容易发生取代反应。
苯的凯库勒式结构+H 2∆H=-120kJ/mol+3H 2∆H=-208kJ/mol (2)苯的氢化(3)1,3-环己二烯脱氢-H 2∆H=-23kJ/mol苯的稳定性证明(1) 环己烯催化加氢:四、单环芳烃的物理性质芳香烃不溶于水,但溶于有机溶剂。
一般芳香烃均比水轻。
沸点随相对分子质量升高而升高。
熔点除与相对分子质量有关外,还与结构有关,通常对位异构体由于分子对称,熔点较高。
苯亲电取代反应的能量示意图反应进程势能+E +EE H+六、苯环上亲电取代反应的定位效应1. 定位规律A.烷基苯的取代反应CH3CH3NO2NO2CH3混酸℃3057%40%甲苯的硝化比苯容易,新引入的取代基主要进入原取代基的邻对位。
实验现象:B.硝基苯的取代反应发烟HNO3+H2SO4NO2NO2NO295℃93.2%硝基苯的硝化比苯困难,新引入的取代基主要进入原取代基的间位。
酰化反应

4. 酰氯为酰化剂
(1)反应通式 (2)反应机理
55
(3)影响因素
A 酰氯结构的影响
■ 脂肪族酰氯 > 芳酰氯 ■ 羰基的α位连有吸电子基团时,活性增强 ■ 芳酰氯邻位有取代基时,活性降低
B 催化剂的影响
■ 有机碱:吡啶、三乙胺、N,N-二甲基苯胺、N,N-二甲基吡啶 ■ 无机碱:NaOH、KOH、Na2CO3、K2CO3 ■ 采用吡啶类碱不仅可以中和反应生成的HCl,还有催化作用,增强活性
S
R CH S
n-C4H9Li
S RC Li S
H2O/HgCl22
第二节 氧原子上的酰化反应
• 醇的O-酰化反应 • 酚的O-酰化反应 • 醇、酚羟基的保护
13
一、醇的O-酰化反应
1. 羧酸为酰化剂
(1)反应通式
(2)反应机理
提高收率:
■ 增加反应物浓度
19
(iii) Vesley法 采用强酸型离子交换树脂加硫酸钙 催化能力强、收率高、条件温和
Vesley法
CH3COOH + CH3OH 10min
CH3COOCH3 (94%)
20
(iv) DCC法( dicyclohexylcarbodiimide,二环己基碳二亚胺)
21
DCC类似物:
CH3-N=C=N-C(CH3)3
N
r.t., 12 min
(96%)
H3C
CH3 COOC(CH3)3
金属离子Hg2+、Ag+、Cu+、Cu2+等对反应有催化作用
35
(ii) 羧酸吡啶酯
36
(iii) 羧酸三硝基苯酯( 一锅煮合成法 )
酰基化反应

酰基化反应简介酰基化反应是一种常见的有机合成反应,其基本原理是将醇或胺与酸酐进行反应,生成相应的酯或酰胺。
该反应在药物合成、材料科学及精细化工领域中广泛应用。
在本文中,我们将重点介绍酰基化反应的机理、常用试剂以及反应条件。
反应机理酰基化反应的机理可分为两个步骤:酸促进的亲电加成和消除反应。
1.酸促进的亲电加成:酰化反应中最关键的步骤之一是酸促进的醇或胺的亲电加成。
在该步骤中,酸酐的羰基碳原子受到酸催化剂的亲电攻击,形成一个中间化合物。
这个中间化合物可以进一步与醇或胺反应,生成酯或酰胺。
2.消除反应:在酰基化反应的第二步中,中间化合物经过酸或碱催化剂的作用,发生消除反应,生成最终的产物。
酰基化反应的中间化合物可以通过水解或脱水反应来生成酯或酰胺。
反应示例1.酯的合成:酯是酰基化反应的常见产物之一。
例如,将酸酐和醇反应可以得到相应的酯。
以乙酸酐和甲醇为例:CH3COOCH3 + CH3OH --> CH3COOCH3 + CH42.酰胺的合成:酰胺是将酸酐与胺反应得到的产物。
以乙酸酐和乙胺为例:CH3COOCH3 + CH3CH2NH2 --> CH3CONHCH2CH3 + CH4常用试剂1.酸酐:常用的酸酐包括乙酸酐、乙酸乙酯、酞酸酐等。
不同的酸酐在反应中可能有不同的活性和特点。
2.醇或胺:醇和胺在酰基化反应中起到了亲电试剂的作用,常用的醇包括甲醇、乙醇和苯酚等,常用的胺包括乙胺、苯胺和吡啶等。
3.催化剂:常见的催化剂包括酸、碱或酸碱催化剂。
酸可以提供质子,促进亲电加成步骤的进行;碱可以催化消除反应。
反应条件酰基化反应的反应条件可以根据具体的反应物和需求进行调节,以下是一些常见的反应条件:1.温度:反应通常在室温或加热条件下进行,具体的反应温度取决于反应的性质和所使用的试剂。
一般来说,反应温度在40℃至120℃之间。
2.去水剂:在反应中可能需要加入一些去水剂,以去除反应中产生的水。
常用的去水剂包括无水碳酸钠和无水氯化钙等。
第六章:芳烃-2

4% 微量
25 0.03
NO2
95oC
6%
1%
93%
10-4
取代基对反应有两方面影响——反应活性和反应取向
1.定位基
在苯环上引入新的取代基时,其进入苯环的位置,主要决定 于原有取代基的性质。这个原有的取代基称为定位基。 活化基团和钝化基团(考虑对反应活性/速率的影响)
如:
CH3
活化基团(亲电取代反应比苯快)
?
NO2
CH3
Br2/Fe
CH3 Br NO2 CH3 Br
NO2 CH3
注1:引入第三个基团时,前两 个基团的定位作用一致更好。
溴化
?
CH3
⑤
磺化、硝化
CH3
NO2 SO3H
注2:定位作用不矛 盾的前提下,一般先 对位,后邻位。
CH3 ⑥
硝化、氧化
?
COOH 注3:利用–SO3H占 NO2 据对位的方式,可提 高邻位产物产率
酰基化 、硝化
COCH3
NO2
Cl2/Fe
H2SO4
CH3COCl /AlCl3
Cl
HNO3/H2SO4
COCH3
CH3
③
氧化、硝化 、溴化
COOH
④ NO2 Br
CH3
COOH 硝化、溴化 Br
、氧化
KMnO4
Br2/Fe
HNO3 H2SO4
NO2
KMnO4
COOH
HNO3 H2SO4 Br
COOH COOH
三、空间效应
CH3
理论上: 邻位=2× 对位 实际上: 邻位/ 对位< 2
① 原定位基大小影响
OH
第六章芳烃
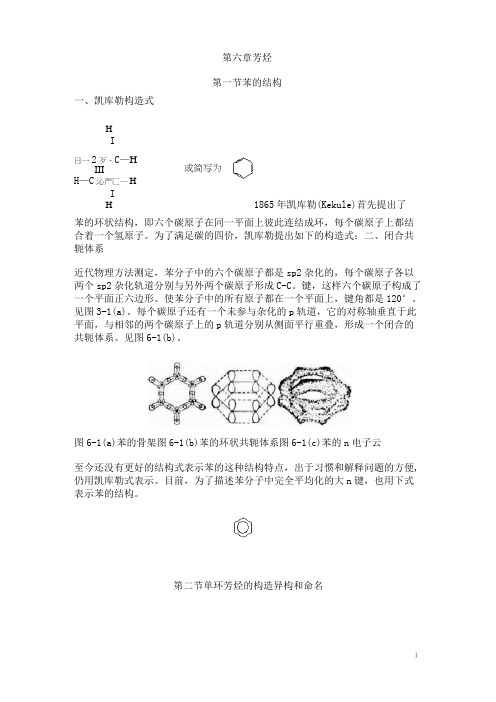
一、凯库勒构造式HI日一2歹、C —HIIIH —C 沁严匚一HIH苯的环状结构,即六个碳原子在同一平面上彼此连结成环,每个碳原子上都结合着一个氢原子。
为了满足碳的四价,凯库勒提出如下的构造式:二、闭合共轭体系近代物理方法测定,苯分子中的六个碳原子都是sp2杂化的,每个碳原子各以两个sp2杂化轨道分别与另外两个碳原子形成C-C 。
键,这样六个碳原子构成了一个平面正六边形。
使苯分子中的所有原子都在一个平面上,键角都是120°。
见图3-1(a)。
每个碳原子还有一个未参与杂化的p 轨道,它的对称轴垂直于此平面,与相邻的两个碳原子上的p 轨道分别从侧面平行重叠,形成一个闭合的共轭体系。
见图6-1(b)。
图6-1(a)苯的骨架图6-1(b)苯的环状共轭体系图6-1(c)苯的n 电子云 至今还没有更好的结构式表示苯的这种结构特点,出于习惯和解释问题的方便,仍用凯库勒式表示。
目前,为了描述苯分子中完全平均化的大n 键,也用下式表示苯的结构。
第二节单环芳烃的构造异构和命名第六章芳烃 第一节苯的结构或简写为1865年凯库勒(Kekule)首先提出了根据分子中所含苯环的数目和连接方式,芳香烃可分为如下几类:01单环芳烃例如:(苯)芳香烃多环芳烃例如: (联苯)稠环芳烃例如:(萘)一、单环芳烃的构造异构1.苯环上的支链不同,产生的构造异构当苯环上连有不同的支链时,产生异构现象。
如:当苯环支链有三个以上碳原子时,可能出现碳链排列方式不同,产生异构现象。
如:CH3CH2CH3丫咼X CH-CH3正丙苯异丙苯2.支链在环上的位置不同,产生的位置异构CH3衣屯当苯环上连有两个或两个以上支链时,可能出现支链在环上位置不同,产生异构现象。
如:邻二甲苯间二甲苯对二甲苯二、单环芳桂的命名1.苯的一元取代物只有一种时,以苯环为母体命名,烷基作取代基,称为“某烷基苯”,其中“基”字常省略。
若侧链为不饱和桂基(如烯基或烘基等),则以不饱和桂为母体命名,苯环作为取代基。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
定义:在有机化合物分子中的碳、氮、氧、 硫等原子上引入脂肪族或芳香族酰基的反 应称为酰基化反应,简称为酰化。 酰基-是指从含氧的无机酸、有机按酸或 磺酸分子中除去羟基后所剩余的基团。 (RCO-)
O O H C OH H 3C O C OH 苯 甲 酰基 C OH
甲 酰基
乙 酰基
常用的酰基化试剂 常用的酰化剂是酰氯、酸酐和羧酸。 如 乙酰氯、乙酸酐、顺丁烯二酸酐、甲酸、 乙酸、草酸等。
其活性排列次序为:酰氯>酸酐>羧酸。
5.1 N—酰基化反应
酰化反应历程可表示为
O
O AlCl3
H :NH
HN
C
CH 3
+
Cl
C CH 3 δ+
+
H-Cl
属于亲电取代反应
NH 2
NHCOC 8H 17
5.2 C—酰基化反应
多π电子的杂环(如呋喃、噻吩、吡咯等)容易进行酰基化反应; 缺π电子的杂环(如吡啶、嘧啶等)则很难进行酰化反应。
③催化剂和溶剂。当酰化剂为酰氯和酸酐时,常以Lewis酸如AlCl3、 BF3、SnCl4、ZnCl2等为催化剂;若酰化剂为羧酸,则多选用H2SO4、 HF及H3P04等为催化剂。 Lewis酸的催化活性大小次序为
5.2 C—酰基化反应
羧酸可以直接用作酰化剂,一般用硫酸、磷酸,最好是氟化氢作 催化剂。
5.2 C—酰基化反应
②被酰化物的结构。与Friedel—Crafts烷基化反应相似.酰基 化反应属于亲电取代反应 取代芳环的酰基化反应按下列规律进行:当芳环上具有邻、 对位定位基时,酰基主要进入对位,若对位被占,则进入邻位。
5.2 C—酰基化反应
5.2 C—酰基化反应
另一种方法是用一氧化碳和氰化氢在催化剂三氯化铝、氯化 亚铜存在下,与芳环反应使芳环上引入一甲酰基。此法被称 作一氧化碳法,或称Gattermann-Koch(加特曼-科赫反应)反
应,属于傅-克酰基化反应(Friedel-Crafts acylation)的一种 。 反应主要用于烷基苯、烷基联苯等具有推电子取代基的芳甲 醛的合成。 反应所用催化剂除以AlCl3作主催化剂外,还要加辅助催化刑 如CuCl、NiCl2、CoCl2、TiCl3等 该法不适用于酚及酚醚的甲酰化。
酰基化反应介绍
研究意义:
(1) 在羟基或氨基等官能团上引入酰基后可改变原化合物性质和功能。如 染料的染色性能和牢度指标有所改变,药物分子中引入酰基可改变药性;
(2)可用来保护氨基,反应完成后再将酰基水解去掉。
如:在苯胺上引入硝基时,我们一般用苯胺与混酸发生亲电取代反应即 可。但苯胺非常易被氧化,甚至空气中的氧气就能将无色透明的苯胺液体在 几个小时内氧化成黑色的苯醌染料,混酸更是一种强氧化剂,所以必须先将 氨基保护起来才能用混酸硝化。
氢氧化钠水溶液,对有些加热后仍不溶的胺,可用 氢氧化钠的醇—水溶液。酸性水解大多采用稀盐酸 溶液,有时可加入少量硫酸以加速水解。水解反应 般在回流温度下进行。
5.2 C—酰基化反应
一、芳环的碳酰化反应 1.Friedel—Crafts酰化反应(弗里德耳——克拉夫特)(付克反应)
定义:在三氯化铝或其他Lewis酸(或质子酸)催化下,酰化 剂与芳烃发生环上的亲电取代,生成芳酮的反应称为 Friedel—Crafts酰化反应。
O
H
NH
O
O
HN
+
Cl
C
CH 3
AlCl3 - H-Cl
HN
C
CH 3
C
CH 3
+
H 3O - CH 3COOH
NH 2
HNO3 / H2SO4
NH 2
若不保护氨基,则:
HNO3 / H 2SO4 氧化
NO 2
O ONO 2源自黑色染料——苯醌酰基化反应介绍
2. 定义:
酰基化反应指的是有机化合物分子中与碳原子、氮 原子、氧原子或硫原子相连的氢被酰基所取代的反应。
5.2 C—酰基化反应
Vilsmeier反应是在N,N—二烷基苯胺、酚类、酚醚及 多环芳烃等较活泼的芳香族化合物的芳环上引入甲酰 基的最常用的方法。对多π电子的芳杂环如呋喃、噻吩、 吡咯及吲哚等化合物环上的甲酰化,该方法进行反应 也能获得较好的收率。
二、N—酰化方法 1、用羧酸的N—酰化
用羧酸对胺类进行酰化的反应是一个可逆反应。酰化反应通式为
适用范围:碱性较强的胺类进行酰化 为了使反应进行到底用过量的羧酸,并同时不断移去反应生成的水 移去反应生成水的方法:①在反应物中加入甲苯或二甲苯进 行共沸蒸馏脱水②采用化学脱水剂如五氧化二磷、三氯氧磷等 移去反应生成的水。
5.2 C—酰基化反应
(2) Vilsmeier(维尔斯迈尔)反应
以氮取代的甲酰胺为甲酰化剂,在三氯氧磷作用下,在 芳环或芳杂环上引入甲酰基的反应称作Vilsmeier反应。
5.2 C—酰基化反应
反应机理一般认为是甲酰胺与三氯氧磷生成加成物.然 后进一步离解为具有碳正离子的活性中间体,再对芳环 进行亲电取代反应,生成α— 氯胺后很快水解成醛。
质子酸的催化活性大小次序为
5.2 C—酰基化反应
5.2 C—酰基化反应
溶剂的选择十分重要,它不仅可以影响反应的收率,而且可能影 响酰基引入的位置。例如
常用的溶剂有二硫化碳、硝基苯、四氯化碳、二氯甲烷、石油醚等。
5.2 C—酰基化反应
2.Hoesch(霍本-赫施)反应
腈类化合物与氯化氢在Lewis酸氯化锌催化下.与含羟 基或烷氧基的芳烃进行反应,可生成相应的酮亚胺,再经 水解得含羟基或烷氧基的芳香酮,此反应被称为Hoesch反 应。该反应以腈为酰基化试剂,间接地在芳环上引入酰基, 是合成酚或酚醚类芳酮的一个重要方法。 反应历程是腈化物首先与氯化氢结合,在无水氯化锌的 催化下,形成具有碳正离子活性的中间体,向苯核作亲电 进攻,经σ—络合物转化为酮亚胺,再经水解得芳酮。
5.2 C—酰基化反应
用无水氰化锌[Zn(CN)2]和氯化氢来代替氢氰酸和氯化氢, 这样可在反应中慢慢释放氢氰酸,使反应更为顺利。该 反应可用于烷基苯、酚醚及某些杂环如吡咯、吲哚等的 甲酰化。对于烷基苯,要求反应条件较剧烈,需用过量 的三氯化铝来催化反应。对于多元酚或多甲基酚,反应 条件可温和些,有时可以不用催化剂。
5.1
N—酰基化反应
6.酰基的水解 酰胺在一定条件下可以水解,生成相应的羧酸和胺。
常用的简单酰基对水解的稳定性顺序为
水解反应可以在碱性溶液或酸性溶液中进行。选择 水解条件时,必须同时注意酰胺键的稳定性和胺类 的稳定性,防止有些胺类对介质pH的敏感性,或在 较高水解温度下的氧化副反应等,碱性水解常采用
5.2 C—酰基化反应
(1)反应机理 催化剂与酰化剂首先作用,生成酰基正离子活性中间体,进攻芳环上 电子云密度较大的碳,取代该碳上的氢,生成芳酮
5.2 C—酰基化反应
反应后生成的酮和三氯化铝以络合物的形式存在,需 要稀酸处理才能得到游离的酮。AlCl3的用量必须超过 反应物的摩尔数。
(2)影响反应的因素 ①酰化剂。 各种酰化剂的反应活性顺序酰卤>酸酐>羧酸 含有不同卤素的酰卤的反应活性顺序为
5.1 N—酰基化反应
3.用酰氯的N—酰化
用酰氯酰化的反应通式为 反应特征:反应是不可逆的。反应时需要加入碱性物质,如 NaOH、Na2CO3,NaHCO3、CH3COONa、N(C2H5)3 等,以中和生成 的氯化氢,使氨基保持游离状态,从而提高酰化反应的收率。
(1)脂肪酸酰氯酰化 脂肪酸酰氯为强酰化剂,向氨基上引入长碳链酰基时,它常被采
5.2 C—酰基化反应
烃基的结构对反应影响:当酰基的α—碳原子是叔碳时,容易在 AlCl3作用下形成叔碳正离子而使反应所得产物主要是烷基化物。
5.2 C—酰基化反应
常用的酸酐多数为二元酸酐,如丁二酸酐、顺丁烯二酸酐、邻苯 二甲酸酐及它们的衍生物。二元酸酐可用于制备芳酰脂肪酸,该 酸经锌汞齐—盐酸还原可得长链羧酸,接着进行分子内酰化即得 环酮。
氮酰化-将酰基引人氮原子上合成酰胺化合物的 反应称为氮酰化. 碳酰化-将酰基引入碳原子上合成芳酮或芳醛的 反应称为碳酰化。
酰化反应可用下述通式表示
式中的RCOZ为酰化剂,其中的Z代表-X、-OCOR’、OH、-OR’、-NHR’ 等。GH为被酰化物,其中的G代 表ARNH-、R’NH-、R’O-、Ar等。
5.1 N—酰基化反应
羧酸、酸酐和酰氯反应活性的大小次序为:
芳香族酰氯的反应活性低于脂肪族酰氯(如乙酰氯)。
对于酯类,凡是由弱酸构成的酯(如乙酰乙酸乙酯)可用作酰化剂,
而由强酸形成的酯,因酸根的吸电子能力强,使酯中烷基的正电荷 增大,因而常用作烷化剂,而不是酰化剂,如硫酸二甲酯等。
5.1 N—酰基化反应
芳香族伯胺或仲胺用芳磺酰氯酰化能生成许多有价值的中间体,例如
5.1
N—酰基化反应
(3)用光气酰化
①在水介质中酰化。光气在水介质中,在低温就能和两分子芳
胺反应生成二芳基脲衍生物,反应放出的氯化氢可用碱中和。例 如,J酸用光气酰化可制得猩红酸,它是重要的染料中间体。
5.1
N—酰基化反应
③在有机溶剂中酰化。 光气在有机溶剂(如甲苯、氯苯、邻二氯苯)中,在低温下能 与等摩尔量的芳胺作用,先生成芳胺基甲酰氯,再进行加热处 理转变为芳基异氰酸酯。
应用:甲苯二异氰酸酯的制备
甲苯二异氰酸酯合成泡沫 塑料、涂料、耐磨橡胶和高 强度粘合剂的重要中间体。
