卤化丁基胶塞检验记录(DOC)
注射液用覆聚四氟乙烯六氟丙烯的共聚物膜氯化丁基橡胶塞检验记录

记录编码:XX-XL-XX-XX0-X0-X Page 1 of 18【外观】 检验日期 : 年 月 日 判定日期: 年 月 日 1. 操作方法取本品200个,在自然光线明亮处,正视目测,进行检查。
2.3.4. 结果判定符合规定□ 不符合规定□ 检验人/日期: 复核人/日期:1.操作方法取本品10个,照《注射液用胶塞、垫片穿刺力测定法操作规程》操作。
2.标准规定平均穿刺力不得过75N,且每个胶塞的穿刺力均不得过80N,穿刺过程中不应有胶塞被推入瓶内。
平均穿刺力 N,报告值 N。
且胶塞最大穿刺力为 N,报告值 N。
穿刺过程中胶塞被推入瓶内。
4.结果判定符合规定□ 不符合规定□检验人/日期:复核人/日期:【穿刺落屑】检验日期:年月日判定日期:年月日1. 操作方法取本品10个,照《注射剂用胶塞、垫片穿刺落屑测定法操作规程》操作。
2.标准规定落屑数应不得过20粒。
4.落屑数粒。
备注:在穿刺过程中,若有两个以上(含两个)胶塞在穿刺过程中被推入瓶中,则判该项不合格;若10个被测胶塞中有一个被推入瓶中,则需另取10个胶塞重新试验,不得有胶塞被推入瓶中。
如重新试验见附件。
5.结果判定符合规定□ 不符合规定□检验人/日期:复核人/日期:【膜的复合强度】检验日期:年月日判定日期:年月日1操作方法(1)目视观察穿刺力项下已经完成试验的覆膜胶塞。
(2)取经【化学性能】处理后样品。
2标准规定(1)针刺部位膜不应从覆膜胶塞表面脱落。
(2)目视观察膜与覆膜胶塞不得分离。
符合标准规定用“√”表示,有不符合的用“×”表示,异常情况填写备注,无异常情况备注划斜线。
4结果判定符合规定□ 不符合规定□检验人/日期:复核人/日期:1.操作方法将供试液倒入取样杯中,静置,在15-30分钟时间范围内连续测定3次,每次取样应不少于(5ml) ml,记录数据。
每个供试品第一次数据不计,取后续测定结果,计算平均值。
2.标准规定每1ml中含10um以上的微粒不得过30粒,含25um以上的微粒不得过3粒。
注射剂用卤化丁基橡胶塞中工业硬脂酸含量的测定

醇溶解 , 滴加 浓硫 酸 5滴 , 充分 摇匀 , 置 1 n 放 0mi
后加蒸 馏水 3mL、 正庚 烷 1 mL, 萃取 1mi , n 取正
庚 烷层 稀 释 后 进 行 气 相 色 谱 分 析 。 同法 做 空 白
试验 。
1 5 仪器 测试 条件 .
1 5 1 红 外 光 谱 . .
样 品扫描次数
率 4 0 0c . 0 m
3; 2 背景扫 描次数
3 ; 辨 2分
; 样 增 益 1 0 动 镜 速 度 采 .;
0 6 29 光 阑 . 3 ; 束器 KB 。 r
1 0 0 ; 测器 0 .0 检
D GS K r 分 T B;
图 1 样 品 提 取 物 红 外 光 谱
1 2 试 验 仪 器 .
同时 以水做 空 白试 验 。
1 3 2 硬 脂 酸 甲酯 、 脂 酸 甲 酯 对 照 液 .. 软
取 硬脂 酸 甲酯 、 脂 酸 甲酯对 照 品用 正 庚 烷 软
配 成 质 量 浓 度 为 0 2mg・ 的溶 液 。 . mL
1 4 试 样 制 备 .
数 分 别 为 0 0 5 4 1 0 0 5 8 , . 0 1 0 . 0 2 , . 0 3 2 0 0 5 4 ,
氯仿 选择 性 地 提取 胶 塞 中 工 业 硬 脂 酸 等 成
分 ,回收氯 仿 后 的残 留 物用 热无 水 乙醇溶 解 , 除 掉 了部分 非硬脂 酸成 分 。同时无水 乙醇 的使 用 与 标 准滴定 溶液 使用 的溶剂相适 应 。
的含 量 , 果 见 表 1 由表 l可 见 , 过 8h后 基 结 。 经
本提 取完全 。 2 3 提 取 物 成 分 确 定 . 2 3 1 红 外 光 谱 ..
注射用无菌粉末用卤化丁基橡胶塞检测规程

注射用无菌粉末用卤化丁基橡胶塞检测规程背景注射用无菌粉末用卤化丁基橡胶塞广泛用于注射器和输液袋等制品中,它可作为连接容器和导管的关键结构部件。
卤化丁基橡胶塞的主要特性是耐高温,耐腐蚀,有弹性,可以确保药品在运输和储存过程中不受污染。
然而,如果橡胶塞发生变质,会给药品带来潜在的风险,因此在生产过程中应采取措施检测橡胶塞的合格率。
目的本规程旨在确保注射用无菌粉末用卤化丁基橡胶塞的质量达到规定标准,同时规范橡胶塞的生产和检验程序,从而保障注射器和输液袋等制品的安全。
检测项目外观•橡胶塞的颜色应当一致,无明显杂质和裂痕;•橡胶塞的表面平整光滑,无肉眼可见的破损、斑点和凹凸;•橡胶塞与容器、导管的连接处应无漏水、渗水、漏气现象。
硬度应使用硬度计测定卤化丁基橡胶塞的硬度,符合以下标准:•硬度指数在65~80之间;•制品硬度测量应在20℃±5℃的温度下测定。
过氧化值应使用过氧化值法测量卤化丁基橡胶塞的过氧化值,符合以下标准:•过氧化值小于或等于5mmol/k;•按比色法检测和反应检测的结果应符合国家标准。
含氟量应使用热滴定法测定卤化丁基橡胶塞的含氟量,符合以下标准:•含氟量应小于或等于0.1%;•按国家标准进行测定。
溶出物应使用合适的方法检测卤化丁基橡胶塞的溶出物,符合以下标准:•没有明显的异味,不含易溶解的杂质,不影响药品的有效成分;•滴定酸、盐酸、水和其他相关物质的溶出物含量符合国家标准。
检测程序样品准备应根据国家标准和药品的特殊需求选择合适的规格和型号的注射器。
外观检查将样品分别进行外观检验,包括塞口外观、塞体外观、连接处外观。
记录缺陷、杂质和裂痕等情况。
硬度检测取符合要求的橡胶塞样品,将其放置在20℃±5℃的环境中,保持10分钟后,进行硬度测定。
过氧化值检测取符合要求的橡胶塞样品,使用过氧化值法测定其过氧化值,测定结果符合国家标准。
含氟量检测取符合要求的橡胶塞样品,使用热滴定法测定其含氟量,测定结果符合国家标准。
注射用无菌粉末用卤化丁基橡胶塞检测规程

注射用无菌粉末用卤化丁基橡胶塞检测规程注射用无菌粉末用卤化丁基橡胶塞是医学领域中使用最广泛的药物包装物之一。
为了确保使用的安全性和有效性,需要严格按照注射用无菌粉末用卤化丁基橡胶塞检测规程进行检测。
本文将详细介绍该检测规程的相关知识。
首先,检测无菌粉末用卤化丁基橡胶塞的主要目的是确保其在使用期间能够阻止外部污染物进入药物容器内,从而保证药品的纯度和安全性。
常用的检测方法有外观检查、水洗试验和密封性测试等。
外观检查是最基本的检测方法之一,主要用于检查橡胶塞的表面有无破裂、破损、褐变、起皮等缺陷。
外观检查时应使用适当的灯光和放大镜,以确保缺陷的准确判定。
在外观检查之前,应首先检查橡胶塞是否满足药品生产厂家的要求,例如颜色、形状和硬度等。
水洗试验是主要用于检测橡胶塞的水解性能。
试验时,应首先储存测试样品一段时间,通常为24小时,然后将橡胶塞浸泡在水中数小时。
检查浸泡后的水中有无可见的粉碎物,以及是否出现水解和变色等现象。
密封性测试是检测橡胶塞是否能够有效密封容器的重要方法。
在密封性测试中,通常使用高压浸漏法和低压气爆法等。
高压浸漏法是指在一定压力下,采用压缩气体将药品容器浸入水中,检查水中的气泡以及药品溢出情况。
低压气爆法是指在一定压力下,采用压缩气体将药品容器封闭并通气,然后观察橡胶塞是否有膨胀变形现象。
需要注意的是,在进行注射用无菌粉末用卤化丁基橡胶塞检测时,必须严格按照操作规程进行,保证检测的准确性和可靠性,从而保证药品的使用安全性和有效性。
如果发现检测结果不符合要求,必须采取相应的措施,例如责令生产厂家更换塞子,或对药品进行进一步的检测等。
另外,在实际操作中,应注意操作环境的清洁和无菌性,防止污染和交叉感染的发生。
总之,注射用无菌粉末用卤化丁基橡胶塞的检测是确保药品安全和有效的重要措施,必须按照操作规程严格执行,并在检测之前进行必要的前期准备工作,以确保检测结果的准确、可靠和符合标准。
只有这样,才能保障药品的安全性和有效性,为患者带来更好的服务和治疗效果。
注射用无菌粉末用卤化丁基橡胶塞检测规程教学文稿

注射用无菌粉末用卤化丁基橡胶塞检测规程注射用无菌粉末用卤化丁基橡胶塞检测规程1、目的明确注射用无菌粉末用卤化丁基橡胶塞的检测规程。
2、范围适用于注射用无菌粉末用卤化丁基橡胶塞的检测。
3、职责QC人员负责执行、QC主管负责监督。
4、程序4.1外观取本品数个,在自然光线明亮处观察,照表1检查,应符合规定表1外观检测项目、检验水平及接收质量限4.2穿刺落屑取本品适量,照注射剂用胶塞、垫片穿刺落屑测定法第二法对照法测定,落屑数应不得超过5粒。
注:见原厂出厂检验报告书。
4.3穿刺力取本品10个,照注射剂用胶塞、垫片穿刺力测定法第二法测定,穿刺瓶塞所需的力不得过10N。
注:见原厂出厂检验报告书。
4.4胶塞与容器密合性取本品10个,置于烧杯中,加水煮沸5分钟,取出,在70C干燥1小时,备用。
另取10个与之配套的注射剂瓶加水至标示容量,用上述胶塞塞紧,再加上与之配套的铝盖,压盖。
放入高压蒸汽灭菌器中,121C±2C保持30分钟,冷却至室温,放置24小时。
将上述样品倒置,放入含有10%!甲蓝溶液的带抽气装置的容器中,抽真空至真空度25Kpa,维持30分钟,真空装置恢复至常压,再放置30分钟取出,用水冲洗外壁,观察,亚甲蓝溶液不得渗入瓶内。
注:见原厂出厂检验报告书。
4.5自密封性取胶塞与容器密合性项下样品,采取符合注射剂用胶塞、垫片穿刺力测定法第二法的注射针,向胶塞不同穿刺部位垂直刺穿胶塞,每个胶塞穿刺3次,每穿刺10次后更换注射针。
将上述样品倒置,放入含有10%!甲蓝溶液带抽气装置的容器中,抽真空至真空度25Kpa,维持30分钟,真空装置恢复至常压,再放置30分钟取出,用水冲洗外壁,观察,亚甲蓝溶液不得渗入瓶内。
注:见原厂出厂检验报告书。
4.6灰分取本品适量,剪碎,取1.0g,置于已炽热至恒重的坩埚中,精密称定,在电炉上缓缓炽灼至完全炭化(应防止试样着火),放冷;在800C±25C炽灼使完全灰化,移置于干燥器内,放冷,精密称定后,再在800C±25C炽灼至恒重,即得。
14注射液用卤化丁基橡胶塞

检验记录
品 名
注射液用卤化丁基橡胶塞的检测
批 号
生产单位
规 格
检验依据
检验日期
1.试剂试液配制:
(1)10%乌洛托品溶液:称取乌洛托品g,加水至ml,摇匀,即得。
(2)(1→2)盐酸溶液:量取盐酸ml,加水稀释至ml,摇匀,即得。
(3)(1→1000)氯化钾溶液:称取氯化钾g,加水至ml,摇匀,即得。
(11)醋酸盐缓冲液(pH3.5):取醋酸铵g,加水ml溶解后,加7mol/L盐酸溶液ml,用2mol/L盐酸溶液或5mol/L氨溶液准确调节pH值至3.5(电位法指示),用水稀释至ml,即得。
(12)硫代乙酰胺试液:取硫代乙酰胺g,加水使溶解成ml,置冰箱中保存。临用前取混合液(由1mol/L氢氧化钠溶液ml、水ml及甘油ml组成)ml,加上述硫代乙酰胺溶液ml,置水浴上加热20秒钟,冷却,立即使用。
(4)高锰酸钾滴定液(0.002mol/L):称取高锰酸钾g,加水至ml,煮沸15分钟,密塞,静置2日以上,摇匀,即得。
(5)硫代硫酸钠滴定液(0.01mol/L):称取硫代硫酸钠g与无水碳酸钠g,加新沸过的冷水适量溶解使成ml,摇匀,即得。
(6)淀粉指示液:称取可溶性淀粉g,加水ml搅匀后,缓缓倾入ml沸水中,随加随搅拌,继续煮沸分钟,放冷,倾取上清液,即得。
供试液的醋酸铅试纸颜色。 结果:。
(6)不溶性微粒:取被测胶塞表面积cm2,置于锥形瓶中加入ml超滤纯化水至振荡器中(振荡频率300~350次/分钟)振荡20秒后,取水,照不溶性微粒检查法测定(中国药典2005年版二部附录Ⅸ C),粒子直径≥10μm粒子数(个/ml);粒子直径≥25μm粒子数(个/ml)。结果:。
穿刺时穿刺器。穿刺器在0.5Kg重物作用下,且胶塞穿刺部位。结果:。
注射液用氯化丁基橡胶塞
密封性与穿刺器保持性
用符合注射剂用胶塞、垫片穿刺力测(YBB00332004)
用符合注射剂用胶塞、垫片穿刺力测定法(YBB60072012)
无变化
灰分
800℃
修订为:“800±25℃”
挥发性硫化物*
易挥发性硫化物
删去“易”
不溶性微粒
表面积100cm2的“本品”若干个
修订为:表面积100cm2的“完整胶塞”若干个
删去:“且每ml中”
化学性能
澄清度与颜色
pH变化值
吸光度
易氧化物
不挥发物
重金属
铵离子
锌离子
电导率
表面积100cm2的“本品”若干个
/
/
紫外吸收度
/
/
/
/
空白对照液8ml
/
修订为:表面积100cm2的“完整胶塞”若干个
/
/
修订为:“吸光度”
/
/
/
/
修订为:“7ml”
/
无变化
无变化
无变化
无变化
无变化
无变化
注射剂用胶塞、垫片穿刺落屑测定法(YBB60082012)
第一法
第二法增订:“注射针(符合GB15811-2001)”。增订:垫片支撑装置图。
注射剂用胶塞、垫片穿刺力测定法(YBB60072012)第一法,
测定法增订:把被测胶塞分别装在配套注射剂瓶上,第二法增订:“注射针(符合GB15811)”增订:垫片支撑装置图。
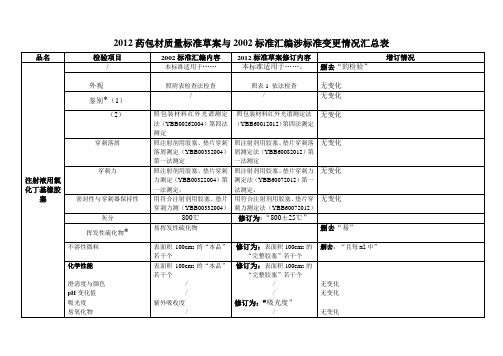
2012药包材质量标准草案与2002标准汇编涉标准变更情况汇总表
品名
检验项目
2002标准汇编内容
2012标准草案修订内容
增订情况
注射液用氯化丁基橡胶塞
丁基橡胶药用瓶塞检测SOP

丁基橡胶药用瓶塞检测SOP1. 目的为规范注射液用卤化丁基橡胶药用瓶塞的检定,特制定本SOP。
2. 范围本SOP适用于直接与注射剂接触的卤化丁基橡胶塞(注射液用卤化丁基橡胶塞、预灌封注射器用氯化丁基橡胶塞、预灌封注射器用溴化丁基橡胶塞)的检定。
3. 定义无4. 职责4.1.QC负责本规程的起草、修订、培训及执行。
4.2.QA、QC组长、质量管理部经理负责本规程的审核。
4.3.质量总监负责批准本规程。
4.4.QA负责本规程执行的监督。
5. 引用标准5.1.注射液用卤化丁基橡胶塞国家食品药品监督管理局直接接触药品的包装材料和容器标准汇编5.2.预灌封注射器用氯化丁基橡胶活塞国家食品药品监督管理局直接接触药品的包装材料和容器标准汇编5.3.预灌封注射器用溴化丁基橡胶活塞国家食品药品监督管理局直接接触药品的包装材料和容器标准汇编5.4.《中华人民共和国药典》6. 材料6.1.仪器设备天平,恒温水浴箱,分光光度计,pH计,恒温干燥箱,变温电炉,干燥器,电导率仪,高温炉。
6.2.试剂溶液标准铅溶液:购入;氯化铵铵溶液:取氯化铵10.5g,加水溶解使成100ml,即得;标准锌溶液:称取硫酸锌(ZnSO4·7H2O)0.440g,置1000ml量瓶中,加水溶解并稀释至刻度,摇匀,即得(每1ml相当于100µg的Zn);0.02mol/L高锰酸钾滴定液: 按《高锰酸钾滴定液配制及标定SOP》操作;0.1mol/L硫代硫酸钠滴定液:按《硫代硫酸钠滴定液配制及标定SOP》操作;碳酸氢钠:购入;硝酸:购入;硝酸银试液:取硝酸银17.5g,加水适量使溶解成1000ml,摇匀,即得;0.1%氯化钾溶液:取氯化钾0.1g,加水使溶解成100 ml,即得;稀硫酸:取硫酸57ml,加水稀释至1000ml,即得;淀粉指示液:取可溶性淀粉0.5g,加水5ml搅匀后,缓缓倾入100ml沸水中,随加随搅拌,继续煮沸2min,放冷,倾取上层清液,即得,本液应临用新制;碱性碘化汞钾试液:二氯化汞饱和水溶液:取二氯化汞7g,溶于100ml水中,摇匀。
药用卤化丁基胶塞溶血试验

2017年4月药用商化丁基胶塞溶血试验73药用商化丁基胶塞溶血试验李婷婷1朱碧君&(1.成都市食品药品检验研究院,四川成都,610045;2.江西省药品检验检测研究院、江西省药品与医疗器械质量工程技术研究中心,江西南昌,330029)摘要:[目的]研究药用丁基胶塞的溶血性能。
[方法]采用紫外分光光度法测定溶 血率。
[结果]溶血率均低于5%。
[结论]药用丁基胶塞在急性溶血方面,具有良好的生物安全性。
关键词:药用丁基胶塞,溶血试验丁基橡胶是由异丁烯和少量异戊二烯(<3%)在 超低温(-95$)条件下聚合而成的合成橡胶,卤化丁 基橡胶是在丁基橡胶分子结构中引人了活泼的g素原 子,同时保存了异戊二烯双键,使其不仅具备丁基橡胶 的优良性能,还减少了抗氧剂的污染,提高了纯度,加 快了硫化速度,更可实现无硫硫化、无锌硫化,大大地 减少了有害物质对药物的污染和副作用[1]。
卤化丁基 胶塞是瓶装药品重要的密封材料,由于它在药物的贮 存过程中,直接与药物接触,可能会通过吸附、吸收、渗 透和抽提等方式与药物发生相互反应,因此要求药用 丁基胶塞具备良好的生物安全性[2_3]。
本试验将3个 厂家共6批药用卤化丁基胶塞于-20丈低温冰箱中分 别放置1、2、4、8、12、18、24、36和48小时后,取出立即放人105 t烘箱中加热30分钟,对试验样品采用紫外 分光光度法测定溶血率[4]。
1材料和方法1.1实验材料1.1.1仪器UV-2550紫外分光光度计,日本岛津;SPX- 150B 型生化培养箱,上海博讯实业有限公司医疗设备厂;LX J-2B低速大容量多管离心机,上海安亭科学仪器 厂。
1.1.2试剂0.9 %氯化钠溶液,回音必集团(江西)东亚制药 有限公司,批号=200904032。
1.1. 3实验动物家兔(日本大耳白),来源:南昌龙平兔业有限公司,许可证号:SCXK(赣)2〇09 - 0001,合格证号00013。
注射液用卤化丁基橡胶塞质量认证检测项目

注射液用卤化丁基橡胶塞质量认证检测项目
三泉中石梳理了药品飞行检查中常见的注射液用卤化丁基橡胶塞缺陷,希望对制药领域有所参考,加强企业内部质量控制,并严格按照
YBB00042005《注射液用卤化丁基橡胶塞》要求进行管理。
穿刺力测试仪
注射液用卤化丁基橡胶塞质量认证常见的问题
1.医护人员在进行药业抽取的过程中,注射针穿刺部位存在落屑;
2.注射液用卤化丁基橡胶塞在穿刺的过程中,出现胶塞被推入内的现象;
3.穿刺后的卤化丁基橡胶塞密封性不严实,在输液的过程中发生泄漏; 4.穿刺器保持性差,使用中发生注射针掉落问题。
综上所述注射液用卤化丁基橡胶塞质量认证常见的问题中,有些药企没有科学的设备来判定,并且缺乏数据来源的支持,造成注射液用卤化丁基橡胶塞质量质量问题的出现。
本文济南三泉中石实验仪器有限公司推荐几款注射液用卤化丁基橡胶塞质量认证检测项目测试所用设备,希望可以帮助到大家。
穿刺力测试仪
注射液用卤化丁基橡胶塞质量认证检测项目和对应的检测设备
注射液用卤化丁基橡胶塞穿刺力和穿刺落屑检测可以用济南三泉中石实验仪器有限公司的穿刺力测试仪CCY-02,该仪器应用于测试各种薄膜、复合膜、电池隔膜、人造皮肤、药品包装用胶塞、组合盖、口服液盖等材料穿刺力强度试验。
注射液用卤化丁基橡胶塞穿密封性与穿刺器保持性检测需要用到三泉中石的穿刺力测试仪、悬挂力实验装置、金属穿刺针、手动封盖器。
注射液用卤化丁基橡胶塞

YBB30062012注射液用卤化丁基橡胶塞Zhusheyeyong Luhuadingji XiangjiaosaiHalogenated Butyl Rubber Stopper for Injection本标准适用于直接与注射液接触的氯化或溴化丁基橡胶塞。
【外观】取本品数个,照表1 依法检查,应符合规定。
【规格尺寸】取本品数个,照表2 和表3 依法检查,应符合规定。
【鉴别】*(1)称取本品2.0g,剪成小颗粒,置坩锅中,加碳酸氢钠2.0g 均匀覆盖试样,置电炉上,缓缓加热至炭化,放冷,置马弗炉300℃加热至完全灰化,取出后,冷却至室温,加水10ml 使溶解,滤过,取续滤液1.5ml,置于试管中,加硝酸酸化,加入硝酸银试液1 滴,应产生白色或淡黄色沉淀。
(2)取本品适量,照包装材料红外光谱测定法(YBB60012012)第四法测定,应与对照图谱基本一致。
【穿刺落屑】取本品10 个,照注射剂用胶塞、垫片穿刺落屑测定法(YBB60082012)第一法测定,落屑数应不得过20 粒。
【穿刺力】取本品10 个,照注射剂用胶塞、垫片穿刺力测定法(YBB60072012)第一法测定,平均穿刺力不得过75N,且每个胶塞的穿刺力均不得过80N,穿刺过程中不应有胶塞被推入瓶内。
【密封性与穿刺器保持性】取本品10 个,置高压蒸汽灭菌器中(不浸水),121℃±2℃,保持30 分钟,冷却至室温,另取10 个与之配套的玻璃注射液瓶加水至标示容量,用上述胶塞,塞紧,再加上与之配套铝盖,压盖。
用符合注射剂用胶塞、垫片穿刺力测定法(YBB60072012)中图1 所示的穿刺器,向胶塞穿刺部位垂直穿刺,穿刺器刺穿胶塞,倒挂瓶,穿刺器悬挂0.5kg 重物,穿刺器应保持4 小时不被拔出,且瓶塞穿刺部位应无泄漏。
【灰分】取本品1.0g,照橡胶灰分测定法(YBB600212012)测定,不得过45%。
【挥发性硫化物】* 取本品,照挥发性硫化物测定法(YBB60052012)测定,应符合规定。
丁基橡胶药用瓶塞检验规程

编号:ZL-SOP-QC-001-00目的:建立丁基橡胶药用瓶塞检验操作规程范围:本规程适用于丁基橡胶药用瓶塞的检验责任人:质检科内容:1.器具:量筒、烧杯、刻度吸管、pH计、移液管、100ml容量瓶、TU-1800型紫外分光光度计、微孔滤膜、10ml移液管、电炉、天平、锥形瓶、电热恒温干燥箱、瓷蒸发皿、干燥器、纳氏比色管、高温电炉。
2.试剂:淀粉指示液、高锰酸钾液(0.002mol/L)、硫代硫酸钠滴定液(0.01mol/L)、醋酸盐缓冲液(pH3.5)、碱性碘化汞钾、氯化铵溶液、2mol/L 盐酸、亚铁氰化钾试液、标准锌溶液、标准铅溶液(1ml相当于10μg的Pb)、硫代乙酰胺试液、混合液、碘化钾、稀硫酸、0.1%氯化钾溶液。
3.检查:3.1外观:3.1.1操作步骤:取样品100个,目视检测。
3.1.2结果判定:表面色泽应均匀,不得有污点、杂质、气泡、裂纹、缺胶、粗糙、胶丝、海绵状毛边;不得有除边造成的残缺或锯齿现象;不得有模具造成的明显痕迹,判为合格。
3.2灰分:3.2.1操作步骤:3.2.1.1分别称取样品1.0g两份,放入已炽灼至恒重的两个坩埚中,精密称定;3.2.1.2放入高温电炉中,缓缓炽灼至完全炭化;3.2.1.3再放入800℃炽灼至完全灰化,移置干燥器内;3.2.1.4放冷至室温,精密称定后,再在800℃炽灼至恒重。
4.2.2结果判定:遗留残渣不得过45%,判为合格。
3.3澄清度与颜色:3.3.1操作步骤:取供试液10.0ml置纳氏比色管中。
4.3.2结果判定:溶液应澄清无色。
如显浑浊,与2号浊度标准液比较,不得更浓;如显色,与黄绿色5号标准比色液比较,不得更浓,判为合格。
3.3.3注:试验液S1和空白液S0的制备按《丁基橡胶药用瓶塞质量标准》进行。
3.4酸碱度3.4.1操作步骤3.4.1.1用量筒分别量取试验液S1和空白液S0各20ml,置两个小烧杯中。
3.4.1.2向两个小烧杯中各加入氯化钾溶液(1→1000)1.0ml。
卤化丁基胶塞检验记录
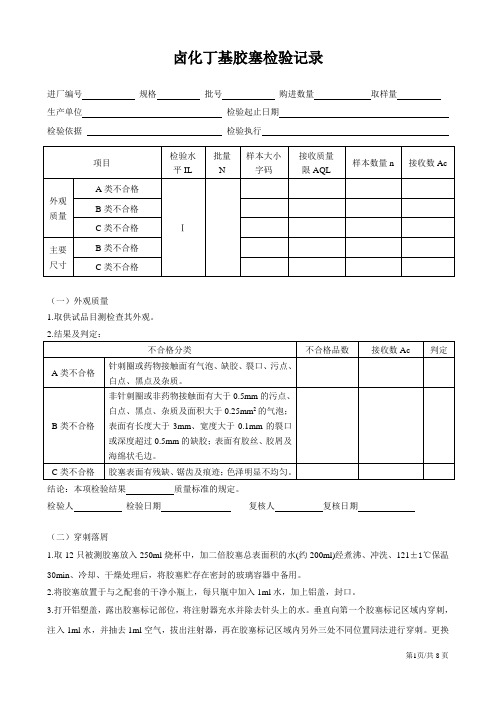
卤化丁基胶塞检验记录进厂编号规格批号购进数量取样量生产单位检验起止日期检验依据检验执行(一)外观质量1.取供试品目测检查其外观。
结论:本项检验结果质量标准的规定。
检验人检验日期复核人复核日期(二)穿刺落屑1.取12只被测胶塞放入250ml烧杯中,加二倍胶塞总表面积的水(约200ml)经煮沸、冲洗、121±1℃保温30min、冷却、干燥处理后,将胶塞贮存在密封的玻璃容器中备用。
2.将胶塞放置于与之配套的干净小瓶上,每只瓶中加入1ml水,加上铝盖,封口。
3.打开铝塑盖,露出胶塞标记部位,将注射器充水并除去针头上的水。
垂直向第一个胶塞标记区域内穿刺,注入1ml水,并抽去1ml空气,拔出注射器,再在胶塞标记区域内另外三处不同位置同法进行穿刺。
更换一个新的注射针和被测胶塞,按上述步骤进行穿刺,直至每个胶塞被穿刺4次。
4.将瓶中水全部通过一张0.5μm滤纸过滤,确保瓶中不残留落屑。
用肉眼观察滤纸上的落屑总数。
结果:落屑总数为(落屑总数≤5粒)结论:本项检验结果质量标准的规定。
检验人检验日期复核人复核日期(三)灰分仪器名称:箱式电阻炉型号:设备编号:仪器名称:电子分析天平型号:设备编号:1.空坩埚恒重W0:取坩埚置箱式电阻炉,于700℃~800℃炽灼至恒重;W02.称取本品1.0g,至已恒重的坩埚内,精密称定W1g。
3.样品经炭化、灰化后,置箱式电阻炉,于700℃~800℃炽灼至恒重W2:W24.计算:遗留残渣=(W2 - W0 )/(W1- W0)*100%= (灰分应≤55%)结论:本项检验结果质量标准的规定。
检验人检验日期复核人复核日期(四)不溶性微粒(检验执行SOP-)仪器:激光注射液微粒分析仪型号:编号:1.试验环境检测:取纯化水500ml,用µm的滤膜抽滤,取抽滤后的水依法检测。
2.供试品检测:取完整被测胶塞个(取用胶塞的数量应使总表面积尽量接近100cm2),置250ml三角烧杯中,加入微粒检查用水适量(取用微粒检查用水的ml数与被测胶塞总表面积的cm2数之比为1:1),用铝箔盖住三角烧杯杯口,置振荡器中,水平振蒎20秒,小心移开铝箔,先倒出部分供试液冲洗开启口及取样瓶后,将供试液倒入取样瓶中(或直接置于取样器上),静置,在15~30分钟时间范围内连续测定3次,弃去第1次数据,读取后两次测定结果,计算平均值。
卤化丁基橡胶塞二次灭菌后性能验证方案

卤化丁基橡胶塞二次灭菌后性能验证方案第一篇:卤化丁基橡胶塞二次灭菌后性能验证方案XXXX有限公司卤化丁基橡胶塞二次灭菌后性能验证一、目的:1、考察卤化丁基胶塞两次灭菌后的性能变化;2、通过实验数据对比,为胶塞二次灭菌的可行性提供依据。
二、试验依据:1、YBB00042005注射液用卤化丁基橡胶塞2、YBB00052005注射用无菌粉末用卤化丁基橡胶塞3、Q/320281YDZ 1-2011注射用冷冻干燥无菌粉末用卤化丁基橡胶塞三、试验方案:1、取清洗干净的卤化丁基胶塞1000只,在高压灭菌器中121℃×30min灭菌;2、将灭菌后的胶塞在90℃×2h条件下干燥,待用;3、按照YBB00052005标准或Q/320281YDZ 1-2011标准用上述胶塞做全项检验(说明:溶血、全身急性毒性试验未作,热原试验用细菌内毒素试验替代);4、将上述实验剩余胶塞(即第一次灭菌胶塞)按照步骤1、2进行第二次灭菌处理,再按照步骤3进行全项检验;5、将第二次灭菌后试验剩余胶塞再按照步骤4进行第三次灭菌及全项检验;6、分别按照上述实验步骤,注射用无菌粉末用卤化丁基橡胶塞和注射用冷冻干燥无菌粉末用卤化丁基橡胶塞各做10组试验;7、由于注射液用卤化丁基橡胶塞是终端灭菌,本方案没有进行验证。
四、结论:1、对上述每类胶塞的10组试验数据进行整理并进行对比分析,找出卤化丁基橡胶塞经过第一、二、三次灭菌后的性能变化趋势。
2、通过数据分析,得出结论。
编制:审核:批准:日期:日期:日期:第二篇:试剂性能验证方案酶联试剂性能验证方案验证试剂名称:验证时间:验证实验室负责人: 本方案根据ISO15189要求制定,适用于酶联试剂项目的性能验证,本方案从特异性、敏感性、测定下限、重复性(包括CUT-OFF值的重复性)、符合率5个方面对各个试验项目进行评价。
实验准备:1、质控品:使用商品化质控物进行,包括阴性和阳性。
2、样本的采集和保存:采集时间、保存方式等必须保证一致性。
HPLC法同时测定药用卤化丁基胶塞中5种抗氧剂和游离硫的含量

HPLC法同时测定药用卤化丁基胶塞中5种抗氧剂和游离硫的含量目的:建立同时测定药用卤化丁基胶塞中2,6-二叔丁基对甲酚(BHT)、游离硫、抗氧剂1010、抗氧剂330、抗氧剂1076、抗氧剂168含量的方法。
方法:采用高效液相色谱法。
色谱柱为Agilent Zorbax SB-C18,流动相为甲醇-水(梯度洗脱),流速为1.0 mL/min,柱温为25 ℃,检测波长为220 nm,进样量为10 μL。
结果:BHT、游离硫、抗氧剂1010、抗氧剂330、抗氧剂1076、抗氧剂168的检测质量浓度线性范围分别为2.592~64.80 μg/mL(r=0.999 9)、2.648~66.20 μg/mL(r=0.999 9)、2.062~51.55 μg/mL(r=0.999 9)、2.654~66.35 μg/mL(r=0.999 9)、2.128~53.20 μg/mL(r=0.999 9)、2.468~61.70 μg/mL(r=0.999 9);定量限分别为2.073 6、2.118 4、2.749 2、1.061 6、4.436 0、3.090 4 mg/kg,检测限分别为0.628 4、0.641 9、0.833 1、0.321 7、1.344 2、0.992 4 mg/kg;精密度、稳定性、重复性试验的RSD均小于3%;加样回收率分别为96.57%~99.17%(RSD=0.92%,n=9)、77.47%~86.14%(RSD=2.94%,n=9)、96.11%~98.39%(RSD=0.63%,n=9)、96.22%~98.33%(RSD=0.67%,n=9)、95.59%~99.22%(RSD=1.11%,n=9)、81.54%~88.31%(RSD=2.46%,n=9)。
结论:该方法灵敏快速、操作简便、重复性好,可用于同时测定药用卤化丁基胶塞中5种抗氧剂和游离硫的含量。
ABSTRACT OBJECTIVE:To establish a method for simultaneous determination of BHT,free sulfur,antioxidant 1010,antioxidant 330,antioxidant 1076 and antioxidant 168 in pharmaceutical halogenated butyl rubber stopper. METHODS:HPLC method was adopted. The determination was performed on Agilent Zorbax SB-C18 column with mobile phase consisted of methanol-water (gradient elution)at the flow rate of 1.0 mL/min. The column temperature was 25 ℃,and detection wavelength w as set at 220 nm. The sample size was 10 μL. RESULTS:The linear ranges of BHT,free sulfur,antioxidant 1010,antioxidant 330,antioxidant 1076 and antioxidant 168 were 2.592-64.80 μg/mL (r=0.999 9),2.648-66.20 μg/mL (r=0.999 9),2.062-51.55 μg/mL (r=0.999 9),2.654-66.35 μg/mL (r=0.999 9), 2.128-53.20 μg/mL (r=0.999 9), 2.468-61.70 μg/mL (r=0.999 9),respectively. The limits of quantitation were 2.073 6,2.118 4,2.749 2,1.061 6,4.436 0,3.090 4 mg/kg;the limits of detection were 0.628 4,0.641 9,0.833 1,0.321 7,1.344 2,0.992 4 mg/kg,respectively. RSDs of precision,stability and reproducibility tests were all lower than 3%. The average recoveries were 96.57%-99.17%(RSD=0.92%,n=9),77.47%-86.14%(RSD=2.94%,n=9),96.11%-98.39%(RSD=0.63%,n=9),96.22%-98.33%(RSD=0.67%,n=9),95.59%-99.22%(RSD=1.11%,n=9)and 81.54%-88.31%(RSD=2.46%,n=9),respectively. CONCLUSIONS:The method is sensitive,rapid,convenient and reproducible,and can be used for simultaneous determination of 5 antioxidant and free sulfur in pharmaceutical halogenated butyl rubber stopper.KEYWORDS Pharmaceutical halogenated butyl rubber stopper;BHT;Free sulfur;Antioxidant 1010;Antioxidant 330;Antioxidant 1076;Antioxidant 168;HPLC;Content determination药用卤化丁基胶塞是药品包装中瓶装密封材料的重要组成部分,具有吸湿率低、耐化学性及气密性好、无生理毒副作用等特点[1]。
药用氯化丁基橡胶塞测试标准

药用氯化丁基橡胶塞标准(试行)YBB 00042002本标准适用于直接与注射剂接触的氯化丁基橡胶塞。
【外观】取本品数个,目视检测,表面色泽应均匀,不得有污点、杂质、气泡、裂纹、缺胶、粗糙、胶丝、胶屑、海绵状、毛边;不得有除边造成的残缺或锯齿现象;不得有模具造成的明显痕迹。
【鉴别】(1)称取本品5~20g,置于干燥的试管中,将长约4毫米的钠片一片置于固定并倾斜的试管中,使其恰好位于试样之上,用火焰的尖端加热试管,将钠融化在试样上,继续加热2分钟,使呈深红色,冷却后加入乙醇,将过剩的钠醇化,加水约10ml溶解,过滤,滤液备用。
A:取滤液1.5ml置于试管中,加硝酸酸化,煮沸1~2分钟,加入硝酸银1滴,应产生白色沉淀。
B:取滤液0.2ml,置于微量试管中,加氯仿1滴,加稀硫酸1滴,加薪配置的氨水1滴(或3%H2O2溶液2~3滴),经振荡混匀后,静止5分钟,氯仿层应不显色。
(2)红外光谱取本品约3g切成3mm×3mm小块置索氏抽提器中用丙酮或适宜的溶剂回流浸提8小时,取残渣80℃烘干,取0. 1~0.2g置于裂解管的底部,然后用试管夹水平的将裂解管移到酒精灯上加热,当出现裂解产物冷凝在裂解管冷端时,再继续加热至裂解基本完全但没碳化为止,取少许裂解物滴在溴化钾片上,在80℃烘干,照分光光度法(《中华人民共和国药典》2000年版二部ⅣC)测定,应与对照图谱基本一致。
【穿刺落屑】输液瓶用胶塞:取10只被测胶塞和10只已知穿落屑数的胶塞分别装在与其相配的输液瓶上,每只瓶中注入半瓶水。
加上铝盖,用手动封盖机封口,打开铝盖穿刺部位。
按先被测胶塞再已知穿刺落屑数胶塞的顺序交替穿刺胶塞。
穿刺时,胶塞保持直立,握持金属穿刺器(见图1)垂直向胶塞标记区域内穿刺,晃动数秒后拨出穿刺器。
每次穿刺前用丙酮或甲基—异丁基酮擦拭穿刺器。
穿刺器不得有损坏,并保持锋利(如穿器损坏,须换用新的)。
直至所有胶塞胶被穿刺一次。
取下被测胶塞,将瓶中水全部通过快速滤纸过滤,确保瓶中不残留落屑。
丁基胶塞

丁基胶塞检验记录
检品名称
规 万只
生产单位 取样日期 年 月 日 物料编号 报告日期 年 月 日 取样数量 只 检验者 复核者 检验依据 企业标准《Q/320281YDZ-2008》
结 论 本品按企业标准《Q/320281YDZ-2008》检验,结果
一、外观质量:
本品表面光洁、色泽 ,
二、化学性能:
1、澄清度与颜色:
取本品,依法制备试验液。
取试验液 ml ,置比色管中观察,溶液
2、PH 变化值:
取制备的试验液与空白液分别测定PH 值,PH 值分别为: 、
三、胶塞与容器的密合性:
与配套西林瓶口配合
四、不挥发物:
取制备的试验液与空白液,依法检查,两者之差 过4.0mg 。
五、标志、包装:
标志:产品名称、生产厂家、厂址、商标;生产日期、规格、数量等
包装:外包装为 内包装为
丁基胶塞检验报告书
报告书编号:BH057R—10005
检品名称药用卤化丁基橡胶塞规格20-D3
生产单位江阴海华橡塑有限公司数量150.5万只
物料编号BH07-100803 取样日期2010 年10 月05 日取样数量200 只报告日期2010 年10 月09 日检验依据企业标准《Q/320281YDZ-2008》
检验项目标准规定检验结果
外观质量:应符合规定符合规定
化学性能:应符合规定符合规定
密合性能:应符合规定符合规定
不挥发物:应符合规定符合规定
标志、包装:应符合规定符合规定
结论本品按企业标准《Q/320281YDZ-2008》检验,以上检验结果均符合规定。
质量受权人复核人检验人。
药用卤化丁基胶塞溶血试验

药用卤化丁基胶塞溶血试验药用卤化丁基胶塞(PIB)是一种常用的血液采集器材,在医疗领域普遍使用。
然而,PIB在某些情况下可能引起患者的溶血反应。
因此,溶血试验是必需的,以评估PIB对患者的安全性。
本文将介绍药用PIB的溶血试验。
首先,需要准备一份PIB溶血试验方案。
试验方案包括以下几个步骤:1. 准备试验物质:需要准备一定量的PIB,以及不同浓度的溶菌酶。
2. 制备试样:将患者血液加入PIB中,使其与PIB混合均匀。
制备不同的试样,每个样品含有不同的PIB质量和不同浓度的溶菌酶。
3. 孵育样本:将每个样本孵育在37°C的试验条件下。
观察样本30分钟,1小时,2小时和24小时的变化。
4. 评估样本:观察每个样本的溶血程度。
不同程度的溶血可以通过观察血液液化程度、红细胞碎片数量、血红蛋白含量等指标来评估。
然后,按照上述方案进行试验。
试验后,可以通过以下步骤来评估溶血反应:1. 观察样本中红细胞数量和形态的变化。
如果红细胞数量减少,而且形态不正常,说明PIB产生了溶血反应。
2. 测量样品中游离血红蛋白的含量。
溶血反应会导致红细胞破裂,释放游离血红蛋白,因此通过测量血红蛋白含量也可以评估溶血反应。
3. 观察血浆的透明度。
溶血后,血浆中的蛋白质会减少,从而导致血浆的透明度下降。
4. 减轻剂量或替换血管取血工具。
如果观察到严重的溶血反应,需要减轻剂量或替换血管取血工具。
综上所述,药用PIB的溶血试验是必要的,可以保存患者的安全,并确保正确的治疗。
当医护人员使用这种血管采集系统时,应该牢记这个过程,并采用正确的技术和安全措施。
注射液用卤化丁基橡胶塞

YBB30062012注射液用卤化丁基橡胶塞Zhusheyeyong Luhuadingji XiangjiaosaiHalogenated Butyl Rubber Stopper for Injection本标准适用于直接与注射液接触的氯化或溴化丁基橡胶塞。
【外观】取本品数个,照表1 依法检查,应符合规定。
【规格尺寸】取本品数个,照表2 和表3 依法检查,应符合规定。
【鉴别】*(1)称取本品2.0g,剪成小颗粒,置坩锅中,加碳酸氢钠2.0g 均匀覆盖试样,置电炉上,缓缓加热至炭化,放冷,置马弗炉300℃加热至完全灰化,取出后,冷却至室温,加水10ml 使溶解,滤过,取续滤液1.5ml,置于试管中,加硝酸酸化,加入硝酸银试液1 滴,应产生白色或淡黄色沉淀。
(2)取本品适量,照包装材料红外光谱测定法(YBB60012012)第四法测定,应与对照图谱基本一致。
【穿刺落屑】取本品10 个,照注射剂用胶塞、垫片穿刺落屑测定法(YBB60082012)第一法测定,落屑数应不得过20 粒。
【穿刺力】取本品10 个,照注射剂用胶塞、垫片穿刺力测定法(YBB60072012)第一法测定,平均穿刺力不得过75N,且每个胶塞的穿刺力均不得过80N,穿刺过程中不应有胶塞被推入瓶内。
【密封性与穿刺器保持性】取本品10 个,置高压蒸汽灭菌器中(不浸水),121℃±2℃,保持30 分钟,冷却至室温,另取10 个与之配套的玻璃注射液瓶加水至标示容量,用上述胶塞,塞紧,再加上与之配套铝盖,压盖。
用符合注射剂用胶塞、垫片穿刺力测定法(YBB60072012)中图1 所示的穿刺器,向胶塞穿刺部位垂直穿刺,穿刺器刺穿胶塞,倒挂瓶,穿刺器悬挂0.5kg 重物,穿刺器应保持4 小时不被拔出,且瓶塞穿刺部位应无泄漏。
【灰分】取本品1.0g,照橡胶灰分测定法(YBB600212012)测定,不得过45%。
【挥发性硫化物】* 取本品,照挥发性硫化物测定法(YBB60052012)测定,应符合规定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
卤化丁基胶塞检验记录
进厂编号规格批号购进数量取样量
生产单位检验起止日期
检验依据检验执行
(一)外观质量
1.取供试品目测检查其外观。
结论:本项检验结果质量标准的规定。
检验人检验日期复核人复核日期
(二)穿刺落屑
1.取12只被测胶塞放入250ml烧杯中,加二倍胶塞总表面积的水(约200ml)经煮沸、冲洗、121±1℃保温30min、冷却、干燥处理后,将胶塞贮存在密封的玻璃容器中备用。
2.将胶塞放置于与之配套的干净小瓶上,每只瓶中加入1ml水,加上铝盖,封口。
3.打开铝塑盖,露出胶塞标记部位,将注射器充水并除去针头上的水。
垂直向第一个胶塞标记区域内穿刺,注入1ml水,并抽去1ml空气,拔出注射器,再在胶塞标记区域内另外三处不同位置同法进行穿刺。
更换
一个新的注射针和被测胶塞,按上述步骤进行穿刺,直至每个胶塞被穿刺4次。
4.将瓶中水全部通过一张0.5μm滤纸过滤,确保瓶中不残留落屑。
用肉眼观察滤纸上的落屑总数。
结果:落屑总数为(落屑总数≤5粒)
结论:本项检验结果质量标准的规定。
检验人检验日期复核人复核日期
(三)灰分
仪器名称:箱式电阻炉型号:设备编号:
仪器名称:电子分析天平型号:设备编号:
1.空坩埚恒重W0:取坩埚置箱式电阻炉,于700℃~800℃炽灼至恒重;
W0
2.称取本品1.0g,至已恒重的坩埚内,精密称定W1g。
3.样品经炭化、灰化后,置箱式电阻炉,于700℃~800℃炽灼至恒重W2:
W2
4.计算:遗留残渣=(W2 - W0 )/(W1- W0)*100%
= (灰分应≤55%)
结论:本项检验结果质量标准的规定。
检验人检验日期复核人复核日期
(四)不溶性微粒(检验执行SOP-)
仪器:激光注射液微粒分析仪型号:编号:
1.试验环境检测:
取纯化水500ml,用µm的滤膜抽滤,取抽滤后的水依法检测。
2.供试品检测:取完整被测胶塞个(取用胶塞的数量应使总表面积尽量接近100cm2),置250ml三角烧杯中,加入微粒检查用水适量(取用微粒检查用水的ml数与被测胶塞总表面积的cm2数之比为1:1),用铝箔盖住三角烧杯杯口,置振荡器中,水平振蒎20秒,小心移开铝箔,先倒出部分供试液冲洗开启口及取样瓶后,将供试液倒入取样瓶中(或直接置于取样器上),静置,在15~30分钟时间范围内连续测定3次,弃去第1次数据,读取后两次测定结果,计算平均值。
判定:本项检验结果质量标准之规定。
检验人检验日期复核人复核日期
(五)化学性能
试验液、空白液制备:按SOP-2制备试验液、空白液。
1、澄清度与颜色
(1)澄清度检查
仪器名称:澄明度检测仪型号:设备编号:
取试验液S1、空白液S0、2号浊度标准液各10ml分别置于3只配套的纳氏比色管中。
在浊度标准液制备5分钟后,在暗室内垂直同置于伞棚灯下、照度为1000Lx,从水平方向观察比较。
结果:(试验液的浊度应与空白液的一致,即为澄清;如显浑浊,应不浓于2号浊度标准液。
)
结论:本项检验结果质量标准的规定。
检验人检验日期复核人复核日期
(2)颜色检查
取试验液S1、5号标准比色液各10ml分别置于2只配套的纳氏比色管中。
两管同置白色背景上,自上向下透视,或同置白色背景前,平视观察。
结果:(试验液如显色,应不深于黄绿色5
号标准比色液。
)
结论:本项检验结果质量标准的规定。
检验人检验日期复核人复核日期
2、pH变化值:仪器名称:精密pH计型号:设备编号:
(1)校正:标准缓冲液
a、混合磷酸盐标准缓冲液(25℃,PH6.86)实测温度℃,PH校正为
b、邻苯二甲酸氢钾标准缓冲液(25℃,PH4.00)实测温度℃,PH校正为
(2)取试验液20.0ml,加氯化钾溶液(1→1000)1ml,实测温度℃,PH1=
(3)取空白液20.0ml,加氯化钾溶液(1→1000)1ml,实测温度℃,PH0=
结果:试验液与空白液的PH之差│PH1-PH0│= (应≤1.0)
结论:本项检验结果质量标准的规定。
检验人检验日期复核人复核日期
3、紫外吸收度
仪器名称:紫外-可见分光光度计型号:设备编号:
将试验液S1用0.45μm的微孔滤膜过滤。
以空白液为对照。
将试验液及参照液放入比色皿中,用紫外可见分光光度计在220-360nm范围内扫描检测,寻找最大的吸光度。
结果:最大吸光度为(应≤0.1)
结论:本项检验结果质量标准的规定。
检验人检验日期复核人复核日期
4、易氧化物
(1)取20.00ml试验液S1,加入250ml具塞三角瓶中,加入稀硫酸2ml和KMnO4滴定液(0.002mol/L)20.00ml,煮沸3min,迅速冷却,加0.1gKI,用Na2S2O3滴定液(0.01mol/L)滴定至浅棕色,再加入5滴淀粉指示液,继续用Na2S2O3滴定液(0.01mol/L)滴定至无色。
消耗的Na2S2O3滴定液(0.01mol/L)的体积V1ml
(2)同法滴定空白液So,消耗的Na2S2O3滴定液(0.01mol/L)的体积Vo ml。
(3)计算:
V=Vo-V1= (应≤5.0ml)
结论:本项检验结果质量标准的规定。
检验人检验日期复核人复核日期
5、不挥发物
仪器名称:电子分析天平型号:设备编号:
(1)取2只洁净的玻璃蒸发皿置电热鼓风干燥箱内,在105℃干燥至恒重:
①W1
②W2
(2)取试验液及空白液各100.00ml,置上述恒重的空蒸发皿内,在水浴上蒸干。
(3)移入电热鼓风干燥箱内,在105℃干燥至恒重,称取重量。
①W1/(试验液)
②W2/(空白液)
(4)计算:W=(W1/-W1)-(W2/-W2)= mg (应≤3.0mg/100ml)
结论:本项检验结果质量标准的规定。
检验人检验日期复核人复核日期
6、重金属
(1)供试品管A:取试验液10.00ml置比色管中。
(2)对照管B:取标准铅溶液1.00ml置比色管中。
(3)将上述两管中分别加入醋酸盐缓冲液(PH3.5)2ml,硫代乙酰胺试液2ml,摇匀,放置2分钟。
(4)两管进行颜色比较。
结果:[A管的颜色应不深于B管的颜色(≤0.0001%)。
]
结论:本项检验结果质量标准的规定。
检验人检验日期复核人复核日期
7、铵离子
(1)取试验液10.00ml置比色管中,加入碱性碘化汞钾2ml,摇匀,放置15分钟。
观察。
(2)如显色,取氯化铵溶液2.0ml,加空白液8.0ml置比色管中,加入碱性碘化汞钾2ml,摇匀,放置15分钟。
将两管进行比较。
结果:[供试品管的颜色应不深于对照管的颜色(≤0.0002%)。
]
结论:本项检验结果质量标准的规定。
检验人检验日期复核人复核日期
8、锌离子
(1)供试品管A:取试验液10.00ml置比色管中。
(2)对照管B:取标准锌溶液(Zn2+10μg/ml)3.0ml置比色管中。
(3)将上述两管中分别加入2M盐酸1ml和亚铁氰化钾3滴混合,摇匀。
(4)供试品管A应不显色;如显色,与对照管B进行颜色比较。
结果:[A管应不显色或不深于B管的颜色(≤0.0003%)。
]
结论:本项检验结果质量标准的规定。
检验人检验日期复核人复核日期
9、电导率:(在试验液制备5h内进行)
仪器名称型号设备编号电极常数
(1)取空白液20ml,测量其电导率。
实测温度℃,电导率μS/cm(在20±1℃下应小于3.0μS/cm)。
(2)取试验液20ml,测量其电导率。
实测温度℃,电导率μS/cm。
(≤30.0μS/cm。
)
结论:本项检验结果质量标准的规定。
检验人检验日期复核人复核日期
(六)主要尺寸
1.按胶塞正常检验一次抽样方案表,随机抽取样品只。
2.用精度为0.02mm的游标卡尺进行测量并记录。
3.结果(单位:mm)
判定:本品检验结果质量标准的规定。
检验人检验日期复核人复核日期。
