微粒分散体系
分散体系中微粒大小与特征
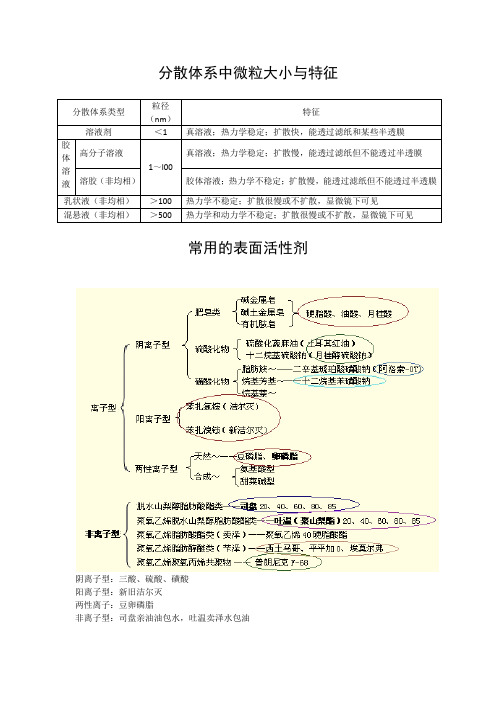
分散体系类型
粒径(nm)
特征
溶液剂
<1
真溶液;热力学稳定;扩散快,能透过滤纸和某些半透膜
胶体溶液
高分子பைடு நூலகம்液
1~l00
真溶液;热力学稳定;扩散慢,能透过滤纸但不能透过半透膜
溶胶(非均相)
胶体溶液;热力学不稳定;扩散慢,能透过滤纸但不能透过半透膜
乳状液(非均相)
>100
热力学不稳定;扩散很慢或不扩散,显微镜下可见
混悬液(非均相)
>500
热力学和动力学不稳定;扩散很慢或不扩散,显微镜下可见
常用的表面活性剂
阴离子型:三酸、硫酸、磺酸
阳离子型:新旧洁尔灭
两性离子:豆卵磷脂
非离子型:司盘亲油油包水,吐温卖泽水包油
微粒分散体系在药剂学中的意义

微粒分散体系在药剂学中的意义
微粒分散体系在药剂学中具有重要的意义,因为它们能够改善药物的生物利用度、稳定性和治疗效果。
以下是微粒分散体系在药剂学中的一些重要意义:
1. 提高药物溶解度和生物利用度:微粒分散体系可以将水不溶性药物转化为更易溶解或更易吸收的形式,提高药物的生物利用度。
2. 延缓药物的释放:微粒分散体系可以通过控制粒子大小和分散度来延缓药物的释放,从而实现长效稳定的治疗效果。
3. 改善药物的稳定性:在微粒分散体系中,药物分子可以被包裹在分散介质中,从而提高其稳定性,防止化学反应或失效。
4. 提高药物的选择性和特异性:微粒分散体系可以通过改变粒子的表面性质和大小来提高药物的选择性和特异性,从而实现更准确的治疗效果。
5. 改善制剂工艺和生产效率:微粒分散体系可以使用常规方法进行制剂和生产,从而提高制剂工艺和生产效率,降低成本。
综上所述,微粒分散体系在药剂学中具有重要的应用前景,有望推进药物研究和开发,提高药物治疗效果和患者生活质量。
药物微粒分散系

第三节 与微粒分散体系物理稳定性有关的理论 微粒聚结动力学 >1μm微粒不稳定(聚沉速度相对快) 快聚结 ΦT=0时势垒为0 ,一经碰撞就聚结,聚结速度由碰撞速率决定,碰撞速率由布朗运动决定即由扩散速度决定。 快聚结速度与微粒大小无关,若温度黏度固定,与微粒浓度平方成正比。
第三节 与微粒分散体系物理稳定性有关的理论 微粒聚结动力学 慢聚结 当势垒存在时,聚结速度比公式预测小。电解质有显著影响浓度降低聚结速度降低明显。浓度低反离子少双电层斥力大。 架桥聚结 聚合物有效覆盖微粒表面时能发挥空间结构的保护作用;当被吸附的聚合物只覆盖微粒一小部分表面时,使微粒对电解质敏感性大大增加,称此种絮凝作用称为敏化,可减少絮凝所需的电解质用量。这时吸附在微粒表面的高分子聚合物长链可能同时吸附在另一颗粒表面形成分子桥。
第十一章 药物微粒分散系的基本理论 第二节 微粒分散体系的性质与特点 微粒分散体系的动力学稳定性 两方面 减少粒径是防止沉降速度最有效方法,同时增加粘度,减少微粒和分散介质之间的密度差,控制温度,可阻止沉降
三、微粒光学性质(光散射丁泽尔效应) 四、微粒电学性质(电泳、双电层)
第十一章 药物微粒分散系的基本理论 第二节 微粒分散体系的性质与特点
第二篇 药物制剂的基本理论 第十一章 药物微粒分散体系的基础理论
01
04
02
05
添加标题
第一节 概述
添加标题
微粒给药系统
添加标题
第二篇 药物制剂的基本理论
添加标题
粗分散体系:混悬剂、乳剂、微囊
07
08
添加标题
胶体分散体系:纳米微乳、脂质体、
添加标题
纳米粒、纳米囊(<1000nm)
第十一章 药物微粒分散系的基本理论 第三节 与微粒分散体系物理稳定性有关的理论 二、DLVO理论 (四)临界聚沉浓度 通常势垒为零或很小时才发生聚沉。微粒凭借动能可克服势垒障碍,一旦越过势垒,微粒间相互作用的势能随彼此接近而降低,最后势能曲线在第一极小处达平衡,如势能较高足以阻止微粒在此处聚结。但在第二极小处足以阻挡微粒动能发生聚结,且由于微粒间距较远,聚集体呈松散结构,易破坏和恢复,有触变性。 第一极小处发生聚结称聚沉 第二极小处发生聚结称絮凝
第四章_微粒分散体系

分子的真溶液则是透射光为主,同样观察不到乳光。
当一束光线在暗室通过胶粒分散系,在其侧面 可看到明显的乳光,即Tyndall现象。丁铎尔 现象是微粒散射光的宏观表现。
低分子溶液—透射光;粗分散体系—反射光;
胶体分散系—散射光。
丁达尔现象
丁达尔现象(Tyndall phenomena)
在暗室中,将一束光通过溶胶时,在侧面可 看到一个发亮的光柱,称为乳光,即丁达尔 (Tyndall)现象。
1、分散性
2、多相性 3、聚结不稳定性
三、在药剂学中的应用
1、有助于提高药物的溶解速度及溶解度,有利 于提高难溶性药物的生物利用度 2、利于提高药物在分散介质中的分散性 3、在体内分布上具有一定的选择性 4、具有缓释作用,减少剂量,降低毒副作用 5、改善药物在体内外的稳定性等
发生的电离、吸附或摩擦等产生的电荷所表现
的性质。
(一)电泳(electrophoresis) 在电场作用下微粒的定向移动叫电泳。 在溶液的电场中,微粒受两种作用力,一种是静电力Fe, 另一种是摩擦力Fs,而且这两种力在恒速运动时大小相 等。 E (4-16) v E 6rv
6r
其中,r—球型微粒半径, σ—表面电荷密度,E—电场强度,v—恒 速运动的速度。
式中,Π—渗透压,c—溶胶的浓度,R—气体常数,
T—绝对温度。
(三)沉降与沉降平衡
在一个分散体系中微粒的密度大于分散介质的密度,就会发生沉降。 如果是粗分散体系,粒子较大,经过一段时间以后,粒子会全部沉降到容器 的底部。如果粒子比较小,由于粒子的布朗运动,一方面受到重力作用而沉 降,另一方面由于沉降使上、下部分的浓度发生变化,引起扩散作用,使浓 度趋向于均匀。当沉降和扩散这两种方向相反的作用力达到平衡时,体系中 的粒子以一定的浓度梯度分步,这种平衡称作沉降平衡。达到沉降平衡后体 系的最下部浓度最大,随高度的上升浓度逐渐减小。
第四章-微粒分散体系

二、微粒分散体系的光学性质
光是一种电磁波,当一束光照射到一个微粒分散体系时,
可以出现光的吸收、反射和散射等现象。
光的吸收主要由微粒的化学组成与结构决定;光的反射 与散射主要取决于微粒的大小。丁铎尔现象是微粒散射光的 宏观表现。现今丁铎尔现象已经成为判断纳米体系的一个简 单方法。微粒大小不同,光学性质相差很大。在同等条件下, 粗分散体系由于反射光为主,不能观察到丁铎尔现象;而低 分子的真溶液则是透射光为主,同样观察不到乳光。
➢ 注射>50m的微粒,可使微粒分别被截留在肠、肾等相应部位。
四、微粒大小与测定方法
微粒大小完全均一的体系称为单分散体系; 微粒大小不均一的体系称为多分散体系; 微粒分散系中常用的粒径表示方法有几何学粒
径、比表面积径等。
1.电子显微镜法
测定原理:电子束射到样品上,如果能量足够大就 能穿过样品而无相互作用,形成透射电子,用于透 射电镜(TEM)的成像和衍射;
一、微粒分散系的动力学性质
➢ 微粒分散体系的动力学稳定性主要表现在 两个方面。
当微粒较小时,主要是分子热运动产生的
布朗运动;提高微粒分散体系的物理稳定
性
当微粒较大时,主要是重力作用产生的沉 降。降低微粒分散体系的物理稳定性
(一)Brown运动
布朗运动:粒子永不停息的无规则的直线运动
布朗运动是粒子在每一瞬间受介质分子碰撞的合力方向 不断改变的结果。由于胶粒不停运动,从其周围分子不 断获得动能,从而可抗衡重力作用而不发生聚沉。
反离子排列在定位离子附近。
反离子中心称为斯特恩面,从斯
特恩面到粒子表面之间为斯特恩
层。该层ψ0直线下降到ψd 。
ψo
斯特恩层外有一切动面,该处
电势即ζ电势,它是衡量胶粒带电
微粒分散体系

I
I0
24 3V 2 ( n 2 n02 ) 2
n 2n 4
2
2
I
I0
24 3V 4
2
( n2 n02 n2 2n02
)2
0
I—散射光强度;I0_ —入射光强度;n —分散相的折射率; n0 — 分散介质的折射率;—入射光波长;V —单个粒子的 体积;ν —单位体积中粒子数目。
17
五、微粒的电学性质
• 微粒带电原因:电离、吸附、摩擦。
(一)电泳(electro phoresis)
• 定义:微粒分散系中的微粒在电场作用 下,向阴极、阳极做定向的移动。
• 微粒受力:静电力、摩擦力
E / 6r
粒子越小,移动越快
18
(二)微粒的双电层结构
•
微粒表面带同种电荷,通过静电引力,使反离
• 1980年已制得热力学稳定的氢氧化铝 溶胶,说明制备热力学稳定的微粒分散系 是可能的。
23
二、动力学稳定性
• 动力稳定性表现在: 布朗运动 沉降 • 粒子的沉降(上浮)速度符合Stokes方程:
V 2r 2 ( 1 2 ) g 9
防止沉降方法 1. 减少粒度(增加均匀性) 2. 增加粘度 3. 降低密度差 4. 防止晶型转变 5. 控制温度变化
力学、光学、电学性质) • 微粒分散系的物理稳定性(动力学、
热力学)进行较深入的讨论。
1
第一节 概述
• *分散体系:一种或几种物质高度分散在某 种介质中所形成的体系。
• 按分散相粒子大小分类: • 微粒分散体系:1nm~100µm • 微粒给药系统: • 微粒分散体系的特点:多相、热力学不稳定、
微粒分散体系-精品医学课件 (2)

药物微粒分散体系
粗 Suspension 分 Sol 散 Emulsion 体 Microcapsule 系 microsphere
粒径 100nm-100μm
nanoemulsion 胶
Liposome
体
nanoparticle 分
Nanocapsule
散 体
Nanomicell
系
粒径 <100nm
临界聚沉浓度
三、 空间稳定理论
(一) 实验规律
相对分子质量大小高分子对微粒保护作用的影响
(a)较小相对分子量高分子;(b)中等相对分子量高分子;(c)较高相对分子量高分子
敏化作用(sensitization) :高分子在粒子表面覆
盖度q =0.5时絮凝效果最好,微粒聚集下沉
(二) 理论基础 1、两种稳定理论
3
r3( 0)g
在高度为dh的体积内粒子所受的总扩散力:
F扩散 Ad ARTdC
粒子总数为: LCdV LCAdh
每一个粒子所受到的扩散力:F扩散
ARTdC LCAdh
RT LC
dC dh
(二)沉降与沉降平衡
达平衡时,重力与扩散力大小相等、方向相反:
F扩散
1)体积限制效应理论: 两微粒接近时,彼此的吸附层不能互相穿透 2)混合效应理论: 微粒表面上的高分子吸附层可以互相穿透。
四、空缺稳定理论
亦称自由聚合物稳定理论。
五、微粒聚结动力学
快聚结 慢聚结
架桥聚结 聚合物
有效覆盖 微粒表面
小部分覆盖 微粒表面
空间保护作用 架桥聚结
★
Tyndall现象的本质 是粒子对光的散射
2-第四章微粒分散体系

微粒分散体系的特殊性能:
①微粒分散体系首先是多相体系,分散相与 分散介质之间存在着相界面,因而会出现 大量的表面现象; ②随分散相微粒直径的减少,微粒比表面积 显著增大,使微粒具有 相对较高的表面自 由能,所以它是热力学不稳定体系 ,因此, 微粒分散体系具有容易絮凝、聚结、沉降 的趋势, ③粒径更小的分散体系(胶体分散体系)还 具有明显的布朗运动、丁铎尔现象、电泳 等性质。 Nhomakorabea
注射大于50m的微粒,可使微粒分别被截留在肠、 肝、肾等相应部位。
第三节
微粒分散体系的物理稳定性
微粒分散体系的物理稳定性直接关系到 微粒给药系统的应用。在宏观上, 微粒 分散体系的物理稳定性 可表现为 微粒粒 径的变化 , 微粒的絮凝 、 聚结 、 沉降 、 乳析和分层等等。 一、热力学稳定性 二、动力学稳定性 三、絮凝与反絮凝
第二节
微粒分散系的主要性质和特点
一、微粒大小与测定方法
微粒大小是微粒分散体系的重要参数,对其体内 外的性能有重要的影响。微粒大小完全均一的体 系称为单分散体系;微粒大小不均一的体系称为 多分散体系。绝大多数微粒分散体系为多分散体 系。常用平均粒径来描述粒子大小。 常用的粒径表示方法:几何学粒径、比表面粒径、 有效粒径等。 微粒大小的测定方法有光学显微镜法、电子显微 镜法 、 激光散射法 、 库尔特计数法 、Stokes 沉 降法、吸附法等。
微粒分散体系在药剂学的重要意义:
①由于粒径小,有助于提高药物的溶解速度及溶解 度,有利于提高难溶性药物的生物利用度; ②有利于提高药物微粒在分散介质中的分散性与稳 定性; ③具有不同大小的微粒分散体系在体内分布上具有 一定的选择性,如一定大小的微粒给药后容易被 单核吞噬细胞系统吞噬; ④微囊、微球等微粒分散体系一般具有明显的缓释 作用,可以延长药物在体内的作用时间,减少剂 量,降低毒副作用; ⑤还可以改善药物在体内外的稳定性。
药剂学:药物微粒分散体系的基础理论

三、微粒分散系的光学性质
当一束光照射到微粒分散系时,可以出现光的吸
(二)沉降——Stokes’定律
• 粒径 较 大 的 微 粒 受 重力作 用 ,静 置 时 会 自 然 沉降 , 其沉降速度服从 Stokes ’ 定律: (4-11)
r愈大,微粒和分散介 质的密度差愈大,分散 介质的粘度愈小,粒子 的沉降速度愈大。
2r 2 ( 1 2 ) g V 9
– 小分子真溶液(<10-9m;<1nm) – 胶体分散体系(10-7~10-9m;1~100nm) – 粗分散体系(>10-7m;>100nm) • 微粒:直径在10-9~10-4m的微粒,其构成的分散体系统称为 微粒分散体系。如微米与纳米级大小的各种给药载体/系统。
微粒分散体系的特殊性能:
①多相体系:
微球表面形态
Scanning electron micrography of ADM-GMS(阿霉素明胶微球)
微球橙红色,形态圆整、均匀,微球表面可见孔 隙,部分微球表面有药物或载体材料结晶。
2.激光散射法——动态光散射法
• 对于溶液,散射光强度、散射角大小与溶液的性质、溶质 分子量、分子尺寸及分子形态、入射光的波长等有关,对 于直径很小的微粒,雷利(瑞利)散射公式:
微粒大小与体内分布
< 50nm 的微粒能够穿透肝脏内皮, 通过毛细血管末梢或
淋巴传递进入骨髓组织。
静脉注射、腹腔注射0.1~3.0m的微粒能很快被单核吞噬 细胞系统吞噬,浓集于巨噬细胞丰富的肝脏和脾脏等部位。 人肺毛细血管直径为2m,>2m的粒子被肺毛细血管滞 留下来,<2m的微粒则通过肺而到达肝、脾等部位。 。 注射> 50m 的微粒,可使微粒分别被 截留在肠、肾等相 应部位。
11-药剂学-药物微粒分散系的基础理论

2.高分子聚合物在固体微粒表面上的吸附构型 高分子在溶液中具有一定的挠曲性和一定数量 的活性基团,这些活性基团能吸附在固体微粒 表面上而使吸附的高分子具有一定形状。 其吸附的高分子构型取决于固体微粒和高分子 聚合物的性质以及它们之间的相互作用。如固 体微粒表面吸附点的数目、高分子聚合物的链 长与活性基团的数目和位置、高分子聚合物在 溶剂中的溶解度等都是影响其吸附构型的重要 因素。 这样可将吸附高分子聚合物的构型分成六种形 式。
当微粒的半径大于1μm后,微粒的平均 位移只有0.656μm/s,已不显著,在分散 介质中受重力场作用而匀速运动,此时 应按Stoke′s定律,其沉降或上浮的速 度u以下式表示:
2a (ρ − ρ ) g u= 9η
2 0
式中,a——微粒的半径;g——重力加 速度;η——分散介质的粘度;ρ和 ρ0——微粒和分散介质的密度。
吸附高分子的构型
(二)高分子化合物的稳定作用 高分子化合物对微粒分散系的稳定作用主要体 现在以下几方面:高分子吸附层存在,产生一 种 新 的 斥 力 势 能 ─ 空 间 斥 力 势 能 (Steric Repulsive Energy);高分子的存在减小微粒 间的Hamaker常数,因而也就减少了范德华引 力势能;带电高分子被吸附会增加微粒间的静 电斥力势能。 总的势能VT: VT= VA + VR + VS 中, VA—— 吸 引 势 能 , VR—— 静 电 斥 力 势 能 , VS——空间斥力势能。
当微粒半径a>1μm后,则微粒就要沉降 或上浮,动力稳定性较差。因此为了减 小微粒沉降或上浮的速度,则通过增加 分散介质的粘度,加入增稠剂,调节微 粒与分散介质的密度差,使ρ≈ρ0。这 样可提高此微粒分散制剂的稳定性。 但最主要的是减小微粒的半径,当微粒 半径a从 10μm减小为 1μm时,其沉降 速度从4.36×102μm/s降低为 4.36μm/s,相差100倍。
药剂学第四章药物微粒分散体系分析

第四章药物微粒分散体系一、概念与名词解释1.分散体系2.扩散双电层模型3.DLVO理论4.临界聚沉状态二、判断题(正确的填A,错误的填B)1.药物微粒分散系是热力学稳定体系,动力学不稳定体系。
( )2.药物微粒分散系是动力学稳定体系,热力学不稳定体系。
( )3.药物微粒分散系是热力学不稳定体系,动力学不稳定体系。
( )4.微粒的大小与体内分布无关。
( )5.布朗运动可以提高微粒分散体系的物理稳定性,而重力产生的沉降降低微粒分散体系的稳定性。
( )6.分子热运动产生的布朗运动和重力产生的沉降,两者降低微粒分散体系的稳定性。
( ) 7.微粒表面具有扩散双电层。
双电层的厚度越大,则相互排斥的作用力就越大,微粒就越稳定。
( )8.微粒表面具有扩散双电层。
双电层的厚度越小,则相互排斥的作用力就越大,微粒就越稳定。
( )9.微粒体系中加入某种电解质使微粒表面的ζ升高,静电排斥力阻碍了微粒之间的碰撞聚集,这个过程称为反絮凝。
( )10.微粒体系中加入某种电解质使微粒表面的ζ升高,静电排斥力阻碍了微粒之间的碰撞聚集,这个过程称为絮凝。
( )11.微粒体系中加入某种电解质,中和微粒表面的电荷,降低双电层的厚度,使微粒间的斥力下降。
( )12.微粒体系中加入某种电解质,中和微粒表面的电荷,降低双电层的厚度,使微粒表面的ζ上升。
( )13.微粒体系中加入某种电解质,中和微粒表面的电荷,降低双电层的厚度,使微粒表面的ζ降低,会出现反絮凝现象。
( )14.微粒体系中加入某种电解质,中和微粒表面的电荷,降低双电层的厚度,使微粒间的斥力下降,出现絮凝状态。
加入的电解质叫絮凝剂。
( )15.絮凝剂是使微粒表面的ζ降低到引力稍大于排斥力,引起微粒分散体系中的微粒形成絮凝状态的电解质。
( )16.絮凝剂是使微粒表面的ζ升高,使排斥力大于吸引力,引起微粒分散体系中的微粒形成絮凝状态的电解质。
( )17.反絮凝剂是使微粒表面的ζ升高,使到排斥力大于吸引力,引起微粒分散体系中的微粒形成絮凝状态的电解质。
药剂学:第5章 药物微粒分散体系

加入后可提高微粒分散体系的物理稳定 性;
同一电解质,加入量不同,起絮凝作用 或反絮凝作用;
絮凝剂与反絮凝剂的作用强弱一般为:
阴离子>阳离子;高价离子>低价离子
枸橼酸盐、酸式枸橼酸盐;酒石酸盐、酸式酒石酸 盐;磷酸盐;氯化物(如:三氯化铝)……
多相体系,存在相界面,出现大量的表 面现象;
随粒径减小,比表面积增大,有相对较 高的表面自由能,热力学不稳定体系, 自发聚集;
粒径更小的具有布朗运动,丁达尔现象, 电泳。
3、在药剂学中的作用
粒径小,提高溶解度和溶解速度,提高 生物利用度;
提高分散性与稳定性; 在体内分布有一定的选择性; 有的有明显的缓释作用,延长药物在体
9
V越小,体系越稳定。r小于3μm,基本
可以克服重力不沉降。
3、絮凝flocculation与反絮凝
一般情况,微粒荷电,电荷的排斥力阻 碍微粒产生聚集,若加入电解质,使系 统对离子选择性的吸附,中和微粒表面 的电荷,使ζ电位降低到一定程度(约 25mv),减少电荷排斥力,以至微粒形 成疏松聚集体。此过程称为絮凝,此电 解质称絮凝剂。
1、热力学稳定性
对于微粒分散体系,随着粒径的减小,比表 面积增加,表面自由能增加:
表面积增加 /抑制聚结(稳定剂、粘度) 表面张力下降 微粒大小改变
选择适当的表面活性剂、稳定剂、增加介质粘度等
2、动力学稳定性
表现在两个方面:布朗运动 重力产生的沉降
Stokes定律
V 2r 2 1 2 g
双电层结构(P68) ζ=σε/r 微粒越小,ζ电位越高 ζ电位与微粒的稳定性关系密切。
内容提要
微粒分散体系的名词解释

微粒分散体系的名词解释微粒分散体系是指由微小颗粒组成的分散相和连续相共同构成的体系。
其中,分散相是指微粒以颗粒形式存在于连续相中,而连续相是指微粒所处的环境。
微粒分散体系存在于我们日常生活中的许多物质中,如悬浮液、乳液、凝胶等。
本文将从不同的方面探讨微粒分散体系的特点、应用以及其在科学研究中的价值。
一、特点与分类微粒分散体系的特点之一是微粒颗粒大小较小,通常在1纳米到1000纳米之间。
这些微粒能够在溶剂中分散,形成均匀分布的体系。
另一个特点是微粒分散体系具有热力学稳定性,指的是微粒能够长时间保持均匀的分布状态,不发生颗粒间的聚集。
微粒分散体系还具有流变学特性,其粘度和流动性取决于微粒颗粒的浓度和大小。
根据微粒和连续相之间的相对疏水性和疏油性,微粒分散体系可分为水/油体系和油/水体系。
水/油体系是指水作为分散相,悬浮于油中;油/水体系则是指油作为分散相,悬浮于水中。
这两种体系在实际应用中具有广泛的用途,如食品加工、药物传递和护肤品制造等。
二、应用领域探索微粒分散体系在药学领域中的应用十分广泛。
例如,药物纳米颗粒通过微粒分散体系可以被更好地传递到病灶部位,提高药物的生物利用度和治疗效果。
此外,微粒分散体系还被用于制备微胶囊,用于控制药物释放速率,延长药物的作用时间。
在食品工业中,微粒分散体系被广泛应用于乳制品和饮料的制造。
通过微粒分散体系,可以使食品呈现出更好的稳定性和均匀性。
例如,乳液体系通过分散脂肪颗粒在水中,使牛奶具有稳定的乳浊液状态,并且能够提高食品的质感和口感。
微粒分散体系还在化妆品工业中有重要应用。
许多化妆品如乳霜、化妆水和面膜等都是通过微粒分散体系制备而成。
这些微粒能够在皮肤上形成保护层,改善肌肤质量和外观。
此外,微粒分散体系还广泛应用于防晒霜和抗氧化剂等护肤品的制造中。
三、科学研究的价值微粒分散体系在科学研究中具有重要的价值。
首先,通过对微粒分散体系的研究,可以深入了解微粒颗粒在不同连续相中的行为和性质。
药剂学第四章药物微粒分散体系

第四章药物微粒分散体系一、概念与名词解释1.分散体系2.扩散双电层模型3.DLVO理论4.临界聚沉状态二、判断题(正确的填A,错误的填B)1.药物微粒分散系就是热力学稳定体系,动力学不稳定体系。
( )2.药物微粒分散系就是动力学稳定体系,热力学不稳定体系。
( )3.药物微粒分散系就是热力学不稳定体系,动力学不稳定体系。
( )4.微粒的大小与体内分布无关。
( )5.布朗运动可以提高微粒分散体系的物理稳定性,而重力产生的沉降降低微粒分散体系的稳定性。
( )6.分子热运动产生的布朗运动与重力产生的沉降,两者降低微粒分散体系的稳定性。
( )7.微粒表面具有扩散双电层。
双电层的厚度越大,则相互排斥的作用力就越大,微粒就越稳定。
( )8.微粒表面具有扩散双电层。
双电层的厚度越小,则相互排斥的作用力就越大,微粒就越稳定。
( )9.微粒体系中加入某种电解质使微粒表面的ζ升高,静电排斥力阻碍了微粒之间的碰撞聚集,这个过程称为反絮凝。
( )10.微粒体系中加入某种电解质使微粒表面的ζ升高,静电排斥力阻碍了微粒之间的碰撞聚集,这个过程称为絮凝。
( )11.微粒体系中加入某种电解质,中与微粒表面的电荷,降低双电层的厚度,使微粒间的斥力下降。
( )12.微粒体系中加入某种电解质,中与微粒表面的电荷,降低双电层的厚度,使微粒表面的ζ上升。
( )13.微粒体系中加入某种电解质,中与微粒表面的电荷,降低双电层的厚度,使微粒表面的ζ降低,会出现反絮凝现象。
( )14.微粒体系中加入某种电解质,中与微粒表面的电荷,降低双电层的厚度,使微粒间的斥力下降,出现絮凝状态。
加入的电解质叫絮凝剂。
( )15.絮凝剂就是使微粒表面的ζ降低到引力稍大于排斥力,引起微粒分散体系中的微粒形成絮凝状态的电解质。
( )16.絮凝剂就是使微粒表面的ζ升高,使排斥力大于吸引力,引起微粒分散体系中的微粒形成絮凝状态的电解质。
( )17.反絮凝剂就是使微粒表面的ζ升高,使到排斥力大于吸引力,引起微粒分散体系中的微粒形成絮凝状态的电解质。
药剂学第四章药物微粒分散体系

第四章药物微粒分散体系一、概念与名词解释1.分散体系2.扩散双电层模型3.DLVO理论4.临界聚沉状态二、判断题(正确得填A,错误得填B)1.药物微粒分散系就是热力学稳定体系,动力学不稳定体系。
( )2.药物微粒分散系就是动力学稳定体系,热力学不稳定体系。
( )3.药物微粒分散系就是热力学不稳定体系,动力学不稳定体系。
( )4.微粒得大小与体内分布无关。
( )5.布朗运动可以提高微粒分散体系得物理稳定性,而重力产生得沉降降低微粒分散体系得稳定性。
( )6.分子热运动产生得布朗运动与重力产生得沉降,两者降低微粒分散体系得稳定性。
( ) 7.微粒表面具有扩散双电层。
双电层得厚度越大,则相互排斥得作用力就越大,微粒就越稳定。
( )8.微粒表面具有扩散双电层。
双电层得厚度越小,则相互排斥得作用力就越大,微粒就越稳定。
( )9.微粒体系中加入某种电解质使微粒表面得ζ升高,静电排斥力阻碍了微粒之间得碰撞聚集,这个过程称为反絮凝。
( )10.微粒体系中加入某种电解质使微粒表面得ζ升高,静电排斥力阻碍了微粒之间得碰撞聚集,这个过程称为絮凝。
( )11.微粒体系中加入某种电解质,中与微粒表面得电荷,降低双电层得厚度,使微粒间得斥力下降。
( )12.微粒体系中加入某种电解质,中与微粒表面得电荷,降低双电层得厚度,使微粒表面得ζ上升。
( )13.微粒体系中加入某种电解质,中与微粒表面得电荷,降低双电层得厚度,使微粒表面得ζ降低,会出现反絮凝现象。
( )14.微粒体系中加入某种电解质,中与微粒表面得电荷,降低双电层得厚度,使微粒间得斥力下降,出现絮凝状态。
加入得电解质叫絮凝剂。
( )15.絮凝剂就是使微粒表面得ζ降低到引力稍大于排斥力,引起微粒分散体系中得微粒形成絮凝状态得电解质。
( )16.絮凝剂就是使微粒表面得ζ升高,使排斥力大于吸引力,引起微粒分散体系中得微粒形成絮凝状态得电解质。
( )17.反絮凝剂就是使微粒表面得ζ升高,使到排斥力大于吸引力,引起微粒分散体系中得微粒形成絮凝状态得电解质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、微粒的动力学性质 (一)Brown运动 微粒作布朗运动时的平均位移△可用布朗运动方程表示:
RTt
(4-3)
L3 r
t—时间;T—系统热力学温度; η—介质黏度 r—微粒半径;L—阿伏伽德罗常数 小的微粒在动力学上是稳定体系。
r愈小,介质粘度愈小,温度愈高,粒子的平均位移愈大, 布朗运动愈明显。
三、特殊性能:
1、分散相与分散介质之间存在着相界面, 会出现大量的表面现象;
2、具有较高的表面自由能是热力学不稳 定体系。
3、粒径更小的分散体系还具有明显的布 朗运动、丁铎尔现象等。
四、在药剂学中的重要意义
1、有助于提高药物的溶解速度及溶解度, 有
利于提高难溶性药物的生物利用度
场作用下可呈曲线运动,翻越障碍进入检测器, 使表面凸凹的各个部分都能清晰成像。
二次电子和背景散射电子共同用于扫描电镜 (SEM)的成像。
微球表面形态
Scanning electron micrography of ADM-GMS
微球橙红色,形态圆整、均匀,微球表面可见孔 隙,部分微球表面有药物或载体材料结晶。
1.电子显微镜法
测定原理:电子束射到样品上,如果能量足够 大就能穿过样品而无相互作用,形成透射电子, 用于透射电镜(TEM)的成像和衍射;
当入射电子穿透到离核很近的地方被反射,而 没有能量损失,则在任何方向都有散射,即形
成背景散射;
如果入射电子撞击样品表面原子外层电子,把
它激发出来,就形成低能量的二次电子,在电
注射用水 加至 1000ml 分散介质
二、分类
分散体系按分散相粒子的直径大小可分为 小分子真溶液(直径<1nm)、胶体分散体 系(直径在1~ 100nm )粗分散体系(直径 > 100nm)。将微粒直径在1nm~ 100μm范 围的分散相统称为微粒,由微粒构成的分 散体系则统称为微粒分散体系。
由上式,散射光强度与粒子体积V的平方成正比, 利用这一特性可测定粒子大小及分布。
第二节 微粒分散体系的性质和特点
一、微粒分散体系的热力学性质
微粒分散体系是典型的多相分散体系。随着:
σ △G = △A
(4-2)
σ—表面张力; △A—表面积的增加。对于 常见的不溶性微粒的水分散体系,σ为正值,而 且数值也比较大。
2.激光散射法
对于溶液,散射光强度、散射角大小与溶液的性 质、溶质分子量、分子尺寸及分子形态、入射光 的波长等有关,对于直径很小的微粒,瑞利散射 公式:
24 3V 2
I I0 4
n2 n02 n2 2n02
2
(4-1)
In-0-散分射散光介强质度折;射I率0-;入λ射-光入的射光强波度长;;n V--分单散个相粒折子射体率积;; υ-单位体积溶液中粒子数目。
Brown运动的位移与扩散系数之间的关系:
2Dt
上述两公式综合可得:
(4-5)
D RT 1
(4-6)
L 6r
可见粒子的扩散能力和粒子的大小成反比,粒径越大,扩散 能力越弱
半透膜两侧分别放入溶液和纯溶剂,这时纯溶剂侧 的溶剂分子通过半透膜的扩散到溶液侧,这种现象 称为渗透。如果没有半透膜,溶质分子将从高浓度 向低浓度方向扩散。胶体粒子比溶剂分子大得多, 不能通过半透膜,因此在溶胶和纯溶剂之间会产生 渗透压,渗透压的大小可用稀溶液的渗透压公式计 算:
Π=cRT
(4-7)
式中,Π—渗透压,c—溶胶的浓度,R—气体常数,
静脉注射、腹腔注射0.1~3.0m的微粒能
很快被单核吞噬细胞系统吞噬,浓集于巨噬
细胞丰富的肝脏和脾脏等部位。
人肺毛细血管直径为2m,>2m的粒子被 肺毛细血管滞留下来,<2m的微粒则通过 肺而到达肝、脾等部位。 。
注射>50m的微粒,可使微粒分别被截留 在肠、肾等相应部位。
第二节 微粒分散系的主要性质与特点
第一节
一、概念
概述
分散体系(disperse system):是一种或几种物
质高度分散在某种介质中形成的体系。被分散 的物质称为分散相,而连续的介质称为分散介 质。
异丙酚纳米乳
异丙酚
10g
1,2丙二醇 50ml
精制大豆油 10g
分散相
注射用磷脂 20g
牛璜胆酸钠 14g
(二)扩散与渗透压
作为Brown运动的结果,胶体质点可自发地从高浓度 区域向低浓度区域扩散。扩散速率遵从Fick第一定律:
dm DA dC
dt
dx
(4-4)
式中, dm —扩散速度;dC —胶体分散系的浓度
梯
dt
dx
度;D—扩散系数;A—扩散界面S的面积。负号表示扩
散方向与浓度梯度的方向相反。
本节主要分析讨论与其粒径大小和物理稳 定性有关的性质。
一、微粒大小与测定方法
微粒大小完全均一的体系称为单分散体系; 微粒大小不均一的体系称为多分散体系; 微粒分散系中常用的粒径表示方法有几何学
粒径、比表面积径等。
1、电子显微镜法 其里面的TEM法较常用。 2、激光散射法 此种方法现今也十分常用
2、利于提高药物微粒在分散介质中的分散 性与稳定性
3、具有不同大小的微粒分散体系在体内分 布上具有一定的选择性,如一定大小的微 粒给药后容易被单核吞噬细胞系统吞噬
4、微囊、微球具有缓释作用,减少剂量, 降低毒副作用
5、改善药物在体内外的稳定性等
微粒大小与体内分布
<50nm的微粒能够穿透肝脏内皮,通过毛 细血管末梢或淋巴传递进入骨髓组织。
二、微粒分散系的动力学性质
微粒分散体系的动力学稳定性主要表现 在两个方面。
当微粒较小时,主要是分子热运动产
生的布朗运动;提高微粒分散体系的
物理稳定性
当微粒较大时,主要是重力作用产生
的沉降。降低微粒分散体系的物理稳
定性
布朗运动:粒子永不停息的无规则的直线运动
布朗运动是粒子在每一瞬间受介质分子碰撞的 合力方向不断改变的结果。由于胶粒不停运动, 从其周围分子不断获得动能,从而可抗衡重力 作用而不发生聚沉。
