胃肠道肿瘤病人营养支持_洪铮
关于胃肠道恶性肿瘤患者围手术期营养支持的观点

肠 外 营养 ( N) 初又称 之 为外科 营养 ,0世 纪 5 P 最 2 0年 代 起 由法 国外 国医师 A bna uai c开始 应 用于 临床 ,9 8年 , 16 美 国学 者威 尔莫尔 等人报 告 了婴儿 临床应用 P N的成功经 验, 证实 了其临 床有效 性 , 引起 全世界 的重视 。7 0年代初 ,
此 通过 术后 早 期肠 内营养 为 患者 的康 复 提供 了 足够 的 营 养, 可减少 术后 并发症 并促 进患 者 的术 后创 伤性 恢复 。喻 祖胜 E等 通过 对 6 2组贲 门癌 病人 随机分 为 E N组 和 P 组 N
进行 比较 ,结果 发 现无 论是 病 人主 诉 和术 后并 发症 的发
作者 单 位 : 10 1 广 东 汕头 汕 头大 学 医学 院 第 一 附属 医 554
院 胃肠外 科
生 率 等 临 床 观 察 指 标 , 是 营 养 指 标 , N组 均 优 于 P : 李威
E m i 1 m i m d a . m c — a : a @ e m ic . lw l lo n
有维 护 肠黏 膜屏 障 的效果 , 供给 的营养 量过 多 , 且 机体 并 不 能加 以代谢 、 利用 。故有 人提 出低热 量供 给 的理念 ,按
8 .8 146k ( 0— 2k  ̄) ( g d 给 予 。经 一 段 时 间 的 36 ~ 0 . J2 5c / k ・ )
实 践 . 现低 热量 营养 供 给 的时 间稍 长后 , 产生 的负平 发 所 衡 将 增 加并 发症 的发 生率 [4, “ 营养 支 持 . 选 肠 3 ]故 全 - 首 内 , 要时肠 内肠外 营养联 合应用 ” 必 的观点逐 渐被接 受 。 杨 祖安 研 究表 明 , 胃肠肿瘤 患 者术后 早期应 用 肠 内营养 在
肿瘤患者营养状况评估与营养支持措施

肿瘤患者营养状况评估与营养支持措施在与肿瘤抗争的漫长道路上,患者的营养状况至关重要。
良好的营养支持不仅有助于提高患者的生活质量,还能增强其对治疗的耐受性和康复的可能性。
因此,对肿瘤患者进行准确的营养状况评估,并采取相应的营养支持措施,是肿瘤综合治疗中不可或缺的环节。
肿瘤本身以及肿瘤治疗过程都会对患者的营养状况产生显著影响。
肿瘤细胞的快速增殖消耗了大量的营养物质,同时可能引起机体代谢紊乱。
治疗手段如手术、放疗、化疗等,也常常导致患者出现食欲减退、恶心呕吐、口腔黏膜炎、味觉改变等不良反应,进一步影响其营养摄入和吸收。
为了全面评估肿瘤患者的营养状况,通常需要综合考虑多个方面的因素。
首先是患者的体重变化,包括近期体重的下降程度以及体重指数(BMI)。
体重短期内显著下降往往提示营养不良的风险增加。
其次,要评估患者的饮食摄入情况,包括食物的种类、摄入量以及饮食模式。
此外,还需关注患者的身体功能状态,如体力活动水平、肌肉力量等。
实验室检查指标如白蛋白、前白蛋白、血红蛋白、总淋巴细胞计数等,也能反映患者的营养状况。
主观全面评定法(SGA)和患者主观整体评估法(PGSGA)是常用的综合评估工具,它们结合了上述多个方面的信息,对患者的营养状况进行较为全面和准确的判断。
对于营养状况良好的肿瘤患者,预防营养不良的发生同样重要。
这包括提供营养教育,指导患者保持均衡的饮食,摄入足够的蛋白质、碳水化合物、脂肪、维生素和矿物质。
鼓励患者适量运动,有助于维持肌肉质量和身体功能。
对于存在营养风险或已经出现营养不良的患者,则需要及时采取营养支持措施。
营养支持的方式主要包括肠内营养和肠外营养。
肠内营养是指通过胃肠道途径为患者提供营养物质,包括口服营养补充剂、管饲营养等。
如果患者的胃肠道功能基本正常,肠内营养通常是首选的营养支持方式。
口服营养补充剂方便易行,适合能够正常进食但摄入量不足的患者。
管饲营养则适用于无法正常经口进食的患者,可通过鼻胃管、鼻肠管或经皮内镜下胃造瘘(PEG)等途径进行。
胃肠道肿瘤患者术后肠内外营养支持的临床对照研究

t e s t i n a l c a r c i n o ma ,a n d p r o v i d e t h e t r u e a n d r e l i a b l e e v i d e n c e f o r c l i n i c a l d e c i s i o n - ma k i n g .M e t h o d s : Th e d a t a o f 4 4 p a —
d i f f e r e n c e b e t we e n t WO g ou r p s ( P< O . O 1 o r P< O . 0 5 ) . Th e p o s t o p e r a t i v e f l a t u s ,d e f e e a t i o n t i me ,t o t a l h o s p i t a l c o s t s i n
中 图分 类 号 : R5 8 7 . 1 文献标识码 : A 文章编号 : 1 0 0 1 — 7 5 8 5 ( 2 0 1 4 ) 1 7 — 2 2 5 0 — 0 3
C o mp a r a t i v e S t u d y o f Ea r l y P o s t o p e r a t i v e En t e r a l Nu t r i t i o n a n d Pa r e n t e r a l Nu t r i t i o n S u p p o r t i n P a t i e n t s wi t h G ̄t mi n t e s - i f n a l Ca r c i n o ma
t o t a l s e r u m p r o t e i n, l e v e l s o f s e r u m a l b m i u n i n E N g r o u p d e c r e a s e d l e s s t h a n t h a t i n P N g r o u p ,t h e r e wa s s i g n i f i c a n t
营养支持在胃肠道肿瘤手术后患者中的应用

营养支持在胃肠道肿瘤手术后患者中的应用摘要:目的:探讨有效的营养支持策略在胃肠道肿瘤手术后患者中的作用。
方法:回顾性分析院2016年1月-2016年12月来院诊治的胃肠道肿瘤患者临床资料,依据营养支持策略的不同分为对照组与观察组,对照组41例患者术后接受常规营养支持;观察组 43例患者接受有效营养支持。
比较两组患者首次排便时间、首次排气时间,血清蛋白情况及不良事件发生情况。
结果:观察组患者首次排便时间、首次排气时间均优于对照组(P<0.05);经治疗两组患者血清蛋白情况与治疗前相比有差异(P<0.05),观察组患者血清蛋白情况明显好于对照组(P<0.05);观察组患者不良事件发生率显著低于对照组(P<0.05)。
结论:有效营养支持在胃肠道肿瘤手术后患者中作用切确,值得应用。
关键词:营养支持;胃肠道肿瘤;血清蛋白胃肠道肿瘤属于临床常见病症,恶化几率较大,术后易出现营养不良、肠道不适、肠胃功能絮乱等症状,严重影响患者术后康复进程。
营养支持是临床护理常用措施,适用大多数手术患者,及时、有效的营养支持可改善患者身体机能,提高患者免疫力有积极作用[1]。
因此,本文选取我院2016年1月-2016年12月来院诊治胃肠道肿瘤患者术后给予有效营养支持,作用理想,现汇报如下。
1资料与方法1.1一般资料回顾性分析我院2016年1月-2016年12月来院诊治的胃肠道肿瘤患者临床资料,剔除与不符合研究条件的患者,有84例患者参与本次研究;依据营养支持措施的不同分为对照组及观察组,其中41例患者术后接受常规营养支持,为对照组;另43例患者接受有效营养支持,为观察组。
对照组患者中男21例,女20例,年龄15~56岁,平均年龄(45.57±5.48)岁;类型:胃癌14例,直肠癌19例,小肠肿瘤8例。
对照组患者中男21例,女22例,年龄15~57岁,平均年龄(45.54±5.17)岁;类型:胃癌18例,直肠癌20例,小肠肿瘤6例。
胃肠道肿瘤患者术后营养支持的研究

胃肠道肿瘤患者术后营养支持的研究摘要】目的观察胃肠道肿瘤患者术后营养支持对术后并发症的影响。
方法8例胃肠道肿瘤患者随机均分为肠内营养(EN)支持组、全胃肠外营养(TPN)支持组及对照组。
结果术后患者肛门排气的恢复时间:对照组、EN组及TNP组分别为(80.3±19.5)h、(55.7±10.2)h和(73.6±22.1)h,EN及TNP组肛门排气的恢复时间均较对照组显著降低(P<0.05);EN组及TNP组术后并发症发生率分别为0.0%、33.3%,均较对照组(50.0%)显著降低(P均<0.05);术后住院天数也较对照组有所减少,具有显著性差异(P<0.05)。
结论对胃肠道肿瘤患者进行围手术期营养支持可降低并发症的发生率,缩短其住院天数,节省患者的治疗成本。
【关键词】胃肠道肿瘤患者营养支持围手术期【中图分类号】R459.3 【文献标识码】A 【文章编号】2095-1752(2013)14-0188-02胃肠道肿瘤患者大多存在蛋白质-热卡平衡失调的状况,并且常伴有不同程度营养不良,术后感染性并发症与病死率较高[1]。
文献报道[2]对胃肠道肿瘤患者术后进行早期的营养支持可促进伤口愈合、提高患者自身免疫力、减少感染性并发症的发生。
本研究通过对胃肠道肿瘤患者实施术后肠内营养(enteral nutrition,EN)或全胃肠外营养(total parenteral nutrition,TPN)支持,均可显著降低术后并发症的发生,现报道如下。
1 资料与方法1.1 临床资料选取2011年8月至2012年11月收治的8例胃肠道肿瘤患者,其中男5例,女3例;年龄37~82岁,平均年龄48±10.5岁。
所选的8例患者在我院肿瘤科住院期间均行根治性肿瘤切除手术,均无心脑血管疾病、肝、肾功能异常等疾患。
所有患者随机均分为对照组、EN组、TPN组,EN组、TPN组各3例,对照组2例。
胃肠道肿瘤术后早期肠内营养支持效果观察

e e a nt r lnutiin i hepa int nd g ng ga toi e tna u oro r to a m ant i ut ii a t t , o ot s r n e tn 1 rto n t te s u er oi s r nt s i 1t m pe a in c n i an n rton lsa e pr m ega toit s ia f nc i a e ov r I Sa s f nd e fc i e nu rto 1s pp t me h . u ton 1r c e y. ti a e a fe tv t ii na u or t od Ke r : nt r 1nu rto y wo ds e e a t iin;ga toi e tna u or nu rto up r s r nt s i 1t m ; t iin s po t
维普资讯
重庆 医 学 2 0 08年 5月 第 3 卷 第 1 7 O期
1 77 O
・
临床 研 究 ・
胃肠 道肿 瘤 术 后 早 期 肠 内营 养支 持效 果观 察
杨 祖 安
( 庆 市肿瘤 研 究所 营养 科 重
4 0 3) 0 0 0
ቤተ መጻሕፍቲ ባይዱ
摘 要 : 目的 探 讨 胃肠 肿 瘤 术 后 早 期 应 用肠 内营 养 支持 对 患者 营 养状 况及 胃肠 功 能 恢 复 的 临 床 效 果 。方 法 选 择 2 O例 胃 肠肿 瘤 患 者 手 术后 通 过 鼻 肠 管 实施 早 期 E 支 持 治 疗 , 定 患 者 入 院 时 与 E 开 始 进 行 后 第 8天 的 钾 、 、 糖 、 素 氮 和谷 丙转 N 测 N 钠 血 尿 氨 酶 等 各 项 生 化 指 标 及 血 清 总蛋 白 、 清 清 蛋 白 、 红 蛋 白等 多 项 营 养 指 标 , 察 术 后 胃肠 功 能 恢 复 时 间 以及 肠 内 营养 支持 并 发 血 血 观 症 等 。 结 果 E 支持 前 后 患 者 的 钾 、 、 糖 、 素 氮 和谷 丙 转 氨 酶 等 各 项 生化 指 标 差 异 均 无 统 计 学 意 义 , 时 患 者 的 总 蛋 白 、 N 钠 血 尿 同 清蛋 白以及 血 红 蛋 白等 也保 持 在 一 个较 为 稳 定 的 水 平 , 生 腹 泻 和 腹 胀 率 分 别 有 1 和 5 。结 论 胃肠 肿 瘤 术 后 早 期 应 用 肠 发 O 内营 养 支持 , 以有 效 维持 患 者 的 营 养 状 况 , 进 胃肠 功 能恢 复 , 临床 胃肠 肿 瘤 术后 安 全 、 效 的 营 养 支持 方 法 。 可 促 是 有
肿瘤病人营养支持治疗指南的解读

肿瘤病人营养支持治疗指南的解读一、营养不良对肿瘤病人的危害营养不良严重影响肿瘤病人的生活质量及体能状态,它也常常是导致肿瘤病人死亡原因之一。
恶性肿瘤病人中营养不良发生率高,营养不良显著地危害着病人的生存及生活质量,因此,针对肿瘤病人进行营养支持的研究及临床应用具有重要的现实意义。
肿瘤营养学是应用营养学的方法和理论,进行肿瘤预防及治疗的一门新学科[1]。
营养不良降低肿瘤治疗的有效性,增加化、放疗的毒副作用,降低病人的生活质量,缩短肿瘤病人的生存时间。
肿瘤病人发生营养不良的发生是多方面的,运用肠内和肠外营养以及免疫代谢调节的方法,有望为临床肿瘤病人的治疗开创新的途径和方法。
目前,欧美国家也正逐渐加大对肿瘤营养学研究的投入,以期在肿瘤综合治疗中发挥营养支持和治疗的重要作用二、肿瘤营养支持治疗的应用指南2009年ASPEN发布了临床肿瘤病人营养支持治疗的新指南[2],重点是再次强调了营养支持治疗在肿瘤病人综合治疗中的重要性。
指南重点:1、无证据表明营养支持会促进肿瘤生长。
虽然理论上有担心营养支持可能促进肿瘤的生长,但多年来的临床实践没有证据显示营养支持促进了肿瘤生长。
虽然目前也没有明确的证据表明预防性地使用营养支持可以延长肿瘤病人的生存时间,但有证据表明针对营养不良的肿瘤病人积极地开展营养支持,可以减少并发症,改善生活质量。
1.营养良好的手术病人不需要常规使用营养支持,无论肠外或肠内营养支持都没有显示出比标准口服进食更好的优越性。
2.但对于中度或重度营养不良的手术病人,术前进行7-14d的营养支持是有益的,但需要评估营养支持与延迟手术之间的利弊。
3.营养支持不应作为营养良好病人进行化疗时常规的辅助手段。
4.营养支持也不应作为营养良好的头颈部、腹部或盆腔放疗病人的常规辅助手段。
5.营养不良与长期不能进食或营养吸收不够的病人,进行积极抗癌治疗时适宜给予营养支持。
6.在姑息支持终末期的肿瘤病人中,通常很少使用营养支持。
胃肠道肿瘤患者术后不同营养支持的预后效果

胃肠道肿瘤患者术后不同营养支持的预后效果摘要:目的:探讨围手术期中不同营养支持在胃肠道肿瘤患者的应用价值。
方法:选取医院收治的50例胃肠道肿瘤患者,并随机将其分为观察组和对照组。
观察组实施肠内营养支持;对照组行肠外营养支持。
利用仪器,观察两组患者的康复指标,并观察其效果。
结果:观察组各项指标均优于对照组,差异有统计学意义(P<0.05)。
结论:肠内营养在胃肠道肿瘤患者围手术期中,应用价值和显效价值较好,值得在临床上大力推广。
关键词:营养支持;胃肠道肿瘤;围手术期胃肠道肿瘤是临床常见的消化系统病变,近年来,随着人们饮食结构的变化及生态环境影响,胃肠道肿瘤的发病率呈上升趋势。
大多数患者会出现一定程度的贫血、营养不良等问题,有调查报道,胃肠道癌症患者的营养不良发生率达到40%以上,胃癌更为明显。
由于根治术的创伤性、应激性会导致机体进入高分解、高代谢状态,而胃肠道功能存在一定损伤,不能更好消化和吸收营养,使手术危险性增大。
现阶段,国内外临床上均对肠内营养给予高度重视,只要胃肠道功能仍然存在,那么就需要做好肠内营养。
但临床研究表明,胃肠道肿瘤患者在根治术后早期进行肠内营养有助于肠道蠕动恢复,即便提供少量低热量膳食也有积极效用。
原因可能是早期实施肠内营养支持,可实现良好的局部营养效用,可有效促进肠道黏膜上皮细胞的生长,使胃肠激素得以有效分泌,进而使胃肠道功能得以恢复,同时还能早期拔掉胃管,预防和减少切口感染等发生。
基于此,为确保肠胃道肿瘤患者手术安全性和有效性,对患者行不同的营养支持手段可以降低患者因营养缺失造成的风险,同时必须做好围手术期营养支持。
本文主要对我院收治的胃肠道肿瘤患者围术期营养支持情况进行回顾分析,探讨不同营养支持方法的临床效果,报告如下。
1资料与方法1.1一般资料选取医院2019年1月-2021年12月收治的50例确诊为胃肠道肿瘤患者,随机分为观察组和对照组,观察组26例,男10例,女16例,平均年龄(62.33±11.22)岁,平均病程5年;对照组24例,男14例,女10例,平均年龄(63.26±10.55)岁,平均病程10年,两组患者年龄、性别、平均病程等比较差异无统计学意义(P>0.05),具可比性。
胃肠道肿瘤患者围手术期营养支持的临床研究-1735-2020年华医网继续教育答案

2020年华医网继续教育答案-1735-胃肠道肿瘤患者围手术期营养支持的临床研究备注:红色选项或后方标记“[正确答案]”为正确选项(一)肠内营养支持的安全管理1、肠内营养制剂开盖后即使冷藏,超过()小时也不可使用A、24[正确答案]B、12C、6D、102、肠内营养支持的管道护理,要求定期冲洗管道,连续输注营养液时,应每()小时用温水冲洗喂养管1次A、6-12B、12-24C、4-6[正确答案]D、24-363、以下对经肠内营养管路给药的认识,错误的是()A、不能直接向肠内营养制剂中添加药物B、可以将所有药物混在一起[正确答案]C、给药前需稀释药物D、不能将所有药物混在一起4、肠内营养用法,最全面的是()A、间断泵喂养法、连续泵喂养B、推注法C、重力滴注法D、以上均是[正确答案]5、肠内营养制剂的污染问题,认识错误的是()A、在清洁区域采用无菌技术准备肠内营养B、配液过程中需要佩戴无菌手套C、密闭系统48小时更换1次D、尽量使用粉状制剂而非液态制剂[正确答案]6、持续胃肠泵输注的缺点是()A、活动时间少[正确答案]B、并发症较多C、操作复杂D、营养吸收不良7、()是最好的肠内营养治疗输注方式A、持续胃肠泵输注[正确答案]B、一次性输注C、间歇性重力输注D、推注法8、经鼻胃管行肠内营养前48小时内,每()小时需检查1次胃残留内容物的量A、10B、4[正确答案]C、12D、249、间歇性重力滴注的适应证是()A、危重病人B、空肠造口C、胃造口D、鼻饲喂养[正确答案]10、肠内营养支持的输注护理措施中,错误的是()A、胃内喂养时,病人应取头高30°-45°卧位,定时检查胃残留量,以减少误吸发生率B、肠内营养泵输注导管建议每日要更换C、输注浓度从高到低[正确答案]D、要观察病人有无腹痛、呕吐等症状,病人不能耐受,可减慢输注速度(浓度)或停止输注11、肠内营养支持发生堵管的原因,不包括以下哪项()A、营养液中蛋白质凝固B、注入药物溶解不彻底C、过度摄入高渗性药物[正确答案]D、冲洗管路不及时不正确12、经肠内营养管路给药,给药后一般()min可以重新输注A、10B、30[正确答案]C、5D、15(二)肠内营养支持途径的建立与发展1、经皮内窥镜引导下胃造口术(PEG)为微创操作,其适应证包括()。
胃肠道肿瘤病人营养状况与营养支持分析

1.1 一般资料 选择 2017 年 11 月至 2018 年 12 月到我院接受治疗的
78 例胃肠道肿瘤患者,随机分为 A 组(39 例)与 B 组(39 例)。 A 组中男性与女性例数分别 22 例、17 例,年龄最大 72 岁,最 小 18 岁,平均(42.36±3.04)岁;B 组中男性与女性例数分别 21 例、18 例,年龄最大 74 岁,最小 19 岁,平均(42.37±3.06) 岁。组间资料经统计学对比(P>0.05)。
TSF(mm)
6(15.38) 11(28.21) 4.829 0.028
AC(cm)
5(12.82) 11(28.21) 7.263 0.007
AMC(cm) 7(17.95) 16(41.03) 12.809 0.001
ALB(g/L)
1(2.56) 5(12.82) 7.415 0.006
Hb(g/L)
观察统计治疗后营养不足发生情况以及治疗前后营养状 况,并予以对比分析。
营 养 状 况:BMI(体 重 指 数)、AC(上 臀 围)、ALB(血 清
白蛋白)、TSF(肱三头肌皮皱厚度)、AMC(上臂肌围)、Hb(血 红蛋白)。
营 养 不 足 判 定 标 准:BMI<18.5kg/m2 为 营 养 不 足; ALB<35g/L 为 营 养 不 足;男 性 Hb<120g/L 为 营 养 不 足,女 性 <110g/L 为 营 养 不 足。TSF 正 常 值:男 性 8.3mm,女 性 15.3mm;AC 正常值:男性 27.4cm,女性 25.8cm;AMC 正常值: 男性 25.3cm,女性 23.2cm;同正常值对比,如果低于其 90%, 则为营养不足。 1.4 统计学方法
胃肠道肿瘤患者围手术期营养支持

胃肠道肿瘤患者围手术期营养支持作者:李瑞珍来源:《中国保健营养·中旬刊》2013年第02期【摘要】目的:总结了426例胃肠道肿瘤病人的围手术期营养支持的效果。
方法:回顾性分析我院2010年9月至2012年8月收治的426例胃肠道肿瘤患者围手术期营养支持。
结果:对426例胃肠道肿瘤患者进行有效的心理支持,充分的术前准备,精心的术后护理,增强了病人治疗疾病的信心,减少了术后疼痛、不适和并发症等。
结论:我科收治的426例病人中,术后坚持完成化疗的334例,占78.4%,中途改为其他治疗方法(口服)的78例,占18.3%,放弃治疗的14例,占0.54%。
【关键词】胃肠道肿瘤;围手术期营养支持【中图分类号】R473.73 【文献标识码】A 【文章编号】1004-7484(2013)02-0247-02随着经济社会不断进步,人们饮食文化日益多样化,食品卫生与安全也成了备受关注的热点问题,胃肠道肿瘤病人也日益增多,据统计胃癌占肿瘤发病率第二位,仅次于肺癌。
我国是胃癌的高发区,每年新发现40万胃癌患者,占世界胃癌发病人数的42%,近5年来,19-35岁青年人胃癌发病率比20年前翻了一倍,年均增速超过4%。
面对这样的严峻形势,胃肠道肿瘤患者的疾病治愈、生活质量、营养支持也备受关注。
我科2010年9月至2012年8月共收治胃肠肿瘤患者426例,现对胃肠肿瘤患者围手术期营养支持汇总如下:1 临床资料2010年9月~2012年8月共收治胃肠道肿瘤患者426例,男289例,女137例,年龄最小的29岁,最大的87岁,平均年龄57岁,其中胃癌225例,肠癌201例,保肛的79例,人工肛门的12例,发生严重并发症的2例,均为大出血,2次手术后治愈;发生肠漏的2例,经黎氏管冲洗、换药治愈;术后化疗的365例,完成化疗的334例,中途改为其他治疗方法的78例,放弃治疗的14例。
2 术前营养支持当患者感觉胃肠不适,检查发现患了肿瘤时,对患者和家属都是致命的打击,本来有限的食欲随着诊断的明确会直线下降甚至茶饭不思,日趋严重,体质明显下降、消瘦,影响手术的进行,这时的心理护理和营养支持非常重要。
消化道肿瘤患者术后营养支持治疗观察及护理

21 心理护理 .
肿瘤术后 患者早期经鼻 一肠喂养管应用
能全力进 行肠 内营养 ( N) E 支持可 以维护 胃肠道 黏膜 的完整性
和屏 障功 能 , 少肠 道 细 菌 易 位 … 提 升 血 白蛋 白 的浓 度 也 更 加 减 ,
于 肿瘤 患 者 来 说 表 现 得更 为 突 出 。 此 及 时 纠 正创 伤 后 机 体 营 因 养 不 良 , 高 并 恢 复 患 者 自身 的 免 疫 功 能 是 术 后 治疗 、 理 中 提 护
1 统计学方法 . 5
3组问定量资料 比较 , 在满足方差 齐l l 生
的情况下采用单因素方差分析 检验 ,所有数据分析均应用
13 营养制剂 .
采用能全力 ( 兰 N te 荷 ur i 司产品 ) iu公 作
【 关键词 】消化道肿瘤
早期
肠 内营养
护理
为标准肠内营养 , 1 J(g d , 4l 8 /k ・ )非蛋 白热量 : = 3 1 k 氮 13: . 也 可根据消化功能选择其他肠 内营养制品 , 如百普力 、 瑞素等 。
动 恢 复 时 间 、住 院 时 间 E N 组 均 优 于 DE 组 和 对 照组 : E N 3组 术后 并发 症 比较 无 统 计 学 差异 。 论 消化 道 肿 瘤 患者 术后 进 结
未进行肠 内营养 ( 照 ) 3 对 组 6例 。3组患者一般情况 均具 有可
比性 。
1 营养支持方法及途径 . 2
最 严 重 的并 发 症 是 肺 栓 塞 ,应 避 免 活 动 度 过 大 ,禁 止 按 摩 、 挤 压 、 打 患肢 , 防 止 血 栓 脱 落 , 成 肺 动 脉栓 塞罔 如果 患 者 出 拍 以 造 ,
肿瘤科病人营养支持与饮食指导

肿瘤科病人营养支持与饮食指导在肿瘤科病人的治疗过程中,营养支持与饮食指导起着至关重要的作用。
良好的营养状态不仅有助于增强身体的免疫力,提高治疗效果,还可以缓解副作用,提高生活质量。
本文将从饮食建议、营养调理、饮食注意事项等方面详细介绍肿瘤科病人的营养支持与饮食指导。
一、饮食建议1. 增加能量摄入:由于肿瘤患者身体消耗增加,摄入足够的能量对于维持良好的身体状态至关重要。
建议适量增加高蛋白、高热量的食物摄入,如禽肉、鱼、蛋类、豆制品等,同时合理增加碳水化合物的摄入。
2. 增加蛋白质摄入:肿瘤患者的身体需要更多的蛋白质来维持组织修复与免疫功能。
建议摄入富含优质蛋白的食物,如瘦肉、鱼类、奶制品等。
3. 多摄入维生素与矿物质:维生素和矿物质在肿瘤患者的治疗过程中起着重要的辅助作用。
建议食用新鲜蔬菜、水果、坚果等,以摄取足够的维生素和矿物质。
二、营养调理1. 液体饮食:对于进食困难或消化吸收受限的肿瘤患者,可以采用流质或半流质饮食,如汤、糊状食物、果汁等。
适当增加每天的摄入量,保证足够的营养。
2. 膳食纤维:对于便秘问题较为严重的患者,可以适量增加膳食纤维的摄入,如蔬菜、水果、全谷类等。
同时也要避免高脂、高盐、高糖等食物的摄入。
3. 补充肠道菌群:肿瘤患者往往在治疗过程中会破坏肠道菌群平衡,影响消化吸收功能。
可以适量摄入含益生菌的食物,如酸奶、发酵食品等,以增强肠道功能。
三、饮食注意事项1. 避免生冷食物:肿瘤患者的消化功能较弱,易受凉,建议避免生冷食物的摄入,以免加重不适。
2. 控制草药饮食:某些中草药可能会与药物产生相互作用,患者应避免盲目使用。
3. 避免过烟烤食物:过烟烤食物中含有致癌物质,肿瘤患者应尽量避免食用。
4. 少食多餐:对于有恶心、呕吐等消化问题的患者,可以采用少食多餐的方式,分散摄入量,减轻不适。
5. 合理用药:部分药物可能会影响患者的食欲和口味,患者应遵医嘱用药,不随意停药。
总结:肿瘤科病人的营养支持与饮食指导是重要的治疗辅助手段。
胃肠道肿瘤术后早期营养支持的临床研究
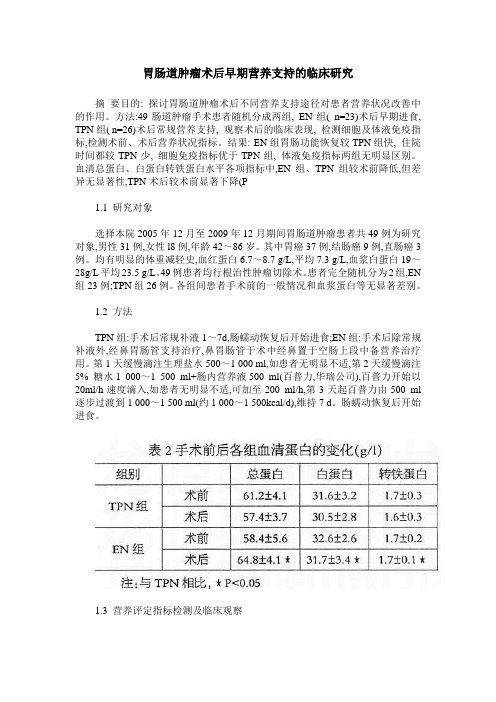
胃肠道肿瘤术后早期营养支持的临床研究摘要目的: 探讨胃肠道肿瘤术后不同营养支持途径对患者营养状况改善中的作用。
方法:49肠道肿瘤手术患者随机分成两组, EN组( n=23)术后早期进食, TPN组( n=26)术后常规营养支持, 观察术后的临床表现, 检测细胞及体液免疫指标,检测术前、术后营养状况指标。
结果: EN组胃肠功能恢复较TPN组快, 住院时间都较TPN少, 细胞免疫指标优于TPN组, 体液免疫指标两组无明显区别。
血清总蛋白、白蛋白转铁蛋白水平各项指标中,EN组、TPN组较术前降低,但差异无显著性,TPN术后较术前显著下降(P1.1 研究对象选择本院2005年12月至2009年12月期间胃肠道肿瘤患者共49例为研究对象,男性31例,女性l8例,年龄42~86岁。
其中胃癌37例,结肠癌9例,直肠癌3例。
均有明显的体重减轻史,血红蛋白6.7~8.7 g/L,平均7.3 g/L,血浆白蛋白19~28g/L平均23.5 g/L。
49例患者均行根治性肿瘤切除术。
患者完全随机分为2组,EN 组23例;TPN组26例。
各组间患者手术前的一般情况和血浆蛋白等无显著差别。
1.2 方法TPN组:手术后常规补液1~7d,肠蠕动恢复后开始进食;EN组:手术后除常规补液外,经鼻胃肠管支持治疗,鼻胃肠管于术中经鼻置于空肠上段中备营养治疗用。
第1天缓慢滴注生理盐水500~1 000 ml,如患者无明显不适,第2天缓慢滴注5% 糖水1 000~1 500 ml+肠内营养液500 ml(百普力,华瑞公司),百普力开始以20ml/h速度滴入,如患者无明显不适,可加至200 ml/h,第3天起百普力由500 ml 逐步过渡到1 000~1 500 ml(约1 000~1 500kcal/d),维持7 d。
肠蠕动恢复后开始进食。
1.3 营养评定指标检测及临床观察术前1天,术后第7天清晨采血检测血红蛋白、总蛋白、白蛋白及转铁蛋白,观察其手术前后的变化。
胃肠道肿瘤患者术后营养状态支持治疗和T细胞亚群的影响作用

胃肠道肿瘤患者术后营养状态支持治疗和T细胞亚群的影响作用发表时间:2012-08-15T14:52:49.577Z 来源:《中外健康文摘》2012年第20期作者:周清发[导读] 总蛋白和前清蛋白水平较手术前降低,差异有统计学意义(P<0.05)。
周清发(沈阳市天桥中医院外科辽宁沈阳 110000)【中图分类号】R735【文献标识码】A【文章编号】1672-5085(2012)20-0166-02 【关键词】肿瘤胃肠道胃肠外营养肠道营养胃肠道恶性肿瘤患者往往都伴有明显的营养不良,容易造成患者脏器功能和免疫功能衰竭,从而增加手术危险性、手术后并发症及病死率[1,2],手术后食物的摄入和消化吸收障碍。
为保证患者围术期营养状况和机体免疫功能,现将肠外、肠内营养支持对胃肠道肿瘤患者营养状况和T细胞亚群的影响报告如下:1 资料和方法1.1资料选择2009年6月至2011年4月沈阳市天桥中医院外科住院,经病理证实并接受择期手术的成年胃肠道肿瘤患者86例。
排除术前重度营养不良,肝肾功能障碍及内分泌、代谢性疾病患者。
所有患者均有明显的体重减轻史;血红蛋白61~92g/L;血浆白蛋白20~28g/L;患者均行根治性肿瘤切除术;按TNM分期,均为Ⅱ、Ⅲ期患者。
采用随机数法分组决定患者给予营养支持或自然进食。
营养支持组43例,其中男28例、女15例,年龄(62.3±12.4)岁;胃癌24例,结肠癌19例。
自然进食组43例,其中男25例、女18例,年龄(61.8±14.0)岁;胃癌22例,结肠癌21例。
患者的手术和治疗均由同一组医生完成,除营养支持方式外,两组患者的年龄、性别比例及其他治疗方面差异均无统计学意义(P>0.05),具有可比性。
1.2方法营养支持组根据患者饮食和全身状况给肠外营养(PN)、肠内营养(EN)或EN联合PN。
单行PN者热量供给为62.76~83.68kJ/(kg·d),氮入量0.15g/(kg·d);EN采用高脂肪、低糖类、含ω-3脂肪酸的营养制剂。
胃肠肿瘤患者术前是否行营养支持治疗对术后恢复的影响

胃肠肿瘤患者术前是否行营养支持治疗对术后恢复的影响郑立锋
【期刊名称】《内蒙古中医药》
【年(卷),期】2012(031)019
【摘要】目的:探讨胃肠肿瘤患者术前是否行营养支持对患者术后恢复的影响.方法:根据营养风险筛查工具2002(NRS2002)进行营养风险筛查,选取2010年1月~2012年2月我院存在营养风险的胃肠道肿瘤患者60名,将其随机分为两组,试验组患者术前7~14天内及术后均采用营养支持法;对照组术前7~14天内给予常规饮食,术后给予营养支持治疗.结果:试验组平均总住院时间、营养支持费用、并发症发生率均小于对照组,且两组间的差异有统计学差异(P<0.05).结论:术前对存在营养风险的消化道肿瘤患者采取营养支持治疗,可以减少患者的平均住院时间,降低患者的平均住院费用,减少患者并发症的发生.
【总页数】2页(P8-9)
【作者】郑立锋
【作者单位】江苏省南京市江北人民医院普外科 210048
【正文语种】中文
【中图分类】R735;R459.3
【相关文献】
1.肠外营养支持治疗对围化疗期晚期胃肠道肿瘤患者营养状况及免疫功能的影响[J], 李竟长;倪秉强;蒋志雄;陈日新;张志红;秦佳宁;朱州
2.快速康复外科理念应用于胃肠肿瘤患者对术后恢复的影响 [J], 陈港心;杜嘉原
3.不同剂量布托啡诺对胃肠肿瘤患者术后恢复的影响 [J], 王瑞祥
4.术后早期运动护理对胃肠道肿瘤患者术后恢复的影响 [J], 魏金凤;李慧君
5.肠内和肠外营养对胃肠道肿瘤患者术后恢复及免疫功能的影响分析 [J], 张自强;李雪梅
因版权原因,仅展示原文概要,查看原文内容请购买。
胃肠道肿瘤病人营养支持

胃肠道肿瘤病人营养支持
洪铮;江志伟;黎介寿
【期刊名称】《肠外与肠内营养》
【年(卷),期】2002(9)4
【摘要】肿瘤是当前常见病之一 ,胃肠道肿瘤病人有多种原因可引起营养不良。
因此有必要对胃肠道肿瘤病人营养不良进行分析、评估 ,以便临床治疗。
有研究表明 ,营养支持是肿瘤综合治疗中不可缺少的一个环节。
【总页数】3页(P238-240)
【关键词】营养支持;胃肠道肿瘤;营养不良;影响因素
【作者】洪铮;江志伟;黎介寿
【作者单位】南京军区南京总医院解放军普通外科研究所,江苏南京,210002
【正文语种】中文
【中图分类】R735;R459.3
【相关文献】
1.浅谈胃肠道恶性肿瘤病人的营养支持 [J], 王林茂;
2.胃肠道肿瘤病人营养状况与营养支持 [J], 覃日清
3.老龄胃肠道恶性肿瘤病人围手术期营养支持的应用效果观察 [J], 王珏;于海东
4.胃肠道恶性肿瘤病人的围手术期营养支持治疗研究 [J], 刘学伟;邢宝成;刘博;严京哲;柴淑梅
5.胃肠道肿瘤病人营养状况与营养支持分析 [J], 蒋晶红
因版权原因,仅展示原文概要,查看原文内容请购买。
胃肠道肿瘤术后肠内外营养支持治疗探讨

胃肠道肿瘤术后肠内外营养支持治疗探讨
邱志泽
【期刊名称】《临床和实验医学杂志》
【年(卷),期】2006(5)6
【摘要】目的探讨胃肠道肿瘤患者术后营养支持的合理途径.方法选取129例胃肠肿瘤术后病人随机分成两组,并给予肠外营养(PN)或PN+肠内营养(EN)进行营养支持.并对支持前后患者的各项营养指标、免疫指标、肝肾功能及并发症情况进行比较.结果在给予PN+EN进行营养支持的84例患者的各项营养指标、免疫指标、肝肾功能及并发症情况均优于单纯给予PN组的病人.结论早期合理给予PN+EN有助于胃肠道肿瘤患者早期的胃肠功能恢复、营养状态的改善及减少并发症的发生.【总页数】2页(P698-699)
【作者】邱志泽
【作者单位】珠海市拱北医院普外科,广东,珠海,519020
【正文语种】中文
【中图分类】R73
【相关文献】
1.2型糖尿病合并胃肠道肿瘤术后肠内外营养支持的疗效观察 [J], 全信保;邹佩钢;杨学军;贾映东;吴建平;刘静
2.应用肠内外营养支持结合功能锻炼治疗胃肠道疾病术后并发肠瘘的疗效及护理干预措施探析 [J], 熊娟
3.早期肠内外营养支持及护理干预对食管癌根治术患者营养状态及胃肠道功能的影
响 [J], 丁叶
4.胃肠道肿瘤患者首次化疗期间肠内外营养支持的效果分析 [J], 林红; 马文丽; 金海平
5.胃肠道肿瘤患者术后肠内外营养支持治疗的临床对照研究 [J], 李媛媛
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第9卷 第4期肠外与肠内营养Vol.9 No.4 2002年10月Parenteral&Enteral N utrition Oct.2002·综 述·胃肠道肿瘤病人营养支持洪 铮综述; 江志伟, 黎介寿审校(南京军区南京总医院解放军普通外科研究所,江苏南京210002)摘要: 肿瘤是当前常见病之一,胃肠道肿瘤病人有多种原因可引起营养不良。
因此有必要对胃肠道肿瘤病人营养不良进行分析、评估,以便临床治疗。
有研究表明,营养支持是肿瘤综合治疗中不可缺少的一个环节。
关键词: 胃肠道肿瘤; 营养不良中图分类号: R735.2,R735.3 文献标识码: A 文章编号: 1007-810X(2002)04-238-03Nutrition support of gastrointestinal tumor patientHONG Zheng reviewing,JIANG Zhi-w ei,LI Jie-shou checking (Resarch Institute of General Surgery,Nanjing G eneral Hospital of Nanjing Com mand,Nanjing 210002,J iangsu,China)A bstract: Gastrointestinal tumo r patients are characterized by malnutrition resulting from various el-ements.So it is necessary to analyze,assess,and treat m alnutrition of patients w ith gastrointestinal tu-mor.Nutrition suppo rt is an indispensable step in tumor therapy.Key words: Gastrointestinal tumors; M aluntrition0 引 言近70%的胃肠道肿瘤病人在其病情发展过程中会发生营养不良,营养不良引起病人器官系统功能(如免疫功能等)不同程度的减退,降低病人对手术、放疗、化疗、生物治疗等的耐受性。
胃肠道肿瘤病人营养不良的发生又比一般肿瘤病人更加早且多见,病人的营养状况受肿瘤综合治疗的影响也更大。
因此,胃肠道肿瘤病人往往更需要一定的营养支持,作者就近年来营养支持在胃肠道肿瘤病人的应用作一综述。
1 胃肠道肿瘤病人营养不良的原因1.1 厌食 厌食是肿瘤病人的常见并发症。
癌痛、心理障碍、药物等均可引起食欲降低。
另外,食欲还受血液内营养素水平、人体营养贮备、肝和胃肠功能状况的影响[1]。
各种因素通过不同机制影响下丘脑,下丘脑是控制饥饿感的中枢,它可协调不同来源的刺激,结果使病人的食欲降低[2,3]。
1.2 胃肠道疾病 胃肠道肿瘤病人常发生肠腔堵塞、肠壁浸润或肠腔外压迫等情况,可以引起胃肠道蠕动障碍,影响食物的消化吸收;食管癌病人的进食减少,还可以引起消化液分泌障碍;胰头癌压迫胆总管胰管开口,胰液、胆汁分泌障碍,食物的消化吸收受到影响;肿瘤本身(如大肠癌)分泌粘液以及引起继发性炎症,使胃肠道蠕动功能紊乱;胃炎、溃疡性结肠炎等病人的消化吸收异常,营养状况也会恶化。
1.3 医源性营养不良 手术、放疗、化疗等治疗对胃肠道肿瘤病人的营养状况有影响,如胃切除常引起铁、维生素B12、叶酸的缺乏,食物摄入减少;肠切除引起肠道消化吸收面积减少;胰腺切除引起胰腺内、外分泌不足;化疗引起严重的胃肠道反应,表现·238·收稿日期: 2002-03-18; 修订日期: 2002-08-05作者简介: 洪 铮(1970-),男,江苏南京人,医学硕士研究生,从事普通外科专业。
DOI:10.16151/j.1007-810x.2002.04.016为恶心呕吐、肠炎等;放疗引起的肠瘘、放射性肠炎等。
1.4 机体能量代谢异常和细胞因子作用 胃肠道肿瘤病人往往有各种能量代谢异常,其具体表现有[4,5]:碳水化合物代谢的改变是糖异生增加,葡萄糖清除和再循环加快,胰岛素抵抗;脂肪代谢表现为脂肪动员增加,血清脂肪廓清速度减慢,脂肪氧化加快,合成减少,血清脂肪水平不稳定升高;蛋白质代谢的改变是肌肉蛋白分解增加,合成减少,全身蛋白质转换加快,肝内蛋白质合成加快。
这些代谢异常均可引起严重的营养不良。
目前认为,细胞因子在肿瘤病人的能量代谢中也扮演了重要的角色[6~10]。
如来源于体内免疫活性细胞的细胞因子IL-1、IL-6、TNF-α、IFN-γ等对代谢有重要影响,TNF-α和IL-1可引起糖、蛋白质、脂肪代谢异常,IL-6和IFN-γ等可引起蛋白质、脂肪代谢异常。
最后,肿瘤细胞分泌于血液循环中的特殊因子,如脂肪动员因子(LMF)和蛋白质动员因子(PMF)在癌性恶病质中的作用也日益得到重视[11]。
1.5 肿瘤消耗 厌食和(或)进食过少等原因引起能量摄入减少,癌组织细胞本身还进行高消耗的能量代谢,即通过Cori循环活跃,使耗能增加。
另外,生长旺盛的肿瘤细胞蛋白质合成增加,从机体摄取的氨基酸增多,肿瘤细胞内氨基酸分解减弱,病人出现血游离氨基酸谱异常。
由于肿瘤细胞消耗大量的谷胺酰胺,而谷胺酰胺主要贮存在肌肉内,使病人体内肌蛋白合成减少。
2 胃肠道肿瘤病人营养状况的评估胃肠道肿瘤病人主要表现为蛋白质-能量缺乏型的营养不良。
营养状况的粗略评估指标是近期体重下降(低于正常标准的10%),全身瘦组织(如肌组织)减少,皮下脂肪减少;进一步的检查是测定血清蛋白(如白蛋白、转铁蛋白、前白蛋白),其中白蛋白是营养评价的一项金指标,转铁蛋白和前白蛋白半衰期短,因而更加敏感;总淋巴细胞计数也是反映病人营养状况的一个指标(表1)。
合理应用上述指标可以基本反映病人的营养状况,以此进行营养状况的评估,为营养支持治疗提供依据[12]。
3 胃肠道肿瘤病人营养支持胃肠道肿瘤病人营养支持的目的是逆转营养不良,减少恶病质发生,减少相关的并发症和死亡率。
这个目标目前只能部分达到,因为胃肠道肿瘤营养不良不是单纯由饥饿引起的,它是由多种原因引起。
表1 营养不良的评估参数T able1 Parame ters of malnutrition analysis指 标正常轻度中度重度体重减轻<5%5%~9%10%白蛋白(g/L)35~5830~3524~30<24转铁蛋白(mg/L)2000~40001500~20001000~1500<1000前白蛋白(mg/L)<50100~15050~100上臂肌围(%)>4035~4030~34<30肱三头肌皮皱厚度(%)>4035~4030~34<30肌酐/身高指数(%)>9081~9060~80<60总淋巴细胞计数(109/L) >2.01.2~200.8~1.2<0.8胃肠道肿瘤病人发生营养不良时,应及早给予营养支持。
当病人的肠道功能能满足机体三分之二的能量和氮的需要时,可以完全经肠内途径给予营养补充,具体方法有经口、鼻饲、胃造口、空肠造口输入。
营养制剂也有多种供可选择,如匀浆膳、整蛋白制剂、多肽制剂、要素膳等。
根据病人胃肠道的适应情况及营养需要加以选择。
在肠内营养不能满足机体能量和氮的需要情况下,可以用肠外营养途径加以补充。
营养支持方案是给予病人25~35kJ/(kg·d)的热量和1~2g/(kg ·d)的氨基酸,脂肪占总热量的30%~50%。
由于肿瘤病人糖代谢明显异常,可以适当提高脂肪占总热量的比例。
临床上还可以用代谢车测定病人三大营养素来计算氮平衡,帮助临床医师了解肿瘤病人代谢的确切情况。
根据代谢车测定的结果,进行个体化的营养支持,效果更加理想。
对胃肠道肿瘤营养不良的病人进行人工营养支持后,许多营养指标改善有限。
这种情况下,人工营养支持比较好的结果只是防止营养不良的进一步发展。
如果病人体重丢失是因进食过少引起的,肿瘤生长又不快时,也许有时间和机会可以看到长期营养支持的效果。
4 不同临床阶段营养支持的应用4.1 围手术期营养支持 围手术期营养支持的效果评价各异。
有研究报道[13]营养不良的肿瘤病人,从术前7~10天的TPN直至术后可以口服进食阶段的营养支持可使病人的营养状况改善,术后早期化疗的耐受性提高。
建议摄入的能量是基础代谢率的1.5倍,热氮比是150∶1。
营养状况良好的病人进行术后早期肠内营养,使用加入免疫营养素如ψ-3PUFA、精氨酸、核苷酸的制剂,比使用标准膳食和静脉营养的病人缩短术后住院时间和降低费用。
也有给这些病人使用谷氨酰胺获益的报道[14]。
·239· 第4期 洪 铮 胃肠道肿瘤病人营养支持4.2 肿瘤放疗、化疗病人的营养支持 胃肠道肿瘤化疗、放疗病人辅助营养支持治疗,目前未见明显的临床效果,在放、化疗前,如病人已有明显营养不良,或者是放疗、化疗会严重影响病人的摄食,预计持续1周以上,可以在化、放疗的同时给病人一定的肠内或肠外营养支持。
4.3 家庭TPN和EN应用 当胃肠道肿瘤病人发生肠梗阻时,TPN或EN是维持生命所必需的。
如果满足以下标准,给进展期肿瘤病人进行家庭TPN 是一种合理的选择,对不能吞咽和慢性肠梗阻的胃肠道肿瘤病人,预计生存期能超过2个月,此类病人营养不良大多是因饥饿而不是由于肿瘤进展引起[13]。
5 新的营养底物可能成为肿瘤病人新的营养底物有谷氨酰胺,精氨酸,ω-3脂肪酸。
谷氨酰胺是肠粘膜细胞的一种必需营养素,可以改善肠粘膜功能状态,临床使用谷氨酰胺有一定效果,且没有资料显示谷氨酰胺会促使人类肿瘤生长,口服谷氨酰胺不会影响化疗药物的效果[16,17]。
含精氨酸、ω-3脂肪酸、核苷酸的EN制剂对胃肠道肿瘤手术病人有利[18,19〗。
如术前开始给予含免疫物质的EN,效果会更加好。
这种效果来源于对感染的预防,而不是逆转病人的恶病质状态。
近来研究表明,进展期胰腺癌病人使用ω-3脂肪酸的营养制剂,可以使病人的体重增加,并使一系列生化指标改善,机制可能是减少了IL-1、TNF的合成。
总之,营养不良往往继发于某种严重疾病,胃肠道肿瘤是其中常见的一种。
胃肠道的恶性疾病和营养不良往往是一种恶性循环,胃肠道肿瘤病人常有不同程度的胃肠功能不全,而胃肠功能不全又使营养摄入减少,进一步使肿瘤病人的全身情况恶化,病人有可能无法接受其他的肿瘤治疗措施。
所以,只要营养支持能为肿瘤病人的综合治疗提供一个机会,能够改善病人的身体状况,就应该进行营养支持。
参考文献:[1] M antovani G.Cachexia and anorexia[J].Support Care Cancer,2000,(6):506-509.[2] Konsman JP,Dantzer R.How the immune and nervous systeminteract during dis ease-associated anorexia[J].Nutrition,2001,17(7-8):664-668.[3] Plate-Salaman CR.Central nervous system mechanis m s con-tributing to the cachexia-anorxeia syndrome[J].Nutrition,2000,16(10):1009-1012.[4] Herber D.M etabolic abnormalities in the cancer patien t[J].Can-cer,1984,55:225.[5] Baracos VE.Regulation of skeletal-muscl e-protein turnover incancer-associated cachexia[J].Nutrition,2000,16(10):1015-1018.[6] M oldawer LL.T he role of cytokines in cancer cachexia[J].JEPN,1992,16:435.[7] Gelin J.The role of endogenous TNF-αand IL-1for experimen-tal tumor progression and the developmen t of cancer cachexia[J].Cancer Res,1991,51:415.[8] Ku rz rock R.The role of cytokines in cancer-related fatigue[J].Cancer,2001,92(6):1684-1688.[9] Schattner A,Tepper R,Steinbock M,et al.TNF-α,interferon-gamma and cell-mediated cytotoxicity in anorexia nervosa,effectof refeeding[J].J Clin Lab Immunol,1990,32(4):183-184. [10] Karayiannakis AJ,Syrigos KN,Polych ronidis A.Serum levelsof tumor necrosis factor-alpha and nutritional status in pancreaticcancer patien ts[J].Antecancer Res,2001,21(2B):1355-1358.[11] Argiles JM,Lopez-Soriano FJ.New mediators in cancer cachexia[J].Nestle Nutr Workshop Ser C l in Perform Programme,2000,4:147-162.[12] 孙 燕主编.内科肿瘤学[M].北京:人民卫生出版社,2001.197.[13] Buzby GP.The veterans affair TPN cooperative study group Pe-rioperative TPN in s u rgical patients[J].New Engl J M ed,1991,324(5):325.[14] Fahr M J.Glutamine enhances immunoregulation of tumorgrow th[J].JPEN,1994,18:471.[15] Cozzaglio L,Bal zola F,Cosentino F.Outcome of cancer patientsreceiving home parenteral nutrition[J].JPEN,1997,21:339. [16] Bozzetti f,Biganzolibl,Gavazzi C.Glutamine supplementation incancer patients receiving chemotherapy[J].Nutrition,1997,13:748.[17] Fahr M J.Glutamine enhance immunoregulation of tumor grow th[J].JPEN,1994,18:471.[18] Kenneth GM.Arginine metabolism in benign and malignant dis-ease of breast and colon[J].Nutrition,1991,7:185.[19] Barber.Cancer cachexia and its treatment with fish-oil s-enrichednutritional s upplementation[J].Nutrition,2001,17(9):751-755.(责任编辑 李风华)·240·肠外与肠内营养 2002年10月 第9卷 。
