第一章-卤化反应习题
第一章 卤化反应20130912

(41%-72%) (95%-98%)
五、不饱和烃的硼氢化-卤解反应
5.1. 烯烃的硼氢化-卤解反应
包括:首先将烯烃进行硼氢化,然后用卤解 反应转化为卤代饱和烃或卤代烯烃,整个反 应过程均是立体和区域选择性的。
HBr
5.2. 炔烃的硼氢化-卤解反应
反应产物的立体化学常随卤化剂和反应条件不同而异。
a
90% ee%>99%
69%
CO2H
少量
三、不饱和烃和次卤酸(酯)、 N-卤代酰胺的反应
1.次卤酸及酯为卤化剂和烯烃的反应
(1)反应通式
次卤酸对烯烃成反应。
如:次卤酸为卤化剂
OH X R4 X OH H2O R1 R2 OH R3 X R4 OH R1 R2 X R3 R4
其中卤化剂均可简单理解为提供卤素
正离子的试剂
亲电加成机理:
桥型卤正离子(1)形式,得对向产物; 开放式碳正离子和卤素负离子的离子对(2)
形式,得相同量的同向产物
三分子协同亲电加成
三分子协同亲电卤加成,主要存在于卤化 氢对烯烃的加成反应过程。 两个卤化氢以不同的亲电和亲核部分与双 键的两个碳原子形成过渡态,然后形成最 后的加成产物。
O HN O N H F
5-氟尿嘧啶
诺氟沙星胶囊
【适应症】:用于泌尿道、呼吸系统、肠道、耳 鼻喉科、妇科、外科和皮肤科等感染性疾病。
Et HN N F O N COOH
诺氟沙星
溴苯那敏片剂
【适应症】:减轻过敏症状,例如过敏性鼻炎 (包括花粉症)、蕁麻疹等。溴苯那敏可减轻 流鼻涕及喷嚏。
第一章 有机化学-卤化反应

X
H
CH3
Cl2 /Fe
例
+
OH H2O 3Br2 OH H2O 2Br2 Br
OH Br
OH Br 2Br2/Bu-NH2 °C -70 OH Br
1molBr2 /CS2 0°C
OH Br
Br OH
OH
Br
Br
OH Br2/CS2 CH3
OH
CH3 Br
OH Br2 CH3
OH Br
CH3
NH2 NBS/DMF
O BrH2C C CH2CH2CH3 (1.5%) +
α-羰基自由基取代
O
O R' C
H C R''' Br2 R''
O
+
Br2
+ 光
O
光
Br C R''' R''
R'
C
2Br OH O + HBr Br
选择性溴化剂
O Br2 Br Br O
副反应
O Br Br
+
O
O Br
+
OH Br Br
Br
O CH3 BuH2C C
Si CH 2
Bu
OSi C C CH3
+
H Br2
-78℃
O BuH2 C C
△
O BuHC C Br
CH2 Br +
CH 3
反应机理
X C C OSi X-X C X C O- Si X C O C + XSi
例
OHC
COOEt ClSi
药物合成习题答案
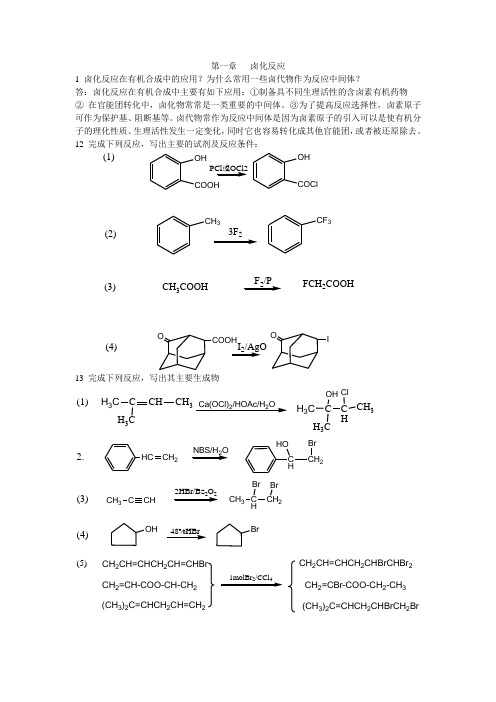
13完成下列反应,写出其主要生成物
第二章烃化反应
一√烃化剂的种类有哪些?进行甲基化和乙基化反应时,应选用那些烃化剂?引入较大烃基时选用那些烃化剂为好?
答:烃化剂种类主要有:卤代烷类;硫酸酯、磺酸酯类;醇、醚类;烯烃类;环氧烷类;重氮甲烷;甲基化和乙基化时选用的烃化剂为:卤代烃RX(R为甲基或乙基,);硫酸二甲酯或硫酸二乙酯,重氮甲烷。引入较大的烃基时选用芳基磺酸酯。
答:KmnO4的氧化能力在酸性条件下最强;中性和碱性条件下氧化能力相当且相对较弱,两者只是使用场合有些不同。KmnO4主要用于烯键的断裂氧化、将醇氧化成醛或酮和将醛氧化成酸。
16完成下列反应(12345)
(1)
(2)
(3)
(4)
(5)
重排反应
完成下列反应,并注明反应名称
1
2
3
4
5
6
3在Backmann重排中常用的催化剂有那几种?
用LiAlH4反应结束后可加入乙醇、无水乙醚或10%氯化胺水溶液以分解未反应的LiAlH4和还原物;NaBH4反应结束后可加稀酸分解还原物并使剩余的NaBH4生成硼酸,便于分离。
七、√完成下列反应
九、√完成下列反应
第三章酰化反应
2.常见的酰化剂有哪些?他们的酰化能力、应用范围、以及使用条件上有何异同点?
答:常见的酰化剂有:羧酸、羧酸酯、酸酐、酰氯、酰胺等。
羧酸的酰化能力较弱,可用于C-酰化、N-酰化和O-酰化,一般需设法活化羧酸以增强羰基的亲电能力。
羧酸酯的酰化能力比羧酸弱,可用于N-酰化和O-酰化反应,一般应在高温下进行反应,且以质子酸、Lewis酸或醇钠进行催化。
相转移催化氢化:指在相转移催化剂的作用下所进行的催化氢化反应。相转移催化剂是指在非均匀相反应中,它能使水相中的反应物转入有机相,从而改变了离子的溶剂化程度,增大离子反应活性,加快反应速率,简化处理手续的一种有机试剂。
1-卤化反应

Cl CM e3
桥式(环状)卤正离子
M e3C C H C Cl CM e2 Me H
反式(anti)加成
M e3C H H CH2 Me C Me
H
重排产物
M e3C
Cl C C
H CH2
Me C Me (40%*) H
过硫酸氢钾(oxone, 2KHSO5· KHSO4· K2SO4)与NaCl或NaBr 反应能迅速产生氯或溴,进而与不饱和键加成。 这种方法可避免直接使用氯或溴
在脂环烯的卤素加成反应中,由于存在邻位取代基等
空间位阻,卤素必然进攻在平面位阻较小的一方而形成桥卤正离 子,然后卤负离子也从环背面进攻有利于碳正离子的部位,生成 反式1,2-双直立键的二卤化物
C1 6H30
Me HO
C16H30
Br2/AcOH AcONa/Et 2O 20-25
o
Me HO Br
C16H30
苯环亲电取代反应的一般模式
+ E+
亲电试剂
E+
p -络合物
+
H E
E
+ H+
-络合物
-络合物的表达方式
H
E + +
H
E
+
H
E
H
+ E
共振式
离域式
反应机理
+ Cl-Cl 快 Cl
+
Cl Cl
- AlCl3
慢
Cl
+
_
H
ClAlCl3
快
+ AlCl3 + HCl
+
Br-Br
快
药物合成考试题及答案

第一章卤化反应试题一.填空题。
(每空2分共20分)1.2Cl和2Br与烯烃加成属于(亲电)(亲电or亲核)加成反应,其过渡态可能有两种形式:①( 桥型卤正离子 )②(开放式碳正离子)2.在醇的氯置换反应中,活性较大的叔醇,苄醇可直接用(浓HCl )或( HCl )气体。
而伯醇常用(LUCas)进行氯置换反应。
3.双键上有苯基取代时,同向加成产物(增多){增多,减少,不变},烯烃与卤素反应以(对向加成)机理为主。
4在卤化氢对烯烃的加成反应中,HI、HBr、HCl活性顺序为(HI>HBr>HCl )烯烃RCH=CH2、CH2=CH2、CH2=CHCl的活性顺序为( RCH=CH2>CH2=CH2>CH2=CHCl )5写出此反应的反应条件-----------------( NBS/CCl hv,4h)Ph3CCH2CH CH2Ph3CCH CHCH2Br5 二.选择题。
(10分)1.下列反应正确的是(B)A. B.C.(CH3)3HCH2CHCl(CH3)3C CHCH3ClD.Ph3C CH CH22CCl4/r,t.48h3CHCBrCH2Br2.下列哪些反应属于SN1亲核取代历程(A)A.(CH3)2CHBr+H2O(CH3)2CHOH+HBrB.CH2I+CH2CNNaCN+NaIC. NH3+CH3CH2I CH3CH3NH4+ID. CH3CH(OH)CHCICH3+CH3CHOCHCH3CH3ONa3.下列说法正确的是(A)A、次卤酸新鲜制备后立即使用.B、次卤酸酯作为卤化剂和双键反应, 在醇中生成卤醇, 在水溶液中生成卤醚.C、次卤酸(酯)为卤化剂的反应符合反马氏规则, 卤素加在双键取代基较多的一端;D、最常用的次卤酸酯: 次氯酸叔丁酯(CH3)3COCl是具有刺激性的浅黄色固体.4.下列方程式书写不正确的是(D)A.RCOOH RCOCl + H3PO3PCl3B.RCOOH RCOCl + SO2 + HClSOCl2C.D.5、N-溴代乙酰胺的简称是(C)A、NSBB、NBAC、NBSD、NCS 三.补充下列反应方程式(40分)1O EtO t-BuOCl / EtOH-55~0℃OEtOClOEt.2.CH3(CH2)2CH2CH=CHCH3NBS / (PhCO)2O24CH3(CH2)2CHCH=CHCH3Br3.4.5.6.7.8.9.10. NHCOOHNHCOOC2H5C2H5OH, H2SO4Br NO2BrHNO3 / H2SO4BrBrC.H2CH2COCH3四.简答题(20分)1.试从反应机理出发解释酮羰基的α-卤代在酸催化下一般只能进行一卤代,而在碱催化时则直接得到α-多卤代产物。
有机工业化学练习参考答案

二、 完成反应方ห้องสมุดไป่ตู้式:
1. CH2 COOH O 2. CH 3COCH2 CH3 Br 2 H+ H CHO 3. (CH 3 )3 SiCl Et 3 N H 3C I 2 / KI / NaHCO3
I O O
CH3 Br
OSi(CH 3) 3
Br 2
CHO Br
4.
Br Cl Cl
COOH + HgO + Br 2 F KF Cl
3.
CH2 OH
+ CH 3CH2 COOH
(CF 3CO) 2O
H2 N
CH 2OCOCH 2CH 3
O 4. H2 C O O R' R COOEt + COOEt H2 N O + O O AlCl3 90o C CO2H + PhNH 2 H2 N O H 3C O 5. R' R O O NH
Br
Br
5. NO 2
NO 2
三、写出下列反应机理:
H 3C 1. H H + Br 2 CH 3 CH 3 H Br H Br CH 3 Br a Br Br 2 H3 C H a Br H3 C H Br CH3 b b Br H H Br CH 3 Br Br H3 C H H CH 3 CH 3 H Br H Br CH 3
1.9-BBN
1.DIBAH
6. LAH
二、完成反应:
LiAlH4
对二甲氨基吡啶 对吡咯烷基吡啶 偶氮二羧酸二乙酯 1-羟基苯并三唑
N O N C N N
N C N
N(CH 3) 2
N
N
N
O O C2 H5 O C N N C O C2 H5
第1章 卤化

注意事项: 1) 氢原子和卤原子的定位符合马尔科夫尼科夫(Mark ovnikov)规则,即氢原子加到含氢原子多的碳原子 上 2) 当烯烃上带有强的吸电性取代基,如-COOH、-CN, -CF3,-N(CH3)3时,使烯烃的电子云向取代基方向 转移,烯烃与卤化氢加成时活性降低,且定位方向 正与马尔科夫尼科夫规则相反 3) 卤化氢的活性次序为:HI > HBr > HCl
+ Ph2C=C-CH2Br Ph 23%
二、不饱和羧酸的卤内酯化反应
• 某些不饱和羧酸的双键上形成环状卤正离子时, 若立体条件许可,亲核性羧酸负离子向其进攻可 生成卤代五元或六元内酯称为卤内酯化反应 (halolactonization)。此反应与烯烃的对向卤加成 历程相似,在碱性条件下是高度立体选择性的。 • 在有机合成上,利用这一方法,可将不饱和羧酸 转化成用其他方法难以制得的内酯
R1 H
C
C
R2 H
NBS/DMSO
Br R1 R2 C C H H Me O S Me
Br R1 H
R2
C
C O SMe2
H
H2O
Br C H R1 C β OH H
R2
Dalton反应 β-溴醇
-消 除 (在 燥 MSO中 干 D )
R2 Br α-溴酮 C R1 C O α H
四、卤化氢对不饱和烃的加成反应
3)位阻的影响 无位阻,机会均等,形成外消旋混合物; 有位阻,在位阻小的一侧形成三元环 例3:
HO ACONa/Et2O Me Br HO Br Me Br2/AcOH HO + Br BrMe
对于刚性环烯,立体选择性主要取决于中间体卤鎓 离子的稳定性
4) 有重排产物生成,生成更稳定的C+离子
药物合成反应习题
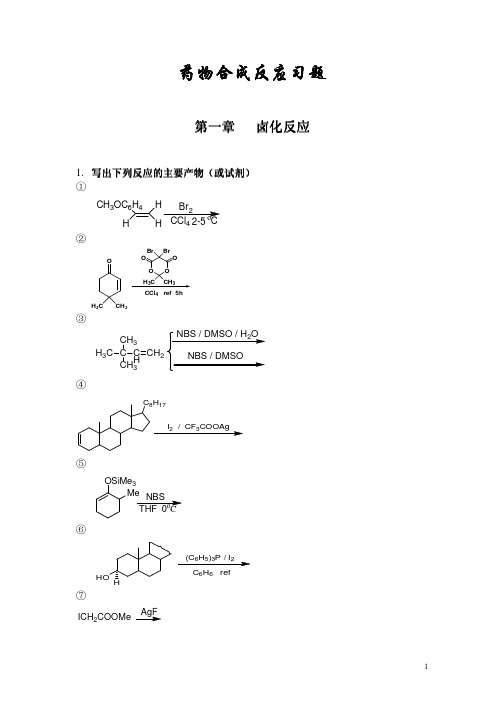
药物合成反应习题药物合成反应习题第一章 卤化反应1. 写出下列反应的主要产物写出下列反应的主要产物((或试剂或试剂))①CH 3OC 6H4HH H4②H 3C CH 3OH 3CCH 3OBr Br CCl 4ref 5h③H 3C C CH 33C H CH2④C 8H 17I 2/CF 3COOAg⑤OSiMe 3Me NBS THF 0οC⑥HOH(C 6H 5)3P /I 2C 6H 6ref⑦ICH 2COOMeAgF⑧OAcOEt 2O /HClBr Br OBr Br⑨COCH 3H 3COCOBr 2 / NaOHH 2O/diox,10°CHCl⑩HB2C CH H I 2NaOCH 3,CH 3OH2.写出下列反应的可能产物①H 3C C CH 3CH 3CH 2OH HBr,100°C②H H 3CCH 3COOCH CCl 4refNBS/(C 6H 5CO)2O 2③H 3C C OH 2C CH 2CH 3Br 2KClO 3H 2O40-50°C④H 3C HHC 2H 5Cl 2,CH 3COOH光照3. 写出下列写出下列反应的主要试剂及条件反应的主要试剂及条件①C(CH 2OH)2Br)4②HOOC(CH 2)4COOHClCO(CH 2)4COCl③PhCH 2COCH 3PhCHCH 2OCH 3Cl ④OCOOHIO第二章 烃化反应1. 完成下列反应①COOCH 3OHOHCH 3I NaOH②OHOHCOCH 3Me 2SO 4K 2CO 3③HC OCH 2H 3C④HNC(CH2)5 O 85-95°Me2SO4⑤ClNO2NO22 95°C⑥CH2(COOC2H5)2C2H5ONa C2H5OH ⑦Br(CH2)5Br+CH2(COOC2H5)2C2H5OH⑧NH2Raney-Ni加热⑨OH3C2.完成下列反应过程①NCCOCH(COOC2H5)225C2H5OHHCl.H2OCH3COOHPy②HC O+CH 3NH2③C 6H 5CH 2NH 22H2/(n-C 4H 9)4HSO4④OCH 3C(CH 3)3C 6H 6ref第三章 酰化反应1.完成下列反应①OCH 3OCH 3H 3CO +CH 3COCl②C O 2NH OH C NHCOCHCl 2HCH 2OH +CH 3(CH 2)16COClN/66③SC N OCH 3COOHClCH 2CONH+N SOCH 2S H 2N N N NNCH 3DCC THF④CH 3CH 3(CH 2)5COClClCH 2CH 2Cl 0°C⑤OCH 3H 3CO H 3COH 3CO OCH3H 3COH 3COH 3COCHO⑥+C 6H 5N CH 3CHOPOCl 3⑦CH 3CO H 2C COOC 2H5+HO2.完成下列合成路线①OHOC 2H 5OC 2H COCl② 以苯和丁二酸酐为起始原料合成四氢萘第四章 缩合反应1. 改错改错((只能改动一处只能改动一处))①Ph 3P +-CHCH3+CHOHCH 3H②CH 3CH 2CH 2COCH 3+CH 3COOC 2H 5C 3H 7H 3C C2H 5③CHO +ClCH 2COOC 2H 5Zn +C 6H 6(C 2H 5)2OH CCHCOOC 2H 52. 完成下列反应式① OCH 3+NO 2CHO -2②OO CHCH 3H 3CHC③ O+CH 2O④C 6H 5CHOC HCCOOH C 2H 5 ⑤O3+⑥+C 6H 5CH 2CNC 6H 5HC CN C OC 2H 5O⑦(C 6H 5)3P C H 2C HCH 2OCH 2CH 2CHOCH 3C 6H 6Br2⑧H 3COOCH 3CO 2CH 3BrCH 2CO 2CH 3Zn+66252H 2O3. 完成下列合成过程 ①CCOOC 2H 5C 2H 5COOC 2H 5②CH 3CH 3H 2C CH 3HC CHOCH 3从甲苯4. 填写下列各部分产物(1)a-甲基丙醛_C 5H 10O23BC 6H 12O4CC 6H 10O3D+EC 9H 17NO 5+PhCH 2OH(2)OCOCH 3(C 2H 5)2CH 2CH 2COCH 3CH 3CH 3ONa CH 3OH C 6H6AKOH CH 3OH/H 2O, ref.H3O +B(3)(4)N HMeCO 2EtMeor DMF/POCl 3第五章 重排反应1.完成下列反应式 (1)OHOHdilute H SO(2)CONH 2H OH HO H H OH HOH 2OH2(3)NC 2H 5CH 3OCH 3C 6H 5Li Et 2O(4)N ClC H Libenzene, heat(5)N CH 2N(CH 3)3CH 3NaNH 2 / NH 3(6)CH 3CH 3OH OH H +- H 2O(7)OCH 3CONH 2OCH 3(8)NC EtOOCo(9)O3CH 3CH 32(10)CH 32+HOCH 2NH 2(11)CH 3C(OEt)3142-147o C, 8days(12)1. HCl-HOAc-Ac O2. H 3O +2HO2.完成下列合成过程 (1)OCHOO COOH OHO(2)OCH 2OH+CH 3OC 2H 5OCH 3CHO(3)CH 3EtOCH 3OCH 3+H 3COOCOHCH 3Claisen RearrangementCOOCH 3EtOHCH 3CH 3EtOCH 3OCH 3Claisen RearrangementCOOCH 3EtCH 3Et2654NaBH 4MeOH第六章氧化反应1.完成下列反应式①CH3NO2CrO3/Ac2O24②CH3③CH3CH3CH3COCl33④HO OH2CHCl3,25°C R⑤OAcOKMnO4BaOH42/K2CO3/35°C⑥CH3NO2 OCH3CrO Cl CS225°C⑦HO CH2OH5523CH2Cl225°C⑨H 3COHOOHRT⑩CCH 3RO⑾H 3C H 3CH HHH25225°C⑿HCOCH3CH COOOHCHCl 3 25°C2. 试以化学式表示实现下列变化的各步反应①1.SOCl 22.NH 3RCO 3H②HO(CH 2)6CH 33CSO 2ClOHC(CH 2)5CH 3OHCHO④OH Bu-tO Bu-tOOBu-t第七章还原反应1、完成下列反应 ① CH 3CH CHCHO②NO 2Pd-C /C 2H 5OH③OOH④CO(CH 2)3BrOCH 3OCH 3Zn-Hg.HCl⑤H 3CCH 3CH 3H B 2H 6⑥OCH 3CH 3OCH 3CH 3CHO⑦ 2PhCH 2C HCH2+⑧O⑨ OO PhH 2 / Pd-C AcOH , HClO 4⑩NH 3COCNHCH 2O2. 改错① COOHCOOEtCH 2OHCOOEt②CH 3CO COOEtZn-Hg HClCH 3CH 2COOEt③C CH 3O C H 3C H C H 3C CH 33C CH 3OHC H 3C H C H 3C CH 3CH 3H3. 完成下列合成题①试由环己醇,氯乙酸,乙醇合成C 10O②试由OOCH 3合成O。
药物合成反应(08级)(卤化)

CH3 CH2 CH2 CH2Br (亲核置换)
三、卤化反应的应用
1、制备具有不同生理活性的含卤素药物。
2、在官能团转换中,卤化物常常是重要的中间体。
3、为提高反应的选择性,卤原子可作为保护基、
阻断基等。
第一节 卤化反应机理
一、电子反应机理(P1-3)
1、亲电反应
(1)亲电加成 ① 桥型卤正离子或离子对的过渡态形式 ② 三分子协同亲电加成 (2)亲电取代
CH3(CH2)4 CH
CH2
NBA/HF/Et 2O
CH3(CH2)4 CHCH2Br F
四、卤化氢对不饱和烃的加成反应 1、卤化氢对烯烃的加成反应 (1)反应通式 生成卤素取代的饱和烃。反应时可采用卤化氢 气体或其饱和有机溶剂,或用浓的卤化氢水溶液, 或用无机碘化物/磷酸等方法。
H C R2 C X R4
(3)卤化试剂(P16)
常用卤化剂为卤素、 N-卤代酰胺(NBS和
NCS)、次卤酸酯等,其中N-卤代酰胺最好,
无芳核取代和羰基α位取代(亲电取代)等副反
应,特别适用于苄位和烯丙位的卤取代。 (4)溶剂(P16) 常用惰性溶剂,如CCl4、CHCl3、苯等。 (5)作用物结构(P13-15)
主要取决于中间体自由基的稳定性。
① 芳烃的卤取代反应
② 羰基α位的卤取代反应
③ 炔烃的卤取代反应
2、亲核反应:亲核取代
二、自由基反应机理(P3-4)
1、自由基加成
2、自由基取代
第二节 不饱和烃的卤加成反应
一、不饱和烃和卤素的加成反应 1、卤素对烯烃的加成反应
(1)反应通式
生成邻二卤化物。其中,氯化和溴化最常用,
氟化和碘化的应用受到限制(P5)。
[医学]药物合成反应第一章卤化反应-0
![[医学]药物合成反应第一章卤化反应-0](https://img.taocdn.com/s3/m/7fc42647b84ae45c3b358cf9.png)
孙丽萍 张灿 孙宏斌 黄文龙 张惠斌
赖宜生
张大永 钱海 柳红
考试科目
药物化学- 有机合成综合
业务课复试参考书目(仅供参考、不作业务课命题依据)
参考书目咨询qq:2233244831
参考书目,编著者及出版者、版本
《药物合成反应》闻韧主编,化学工业出版社,2003年,第二版。 《新编有机合成化学》黄宪等主编,化学工业出版社,2003年,第一版。 《药物化学》(第二版)尤启冬主编,化学工业出版社,2008年。(此参考书目也适用于面试
8
药物合成反应
Organic Reactions for Drug Synthesis
课程教学目的: 本课程的教学目的是使学生在学习有关基础课后(如有机化
学等),能较系统地掌握常见的重要有机药物合成反应、反应 的影响因素、反应的选择性及其实际应用,培养学生在药物合 成中的实际工作能力,并具有发现问题、分析问题和解决问题 的初步能力,为学生学习“药物化学”和“制药工艺学”奠定 基础。
10
学习方法和要求
学习方法: 在学好有机化学的基础上,掌握重要药物合成反应,将官能团
反应性、试剂活性、反应条件之间的关系进行联系、比较,以达 到牢固掌握药物合成的方法及其重要反应。
学习安排: 课堂讲授为主、自学为辅。课堂上重点突出,讲解主要内容及
难点,因课时限制,部分内容要求同学自学,仍属大纲中要求掌 握的内容。本课程进行期终考试。
药物合成反应_第一 章___卤化反应-0
前途有木有?
2
3
4
中 国 药 科 大 学二○一二年硕士研究生招生简章与招生目录
院系所、专业、研究方向
导师
001药学院
100701药物化学
药物合成反应(闻韧_第三版)第一章课后答案Chapter_1_Halogenation_Reaction
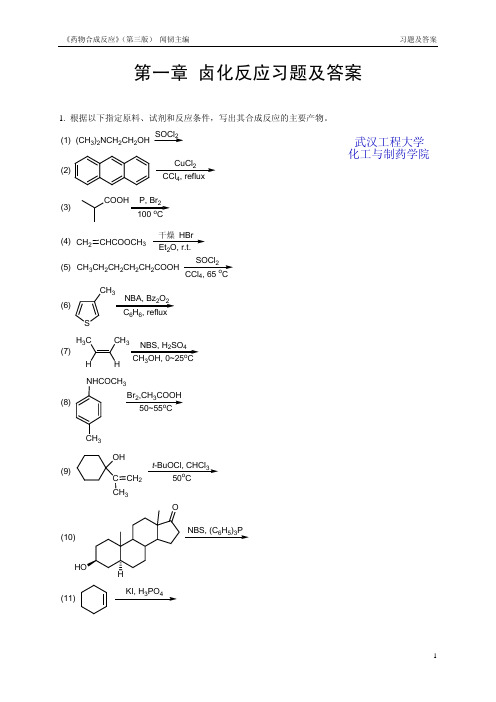
第一章 卤化反应习题及答案1. 根据以下指定原料、试剂和反应条件,写出其合成反应的主要产物。
(1)(CH 3)2NCH 2CH 2OHSOCl 2(2)CuCl 24(3)P, Br 2o(4)CH 2CHCOOCH 3干燥 HBr 2 (5)CH 3CH 2CH 2CH 2CH 2COOHSOCl 24o(6)S CH 32266(7)H 3C CH 3NBS, H 2SO 43o(8)NHCOCH 3CH 3Br 2,CH 3COOH o(9)OHC CH 3CH 2t -BuOCl, CHCl 3o(10)NBS, (C 6H 5)3P(11)KI, H 3PO 4武汉工程大学化工与制药学院(12)C 6H 5H 3Br 2,Cl 4o (13)CH 3CH CH CH 3232(14)(CH 3)3CCH 2OHHBr(15)OOP2(16)NBS, Et 3N ·3HF 22o(17)OHBr 24o(18)O23o2. 在下列指定原料和产物的反应式中分别填入必需的化学试剂(或反应物)和反应条件。
(1)CH 3CH 2CH 2CH 2CH CHCH 3CH 3CH 2CH 2CHCHCHCH 3Br(2)COOHBr(3)(4)OHBr(5)2CH 2BrBr(6)(7)(CH 3)3CCH 2OH(CH 3)3CCH 2Br(8)OOBocHNO OBocHNBr(9)OOBr OO BrBr2. 在下列指定原料和产物的反应式中分别填入必需的化学试剂(或反应物)和反应条件。
(参考答案)题号答案注释(1) NBS/(PhCO)2O, CCl4, △(2) Br2/HgO/tetrachloroethaneNaNO2, HCl, H2O; 2. HPF6; 3. △ (168℃)(3) 1.(4) Ph3P, Br2, CH3CN, △ (200-340℃)(5) NBS/(PhCO)2O, CCl4refluxing (10min. )acetone,(6) NaI,(7) Bu3P, Br2, DMF(8) NBS/hv, CCl4(9) NBS/(PhCO)2O, CCl4, reflux3. 阅读(翻译)以下有关反应操作的原文,请在理解基础上写出:(1)此反应的完整反应式(原料、试剂和主要反应条件);(2)此反应的反应机理(历程)。
药物合成反应习题
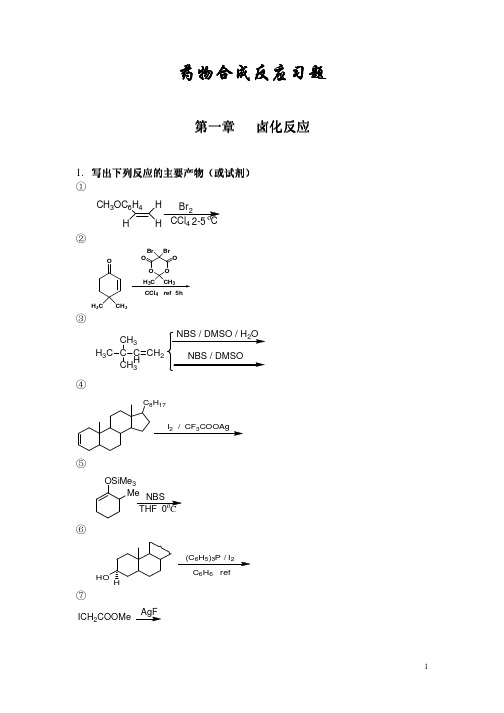
40-50°C
④
H3C H C2H5 H Cl2, CH3COOH
2
3.
①
写出下列反应的主要试剂及条件 写出下列反应的主要试剂及条件
C(CH2OH) 4
C(CH2Br)4
②
HOOC(CH2)4COOH ClCO(CH2)4COCl
③
PhCH 2COCH3 PhCHCH 2OCH 3 Cl
④
O COOH O I
药物合成反应习题
第一章 卤化反应
1. 写出下列反应的主要产物( 写出下列反应的主要产物(或试剂) 或试剂) ①
CH3OC6H4 H H Br 2 ο H CCl4 2-5 C
Br O O O H3C O CH3 Br O
②
CCl4 ref 5h H3C CH3
③
CH3 H3C C C CH2 H CH3 NBS / DMSO / H2O NBS / DMSO
氧化反应
①
②
CH3 COOH
③
CH3 CH3COCl AlCl3 CH3 CH3
R MnO2 CHCl 3 ,25°C HO OH
CH3 COOH
④
⑤
OAc KMnO 4/ KIO4 / H2O BaOH / K2CO3 / 35°C O
⑥
CH3 NO2 OCH3 CrO2Cl2 CS2 25° C
⑦
HO CH2OH (C5H5N)2CrO3 CH2Cl 2 25° C
13
⑧
0.5 M SeO 2 C2H5OH, ref.
⑨
HO OH DMSO-DCC H3PO4 RT H3CO
⑩
CH3 C O CH3 C O O
第一章卤化反应-第三节

Br O
Br (19)
O Br Br
Br Br O
OH
O CH3 Br
N
O CH3 BrBiblioteka NOH(20)
(21)
O CI
O
CI
N
N
O
N
O
CI
(22)
卤化试剂(19)用于对α,β-不饱和酮的α′-卤取代反应中,能 够减少双键加成副反应。
卤化试剂(20)和(21)的特点是亲电活性大,不需要任何催
化剂,反应条件温和,只得到单溴代物,且在反应中不生成
快
C H B:
C
B: 慢
C
OH
(-BH ) X
C OH X
X2
( -HX ) 快
CC XO
▪ 在酸或碱催化的α-卤取代反应中,羰基α 位取代基的影响是不同的。
▪ 对于酸催化的反应来说,若α位上具推电 子取代基,则有利于烯醇的稳定化,卤取 代反应比较容易,如环状酮的反应,均主 要得到在烷基较多的α位上卤取代的酮。
卤素分子和卤化氢,特别适用于对酸、碱敏感的酮。
卤化试剂(22)可在温和条件下对羰基α位及苄位、烯丙位进 行氯代反应
▪ 四溴环己二烯酮(不发生双键加成反应)
▪ 在少量HCl或HBr气体催化下,反应中以生成稳 定的三溴苯酚为动力,促使4位碳一溴键异裂, 生成的溴正离子向α,β-不饱和酮的α'位C-H作亲 电取代;同时,能有效地消除x-,于是可得到收 率良好的α'-溴代-α,β-不饱和酮。
CHO
O Br
O
Br O
O
OAc
C3H7CHCH
Br
OAc
H+ C3H7-C CHO Br
药物合成反应习题 第一章 卤化反应ppt课件

C r O /P y /C H C l 3 2 2
L i A l H / E t O 4 2
O H O H
C l C H C H C H ( C H ) C H O H 2 2 2 4 2 C l C H C H C H ( C H ) C O O C H 2 2 2 4 2 5
N a B H / E t O H 4
N R X N N+ N N X N NR N
环 六 亚 甲 基 四 胺 ( 乌 洛 托 品 )
四、药物合成反应课程的学习方法
3. 了解一些新试剂,新反应的特点、应用 范围,并与类似反应进行比较. 4.课后要做练习; 5.重视《药物合成实验》提高自己的动手 能力。
五.药物合成反应授课的要求和安排
H O 2
N H 2
B r
B r
(3)阻断基
• 阻断基的引入使反应物分子中某一活性部位被 封闭,让分子中其他活性低的部位发生反应并 顺利引入所需的基团,等目的达到后再除去阻 断基。
N H 2
( C H C O ) O 3 2
N H C O C H 3
H S O 9 8 % 2 4
N H C O C H 3
• 课堂讲授为主、自学为辅。课堂上的重 点突出,讲解主要内容及难点,因课时 有限,有部分内容要求同学自学。 • 课前要预习.
讨论与练习
1.学好本课程对从事药物及其中间体合 成工作有何意义? 2.药物合成反应有哪些特点?应如何学 习和掌握? 3.什么是导向基?具体包括哪些类型? 举例说明。 4.查阅报道药物合成领域的新技术及发 展动态资料?
药物合成反应习 题 第一章 卤化 反应
绪论
一、药物合成课程的目的 二、药物合成的发展趋势与新技术 三、药物合成反应课程教授内容 四、药物合成反应课程的学习方法 五、药物合成反应授课的要求和安排
第一章 卤化反应(上)

离子对过渡态
三分子协同
反马氏规则机理
R R C C H H + Br
HBr
光
R R C
H
C Br
+ Br
H H HBr R H C H C Br H
29
H Br
例如
雌激素己烯雌酚中间体的合成:马式加成
MeO CH CH CH3 MeO CH Cl CH2 CH3
HCl/PhH
消炎镇痛药苄达明中间体的合成:反马式加成
H
H O O
17
H C C
H Ph COOH
Br
H H Ph O O
Br2/CHCl3
69%
①
H C
Br H C Ph COO -
②
18
三、不饱和烃和次卤酸(酯), N-卤代 酰胺的反应
1.次卤酸(酯)对烯烃的加成反应 (1)反应通式
P8下
20
(2). 反应机理:
21
2. N-卤代酰胺对烯烃的加成反应
X O
①
C C C
+ HX 或
NH O
O N X O
③
C C C + X2 或
O NX O O
N +X O
C C C X
+ X
或
36
N O
(3). 影响因素
①取代基的影响: 若苄位有卤素 等吸电子取代 基,自由基的 稳定性降低, 使卤取代不容 易发生,除非 提高卤素浓度、 反应稳定或改 用活性更高的 卤化剂。 反之呢?
N-卤代酰胺和烯烃在酸催化下于不同亲核性溶剂中反应, 生成-卤醇类,羟基和卤素的定位符合马氏规则。
(1)反应通式
药物合成反应_第一章___卤化反应

R1 R2
R3 + ROX R4
Nu
R1 R2
R3 R4 Nu
(2)反应机理
R1 R2 X R3 X R4 OH H2O R1 R2 OH R3 X R4 OH R1 R2 X OH R3 R4
• (3)应用特点 • 次卤酸水溶液,制备卤代醇
Cl2/NaOH/H2O70~73% HgCl2/15~20 C
良好的药物合成反应须具备的特点: (1) 反应条件温和,操作简便,收率高;
(2) 具有较高的化学、位置和立体选择性;
(3) 导向基的应用;
(4)适应性强、适用面广,实用性好;
(5) 原铺材料价廉易得,有丰富的来源;
(6) 不产生公害,不污染环境。
二、药物合成反应的分类方法及所用原料
(一)药物合成反应的分类方法 1、按新键的形成分类:碳 -氢键、碳-卤键、碳-氧键、 碳-氮键等形成反应 2、按引入的原子、基团或采用的试剂分类: (1)按引入的原子、基团不同可分为:卤化、磺化 、消化、重氮化、酰化、烃化等反应。 ( 2 )按采用的试剂和原料不同分类:氧化、还原、 水解、醇解、氨解、缩合、环和等反应 3、按反应机理分类:亲电取代反应、亲电加成反应、 亲核取代反应、亲核加成反应、游离基型反应等
(三)需用的原辅材料多,且有多种易燃、易爆、 有毒以及具有刺激性和腐蚀性等物质。药物的化学结构 一般都较为复杂,需经过多步化学反应才能得到产品; (四)质量要求严格 ,符合GMP要求;
(五)批量小,需用急。
四、理论联系实际,学好药物合成反应
有机合成药物归根结蒂是有机化合物,可以采用 不同的原料,由不同的途径加以合成。 掌握药物合成 反应的基本原理和知识非常重要,而药物合成实验操 作技能,更是必不可少的基本功之一。 在学习中,既立足于各药物合成反应的通性和一 般规律,又注重反应的特性、具体反应条件、应用和 限制等;既重视合成实验操作技能的基本训练,又要 认真钻研一些合成实例;同时,还迫切需要我们不断 培养自己查阅科学技术文献的能力。
药物合成反应复习题

第一章卤化反应1 卤化反应在有机合成中的应用?为什么常用一些卤代物作为反应中间体?2 归纳下常用的氯化剂、溴化剂都有哪些?它们的主要理化性质及应用范围?3 根据反应历程的不同,讨论一下卤化反应的类型、机理及对反应的影响。
(1)卤素对双键的离子型加成(2)芳香环上的取代(3)方向化合物侧链上的取代(4)卤化氢对醇羟基的置换(5)NBS 的取代反应4 比较X2、HX 、HOX 对双键的离子型加成反应的机理又何异同点。
怎样判断加成方向5 在-OH 得置换反应中各种卤化剂各有何特点?他们的应用范围如何?6 预测Br2/CCl4 于下列各种烯烃进行溴化反应的相对速度的次序。
CH2=CH2 (CH3)2C=CH2 HOOC-CH=CH-COOH (CH3)2C=C(CH3)2 CH3CH2=CH2 CH2=CH-CN7 对比下列反应的条件有何不同?结合反应机理加以说明:H3C CH2 CH 2Br(1)H3C CH CH 2H3C CHBr CH 3CH 3Cl CH 3(2)CH 2ClRH 2C CH CH 2(3) R H 2C CH CH 2BrRH 2C C CH 2OH8 下列反应选用何种氯化剂为好?说明原因。
(1) H3C C CH CH3 H3CC CH CH 2BrCH 3 CH 3(2)H3 C HC CH COOH H3C HC CH COCl(3) HO (CH 2 )6 OH IH2C(CH 2)4 CH 2 OH(4) H3CCO C H 2CH 2 COOH H3 CCO CH2CHCOBrBr(5) H3 CO CH2 OHH3CO CH 2 ClH2C C (CH 2 )6 COOHCl(6)H2 C HC (CH 2)6 COOHBr H2C (CH 2)6 COOHCOOHCOOHCOCl(7)Cl Cl HO OHNCl Cl NNCOClHO OHN9 完成下列反应,写出主要的试剂及反应条件:OHOH(1)COOH COClCH 3 CF3(2)(3) CH3COOHFXH2COOH(4) O COOH O I10 完成下列反应,写出其主要生成物(1) H3C C CHCH3Ca(OCl) 2/HOAc/H 2OH3C(2)HC CH2NBS/H 2O(3) CH3 C CH 2HBr/Bz2O2(4) OH 48%HBr(5) C H 2CH=CHCH2CH=CHBrCH 2=CH-COO-CH-CH 2 1molBr2/CCl4(CH 3)2C=CHCH 2CH=CH 2第二章烃化反应一烃化剂的种类有哪些?进行甲基化和乙基化反应时,应选用那些烃化剂?引入较大烃基时选用那些烃化剂为好?二用卤代烃对氨基和羟基的烃化反应各有何特点?烃化剂及被烃化物的结构对反应有何影响?三用于制备较纯的伯胺的方法有那几种?四举例说明“还原烃化”、“羟乙基化”的机理、特点及反应中的注意事项。
第一章 卤化反应 1.4
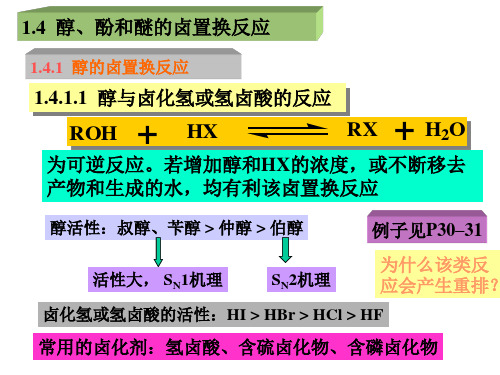
3
o
95%
BrH 2 C BrH 2 C CH 2 Br CH 2 Br
N aI/M e 2 C O 63%
90 h
磺酸酯的卤置换效果更好!!!
1.6.2 芳香重氮盐化合物的卤置换反应
A rN 2 X H X/C uX 注意:一价铜 ArX
+
N2
例子见书 Page47
NH 2 1. E tO C S K /2. H C l 2 OH N O Et Cl
BF 4
Et 3 OBF
HO
4
CO 2 Me
Br CO 2 Me
HO OSiR Br
3
Et 4 N B r o CH 2 Cl 2 /-15 20 min Br
OSiR Br CO 2 Me
第一章 卤化反应

O H3C C NHCl
(NCA)
O
O
N-溴(氯)代丁二酰亚胺
N Br
O (NBS)
N Cl
O (NCS)
4. 定位:遵循马氏规则
H Ph C CH2
NBS / H2O
H Br Ph C CH2
OH
R1
R2 NBS/ DMSO
R1
Br R2 CC
H
H
H
H
O S CH3 CH3
R1
Br C
注:只有溴化氢才能和烯烃发生自由基型亲电 加成反应到反马氏规 则的产物,这一研究无论是在理论还是在工业 上都有非常广泛的应用。
利用烯烃加溴化氢的离子型亲电加成途径 和自由基型加成途径,我们可以有选择性的制 备两种类型结构的溴代物。
CH3CH2CH2CH2CH2Br + KF 120℃
CH3CH2CH2CH2CH2F
沸点 129℃
沸点 62.8℃
1. 卤素与烯烃的亲电加成反应
(1)反应历程: 第一步:卤正离子向π 键进攻,形成三员环卤正离子 或开放式碳正离子的过渡态。
R1 R3
R2
R4
δ +δ XX
R1 R3 CC
R2 X R4
工业应用:20世纪20年代以后 1923年:甲烷气相氯化的工业装置建成 1931年:工业生产氟氯甲烷 1958年:氧化氯化法合成卤代烷 现在:广泛用于有机合成,制备各种重要的原料、中间 体和工业溶剂
卤化反应在有机合成中的用途:
1.制备含卤素的有机药物
H NHCOCHCl2
O
H2N
F
CC
CH2OH
COOH
3. 卤化氢对炔烃的加成
矿产

矿产资源开发利用方案编写内容要求及审查大纲
矿产资源开发利用方案编写内容要求及《矿产资源开发利用方案》审查大纲一、概述
㈠矿区位置、隶属关系和企业性质。
如为改扩建矿山, 应说明矿山现状、
特点及存在的主要问题。
㈡编制依据
(1简述项目前期工作进展情况及与有关方面对项目的意向性协议情况。
(2 列出开发利用方案编制所依据的主要基础性资料的名称。
如经储量管理部门认定的矿区地质勘探报告、选矿试验报告、加工利用试验报告、工程地质初评资料、矿区水文资料和供水资料等。
对改、扩建矿山应有生产实际资料, 如矿山总平面现状图、矿床开拓系统图、采场现状图和主要采选设备清单等。
二、矿产品需求现状和预测
㈠该矿产在国内需求情况和市场供应情况
1、矿产品现状及加工利用趋向。
2、国内近、远期的需求量及主要销向预测。
㈡产品价格分析
1、国内矿产品价格现状。
2、矿产品价格稳定性及变化趋势。
三、矿产资源概况
㈠矿区总体概况
1、矿区总体规划情况。
2、矿区矿产资源概况。
3、该设计与矿区总体开发的关系。
㈡该设计项目的资源概况
1、矿床地质及构造特征。
2、矿床开采技术条件及水文地质条件。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
矿产资源开发利用方案编写内容要求及审查大纲
矿产资源开发利用方案编写内容要求及《矿产资源开发利用方案》审查大纲一、概述
㈠矿区位置、隶属关系和企业性质。
如为改扩建矿山, 应说明矿山现状、
特点及存在的主要问题。
㈡编制依据
(1简述项目前期工作进展情况及与有关方面对项目的意向性协议情况。
(2 列出开发利用方案编制所依据的主要基础性资料的名称。
如经储量管理部门认定的矿区地质勘探报告、选矿试验报告、加工利用试验报告、工程地质初评资料、矿区水文资料和供水资料等。
对改、扩建矿山应有生产实际资料, 如矿山总平面现状图、矿床开拓系统图、采场现状图和主要采选设备清单等。
二、矿产品需求现状和预测
㈠该矿产在国内需求情况和市场供应情况
1、矿产品现状及加工利用趋向。
2、国内近、远期的需求量及主要销向预测。
㈡产品价格分析
1、国内矿产品价格现状。
2、矿产品价格稳定性及变化趋势。
三、矿产资源概况
㈠矿区总体概况
1、矿区总体规划情况。
2、矿区矿产资源概况。
3、该设计与矿区总体开发的关系。
㈡该设计项目的资源概况
1、矿床地质及构造特征。
2、矿床开采技术条件及水文地质条件。
