醇和醚
第八章 醇和醚

}
弱碱,反应条件温和, 不饱和键不受影响。
琼斯试剂
CrO3+稀H2SO4 费慈纳-莫发特试剂
醛(产率不高, 不用。)
醛(产率很高)
稀酸,反应条件温和, 不饱和键不受影响。
酸性 (H3PO4) , 其它基团不受影响。 碱性,可逆,分子 内双键不受影响。
二环己基碳二亚 胺二甲亚砜
{
丙酮、甲乙酮等 醛(会发生醇醛缩 (欧芬脑尔氧化) 合付反应,不用。)
CH3CHCH2CH2CH3 + HBr
OH
CH3CHCH2CH2CH3 + CH3CH2CHCH2CH3
Br Br
86%
14%
2o
2o, 氢重排
(CH3)2CHCH2OH + HBr
(CH3)2CHCH2Br + ( CH3)3CBr
80% 20%
1o
3o, 氢重排
(CH3)3CCH2OH + HBr
醇化物(结晶醇)
低级醇与一些无机盐形成的结晶状分子化合物称 之为结晶醇,也称之为醇化物。 MgCl2 6CH3OH CaCl2 4C2H5OH 工业乙醚常杂有 少量乙醇,加入 CaCl2可使醇从乙 醚中沉淀下来。
注意
许多无机盐 不能作为醇 的干燥剂。
结晶醇不溶于有机 溶剂而溶于水。 利用这一性质,可 以使醇和其它有机 溶剂分开,或从反 应物中除去醇类。
第八章 Alcohols
醇和醚 and Ethers
8.1 醇 本章提纲
一 、醇的分类、命名与结构 二 、醇的性质 三、醇的制备
8.2 醚 一、醚的分类和命名 二、醚的性质 三、醚的制备 四、相转移催化作用
一、 醇的分类、命名与结构
有机化学醇和醚
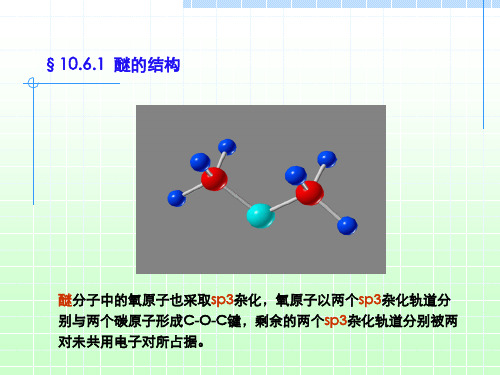
3. 溶解性 醚一般微溶于水,能与水分子形成氢键;易溶于有机溶剂。 由于 醚的化学性质不活泼,是良好的溶剂。
§10.9 醚的化学性质
醚键(C-O-C)的极性很小,比较稳定。
对碱、氧化剂、还原剂都很稳定; 在常温下醚也不与金属钠作用; 但是在一定条件下,醚也能发生某些化学反应。
§10.9 醚的化学性质
+ CH3CH2I
CH 3CH 2I
+ H2O
混醚与氢碘酸作用时,一般是较小的烃基生成碘代烷,较大的烃基
生成醇或酚。
CH 57%HI O C H 2 5 3 △ O C H 2 5 HI △ C H OH 2 5 OH + C H I 2 5 +
CH I 3
§10.9.2 络合物的生成 醚可以将氧上的未共用电子对与缺电子的试剂(如BF3、AlCl3、 RMgX等)形成相应的络合物。
HOCl
HOCH2 CH2 Cl
§10.10 重要的醚
环氧乙烷
b. 化学反应
在酸或碱催化下可以与许多含活泼氢的试剂(如水、氢卤酸、醇、氨
等)发生化学反应。
CH2 O
CH2
+
HA
CH2 OH
CH2 A
式中:A代表-OH,-X,-OR,-NH2等。
§10.10 重要的醚
环氧乙烷
b. 化学反应
① 与水反应
用,形成佯盐,而溶于强酸体系(如浓硫酸、浓盐酸)。
金 羊盐不稳定,遇水很快分解为原来的醚。
§10.9.1 佯盐的形成和醚键的断裂
醚键的断裂
醚与浓氢卤酸(一般用氢碘酸)共热,醚键可以断裂生成卤代烷 和醇。如果氢卤酸过量,生成的醇进一步反应生成卤代烷。
第十章醇和醚

Br -
CH3 CH3 C CH2CH3
Br
三卤化磷或亚硫酰氯(SOCl2)也可与醇反应 制卤代烃,且不发生重排,因此是实验室制卤代
烃的一种重要方法。
CH3CH2CH2OH
P+I2(PI3) 85~90℃
CH3CH2CH2I
CH3CH2CH2CH2OH + SOCl2
CH3CH2CH2CH2Cl + SO2 + HCl
③写出全称 “某醇”。
3CH3 H2C3CH3 3CH3
CH3
CH3CHCH2CH2CCH3
OH
CH3
5,C5H-二3C甲HC基H-22C-H己2醇CHCH2CH3
OH
OH
CHC3CHH3CCHHC2HC2HC2HC2HCHCCHH2C2CHH33
OHOH
OHOH
2,5-庚二醇
CCHH2O2OHH
3. 酯的形成
CH3 OH +H OSO3H
CH3OSO3H +H2O
硫酸氢甲酯
CH2 OH
H2SO4(浓) CH2 ONO2
CH OH + 3HONO2 10~20℃ CH ONO2 + 3H2O
CH2 OH
CH2 ONO2
三硝酸甘油酯(硝化甘油)
硝化甘油是一种烈性炸药;在医疗上可扩张血管,做心 血管的急救药。
不同的醇与同一种氢卤酸反应的活性: 烯丙醇、苄醇>叔醇>仲醇>伯醇>甲醇
卢卡斯(Lucas)试剂:无水氯化锌的浓盐酸溶液
CH3 CH3 C OH
CH3
+ HCl
ZnCl2 20℃
CH3
CH3 C Cl + H2O
第九章 醇和醚

反应可逆,需采用一定措施以利于正向进行。
各类醇的鉴别-卢卡斯试剂
用浓盐酸与ZnCl2配置的溶液-卢卡斯(Lucas)试剂与各类醇 反应的活性如下:
叔醇
(CH3)3C-OH
ZnCl2-HCl
20oC,1min
ZnCl2-HCl
(CH3)3C-Cl + H2O
仲醇 (CH3)2CH-OH 20oC,10min (CH3)2CH-Cl + H2O 伯醇 CH3(CH2)3-OH
HO-(CH2)10-OH
O2N
-CH2OH
O CH3 CH3 OH ① LiAlH4,干醚 CH3C=CHCH2CH2CCH3 CH3C=CHCH2CH2CHCH3
② H2O
CH3CH=CHCHO 巴豆醛
Al[OCH(CH3)2]3 (CH3)2CHOH
CH3CH=CHCH2-OH 巴豆醇 -CH=CHCH2OH
C-H 0.110nm
O-H 0.096nm C-O 0.143nm
∠HCH=109◦
∠HCO=110◦ ∠COH=109◦
2、醇的分类
根据羟基所连的C的性质分为伯醇、仲醇、叔醇。 称为一级醇,二级醇…..,分别记为1°,2°,3°等。 如: RCH2OH R2CHOH R3COH
根据R的性质分为饱和醇、不饱和醇和芳香醇,如: CH3CH2CH2OH
CH2=CH-CH2OH
Ph-CH2OH
根据分子中含羟基的数目分为一元醇、二元醇和多 元醇。如:
CH3CH2OH CH2-CH2 OH OH CH2-CH-CH2 OH OH OH
一个碳原子上有两个或两个以上羟基就不稳定, 容易分子内脱水形成羰基。
3、醇的异构和命名
有机化学中的醇和醚

有机化学中的醇和醚醇和醚是有机化合物中常见的两类化合物,它们在化学性质和应用领域上具有一定的相似性和差别。
本文将对有机化学中的醇和醚进行详细的介绍和分析。
一、醇的概念和性质1.概念:醇是由一个或多个羟基(OH)取代碳原子而形成的有机化合物,通式一般为ROH,其中R代表烷基或芳基。
2.性质:醇具有以下几个特点:(1)醇分子中的羟基具有极性,导致醇具有较高的沸点、溶解度和比热容,同时也使醇能够与水分子形成氢键。
(2)醇可以和酸反应,形成醚、酯等化合物,这是醇的一个重要反应。
(3)醇可以进行氧化反应,形成醛、酮等化合物,这是醇的另一个重要反应。
二、醇的命名和分类1.命名:醇的命名遵循系统命名法,以确定主链和羟基的位置、取代基和官能团等因素,例如乙醇、异丙醇等。
2.分类:醇可以根据羟基所连接的碳原子个数进行分类,分为一元醇、二元醇等。
三、醇在有机合成中的应用1.醇的还原性:由于醇分子中含有极易离去的羟基,醇具有还原性,可以被氢化剂还原为饱和烃。
这一性质使得醇成为重要的还原试剂,在有机合成中用于还原醛、酮等化合物。
2.醇的亲核性:醇分子中的羟基具有较强的亲核性,可以与酰卤、烯烃等电子不足的化合物发生亲核取代反应,形成醚、酯等化合物。
这一反应在有机合成中十分常见。
3.醇的氧化性:醇可以通过氧化反应被氧化剂氧化为醛、酮等化合物,这一反应常用于有机合成中的氧化反应。
四、醚的概念和性质1.概念:醚是由两个有机基通过氧原子连接而成的化合物,通式一般为R-O-R'。
2.性质:醚具有以下特点:(1)醚是较稳定的化合物,具有较低的沸点和溶解度。
(2)醚分子中的氧原子不带电荷,因此醚没有和水分子形成氢键的能力。
(3)醚可以被酸催化下的水解反应,将醚分解为两个醇。
五、醚的命名和分类1.命名:醚的命名同样遵循系统命名法,以确定两个有机基的结构和官能团等因素,例如乙醚、二甲醚等。
2.分类:醚可以根据氧原子所连接的碳原子个数进行分类,分为二元醚、三元醚等。
醇与醚的合成与应用

醇与醚的合成与应用醇和醚是有机化学中常见的化合物,它们在生活和工业中有着广泛的应用。
本文将介绍醇和醚的合成方法以及其在各个领域中的应用。
一、醇的合成与应用1. 醇的合成方法醇的合成主要有以下几种方法:(1)醇的氢化:通过将醛、酮或酸等有氧基官能团还原为醇,常用还原剂有氢气/催化剂或金属碱金属醇。
(2)格氏试剂反应:将酰氯与铝醇反应得到酯,再经水解制备醇。
(3)溴代反应:利用亲电试剂溴代醇基或醚基。
(4)格氏反应:利用醇和酸进行酯交换反应,生成醇。
(5)卡宾重排反应:以环丁烷二酮为例,发生负离子卡宾重排,生成二甲基二氧杂环丁烷。
(6)格氏试剂与醛酮的反应,生成复杂的含氧杂环,再经水解获得醇。
2. 醇的应用醇在生活和工业中有着广泛的应用:(1)醇常被用于制药工业,作为溶剂和反应物。
(2)醇可用作燃料和燃料添加剂。
(3)甘露醇等某些醇类物质可用作食品添加剂,具有甜味。
(4)丙二醇可用于制备聚醚、聚酯等聚合物,用于制作塑料和纤维。
(5)醇具有良好的溶解性和挥发性,可用作清洁剂和溶剂。
二、醚的合成与应用1. 醚的合成方法醚的合成主要有以下几种方法:(1)Williamson合成:通过醇和卤代烷反应生成醚。
(2)Alkoxy化反应:利用溴代烷与金属醇反应,生成醚。
(3)重排反应:例如华格纳重排、负离子分子重排等。
2. 醚的应用醚在生活和工业中也有广泛的应用:(1)作为有机溶剂,醚具有较低的沸点和良好的挥发性,常被用作涂料和油漆中的溶剂。
(2)醚可用作燃料和燃料添加剂。
(3)醚可用作抗心律失常药物和全身麻醉药物的成分。
(4)醚可用作润滑剂和冷却剂。
(5)醚还可用作合成高分子材料的起始物料,如聚醚、聚酯等。
总结:醇和醚是有机化学中常见的化合物,在生活和工业中有着广泛的应用。
醇的合成可通过氢化、格氏试剂反应、溴代反应等方法实现,应用领域涵盖制药工业、燃料、食品添加剂、塑料等。
醚的合成则可通过Williamson合成、Alkoxy化反应、重排反应等方法实现,应用领域包括有机溶剂、药物、润滑剂等。
醚和醇的反应

醚和醇的反应1. 嘿,化学小伙伴们!今天咱们来聊聊醚和醇的反应,这可是个热闹非凡的化学派对哦!别以为它们只是些枯燥的分子,在化学世界里,它们可是能闹出不少笑话来的!2. 醚和醇,听起来像是一对欢喜冤家。
醚总是一副高冷的样子,整天端着架子说:"瞧瞧我,多稳定啊!"醇则像个活泼的小调皮,蹦蹦跳跳地回应:"切,我可是反应性的王者!"3. 说到醚的反应,它可真是个慢性子。
在常温下,它就像个睡不醒的大懒虫,对大多数试剂都爱理不理的。
但别被它骗了,给它点刺激,它也能变身化学界的"急性子"!4. 比如,当强酸来捣乱时,醚就会被"刺激"得裂开。
这个过程叫做"醚的裂解",听起来挺吓人的,就像是把醚分子劈成两半。
我们可以想象醚分子在尖叫:"救命啊!我要被拆散了!"而酸分子则得意洋洋地说:"嘿嘿,让你平时装高冷,现在尝尝我的厉害!"5. 醚还有个有趣的反应,叫做"自氧化"。
这就像是醚分子自己给自己找麻烦,慢慢变成过氧化物。
我们可以想象醚分子自言自语:"嗯,今天天气不错,要不我出去晒晒太阳?哎呀,晒过头了,变成过氧化物了!"6. 再说说醇,这个小家伙可是反应界的"多面手"。
它能和酸反应生成酯,就像是化学界的"变装达人"。
想象一下,醇分子兴高采烈地说:"看我的厉害,变身酯分子!"旁边的水分子酸溜溜地说:"切,不就是换了身衣服嘛。
"7. 醇还能脱水,变成烯烃。
这就像是醇分子参加了一个"减肥训练营",脱掉了一个水分子的重量。
醇分子可能会自豪地说:"瞧瞧我的新身材,多么苗条啊!"8. 醇的氧化反应更是精彩。
根据氧化的程度不同,醇可以变成醛或酸。
有机化学中的醇与醚的合成

有机化学中的醇与醚的合成有机化学作为化学的一个重要分支,研究的是碳氢化合物及其衍生物的结构、性质和反应。
其中,醇和醚是有机化合物中常见的两类官能团,它们在生物、药物、农药等领域具有重要的应用价值。
本文将重点讨论有机化学中醇与醚的合成方法。
一、醇的合成
醇是含有羟基(-OH)官能团的有机化合物,在合成中使用广泛。
下面介绍几种常见的醇合成方法:
1. 烷烃氧化法:烷烃氧化是醇的一种重要合成途径,其中最常见的是烷烃的氧化裂解反应。
例如,乙烷氧化可生成乙醇。
2. 烯烃水化法:烯烃通过水合反应可以生成醇。
例如,乙烯经过水合反应可以制备乙醇。
3. 羧酸还原法:羧酸的还原反应也是醇的常见合成方法。
例如,乙酸经过还原反应可以生成乙醇。
二、醚的合成
醚是含有氧桥(-O-)官能团的有机化合物,通常可以由醇和卤代烷基的缩合反应来合成。
下面介绍几种常见的醚合成方法:
1. 醇缩合法:醇和卤代烷基经过缩合反应可以生成醚。
例如,甲醇和溴乙烷经过缩合反应可以制备甲基乙基醚。
2. 醇脱水法:醇经过脱水反应也可以生成醚。
例如,乙醇在酸性条件下脱水反应可以生成乙醚。
3. 醇与醚之间转化法:醇可以通过醚化反应转化为醚。
例如,在酸催化条件下,乙醇可以与甲醇发生醚化反应生成乙基甲醚。
综上所述,有机化学中的醇与醚是重要的有机化合物,在实际合成中有着广泛的应用。
通过实验室合成或生物合成等方法,我们可以合成出各种类型的醇和醚化合物,为化学领域的发展和应用提供了有力支持。
希望本文对读者有所帮助,欢迎交流讨论。
本科有机化学 第五章 醇和醚
5
6
结构与化学性质
碳氧单键为极性键 (与碳卤单键类似) 亲核取代反应、消除反应
氢氧极共用电子对 碱性、亲核性 7
一元醇的化学性质
1. O-H键的断裂:酸性(acidity)
醇酸性的体现
酸性的度量 (酸解离常数)
8
9
• the acid-dissociation constants for alcohols vary according to their structures • the acidity decreases as the substitution on the alkyl group increases • substitution by electron-withdrawing halogen atoms enhances the acidity of alcohols
27
28
本反应的一个早期应用:Alcohol Breath Tester
用嘴吹气 玻璃管:内壁附着 涂有重铬酸钾和 硫酸的硅胶颗粒
气 球
29
(2)选择性氧化剂氧化: PCC(pyridinium chlorochromate)
特点:活性相对较低,故选择性强,适合由伯醇氧化制备醛和由仲 醇氧化制备酮,不影响碳碳重键
SN2
亲核试剂进攻质子 化的羟基,水离去, 形成产物
伯醇和仲醇与HCl的反应常需添加ZnCl2,以促进反应的进行 反应活性较低的原因:亲核性Cl- < Br- (如何解释?)
16
Lucas reagent (卢卡斯试剂) 浓盐酸+无水ZnCl2
活化的原因:Zn2+与羟 基配合能力较H+更强!
Lucas test:可粗略地通过醇与Lucas试剂反应的时间推测醇的 类型(伯、仲、叔醇)
醇和醚知识点详解

醇和醚知识点详解醇和醚是有机化合物中常见的两类化合物。
它们在许多领域具有重要的应用,如有机合成、溶剂、药物和香料等。
本文将详细介绍醇和醚的定义、性质、制备方法和应用等知识点。
一、醇的定义和性质醇是一类含有氢氧基(-OH)的有机化合物。
根据氢氧基的位置,醇可以分为一次醇、二次醇和三次醇。
一次醇中,氢氧基连接在碳链上,如甲醇(CH3OH)和乙醇(C2H5OH)。
二次醇中,有两个氢氧基连接在碳原子上,如乙二醇(HOCH2CH2OH)。
三次醇则有三个氢氧基连接在碳原子上。
醇分子中的氢氧基使其具有一些特殊性质,如溶解性和酸碱性。
1. 溶解性:醇一般可溶于水。
较短的醇(一次醇和二次醇)溶解性较高,而较长的醇溶解性较差。
这是因为水分子能与醇分子的氢键形成氢键,使其能够相互溶解。
2. 酸碱性:醇可作为酸或碱。
在适当条件下,醇的氢氧基可以脱去质子成为负离子(醇的碱性),也可以接受质子成为正离子(醇的酸性)。
二、醇的制备方法1. 氢氧化物的还原:将醛或酮用还原剂(如氢气与催化剂)还原即可得到相应的醇。
2. 同分异构体的合成:对一些具有同分异构体的化合物,通过适当的反应条件,可以选择性地将其转化为某一种醇。
3. 环氧化合物的开环:将环氧化合物与酸或碱反应,使其开环而生成相应的醇。
4. 卤代烃的取代反应:醇也可以通过将卤代烃与水反应来获得。
三、醇的应用1. 溶剂:醇在许多化学反应中可以作为溶剂使用,如乙醇常用于制备药物和香料。
2. 酯的制备:醇与酸酐反应,通常可以生成酯。
酯在食品工业、香料工业和制药工业中有广泛的应用。
3. 脱水剂:由于醇分子中含有活泼的氢氧基,因此醇在一些有机合成反应中可以作为脱水剂使用。
四、醚的定义和性质醚是一类含有两个烷基或芳基团的有机化合物,其通式为R-O-R',其中R和R'可以是烷基或芳基团。
根据醚分子中氧原子在碳链上的位置,可以分为对称醚和非对称醚。
1. 对称醚:两个烷基或芳基团相同,例如乙醚(CH3OCH3),是最简单的醚。
第十章醇和醚

O CH3CH2CC6H5 + CH3CH2MgBr
三、醇的化学反应
Nu:C O H H
羟基质子化 弱酸性
C H
O C
O
H
O
H H
氧化与脱氢
醇的化学性质主要由羟基官能团所决定,同 时也受到烃基的一定影响,从化学键来看,反 应的部位有 C—OH、O—H、和C—H。
H2
RONa
H2O
ROH
NaOH
醇钠的碱性比NaOH强。 加入苯通过三元共沸物蒸馏也可以制备醇钠。
6(CH3)2CHOH
2Al
2 [(CH3)2CHO]3Al
3H2
Lucas reagent
CH3 H3C C OH CH3 H
H5C2 C OH CH3
无水ZnCl2 和浓HCl
ZnCl2/HCl r.t. CH3 H3C C Cl CH3
+
1 H 2 2 1 H + 12 2
3 (CH3)2CHOH + Al
(CH3)2CHO 3Al
ROH的反应活性1°>2°>3°
相对酸性
H2O > ROH.> RC CH > H2 > NH3 > RH
相对碱性
-
R >
-
NH2
> H > RC
-
C > RO > OH
2 ROH
2Na
2 RONa
H δ R C δ O δ H 酸性,生成酯
H 氧化反应 形成 C ,发生取代及消除反应
分子中的C—O键和O—H键都是极性键, 因而醇分子中有两个反应中心。 又由于受C— O键极性的影响,使得α—H具有一定的活性, 所以醇的反应都发生在这三个部位上。
有机化学中的醚,酮,醇等有机物如何区别

引言概述:正文内容:一、醚的特征和区分方法:1.醚的结构特征:醚是由一个氧原子连接两个碳原子而形成的,有一个共轭π键。
它的化学式通常为ROR’,其中R和R’表示取代基。
2.区分方法:a.溶解性:醚通常具有较好的溶解度,可以与许多有机物和无机盐溶解。
b.热稳定性:醚的热稳定性较好,可以在较高温度下稳定存在。
c.反应性:醚在强酸或强碱条件下容易发生醚裂解反应醇或醛,并参与其他反应如氧化和酯化等。
二、酮的特征和区分方法:1.酮的结构特征:酮是由一个碳原子连接两个碳原子而形成的,有一个共轭π键。
它的化学式通常为RC(=O)R’,其中R和R’表示取代基。
2.区分方法:a.溶解性:酮具有较好的溶解性,但不如醚溶解性好。
b.氧化性:酮通常不容易被氧化,区别于容易被氧化的醛。
c.反应性:酮在酸或碱条件下相对稳定,但可以参与其他反应如催化加氢和亲核加成等。
三、醇的特征和区分方法:1.醇的结构特征:醇是由一个氧原子连接一个碳原子和一个氢原子而形成的,有一个共轭π键。
它的化学式通常为ROH,其中R 表示取代基。
2.区分方法:a.溶解性:醇具有较好的溶解性,可以与水和许多有机溶剂混溶。
b.反应性:醇具有亲核取代和酸催化裂解的反应性,容易发生醇缩合、脱水和氧化反应等。
四、醚、酮和醇的比较:1.溶解性:醚和醇的溶解性较好,而酮的溶解性相对较差。
2.氧化性:醛是酮的氧化产物,具有较强的氧化性,而醚和醇的氧化性相对较弱。
3.反应性:醚相对较稳定,酮的反应性较中等,而醇的反应性较高。
4.高温稳定性:醚和酮具有较好的高温稳定性,而醇在高温下容易发生分解反应。
五、应用和重要性:1.醚的应用:醚在有机合成和溶剂中广泛应用,如醚染料、醚溶剂和醚抗生素等。
2.酮的应用:酮在医药化工中具有重要的应用,如药物合成和表面活性剂制备等。
3.醇的应用:醇是化学合成和制备其他化合物的重要原料,也是许多溶剂和表面活性剂的成分。
总结:。
醇和醚

第五章 醇和醚主要内容第一节 醇第二节 醚重点内容:醇和醚的化学性质难点内容:醇和醚的化学性质学时:4第一节 醇一、分类和命名选长链——含羟基; 编位次——羟基始。
同一个碳原子上连有两个羟基的结构是不能稳定存在的。
因此,在多元醇中,像乙二醇,丙三醇这样的名称并不会产生歧义。
只有当碳原子数多于羟基数目时,才需标出羟基所在的位置。
如:二、结构和物理性质物理性质 特点是存在分子间的氢键作用为什么醇具有较高的沸点?(分子间氢键缔合)醇分子中烃基对氢键缔合有阻碍作用。
多元醇,分子中两个以上位置可形成氢键。
低级醇与水互溶。
醇在强酸中的溶解度比在水中大。
CH 3C CH 2OH CH 2O H CH 2O H CH 3CH =C CHCH(CH 3)2(CH 3)2CH OH 3__ _2甲基戊醇243__ _4_ __ _甲基异丙基己烯醇CH 3CH CHCH 3CH 3CH 2O H O H CH 2CH 3_ _22_甲基羟甲基_ _1 , 3丙二醇2__ _1乙基环己醇三、化学反应 一元醇的化学反应 ROH 的反应活性1°>2°>3° 烷氧负离子的碱性: 碱性:盐的生成(二)碳氧键断裂的反应 1、亲核取代反应 (1)与氢卤酸反应 醇的亲核取代反应一般在酸性条件下进行 酸催化可使羟基质子化,减弱C-O 键,然后以水的形式离去。
SN1机理: (多数 叔、仲醇以及一部分伯醇)这是因为按SN1机理进行反应时,可能发生分子重排的结果。
C 性酸 性α涉及αH 的反应主次C H 3C C H C H 3C H 3O HH +C H 3C C H C H 3C H 3H 2H +重 排CH 3C CH CH 3CH 3+2°碳正离子仲醇与HX 酸的反应中,生成重排产物则是SN1机理的重要特征。
SN2机理:(多数 1o 醇 特点:没有重排 )下面的反应能否顺利进行?然而,作为新戊醇这一伯醇与HCl 的作用却是按SN1历程进行的,且几乎都是重排产物。
有机化学醇和醚

* 同分异构 由于烃基的异构和官能团位置的
不同,可引起同分异构现象,另外相 同碳原子的醇和醚也互为构造异构体 ,这种异构体是属于官能团不同的构 造异构体。
2024/6/22
二、 醚的制法 * 醇分子间脱水(详见醇的性质)
此法适合于制取单醚 * 卤烷与醇金属作用(威廉森合成) ● 这是一个双分子亲核取代反应,叫做威廉森 合成法,可用于合成单醚或混醚,但主要用来 合成混醚。
2024/6/22
2024/6/22
* 醇的分类 ● 按羟基所连的碳原子类型: 伯醇(1°醇)
仲醇(2°醇) 叔醇(3°醇)
● 按羟基所连的烃基不同:饱和醇 不饱和醇 芳醇
● 按羟基数目: 一元醇 二元醇 多元醇
2024/6/22
* 异构和命名 ● 异构:醇的构造异构包括碳链异和官能团位
置异构。
2024/6/22
甘油三硝酸酯是一种炸药;磷酸三丁酯用 作萃取剂和增塑剂。
2024/6/22
* 氧化和脱氢(α—H的氧化)
叔醇无α—H,一般氧化剂不能氧化,上述反应 氧化剂可为KMnO4 + H2O、K2Cr2O7 + H2SO4。
由于伯、仲、叔醇氧化后所生成的产物不同,因 此根据氧化产物的结构,可以区别它们。
2024/6/22
* 化学性质 醚的化学性质比较不活泼,在常温下不与
金属钠发生作用,对碱、氧化剂和还原剂都十 分稳定,但能发生下列反应:
● 盐的生成 醚 R-O-R 的氧原子上有未共用电子对,它是
一个路易斯碱,在常温时能溶于强酸,形成 盐, 但醚的碱性很弱,所以生成的 盐遇水很快分解为 原来的醚。此反应可用于醚的提纯和分离。
2024/6/22
2024/6/22
有机化学基础知识点整理醇和醚的性质和反应

有机化学基础知识点整理醇和醚的性质和反应醇和醚是有机化合物中常见的官能团,它们在化学反应中起着重要的作用。
了解其性质和反应对于有机化学的学习和应用非常重要。
本文将对醇和醚的性质和反应进行整理和总结。
一、醇的性质和反应1. 醇的结构和命名醇是含有羟基(-OH)官能团的化合物。
根据羟基上所连接的碳原子数目,醇可以分为一元醇(含有一个羟基),二元醇(含有两个羟基),三元醇(含有三个羟基)等。
醇的命名通常采用将烷烃命名法中的“烷”改为“醇”,同时在碳原子前面标记羟基所连接的位置。
2. 醇的物理性质醇具有许多与羟基相关的物理性质。
由于羟基可以形成氢键,醇的沸点和溶解度通常较高。
此外,醇还具有较大的极性,使得它们具有良好的溶剂性,尤其对于极性化合物。
3. 醇的酸碱性醇既可以表现出酸性,也可以表现出碱性。
醇的酸性主要体现在羟基上,它可以失去氢原子形成羟基阴离子。
同时,醇中的氧原子也能形成键合氢,表现出碱性。
4. 醇的氧化反应醇可以发生氧化反应,其中最常见的就是醇的燃烧反应。
醇在氧气的存在下可以燃烧,并释放出大量的热能和水。
此外,醇还可以被氧化剂如酸性高锰酸钾(KMnO4)氧化成酮或醛。
5. 醇的酯化反应醇与酸酐发生酯化反应,生成酯。
酯是一类常见的醇的衍生物,具有良好的香味和挥发性。
酯化反应是众多有机合成中常用的一种方法。
二、醚的性质和反应1. 醚的结构和命名醚是由两个碳原子通过一个氧原子连接形成的化合物。
根据氧原子所连接的碳原子的数目和位置,醚可以分为对称醚和不对称醚。
醚的命名通常采用将两个碳原子团按字母顺序排列,并在后面加上“醚”字。
2. 醚的物理性质醚具有较低的沸点和较好的挥发性,这使得它们广泛应用于溶剂和非极性反应介质中。
醚的极性较小,不溶于水,但溶于大部分有机溶剂。
3. 醚的裂解反应醚可以通过热或酸性条件下的裂解反应进行分解,生成相应的醇。
这是由于氧原子的带负电荷引发了裂解反应。
4. 醚的醚化反应醚还可以通过醇的酸性氢进行醚化反应。
化学反应的醇醚反应

化学反应的醇醚反应化学反应是化学领域研究的重要内容之一,其中醇醚反应是一类常见且广泛应用的反应类型。
醇醚反应是指醇和醚之间发生的化学反应,其原理和反应机制十分复杂,但在有机合成和化工生产中具有重要的应用价值。
本文将介绍醇醚反应的基本原理、应用领域以及一些具体的实例,以帮助读者更好地了解和掌握这一反应类型。
一、醇醚反应的基本原理醇醚反应是通过醇分子与醚分子之间发生亲核取代反应而实现的。
在这类反应中,醇分子中的氧原子(即羟基)参与反应,与醚分子中的碳原子产生化学键。
酸、碱和催化剂等物质的参与可以加速醇醚反应的进行。
在醇醚反应中,醛、酮和羧酸等官能团也可作为亲核试剂与醚分子反应,从而扩大了这类反应的适用范围。
此外,醚和醚之间也可发生醇醚交换反应,也就是醚的醇解反应。
二、醇醚反应的应用领域醇醚反应在有机化学和化工领域具有广泛的应用。
以下是几个常见的应用领域:1. 有机合成:醇醚反应是有机合成中重要的反应类型之一。
通过控制反应条件和合理选择反应物,可以合成出多种有机化合物,如醚类化合物、卤代醚、酸酐醚等。
这些化合物在药物合成、精细化工等方面有着广泛的用途。
2. 溶剂:醇醚作为有机溶剂在化学合成中得到广泛应用。
醇醚具有较好的溶解性能和溶解度,对某些溶质有良好的溶解度,同时又具有较好的挥发性。
3. 燃料添加剂:一些醚类化合物具有较好的燃烧特性,可以作为燃料的添加剂使用。
其中,甲醚和乙醚常被用作汽油的添加剂,可提高汽油的燃烧效率和动力性能。
4. 表面活性剂:醚类化合物在表面活性剂的制备中起着重要的角色。
醚类表面活性剂在油水分离、浮选和润滑等过程中具有重要的应用价值。
三、醇醚反应的示例1. 醚的合成:甲醇和乙醇是常见的醇类化合物,可以通过与硫酸或磷酸等酸类催化剂反应,生成对应的醚。
例如,甲醇与硫酸反应可得甲醚,乙醇与磷酸反应可得乙醚。
2. 酯的合成:通过醇醚反应,还可以合成酯类化合物。
例如,甲醇与乙酸反应可生成乙酸甲酯。
第九章醇和醚

醇、醚可看成是水分子中的氢原子被烃基所取代的 产物,属烃的含氧衍生物。
通式:R-OH 脂肪醇;Ar-R-OH 芳香醇;
R-O-R` 脂肪醚、Ar-O-Ar 芳醚。
如果硫化氢分子中的氢原子被烃基取代,则得到硫 醇、硫酚、硫醚。R-SH、 Ar-SH、 R-S-R`
第一节
醇
醇可以看成是烃分子中的氢原子被羟基(OH)取代后 生成的衍生物(R-OH)。
环氧乙烷化学性质活泼,在酸或碱催化下能与多种试剂 反应,形成一系列重要工业原料。
A. 在酸催化下,环氧乙烷可与水、醇、卤化氢等含活泼氢的 化合物反应,生成双官能团化合物。
这些产物同时有醇和醚的性质,是很好的溶剂,常称溶 纤素,广泛用于纤维素酯和油漆工业。
B. 在碱催化下,环氧乙烷可与RO-,NH3,RMgX等反应生成 相应的开环化合物。
发。大于6个碳的醇(苄醇除外)不溶于卢卡斯试剂,易混淆实
验现象。
2) 醇与HX的反应为亲核取代反应,伯醇为SN2历程,叔醇、烯 丙醇为SN1历程,仲醇多为 SN1历程。 A. SN1: 烯丙醇、苄醇、叔醇、仲醇。
这是因为按SN1机理进行反应时,可能发生分子重排的结果。
B. SN2:大多数伯醇,且没有重排反应。
硫醇的分解:氢解和热解两种,用于脱硫。
氢解:H2,CoMnO4 340℃-400℃
RH + H2S 烯烃 + H2S
R-SH
热解:340℃-400℃
硫醚的C-S键较弱,反应活性大于醇。 硫醚的氧化:生成亚砜和砜类。
二甲亚砜的溶解能力和穿透能力极强,在实验室中应避 免与人体皮肤接触。 锍盐的生成:
3.醇的命名 1)俗名 如乙醇俗称酒精,丙三醇称为甘油等。 2)简单的一元醇用普通命名法命名。
有机化学 第5章醇和醚

(二)物理性质
1.性状:
2.沸点:
1)比烷烃的沸点高(形成分子间氢键的原因), 如 乙烷的沸点为-88.6℃,而乙醇的沸点为78.3℃。
2)含支链的醇比直链醇的沸点低,如正丁醇 (117.3 ℃ )、异丁醇(108.4 ℃ )、叔丁醇 (88.2 ℃ )。
3.溶解度:
✓ 甲、乙、丙醇与水以任意比混溶(与水形 成氢键的原因);
CH3CH2O- (乙醇钠)的碱性HO-(氢氧化钠)强, 所以醇钠极易水解。
CH3CH2ONa + H2O
较较强强键碱 较强较酸强酸
CH3CH2OH + NaOH
较弱酸 较较弱弱酸碱
较弱减
即:强酸置换弱酸盐!
工业上制备醇钠常用上述逆反应,但需将生 成的水及时移走。
醇与钠的反应活性:
CH3OH > 伯醇(乙醇) > 仲醇 > 叔醇
伯醇 仲醇 叔醇
Lucas试剂
(-) 5分钟内浑浊 立即浑浊
4)与卤化磷和亚硫酰氯反应p154
3ROH + PX3
3RX + P(OH)3
X=Br、I,制备溴代或碘代烃
( Cl的反应产率低于50%)
ROH + PCl5 ROH + SOCl2
RCl + POCl3 + HCl RCl + SO2 + HCl
OO O K+ O
OO
MnO4-
COOH COOH
六、环氧乙烷的部分化学性质
H
R Cδ
Oδ
δ H
H
酸性,生成酯
氧化反应 形成 C ,发生取代及消除反应
(一)O-H键断裂的反应 1.与活泼金属的反应
第五章 醇和醚

H2C
CH
CH2 OH
OH OH
(多元醇)
R" RCR' OH
(仲醇)
(叔醇)
注意:
多元醇不包括同C原子上连有两个以上羟 基的醇,因为该类醇易发生异构化:
CH3CH OH OH
异构化
O H3C C H
不饱和醇不包括羟基与碳碳双键相连的醇, 因为该类醇易发生异构化:
H2C CHOH
异构化
ROH + POCl3
(RO)3PO + 3HCl
磷酸酯
3、醇与卤化亚砜反应: 由醇制备卤代 烃最常用的试剂是卤化亚砜(SOCl2)
ROH + SOCl2
醚 △
RCl + SO2 + HCl
该反应的优点:副产物都为气体。特点:1、 当与羟基相连的C原子有手性时,产物中手性 C的构型保持;2、反应体系中加入吡啶,得 CH3 构型转化产物。例:
OH
环己醇 (cyclohexanyl alcohol)
CH2OH 苯甲醇 (苄醇)
2. 系统命名 ①选择主链;②从靠近羟基的一端主链开 始编号,如:
CH3CH2CHCHCH2CH3 OHCH3
6 5 4
4-甲基-3-己醇 (4-methyl-3-hexanol)
CH3CH CH
CH CH CH2CH3
想一想
?
试用合理的反应机理解释下列反应。
CH3
CH3
HBr
CH3
C CH2OH CH3
CH3
C CH2CH3 Br
2、 与卤化磷反应:醇与卤化磷反应生 成卤代烃,是制备卤代烃的常用方法。
3ROH + PX3 3RX +P(OH)3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3 CH3 C OH
CH3
HCl
ZnCl2 室温
CH 3 CH3 C Cl H2O
CH3
(马上出现浑浊)
CH3CH2 CH CH3 OH
HCl
ZnCl2 室温
CH3CH2CHCH3
H2O
Cl
(2~5min后出现浑浊)
CH3CH2CH2CH2 + HCl ZnCl2 OH
CH3CH2CH2CH2 + H2O
6. 氧化和脱氢
广义上讲,有机化合物 ① 氧化
+O或–H —称氧化反应 –O或+H—称还原反应
伯醇氧化生成醛和羧酸 O
75~85℃ R—C—H
R-CH2OH + K2Cr2O7 117℃
Cr2O72ˉ
R—C—OH
O
若要制得醛
a) 严格控制反应温度 b) 及时把生成的醛蒸出
仲醇氧化生成酮
R/
R/
R CH OH
H
H
C R
OMgCl
H2O H+
R
CH2 OH
伯醇
格氏试剂与醛反应制仲醇
R/ C
O+
R MgCl
无水乙醚
R/
H C
OMgCl
H2O H+
R/
CH
OH
H
R
R 仲醇
格氏试剂与酮反应制叔醇
R// C O + R/
R MgCl 无水乙醚
R//
R/
C OMgCl R
H2O H+
R/ R// C
OH
R叔醇
制备:
R-Cl + SO2 + HCl 此反应产物纯净
制氯代烃
4.与酸反应(成酯反应)
醇和无机酸、有机酸作用,生成相应的酯
与有机酸反应: O
C2H5OH + CH3-C-OH
O
H+
CH3-C-O-C2H5 + H2O
与无机酸反应:
CH3OH + HOSO2OH
CH3OSO2OH + H2O
硫酸氢甲酯(酸性硫酸酯)
)
硼 化氢
CC
氧化
BH2 H2O2、OH-
CC H OH
硼氢化—氧化法两个独特之处:
① 有“反常”的选择性——制得反马氏规则产物。
CH3 CH2 CH CH2 (BH3)2 (CH3 )2 C CHCH3 (BH3)2
H2O2 HO-
CH3CH2 CH2CH2 OH
92%
H2O2 HO-
(CH3)2CH CH
二元醇: CH2—CH2 OH OH
多元醇: CH2—CH—CH2 OH OH OH
② 按烃基结 构分类:
脂肪醇: 饱和醇:RCH2-OH 不饱和醇:CH2=CHCH2OH
芳香醇:
-CH2-OH
脂环醇: -OH
3. 命名
① 普通命名法:----- 一般适合于简单的一元醇 (按相应烃来命名)
CH3-OH
CH3-C-CH2-CH3 Cl 重排产物
64%
OH
CH3
称为瓦格涅尔—麦尔外因重排
CH3-CH-CH-CH3 Cl
原因:
CH3 H CH3-C— C-CH3
OH
H+
CH3 H CH3-C— C+-CH3
-H2O
OH2
H H
CH3 H
CH3-C—
(Ⅰ)
C+ -CH3
Cl -
CH3
CH3-CH-CH-CH3
Ph
CH3CHCH2-OH 2-苯基-1-丙醇
如果有不饱和键----以含-OH和不饱和键的最长碳 链为母体。
43 2 1
CH3CH2CH2CHCH2CH2CH2
C6 H2=C5 H
OH
4-丙基-5-己烯-1-醇
3 21
-CH=CHCH2-OH 3-苯基-2-丙烯醇
如果为多元醇-----选择含尽可能多-OH的最长碳 链为母体。
Cl
(加热才出现浑浊)
HCl + ZnCl2 -----卢卡斯试剂(Lucas)可鉴别伯仲叔醇
反应活性
R-CH=CH-CH2OH ﹥ 3°R-OH ﹥ 2°R-OH ﹥ 1°R-OH C6H5CH2OH
③ 反应历程(亲核取代)
SN2历程
RCH2-OH + HX
﹢
﹣
RCH2-OH2 + X
﹢
X﹣+ R-CH2-OH2
CH3OSO2OH 减压蒸馏
+
CH3OSO2OCH3 + H2SO4
CH3OSO2OH
硫酸二甲酯(中性硫酸酯)
(CH3)2SO4毒性大,但是很好的甲基化试剂
酸性硫酸酯用碳酸钠中和时,即得其钠盐。
C12H25OSO2OH + Na2CO3
C12H25OSO3Na + CO2
(十二烷基硫酸钠) 乳化剂
CH3CH2CHCH3
H2SO4 △
CH3CH=CHCH3 + CH3CH2CH=CH2
OH
65~80﹪
少量
CH3 H
CH3-CH—C-CH3
H2SO4 △
CH3 CH3-C=CH-CH3
OH
CH3 OH
H3PO4 △
CH3 +
84﹪Leabharlann CH316﹪② 分子间脱水
CH3CH2OH + HOCH2CH3130H~12S4O0℃4 CH3CH2OCH2CH3
Cl
重排
CH3 H
CH3-C+ —
C-CH3
(Ⅱ)
Cl -
CH3
CH3-C-CH2-CH3
Cl
3.与卤化磷和二氯亚砜反应
3ROH+ PX3(P+X2)
3R-X+ P(OH)3 X = Br 、 I ( 制备溴代或碘代烃)
ROH + PCl5 ROH + SOCl2
R-Cl + POCl3 + HCl
醇结构特点:
① -OH 连接在不饱和碳上,化合物不稳定;
如:[CH2=CH-OH] 重排
O CH3-C-H
② 一个碳上如果连有多个-OH,化合物不稳定。
OH 如:R-CH-OH
-H2O
O R-C-H
2. 分类
① 按-OH数 目分类:
一元醇:
伯醇:RCH2-OH 仲醇:R2CH-OH 叔醇:R3C-OH
CH2CH3
甲基二乙基甲醇
③ 系统命名法:-------选择含有-OH的最长为主链, 编号从离-OH最近的一端开始。
CH3 OH CH3CHCH2CHCH2CH3
6 54 32 1
5-甲基-3-己醇
CH3 CH2CH3 C1 H3C2 H—3OC—H4CC5HHC2C6HH33
2,4-二甲基-3-乙基-3-己醇
CH3
9 8 % OH
② 有高度的立体选择性——反应属顺式加成
(BH3)2
CH3
H2O2 HO-
OH 8 5 % CH3
2、由醛、酮制备 1) 醛、酮与格氏试剂反应
通式:
C
δ-
O
R MgX
无水乙醚
C
OMgX
H2O H+
Mg(OH)X
R
格氏试剂与甲醛反应制伯醇
C OH R
H
无水乙醚
H C O + R MgCl
[X CH2 R
﹢
OH2]
R-CH2-X + H2O
或:RCH2OH + ZnCl2
﹢
RCH2OH-ZnCl2
﹢
X﹣ + RCH2OH-ZnCl2
[X CH2
R
RX + [Zn(OH)Cl2] ﹣
﹢
OH-ZnCl2]
一般多数伯醇是SN2历程。
SN1历程
CH3
δ+ δ- 快
C H 3 C O H + H—X
C=C
不同醇反应难易不同
+ H2O
CH3CH2OH
96%H2SO4 170℃
CH2=CH2 + H2O
CH3CHCH2CH3
60%H2SO4 100℃
OH
CH3-CH=CH-CH3 + H2O
CH3 CH3CH2-C-CH3
OH
46%H2SO4 87℃
CH3 CH3-CH=C-CH3 + H2O
OH 85%H3PO4
KMnO4 H+
R
C O (酮 )
OH
K2Cr2O7 H2SO4
4. 与某些无机盐形成结晶醇化合物
MgCl2·6CH3OH 故:
CaCl2·4C2H5OH
① 有机物中有少量醇时,可加无机盐提纯。
② 不能用无水MgCl2、CaCl2、CuSO4 等无机盐干 燥醇。
§10.4 醇的化学性质
1. 与活泼金属反应
快,剧烈
H-OH + Na
NaOH
+
1 2
H2↑
R-OH + Na
反应历程
CH3CH2OH + H+
‥
+
CH3CH2OH + CH3CH2OH2
+
CH3CH2OH2
δ+
[CH3CH2O
CCH3Oδ+H2]
H HH
-H2O CH3CH2 O CH2CH3 -H+ CH3CH2 O CH2CH3
