核医学(PETCT显像剂
PET与ECT的区别

PET与ECT的区别应用计算机辅助断层技术进行显像的设备统称为ECT。
ECT称为发射型计算机断层显像Emission Computed Tomography)。
ECT又包括SPECT(即习惯讲的ECT)和PECT(即习惯讲的PET)。
科学家将CT技术融入了ECT,从而产生了PET-CT和SPECT-CT。
ECT,即SPECT,是以发射单光子放射性核素做为示踪剂的显像设备,称为单光子发射型计算机断层显像single photon emission computed tomography。
目前国内很多三级以上医院都已经配备SPECT,数量达300台以上,主要用于全身骨骼、心肌、心脏功能、肾、脑、甲状腺等检查。
PET,即PECT,是ECT的另一类设备,是以发射正电子的放射性核素做为显像剂,称为正电子发射型计算机断层显像positron emission computed tomography,即我们通常所说的PET。
PET是核医学领域中最先进的显像设备,被视为核医学史上划时代的里程碑,是最高水平核医学的标志。
PET所应用的显像剂如F-18-FDG、C-11、N-13,O-15等都是人体组织的基本元素,易于标记到各种生命必须的化合物、代谢产物或类似物上而不改变它们的生物活性,且可以参与人体的生理、生化代谢过程,因而能够深入分子水平反映人体的生理、生化过程,从功能、代谢等方面前面评价人体的功能状态,达到早期诊断疾病、肿瘤分期、疗效判断、预后评估等目的。
PET最大的缺点是解剖结构不够清晰。
因此人们尝试把擅长功能显像的PET与擅长显示解剖结构的全身CT结合起来,PET-CT研制成功。
SPECT与PECT,就是通常说的ECT和PET,都属于核医学发射型计算机断层的影像设备ECT,各有优势,相互补充。
在肿瘤的临床应用方面PET,特别是PET-CT有极高的应用价值。
另外,SPECT还能够进行其它功能检查、脏器显像与核素治疗的示踪分析,PET-CT却不能。
peT医学是什么意思

peT医学是什么意思peT医学,全称正电子发射计算机断层扫描(PET)医学,是一门利用核医学技术对人体进行诊断和治疗的学科。
它结合了核医学、影像学、生物医学工程等多个学科的理论和方法,通过使用放射性同位素示踪剂,能够观察到人体内部生物化学和生理活动的变化,并通过图像技术进行准确的定位和分析。
在peT医学中,最常用的示踪剂是正电子放射性同位素,例如氟-18、碳-11等,这些同位素可以与人体内的特定分子结合。
通过将示踪剂注入人体,放射性同位素会释放出正电子,当这些正电子遇到负电子时会发生湮灭反应,产生两个相对运动的光子。
PET设备可以探测到这两个光子,通过计算机分析并重建成图像,展示人体内部的生物代谢和功能活动。
peT医学在临床中起着重要的作用。
它可以帮助医生诊断和区分多种疾病,如肿瘤、心脏病、神经系统疾病等。
通过扫描获得的图像,医生可以观察到组织器官的代谢活动、血液供应及血液循环等情况,从而帮助确定疾病的类型、严重程度和发展趋势,为治疗方案的选择提供依据。
与传统的影像学技术相比,peT医学具有明显的优势。
它能够提供更加全面和准确的信息,不仅可以显示组织和器官的结构,还可以观察到其功能活动的改变。
这对于一些病变早期阶段或仅在代谢水平发生改变时难以被发现的疾病特别重要。
此外,peT扫描也能实时监测治疗效果,及时调整治疗方案,提高治疗的准确性和效果。
然而,peT医学也存在一些限制和挑战。
首先,这一高精度的诊断技术要求设备和技术的高度精确和成熟,同时也对操作人员的临床经验和技术要求较高。
其次,由于放射性同位素的使用,对辐射防护和剂量控制非常重要,需要保证患者和医务人员的安全,避免副作用和长期影响。
随着医学科技的不断进步,peT医学在临床中的应用也在不断拓展。
未来,随着设备的进一步完善和技术的创新,peT医学有望在癌症早期诊断、个体化治疗等方面发挥更大的作用。
此外,随着分子生物学和基因组学的快速发展,peT医学也将与这些领域紧密结合,为研究和治疗提供更多的信息和手段。
影像医学课件:PETCT显像

研发新型的高灵敏度和高分辨率的探测器材料,能够提高PETCT显 像的图像质量。
人工智能辅助诊断
利用深度学习等人工智能技术,辅助医生进行PETCT图像的解读和 诊断,提高诊断准确率。
在精准医疗中的应用前景
1 2 3
个性化治疗
通过PETCT显像,医生可以根据每个患者的肿瘤 类型、大小和位置等信息,制定个性化的治疗方 案,提高治疗效果。
PETCT还广泛应用于心血管疾病、感染性疾病和其他复杂疾病的诊断和治疗中。
02
PETCT显像原理
PET显像原理
正电子发射断层扫描(PET)是一种核医学影像技术,利用 正电子发射体标记的特定生物分子在体内代谢过程进行显像 。
PET显像原理基于人体内细胞对标记化合物的摄取,通过体 外发射的带电粒子(如β粒子)与人体内物质相互作用产生能 量转移,进而检测发射光子,形成图像。
饮食控制
患者在检查前需遵循医生建议的饮食 计划,通常需要禁食4-6小时,以避 免食物对检查结果产生干扰。
停用药物
患者在检查前需停用可能影响检查结 果的药物,如降糖药、降压药等。
检查中操作
核医学技术员
CT扫描
核医学技术员负责为患者注射放射性药物 ,并监控其在体内的分布情况。
图像采集
在注射药物后的一定时间内,患者需要进 行CT扫描,以获取身体各部位的结构图像 。
药物研发与评估
PETCT显像可以用于新药研发和评估过程中,帮 助研究人员了解药物在体内的分布和效果,为新 药研发提供重要依据。
基因诊断与治疗
随着基因组学的发展,PETCT显像有望用于基因 诊断和基因治疗中,为精准分期
PETCT显像在肿瘤诊断和分期中具有重要作用,能够准确 识别肿瘤的位置、大小和转移情况,为制定治疗方案提供 重要参考。
petct简介

PET/CTPET/CT是一种将PET(功能代谢显像)和CT(解剖结构显像)两种影像技术有机地结合的新型影像设备,是将微量的正电子核素示踪剂注射到人体内,然后采用特殊的体外探测仪(PET)探测这些正电子核素人体各脏器的分布情况,通过计算机断层显像的方法显示人体的主要器官的生理代谢功能,同时应用CT技术为这些核素分布情况进行精确定位,使这台机器同时具有PET 和CT的优点,发挥出各自的最大优势。
中文名正电子发射断层显像/X 线计算机体层成像仪PET/CTPET/CT(positron emission tomography / computedtomography )全称为正电子发射断层显像/X 线计算机体层成像仪,是一种将PET(功能代谢显像)和CT(解剖结构显像)两种先进的影像技术有机地结合在一起的新型的影像设备. 它是将微量的正电子核素示踪剂注射到人体内,然后采用特殊的体外探测仪(PET)探测这些正电子核素人体各脏器的分布情况,通过计算机断层显像的方法显示人体的主要器官的生理代谢功能,同时应用CT 技术为这些核素分布情况进行精确定位,使这台机器同时具有PET 和CT 的优点,发挥出各自的最大优势[1] 。
PET/CT是PET和CT的组合体,将PET和CT设计为一体,由一个工作站控制[2] 。
单PET进行核医学显像时,有其它诊断设备无法比拟的早期发现灵敏性等优越特性,但因药物及其原理所限,其定位精度不够好,有厂商后来将PET和CT设计为一体,扫描时根据需求同时进行PET显像和CT显像[3] ,并由工作站将两种图像融合到一起,以达到更好的鉴别和定位。
2 发展历史编辑PET/CT近年来,影像诊断学的一个重要进展,就是图像融合技术的发展与应用。
图像融合包括硬件与软件,是一个全自动图像配准及多种图像的解读技术,它不仅具有全自动的功能与解剖图像的融合,还可以让具有不同特征的影像在同一平台显示、解读,对比与分析,为临床诊断与治疗之间架起了一座高速、流畅的桥梁。
petct肿瘤显像原理

petct肿瘤显像原理
PET-CT肿瘤显像原理是利用PET和CT联合成像,通过引入放射性核素进行显像,然后再使用CT解剖结构进行联合诊断。
其显像主要引入的显像剂包括代谢物、葡萄糖、氨基酸、蛋白质及多肽等元素,属于综合分子显像技术。
葡萄糖是人体细胞(包括肿瘤细胞)能量的主要来源之一,恶性肿瘤摄取的葡萄糖远远多于其它正常组织。
利用这一特性,在葡萄糖上标记上带有放射活性的元素氟-18作为显像剂18F-FDG,将此显像剂注入静脉内,在体内回圈,恶性肿瘤摄取的18F-FDG远多于其它组织。
因此肿瘤细胞内可积聚大量18F-FDG,经PET显像可以检测到体内18F分布情况从而显示肿瘤的部位、形态、大小、数量及肿瘤内的放射性分布。
pet ct 简介

时间分辨率定义为:对已知好事例相对的两个探测器响应的时间差分布的半宽高。时间分辨率[18]是时间窗的选定主要依据,时间窗选择应比时间分辨率稍大,一般以时间分布曲线的1/10高宽来定。
能量分辨率
能量甄别是排除散射事例的有力依据。因为散射事例中至少有一个光子经过了康普顿散射,能量部分损失,因而可以根据被测光子的能量大小决定好坏事例的取舍。系统能量分辨率的大小决定着能量窗的选择,好的能量分辨率可以选择较小的能量窗。
CT的基本原理
CT的全称是:计算机断层扫描显像(computedtomography,简称CT),利用人体各种组织对X线的吸收能力不等的特性,X线通过人体衰减,经重建计算获得图像矩阵。CT对组织的密度分辨率较高。
PET/ CT的工作原理
PET主要根据示踪剂来选择性地反映组织器官的代谢情况,从分子水平上反映人体组织的生理、病理、生化及代谢等改变,尤其适合人体生理功能方面的研究。但是图像解剖结构不清楚;CT功能有:采用X线对PET图像进行衰减校正,大大缩短了数据采集时间,提高了图像分辨率;利用CT图像对PET图像病变部位进行解剖定位和鉴别诊断。所以PET/ CT从根本上解决了核医学图像解剖结构不清楚的缺陷,同时又采用CT图像对核医学图像进行全能量衰减校正,使核医学图像真正达到定量的目的并且提高诊断的准确性,实现了功能图像和解剖图像信息的互补。
在1998~2001年间,在这台原型机上做了300余例肿瘤病人,并获得很好的效果。这一工作还获得一系列的荣誉:其中一幅图像被评为1999年美国核医学年会最佳图像。[
3成像原理编辑
PET的基本原理
PET/ቤተ መጻሕፍቲ ባይዱT
PET其全称是:正电子发射型计算机断层扫描显像仪(positron emission tomography,简称PET)由探头、数据处理系统、图像显示及检查床组成。PET使用正电子示踪剂,核素衰变过程中正电子从原子核内放出后很快与自由电子碰撞湮灭,转化成一对方向相反、能量为511 keV的γ光子。在这光子飞行方向上对置一对探测器,便可以几乎在同时接受到这两个光子,并可推定正电子发射点在两探头间连线上,通过环绕360°排列的多组配对探头,得到探头对连线上的一维信息,将信号向中心点反投射并加以适当的数学处理,便可形成断层示踪剂分布图像。凡代谢率高的组织或病变,在PET上呈明确的高代谢亮信号,凡代谢率低的组织或病变在PET上呈低代谢暗信号。
核医学(PETCT显像剂
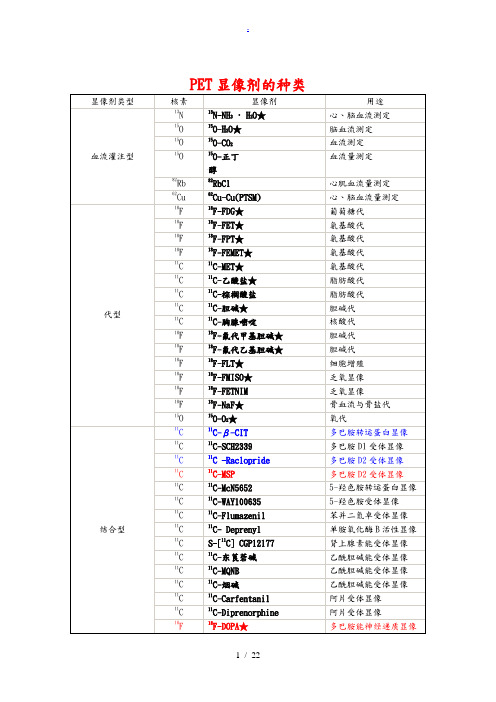
PET显像剂的种类正电子显像剂的一般性质量要求正电子显像剂有其本身的特殊性,即必须在严格的时间限制完成生产和就地就近使用,而且在生产与应用之间没有足够时间进行目前认可的所有质量控制(QC)试验,不仅细菌学、毒素检查是如此,某些化学质量检查也是如此。
正电子显像剂有两个特点,其一是因所用放射性核素的半衰期短,生产这些化合物时必须涉及高水平的放射性,以便最后能得到临床研究需要的有用数量,生产工序必须遥控。
其二,所研究的化合物极其微量,生产的绝大多数正电子显像剂不加载体,通常相当于近纳摩尔量级。
这在测定生理机能时具有不产生药效效应的优点。
因此,使用于质量控制的分析方法必须具有更低的探测下限。
在正电子显像剂这种特殊情况下,最终产品的质量控制受到时间的限制,对质量保证来讲,过程控制成为主要因素。
因此应建立单独而又严格的生产控制测量方法和程序。
例如在生产过程中,采用放射性高效液相色谱(HPLC)和放射性气相色谱(GC)等方法,无疑可以保证产品质量。
在线(Online)生产控制更有效的方法是连续监测合成中放射性的变化,这有可能在很早阶段就发现生产过程中的大多数问题。
生产工艺研究结束时以及随后工艺和物料来源的任何明显变化,都应通过对几批放射性显像剂的必要质量指标进行验证以进行全面的质量控制。
成分和原材料的质量管理是正电子显像剂质量保证的重要的过程控制。
这些原材料包括生产器具以及药物制品等所有成分。
每批原材料的一致性和质量必须得到保证并有证明文件。
经过“入口控制”后,该批产品必须作出标记并登记批号,且应备有关生产控制方式的证明文件,并制订试验记录和分析方法细则说明。
凡药典收载的成分,有详细的说明书就足够了。
如果试验方法药典未载明,则必须对其确认并被证实符合质量要求。
如果药典未载明而通常用作PET显像剂合成前体的原材料,必须以专题报告形式作出说明,包括名称、鉴定方法、纯度试验说明、稳定性和物理、化学性质。
在18F-FDG生产中,比较重要的原材料包括靶材料的纯度和丰度、三氟甘露糖的纯度、乙腈的纯度与含水量的高低以及其它化学试剂的质量,同时也包括靶室的清洁程度、反应器皿的清洁程度以及分离纯化材料的质量等,只有这些材料均合乎要求,才能生产出符号要求的18F-FDG。
PETCT肿瘤显像操作程序指南

2006年核医学杂志18F-FDG PET/CT肿瘤显像操作程序指南2007-03-12 21:44 文章来源: 丁香园点击次数:2650Ⅰ『目的』本指南旨在帮助医师在成人及儿童患者施行18F-FDG PET/CT肿瘤显像过程中如何介绍、操作、解释和报告检查结果。
Ⅱ『背景信息及定义』PET是一种断层闪烁显像技术,它通过探测引入机体的正电子核素发生衰变时释放出的正电子所发射的湮没光子来反映示踪剂在机体局部组织内的分布。
18F-FDG PET 是通过利用放射性核素标记的葡萄糖类似物,即18F-FDG,来显示不同组织的糖利用率的一种断层显像技术。
许多恶性病变对葡萄糖的利用增加,因此,18F-FDG对许多恶性肿瘤的探测、临床分期及疗效的监测是一种灵敏的方法。
CT是利用X线束形成解剖影像的一种断层显像技术,CT解剖影像信息用于探测和帮助确定恶性病灶的部位及范围。
同机PET/CT一次检查可同时提供18F-FDG PET的代谢信息及CT的解剖形态学信息。
正如一些临床所显示的那样,PET/CT提供的信息在评估已知或疑有恶性病灶病人的准确性方面优于单独PET或单独CT或异机PET加CT。
18F-FDG PET及CT是成熟的诊断方法,多年来,尽管对异机PET及CT扫描图形进行校准及融合在技术上是可行的,但由于PET与CT同机融合所具有的优越性,P ET/CT技术在美国得以迅速推广,本操作指南仅适用于PET/CT。
定义A、PET/CT是带有一个病人检查床且同时包含CT扫描仪及PET扫描仪于一体的集成装置,可同时获取CT扫描、PET扫描及PET/CT扫描图像。
若PET及CT扫描期间病人体位保持不变,则重建的PET及CT图像空间上是一致的。
B、PET/CT重合过程是将PET及CT图像进行校准,以获取融合图像及进行图像分析。
C、PET/CT图像同时显示PET及CT图像,叠加的数据以PET数据彩色编码叠加到CT灰阶上而显示出来。
fdg显像检查流程

前往PETCT检查预约登记处进行预约,明确具体检查时间,并签署知情同意书。
检查前24小时内避免剧烈运动,避免在寒冷环境中长时间滞留及肌肉过度运动(如频繁说话、嚼口香糖等)。
检查前禁食和禁饮含糖饮料4-6小时以上,不注射含糖液体。
测量血糖水平应<11.1mmolL。
血糖水平过高时可通过注射短效胰岛素降低血糖水平,胰岛素注射2小时后应重新测定血糖水平,合格后方可检查。
测量受检者身高、体重。
需要提前注射显像剂,注射显像剂后约45-60分钟进行显像检查。
核医学常见检查所用显像剂

脑血流灌注显像:99mTc-HMPAO、99mTc-ECD、99mI-IMP
脑葡萄糖代谢显像:18F-FDG
甲状腺静态显像:131I、99mTc Oˉ4
甲状腺动态显像: 99mTc Oˉ4
甲状腺亲肿瘤显像:99mTc-MIBI
肾上腺皮质显像:NP-59(131I-b-甲基-19去甲基碘胆固醇)
肾上腺髓质显像:MIBG(间位碘代苄胍)
多门电路心血池显像:99mTc-RBC(99mTc=标记自体红细胞)
心机灌注显像;201TI、99mTc-MIBI、99mTc-P53
急性心肌梗死灶显像:99mTc-PYP(99mTc-焦磷酸盐)
PET心肌灌注显像:13N-NH3
PET心肌代谢显像:18F-FDG
静态/动态骨显像:99mTc-MDP、
甲状腺髓样癌显像;99mTc(v)-DMSA
异位胃粘膜显像:99mTc Oˉ4
胃肠道出血显像:99mTc-SC(仅试用于急性出血)、99mTc-RBC
肝胶体显像:99mTc-SC、99mTc-植酸钠
肝血流血池显像:99mTc-RBC
肝癌阳性显像:99mTc-PMT
肝胆动态显像:99mTc-HIDA、99mTc-EHIDA、99mTc-DISIDA
肺灌注显像;99mTc-MAA、99mTc-HAM
惰性气体肺通气显像;133Xe、81mKr
气溶胶吸入显像:99mTc-DTPA、碍气体
泌尿系统
肾动态显像;(1)肾小球滤过型:99mTc-DTPA
(2)肾小管分泌型:131I-OIH、99mTc-MAG3、99mTc-EC 肾图:131I-OIH
肾静态显像:99mTc-DMSA、99mTc–GH
T唾液腺显像:99mTcOˉ4。
PETCT肿瘤显像操作程序指南

2006 年核医学杂志18F-FDG PET/CT 肿瘤显像操作程序指南2007-03-12 21:44 文章来源: 丁香园点击次数:2650 Ⅰ『目的』本指南旨在帮助医师在成人及儿童患者施行18F-FDG PET/CT 肿瘤显像过程中如何介绍、操作、解释和报告检查结果。
Ⅱ『背景信息及定义』PET 是一种断层闪烁显像技术,它通过探测引入机体的正电子核素发生衰变时释放出的正电子所发射的湮没光子来反映示踪剂在机体局部组织内的分布。
18F-FDG PET 是通过利用放射性核素标记的葡萄糖类似物,即18F-FDG ,来显示不同组织的糖利用率的一种断层显像技术。
许多恶性病变对葡萄糖的利用增加,因此,18F-FDG 对许多恶性肿瘤的探测、临床分期及疗效的监测是一种灵敏的方法。
CT 是利用X 线束形成解剖影像的一种断层显像技术,CT 解剖影像信息用于探测和帮助确定恶性病灶的部位及范围。
同机PET/CT 一次检查可同时提供18F-FDG PET 的代谢信息及CT 的解剖形态学信息。
正如一些临床所显示的那样,PET/CT 提供的信息在评估已知或疑有恶性病灶病人的准确性方面优于单独PET 或单独CT 或异机PET 加CT 。
18F-FDG PET 及CT 是成熟的诊断方法,多年来,尽管对异机PET 及CT 扫描图形进行校准及融合在技术上是可行的,但由于PET 与CT 同机融合所具有的优越性,P ET/CT 技术在美国得以迅速推广,本操作指南仅适用于PET/CT定义A、PET/CT 是带有一个病人检查床且同时包含CT 扫描仪及PET 扫描仪于一体的集成装置,可同时获取CT 扫描、PET 扫描及PET/CT 扫描图像。
若PET 及CT 扫描期间病人体位保持不变,则重建的PET 及CT 图像空间上是一致的。
B、PET/CT 重合过程是将PET 及CT 图像进行校准,以获取融合图像及进行图像分析。
C 、PET/CT 图像同时显示PET 及CT 图像,叠加的数据以PET 数据彩色编码叠加到CT 灰阶上而显示出来。
影像医学课件:PETCT显像

PET
Positron Emission Tomography
正电子发射计算机断层扫描
上海交通大学医学院临床核医学研究所九龙研究室
Coincidence detection
g1
g2
Coincidence event
detected in ring PET scanner
上海交通大学医学院临床核医学研究所九龙研究室
头颈部肿瘤
• 常见肿瘤依次为喉癌32.1%,甲状腺19.6%,口腔16.1% ,鼻咽14.9%,副鼻窦16.6%,大涎腺4.2%,口咽3.3%, 眼1.52%,下咽1.5%。 •病理类型中90%以上为鳞状细胞癌(squamous cell carcinoma,SCC) • 早期发生淋巴结转移,无痛性淋巴结转移是头颈部肿瘤 或其它原因不明肿瘤转移灶首先被发现的异常表现;肿瘤 可直接破坏颅底骨骼;血行转移以骨、肺、肝为常见。 • PET显像诊断、分期、疗效评价、鉴别复发及寻找原发灶 等方面均具有较高灵敏度。
A 小细胞肺癌 右肺门肿块、 纵隔淋巴结、骨转移。
B 化疗后完全缓解
Well-circumscribed squamous cell carcinoma (T2, N0, M0) in the middle lobe of the right lung of a 67-year-old male smoker deemed unfit for surgery because of dilated cardiomyopathy. Before RFA, the axial fused PET/CT image shows the right lung mass .After RFA, complete metabolic response of the right lung mass (arrow), which is suggestive of co女性,右上肺腺 癌,PET/CT进行分期。 PET/CT显示同侧纵隔 淋巴结转移。
核医学:第十章 PETCT在肿瘤诊断治疗中的应用显像

PET能准确鉴别肺部肿瘤的良恶性病变性质及转 移灶、复发灶,同时对各种治疗方法的疗效判断中 也显示出独特的优势。
通过使用放射性核素标记一定量的特异性抗体引入机体后标记抗体与肿瘤表面的相关抗原产生特异性的抗原抗体免疫结合反应形成抗原抗体免疫复合物从而使放射性核素标记抗体在肿瘤部位产生特异性集聚然后通过体外探测放射性核素在体内的分布可以发现肿瘤存在的部位形态大小肿瘤灶的数量以及是否存在转移等情况为临床判断肿瘤的位置性质以及肿瘤侵犯范围是否转移等提供科学依据
男,48岁,食管中下段及贲门癌术后。PET/CT示贲门胃底团状和双肺门、 纵隔淋巴结局限性异常高代谢灶,提示复发伴转移。
CT
PET
Fusion
女性,23岁,有卵巢区域淋巴瘤史 18F-FDG PET/CT随访证实肿瘤局部复发
女,59岁,有转移性黑色素瘤史,临床疑胰腺附近复发。18F-FDG PET/CT: 未见复发证据。
第十章 PET/CT在肿瘤诊断治
疗中的应用显像
肿瘤代谢显像分类
➢ 糖代谢显像 ➢ 氨基酸代谢显像 ➢ 磷脂代谢显像 ➢ 核酸代谢显像
一、糖代谢显像
糖代谢是核医学代谢显像中最常用、最经典的 显像方法。18F-FDG是临床上应用最多的肿瘤代谢显 像剂。
应用18F-FDG进行PET显像可获得可靠的葡萄糖 代谢影像,借助生理学模型和参数,对局部放射性 经过换算还可以获得局部组织葡萄糖代谢的定量功 能图像,清晰地显示与定位葡萄糖代谢增高的肿瘤 病灶和葡萄糖代谢减低的其它病灶。
PET是什么

PET是什么简介PET,全名为Positron Emission Tomography(正电子发射断层扫描),是一种核医学成像技术,用于评估人体内部器官或组织的代谢活动以及相关疾病的生理功能。
PET通过测量放射性示踪剂在人体内的分布和浓度,能够提供高分辨率、功能性的图像,帮助医生进行疾病诊断和治疗选择。
工作原理PET技术基于正电子自发变换原理,使用放射性示踪剂通过静脉注射到患者体内。
这些示踪剂会被患者的组织和器官吸收,发出正电子,并与电子发生湮灭反应,产生两个光子。
这些光子会被PET设备中的探测器所探测,并生成图像。
PET设备通常由放射性示踪剂注射系统、环形探测器、数据获取系统和图像重建系统组成。
当患者接受PET扫描时,探测器会测量出示踪剂发射的两个光子的时间、位置和能量信息,然后数据获取系统会将这些信息整合成三维图像。
图像重建系统会对这些数据进行图像重建和处理,最终生成一个清晰的PET图像。
应用范围PET技术在临床医学中有着广泛的应用。
下面列举了几个常见的应用领域:PET技术在肿瘤诊断中扮演着重要的角色。
通过注射放射性示踪剂,医生能够准确地评估肿瘤的生长速度、代谢情况以及有无转移。
这种功能性信息能够帮助医生制定更准确的治疗方案,提高治疗效果。
心脏疾病评估PET技术在评估心脏疾病方面具有独特的优势。
通过注射放射性示踪剂,医生能够评估心肌的代谢情况和血流动力学。
这对于心脏病的早期诊断、疾病的分型以及治疗效果的监测非常有帮助。
脑功能研究PET技术在研究脑功能和神经系统疾病方面发挥着重要作用。
通过注射放射性示踪剂,医生能够观察脑血流、代谢率和相关脑区的活动情况。
这种功能性信息对于研究脑神经系统的功能连接、疾病的诊断和疾病治疗效果的评估非常有帮助。
优势和局限性优势•PET技术能够提供高分辨率、功能性的图像,显示出生物学代谢和功能的信息。
•PET技术可以早期发现疾病的代谢改变,对疾病的诊断、治疗和监测具有重要意义。
正电子发射断层扫描成像技术

正电子发射断层扫描成像技术,简称PET扫描技术,是一种采用正电子核素作为显像剂来进行检查的医学成像方法。
该技术可以用于脑、心脏、肿瘤等部位的检查,具有对体内代谢和分子水平的直接反映,可提供医学诊断和治疗方案的有价值信息。
1. PET技术的基本原理PET扫描技术的原理是使用放射性同位素标记成分来研究生物分子在人体内的代谢过程。
PET显像剂通常是一种由正电子放射性同位素构成的物质,如碳、氧、氮等,这些核素都具有较短的半衰期,通常只有数分钟到数小时的时间。
放射性核素素被注射到体内,然后被生物分子(如葡萄糖、氨基酸等)吸收。
放射性同位素会随着这些生物分子移动,发射出正电子,这些正电子会与负电子相遇,产生光子并释放出能量。
得到的光子被探测器捕获并逆向分析,计算机则会形成一个更为清晰、准确的图像。
2. PET技术的应用PET扫描技术在医学上有着广泛的应用,如临床肿瘤学、心脏学、神经学等领域。
其主要特点是精确定位,器官成像,对病灶的检测敏感度高,同时可以提供代谢情况信息。
临床应用方面,PET扫描技术主要用于检测肿瘤的位置和生长情况、肿瘤的治疗效果等。
此外, PET扫描技术还可用于检查神经系统疾病的类型和程度,如阿尔茨海默病等,对于心脏缺血、心脏瓣膜病等也有一定的诊断价值。
3. PET技术的优势和限制相对于其他常见的成像技术,如CT、MRI等,PET扫描技术具有以下优势:首先,PET技术具有出色的分辨率,且诊断效果准确可靠,增强了医学诊断的效率和准确度。
其次, PET扫描技术可以提供更全面和准确的代谢信息,因此在个性化治疗方案的制定方面有着独特作用。
然而, PET扫描技术也存在一定的限制。
首先, PET扫描技术需要定期补充放射性同位素,因为这些核素具有短暂的半衰期,造成成像的周期性和取检前需停止某些药物的使用。
其次, PET扫描技术费用高、操作难度相对较大,目前仍处于比较高的技术门槛和设备成本下,难以普及到每一个医疗机构和科研机构中。
(精品)影像医学课件:PETCT显像

3
病例总结
本病例通过PETCT显像成功诊断出其他疾病, 并明确了治疗方案,为后续治疗提供了重要指 导。
讨论与总结
讨论
通过对以上三个病例的分享与讨论,总结出PETCT显像在不 同领域的应用价值及注意事项。
总结
PETCT显像是医学影像学中的重要技术,在临床实践中具有 广泛的应用价值。通过对不同疾病的PETCT显像结果进行综 合分析,可以为临床提供更为全面准确的诊断和治疗建议。
SUV值
01
SUV值反映病变组织的葡萄糖代谢率,对病变良恶性鉴别及预
后评估有重要意义。
MTV值
02
MTV值反映病变组织的体积大小,有助于病变范围的确定和
预后评估。
TLG值
03
TLG值综合反映病变组织的葡萄糖代谢和体积大小,对恶性病
变预后评估有重要意义。
PETCT与其他影像学方法的联合应用
与CT联合应用
。
02
扫描时间较长
PETCT扫描时间较长,一般需要30分钟左右,对于一些患者来说可能
比较难以忍受。
03
图像质量受多种因素影响
PETCT图像质量受多种因素影响,如患者体位、呼吸、部分容积效应
等,可能导致病灶的漏检或误诊。
PETCT的展望和未来发展
技术创新和普及推广
随着技术的不断创新,PETCT的普及率将会得到提高,同时设备价格也会逐渐降低,使得 更多患者能够受益。
病例总结
本病例通过PETCT显像成功诊断出肺癌,并明确了肿瘤分期,为后续治疗方案的制定提供 了重要依据。
病例二:脑肿瘤的PETCT显像
01
临床背景
脑肿瘤是发生在脑实质内的恶性肿瘤,PETCT显像可以评价肿瘤的恶
(精品)影像医学课件PETCT显像

01 PETCTChapterPETCT显像技术定义PETCT显像技术发展历程90年代,进入21原理PETCT显像技术利用正电子核素标记的葡萄糖等人体代谢物作为显像剂,通过病灶对显像剂的摄取来反映其代谢变化,再经过计算机处理重建出断层图像。
能够检测出微小的代谢变化,有助于早期发现疾病。
能够清晰地显示病灶的形态、大小和位置。
可以同时进行多种显像剂的成像,提供丰富的诊断信息。
显像剂多为人体正常代谢物,对人体无害,且检查过程无痛、无创。
高灵敏度多功能性安全性高分辨率PETCT显像技术原理及特点02 PETCTChapter患者准备知情同意病史采集向患者及其家属解释目的、方法、风险和注意事项,征得患者同意并签署知情同意书。
情绪稳定检查前饮食调整控制饮食禁食时间禁忌症与相对禁忌症禁忌症相对禁忌症放射性药物选择及注射方法药物选择注射方法放射性药物通常通过静脉注射的方式给予患者。
在注射过程中,需确保药物剂量准确、注射速度适中,并密切观察患者的反应。
03 PETCTChapter设备启动及预热使用专用固定装置对患者进行固定,以减少运动伪影。
调整床板高度和角度,使患者舒适且方便扫描。
根据检查部位和患者情况,选择合适体位,如仰卧位、俯卧位等。
患者体位摆放和固定扫描参数设置和调整010203图像采集和处理04 PETCTChapter1 2 3熟悉正常PETCT解剖结构识别生理性摄取区分生理性变异正常解剖结构和生理变异识别异常摄取识别病灶定位多模态融合显像030201异常病灶发现和定位通过测量病灶的标准化摄取值(SUV )等指标,评估其代谢活性。
代谢活性评估观察病灶的形态、大小、边缘等特征,辅助良恶性鉴别。
形态学特征分析综合考虑患者的临床病史、实验室检查结果等信息,提高诊断准确性。
临床病史和实验室检查结合良恶性病变鉴别诊断肿瘤分期评估根据PETCT显像结果,评估肿瘤的大小、浸润范围、淋巴结转移和远处转移情况,为临床制定治疗方案提供依据。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
正电子显像剂的一般性质量要求正电子显像剂有其本身的特殊性,即必须在严格的时间限制内完成生产和就地就近使用,而且在生产与应用之间没有足够时间进行目前认可的所有质量控制(QC)试验,不仅细菌学、内毒素检查是如此,某些化学质量检查也是如此。
正电子显像剂有两个特点,其一是因所用放射性核素的半衰期短,生产这些化合物时必须涉及高水平的放射性,以便最后能得到临床研究需要的有用数量,生产工序必须遥控。
其二,所研究的化合物极其微量,生产的绝大多数正电子显像剂不加载体,通常相当于近纳摩尔量级。
这在测定生理机能时具有不产生药效效应的优点。
因此,使用于质量控制的分析方法必须具有更低的探测下限。
在正电子显像剂这种特殊情况下,最终产品的质量控制受到时间的限制,对质量保证来讲,过程控制成为主要因素。
因此应建立单独而又严格的生产控制测量方法和程序。
例如在生产过程中,采用放射性高效液相色谱(HPLC)和放射性气相色谱(GC)等方法,无疑可以保证产品质量。
在线(Online)生产控制更有效的方法是连续监测合成中放射性的变化,这有可能在很早阶段就发现生产过程中的大多数问题。
生产工艺研究结束时以及随后工艺和物料来源的任何明显变化,都应通过对几批放射性显像剂的必要质量指标进行验证以进行全面的质量控制。
成分和原材料的质量管理是正电子显像剂质量保证的重要的过程控制。
这些原材料包括生产器具以及药物制品等所有成分。
每批原材料的一致性和质量必须得到保证并有证明文件。
经过“入口控制”后,该批产品必须作出标记并登记批号,且应备有关生产控制方式的证明文件,并制订试验记录和分析方法细则说明。
凡药典收载的成分,有详细的说明书就足够了。
如果试验方法药典未载明,则必须对其确认并被证实符合质量要求。
如果药典未载明而通常用作PET显像剂合成前体的原材料,必须以专题报告形式作出说明,包括名称、鉴定方法、纯度试验说明、稳定性和物理、化学性质。
在18F-FDG生产中,比较重要的原材料包括靶材料的纯度和丰度、三氟甘露糖的纯度、乙腈的纯度与含水量的高低以及其它化学试剂的质量,同时也包括靶室的清洁程度、反应器皿的清洁程度以及分离纯化材料的质量等,只有这些材料均合乎要求,才能生产出符号要求的18F-FDG。
任何满足短寿命放射性药物质量要求的体系,均取决于经过良好培训、具有经验的高素质人员,这就要求有一支在药物实践方面有经验的放射性药物化学专家或有经验的放射性药物专家,并要在短寿命放射性药物的专业化生产与分析方面进行培训。
18F-FDG国家暂行标准•本品为无载体的氟[18F]脱氧氧葡萄糖的无菌、无热原、等渗水溶液。
含18F的放射性浓度,按其标签上记载的时间,为标示量的-110%。
•性状:本品为无色澄明测试液体•鉴别:(1)取本品适量,用合适的仪器测量本品的半衰期(中国药典2000版二部附录XIII,半衰期测定法),其半衰期为105-115分钟之间。
•(2)取本品适量,照g谱仪法(中国药典2000牘二部附录XIII,g谱仪法)测量,其主要光子的能量应为和可能有的合成峰.•(3)取本品适量,照放射化学纯度项下的方法测量,在Rf值约为处有放射性主峰。
•检查:pH值:应为-(中国药典2000牘二部附录XIII,pH值测量法)•含氨基聚醚2.2.2()量对照溶液的配制精密称取氨基聚醚于50ml 烧杯,加热的二次蒸馏水溶解,次却后定量转移到250ml量瓶里,加水至刻度,摇匀即得含氨基聚醚量为的对照溶液.•工作曲线的绘制:精密量取对照溶液, 0.05.0.10,,,分别置于5ml容量瓶中,依次加入pH值为的柠檬酸一氢钠缓冲溶液(称取柠檬酸和氢氧化钠于烧杯,用50ml水溶解,以L的NaOH溶液和pH计调节pH值为,再稀释到250ml,摇匀,即可),含Pb2+500mg/ml的硝酸铅溶液(称取(NO3)2于烧杯中,加水溶解,转移到100ml容量瓶中,用水定容,摇匀,即可),加水到刻度,摇匀.照紫外分光光度法(中国药典2000年版二部附录IV A),在254nm波长处分别测定吸光度,绘制工作曲线,工作曲线相关系数不小于.•测量法:精密量取供试品溶液于5ml量瓶中,以下操作步骤同工作曲线的绘制.测定供试品的吸光度,根据工作曲线求出氨基聚醚量.本品每ml含氨基聚醚(2.2.2)量不超过25mg.•细菌内毒素:取本品适量,至少稀释6倍后,依中国药典2000年版二部附录XIE检查,本品每1ml含细菌内毒素量应小于15EU.•无菌:取本品适量,依中国药典2000年版二部附录XI H,无菌应符合规定.•其它:应符合注射剂项下有关规定(中国药典2000年版二部附录IB)•放射化学纯度取本品适量,以硅胶为固定相,以乙腈:水(85:5 V/V)为展开剂,按放射化学纯度测量第一法(中国药典2000年版二部附录藏XIII)测量,含氟[18F]脱氧氧葡萄糖放射化学纯度应不低于90%.•放射性浓度取本品适量,按中国药典2000年版二部附录XIII,放射性浓度测量法第一法,按标签上记载的时间,放射性浓度应不低370MBq/ml.•类别放射性诊断用药•规格•贮藏本品密封于30ml或10ml无菌瓶中,置于铅容器内.•有效期从标定时间开始计算为6小时.18F-FDG的质量指标18F-FDG是载于美国药典的第一个PET放射性药物,这里按照美国药典(1995年)制订的关于18F-FDG的质量要求,对18F-FDG的质量指标进行简要介绍。
①放射性核纯度核杂质来源:对于不同的18F生产方法,可能产生不同的杂质同位素。
以20Ne(d,α)18F反应生产的18F-F2的质量较高,可能的杂质同位素是寿命很短的钠和氖,在加工过程中会逐渐衰变,并在合成期间消失。
以18O-H2O为靶材料,通过18O(p,n)18F反应生产18F-F-,其放射性核纯度需要严格的控制,因18F-F-的质量不仅决定最终产品的核纯度,而且还影响亲核取代的反应性。
随着18O-H2O的丰度下降,通过16O(p,α)13N反应生成13N的量增加。
另外,来自靶窗箔膜和因箔膜材料改变产生的阳离子型放射性核素杂质也是较有影响的因素。
因此,建议用阴离子交换柱来固定吸附18F-F-。
核纯度的测定:有两种方法可以进行核纯度的鉴定。
其一是利用锗半导体多道γ谱仪测量法进行测定,其γ谱出现一个的主光电峰。
在检测中,可能出现一个的总峰,这取决于源的几何条件和探测器效率。
其二是半衰期测定法,即取一定剂量的18F-FDG溶液,测定其放射性活度,并记录测量时间,然后以一定的时间间隔进行连续测定5个半衰期内18F-FDG溶液的放射性活度,以时间为横坐标,放射性活度的对数为纵坐标作图,得到斜率k<0的直线,由此直线上的任何两点可计算得半衰期,并求得在t=0时的总放射性活度,与原始总放射性活度相比,从而求得18F的核纯度。
18F的核纯度大于%。
②化学纯度除了合成前体三氟甘露糖(Mannose triflate)和3.4.6-三乙酰-D-葡萄糖醛(TAG)的纯度影响最终18F-FDG的化学纯度外,合成方法和反应条件也显著影响18F-FDG的化学纯度。
因此在市场购买前体时,尽量选用色谱级试剂。
在氨基聚醚Kryptofix 2.2.2()催化法中,必须在最终产品中控制有机溶剂和的含量。
利用AG50树脂可以除去。
元素分析、质谱和色谱已用于测定极微水平的。
硅胶板-TLC法是目前分析最实用的方法,最低检出限量为ml,展开剂为甲醇-30%氨水(9:1 V/V)或%三乙胺甲醇溶液,用碘显色,并与50μg/mL标准的层析斑点比较,要求2-18F-FDG注射液所呈现斑点的大小及明暗度不能超过标准溶液。
在亲核或亲电取代法中会产生2-18F-FDG的差向异构体2-[18F]氟-2-脱氧-D-甘露糖(18F-FDM)(图)。
特别以亲电取代法产生2-18F-FDG时,所选择的底物、亲电氟化试剂、反应溶剂对2-18F-FDG和2-18F-FDM的构成比例有很大的影响。
表列举了以TAG为底物进行2-18F-FDG生产时亲电氟化试剂和反应溶剂对2-18F-FDG和2-18F-FDM的构成比例的影响。
1818亲电氟化试剂反应溶剂2-18F-FDG :2-18F-FDM18F-F2CH3COOH65 :3518F-F2CH3CN65 :3518F-CH3COOF CH3COOH27 :7518F-CH3COOF CH3CN30 :70利用纯的2-F-FDG和2-F-FDM进行PET脑显像,发现局部大脑的代谢率无差异,但是进行2-18F-FDG和2-18F-FDM比例的测定仍然是有必要的,并尽量使2-18F-FDM的比例低于5%。
HPLC法是进行2-18F-FDG化学纯度分析的最好方法,以85%乙腈水溶液为流动相,流速为1ml/min,层析柱为反相氨基柱,以视差检测器进行检测,要求化学纯度大于95%。
③放射化学纯度除含有2-18F-FDG外,可以通过放射分析方法来鉴定未反应的[18F]氟化物、部分乙酰化的[18F]氟-脱氧葡萄糖衍生物或[18F]氟标记化合物。
要求2-18F-FDG的放射化学纯度大于95%。
放射性-HPLC法:该法是快速而准确的方法,容易对放射性杂质进行有效的分离并进行定量测定。
测定时同样以85%乙腈水溶液为流动相,流速为1ml/min,层析柱为反相氨基柱,用放射性探测器进行检测,要求放射化学纯度大于95%。
但使用反相氨基柱,由于拖尾效应,2-18F-FDG与[18F]氟化物的分离不理想。
因此,在乙腈水溶液洗脱的反相氨基柱法中,为了起排代作用,在洗脱液中加入一定量的NaF,才能有效地将[18F]氟化物分离并从该柱上洗脱下来。
另外,也可用Dionex PA100阴离子交换柱,用L NaOH作为洗脱剂,该法能使[18F]氟化物、葡萄糖、2-18F-FDG以及部分水解的糖实现分离。
TLC法:取适量注射液和标准2-19F-FDG溶液分别点于硅胶薄层层析板上,用95%乙腈水溶液为展开剂进行展开,直到溶剂移到层析板长度的约3/4处,取出并干燥,然后用适当的放射性测定法测定放射性分布。
或在已展开的层析板上喷2N H2SO4溶液并在110℃下显色10min,以确定FDG的Rf值。
其2-18F-FDG的Rf值应与标准2-19F-FDG的Rf值一致,约为。
④比活度比活度(Specific activity)可以通过合成时引入合成系统的氟化物的量来确定。
用不加载体的18F-F-的亲核取代法进行18F-FDG合成时,比活度能达到270Ci/μmol。
在亲电取代合成的情况下,靶气体中的载体氟将会限制比活度,而此时比活度是靶气体中氟的浓度、靶体积和靶气体压力的函数。
载体量依靶设计参数而定,通常可能在~之间变化,在这样的条件下,可能得到的比活度在20~400GBq/mmol(~8Ci/mmol)之间变化,这时18F-FDG所含葡萄糖量在100~300μmol范围。
