有机化合物波谱分析(课堂PPT)
合集下载
有机化合物波谱分析_ppt课件

二. 弯曲振动(变形振动,变角振动)
弯曲振动:指键角发生周期性变化,而键长不变的振动。
包括面内弯曲振动、面外弯曲和变形振动。
面内弯曲振动β:包括剪式振动和面内摇摆。
剪式振动δ
面内摇摆ρ
面外弯曲γ:包括面外摇摆和蜷曲。
面外摇摆ω
蜷曲τ
变形振动δ :包括对称变形振动和不对称变形振动。
对称的变形振动δs
可 见 光 红 外 光
波 长 引 起 分 子 振 动 和 转 动 状 态 变 化 引 起 单 电 子 自 旋 改 变 长
波 谱 区
微 波
无 线 电 波引 起 磁 性 核 的 自 旋 改 变
有机化学四大谱
1. 红外光谱 (IR) (Infrared Spectroscopy) 2. 紫外光谱 (UV) (Ultraviolet Spectroscopy) 3. 核磁共振谱 (NMR)
鉴定化合物结构:根据红外吸收曲线的峰位、峰强以及峰
形判断化合物的官能团,确定化合物类别。 红外光谱产生必要条件
分子在振、转过程中的净偶极矩的变化不为0,即分子产生
红外活性振动过程中: Δμ ≠ 0
8.1.1 分子的振动和红外光谱
8.1.1.1 振动方程式
1 v = 振 动 2 π
√ √
1 1 1 K = + K m m 2 μ 2 1 π
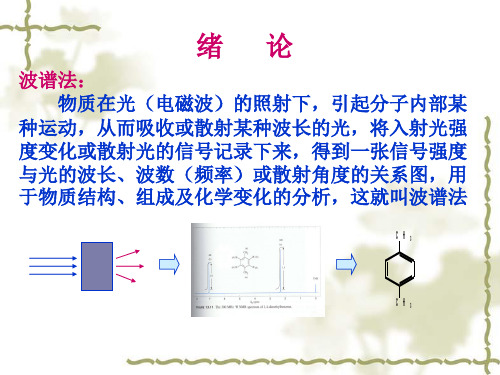
不同能量的电磁波能引起物质不同运动状态的变化,促 使一定能态的基态跃迁至激发态,在连续的电磁波谱上出现 吸收信号。
高 能 辐 射 区
γ射 线 x射 线 紫 外 光
引 起 原 子 核 的 裂 变 使 内 层 电 子 逸 出 轨 道 引 起 原 子 和 分 子 外 层 价 电 子 跃 迁
有机化学有机化合物的波谱分析PPT课件

红外光谱是以波长λ或波数σ第为5横页/坐共8标0页,表示吸收峰的峰位;以透射比 T(以百分数表示,又称为透光率或透过率)为纵坐标,表示吸收强度。
5
7.2.1分子化学键的振动和红外光谱
1.振动方程式
可把双原子分子的振动近似地看成用弹簧连接着的两个小球的 简谐振动。根据Hooke定律可得其振动频率为:
分子化学键的振动是量子化的,其能级为:
式中: υ为振动量子数(0,1,2,…);h为Planck常量;ν振为化学 键的振动频率。
第8页/共80页
8
分子由基态υ =0跃迁到激发态υ =1时吸收光的能量为:
第9页/共80页
9
分子振动频率习惯以σ表示,由(7–2)式、(7–3)式和(7–5)式得:
红外吸收峰的峰位(σ)取决于键的力常数,以及键两端所连原子的 质量m1和m2,即取决于化合物分子的结构。这是红外光谱用来测 定化合物结构的理论依据。
n≥4在 725~720 处有吸 收。
32
1300 cm-1以下区域的光谱:715 cm-1处的面外弯曲振动吸收,表明 烯烃为顺式构型。
综合以上分析,有双键吸收,无三键及甲基吸收,另一不饱 和≥4在 725~720 处有吸 收。
33
7.3核磁共振谱(NMR)
这样对测定有机化合物结构毫无意义。但实验证明,在相同频 率照射下,化学环境不同的质子在不同的磁场强度处出现吸收峰。
第20页/共80页
20
3.鉴定已知化合物
用被测物的标准试样与被测物在相同条件下测定红外光谱,若 吸收峰位置、强度和形状完全相同,可认为是同一种物质(对映异 构体除外)。若无标准试样而有标准谱图,可查阅标准谱图。
查阅时应注意被测物与标准谱图所用试样的状态、制样方法、 所用仪器的分辨率等是否相同。
5
7.2.1分子化学键的振动和红外光谱
1.振动方程式
可把双原子分子的振动近似地看成用弹簧连接着的两个小球的 简谐振动。根据Hooke定律可得其振动频率为:
分子化学键的振动是量子化的,其能级为:
式中: υ为振动量子数(0,1,2,…);h为Planck常量;ν振为化学 键的振动频率。
第8页/共80页
8
分子由基态υ =0跃迁到激发态υ =1时吸收光的能量为:
第9页/共80页
9
分子振动频率习惯以σ表示,由(7–2)式、(7–3)式和(7–5)式得:
红外吸收峰的峰位(σ)取决于键的力常数,以及键两端所连原子的 质量m1和m2,即取决于化合物分子的结构。这是红外光谱用来测 定化合物结构的理论依据。
n≥4在 725~720 处有吸 收。
32
1300 cm-1以下区域的光谱:715 cm-1处的面外弯曲振动吸收,表明 烯烃为顺式构型。
综合以上分析,有双键吸收,无三键及甲基吸收,另一不饱 和≥4在 725~720 处有吸 收。
33
7.3核磁共振谱(NMR)
这样对测定有机化合物结构毫无意义。但实验证明,在相同频 率照射下,化学环境不同的质子在不同的磁场强度处出现吸收峰。
第20页/共80页
20
3.鉴定已知化合物
用被测物的标准试样与被测物在相同条件下测定红外光谱,若 吸收峰位置、强度和形状完全相同,可认为是同一种物质(对映异 构体除外)。若无标准试样而有标准谱图,可查阅标准谱图。
查阅时应注意被测物与标准谱图所用试样的状态、制样方法、 所用仪器的分辨率等是否相同。
《有机波谱分析》PPT课件

不对称伸缩振动(vas) 精选课件ppt (2926 cm-1)
5
(2)弯曲振动:
+
+
+ +
C
C
C
C
剪式振动(δs)
面内摇摆振动(ρ) 面外摇摆振动(ω)
扭式振动(τ)
面内
面外 弯曲振动只改变键角,不改变键长
值得注意的是:不是所有的振动都能引起红外吸收,
只有偶极矩(μ)发生变化的,才能有红外吸收。
X-H 伸缩振动吸收范围。X代表O、N、C、S, 对应醇、酚、羧酸、胺、亚胺、炔烃、烯烃、芳烃 及饱和烃类的 O-H、N-H、C-H 伸缩振动。
1. O-H 醇与酚:游离态--3640~3610cm-1,峰形尖锐。
缔合--精3选30课0件cpmpt -1附近,峰形宽而钝 11
羧酸:3300~2500cm-1,中心约3000cm-1,谱带宽
2 . N-H
胺类: 游离——3500~3300cm-1
缔合——吸收位置降低约100cm-1 伯胺:3500,3400cm-1,(吸收强度比羟基弱) 仲胺:3400cm-1(吸收峰比羟基要尖锐) 叔胺:无吸收
酰胺:伯酰胺:3350,3150cm-1 附近出现双峰
仲酰胺:3200cm-1 附近出现一条谱带
第三章 红外光谱
3.1 基本原理
3.1.1波长和波数
电磁波的波长( )、频率( v)、能量(E)之间的关系:
精选课件ppt
1
3.1.2 近红外、中红外和远红外
波段名称 近红外 中红外 远红外
波长 μ 0.75—2.5 2.5-25
25-1000
波数(cm-1) 13300-4000 4000-400
有机化合物波谱解析(1)96页PPT
即: E=Ee+Ev+Er ΔΕe>ΔΕv>ΔΕr
能级跃迁
电子能级间跃 迁的同时,总伴随 有振动和转动能级 间的跃迁。即电子 光谱中总包含有振 动能级和转动能级 间跃迁产生的若干 谱线而呈现宽谱带 。
讨论:
(1) 转动能级间的能量差ΔΕr:0.005~0.050eV,跃迁
最后确定为A
杜鹃酮最后确定结果为A(先后经历了30多年之久!!!)
发展
微量
通常 mg级,甚至g、pg级
快速
复杂化合物仅需几天甚至更少
计算机化 利用计算机快速信息存贮和分析运算功能,
结合波谱仪快速扫描,可进行快速检测而进
行以前难以研究的领域如动力学研究、反应
机理、药物代谢等。
色谱-波谱 如气相色谱、液相色谱联用,充分发挥各自
• R.M. Silverstein, et.al., “Spectrometric Identification of Organic Compounds”, 6th ed., Jhon Wiley & Sons, 2019
第一章 紫外吸收光谱分析法
ultraviolet spectrometry, UV
联用
优势,可以在一次测定中完成一个样品中二
三百个化合物的分离与测定。
课程简介
课时
40学时
考核
期末考试 70%
平时成绩 30%
(包括出勤、课堂表现、小作业等)
主要章节 1. 紫外
2. 红外光谱
3. 质谱
4. 核磁共振(H谱、C谱、二维谱)
5. 波谱综合解析
教材 《有机化合物波谱解析》
姚新生主编,医药卫生出版社
波长范围:1-800 nm.
能级跃迁
电子能级间跃 迁的同时,总伴随 有振动和转动能级 间的跃迁。即电子 光谱中总包含有振 动能级和转动能级 间跃迁产生的若干 谱线而呈现宽谱带 。
讨论:
(1) 转动能级间的能量差ΔΕr:0.005~0.050eV,跃迁
最后确定为A
杜鹃酮最后确定结果为A(先后经历了30多年之久!!!)
发展
微量
通常 mg级,甚至g、pg级
快速
复杂化合物仅需几天甚至更少
计算机化 利用计算机快速信息存贮和分析运算功能,
结合波谱仪快速扫描,可进行快速检测而进
行以前难以研究的领域如动力学研究、反应
机理、药物代谢等。
色谱-波谱 如气相色谱、液相色谱联用,充分发挥各自
• R.M. Silverstein, et.al., “Spectrometric Identification of Organic Compounds”, 6th ed., Jhon Wiley & Sons, 2019
第一章 紫外吸收光谱分析法
ultraviolet spectrometry, UV
联用
优势,可以在一次测定中完成一个样品中二
三百个化合物的分离与测定。
课程简介
课时
40学时
考核
期末考试 70%
平时成绩 30%
(包括出勤、课堂表现、小作业等)
主要章节 1. 紫外
2. 红外光谱
3. 质谱
4. 核磁共振(H谱、C谱、二维谱)
5. 波谱综合解析
教材 《有机化合物波谱解析》
姚新生主编,医药卫生出版社
波长范围:1-800 nm.
有机化学课件7波谱分析

可以跃迁的电子有:电子, 电子和n电子。 跃迁的类型有: *, n *, *, n *。各类电子跃迁的能量大小见下图:
既然一般的紫外光谱是指近紫外区,即 200-400nm,
那么就只能观察 *和 n *跃迁。也就是说紫
外光谱只适用于分析分子中具有不饱和结构的化合物。
乙炔碳是SP杂化,电负较
大,为什么化学位移这么小?
δ1.8
2
PPM
1
0
电子的各向异性效应:屏蔽效应
例3:
H感
H
δ :2.5
炔氢感受 到的是屏 蔽效应, 核磁信号 在较高场 出现!
1HNMR
of CH≡CH
H H0
H感
2 PPM 1 0
电子的各向异性效应:屏蔽效应与去屏蔽效应并存
H H H
例4:
γh
2π
H0 ,
即:υ= 2π H0
γ
(无线电射频的频率必须与外加磁场的强度相匹配) 例:当H0=14100Gs时,
核磁共振的外在表现
0
60MHz
当υ=60MHz时,
有机物中质子 裸露质子 0 14100Gs
H0(扫场)
二 核磁共振信号的位移现象(有机分子中质子) 1. 屏蔽效应(shielding effect):
外加磁场H0
δ: 7.3
7 6 5 4 PPM 3
H H
H
2
1
0
去屏蔽效应使核磁信号向低场移动。
电子的各向异性效应:去屏蔽效应
例2: CH3CH3
δ:0.86
δ: 5.3
H C H
H感 H
C H
2
PPM
1
0
有机化合物解析波普PPT课件

(3)在常温下,分子处于最低的振动能级,化学键振动 与简谐振动模型非常近似。由于通常的红外光谱主要பைடு நூலகம் 论从基态跃迁到第一激发态或从基态跃迁到第二激发态 引起的吸收。因此,可以用谐振子运动规律近似地讨论 化学键的振动。
(4)因振动量子数越大,振幅也随之加宽,故势能曲线 的能级间隔将越来越小。
(5)振幅超过一定值,化学键断裂,分子离解,势能曲 线趋于一条水平线,这时的势能就等于离解能。
第65页/共110页
羰基峰位的计算方法
第66页/共110页
第67页/共110页
第68页/共110页
第69页/共110页
(七)C-H弯曲振动区(面内) (1475~1300cm-1) X-Y
说明:
偕二甲基双峰强度相当,裂距15~30cm-1以上。(振动 偶合)
偕三甲基双峰一强一弱,裂距30cm-1以上。
第56页/共110页
(三)饱和烃的C-H和醛基C-H伸 缩振动区(3000~2700cm-1)
第57页/共110页
第58页/共110页
第59页/共110页
说明:
1、烷烃的υC-H均在3000cm-1以下。原因? 2、-CH3、-CH2均表现为双峰,其中,高频端
υas ,低频为υs, -CH的υC-H为单峰。 3、醛基上的C-H在2820、2720处有两个吸收峰,
第16页/共110页
三、分子的偶极矩与峰强
• (一)峰强的表示方法
红外光谱用百分透光率(T)表示峰强 T%=I/I0×100% 也可用摩尔吸光系数表示:εa=1/c×L*lg(T0/T) εa大于100时,示峰带很强(vs) εa 等于20~100,为强峰(v) εa 等于10~20,为中强峰(m) εa小于1时,峰很弱(vw)
(4)因振动量子数越大,振幅也随之加宽,故势能曲线 的能级间隔将越来越小。
(5)振幅超过一定值,化学键断裂,分子离解,势能曲 线趋于一条水平线,这时的势能就等于离解能。
第65页/共110页
羰基峰位的计算方法
第66页/共110页
第67页/共110页
第68页/共110页
第69页/共110页
(七)C-H弯曲振动区(面内) (1475~1300cm-1) X-Y
说明:
偕二甲基双峰强度相当,裂距15~30cm-1以上。(振动 偶合)
偕三甲基双峰一强一弱,裂距30cm-1以上。
第56页/共110页
(三)饱和烃的C-H和醛基C-H伸 缩振动区(3000~2700cm-1)
第57页/共110页
第58页/共110页
第59页/共110页
说明:
1、烷烃的υC-H均在3000cm-1以下。原因? 2、-CH3、-CH2均表现为双峰,其中,高频端
υas ,低频为υs, -CH的υC-H为单峰。 3、醛基上的C-H在2820、2720处有两个吸收峰,
第16页/共110页
三、分子的偶极矩与峰强
• (一)峰强的表示方法
红外光谱用百分透光率(T)表示峰强 T%=I/I0×100% 也可用摩尔吸光系数表示:εa=1/c×L*lg(T0/T) εa大于100时,示峰带很强(vs) εa 等于20~100,为强峰(v) εa 等于10~20,为中强峰(m) εa小于1时,峰很弱(vw)
有机化学课件-波谱分析

995~985,915~905(单 取代烯) 980~960(反式二取代烯) 690(顺式二取代烯) 910~890(同碳二取代烯) 840~790(三取代烯)
C H 面外 弯曲振动
660~630(末端炔烃)
烷烃:C—H伸缩振动 2940 cm-1和 2860 cm-1,C—H 面内
弯曲1460(不对称)和1380 cm-1 (对称), -(CH2)n- (n>=4)一般在 720 cm-1处有特征峰(弱)
第八章 有机化合物的波谱分析
1.分子吸收光谱和分子结构 2.红外吸收光谱 3.核磁共振谱
第八章
1.紫外光谱(UV) 2.红外光谱(IR)
有机化合物的波谱分析
3.核磁共振谱(NMR ) 4.质谱(MS)
有机化学中应用最广泛的四大波谱:
一、分子的吸收光谱和分子结构 E= hν= hc/λ ν= c/λ 1/λ=σ E 代表光子的能量,单位为J; h planck 常数 6.63x10-34J•S
TMS:四甲基硅烷
低场
屏蔽效应大,共振信号在高场,
CH3
吸收峰为单峰,化学惰性。
TMS 化学位移定为0 ppm 高场
10
9
8பைடு நூலகம்
7
6
5
4
3
2
1
零 点
-1
-2
-3
TMS
三、核磁共振谱
3. 影响化学位移的因素
(1). 电负性的影响 电负性较大的吸电子基团,使与之相连的碳上的质子周围 电子云密度降低,屏蔽作用弱,共振信号→低场(位移增大)
1
0
一张NMR谱图,通常可以给出四种重要的结构信息:化学位 移、自旋裂分、偶合常数和峰面积(积分线) 峰面积大小与质子数成正比,可由阶梯式积分曲线高度求出。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
23
不同能量的电磁波能引起物质不同运动状态的变化,促 使一定能态的基态跃迁至激发态,在连续的电磁波谱上出现 吸收信号。
3
高能辐射区 光学光谱区
γ 射线 x 射线 紫外光 可见光 红外光
引起原子核的裂变
短
使内层电子逸出轨道
引起原子和分子外层价电子跃迁 引起分子振动和转动状态变化
波长
波谱区
微波 引起单电子自旋改变烯Βιβλιοθήκη 类型各类烯烃的特征吸收位置表
v=C–H/cm-1
vC=C/cm-1
RHC=CH2 R1R2C=CH2 R1HC=CHR2(Z)
3100~3000(m) 3100~3000(m) 3100~3000(m)
R1HC=CHR2(E) 3100~3000(m)
R1R2C=CHR3
3100~3000(m)
面外弯曲γ:包括面外摇摆和蜷曲。 面外摇摆ω
蜷曲τ
14
变形振动δ :包括对称变形振动和不对称变形振动。 对称的变形振动δs
不对称的变形振动δas
15
8.1.2 烃类化合物的IR谱图解析
8.1.2.1 烷烃
烷烃的IR谱应关注三个吸收段的情况: (1) C–H伸缩振动(vC–H):3000~2800cm-1;
形判断化合物的官能团,确定化合物类别。 红外光谱产生必要条件 分子在振、转过程中的净偶极矩的变化不为0,即分子产生
红外活性振动过程中:
Δμ ≠ 0
8
8.1.1 分子的振动和红外光谱
8.1.1.1 振动方程式
√ √ 1
v振 动 =2 π
μ K=2 1 π Km 11+m 12
√ 1
σ=2πc
K
m 11+
伸缩振动分类:不对称伸缩、对称伸缩。
(1) 对称伸缩振动vs
(2) 不 对 称 伸 缩 振 动 vas
12
二. 弯曲振动(变形振动,变角振动) 弯曲振动:指键角发生周期性变化,而键长不变的振动。
包括面内弯曲振动、面外弯曲和变形振动。 面内弯曲振动β:包括剪式振动和面内摇摆。
剪式振动δ
面内摇摆ρ
13
vC–H > vC–C > vC–O
10
用波数(σ)或波长(λ)为横坐标,用透光率(Transmittance,T%) 为纵坐标作图,可得到红外吸收光谱图。
11
8.1.1.2 分子振动类型
分子中键的振动分类:伸缩振动、弯曲振动。 一. 伸缩振动v
伸缩振动:键长沿键轴方向发生周期性变化的振动。它们所 产生的吸收带在高波数一端。
4. 质谱 (MS) (Mass Spectroscopy)
正离子质量谱
5
有机化合物结构研究方法
元素分析 —— 元素组成 质谱 (MS) —— 分子量及部分结构信息 红外光谱 (IR) —— 官能团种类 紫外−可见光谱 (UV / Vis) —— 共轭结构 核磁共振波谱 (NMR) —— C–H骨架及所处化学环境 X-射线单晶衍射 —— 立体结构
CH3
对称变形(δs) :~1380cm-1(s)
CH2剪切(δ):~1460cm-1(s)
(3) CH2平面摇摆(ρ):780~720cm-1(m) 。 (CH2)n,n≥4时,~720cm-1
17
18
CH3(CH2)6CH3
19
(4) –CH(CH3)2中CH3的对称变形振动(δs):
~1385cm-1(m) ~1370cm-1(m)
R1R2C=CR3R4
1645(m) 1653(m) 1650(m~w) 1675(w~n) 1680(m~w) 1670(w~n)
ω=C–H/cm-1 995~985(s) 910~905(s) 895~885(s) 730~650(m, b) 980~965(s) 840~790(s)
22
C H 3(C H 2)4C HC H 2
无线电波 引起磁性核的自旋改变
长
4
有机化学四大谱
1. 红外光谱 (IR) (Infrared Spectroscopy)
分 子
2. 紫外光谱 (UV) (Ultraviolet Spectroscopy)
吸 收
3. 核磁共振谱 (NMR)
光 谱
(Nuclear Magnetic Resonance Spectroscopy)
1 m2
c:光速, μ:原子的折合质量,
K:键的力常数
谐振子,简谐振动
9
√ 1
σ=2πc
K
m 11+
1 m2
由振动公式可知,力常数K相当于键的强度,随着键能的增 加,IR谱在高波数(高能)一端具有吸收带。例:
vC≡C > vC=C > vC–C vO–H > vN–H > vC–H
IR谱的吸收位置除与键的力常数K有关外,还与键两端的原 子质量(m1、m2)有关,与质量大的原子结合在一起,IR谱吸收 位置处于低波数一端。例:
不对称(as):~2960cm-1(s) CH3 对称(s):~2870cm-1(s) vC–H
不对称:~2920cm-1(s) CH2 对称:~2850cm-1(s)
16
(2) C–H弯曲振动(δC–H):1350~1490cm-1,包括CH3变形和 CH2剪切;
δC–H
不对称变形(δas):~1460cm-1(m)
有机化合物波谱分析
1
电磁辐射(电磁波,光):以巨大速度通过空间、不需要任何 物质作为传播媒介的一种能量。
电磁辐射的性质:具有波、粒二象性:
光的能量
E = hv
普朗克常数 光的频率
v=
c λ
= cσ
波长
波数
2
电磁波谱:电磁辐射按波长顺序排列,称为电磁波谱。 γ射线→x射线→紫外光→可见光→红外光→微波→无线电波
6
7
红外光谱 (Infrared Spectroscopy,IR) 的产生 分子振动和转动所吸收能量而产生的光谱称为红外光谱,
又称为分子振转光谱。 红外光谱 (中红外) 的能量吸收范围 λ:2.5~25μm (σ:4000~400cm-1) 红外光谱的应用 鉴定化合物结构:根据红外吸收曲线的峰位、峰强以及峰
对称双峰 (裂距小)
CH3C C CHCH3 CH3CH3 CH3
20
(5) –C(CH3)3中CH3的对称变形振动:
~1395cm-1(m) ~1370cm-1(s)
不对称双峰 (裂距大)
CH3 CH3 C CH2CH2CH3
CH3
21
8.1.2.2 烯烃
烯 烃 主 要 有 =C–H伸 缩 振 动 (v=C–H)、 C=C 伸 缩 振 动 (vC=C)和 =C–H弯曲振动(ω=C–H)三类吸收段。
不同能量的电磁波能引起物质不同运动状态的变化,促 使一定能态的基态跃迁至激发态,在连续的电磁波谱上出现 吸收信号。
3
高能辐射区 光学光谱区
γ 射线 x 射线 紫外光 可见光 红外光
引起原子核的裂变
短
使内层电子逸出轨道
引起原子和分子外层价电子跃迁 引起分子振动和转动状态变化
波长
波谱区
微波 引起单电子自旋改变烯Βιβλιοθήκη 类型各类烯烃的特征吸收位置表
v=C–H/cm-1
vC=C/cm-1
RHC=CH2 R1R2C=CH2 R1HC=CHR2(Z)
3100~3000(m) 3100~3000(m) 3100~3000(m)
R1HC=CHR2(E) 3100~3000(m)
R1R2C=CHR3
3100~3000(m)
面外弯曲γ:包括面外摇摆和蜷曲。 面外摇摆ω
蜷曲τ
14
变形振动δ :包括对称变形振动和不对称变形振动。 对称的变形振动δs
不对称的变形振动δas
15
8.1.2 烃类化合物的IR谱图解析
8.1.2.1 烷烃
烷烃的IR谱应关注三个吸收段的情况: (1) C–H伸缩振动(vC–H):3000~2800cm-1;
形判断化合物的官能团,确定化合物类别。 红外光谱产生必要条件 分子在振、转过程中的净偶极矩的变化不为0,即分子产生
红外活性振动过程中:
Δμ ≠ 0
8
8.1.1 分子的振动和红外光谱
8.1.1.1 振动方程式
√ √ 1
v振 动 =2 π
μ K=2 1 π Km 11+m 12
√ 1
σ=2πc
K
m 11+
伸缩振动分类:不对称伸缩、对称伸缩。
(1) 对称伸缩振动vs
(2) 不 对 称 伸 缩 振 动 vas
12
二. 弯曲振动(变形振动,变角振动) 弯曲振动:指键角发生周期性变化,而键长不变的振动。
包括面内弯曲振动、面外弯曲和变形振动。 面内弯曲振动β:包括剪式振动和面内摇摆。
剪式振动δ
面内摇摆ρ
13
vC–H > vC–C > vC–O
10
用波数(σ)或波长(λ)为横坐标,用透光率(Transmittance,T%) 为纵坐标作图,可得到红外吸收光谱图。
11
8.1.1.2 分子振动类型
分子中键的振动分类:伸缩振动、弯曲振动。 一. 伸缩振动v
伸缩振动:键长沿键轴方向发生周期性变化的振动。它们所 产生的吸收带在高波数一端。
4. 质谱 (MS) (Mass Spectroscopy)
正离子质量谱
5
有机化合物结构研究方法
元素分析 —— 元素组成 质谱 (MS) —— 分子量及部分结构信息 红外光谱 (IR) —— 官能团种类 紫外−可见光谱 (UV / Vis) —— 共轭结构 核磁共振波谱 (NMR) —— C–H骨架及所处化学环境 X-射线单晶衍射 —— 立体结构
CH3
对称变形(δs) :~1380cm-1(s)
CH2剪切(δ):~1460cm-1(s)
(3) CH2平面摇摆(ρ):780~720cm-1(m) 。 (CH2)n,n≥4时,~720cm-1
17
18
CH3(CH2)6CH3
19
(4) –CH(CH3)2中CH3的对称变形振动(δs):
~1385cm-1(m) ~1370cm-1(m)
R1R2C=CR3R4
1645(m) 1653(m) 1650(m~w) 1675(w~n) 1680(m~w) 1670(w~n)
ω=C–H/cm-1 995~985(s) 910~905(s) 895~885(s) 730~650(m, b) 980~965(s) 840~790(s)
22
C H 3(C H 2)4C HC H 2
无线电波 引起磁性核的自旋改变
长
4
有机化学四大谱
1. 红外光谱 (IR) (Infrared Spectroscopy)
分 子
2. 紫外光谱 (UV) (Ultraviolet Spectroscopy)
吸 收
3. 核磁共振谱 (NMR)
光 谱
(Nuclear Magnetic Resonance Spectroscopy)
1 m2
c:光速, μ:原子的折合质量,
K:键的力常数
谐振子,简谐振动
9
√ 1
σ=2πc
K
m 11+
1 m2
由振动公式可知,力常数K相当于键的强度,随着键能的增 加,IR谱在高波数(高能)一端具有吸收带。例:
vC≡C > vC=C > vC–C vO–H > vN–H > vC–H
IR谱的吸收位置除与键的力常数K有关外,还与键两端的原 子质量(m1、m2)有关,与质量大的原子结合在一起,IR谱吸收 位置处于低波数一端。例:
不对称(as):~2960cm-1(s) CH3 对称(s):~2870cm-1(s) vC–H
不对称:~2920cm-1(s) CH2 对称:~2850cm-1(s)
16
(2) C–H弯曲振动(δC–H):1350~1490cm-1,包括CH3变形和 CH2剪切;
δC–H
不对称变形(δas):~1460cm-1(m)
有机化合物波谱分析
1
电磁辐射(电磁波,光):以巨大速度通过空间、不需要任何 物质作为传播媒介的一种能量。
电磁辐射的性质:具有波、粒二象性:
光的能量
E = hv
普朗克常数 光的频率
v=
c λ
= cσ
波长
波数
2
电磁波谱:电磁辐射按波长顺序排列,称为电磁波谱。 γ射线→x射线→紫外光→可见光→红外光→微波→无线电波
6
7
红外光谱 (Infrared Spectroscopy,IR) 的产生 分子振动和转动所吸收能量而产生的光谱称为红外光谱,
又称为分子振转光谱。 红外光谱 (中红外) 的能量吸收范围 λ:2.5~25μm (σ:4000~400cm-1) 红外光谱的应用 鉴定化合物结构:根据红外吸收曲线的峰位、峰强以及峰
对称双峰 (裂距小)
CH3C C CHCH3 CH3CH3 CH3
20
(5) –C(CH3)3中CH3的对称变形振动:
~1395cm-1(m) ~1370cm-1(s)
不对称双峰 (裂距大)
CH3 CH3 C CH2CH2CH3
CH3
21
8.1.2.2 烯烃
烯 烃 主 要 有 =C–H伸 缩 振 动 (v=C–H)、 C=C 伸 缩 振 动 (vC=C)和 =C–H弯曲振动(ω=C–H)三类吸收段。
