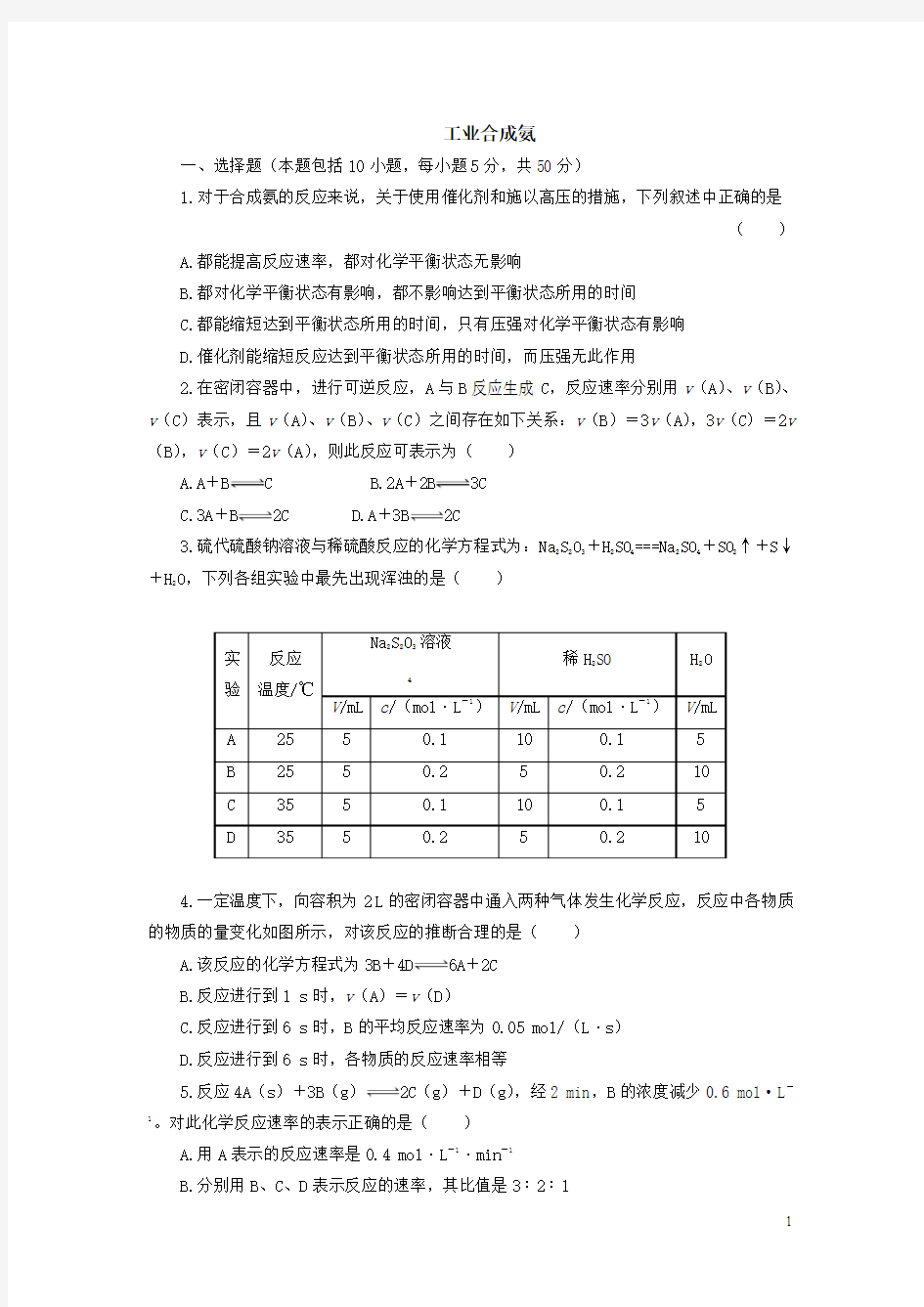
高三化学工业合成氨专题练习
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
工业合成氨
一、选择题(本题包括10小题,每小题5分,共50分)
1.对于合成氨的反应来说,关于使用催化剂和施以高压的措施,下列叙述中正确的是
()
A.都能提高反应速率,都对化学平衡状态无影响
B.都对化学平衡状态有影响,都不影响达到平衡状态所用的时间
C.都能缩短达到平衡状态所用的时间,只有压强对化学平衡状态有影响
D.催化剂能缩短反应达到平衡状态所用的时间,而压强无此作用
2.在密闭容器中,进行可逆反应,A与B反应生成C,反应速率分别用v(A)、v(B)、v(C)表示,且v(A)、v(B)、v(C)之间存在如下关系:v(B)=3v(A),3v(C)=2v (B),v(C)=2v(A),则此反应可表示为()
A.A+B C
B.2A+
2B3C
C.3A+B2C
D.A+3B2C
3.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na
2S
2
O
3
+H
2
SO
4
===Na
2
SO
4
+SO
2
↑+S↓
+H
2
O,下列各组实验中最先出现浑浊的是()
4.一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是()
A.该反应的化学方程式为3B+4D6A+2C
B.反应进行到1 s时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D.反应进行到6 s时,各物质的反应速率相等
5.反应4A(s)+3B(g)2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1。对此化学反应速率的表示正确的是()
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示反应的速率,其比值是3∶2∶1
C.在2 min 末的反应速率,用B 表示是0.3 mol·L -1·min -1
D.在这2 min 内B 和C 两物质浓度都是逐渐减小的
6.把在空气中久置的铝片5.0 g 投入盛有500 mL 0.5 mol ·L -1硫酸
溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v 与反应时间t 可用如右的坐标曲线来表示:下列推论错误的是( )
A.O →a 段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液
B.b →c 段产生氢气的速率增加较快的主要原因之一是温度升高
C.t =c 时反应处平衡状态
D.t >c 产生氢气的速率降低主要是因为溶液中c (H +
)降低 7.下图表示反应N 2(g )+3H 2(g )
2NH 3(g );ΔH <0在某一时间段中反应速率与
反应过程的曲线关系图。下列说法正确的是( )
A.氨气的体积分数最高的一段时间为t 5~t 6
B.t 2~t 3和t 3~t 4时间段氨气的体积分数相等
C.t 1时刻改变的条件是降低温度
D.t 4~t 5时间段平衡向正反应方向移动
8.E 是非金属性最强的元素,M 是E 的气态氢化物,在固定体积
的密闭容器中,气体M 存在如下关系:
x M (g )M x (g ),反应物和生成物的物质的量随时间的变化
关系如右图。下列说法正确的是( )
A.该反应的化学方程式是2HF
(HF )2
B.平衡时混合气体的平均摩尔质量是33.3
C.t 1时刻,保持温度不变,再充入1 mol M ,重新达到平衡时,c (M x )
c (M )
将增大
D.减小M x 的浓度,正反应速率加快
9.实验测得某反应在不同pH 下产物A 的浓度随时间变化的关系如图(其他条件相同)。则下列有关说法正确的是( )
A.若增大压强,该反应的反应速率一定增大
B.pH =6.8时,随着反应的进行反应速率逐渐增大
C.一定pH 范围内,溶液中H +
浓度越小,反应速率越快 D.可采用调节pH 的方法使反应停止
10.合成氨工业对国民经济和社会发展具有重要的意义。对于密
闭容器中的反应:N 2(g )+3H 2(g )
2NH 3(g )(正反应为放热
反应),673 K 、30 MPa 下,n (NH 3)和n (H 2)随时间t 变化的关系示意图如图所示。下列叙述中正确的是( )
A.c 点处正反应速率和逆反应速率相等
B.a 点处正反应速率比b 点处的大
C.d 点(t 1时刻)和e 点(t 2时刻)处n (N 2)不同
D.t 2点时刻,正反应速率大于逆反应速率
二、非选择题(本题包括4小题,共50分)
11.(12分)现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高。
(1)已知1 mol N 2(g )与适量H 2(g )完全反应,生成NH 3(g ),放出92.2 kJ 热量, 写出反应的热化学方程式:________________________________________________ ________________________________________________________________________。 (2)若该反应在298 K 、398 K 时的化学平衡常数分别为K 1、K 2,则K 1 K 2(填“>”“=”“<”)
(3)在一定温度下,向容积不变(始终为10 L )的密闭容器中加入2 mol N 2、8 mol H 2
及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为 ,用氮气表示的反应速率为 。
若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议:
________________________________________________________________________ _____________________________________________________________(任意写一条)。 (4)在上述相同条件下,若起始时加入4 mol NH 3、2 mol H 2及固体催化剂,反应达到平衡时 NH 3的体积分数比(3)中 (填“大”、“小”或“相等”)。
12.(16分)某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液
