基因敲除
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
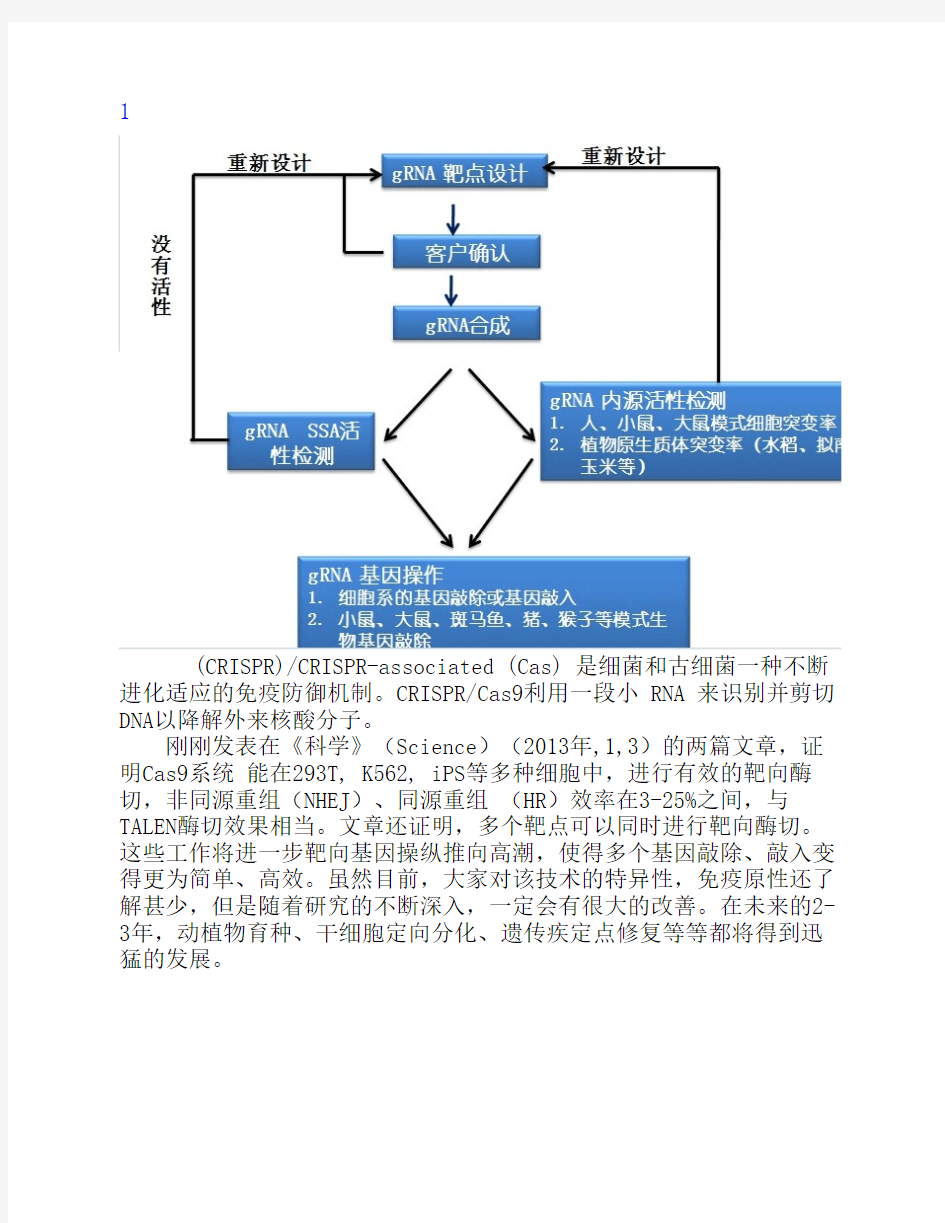
1
(CRISPR)/CRISPR-associated (Cas) 是细菌和古细菌一种不断进化适应的免疫防御机制。CRISPR/Cas9利用一段小 RNA 来识别并剪切DNA以降解外来核酸分子。
刚刚发表在《科学》(Science)(2013年,1,3)的两篇文章,证明Cas9系统 能在293T, K562, iPS等多种细胞中,进行有效的靶向酶切,非同源重组(NHEJ)、同源重组 (HR)效率在3-25%之间,与TALEN酶切效果相当。文章还证明,多个靶点可以同时进行靶向酶切。这些工作将进一步靶向基因操纵推向高潮,使得多个基因敲除、敲入变得更为简单、高效。虽然目前,大家对该技术的特异性,免疫原性还了解甚少,但是随着研究的不断深入,一定会有很大的改善。在未来的2-3年,动植物育种、干细胞定向分化、遗传疾定点修复等等都将得到迅猛的发展。
图1. RNA指导的CRISPR/Cas9基因剪切系统
唯尚立德已经利用CRISPR/Cas9在斑马鱼,哺乳动物细胞上成功实
现基因敲除和基因敲入,现推出如下技术服务:
1. 应用CRISPR /Cas9提供稳定细胞系靶向基因敲除、敲入技术服
务;
2. 应用CRISPR /Cas9提供模式生物靶向基因技术服务,包括小
鼠,大鼠,斑马鱼等;
近几十年来,随着全基因组测序技术的不断成熟,我们在各种
细菌和古细菌(archaea)中也陆续发现了很多成簇的、规律间隔的短
回文重复序列
(clustered regularly interspaced short palindromic repeat sequences,即CRISPR序列,这就是二十多年前日本科学家发现的那个序列)和
CRISPR相关基因(CRISPR-associated genes, Cas gene)。研究发
现,这些CRISPR序列与很多病毒或者质粒的DNA序列是互补的,说明这
套CRISPR–Cas系统很有可能是生物体抵御病毒等外来入侵者的一套特
异性防御机制,就好像是另外一套适应性免疫反应系统
(adaptive immune system)。后续的遗传学试验和生物化学试验也证
实了这种猜测。
虽然有很多CRISPR–Cas系统需要多种蛋白的参与,但是在很多细菌的
胞内都只需要一种内切酶(endonuclease)——Cas9就足够了,我们将
这种CRISPR–Cas系统也称作2型系统(type II systems),如图1所
示。Cas9内切酶在向导RNA的指引下能够对各种入侵的外源DNA分子进行
定点切割,不过主要识别的还是保守的间隔相邻基序(proto-
spacer adjacent motifs,PAM基序)。如果要形成一个有功能的DNA切
割复合体,还需要另外两个RNA分子的帮助,它们就是
CRISPR RNA (crRNA)和反式作用CRISPR RNA(trans -
acting CRISPR RNA, tracrRNA)。不过最近有研究发现,这两种RNA可
以被“改装”成一个向导RNA(single-guide RNA, sgRNA)。这个
sgRNA足以帮助Cas9内切酶对DNA进行定点切割。最新的报道称,在多种
类型的细胞和生物体内,这种RNA介导的Cas9酶切作用能够正常地行使
功能,在完整基因组上的特定位点完成切割反应。这样就可以方便地进
行后续的基因组改造工作了。细胞通常会通过两种方式对发生双链断裂的DNA进行修复,这两种方式分别是同源重组修复机制
(homologous recombination, HR)和非同源末端连接修复机制(non-homologous end joining, NHEJ),不过在修复的过程中细胞有可能会对修复位点进行修饰,或者插入新的遗传信息。
◆YORK/文
Cas 9系统作用于人类细胞
一直以来,在向导RNA的指引下,Cas 9内切酶能够对各种入侵的外源DNA分子进行定点切割,不过主要识别的还是保守的间隔相邻基序(PAM基序)。如果要形成一个有功能的DNA切割复合体,还需要CRISPR RNA(crRNA)和反式作用CRISPR RNA(tracrRNA)这两个RNA分子的帮助。
不过,这两种RNA可被“改装”成一个向导RNA(sgRNA),而sgRNA足以帮助Cas 9对DNA进行定点切割。通常情况下,细胞会通过同源重组修复机制(HR)和非同源末端连接修复机制(NHEJ)这两种方式对发生双链断裂的DNA进行修复。
多项研究均表明,这种RNA介导的Cas 9系统在人类细胞中同样能够正常地发挥作用。具体而言,对化脓性链球菌编码的Cas 9内切酶进行改造后,可让它们在人类细胞的细胞核中被活化,之后再搭配针对人体DNA序列设计的大约20bp长的双RNA复合体或
者sgRNA,进而对人体基因组进行定点切割和改造。科研人员们在多种人体细胞内共表达了这种专用于人体的Cas 9和向导RNA,结果都在预定的DNA位点观察到了基因组双链DNA切割,以及后续的修复现象,成功率高达38%,并且Cas 9对细胞几乎没有毒性。研究认为,这套Cas 9系统能够在人体细胞内以非常高的效率对普通的基因组位点进行定向基因替换的操作。
与此同时,另一组研究发现这套RNA介导的Cas 9系统能够在人体细胞内诱发位点特异性的基因组修饰动作,且Cas 9蛋白与向导
RNA结合、组装的动作是这套位点特异性的基因组修饰过程里的限速步骤。
之前的研究发现,细胞更倾向于使用同源重组机制对单链DNA 损伤进行修复,因此引入的突变也会更少。而新的研究发现,各种不同的、只能够形成单链DNA断裂的Cas 9在细胞内引发NHEJ修复的机率的确更低,但它们在引发基因替换的效率方面与野生型的Cas 9内切酶不相上下。不仅如此,这套Cas 9系统还具有多重靶向功能,如能与基因组中两个不同的序列(位点)结合,形成多处断裂。此外,研究者还认为,分别表达tracrRNA和crRNA还可以进一步提高切割的效率,即如果进一步改进sgRNA的设计方案,使其更接近双RNA复合体的结构,将会进一步提高Cas 9系统的基因组编辑效率。
多领域的遗传学改造功能
除了这些细胞学的研究成果外,科学家们还发现这套Cas 9系统同样可以对生物体进行基因组改造的操作。如在细菌内表达多种向导RNA之后,Cas 9内切酶可以对细菌基因组的多个位点进行修饰操作。借助这一技术,可以对各种微生物进行遗传学改造,打造出符合我们人类需要的工程微生物,使其造福人类,在生物能源或者生物制药等诸多领域具有极大的应用潜力。
与此同时,相关研究还使用单细胞斑马鱼胚胎进行了试验,他们将编码Cas 9蛋白的mRNA和特定的向导RNA(与斑马鱼基因组DNA 的匹配机率高达24-59%)注射到斑马鱼胚胎内,结果取得了成功:在所有被注射的斑马鱼胚胎内,10个切割位点中有8个位点都发生了切割,并且引入了插入或者缺失突变。
这一试验结果表明,Cas 9切割活性完全可以应用于生物体水平,哺乳动物和植物都可以使用这种技术进行遗传学改造。而目前最有价值的应用就是使用这种技术为各种人类疾病构建出动物模型。
除此以外,这种基因组改造技术还可被应用于合成生物学、基因定向干扰或者多重基因干扰和基因治疗等领域。专家认为,接下来
