氢键与混合键
固体物理学-晶体结合类型

同时,由于距离增大,价电子与原子实之间的势能相对于 自由原子时要高。但由于自由电子屏蔽作用的存在,势能的 升高相对于动能的降低要小,二者能量之差就是金属结合的 主要来源。
12
I . 固体结合类型
------共价结合和共价晶体
13
共价键(氢分子为例)
•共价结合是靠两个原子各贡献一个电子,形成共价键。这样一对为两个 原子所共有的自旋相反配对的电子结构称为共价键。
•这对自旋相反的电子在两原子核之间的区域会形成较大的电子云密度, 同时受到两个原子核较强的库仑吸引作用,这就是共价键产生的物理根 源。
这种相互作用一定包括吸引和排斥两种类型。吸引力使粒子 聚集一起,排斥力使粒子之间保持一定间距,维持固体形态。 两种作用并存,粒子处于平衡状态,从而结合形成稳定的晶体 结构。这种维系原子结合在一起的作用力或称为“键”。
粒子之间的作用力应全部归结于静电相互作用,磁力和万有 引力忽略不计。粒子间的吸引作用可以归结为异性电荷间的库 仑吸引力;而排斥作用可以归结为同性电荷之间的库仑斥力以 及由泡利原理引起的排斥力。
4
根据键的特征,固体结合类型主要有以下几种:1. 金属 性结合;2. 共价结合;3. 离子性结合;4.范德瓦尔斯结合。 与结合力类型相对应,晶体可大致分为四种基本类型: 1. 金属晶体; 2. 共价晶体;3.离子晶体;4.分子晶体。
值得指出的是,以上这些类型之间的区分不是严格的, 某些固体的结合往往具有混合的特点或过渡的性质。
氢键的类型和本质
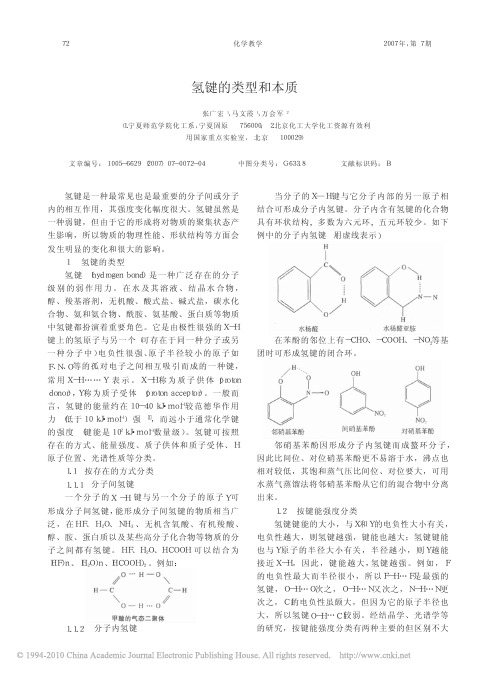
( a) {( PtCl4)·cis- [PtCl2(NH2Me)2]}2- (b) PtBr(I- C10H6NHMe2)(I- C10H6NMe2) 富电子金属原子 (后过渡金属原子) 具有充满 电子的d轨道, 能作为质子的受体容易和H原子一 起形成三中心四电子相互作用; 缺电子金属原子 (前过渡金属原子) 做为lewis 酸, 从富电子的X- H 键接受电子密度形成三中心两电子型的氢键, 这与 我们通常认为的氢键三中心四电子作用不相符合, 这种氢键的出现也反映了氢键理论的动态发展过 程。 ⑤H原子正极性化的M- H…O≡C型 过渡金属原子在配合物或簇合物中是两性的, 体现在与金属原子配位的H能以H+、H、H- 形式参 与氢键的形成, 缺电子金属M使M- H电子云偏向M, 形成氢原子 正 性 极 化 的Mδ-- Hδ+, Mδ-- Hδ+与 配 体δ-O ≡Cδ+相 互 作 用 形 成M- H…O≡C型 氢 键, 多 见 于 中 性多核簇合物。多核金属化合物中的M- H 常可与 第VIII族过渡金属配合物C≡O上的O 原子形成M- H …O≡C型氢键。 ⑥ 分叉的氢键 在氢键中, 由于氢原子很小, 所以绝大多数都 是二配位。只有个别情况下出现三配位的, 即形成 分叉的氢键。1972 年 , Jonsson 和Kvick 通 过 中 子 衍射证实了多中心氢键的存在。例如已发现在
是稳定存在的。
1.3 按质子供体和质子受体分类
1.3. 1 常规氢键
常规氢键X- H…Y是在一个质子供体和一个质
子受体间形成, 质子供体和受体多局限于像N, O,
F等这些原子半径小、电负性大的原子, 质子受体
Y且有一对或一对以上的孤对电子。
1.3.2 非常规氢键
晶体的结合

第二章 晶体的结合组成晶体的原子能够保持中性稳定的周期性排列,说明原子之间有着强烈的相互作用力。
晶体粒子之间的相互作用力包括两种类型:吸引力和排斥力。
当原子受到压缩时,这种作用表现为斥力;当晶体受到拉伸时,这种作用表现为引力。
当斥力和引力平衡时,晶体保持一定的体积和外形。
因此,晶体结构取决于组成晶体的原子的性质及相互作用。
从能量的观点来看,一块晶体处于稳定状态时,它的总能量0E (原子的动能和相互作用势能的总和)比组成这晶体的原子处于自由状态时的总能量N E 低。
两者之差被定义为晶体的结合能W :即0N W E E =-。
结合能就是把晶体分离成自由原子所需要的能量。
对于晶体中原子相互作用的研究,实际上是量子力学的多粒子问题。
由于问题的复杂性,只能采取多种近似的方法进行处理。
本章首先介绍晶体结合类型的物理本质,然后利用经典理论重点讨论离子晶体和分子晶体的结合能。
§2-1晶体的结合类型与原子电负性对原子结合成晶体起主要作用的是各原子的最外层的电子。
按原子间相互作用的性质,可把晶体分为离子晶体、共价晶体、金属晶体、分子晶体和氢键晶体等等。
2.1.1晶体的结合类型 1.离子晶体离子晶体是由正、负离子所组成,依赖离子之间的静电相互作用结合成晶体。
最典型的离子晶体是碱金属元素和卤族元素之间形成的化合物,它们的晶体结构也比较简单,分别属于NaCl 或CsCl 两种典型结构。
在NaCl 晶体中,Na +和Cl -离子相间排列,每一种离子都是以异性离子为最近邻,总的库仑作用的效果是吸引的。
同时,由于Na +和Cl -离子都具有满电子壳层结构,当两个离子相互接近电子云发生重叠时,除静电相互作用外,由于泡利不相容原理,它们之间将产生很强的排斥作用,晶体正是依靠库仑吸引和排斥相平衡结合成稳定的结构。
由于离子具有满壳层电子结构,其电荷分布近似于球对称,所以离子键是没有方向性的,是晶格配位数较高的结构。
这种离子键是相当强的,其结合能的数量级约为800kJ/mol ,离子间的吸引能的数量级约为几eV ,因此一般离子晶体的熔点较高,硬度较大。
氢键的作用原理

氢键的作用原理氢键是一种特殊的化学键,它的存在使得水分子具有独特的性质。
氢键的作用原理涉及到分子间的相互作用和电子分布的情况。
首先,我们来看氢键的定义。
氢键是指与氢原子共价结合的两个原子间的静电力引起的相互作用。
在氢键中,通常一个分子中的碳、氮、氧等电负性较高的原子与另一个分子中的氢原子形成氢键。
例如,在水分子中,氢键就是形成在一个水分子的氢原子与另一个水分子中的氧原子之间。
氢键的形成涉及到电荷分布和原子间的距离。
一般来说,氧、氮等电负性较高的原子会通过共价键与氢原子形成饱和键,但由于氧、氮原子的电子云密度较高,会使这些原子周围的电子云更为偏向氧、氮原子。
因此,氢原子会处于一个相对正电的位置。
经过相互作用,当两个分子的氢原子和电负性原子之间的距离适当时,电负性原子的电子云会与氢原子的正电荷部分发生相互作用。
这种相互作用就是氢键。
氢键的作用原理可以通过分子间的相互作用力来理解。
尽管氢键较弱,但它们的累积效应可以在物质中产生显著的影响。
首先,氢键能够使分子间形成比较稳定的结构。
在液态和固态中,这些结构会导致水分子之间的密排和形成氢键网络。
这就解释了为什么水在室温下是液体,它的密度和沸点比预计的要高。
氢键网络使水分子紧密地连接在一起,难以分离,增加了水的粘稠度和表面张力。
此外,氢键还决定了分子的形状和分子内的键角。
由于氢键的存在,水分子呈现V形结构,原子之间的键角接近104.5。
这种结构和键角使得水分子具有极性,使得水分子能够与其他极性分子或离子发生相互作用。
这也解释了为什么水是一种良好的溶剂和对许多物质表现出特殊性质的原因。
此外,氢键还能够影响分子间的能量。
通过氢键的作用,分子间的能量可以降低,从而使分子更加稳定。
这是因为氢键的形成可以增加相互作用的键能,同时还能够降低混合物中水分子的运动能量。
因此,氢键在许多化学和生物学反应中发挥着重要的作用。
总之,氢键是一种特殊的化学键,它的作用原理涉及到分子间的相互作用力和分子内的电子分布。
化学基本概念--化学键与氢键

化学基本概念--化学键与氢键前面谈了这么多的原子分子离子,是时候谈谈它们之间相互作用的错乱关系了。
这好比是在讲完了梁山好汉每个人物的性格介绍,今天正式进入它们如何相互作用的环节:讲完了潘金莲貌美如花,西门庆好色成性,总得把故事继续下去吧,不然大家肯定有意见了。
所以,今天,在大周末的日子里,我们要谈谈一个东西:化学键,以及另外一个极贱极贱与谁都容易成键的小贱贱-氢贱,大家可以吃上瓜子,坐在篝火旁边,听化学哥讲那故事。
化学哥马上开始给大家讲故事了----图片来自网络先说说化学键(chemical bond),它的定义是:纯净物分子内或晶体内相邻两个或多个原子(或离子)间强烈的相互作用力的统称。
使离子相结合或原子相结合的作用力通称为化学键,而化学键包含了离子键,共价键与金属键。
这里的“键”,表示的是“相互作用”。
我们还是以几个具体的例子来说吧。
共价键:比如说氯化氢分子,它有一个氢原子,一个氯原子,然后两个电子凑在一起,组建了一个小团体,这个小团体吧,不能说真正地归属于哪个原子,它们就一起在两个原子的外围跑啊跑,绕啊绕,让你傻傻分不清。
好比你与邻居各养了一只鸡,两只鸡长得差不多,而且相见恨晚,然后两个鸡就厮混在一起,你家屋后跑跑,邻居家屋后跑跑,而且你与邻居都搞不清楚哪个鸡是哪家的。
最后,你与邻居说,算了吧,反正也分不清楚了,你的是我的,我的是你的,但是你不能吃了它,我也不能吃了它,我们就共同拥有这两只鸡吧。
你与邻居之间通过这种搞不清楚谁谁谁的关系与作用,就是“共价键”。
氯化氢分子---图片来自网络离子键:比如说氯化钠,固体的氯化钠是晶体状,在晶体的内部,里面分布了钠离子与氯离子,钠与氯之间,就是通过正电与负电的相互吸引而作用,形成一种相互作用的力,称为离子键。
还是以鸡的故事为例,你是钠原子,你邻居是氯原子,有一天,你们碰到了一起,你家的鸡(电子)反正直接让邻居给拿走了,然后你那个恨呀,你们之间就是扯上了这种相互想抢鸡的念头,但是终究你还是拿不回来。
氢键的类型和本质

大, π键、离域π键或过渡金属原子等也可以作为
质子受体, 形成一种非常规氢键, 从而大大丰富了
氢键的内容。
①π型氢键
π型氢键是一种缺电子的H 原子与多重键的π
电 子 或 是 共 轭 体 系 的 π电 子 之 间 形 成 的 一 种 弱 相 互
作 用 。 例 如: FH…CH2=CH2, FH… 苯, FH…CH2= C=CH2等。1946年Dewar 就 提 出 了π型 体 系 化 合 物 也 可 以 作 为 一 个π型 质 子 受 体 , 但 是 直 到1971 年
1.4 按氢键中H原子位置分类
1.4.1 不对称氢键
大多数氢键是不对称的, 即H不在X和Y的中
心 点 。 不Βιβλιοθήκη 对 称 氢 键 中 氢 原 子 与 X原 子 由 短 而 强 的 共
价键相连, 与Y原子由长且弱的 “氢键”联系。例
如冰中氢键
0.97A 1.79A
OH O
。
1.4.2 对称氢键
对称氢键是 H 原子正好位于两个电负性大的
π等 多 种 形 式 的 π型 氢 键 不 断 被 发 现 。 研 究 发 现 非
极 化 的 π电 子 可 以 形 成 稳 定 的 π型 氢 键 。 2000 年
Stefov 等对π型体系分子簇化合物进行了详细的综
述和讨论, 其中就涉及了多种形式的π型氢键。
根据已研究的π型氢键体系, 代表性的类型有:
许多酸或酸式盐中电负性强的原子之间, 或者有机
酸阴离子中的O- H…O基, 还可能在配位氰基酸的
N- H…N中发现。根据热力学数据也可以说明强氢
键的存在:
( CH3) 2CO+HF→(CH3) 2CO…HF ΔH=- 46kJ·mol-1
氢键与混合键

的混合键) 一、石墨(共价键、金属键和范德瓦尔斯力的混合键) 石墨(共价键、金属键和 的混合键
1. C原子的三个价电子组成 sp2杂化轨道,分别与最近邻的三个C原 子形成三个共价键,在同一平面内互成120°,使碳原子形成六角 平面网状结构。 2. 第四个价电子未参与杂化,自由的在整个层内活动,具有金属键 的特点。(石墨是一种良导体,可做电极等) 3. 层与层之间以范德瓦尔斯力结合。(结合力弱,所以石墨质地疏 松,在层与层之间可插入其它物质,制成石墨插层化合物)
氢键晶体由氢原子与其他负电性较大,原子半径较 小的原子(如F、O、N等)或原子团结合而成。由 于氢原子只有一个外层电子,其第一电离能(13.6 eV)远高于同族的碱金属原子,因而很难完全失去 其外层电子而形成离子键。同时由于氢原子核中只 有一个质子,比其他离子实小得多,因此当H原子与 另一个负电性大的原子形成共价键后,氢核便暴露 在外,氢核又可通过库仑相互作用与另一个带负电 的原子结合在一起。即在某些条件下,一个氢原子 可同时吸引两个负电性较大的原子,而将这两个原 子结合起来。
氢键
氢键:氢原子可以同时和两个原子相结合,与一个原子 形成共价键后氢核便暴露出来了,再与另一个原子相吸 引,形成较弱的键,这种较弱的键称为氢键,是由于氢 在其中所起的特殊作用而得名。氢键有方向性和饱和性。
F H F H F H F H F
固体氟化氢:H的唯一外层电子与F形成共价键后,因氢 原子核暴露,故还可以与负电性较大的F通过库伦力而结 合,若有第三个负离子要与H核结合,则受到已与H核结 合的2个F的斥力,所以氢键有方向性和饱和性。
石墨结构示意图
2. SiO2 、P2O5 、B2O3 等是玻璃的主要形成体,Stanworth 发现均具有混合型键。其中SiO2 有 共价键──离子键; P2O5有 共价键──离子键;B2O3有 共价键──离子键。 形 成玻璃必须为混合键。 3. 大部分合金都具有金属键──共价键的混合键型,同时 键的性质可随成分变化,故可通过改变成分改变键性比 例,从而改进材料性能等。
氢键等缔合作用

氢键等缔合作用氢键是一种共价键,是一对原子之间的强有力的化学键。
它的力量大约是一个共价键的三分之一。
由于其强度,它们经常用于两个分子之间的结合。
氢键可以看作是由两个在氢原子之间的卤素原子形成的键。
氢键的发现可以追溯到 20 世纪 30代,当时化学家发现氢原子可以在稀薄的液体中以异构方式定向排列。
在这些情况下,氢原子们被发现与其他原子之间的键合牢固。
随着科学发展的不断推进,氢键发挥的作用逐渐得到了更多的关注。
氢键可以用来结合各种类型的分子,最重要的是它们被用于细菌和病毒之间的相互结合。
氢键通常比其他类型的键更强,这使得它们对于结合病毒,细菌,蛋白质及其他生物体物质变得更加有效。
这种作用使得它们在抗感染药物的开发上发挥重要作用。
此外,氢键也被用于构象分析和模拟,以及研究有机分子的结构和性质。
模拟和计算的发展使得科学家能够以计算的方式获得氢键的影响及其他类型化学反应的信息。
最后,氢键还可以用于非生物领域。
它可以用来结合各种类型的溶剂,如有机溶剂,无机溶剂,混合溶剂和生物活性溶剂。
这些类型的溶剂通常需要氢键来维持其稳定性,从而加强其功能。
总之,氢键的发现和发展对化学及其他领域带来了重大影响。
它们的作用被广泛运用于有机合成,抗感染药物的开发,构象分析和模拟以及控制溶剂的性质等。
氢键不仅在科学研究中扮演重要角色,还能够使商业产品更加强大有效。
未来,氢键仍将在医药和其他领域发挥着重要作用。
氢键是一种强有力的共价键,在20世纪30年代被发现,可以用来结合细菌和病毒。
它们也可以用于模拟和计算,以及研究有机分子的结构和性质。
此外,氢键还可以用于控制溶剂的性质,使商业产品更加有效。
氢键作用强度大,在有机合成,抗感染药物开发,构象分析和模拟等领域发挥着重要作用。
未来,随着科学技术的不断发展,氢键仍将保持其重要地位,在医药和其他领域发挥重要作用。
从科学的角度来看,氢键在生物物质结合以及控制溶剂的性质方面表现突出。
但是,它们有可能会产生副作用,如造成分子的不稳定性,从而影响药物的效果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
石墨结构示意图
2. SiO2 、P2O5 、B2O3 等是玻璃的主要形成体,Stanworth 发现均具有混合型键。其中SiO2 有 共价键──离子键; P2O5有 共价键──离子键;B2O3有 共价键──离子键。 形 成玻璃必须为混合键。
3. 大部分合金都具有金属键──共价键的混合键型,同时 键的性质可随成分变化,故可通过改变成分改变键性比 例,从而改进材料性能等。
一、石墨(共价键、金属键和范德瓦尔斯力的混合键)
1. C原子的三个价电子组成 sp2杂化轨道,分别与最近邻的三个C原 子形成三个共价键,在同一平面内互成120°,使碳原子形成六角 平面网状结构。 2. 第四个价电子未参与杂化,自由的在整个层内活动,具有金属键 的特点。(石墨是一种良导体,可做电极等) 3. 层与层之间以范德瓦尔斯力结合。(结合力弱,所以石墨质地疏 松,在层与层之间可插入其它物质,制成石墨插层化合物)
C60结构示意图
除金刚石和石墨外,碳的第三种结晶形式为C60固体,称作足球烯 或富勒烯。C60是由60个碳原子组成的分子,其结构如图所示。碳 原子分布在由20个六边形和12个五边形环所组成的封闭的多面体, 形式象足球,直径约为7Å。在球面上每个碳原子以sp2 杂化轨道与 三个近邻碳原子形成共价键,剩下的一个p电子的电子云分布在球 内外表面上形成π键。 C60固体是由 C60分子组成, C60占据晶格位 置,以范德瓦尔斯键相结合,属于分子晶体。温度在260K以上时 C60晶体是面心立方结构,260K以下转变为简单立方结构。 C60固 体具有许多奇特的物理性质、化学性质,可能有重要的应用前景 而引起人们的重视。
冰是一种典型的氢键晶体,水分子 H2O之间主要靠氢键 相结合,氢原子不但与一个氧原子形成共价键,而且还 和另一个水分子中氧原子相吸引,但后者结合较弱。冰 有许多相,图2-1-3是冰的一种结构。氢键和范德瓦尔斯 键都是弱键,但前者较后者略强一些。
混合键
对于大多数晶体而言,它们的键并不单纯属于上述五种 中的某一种,而具有某种综合性。换言之,许多晶体存 在混合键。
氢键: 氢原子可以同时和两个原子相结合,与一个原子形成共 价键后氢核便暴露出来了,再与另一个原子相吸引,形 成较弱的键,这种较弱Байду номын сангаас键称为氢键,是由于氢在其中 所起的特殊作用而得名。氢键有方向性和饱和性。
F H F H F H F H F
固体氟化氢:H的唯一外层电子与F形成共价键后,因氢 原子核暴露,故还可以与负电性较大的F通过库伦力而结 合,若有第三个负离子要与H核结合,则受到已与H核结 合的2个F的斥力,所以氢键有方向性和饱和性。
氢键晶体由氢原子与其他负电性较大,原子半径较 小的原子(如F、O、N等)或原子团结合而成。由 于氢原子只有一个外层电子,其第一电离能(13.6 eV)远高于同族的碱金属原子,因而很难完全失去 其外层电子而形成离子键。同时由于氢原子核中只 有一个质子,比其他离子实小得多,因此当H原子与 另一个负电性大的原子形成共价键后,氢核便暴露 在外,氢核又可通过库仑相互作用与另一个带负电 的原子结合在一起。即在某些条件下,一个氢原子 可同时吸引两个负电性较大的原子,而将这两个原 子结合起来。
