材料科学基础2
材料科学基础_第2章_固体材料的结构

4
共价键
原子间不产生电子的转移,借共用电子对产生的力结合, 如金刚石,单质硅,SiC 特点: 1.饱和性:电子必须由(8-N)个邻近原子共有;
2.具有方向性:氧化硅四面体中硅氧键为109°
3. 脆性:外力作用,原子间发生相对位移,键将被 破坏
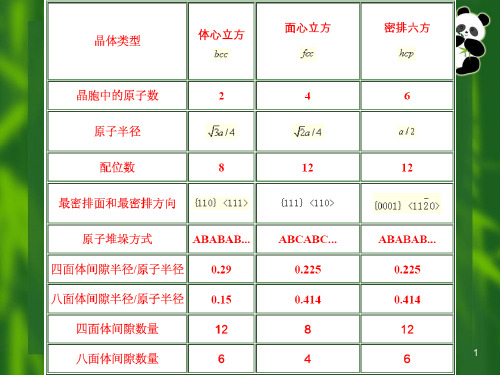
配位数与致密度 配位数 CN=12 致密度 k=0.74
25
体心立方结构(特征)
体心立方晶格密排面
26
ቤተ መጻሕፍቲ ባይዱ
体心立方晶格(间隙及堆垛方式)
间隙: 也是两种,为八面体和四面体间隙, 八面体间隙位于晶胞六面体每个面的中心和每个棱的 中心由一个面上四个角和相邻两个晶胞体心共6个原围成, 即数量为6。大小为rB=0.154R(在<100>) 或rB=0.633R (在<110>) 。
配位数: CN=8 致密度: k=0.68
31
密排六方晶格原子位置
32
密排六方晶格晶胞原子数
33
密排六方晶格密排面
34
密排六方晶格原子配位数
35
密排六方晶格(间隙及堆垛方式)
• 间隙: 较为复杂,如图2.34 八面体间隙rB=0.414R 有 6 个 四面体间隙rB=0.225R 有 12 个
图1 Cl和Na离子保持r0的距离
图2 NaCl 晶体
9
•
分子键(范德华力)
以若静电吸引的方式使分子或原子团连接在一起的。
特点:除高分子外,键的结合不如化学键牢固,无饱和性, 无方向性。
氢键: 分子间特殊作用力
表达为:X—H—Y 特点:具有饱和性和方 向性,可存在于分子内 或分子间。氢键主要存 在于高分子材料内。
材料科学基础第2章
可编辑ppt
10
2.3.1 固溶体
固溶体(solid solution) :
合金组元通过溶解形成一种成分和性能均匀的、 且结构与组元之一相同的固相称为固溶体。
➢ 固溶体的最大特点是保持溶剂的晶体结构。
➢ 与固溶体晶格相同的组元为溶剂,一般在合金中 含量较多;另一组元为溶质,含量较少。
✓ 各向异性:由于在不同方向上的原子排列的紧密程 度不同使晶体在不同方向上的物理、化学和力学性 能不同。而一般整个晶体不显示各向异性,称为伪 等向性。
✓ 晶粒:组成晶体的结晶颗粒。 ✓ 多晶体:凡由两颗以上晶粒组成的晶体一般金属都
是多晶体。。
可编辑ppt
4
晶粒
可编辑ppt
5
Байду номын сангаас
多相合金
可编辑ppt
6
可编辑ppt
12
(3)按溶质原子在溶剂中的分布特点分类 无序固溶体:溶质原子在溶剂中任意分布, 无规律性。
有序固溶体:溶质原子按一定比例和有规 律分布在溶剂晶格的点阵或间隙里。
(4)按基体类型分类: 一次固溶体:以纯金属为基形成的固溶体。
二次固溶体:以化合物为基形成的固溶体。
可编辑ppt
13
固溶体的两种类型(置换和间隙)
中间相可以用分子式来大致表示其组成。
合金相的性质由以下三个因素控制: (1)电化学因素(电负性或化学亲和力因素)
电负性—化学亲和力越大越容易形成化合物,电负性 相近的元素容易形成固溶体。
(2)原子尺寸因素 △r=(rA-rB)/rA △r越大,越易形 成中间相。 △r越小,越易形成固溶体
(3)原子价因素(电子浓度因素): C电子=[A(100-x) +Bx]/100 C越大,越易形成
材料科学基础试卷(二)与答案

材料科学基础试卷(二)与参考答案、名词解释 (每小题 1 分,共 10 分 )1.晶胞2.间隙固溶体3.临界晶核4.枝晶偏析5.离异共晶6.反应扩散7.临界分切应力8.回复9.调幅分解10.二次硬化、判断正误 (每小题 1 分,共 10 分 )正确的在括号内画“V” ,错误的画“X”1. 金属中典型的空间点阵有体心立方、面心立方和密排六方三种。
( )2. 作用在位错线上的力 F 的方向永远垂直于位错线并指向滑移面上的未滑移区。
( )3. 只有置换固溶体的两个组元之间才能无限互溶,间隙固溶体则不能。
( )4. 金属结晶时,原子从液相无序排列到固相有序排列,使体系熵值减小,因此是一个自发过程5. 固溶体凝固形核的必要条件同样是A GB V0、结构起伏和能量起伏。
()6. 三元相图垂直截面的两相区内不适用杠杆定律。
()7. 物质的扩散方向总是与浓度梯度的方向相反。
()8. 塑性变形时,滑移面总是晶体的密排面,滑移方向也总是密排方向。
()9. 和液固转变一样,固态相变也有驱动力并要克服阻力,因此两种转变的难易程度相似。
()10. 除Co以外,几乎所有溶入奥氏体中的合金元素都能使 C曲线左移,从而增加钢的淬透性。
()三、作图题(每小题5分,共15分)1. 在简单立方晶胞中标出具有下列密勒指数的晶面和晶向:a)立方晶系(421), (123),[211]; b)六方晶系(2111),[2113]。
2. 设面心立方晶体中的(111)为滑移面,位错滑移后的滑移矢量为a - [110]。
2(1)在晶胞中画出柏氏矢量b的方向并计算出其大小。
(2)在晶胞中画出引起该滑移的刃型位错和螺型位错的位错线方向,并写出此二位错线的晶向指数3. 如下图所示,将一锲形铜片置于间距恒定的两轧辊间轧制。
试画出轧制后铜片经再结晶后晶粒大小沿片长方向变化的示意图四、相图分析(共20分)⑴就Fe-Fe3C相图,回答下列问题:1•默画出Fe-Fe3C相图,用相组成物填写相图;2. 分析含碳量为I.Owt%的过共析钢的平衡结晶过程,并绘出室温组织示意图。
材料科学基础第2章
晶胞示意图
晶胞大小和形状表示方法
晶胞大小和形状表示方法为:
晶胞的棱边长度a、b、c(称为点阵常数、晶格常 数(lattice constants/parameters)); 棱边的夹角为α、β、γ(称为晶轴间夹角)。 选取晶胞的原则: 1、应反映出点阵的高度对称性 2、棱和角相等的数目最多 3、棱边夹角为直角时,直角数目最多 4、晶胞体积最小
晶面指数(hkil)其中i=-(h+k)
晶向指数 [uvtw] 其中t=-(u+v)
六方晶系按两种晶轴系所得的晶面指数和晶向 指数可相互转化:
六方晶系的晶向(面)指数示意图
六方晶系的一些晶向(面)指数
4.晶带
晶带——所有平行或相交于同一直线的晶面构成一个 晶带,此直线称为晶带轴。属此晶带的晶面称为共 带面。 晶带定理:同一晶带上晶带轴[uvw]和晶带面(hkl) 之间存在以下关系:hu+kv+lw=0 通过晶带定理可以求晶向指数或晶面指数。 a) 求两不平行的晶面(h1k1l1)和(h2k2l2)的晶 带轴。 b) 求两个不平行的晶向[u1v1w1]和[u2v2w2]所决定 的晶面。
面心立方八面体间隙面心立方Biblioteka 面体间隙面心立方四面体间隙
面心立方四面体间隙
面心立方原子堆垛顺序
面心立方晶体的 ABCABC 顺序密堆结构
2.体心立方晶格(特征)
原子排列:晶胞八个顶角和晶胞体心各有一个原子 点阵参数:a=b=c,α=β=γ=90º 晶胞中原子数:n=8×1/8+1=2个 3 原子半径: 4R 3a, R a
三种典型金属晶体结构刚球模型
三种典型金属晶体结构晶胞原子数
原子半径与晶格常数
三种典型金属晶格密排面的堆垛方式
材料科学基础2-概念部分

固态相变:固态金属及合金在温度、压力改变时,内部相结构发生相互转变的现象,称为金属的固态相变。
多型性转变:固溶体的同素异构转变称为多型性转变。
共析转变:冷却时,固溶体同时分解为两个不同成分和结构的相的固态相变称为共析转变。
包析转变:冷却时由两个固相合并转变为一个固相的固态相变过程称为包析转变。
平衡脱溶:在高温相中固溶了一定量合金元素,当温度降低时溶解度下降,在缓慢冷却的条件下,过饱和固溶体将析出新相,此过程称为平衡脱溶。
调幅分解:某些合金在高温时形成单相的均匀的固溶体,缓慢冷却到某一温度范围内时,通过上坡扩散,分解为两个固相,其结构与原固溶体相同,但成分不同,是成分不均匀的固溶体,这种转变称为调幅分解。
非平衡转变:在非平衡加热或冷却条件下,平衡转变受到抑制,将发生平衡图上不能反映的转变类型,获得不平衡组织或亚稳状态的组织。
不平衡脱溶:合金经高温固溶处理后,在室温或加热到某一温度等温,过饱和固溶体中脱溶析出新相的过程,称为不平衡脱溶。
一级相变:在相变温度下,两相的自由焓及化学位均相等,即:Gα= Gβ,μα=μβ。
如果,相变时的化学位的一阶偏导数不等,则称为一级相变。
均匀形核:当缺陷能为零时,即无缺陷时,晶核将均匀形成,称均匀形核。
不均匀形核:当缺陷能不为零时,晶核将在具有缺陷能△Gd的晶体缺陷处形成,此称不均匀形核。
形核率:是单位时间、单位体积母相中形成的新相晶核的数目。
滑移:在切应力作用下,晶体的两部分沿一定的晶面和晶向发生相对的滑动。
通过滑移产生的变形叫滑移变形。
滑移的特点:不改变晶体的取向; 改变晶体的点阵类型;在晶体表面产生台阶。
滑移带:光学显微镜观察到的塑变后单晶试样表面形成的滑移条纹。
滑移线:组成滑移带的平行线条。
滑移面:能够发生滑移的晶面(原子密度最大或次大的晶面)。
滑移系:晶体中一个滑移面和其上的一个滑移方向的组合,称为一个滑移系。
滑移方向:在滑移面上能够进行滑移的方向(原子密度最大的方向)。
《材料科学基础2》课程简介和教学大纲

《材料科学基础2》课程简介课程编号:02024036课程名称:材料科学基础2 [5E] /Fundamentals of MaterialsScience 2学分:2. 5学时:40适用专业:无机非金属材料建议修读学期:第5学期先修课程:物理化学,材料科学基础1 [无]考核方式与成绩评定标准:闭卷考试教材与主要参考书目:Ll]无机材料学基础,张其土,华东理工大学出版社[2]无机材料科学基础,陆佩文,武汉理工大学出版社[3]材料科学基础,张联盟,武汉理工大学出版社内容概述:本课程是无机非金属材料工程专业本科生的重要专业基础课,是一门理论性很强、涉及面广的课程,是本专业的专业课开设前所必须学的课程。
本课程是使学生掌握材料的组成、结构与性能之间的相互关系和变化规律,掌握材料的结构、物性和化学反应的规律及其相互的联系,为今后从事夏杂的技术工作和开发新型材料打下良好的基础。
The course of fUndamentals of materials science, which is highly theoretical, and almost involves all the sides of materials science, is an important fundamental one for the students majoring in inorganic materials science and engineering. Thus it is set to be taught before other specialized courses. It aims at allowing the students to master the relations between materials compositions, structures and properties, and to establish a good theoretical base for the research and development of new materials in the future.《材料科学基础2》[无]教学大纲课程编号:02024036课程名称:材料科学基础2 /Fundamentals of Materials Science 2学分:2. 5学时:40适用专业:无机非金属材料建议修读学期:第5学期先修课程:物理化学,材料科学基础1 [无]一、课程性质、目的与任务【课程性质】本课程是无机非金属材料工程专业(建材方向、陶瓷与耐火材料方向)本科生的重要专业基础课,是一门理论性很强、涉及面广的课程,是本专业的专业课开设前所必须学的课程。
材料科学基础第二章

y
[111]
x
[111]
例:画出晶向
[112 ]
2.立方晶系晶面指数
晶面指数的确定方法
(a)建立坐标系,结点为原点, 三棱为方向,点阵常数为单位 (原点在标定面以外,可以采 用平移法); (b)晶面在三个坐标上的截距a1 a2 a3 ; (c)计算其倒数 b1 b2 b3 ; (d)化成最小、整数比h:k:l ; 放在圆方括号(hkl),不加逗号, 负号记在上方 。
3.六方晶系晶面和晶向指数
三指数表示六方晶系晶面和晶向的缺点:晶体学上等价的 晶面和晶向不具有类似的指数。 例:
晶面指数
(11 0)
(100)
[010] [100]
从晶面指数上不能明确表示等同晶面,为了克服这一缺点, 采用a1、a2、a3及c四个晶轴, a1、a2、a3之间的夹角均 为120º ,晶面指数以(hkil)表示。 根据立体几何,在三维空间中独立的坐标轴不会超过三 个可证明 : i= - (h+k) 或 h+k+i=0
六方晶系
d hkl
h k l a b c
2 2 2
d hkl
a h2 k 2 l 2
1 l c
2
4 h 2 hk k 2 3 a2
注:以上公式是针对简单晶胞而言的,如为复杂晶胞, 例如体心、面心,在计算时应考虑晶面层数增加的影 响,如体心立方、面心立方、上下底(001)之间还有 一层同类型晶面,实际
[1 00 ]
[0 1 0]
[010]
[1 00]
y
[100]
x
[00 1]
第四章 材料科学基础 2

{h k l} 晶面族:等价晶面
立方 {110}=(110)+(101)+(011)+(T10)+(1T0)+(T01) 晶系 晶体 Total: 6
晶面族中等价晶面的个数用于多晶x射线衍射中多重性因 子的表示。
立方晶系: {111}=(111)+(T11)+(1T1)+(11T)
Total: 4 立方晶系: {112 } (112) ( 1 12) (1 1 2) (112)
②由晶向[u1 v1 w1]和晶向[u2 v2 w2]求晶面:
[u1v1w1] [u2v2w2] (h k l)
解出:
hu1+kv1+lw1 = 0 hu2+kv2+lw2 = 0
h:k:l=
h : k : l (v1w2 v2 w1 ) : (w1u2 w2u1 ) : (u1v2 u2v1 )
如何表征晶向和晶面?
为了便于研究和表述不同晶面和晶向的原子排列 情况及其在空间的位向,需要确定一种统一的表示 方法,称为晶面指数和晶向指数。国际上通用密勒 指数(Miller index)标定晶向和晶面。
1. 晶向符号(三轴,如立方)
用三指数u,v,w表示晶向符号。 确定三轴坐标系下晶向指数[uvw]的步骤如下: (1) 建立右手坐标系oabc,将原点置于所论晶向上, 以晶胞的晶轴长度a,b,c为相应轴上的长度单位。 (2) 找出所论直线上除原点外的任一点的坐标(x, y, z) (3) 将x,y,z化为简单整数u,v,w,但保持其比 值不变(即u:v:w=x: y:z)
晶面间距的计算
晶面间距可根据一些几何关系求得
h、k、l为晶面指数(hkl),a、b、c为点阵常数, α、β、γ为晶面法线方向与晶轴夹角。
材料科学基础2复习题及参考答案

材料科学基础2复习题及部分参考答案一、名词解释1、再结晶:指经冷变形的金属在足够高的温度下加热时,通过新晶粒的形核及长大,以无畸变的等轴晶粒取代变形晶粒的过程。
2、交滑移:在晶体中,出现两个或多个滑移面沿着某个共同的滑移方向同时或交替滑移。
3、冷拉:在常温条件下,以超过原来屈服点强度的拉应力,强行拉伸聚合物,使其产生塑性变形以达到提高其屈服点强度和节约材料为目的。
(《笔记》聚合物拉伸时出现的细颈伸展过程。
)4、位错:指晶体材料的一种内部微观缺陷,即原子的局部不规则排列(晶体学缺陷)。
(《书》晶体中某处一列或者若干列原子发生了有规律的错排现象)5、柯氏气团:金属内部存在的大量位错线,在刃型位错线附近经常会吸附大量的异类溶质原子(大小不同吸附的位置有差别),形成所谓的“柯氏气团”。
(《书》溶质原子与位错弹性交互作用的结果,使溶质原子趋于聚集在位错周围,以减小畸变,降低体系的能量,使体系更加稳定。
)6、位错密度:单位体积晶体中所含的位错线的总长度或晶体中穿过单位截面面积的位错线数目。
7、二次再结晶:晶粒的不均匀长大就好像在再结晶后均匀、细小的等轴晶粒中又重新发生了再结晶。
8、滑移的临界分切应力:滑移系开动所需要的最小分切应力。
(《书》晶体开始滑移时,滑移方向上的分切应力。
)9、加工硬化:金属材料在再结晶温度以下塑性变形时强度和硬度升高,而塑性和韧性降低的现象,又称冷作硬化。
(《书》随塑性变形的增大,塑性变形抗力不断增加的现象。
)10、热加工:金属铸造、热扎、锻造、焊接和金属热处理等工艺的总称。
(《书》使金属在再结晶温度以上发生加工变形的工艺。
)11、柏氏矢量:是描述位错实质的重要物理量。
反映出柏氏回路包含的位错所引起点阵畸变的总积累。
(《书》揭示位错本质并描述位错行为的矢量。
)反映由位错引起的点阵畸变大小的物理量。
12、多滑移:晶体的滑移在两组或者更多的滑移面(系)上同时进行或者交替进行。
13、堆垛层错:晶体结构层正常的周期性重复堆垛顺序在某二层间出现了错误,从而导致的沿该层间平面(称为层错面)两侧附近原子的错排的一种面缺陷。
材料科学基础2-第二章-固相反应

1. 相界面上的化学反应机理
ZnO加Fe2O3反应生成尖晶石 的反应,大致可将整个反应过 程分为六个阶段: (1)隐蔽期:约低于300℃,反 应物在混合时已相互接触,随 温度升高,反应物活性增加, 此时在界面上质点间形成了某 些弱的键,试样的吸附能力和 催化能力都有所降低,但晶格 和物相基本上无变化。
② 按照固相反应涉及的化学反应类型不同,可将固相反应分 成合成反应、分解反应、置换反应、氧化还原反应等类型;
③ 按照固相反应的产物空间分布尺度,可将固相反应分为 (界面)成层反应、(体相)非成层反应等两大类型;
④ 按照固相反应的反应控制速度步骤,可以将固相反应分成 化学反应控制的固相反应、扩散控制的固相反应、过渡范 围控制的固相反应等类型
2.反应物通过产物层的扩散
当反应物之间形成一层产物后,则需要有 一种或几种反应物通过产物层的扩散,反应 才能继续进行
固相反应中的扩散规律与一般的扩散规律 相同。
四、固相反应中间产物
固相反应的另一个特点是固相反应产物的阶段性
➢最初反应产物和系统在高温下生成的化合物可能 不同,最初反应产物可以与原始反应物反应生成中 间产物,中间产物可以与最初产物反应,也可能是 一系列反应,最后才形成最终产物
以上六个阶段并不是截然分开的,而是连续地相互交错进 行,同时,并不是所有的固相反应都具有以上的六个阶段
对于不同反应系统,条件不同会各有差别,但一般都包括 以下三个过程: (1) 反应物之间的混合接触并产生表面效应; (2) 化学反应和新相生成; (3) 晶体生长和结构缺陷校正;
如果有液相或气相参与,则反应不局限于物料直接接触的 界面,而可沿整个反应物颗粒自由表面同时进行,此时, 固相与气体、液体间的吸附和润湿作用的影响就很重要。
材料科学基础2

3) 异类原子 在一种类型的原子组成 的晶格中,不同种类的原子替换原 有的原子占有其应有的位置。
第7页/共32页
二、点缺陷的形成
弗仑克耳缺陷:原子离开平衡位置进入间隙,形成等量的空 位和间隙原子。 肖特基缺陷:只形成空位不形成间隙原子。(构成新的晶面)
3. 面缺陷 在三维空间的两个方向上的尺寸很大(晶 粒数量级),另外一个方向上的尺寸很小(原子尺 寸大小)的晶体缺陷。
第6页/共32页
第二节 点缺陷
点缺陷:在三维空间各方向上尺寸都很小,在原子尺寸大小
的晶体缺陷。
一、点缺陷的类型 :
1) 空位 在晶格结点位置应有原子的 地方空缺,这种缺陷称为“空位”。
第15页/共32页
第一节 材料的实际晶体结构
一、多晶体结构
单晶体: 一块晶体材料,其内部
的晶体位向完全一致时,即 整个材料是一个晶体,这块 晶体就称之为“单晶体”, 实用材料中如半导体集成电 路用的单晶硅、专门制造的 金须和其他一些供研究用的 材料。
第1页/共32页
第一节 材料的实际晶体结构
一、多晶体结构
多晶体:
实际应用的工程材料 中,那怕是一块尺寸很小 材料,绝大多数包含着许 许多多的小晶体,每个小 晶体的内部,晶格位向是 均匀一致的,而各个小晶 体之间,彼此的位向却不 相同。称这种由多个小晶 体组成的晶体结构称之为 “多晶体”。
过饱和空位 晶体中含点缺陷的数目明显超过平衡 值。如高温下停留平衡时晶体中存在一平衡空位, 快速冷却到一较低的温度,晶体中的空位来不及移 出晶体,就会造成晶体中的空位浓度超过这时的平 衡值。过饱和空位的存在是一非平衡状态,有恢复 到平衡态的热力学趋势,在动力学上要到达平衡态 还要一时间过程。
材料科学基础2版余永宁 (2)

自由电子的波函数
Ψ r,t Aexp it r k Aexp i t r p
A为振幅,t为时间,r为空间 位置矢量,i为虚数单位。
依据量子理论微观粒子的状态完全由波函数Ψ r,t 描述。
一般波函数 Ψ r,t的物理意义:粒子出现的几率密度
Hund法则通过光谱试验规律总结,得出基态下未满的亚电 子层中电子的排布情况,有关内容涉及了电子的角动量,故 此在介绍角动量之后,介绍Hund法则
电子能级的试验测试手段
设法使电子在不同能级之间跃迁, 尤其在基态与激发态之间变化
能量守恒:电子能级跃迁释放 光子的能量波长关系
Eph
h ph
hc
ph
~
E2
载流子 电子对 自由电子 电子、空穴 电子和/或离子
电导率 : 1 1m-1
例(室温下): • 金属 Ag —6.3x107 ,Cu —6.0x107 ,Al —4.3x107,Fe —1x107; • 纯 Si — 掺杂1ppm的As、P、B、Al后(代位),提高100 000倍; • PE — <10-14, PP : <10-13 , 酚醛树脂(电木)—10-11 , • SiO2 — <10-12 , 石英 —10-18
第二章 固体电子态
课程要求 •具体内容要点——第二章总结
1. 理解、掌握电子的波动性及其应用 2. 全面理解并掌握原子的内层电子状态 3. 了解并掌握固体原子的外层电子状态、特征和描述方法 4. 了解固体材料电子状态的一些实际应用 5.了解电子态的基本理论依据
课程内容框架
固体电子态——在材料学科中的应用
有关材料的研究工作,有大量的关于
材料科学基础第2章

菱方 Rhombohedral a=b=c, α=β=γ≠90º
四方(正方)Tetragonal a=b≠c, α=β=γ=90º
立方 Cubic a=b=c, α=β=γ=90º
简单菱方
简单四方 体心四方
简单立方 体心立方 面心立方
简单三斜
简单单斜
底心单斜
简单正交
体心正交
底心正交
面心正交
简单六方
回转对称轴(n)1,2,3,4,6
宏观对称性 元素 对称面(m)
对称中心(i) 回转 — 反演轴 1,2,3,4,6
微观对称性
元素
滑动面 螺旋轴
a,b,c,n,d 21;31,32;41,43,42;61,65,62,64,63
点群(point group)—晶体中所有点对称元素的集合 根据晶体外形对称性,共有32种点群 空间群(space group)—晶体中原子组合所有可能方式 根据宏观、微观对称元素在三维空间的组合,可能存在 230种空间群(分属于32种点群)
原子半径(atomic radius) R
配位数(coordination number)
致密度(Efficiency of space filling)
N
K
nv
n 4 R3
3
VV
轴比(axial ratio) c/a
堆垛(Stacking) 密排结构(close-packed crystal structure) 最密排面(close-packed plane of atoms) fcc {1 1 1} ABCABCABC······ hcp{0 0 0 1} ABABABAB······
晶系
三斜Triclinic a≠b≠c ,α≠β≠γ
材料科学基础-第2章

a b c,
90o
13
14种Bravais点阵
3. 正交Orthorhombic: 简单正交 (4) 底心正交 (5) 体心正交 (6) 面心正交 (7)
a b c,
90
o
14
14种Bravais点阵
4. 六方Hexagonal:
简单六方(8)
a x
O
b
y
点阵矢量
ruvw ua vb wc
11
7种晶系,14种布拉菲Bravais点阵
晶系 Crystal systems 点阵参数 Lattice parameters 布拉维点阵类型 Types of Bravais lattice 简单三斜(1) 简单单斜(2) 底心单斜(3) 简单正交(4) 底心正交(5) 体心正交(6) 面心正交(7) 简单六方(8) 实例 Instances K2CrO7 -S CaSO4•H2O Fe3C Ga -S Mg, Zn Cd, Ni, As As, Sb, Bi -Sn, TiO2 Fe, Cr, Cu, Ag, Ni,V
abc
90
abc
90%以上 的金属具 有立方晶 系和六方 晶系
12
90
14种Bravais点阵
1. 三斜Triclinic :简单三斜(1)
a b c,
90
o
2. 单斜Monoclinic : 简单单斜(2) 底心单斜(3)
(321)取倒数为 0.333,0.5 ,1
Z
(321)
Y
X
(200)、(333)等是否存在? 具有公因子的晶面不存在
材料科学基础-2

[ 1 11]
[1 1 1]
[1 1 1]
[11 1 ]
[1 1 1]
[1 1 1]
[1 1 1]
例:在一个面心立方晶胞中画出[012]、[123] 晶向。
晶面:通过空间点阵中任一组阵点的平面代表晶 体中的原子平面,称为晶面 晶面指数:表示晶体中点阵平面的指数,由晶面 与三个坐标轴的截距值所决定。 晶面指数的标定步骤: 建坐标:所定晶面不应通过原点; 求截距:求出待定晶面在三个坐标轴上的截距, 如果该晶面与某坐标轴平行,则其截距为∞; 取倒数:取三个截距值的倒数; 化整并加圆括号:将三个截距的倒数化为最小 整数h、k、l,并加圆括号,即(hkl),如果截距 为负值,则在负号标注在相应指数的上方。
正交
三、晶向指数与晶面指数(Miller指数)
晶向:空间点阵中各阵点列的方向代表晶体中原子排列的 方向,称为晶向,即空间点阵中任意两阵点的连接矢量。 晶向指数:表示晶体中点阵方向的指数。 晶向指数的确定步骤:
z
[ 1 11]
[112] • 建立坐标系; • 确定坐标值:在待定晶向上确定 [1 1 1] [1 1 0] 距原点最近的一个阵点的三个坐标值; • 化整并加方括号:将三个坐标值化为最小 [001] [111] 整数u、v、w,并加方括号。如有负值,在 [010] o 该数值上方标负号。 [100] [110]
• 在立方晶系中,具有相同指数的晶面和晶向 必定相互垂直。不适合其它晶系。 如: [121] (121) 即:晶向 [121] 为晶面 (121)的法向量。 ★ 因此,晶面指数可作为向量进行运算。
例:在一个面心立方晶胞中画出(102)、 (223) 晶面。
六方晶系的晶向指数和晶面指数
材料科学基础第二章材料的凝固

液体
晶核 新的晶核 晶核长大 晶粒相互接触 液体消失,结晶完成
液体
形核
长大
晶粒, 构成多晶体
长大
晶体
结晶的一般过程——形核和长大
第二章 材料的凝固-§2.3 金属结晶的原理
第三节 金属结晶的原理
一、结晶的热力学条件
金属结晶为什么需要过冷?
第三章 材料制备的基本过程-§3.1 金属的结晶
σ LB σ αB σ αL cosθ
L
式中:
-晶核与基底的接触角(润湿角);
L-晶核与液相之间的表面能; B -晶核与基底之间的表面能;
LB
LB - 液相与基底之间的表面能。
液相L
S1
晶核
B
r
基底B S2
非均匀形核示意图
在基底B上形成晶核时总的自由能
变化G :
G VGV GS
GS σ L S1 σ BS2 σ LBS2 σ L S1 (σ B σ LB )S2
第二章 材料的凝固-§2.3 金属结晶的原理
讨论:
当T >Tm 时,G=Gs-GL>0, 结晶不能进行。
当T =Tm 时,G=Gs-GL=0, 液、固两相处于动态平衡,
既能结晶,也会熔化。
当T <Tm 时,G=Gs-GL<0, 结晶能够进行。
G
T
Gs
GL
T T1 Tm T2
液、固两相自由能随温度 变化的关系曲线
第二章 材料的凝固-§2.3 金属结晶的原理
二、结晶的结构条件
有序原子团-晶到Tm以下时,一些尺寸较大的有序原子 团就会稳定下来,成为晶核的胚芽,即晶胚 (Embyro),晶胚在一定的条件下能够转变为晶 核。因此,结构起伏是结晶不可缺少的条件。
