甘薯β淀粉酶cDNA克隆及其在大肠杆菌中的表达
DNA分子标记技术在甘薯遗传育种研究中的应用

关键词: 甘薯; 遗传育种; 分子标记 1007- 7731( 2006) 09- 40- 04
App lication of DNA m olecu lar m arkers technology in the sw eetpotato breed ing
之发生倍增, 因此, 野生型向栽培型的进化可能直接与某 些重要基因的积累相关。而杂交育种的目的也往往在于 使某些有益基因 (如抗黑斑病基因 ) 尽可能集中在某一个 杂交品种, 从而获得优良品种 [ 3] 。
甘薯及其近缘野生种统称为甘薯组植物。根据同甘 薯的杂交亲和性, 可将甘薯组植物分为两大群, 一是同甘 薯杂交亲合的 A 群; 二是同甘薯杂交不亲合的 B 群 [ 11] 。 近年来在分子水平上证明了这种分类法, 例如 R ajapakse 等 [ 12] 利用 PCR 扩增不同甘薯组植物编码 - 淀粉酶的基 因 (长 1 1- 1 3kb包含一个内含子和为该内含子隔开的 两个外显子 ), 并进行克隆和测序, 根据内含子的变异程度 对实验中的甘薯组植物进行种间关系分析, 得到的结果与 目前的 甘 薯 分 类 法 ( A 群、B 群 ) 一 致; 实 验 还 发 现 I ram os issmi a和 I um braticola上的 外显子 序列与其 它 A 群植物存在很大差异, I toralis上的内含子与其它 B 群植 物相似, 但外显子则不然, 最重要的是该实验发现 B 群植 物在进化速率上要大于 A 群植物。根据甘薯的种内交配 亲和性, 又可将甘薯划为若干个不孕群, 包括 A - L, N - P 共 15个不孕群和一个亲和群, 每个不孕群受到一对等位 基因的控制, 并将该类基因称为 S 基因 [ 11] , 因此设计与该 类基因紧密连锁的分子标记, 或许可作为一种甘薯不孕群 测定的方法。 2 甘薯的遗传多样性分析与品种鉴定
芽孢杆菌β-淀粉酶基因在大肠杆菌中的克隆与表达

芽孢杆菌β-淀粉酶基因在大肠杆菌中的克隆与表达
王为先;张沁;申同健
【期刊名称】《遗传学报:英文版》
【年(卷),期】1993(20)4
【摘要】本工作采用新设计的营养缺陷型淘汰筛选法,从本实验室筛选的芽孢杆菌Bacillus R2中分离到能够水解生淀粉的β-淀粉酶基因。
该基因所在的DNA片段
为5.25kb,在大肠杆菌(E.coli)中的表达产物具有与供体菌相同的淀粉酶特性,实验
室条件下酶产量为500IU/ml以上,RDA值为57%,并且可以全部分泌到培养基中。
【总页数】7页(P374-380)
【关键词】β-淀粉酶;基因克隆;芽孢杆菌
【作者】王为先;张沁;申同健
【作者单位】中国科学院化工冶金研究所生化工程室;中国科学院生物物理研究所【正文语种】中文
【中图分类】Q939.110.3
【相关文献】
1.地衣芽孢杆菌α-耐高温淀粉酶基因的克隆及在大肠杆菌中的表达 [J], 潘风光;宋德群;任洪林;艾永兴;柳增善
2.地衣芽孢杆菌耐高温α-淀粉酶基因在大肠杆菌中的克隆、表达及其产物的分泌[J], 李金霞;蔡恒;路福平;杜连祥
3.地衣芽孢杆菌耐高温α-淀粉酶基因在大肠杆菌中的克隆及表达 [J], 蔡恒;陈忠军;
路福平;杜连祥
4.产β-淀粉酶菌株的筛选及β-淀粉酶基因在大肠杆菌中的克隆与表达 [J], 李猛;陈利飞;杨建楼;马春玲
5.嗜热脂肪芽孢杆菌耐热α-淀粉酶基因在大肠杆菌中的克隆和表达 [J],
N.Tsukagoshi;李尔炀
因版权原因,仅展示原文概要,查看原文内容请购买。
淀粉酶基因的构建及其在大肠杆菌(amp+)中的表达

淀粉酶基因的构建及其在大肠杆菌(amp+)中的表达一、相关背景淀粉酶是较早发现的酶类之一,早在1833年Payen和Persoz已首次从麦芽的水抽提物中用酒精沉淀分离到淀粉酶。
1894年高峰让吉从米曲霉(Aspergillus oryzae)中提取出作为消化剂的酶,即高峰淀粉酶。
1919年法国Boidin和Effront首次用枯草杆菌生产淀粉酶。
淀粉酶(amylase,AMY,AMS)是作用于可溶性淀粉、直链淀粉、糖元等α-1,4-葡聚糖,水解α-1,4-糖苷键的酶类的总称。
现在淀粉酶大致可分为四大类:第一类α-淀粉酶,广泛分布于动物(唾液、胰脏等)、植物(麦芽、山萮菜)及微生物。
第二类β-淀粉酶(EC3.2.1.2)从底物非还原性末端顺次水解每隔一个α-1,4糖苷键,切下的是麦芽糖单位。
第三类葡萄糖淀粉酶(EC3.2.1.3),习惯上简称糖化酶,从底物的非还原性末端顺次水解α-1,4糖苷键和分支的α-1,6键生成葡萄糖。
第四类解枝酶或异淀粉酶(EC3.2.1.9)只水解糖原或支链淀粉分支点α-1,6糖苷键,切下整个侧枝。
还有淀粉α-1,6葡萄糖酶是在分支点的葡萄糖单位仅一个时起作用。
淀粉酶是水解淀粉和糖原的酶类总称,通常通过淀粉酶催化水解织物上的淀粉浆料,由于淀粉酶退浆机械作用小,水的用量少,可以在低温条件下达到退浆效果,具有鲜明的环保特色。
除此之外,不同性质的α-淀粉酶还具有许多不同的用途。
耐热性α-淀粉酶,由于使用时温度提高,液化完全,用酶量少,操作比较容易,β-淀粉酶在食品工业中主要用于制造麦芽糖浆、啤酒、面包、酱油等。
在制醋工业中,常用β-淀粉酶代替部分麸曲节省成本,在白酒和其他工业中也可以用其作糖化剂。
在医药工业上,β-淀粉酶的一个重要用途是制造麦芽糖,医学上常用该酶和α-淀粉酶一道作为消化剂使用。
二、目前研究情况1 .国内外研究机构由于α-淀粉酶是具有重要应用价值的工业酶,国内外很多课题组对它进行了研究。
甘薯IbGL3的克隆和表达分析

㊀Guihaia㊀Oct.2018ꎬ38(10):1356-1362http://www.guihaia-journal.comDOI:10.11931/guihaia.gxzw201805058引文格式:徐靖ꎬ朱红林ꎬ朱家红ꎬ等.甘薯IbGL3的克隆和表达分析[J].广西植物ꎬ2018ꎬ38(10):1356-1362XUJꎬZHUHLꎬZHUJHꎬetal.CloningandexpressionanalysisofIbGL3inIpomoeabatatas[J].Guihaiaꎬ2018ꎬ38(10):1356-1362甘薯IbGL3的克隆和表达分析徐㊀靖1ꎬ朱红林1ꎬ朱家红2ꎬ符策强1ꎬ韩义胜1ꎬ唐力琼1ꎬ王敏芬ꎬ王新华1ꎬ王效宁1∗(1.海南省农业科学院粮食作物研究所ꎬ海南省农作物遗传育种重点实验室ꎬ农业部作物基因资源与种质创制海南科学观测实验站ꎬ海口571100ꎻ2.中国热带农业科学院热带作物生物技术研究所ꎬ海口571101)摘㊀要:紫色甘薯富含花青素ꎬ具有较高的食用和药用价值ꎮ花青素的生物合成受到结构基因和调节基因的控制ꎮbHLH(basichelix ̄loop ̄helixprotein)转录因子能够调节多个花青素结构基因的表达ꎬ在花青素生物合成途径中具有重要的调控作用ꎬ但目前在甘薯中还没有关于bHLH调控花青素生物合成的相关报道ꎮ为进一步了解IbGL3基因在甘薯花青素生物合成的功能和作用机理ꎬ该研究根据甘薯转录组数据ꎬ利用RT ̄PCR技术在甘薯中克隆了一个2120bp的bHLH基因IbGL3ꎬ该基因包含一个1878bp的开放阅读框ꎬ编码625个氨基酸ꎬ蛋白质分子量69.08kDꎬ理论等电点(pI)5.20ꎮIbGL3蛋白和其他植物中类黄酮合成相关的bHLH蛋白具有较高的同源性ꎬ都包含保守的MIR区㊁bHLH结构域和ACT类似结构域ꎮ系统发育进化树分析结果显示ꎬIbGL3与其他植物类黄酮相关bHLH蛋白聚为一类ꎬ属于Ⅲf亚类成员ꎮ表达结果显示ꎬIbGL3基因在紫色甘薯中的表达量最高ꎬ在浅紫色甘薯中的表达量次之ꎬ在白色甘薯中表达量最低ꎬ与花青素积累正相关ꎬ因此推测其在甘薯花青素生物合成途径中具有重要的调控作用ꎮ关键词:甘薯ꎬ花青素ꎬbHLH转录因子ꎬ基因表达中图分类号:Q943㊀㊀文献标识码:A㊀㊀文章编号:1000 ̄3142(2018)10 ̄1356 ̄07CloningandexpressionanalysisofIbGL3inIpomoeabatatasXUJing1ꎬZHUHonglin1ꎬZHUJiahong2ꎬFUCeqiang1ꎬHANYisheng1ꎬTANGLiqiong1ꎬWANGMinfen1ꎬWANGXinhua1ꎬWANGXiaoning1∗(1.InstituteofCerealCropsꎬHainanAcademyofAgriculturalSciencesꎬKeyLaboratoryofCropGeneticsandBreedingofHainanProvinceꎬScientificObservationStationforGeneResourcesandGermplasmCreationofHainanꎬMinistryofAgricultureꎬHaikou571100ꎬChinaꎻ2.InstituteofTropicalBiosciencesandBiotechnologyꎬChineseAcademyofTropicalAgriculturalSciencesꎬHaikou571101ꎬChina)Abstract:Anthocyanin ̄richpurplesweetpotatoshavehighedibleandmedicinalvalues.Anthocyaninbiosynthesisiscon ̄trolledbystructuralgenesandregulatorygenes.Thebasichelix ̄loop ̄helixprotein(bHLH)transcriptionfactorplaysanimportantroleinanthocyaninbiosynthesisbyregulatingmultiplestructuralgenes.Howeverꎬtherearenoreportsabout收稿日期:2018-07-03基金项目:海南省科研院所技术开发专项项目(KYYS ̄2018 ̄03)[SupportedbySpecialProgramforTechnologyDevelopmentHainanProvincialResearchInstitutes(KYYS ̄2018 ̄03)]ꎮ作者简介:徐靖(1981-)ꎬ女ꎬ安徽淮北人ꎬ硕士ꎬ副研究员ꎬ主要从事甘薯种质资源创新利用研究ꎬ(E ̄mail)jing_jing_xu@163.comꎮ∗通信作者:王效宁ꎬ研究员ꎬ主要从事作物种质资源创新利用研究ꎬ(E ̄mail)wxning2599@163.comꎮbHLHregulatinganthocyaninbiosynthesisinsweetpotato.Inordertofurtherunderstandthefunctionandmolecularmecha ̄nismofIbGL3inthebiosynthesisofanthocyaninsinsweetpotatoꎬinthisstudyꎬabHLHgenenamedIbGL3wasclonedinIpomoeabatatasbasedontranscriptomedataandRT ̄PCRtechnology.Thefull ̄lengthcDNAofIbGL3was2120bpꎬcontai ̄ning1878bpopeningreadingframe(ORF)ꎬandencoding625aminoacids.TheencodedproteinofIbGL3hasamolecularweightof69.08kDandthetheoreticalisoelectricpoint(pI)of5.20.TheIbGL3proteinhadhighlyconservedMIRmotifꎬbHLHdomainandACTdomainꎬsharedhighidentitiesandsimilardomainswithbHLHproteinsinvolvedinanthocyaninbi ̄osynthesisfromotherplants.PhylogeneticanalysisshowedthatIbGL3wasclusteredintheⅢfbHLHsubgrouptogetherwithotheranthocyanin ̄relatedbHLHproteins.TheexpressionofIbGL3inthestoragerootofdifferentsweetpotatovarietieswasdetectedbyquantitativepolymerasechainreaction(qPCR).TheresultsindicatedthatIbGL3wasmainlyexpressedinpur ̄ple ̄fleshedsweetpotatoꎬfollowedbylightpurple ̄fleshedsweetpotatoandweaklyexpressedinwhite ̄fleshedsweetpotatoꎬanditsexpressionwaspositivelyrelatedtotheaccumulationofanthocyaninIpomoeabatatas.TheresultsshowedthatIbGL3maybeinvolvedinregulatinganthocyaninbiosynthesisinIpomoeabatatas.Keywords:IpomoeabatatasꎬanthocyaninꎬbHLHtranscriptionfactorꎬgeneexpression㊀㊀花青素是一种存在于植物体内的类黄酮化合物ꎬ不仅在植物的花着色㊁抵御紫外线伤害㊁防止病源微生物侵袭等过程中起决定作用ꎬ还具有重要的营养价值和医疗保健功效(Pancheetalꎬ2016ꎻLilaꎬ2008)ꎮ花青素生物合成途径在模式植物中已得到广泛研究ꎬ相关基因已在多种植物中得到分离(Hichrietalꎬ2011ꎻAlbertetalꎬ2014ꎻWangetalꎬ2015)ꎮ植物类花青素生物合成主要受两类基因控制:一类是结构基因ꎬ编码与类黄酮生物合成有关的各种酶类ꎻ另一类是调节基因ꎬ其编码的转录因子通过调控多个结构基因的表达参与对类黄酮次生代谢的调控(Hichrietalꎬ2011ꎻWangetalꎬ2015)ꎮ研究证实ꎬ花青素的生物合成主要受到转录因子MYB㊁bHLH和WD40组成的MYB ̄bHLH ̄WD40(MBW)转录复合体的调控(Xuetalꎬ2015)ꎮbHLH转录因子是一类含有basichelix ̄loop ̄helix(bHLH)结构域的转录因子ꎬ根据结构特征可分为12个亚类(I-Ⅻ)ꎬ而调控类黄酮生物合成的bHLH蛋白主要集中在Ⅲf亚类(Xuetalꎬ2015ꎻHeimetalꎬ2003)ꎮ拟南芥中与调控花青素生物相关的bHLH转录因子主要有TT8/AtbHLH42㊁GL3/AtbHLH1和EGL3/AtbHLH2(Gonzalezetalꎬ2008)ꎮ首个调控花青素生物合成的bHLH基因在玉米中得到分离和鉴定(Chandleretalꎬ1989)ꎮ目前ꎬ已在菊花(Chrysanthemums)㊁苹果(Malusdomestica)和荔枝(Litchichinensis)等多种植物中得到分离和鉴定ꎬ这些转录因子大都能激活多个类黄酮生物合成关键酶基因的表达(Xiangetalꎬ2015ꎻXuetalꎬ2017ꎻLaietalꎬ2016)ꎮ甘薯是世界上广泛种植的粮食和经济作物(Huetalꎬ2016)ꎮ作为一种联合国粮食农业组织推荐的健康食品ꎬ甘薯富含淀粉㊁纤维素及多种有益的次生代谢物ꎬ如β胡萝卜素和花青素(Liuetalꎬ2017)ꎮ不同的甘薯品种中ꎬ紫肉甘薯富含的花青素ꎬ具有较高的食用和药用价值(Lietalꎬ2013)ꎮ相对于模式植物而言ꎬ甘薯花青素生物合成和调控机理研究相对滞后ꎬ目前还没有关于bHLH蛋白调控花青素生物合成的相关报道(李霞等ꎬ2014)ꎮ在先前的研究中ꎬ笔者通过对不同肉色甘薯品种进行了比较转录组学分析ꎬ筛选到一批与花青素积累相关的差异表达基因ꎬ获得1条与其它植物中GL3高度同源的EST序列ꎮ本研究将克隆IbGL3基因ꎬ并对其进行生物信息学分析ꎬ检测其表达特征与花青素积累的相关性ꎬ为进一步揭示该基因在甘薯花青素生物合成中的功能和作用机制奠定基础ꎮ1㊀材料与方法1.1材料供试的甘薯材料种植于海南农业科学院永发753110期徐靖等:甘薯IbGL3的克隆和表达分析基地ꎮ选取种植5个月后生长发育基本一致的白色㊁浅紫色和紫色甘薯品种的新鲜块根为实验材料用于RNA提取和花青素的测定ꎮ1.2花青素提取和测定采用1%盐酸溶液作为提取液提取甘薯块根花青素ꎬ采用分光光度法测定花青素含量ꎬ具体参考刘桂玲等(2007)的方法ꎮ1.3核酸提取和cDNA的合成甘薯块根中RNA提取采用天根多糖多酚植物总RNA提取试剂盒ꎻ按照ThermoScientificFirstStrandcDNASynthesisKit说明书将RNA反转录合成cDNA第一链ꎮ1.4基因克隆和序列分析根据转录组数据中注释为GL3的EST序列ꎬ设计5ᶄ端特异引物PGL3F:5ᶄ ̄GCCCAGTTTGT ̄TCAAGAGCC ̄3ᶄ和5ᶄ端引物PGL3R:5ᶄ ̄AGTTAGG ̄GATAAACCTTTGCT ̄3ᶄꎬ以甘薯cDNA为模板对IbGL3进行扩增ꎮ扩增产物经琼脂糖凝胶电泳鉴定ꎬ回收目的条带与pMD19 ̄T载体连接并转化大肠杆菌DH5αꎬ通过蓝白斑筛选和菌落PCR鉴定阳性克隆ꎬ送诺赛基因公司测序ꎮ利用ExPASy在线软件(https://www.expasy.org/)分析预测蛋白的氨基酸组成㊁分子式㊁分子量㊁等电点㊁稳定性和亲水性等ꎻ利用PSORT(http://psort1.hgc.jp/form.html)预测亚细胞定位ꎻ利用SignalP(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽分析ꎻ利用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)预测跨膜结构ꎻ利用DNAMAN软件进行氨基酸序列比对分析ꎻ利用MEGA7进行进化树分析ꎮ1.5基因表达分析利用SYBR SelectMasterMix试剂盒在Mx3005PReal ̄TimePCRSystem上进行qPCR分析ꎮ内参基因为Actinꎬ引物序列为ACT ̄F(5ᶄ ̄CT ̄GGTGTTATGGTTGGGATGG ̄3ᶄ)和ACT ̄R(5ᶄ ̄GGGGTGCCTCGGTAAGAAG ̄3ᶄ)ꎻ目的基因引物GE3 ̄F(5ᶄ ̄CATCTGGACTGCGAAACTATCC ̄3ᶄ)和GE3 ̄R(5ᶄ ̄GCTGGTGATGGTGACGTTAAT ̄3ᶄ)ꎮqPCR反应体积20μL:10μL2ˑSYBRmixꎬ正反向引物各1μL(10μmol L ̄1)ꎬ1μLcDNA模板ꎬ7μLddH2OꎮqPCR反应条件:95ħ10minꎻ95ħ15sꎬ60ħ30sꎬ72ħ30sꎬ40个循环ꎮ2㊀结果与分析2.1IbGL3的克隆根据在甘薯转录组数据中获得的IbGL3基因的EST序列ꎬ设计特异引物对该基因的全长序列进行扩增ꎬ获得一条2100bp左右的特异条带(图1)ꎮ将目的片段连接到T载体上进行测序ꎬ测序结果与通过转录组测序得到结果一致ꎬ将该基因命名为IbGL3ꎮ本研究获得的IbGL3基因全长2120bpꎬ包含一个1878bp完整的开放阅读框ꎮ注:M.DL2000Markerꎻ1.PCR扩增产物ꎮNote:M.DL2000Markerꎻ1.PCRproduct.图1㊀IbGL3的扩增电泳图Fig.1㊀ElectrophoreticresultofIbGL3PCRproduct2.2IbGL3的分子特征IbGL3编码蛋白由625个氨基酸组成ꎬ其中丝氨酸(Ser)最多ꎬ有63个ꎬ占比达到10.1%ꎮIbGL3蛋白分子式为C2982H4784N854O982S24ꎬ预测分子量为69.08kDꎬ理论等电点5.20ꎬ不稳定系数为43.06ꎬ被归类为不稳定蛋白ꎻ总平均疏水指数为-0.555ꎬ属于亲水性蛋白ꎮ亚细胞定位预测显示IbGL3定位在细胞核内的可能性最大ꎬ核定位信号(PSSKKRKASKT)位于C-端ꎮ信号肽分析显示IbGL3蛋白没有信号肽ꎬ不属于分泌蛋白ꎮ跨膜结构域分析显示IbGL3蛋白无跨膜结构域ꎮ8531广㊀西㊀植㊀物38卷注:三角形标示IbGL3ꎻ圆形标示其他植物花青素合成相关的bHLHsꎮNote:IbGL3ismarkedwithtriangleꎻbHLHsinvolvedinanthocyaninbiosynthesisaremarkedwithblackdots.图2㊀IbGL3的进化分析Fig.2㊀PhylogeneticanalysisofIbGL32.3IbGL3的进化和同源性分析为进一步了解IbGL3的功能和进化特征ꎬ将IbGL3氨基酸序列与拟南芥不同亚类的bHLH蛋白及其他植物中已鉴定的与花青素合成相关的bHLH蛋白一起聚类分析ꎬ结果显示IbGL3与TT8㊁GL3和EGL3聚在一起ꎬ属于Ⅲf亚类成员(图2)ꎮ目前ꎬ在不同植物中鉴定的调控花青素生物合成的bHLH蛋白大都属于Ⅲf亚类ꎬ这说明IbGL3可能具有调控甘薯花青素生物合成的功能ꎮ将IbGL3和其他调控花青素的bHLH蛋白进行序列比对ꎬ发现这些蛋白都包含3个保守的结构域:N端与MYB蛋白互作的MIR区㊁bHLH结构域和位于C端的ACT类似结构域(图3)ꎮ2.4IbGL3表达与花青素积累的相关性分析利用定量PCR技术检测了IbGL3在不同肉色甘薯块根中的表达特征ꎬ发现IbGL3在紫色甘薯中953110期徐靖等:甘薯IbGL3的克隆和表达分析注:划线处为保守的结构域MIR区㊁bHLH结构域和CAT结构域ꎮNote:ConservedMIRdomainꎬbHLHdomainandCATdomainareunderlined.图3㊀IbGL3和其他植物花青素相关的bHLHs的序列比对Fig.3㊀AlignmentofIbGL3andanthocyanin ̄relatedbHLHsformotherplants的表达量最高ꎬ在浅紫甘薯中的表达量次之ꎬ在白色甘薯中表达量最低ꎬ与甘薯花青素含量正相关(图4)ꎮ3㊀讨论与结论bHLH转录因子是一类真核生物中存在最广泛的一大类转录因子ꎬ在植物细胞大小和命运调控㊁激素响应㊁金属体内平衡㊁光形态发生和花器官发育等多种生理过程中具有重要的调控作用(Heimetalꎬ2003ꎻFelleretalꎬ2011ꎻYangetalꎬ2017)ꎮ调节花青素生物合成的bHLH转录因子大都属于Ⅲf亚类ꎬ通过改变或过表达花青素合成相关bHLH基因能够影响植物体内花青素的积累(Xuetalꎬ2015ꎻLietalꎬ2016ꎻLimetalꎬ2017)ꎮ本研究在甘薯中克隆一个编码bHLH与拟南芥GL3同源的基因IbGL3ꎬ其编码区全长为1878bpꎬ编码625个氨基酸ꎮ亚细胞定位预测显示ꎬIbGL3蛋白定位在细胞核内ꎬ说明IbGL3在细胞核内发挥功能ꎮ进化分析显示ꎬIbGL3属于Ⅲf亚族的0631广㊀西㊀植㊀物38卷注:A.不同品种甘薯花青素含量ꎻB.不同品种甘薯IbGL3表达量ꎻ1㊁2和3分别代表白色㊁浅紫和紫色甘薯ꎮNote:A.ContentofanthocyanininthestoragerootofdifferentsweetpotatovarietiesꎻB.ExpressionofIbGL3inthestoragerootofdifferentsweetpotatovarietiesꎻ1ꎬ2and3representwhite ̄ꎬlightpurple ̄andpurple ̄fleshedsweetpotatorespectively.图4㊀IbGL3的表达与花青素积累的相关性Fig.4㊀CorrelationbetweenIbGL3expressionandanthocyaninaccumulationbHLH转录因子ꎬ与其他植物中花青素合成相关的bHLH蛋白具有较高的同源性ꎬ都含有保守的MIR区㊁bHLH结构域和ACT结构域ꎮbHLH转录因子通常与MYB转录因子相互作用协同调控花青素的生物合成ꎬMIR区是bHLH与MYB蛋白互作区位于bHLH的N端(Heimetalꎬ2003ꎻFelleretalꎬ2011)ꎮbHLH结构域是DNA结合结构域ꎬ能形成同源或异源二聚体ꎬ这是bHLH蛋白与DNA结合的前提(Heimetalꎬ2003ꎻFelleretalꎬ2011)ꎮACT类似结构域位于C端ꎬ是一段富含酸性氨基酸的序列ꎬ该区域能够与RNA聚合酶Ⅱ结合并启动转录ꎻ此外ꎬ该区域也与bHLH二聚体的形成有关(Felleretalꎬ2006)ꎮ功能预测分析表明IbGL3可能具有调控甘薯花青素生物合成的功能ꎮ表达分析显示ꎬIbGL3在紫色甘薯中大量表达ꎬ在浅紫色甘薯中的表达量次之ꎬ而在白色甘薯中表达量最低ꎬ与花青素积累正相关ꎬ进一步说明IbGL3可能是甘薯花青素生物合成的调控基因ꎮ下一步将进一步研究IbGL3在花青素生物合成中的生物学功能和调控机理ꎬ为甘薯花青素生物合成遗传改良奠定基础ꎮ参考文献:ALBERTNWꎬDVIESKMꎬLEWISDHꎬetalꎬ2014.Acon ̄servednetworkoftranscriptionalactivatorsandrepressorsregulatesanthocyaninpigmentationineudicots[J].PlantCellꎬ26(3):962-980.CHNDLERVLꎬRADICELLAJPꎬROBBINSTPꎬetalꎬ1989.Tworegulatorygenesofthemaizeanthocyaninpathwayarehomologous:isolationofButilizingRgenomicsequences[J].PlantCellꎬ1(12):1175-1183.FELLERAꎬHERMANDEZJMꎬGROTEWOLDEꎬ2006.AnACT ̄likedomainparticipatesinthedimerizationofseveralplantbasic ̄helixloop ̄helixtranscriptionfactors[J].JBiolChemꎬ281(39):28964-28974.FELLERAꎬMACHEMERKꎬBRAUNELꎬetalꎬ2011.Evolu ̄tionaryandcomparativeanalysisofMYBandbHLHplanttranscriptionfactors[J].PlantJꎬ66(1):94-116.GONZALEZAꎬZHAOMꎬLEAVITTJMꎬetalꎬ2008.Regula ̄tionoftheanthocyaninbiosyntheticpathwaybytheTTG1/bHLH/MybtranscriptionalcomplexinArabidopsisseedling[J].PlantJꎬ53(5):814-827.HEIMMAꎬJAKOBYMꎬWERBERMꎬetalꎬ2003.Thebasichelix ̄loophelixtranscriptionfactorfamilyinplants:agenome ̄widestudyofproteinstructureandfunctionaldiversity[J].MolBiolEvolꎬ20(5):735-747.HICHRIIꎬBARRIEUFꎬBOGSJꎬetalꎬ2011.Recentadvancesinthetranscriptionalregulationoftheflavonoidbio ̄syntheticpathway[J].JExpBotꎬ62(8):2465.HUYJꎬDENGLQꎬCHENJWꎬetalꎬ2016.Ananalyticalpipelinetocompareandcharacterisetheanthocyaninantioxi ̄dantactivitiesofpurplesweetpotatocultivars[J].FoodChemꎬ194:46-54.LAIBꎬDULNꎬLIURꎬetalꎬ2016.TwoLcbHLHtranscriptionfactorsinteractingwithLcMYB1inregulatinglatestructuralgenesofanthocyaninbiosynthesisinNicotianaandLitchichinensisduringanthocyaninaccumulation[J].FrontPlant163110期徐靖等:甘薯IbGL3的克隆和表达分析Sciꎬ7(212):166.LILAMAꎬ2008.Anthocyaninsandhumanhealth:aninvitroinvestigativeapproach[J].JBiomedBiotechnolꎬ(5):306-313.LIJꎬLIXDꎬZHANGYꎬetalꎬ2013.Identificationandthermalstabilityofpurple ̄fleshedsweetpotatoanthocyaninsinaqueoussolutionswithvariouspHvaluesandfruitjuices[J].FoodChemꎬ136(3-4):1429-1434.LIMSHꎬKIMDHꎬKIMJKꎬetalꎬ2017.Aradishbasichelix ̄loop ̄helixtranscriptionfactorꎬRsTT8actsapositiveregulatorforanthocyaninbiosynthesis[J].FrontPlantSciꎬ8:1917.LIXꎬWANGXꎬLIUYJꎬetalꎬ2014.Progressonanthocyaninbiosynthesisofsweetpotato[J].MolPlantBreedꎬ12(3):567-576.[李霞ꎬ王欣ꎬ刘亚菊ꎬ等ꎬ2014.甘薯花青苷生物合成调控研究进展[J].分子植物育种ꎬ12(3):567-576.]LIYꎬSHANXꎬGAORꎬetalꎬ2016.TwoⅢfclade ̄bHLHsfromFreesiahybridaplaydivergentrolesinflavonoidbiosyn ̄thesisandtrichomeformationwhenectopicallyexpressedinArabidopsis[J].SciRepꎬ6:30514.LIUGLꎬLIHXꎬGUOBHꎬetalꎬ2007.Effectsofdifferentex ̄tractionmethodsonanthocyanincontentdetectioninsweetpotato[J].ChinAgricSciBullꎬ23(4):91-94.[刘桂玲ꎬ李海霞ꎬ郭宾会ꎬ等ꎬ2007.不同提取方法对甘薯花青素含量测定的影响[J].中国农学通报ꎬ23(4):91-94.]LIUXꎬXIANGMꎬFANYꎬetalꎬ2017.Aroot ̄preferentialDFR ̄likegeneencodingdihydrokaempferolreductaseinvolvedinanthocyaninbiosynthesisofpurple ̄fleshedsweetpotato[J].FrontPlantSciꎬ8(8227):279.PANCHEANꎬDIWANADꎬCHANDRASRꎬ2016.Flavonoids:Anoverview[J].JNutrSciꎬ5:e47.WANGHꎬLIMFꎬYANGYꎬetalꎬ2015.Recentadvancesonthemolecularmechanismsofanthocyaninsynthesisinfruits[J].PlantPhysiolJꎬ51(1):29-43.XIANGLLꎬLIUXFꎬLIXꎬetalꎬ2015.AnovelbHLHtran ̄scriptionfactorinvolvedinregulatinganthocyaninbiosynthesisinChrysanthemums(ChrysanthemummorifoliumRamat.) [J].PLoSONEꎬ10(11):e0143892.XUHꎬWANGNꎬLIUJꎬetalꎬ2017.Themolecularmecha ̄nismunderlyinganthocyaninmetabolisminappleusingtheMdMYB16andMdbHLH33genes[J].PlantMolBiolꎬ94(1-2):149-165.XUWꎬDUBOSCꎬLEPINIECLꎬetalꎬ2015.TranscriptionalcontrolofflavonoidbiosynthesisbyMYB ̄bHLH ̄WDRcom ̄plexes[J].TrendsPlantSciꎬ20(3):176-185.YANGJꎬGAOMꎬHUANGLꎬetalꎬ2017.Identificationandexpressionanalysisoftheapple(Malusˑdomestica)basichelix ̄loop ̄helixtranscriptionfactorfamily[J].SciRepꎬ7(1):28.SENLꎬSUYJꎬZHANGBꎬetalꎬ2010.AdaptiveevolutionoftherbcLgeneinpteridaceousferns[J].JTropSubtropBotꎬ18(1):1-8.[森林ꎬ苏应娟ꎬ张冰ꎬ等ꎬ2010.凤尾蕨科植物rbcL基因的适应性进化分析[J].热带亚热带植物学报ꎬ18(1):1-8.]SUNYLꎬLIQMꎬYANGJYꎬetalꎬ2005.Morphologicalvaria ̄tioninconesandseedsinAbieschensiensis[J].ActaEcolSinꎬ25(1):176-181.[孙玉玲ꎬ李庆梅ꎬ杨敬元ꎬ等ꎬ2005.秦岭冷杉球果与种子的形态变异[J].生态学报ꎬ25(1):176-181.]2631广㊀西㊀植㊀物38卷。
甘薯Iborf56_基因的克隆与表达分析

山西农业科学 2023,51(6):610-619Journal of Shanxi Agricultural Sciences甘薯Iborf56基因的克隆与表达分析常璐,董海涛,吕运韬,赵彩良,唐锐敏,贾小云(山西农业大学生命科学学院,山西太谷 030801)摘要:为了研究甘薯叶绿体基因Iborf56的表达是否受到盐胁迫的诱导以及对生长发育的影响,为甘薯的品种选育提供参考,以栗子香为研究材料,从中克隆Iborf56基因,通过生物信息学方法分析其蛋白序列特征,亚细胞定位预测、系统发育分析、调控元件分析、不同组织及盐胁迫表达模式,以及qPCR验证该基因的表达量。
结果表明,Iborf56与已知序列相似度为99.28%,开放阅读框长度为929 bp,编码60个氨基酸,含有8个磷酸化位点,没有信号肽和跨膜区,不具有分泌蛋白的特性,主要由α-螺旋组成;亚细胞定位在叶绿体基质中;进化树分析表明,Iborf56与三浅裂野牵牛(Ipomoea trifida)和三裂叶薯(Ipomoea triloba)的遗传距离最近;启动子元件分析发现,该基因启动子区域含有光响应元件、抗逆和激素应答等功能元件。
转录组以及实时荧光qRT-PCR定量分析表明,Iborf56在甘薯叶片中的表达量最高且随生长时间增加呈显著上升趋势,推测该基因参与甘薯的生长发育;此外,Iborf56基因的表达量随盐胁迫时间表现为先升后降的趋势,且该基因在盐胁迫下12 h时达到了临界值,暗示其可能参与甘薯盐胁迫响应。
关键词:甘薯;Iborf56基因;基因克隆;生物信息学分析;表达模式分析中图分类号:S531 文献标识码:A 文章编号:1002‒2481(2023)06‒0610‒10Cloning and Expression Analysis of Sweet Potato Iborf56 GeneCHANG Lu,DONG Haitao,LÜ Yuntao,ZHAO Cailiang,TANG Ruimin,JIA Xiaoyun(College of Life Sciences,Shanxi Agricultural University,Taigu 030801,China)Abstract:To investigate whether the expression of the chloroplast gene Iborf56 in sweet potato is induced by salt stress and its effect on growth and development, and provide a reference for sweet potato breeding, in this study, the sweet potato variety, Chestnut Fragrance, was used as the research material to clone the Iborf56gene. The protein sequence features, subcellular localization prediction, phylogenetic analysis, regulatory element analysis, expression patterns under different tissues and salt stress were analyzed using bioinformatics methods, and qPCR was used to validate the expression level of Iborf56. The results showed that Iborf56had a 99.28% similarity with known sequences from NCBI and an open reading frame length of 929 bp, encoding 60 amino acids with 8 phosphorylation sites. The Iborf56 protein lacked signal peptides and transmembrane regions and did not possess the characteristics of secreted proteins. It was mainly composed of α-helices and its subcellular localization was in the chloroplast stroma. Phylogenetic tree analysis showed that Iborf56had the closest genetic distance to Ipomoea trifida and Ipomoea triloba. Promoter element analysis revealed that the promoter region of this gene contained functional elements such as light response, stress response, and hormone response. Transcriptome and qRT-PCR quantitative analysis showed that the expression level of Iborf56 was the highest in sweet potato leaves and increased significantly with growth time, inferring that this gene may be involved in the growth and development of sweet potatoes. In addition, the expression level of the Iborf56gene showed an upward trend first and then a downward trend with increasing salt stress time, and the critical value was reached after 12 h under salt stress, indicating that it may be involved in the salt stress response of sweet potatoes.Key words:sweet potato; Iborf56 gene; gene cloning; bioinformatics analysis; expression pattern analysis甘薯(Ipomoea batatas(L.) Lam.)属旋花科番薯属1年生或多年生双子叶草本植物,是世界上第二大根茎作物,且对各种气候和耕作制度都有广泛适应性[1]。
甘薯_IbHKT-like_基因的克隆与表达分析

江苏农业学报(JiangsuJ.ofAgr.Sci.)ꎬ2021ꎬ37(4):831 ̄838http://jsnyxb.jaas.ac.cn蒋㊀薇ꎬ靳㊀容ꎬ刘㊀明ꎬ等.甘薯IbHKT ̄like基因的克隆与表达分析[J].江苏农业学报ꎬ2021ꎬ37(4):831 ̄838.doi:10.3969/j.issn.1000 ̄4440.2021.04.003甘薯IbHKT ̄like基因的克隆与表达分析蒋㊀薇1ꎬ㊀靳㊀容1ꎬ㊀刘㊀明1ꎬ㊀赵㊀鹏1ꎬ㊀张爱君1ꎬ㊀王丹凤1ꎬ㊀李铁鑫2ꎬ㊀范文静2ꎬ㊀唐忠厚1(1.江苏徐淮地区徐州农业科学研究所/中国农业科学院甘薯研究所ꎬ江苏徐州221131ꎻ2.安徽农业大学农学院ꎬ安徽合肥230036)收稿日期:2020 ̄12 ̄06基金项目:国家重点研发计划项目(2018YFD1000704)ꎻ国家自然科学基金项目(31771721)ꎻ国家甘薯产业技术体系项目(CARS ̄11)作者简介:蒋㊀薇(1996-)ꎬ女ꎬ江苏常州人ꎬ硕士研究生ꎬ主要从事甘薯栽培生理与生态研究ꎮ(E ̄mail)1298081288@qq.com通讯作者:唐忠厚ꎬ(E ̄mail)zhonghoutang@sina.com㊀㊀摘要:㊀植物高亲和钾转运体HKT基因具有Na+(或K+)单向运输或Na+ ̄K+共转运作用ꎮ为了探究甘薯高亲和钾转运体HKT的离子转运情况及其对非生物胁迫的响应ꎬ本研究克隆得到1个甘薯钾离子转运体IbHKT ̄like基因ꎮ生物信息学分析结果表明ꎬIbHKT ̄like基因序列全长为1647bpꎬ编码548个氨基酸ꎮIbHKT ̄like蛋白有2个TrkH(细菌钾转运系统Trk亚基)保守结构域ꎬ10个跨膜片段ꎮ进化树分析结果表明ꎬIbHKT ̄like蛋白与旋花科的矮牵牛InHKT6氨基酸序列十分相似ꎬ相似度为90 63%ꎮ亚细胞定位结果显示ꎬIbHKT ̄like蛋白主要定位在细胞质膜ꎬ在叶绿体中存在少量分布ꎮ组织特异性分析结果表明ꎬIbHKT ̄like基因在叶中表达量最高ꎮ实时荧光定量PCR结果显示ꎬIbHKT ̄like基因的表达受到低温㊁干旱㊁高盐及过氧化氢胁迫的诱导ꎬ说明IbHKT ̄like基因可能在甘薯抵御非生物胁迫中发挥着重要的作用ꎮ关键词:㊀甘薯ꎻIbHKT ̄like基因ꎻ基因克隆ꎻ表达分析ꎻ亚细胞定位中图分类号:㊀Q786㊀㊀㊀文献标识码:㊀A㊀㊀㊀文章编号:㊀1000 ̄4440(2021)04 ̄0831 ̄08CloningandexpressionanalysisofIbHKT ̄likegeneinsweetpotatoJIANGWei1ꎬ㊀JINRong1ꎬ㊀LIUMing1ꎬ㊀ZHAOPeng1ꎬ㊀ZHANGAi ̄jun1ꎬ㊀WANGDan ̄feng1ꎬ㊀LITie ̄xin2ꎬFANWen ̄jing2ꎬ㊀TANGZhong ̄hou1(1.XuzhouInstituteofAgriculturalSciencesofXuhuaiDistrictofJiangsuProvince/SweetPotatoResearchInstituteꎬChineseAcademyofAgriculturalSci ̄encesꎬXuzhou221131ꎬChinaꎻ2.CollegeofAgronomyꎬAnhuiAgriculturalUniversityꎬHefei230036ꎬChina)㊀㊀Abstract:㊀TheplanthighaffinitypotassiumtransporterHKTgenehadNa+(orK+)unidirectionaltransporteffectorNa+ ̄K+co ̄transporteffect.ToexploretheiontransportofhighaffinitypotassiumtransporterHKTinsweetpotatoanditsre ̄sponsetoabioticstressꎬapotassiumtransporterIbHKT ̄likegeneofsweetpotatowasclonedinthisstudy.Resultsofbioinfor ̄maticsanalysisshowedthatꎬthefulllengthofIbHKT ̄likegenesequencewas1647bpꎬencoding548aminoacids.TheIbH ̄KT ̄likeproteinhadtwoTrkH(Trksubunitofpotassiumtransportsysteminbacteria)conservativedomainsandtentrans ̄membranefragments.ResultsofevolutionarytreeanalysisshowedthatꎬtheaminoacidsequenceofIbHKT ̄likeproteinwasverysimilartothatofInHKT6inpetuniaofConvolvulaceaeꎬwiththesimilarityof90.63%.SubcellularlocalizationshowedthatꎬtheIbHKT ̄likeproteinmainlylocatedinthecytoplasmicmembraneandrarelylocatedinthechloroplast.Resultsoftis ̄sue ̄specificanalysisshowedthatꎬtheexpressionquantityofIbHKT ̄likegenewasthehighestintheleaves.Theresultsofreal ̄timefluorescentquantitativePCRshowedthatꎬtheex ̄pressionofIbHKT ̄likegenewasinducedbylowtempera ̄tureꎬdroughtꎬhighsalinityandhydrogenperoxideꎬindica ̄tingthatIbHKT ̄likegenemayplayanimportantroleintheresistanceofsweetpotatotoabioticstress.Keywords:㊀sweetpotatoꎻIbHKT ̄likegeneꎻgene138cloningꎻexpressionanalysisꎻsubcellularlocalization㊀㊀钾元素约占地壳总质量的2.1%~2 3%ꎬ是地球上第七大元素ꎬ同时钾作为作物生长所必需的大量矿质营养元素之一ꎬ对于作物的生长㊁产量㊁品质以及作物对非生物环境胁迫的适应均十分重要[1]ꎮ但中国土壤中有效钾含量偏低ꎬ且低钾胁迫现象在中国甘薯种植区十分普遍ꎬ成为甘薯优质高产的主要制约因素之一ꎮ高亲和钾离子转运体HKT(High ̄affinityK+transporter)是Na+(K+)单向转运体或Na+ ̄K+共转运体的总称ꎬ它由N端短胞质区㊁C端短胞质区及1个带有4个重复MPM基序(1TMS ̄1P ̄1TMS)区域的疏水核心结构组成ꎬ每个基序由2个跨膜区域和1个保守的成孔结构域(P ̄loop)组成ꎮ4个P ̄loop最终排列形成中心的渗透路径[2]ꎮ根据异源表达系统的功能研究和系统发育分析ꎬ在被子植物中ꎬHKT家族可分为2个亚家族ꎮ亚家族I和亚家族II的离子选择特性取决于HKT转运蛋白第1个PA ̄loop保守位点的氨基酸ꎮ亚家族I的4个P ̄loop保守位点的氨基酸为丝氨酸 ̄甘氨酸 ̄甘氨酸 ̄甘氨酸(Ser ̄Gly ̄Gly ̄Gly)ꎬ主要存在于双子叶植物中ꎬ具有Na+转运功能ꎻ亚家族II的4个P ̄loop保守位点的氨基酸为甘氨酸 ̄甘氨酸 ̄甘氨酸 ̄甘氨酸(Gly ̄Gly ̄Gly ̄Gly)ꎬ主要存在于单子叶植物中ꎬ亚家族II不仅是K+ ̄Na+共转运体ꎬ在外界环境影响下ꎬ亦可作为Na+或K+单向转运体[3]ꎮ迄今为止ꎬ人们已对拟南芥[4 ̄5]㊁水稻[6 ̄7]㊁小麦[8 ̄9]㊁小花碱茅[10 ̄11]㊁胡杨[12]等多种作物的HKT蛋白进行了克隆和分析ꎬHKT转运体的K+运输功能主要在异源表达系统得到验证ꎬ小麦TaHKT1转运体参与钾离子运输[13]ꎬ在大肠杆菌㊁酵母的缺陷体中过表达McHKT1㊁OsHKT1基因ꎬ能够弥补钾离子吸收缺陷[14 ̄16]ꎮAtHKT1基因通过在拟南芥根中过表达来减少Na+向叶运输ꎬ降低叶中Na+浓度ꎮOsH ̄KT8(SKC1)基因参与韧皮部汁液的再循环过程ꎬ将Na+从地上部转移至根中ꎬ降低Na+浓度ꎬ进而提高作物的耐盐性[17 ̄18]ꎮ甘薯[Ipomoeabatatas(L.)Lam.]广泛栽培于热带㊁亚热带地区ꎬ具有耐贫瘠㊁适应性强等特性ꎬ是一种重要的 喜钾 粮食作物ꎮ在甘薯中ꎬ一些HKT家族基因已被克隆研究ꎬPark等[19]在研究烟草瞬时表达时发现IbHKT1基因能吸收钠离子ꎬ酵母互补试验发现IbHKT1在没有氯化钠存在的情况下能吸收钾离子ꎮ本课题组前期通过转录组数据共挖掘了4个IbHKT基因[20]ꎬ通过qRT ̄PCR分析发现IbHK ̄Ts受低钾诱导表达ꎬ且在不同耐低钾甘薯品种中的表达量存在差异ꎮ但目前对于甘薯吸收和转运钾离子的机理尚不清楚ꎮ本研究在此基础上ꎬ再次克隆得到1个甘薯IbHKT ̄like基因ꎬ并对其进行了生物信息学分析㊁表达模式分析和亚细胞定位ꎬ为甘薯IbHKT ̄like基因的功能鉴定及甘薯耐低钾分子机制研究奠定基础ꎮ1㊀材料与方法1.1㊀试验材料本试验所用甘薯品种为徐薯32号(由江苏徐州甘薯研究中心育成)和普薯32号(由普宁市农业科学院育成)ꎬ试验材料种植于苗圃温室ꎬ常规管理ꎮ1.2㊀IbHKT1基因克隆根据课题组前期甘薯转录组测序数据获得IbH ̄KT ̄like基因序列ꎬ设计IbHKT ̄like基因特异性的上游引物和下游引物(表1)ꎬ进行PCR扩增ꎮ采用生工生物工程(上海)股份有限公司TaqPCRMix(2ˑꎬ含蓝染料)试剂盒配制反应体系ꎮ反应程序:94ħ预变性10minꎻ94ħ30sꎬ54ħ30sꎬ72ħ2minꎬ30个循环ꎮ扩增产物经1%琼脂糖凝胶电泳检测ꎮ1.3㊀生物信息学分析利用在线工具Pfam(http://pfam.xfam.org)和TMHMMServerv.2.0(http://www.cBMs.dtu.dk/serv ̄ices/TMHMM/)对甘薯IbHKT ̄like氨基酸序列进行保守结构域和跨膜结构域预测ꎮ通过NCBI网站(http://www.ncbi.nlm.nih.gov/)获得其他物种的同源HKT氨基酸序列ꎬ并利用DNAMAN9.0对甘薯IbHKT ̄like蛋白及其他物种同源HKT蛋白的氨基酸序列进行多重序列比对ꎬ然后采用MEGA7.0的邻近法(Neighbor ̄joiningmethodꎬNJ)构建系统进化树ꎬBootstrap设置为1000次重复ꎮ1.4㊀基因表达模式分析将大田剪取的25~30cm长势一致的普薯32号幼苗水培ꎬ待甘薯幼苗长根且顶部长出新叶后ꎬ进行如下胁迫处理:(1)低温胁迫ꎬ放入4ħ光照培养箱水培处理ꎻ(2)干旱胁迫ꎬ放置于无水空瓶中进行干旱培238江苏农业学报㊀2021年第37卷第4期养处理ꎻ(3)过氧化氢处理ꎬ用30%H2O2喷洒叶面并水培处理ꎻ(4)盐胁迫ꎬ用300mmol/LNaCl水培处理ꎬ分别于处理后2h㊁12h取幼苗从上至下第3㊁第4张展开叶ꎬ用液氮速冻ꎬ按照捷瑞动物总RNA快速提取试剂盒说明书提取总RNAꎬ再用宝生物工程(大连)有限公司(PrimeScriptRTreagentKitwithgD ̄NAEraser)试剂盒将其反转录成cDNA备用ꎮ提取田间正常生长的徐薯32的叶㊁茎㊁根(毛根㊁柴根㊁块根)的RNAꎬ进行组织特异性分析ꎮ利用实时荧光定量PCR分析不同胁迫处理下不同时间点IbHKT ̄like基因的表达情况ꎮ该试验用StepOnePlus(美国应用生物系统中国公司产品)定量仪完成ꎮ反应体系(10 0μl):ddH2O2 2μl㊁SYBRGreenRealtimePCRMasterMix(日本东洋纺株式会社产品)5 0μl㊁上游引物0 4μl㊁下游引物0 4μl㊁模板cDNA2 0μlꎮ反应程序:95ħ3minꎻ95ħ15sꎬ57ħ15sꎬ72ħ1minꎬ40个循环ꎮ以IbARF为内参基因ꎬ测得数据经内参基因均一化处理ꎬ以2-әәCt法计算待测基因相对表达量ꎮ使用PrimerPremier5 0设计的引物序列见表1ꎮ数据分析采用单因素方差分析ꎬ通过SAS9.4完成ꎬ利用最小显著性差异法(LSD)在0.05的显著水平上进行多重比较ꎮ表1㊀IbHKT ̄like基因扩增引物信息及功能Table1㊀PrimerinformationandfunctionofIbHKT ̄likegene基因名称上游引物(5ᶄң3ᶄ)㊀㊀下游引物(5ᶄң3ᶄ)㊀㊀㊀用途IbHKT ̄likeATGATGATGGGGTTCCGAACTTATGATAATTTCCAAGCTT基因克隆IbHKT ̄likeGTATTCCTGAGACTTTCCGTATAGCCCTGATGACTTCCAC荧光实时定量PCRIbARFCTTTGCCAAGAAGGAGATGCTCTTGTCCTGACCACCAACA内参基因1.5㊀IbHKT ̄like ̄GFP瞬时表达载体构建及亚细胞定位㊀㊀PCR产物经检测㊁胶回收㊁纯化后ꎬ连接到pCAMBIA1301s载体的35S启动子与绿色荧光蛋白(GFP)基因序列中间ꎬ构建p35S ̄IbHKT ̄like ̄GFP ̄NOS融合表达载体ꎬ继而转化到大肠杆菌DH5α感受态细胞中ꎬ将菌液PCR验证为阳性单菌落的菌液送至生工生物工程(上海)股份有限公司测序ꎮ以GFP空载体为对照ꎬ转化农杆菌EHA105ꎬ接种至含有50mg/L利福平(RifꎬRifampicin)和200μmol/L乙酰丁香酮(AS)的LB液体培养基中ꎬ28ħ摇菌至OD600值为0.8~1 0ꎬ4000r/min离心10minꎬ用含200μmol/LAS的浸润介质(MES100mmol/L㊁MgCl2100mmol/LꎬpH=5 6)洗涤1次ꎬ再重悬ꎮ注射42d苗龄的烟草叶片ꎬ3d后利用激光共聚焦显微镜[卡尔蔡司光学(中国)有限公司产品ꎬ型号LSM7DUO]观察并拍照ꎮ2㊀结果与分析2.1㊀甘薯IbHKT ̄like基因的克隆通过设计引物(IbHKT ̄like基因序列的5ᶄ端20bp为上游引物ꎬ3ᶄ端20bp的反向互补序列为下游引物)ꎬ经PCR扩增㊁电泳后获得大小约为1600bp的目的条带(图1)ꎬ产物经过回收㊁测序㊁比对ꎬ将该基因命名为IbHKT ̄like基因ꎮIbHKT ̄like基因cDNA全长为1647bpꎬ编码548个氨基酸ꎮM:标准分子质量DNAMarkerꎻ1㊁2㊁3㊁4:PCR扩增产物ꎮ图1㊀IbHKT ̄like基因扩增产物的检测Fig.1㊀DetectionofamplifiedIbHKT ̄likegenesequence2.2㊀IbHKT ̄like基因编码的蛋白质信息分析将IbHKT ̄like蛋白与甘薯IbHKT1㊁烟草NtH ̄KT1㊁拟南芥AtHKT1㊁水稻OsHKT6及马铃薯StH ̄KT1氨基酸序列进行比对ꎮ比对分析结果(图2)表明ꎬ除了编码保守结构域的氨基酸ꎬIbHKT ̄like蛋白与其他物种的同源HKT序列在其他非编码保守结构域氨基酸区域的差异较大ꎮ通过Pfam网站保守结构域预测ꎬ发现该蛋白质在第200~412和第435~338蒋㊀薇等:甘薯IbHKT ̄like基因的克隆与表达分析535个氨基酸之间有2个细菌钾转运蛋白Trk系统的亚基 TrkH保守结构域ꎮ经过蛋白质跨膜结构域预测发现ꎬ该序列共有10个跨膜片段(图3)ꎬ可能具有钾离子转运功能ꎮ图2㊀IbHKT ̄like蛋白多序列比对及保守结构域分析Fig.2㊀MultiplesequencealignmentandconserveddomainanalysisofIbHKT ̄likeprotein图3㊀IbHKT ̄like蛋白跨膜结构域预测Fig.3㊀PredictionoftransmembranedomainofIbHKT ̄likeprotein2.3㊀IbHKT ̄like蛋白进化树分析通过NCBI得到矮牵牛InHKT6(IpomoeanilꎬXP_019188746.1)㊁甘薯IbHKT1(IpomoeabatatasꎬAMY98959.1)㊁烟草NtHKT1(NicotianatabacumꎬXP_016457809.1)㊁拟南芥AtHKT1(ArabidopsisthalianaꎬOAO98616.1)㊁木薯MeHKT1(ManihotesculentaꎬXP_021620110.1)㊁大豆GmHKT1(GlycinemaxꎬXP_006582258.1)㊁小麦TaHKT8(TriticumaestivumꎬABG33945.1)㊁水稻OsHKT6(OryzasativaꎬXP_015626193.1)㊁马铃薯StHKT1(SolanumtuberosumꎬXP_006359731.1)㊁葡萄VvHKT1(VitisviniferaꎬRVW85979.1)㊁芝麻SiHKT1(SesamumindicumꎬXP_438江苏农业学报㊀2021年第37卷第4期011077901.1)㊁枸杞LbHKT1(LyciumbarbarumꎬAXY40149.1)㊁茄子ScHKT1(SolanumcornutumꎬCCJ09643.1)㊁番茄SlHKT1(SolanumlycopersicumꎬNP_001295273.1)的氨基酸序列ꎬ与IbHKT ̄like蛋白的氨基酸序列进行比对ꎬ并通过邻近法构建系统进化树(图4)ꎬ发现IbHKT ̄like蛋白与旋花科矮牵牛的氨基酸序列十分相似ꎬ相似度为90 63%ꎬ但与甘薯IbH ̄KT1蛋白关系较远ꎬ相似度为61 00%ꎬ与拟南芥存在一定的进化距离ꎬ相似度为4819%ꎮ图4㊀HKT蛋白的系统进化树Fig.4㊀PhylogenetictreeofHKTprotein2.4㊀甘薯IbHKT ̄like基因表达模式分析对徐薯32号不同部位进行实时荧光定量PCR分析ꎬ结果表明ꎬIbHKT ̄like基因在甘薯不同组织中存在明显的表达特异性ꎬ在叶中表达量最高ꎬ在毛根中表达量最低(图5)ꎮ叶和茎中的表达量分别为毛根的80倍和12倍ꎮ对胁迫处理后的普薯32号进行荧光定量PCR分析ꎬ发现IbHKT ̄like基因受低温㊁干旱㊁盐胁迫及过氧化氢处理诱导(图6)ꎮ胁迫处理后ꎬIbHKT ̄like基因表达量相比对照整体呈现上升趋势ꎻIbHKT ̄like基因受到低温胁迫诱导在短时间内大量表达ꎬ在干旱胁迫下可以持续表达ꎬ在盐胁迫及过氧化氢处理下IbHKT ̄like基因表达量随时间延长而上升ꎮ上述结果说明IbHKT ̄like基因响应甘薯非生物胁迫ꎮ2.5㊀甘薯IbHKT ̄like蛋白亚细胞定位为了明确IbHKT ̄like蛋白在细胞中的定位ꎬ将IbHKT ̄like基因整合到带有GFP荧光标记的pCAM ̄BIA1301s载体上ꎬ得到p35S ̄IbHKT ̄like ̄GFP融合表图5㊀IbHKT ̄like基因在甘薯不同部位的表达模式Fig.5㊀ExpressionpatternofIbHKT ̄likegeneindifferenttis ̄suesofsweetpotato达载体(图7)ꎮ以GFP空载体为阳性对照ꎬ通过农杆菌介导其在烟草叶片中表达ꎬ利用激光共聚焦显微镜进行观察ꎮ从图8可以看出ꎬ细胞质膜上及叶绿体中有强烈的荧光信号ꎬ说明IbHKT ̄like蛋白主要定位在细胞质膜上ꎬ少量分布于叶绿体中ꎬ表明IbHKT ̄like蛋白具有跨膜转运功能ꎮ538蒋㊀薇等:甘薯IbHKT ̄like基因的克隆与表达分析图6㊀IbHKT ̄like基因在不同胁迫下的表达模式Fig.6㊀ExpressionpatternofIbHKT ̄likegeneunderdifferentstressconditionsp35S:35S启动子ꎻIbHKT ̄like:IbHKT ̄like基因ꎻGFP:绿色荧光蛋白基因ꎻNOS:终止子ꎮ图7㊀p35S ̄IbHKT ̄like ̄GFP ̄NOS融合表达载体Fig.7㊀p35S ̄IbHKT ̄like ̄GFP ̄NOSfusionexpressionvector3㊀讨论植物在长期进化过程中ꎬ形成了一套相对完善的机制来响应非生物胁迫ꎬ从而适应不利的生长环境ꎬ植物Na+/K+平衡就是个很好的例子ꎮ植物HKT钾转运体由原核生物钾离子通道亚基进化而来ꎬ与真菌Trk㊁细菌Ktr形成了一个膜转运系统的超家族ꎬ该家族可转运钠离子㊁钾离子等一价阳离子[21]ꎮ据前人研究可作出如下假设:植物HKT转运体具有8个跨膜结构域及4个P ̄loop环[22 ̄23]ꎮ生物信息学分析发现甘薯IbHKT ̄like基因具有10个跨膜结构域ꎬ同时多序列分析结果表明IbHKT ̄like蛋白与其他植物中的HKT蛋白氨基酸序列相似ꎬ都包含2个HKT家族钾转运蛋白保守结构域TrkH[24]ꎮ经过多序列比对及系统进化树分析ꎬ发现IbHKT ̄like基因编码的蛋白质与矮牵牛InHKT6位于同一分支ꎬ相似度达90 63%ꎮ在植物学分类上ꎬ矮牵牛与甘薯同属于旋花科ꎬ亲缘关系相近ꎬ聚类分析结果与物种分类结果一致ꎮ但与亚家族I的拟南芥AtH ̄KT1蛋白相似度为48 19%ꎮ本研究发现的IbHKT ̄like与之前报道的IbHKT1蛋白氨基酸序列(包含11个跨膜结构域)存在较大差异[19]ꎬ相似度为61 00%ꎬ且系统进化距离较远ꎻ与本课题组前期研究的HKT基因家族中的IbHKT3蛋白极为相似ꎬ但在非编码区多了93个氨基酸[20]ꎮ根据结构域分析和比对结果推测IbHKT ̄like为钾离子转运蛋白ꎬ参与甘薯生长发育过程中离子转运ꎮ前人研究报道HKT转运体定位在细胞质膜上[25 ̄26]ꎬ本研究亚细胞定位分析结果表明ꎬIbHKT ̄like蛋白主要定位在细胞质膜上ꎬ少量分布于叶绿体中ꎬ推测其通过参与细胞器及细胞间的离子交换来维持细胞稳态ꎮ不同的HKT转运体之间的表达模式和组织定位差异显著ꎬ如GmHKT6ꎻ2在根㊁茎㊁叶中均表达[27]ꎬ表明HKT转运体在不同部位具有不同的生理功能ꎻTaHKT1主要在根和叶中表达ꎬ帮助植物根系从土壤中吸收钾离子ꎬ运输到叶片[28]ꎻAtHKT1在拟南芥柱鞘及维管束中大量表达ꎬ减少Na+由根至叶的运输[14]ꎮ本研究发现IbHKT ̄like基因在叶中表达量最高ꎬ与水稻OsHKT1ꎻ1㊁OsHKT1ꎻ3㊁OsH ̄KT2ꎻ3以及OsHKT2ꎻ4基因的表达规律一致[29]ꎬ可能在离子的长距离运输及再分配中起重要作用ꎮ外源性过氧化氢(H2O2)㊁高盐等非生物胁迫引起的氧化应激会导致活性氧(ROS)的产生ꎬ加剧氧638江苏农业学报㊀2021年第37卷第4期C:叶绿体ꎻcm:细胞质膜ꎮA.p35S ̄GFP空载体表达蛋白质的烟草亚细胞定位ꎻB.p35S ̄IbHKT ̄like ̄GFP融合载体表达蛋白质的烟草亚细胞定位ꎮ图8㊀IbHKT ̄like蛋白亚细胞定位结果Fig.8㊀SubcellularlocalizationofIbHKT ̄likeprotein化应激损害ꎬ植物常常通过不同代谢途径来清除ROS带来的伤害[30 ̄31]ꎮ在拟南芥中过表达AtHKT1ꎻ1能减少叶中Na+含量ꎬ保护光合器官免受伤害[32]ꎻ同样的ꎬTaHKT1ꎻ5 ̄D在根中介导Na+从木质部中的卸载ꎬ且限制Na+从根到叶的转运ꎬ从而降低植株地上部Na+的含量以保护叶片免受盐胁迫[33 ̄34]ꎮ在低钾胁迫下ꎬHvHKT2ꎻ1在K+吸收或再吸收过程中发挥作用ꎬ保持细胞Na+/K+平衡ꎬ从而维持植株正常生长发育[35]ꎻ小花碱茅PutHKT1ꎻ2在根中表达量最高[11]ꎮ实时荧光定量PCR结果表明ꎬIbHKT ̄like基因受到低温㊁干旱㊁高盐和H2O2等多种胁迫诱导表达ꎬ推测IbHKT ̄like基因通过调节细胞离子稳态ꎬ提高甘薯的耐逆性ꎬ进而适应逆境ꎮ本研究分析了甘薯钾离子转运体IbHKT ̄like蛋白序列信息ꎬ发现其有2个TrkH保守结构域ꎬ10个跨膜片段ꎮIbHKT ̄like蛋白与旋花科的矮牵牛InH ̄KT6氨基酸序列十分相似ꎮIbHKT ̄like蛋白主要定位在细胞质膜上ꎮ组织特异性分析结果表明ꎬIbH ̄KT ̄like基因在叶中表达量最高ꎮ实时荧光定量PCR结果显示ꎬIbHKT ̄like基因受到低温㊁干旱㊁高盐及过氧化氢诱导表达ꎬ说明IbHKT ̄like基因在抵御非生物胁迫中发挥着重要的作用ꎮ本研究为下一步研究甘薯IbHKT ̄like基因在非生物胁迫下的功能及调控机理奠定了基础ꎮ参考文献:[1]㊀ROMHELDVꎬKIRKBYEA.Researchonpotassiuminagricul ̄ture:needsandprospects[J].PlantandSoilꎬ2010ꎬ335(1/2):155 ̄180.[2]㊀DURELLSRꎬGUYHR.StructuralmodelsoftheKtrBꎬTrkHꎬandTrk1ꎬ2symportersbasedonthestructureoftheKcsAK+Channel[J].BiophysicalJournalꎬ1999ꎬ77(2):789 ̄807. [3]㊀WATERSSꎬGILLIHAMMꎬHRMOVAM.Planthigh ̄affinitypo ̄tassium(HKT)transportersinvolvedinsalinitytolerance:structur ̄alinsightstoprobedifferencesinionselectivity[J].InternationalJournalofMolecularSciencesꎬ2013ꎬ14(4):7660 ̄7680. [4]㊀BAXTERIꎬBRAZELTONJNꎬYUDꎬetal.Acoastalclineinso ̄diumaccumulationinArabidopsisthalianaisdrivenbynaturalvar ̄iationofthesodiumtransporterAtHKT1ꎻ1[J].PLoSGeneticsꎬ2010ꎬ6(11):e1001193.[5]㊀JANEDRꎬALICIAMMꎬDEEPAJꎬetal.TheNa+transporterAtHKT1ꎻ1controlsretrievalofNa+fromthexyleminArabidopsis[J].PlantꎬCell&Environmentꎬ2007ꎬ30(4):497 ̄507. [6]㊀COTSAFTISOꎬPLETTDꎬSHIRLEYNꎬetal.Atwo ̄stagedmodelofNa+exclusioninriceexplainedby3DmodelingofHKTtrans ̄portersandalternativesplicing[J].PLoSOneꎬ2017ꎬ7(7):e39865.[7]㊀RENZHꎬGAOJPꎬLILGꎬetal.Aricequantitativetraitlocusforsalttoleranceencodesasodiumtransporter[J].NatureGeneticsꎬ2005ꎬ37(10):1141 ̄1146.[8]㊀MUNNSRꎬJAMESRAꎬXUBꎬetal.WheatgrainyieldonsalinesoilsisimprovedbyanancestralNa+transportergene[J].NatureBiotechnology:TheScienceandBusinessofBiotechnologyꎬ2012ꎬ738蒋㊀薇等:甘薯IbHKT ̄like基因的克隆与表达分析30(4):360 ̄364.[9]㊀SIOBHANBCꎬDAMIENPJꎬWOLFGANGSꎬetal.HKT1ꎻ5 ̄likecationtransporterslinkedtoNa+exclusionlociinwheatꎬNax2andKna1[J].PlantPhysiologyꎬ2007ꎬ143(4):1918 ̄1928. [10]李㊀剑ꎬ张金林ꎬ王锁民ꎬ等.小花碱茅HKT2ꎻ1基因全长cD ̄NA的克隆与生物信息学分析[J].草业学报ꎬ2013ꎬ22(2):140 ̄149.[11]李㊀剑ꎬ张金林.拒盐型牧草小花碱茅PutHKT2ꎻ1基因表达模式分析[J].草业科学ꎬ2012ꎬ29(9):1379 ̄1383.[12]胥㊀猛ꎬ孙子谋ꎬ刘思安ꎬ等.胡杨耐盐基因PeuHKT1的克隆与表达分析[J].分子植物育种ꎬ2016ꎬ14(9):2312 ̄2318. [13]SCHACHTMANDPꎬSCHROEDERJI.Structureandtransportmechanismofahigh ̄affinitypotassiumuptaketransporterfromhigherplants[J].Natureꎬ1994ꎬ370(6491):655 ̄658. [14]SUHꎬBALDERASEꎬVERA ̄ESTRELLARꎬetal.ExpressionofthecationtransporterMcHKT1inahalophyte[J].PlantMolecularBiologyꎬ2003ꎬ52(5):967 ̄980.[15]GARCIADEBLáSBꎬSENNMEꎬBAñUELOSMAꎬetal.SodiumtransportandHKTtransporters:thericemodel[J].ThePlantJournalꎬ2003ꎬ34(6):788 ̄801.[16]RUBIOFꎬGASSMANNWꎬSCHROEDERJI.Sodium ̄drivenpo ̄tassiumuptakebytheplantpotassiumtransporterHKT1andmuta ̄tionsconferringsalttolerance[J].Scienceꎬ1995ꎬ270(5242):1660 ̄1663.[17]陆㊀潭ꎬ陈华涛ꎬ沈振国ꎬ等.植物钾通道与钾转运体研究进展[J].华北农学报ꎬ2019ꎬ34(增刊1):372 ̄379.[18]李㊀平ꎬ冯紫洲ꎬ陈永胜ꎬ等.植物HKT转运蛋白基因的研究进展[J].北方园艺ꎬ2016(10):188 ̄193.[19]PARKSꎬYUYꎬKOUMꎬetal.IpomoeabatatasHKT1transporterhomologmediatesK+andNa+uptakeinSaccharomycescerevisiae[J].JournalofIntegrativeAgricultureꎬ2017ꎬ16(10):2168 ̄2176. [20]靳㊀容ꎬ胡亚亚ꎬ张爱君ꎬ等.甘薯钾离子转运蛋白HKT基因家族鉴定及其低钾胁迫下的表达模式分析[J].江苏师范大学学报(自然科学版)ꎬ2020ꎬ38(1):31 ̄36.[21]SASSIAꎬMIEULETDꎬKHANIꎬetal.ThericemonovalentcationtransporterOsHKT2ꎻ4:revisitedionicselectivity[J].PlantPhysi ̄ologyꎬ2012ꎬ160(1):498 ̄510.[22]VÉRYAAꎬMANUELNCꎬDALYMꎬetal.MolecularbiologyofK+transportacrosstheplantcellmembrane:whatdowelearnfromcomparisonbetweenplantspecies?[J].JournalofPlantPhysiolo ̄gyꎬ2014ꎬ171(9):748 ̄769.[23]DURELLSRꎬHAOYꎬNAKAMURATꎬetal.Evolutionaryrela ̄tionshipbetweenK+channelsandsymporters[J].BiophysicalJournalꎬ1999ꎬ77(2):775 ̄788.[24]LIHYꎬXUGZꎬYANGCꎬetal.Genome ̄wideidentificationandexpressionanalysisofHKTtranscriptionfactorundersaltstressinnineplantspecies[J].EcotoxicologyandEnvironmentalSafetyꎬ2019ꎬ171:435 ̄442[25]CAOYꎬLIANGXꎬPANYꎬetal.Adomestication ̄associatedre ̄ductioninK+ ̄preferringHKTtransporteractivityunderliesmaizeshootK+accumulationandsalttolerance[J].TheNewPhytolo ̄gistꎬ2019ꎬ222(1):301 ̄317.[26]BOHMJꎬSCHERZERSꎬSHABALASꎬetal.VenusflytrapHKT1 ̄typechannelprovidesforpreysodiumuptakeintocarnivorousplantwithoutconflictingwithelectricalexcitability[J].MolecularPlantꎬ2016ꎬ9(3):428 ̄436.[27]陈华涛ꎬ陈㊀新ꎬ顾和平ꎬ等.大豆GmHKT6ꎻ2基因的克隆与表达特性分析[J].华北农学报ꎬ2012ꎬ27(3):1 ̄5.[28]LAURIESꎬFEENEYKAꎬMAATHUISFJMꎬetal.AroleforHKT1insodiumuptakebywheatroots[J].ThePlantJournalꎬ2002ꎬ32(2):139 ̄149.[29]崔立新ꎬ和亚男ꎬ李亚萍ꎬ等.水稻OsHKT基因表达模式分析[J].中国水稻科学ꎬ2017ꎬ31(6):559 ̄567.[30]徐㊀海ꎬ宋㊀波ꎬ顾宗福ꎬ等.植物耐热机理研究进展[J].江苏农业学报ꎬ2020ꎬ36(1):243 ̄250.[31]王㊀宏ꎬ马㊀娜ꎬ蔺㊀经ꎬ等.4个早熟梨品种叶片对黑斑病的抗病性评价及与抗氧化物酶的关系[J].江苏农业科学ꎬ2019ꎬ47(2):80 ̄82.[32]ANDꎬCHENJGꎬGAOYQꎬetal.AtHKT1drivesadaptationofArabidopsisthalianatosalinitybyreducingfloralsodiumcontent[J].PLoSGeneticsꎬ2017ꎬ13(10):e100706.[33]BORJIGINCꎬSCHILLINGRKꎬBOSEJꎬetal.AsinglenucleotidesubstitutioninTaHKT1ꎻ5 ̄DcontrolsshootNa+accumulationinbreadwheat[J].PlantꎬCell&Environmentꎬ2020ꎬ43(9):2158 ̄2171.[34]SIOBHANBCꎬBOXꎬMAHIMAKꎬetal.TheNa+transporterꎬTaHKT1ꎻ5 ̄DꎬlimitsshootNa+accumulationinbreadwheat[J].ThePlantJournal:forCellandMolecularBiologyꎬ2014ꎬ80(3):516 ̄526.[35]ROSARIOHꎬBAÑUELOSMAꎬSENNMEꎬetal.HKT1mediatessodiumuniportinroots.PitfallsintheexpressionofHKT1inyeast[J].PlantPhysiologyꎬ2005ꎬ139(3):1495 ̄1506.(责任编辑:陈海霞)838江苏农业学报㊀2021年第37卷第4期。
甘薯褪绿矮化病毒外壳蛋白基因的克隆及在大肠杆菌中的表达

c o a t p r o t e i n( CP )g e n e o f s we e t p o t a t o c h l o r o t i c s t u n t v i r u s ( S PCS V) , a n d t h e n t o c o n s t r u c t i t s p r o k a r y o t i c e x p r e s s i o n v e c t o r a n d e x p r e s s i t s p r o t e i n i n Es c h e r i c h i a c o l i B L2 1( DE3 ) .Th e p r i — me r s we r e d e s i g n e d a c c o r d i n g t o p u b l i s h e d n u c l e o t i d e s e q u e n c e o f S PCS V_ _ W A Ca n 1 8 1 — 9 i s o l a t e
(完整)分子生物学实验报告

甘薯adk基因的核心片段的克隆西南大学生命科学学院王丽 222014317011011摘要:甘薯为我国农业主要栽培作物,并且是分子生物学实验室常见材料,本次实验主要以甘薯叶片(部分为茎)为实验材料,第一次实验是用CTAB法提取甘薯DNA,PCR扩增再凝胶电泳检测纯度。
第二次实验从材料中提取检测RNA并反转录cDNA第一链,经PCR扩增得到ADK基因核心片段,将其与T载体相连并导入大肠杆菌DH5a感受态细胞中,扩增后在加有相应抗生素的LB平板上筛选阳性克隆,这对后续生物信息学分析等有重要意义。
关键词:甘薯;PCR技术;cDNA;adk基因 ;感受态大肠杆菌细胞Abstract: Sweet potato for my agricultural main cultivation crop,and is molecular biology laboratory common material,this times experiment main to sweet potato leaves (part for stems)for experiment material。
First times experiment was extracted by CTAB method DNA,PCR amplification and gel electrophoresis and purity of sweet potato。
The second experiment from material in the extraction RNA and reverse recorded cDNA first chain,by PCR spread increased get large ADK gene core fragments,electrophoresis detection rubber recycling ADK gene core fragments,will its and T carrier connected and import Escherichia coli DH5(feel state cell) in ,spread increased in plus has corresponding antibiotics of LB Tablet Shang filter positive clone this importance to subsequent bioinformatics analysis。
甘薯半胱氨酸蛋白酶抑制剂基因(CPI)克隆及功能初步分析

研究报告甘薯半胱氨酸蛋白酶抑制剂基因(CPI)克隆及功能初步分析洪子茜,杨秋萍,侯馨怡,邓 鸽,张 立,费雪婷,胡又文,雍 彬,邵欢欢(四川师范大学 生命科学学院,四川 成都 610101)植物蛋白酶抑制剂(protease inhibitors, PIs)是一类分子量较小的蛋白或多肽,P I可以与蛋白酶的变构部位或活性区域结合从而抑制蛋白酶活性,因此可以抑制食草类昆虫消化道中蛋白酶的活性,降低昆虫对植物的摄食量,影响昆虫的生长和发育,甚至可以导致昆虫的死亡,是参与植物防御机制的重要成分之一。
P I在调节蛋白酶的活性以及蛋白质的代谢方面有着难以代替的作用,是生物体内免疫系统的重要组成部分,在植物储存淀粉等营养物质的器官(如块茎、种子、球茎等)中,P I含量甚至高达总蛋白的10%。
目前通过现代分子分离技术已经从50多种植物材料获得蛋白酶抑制剂,其中以植物种子含量最多和最广泛。
半胱氨酸蛋白酶抑制剂(cysteine proteinase inhibtor,C P I)是P I中的一类重要的蛋白酶抑制剂,在动植物体内广泛存在,能够参与生命体内的多种生理生化反应,与巯基蛋白水解酶形成动态平衡。
C P I参与调节各种生命活动,在植物的种子萌发、胚体发育、组织分化、细胞程序性死亡、防治虫害、果实成熟等方面具有重要的作用。
此外,近年来有研究也发现C P I在植物抗逆胁迫方面也发挥了重要的作用,如,拟南芥中存在的两种半胱氨酸蛋白酶抑制剂(cystatin)基因AtCYSa和AtCYSh在逆境环境下,如低温、干旱、盐、氧化胁迫下可以被诱导表达,且在酵母中过表达能提升酵母在胁迫环境下抗低温、盐、干旱、氧化胁迫能力。
麻风树的J c C P I 基因在大肠杆菌和烟草中进行异源过表达也可以提升其耐盐能力,而且转基因烟草中丙二醛含量更低,抗过氧化酶活力更高,这表明C P I可以通过影响过氧化物酶活性来降低非生物胁迫引起的次生氧化胁迫,最终提高植物对非生物胁迫的抗性和适应能力。
甘薯IbTPS1基因的克隆与活性鉴定

03844
甘薯IbTPSl基因的克隆与活性鉴定
王文斌】,于欢】,杨燕新2,邱相坡1
!•山西农业大学 生命科学学院,山西 太谷030801(.山西农业大学 文理学院,山西 太谷030801)
摘 要:[目的]发掘植物海藻糖合成途径关键酶基因,探究其编码蛋白TPS活性,为作物遗传改良抗多种胁迫提供优 良的候选基因’[方法]本研究基于干旱条件下从甘薯转录组数据库中得到一条与拟南芥ATPS1基因高度同源的 Unigene序列,通过RT-PCR技术克隆了甘薯TPS基因。利用生物信息学软件分析序列特征,酵母互补试验鉴定编 码蛋白TPS活性° [结果^IbTPSl基因cDNA序列全长2 811 bp,编码936个氨基酸,且具有典型的GT1-TPS和 HAD-TPP结构域;生物信息学预测表明IbTPS1编码的蛋白是一个不稳定亲水性蛋白,无信号肽,定位于细胞质中; 二级结构元件多以无规则卷曲和-螺旋为主;酵母互补实验证明表达IbTPSl基因的TPS突变酵母菌株和 TPS , TPP双突变酵母菌株(tpslAtps2A",以葡萄糖为唯一碳源的尿嘧啶缺失培养基上可恢复生长° [结论%正实甘 薯IbTPSl基因的编码蛋白具有生物活性° 关键词:甘薯;海藻糖6-磷酸合成酶基因(TPS1);基因克隆 中图分类号:Q78 文献标识码:A 文章编号!671-8151(2019)04-0017-07 doi:10. 13842/ki.issnl671-8151.201811019
Cloning an batatas
Wang Wenbin1 , Yu Huan1 , Yang Yanxin2, Qiu Xiangpo1 (l. College of Life Sciences , Shanxi A.rcultural University , Taigu 03080l , China ; 2.College of Aris and Sci ences ,Shanxi Agricultural University , Taigu 03080l , China ) Abstract: [Objectives] Present study was conducted to explore key enzymatic genes which involved in plant trehalose synthesis, to determine the activity of trehalose-6-phosphate synthase gene, and to provide an excellent candidate gene for crop genetic improvement with resistance to multiple stresses. [*Methods A sweet potato trehalose-6-phosphate synhasegene (IbTPSl ) which hashigh homology wih A,TPSl wasscreenedfrom GheGranscripomedaabase under drought stress conditions , and was amplified by RT-PCR. The bioinformatics software was used to analyze the sequence characteristics , and the yeast complementation assay was used to identify the TPS activity. [Results] The cDNA full-length of IbTPSl was 2 811 bp that encoded 936 amino acid. IbTPS1 protein contained a typical GT1-TPS structure domain and HAD-TPP structure domain. Biological information analysis showed that IbTPS1 belonged to the
甘薯抗逆相关基因IbPIF1、IbPIF3和IbAKR的克隆与功能分析

甘薯抗逆相关基因IbPIF1、IbPIF3和IbAKR的克隆与功能分析甘薯是一种重要的经济作物,具有较强的逆境适应能力。
对于揭示甘薯逆境适应机制以及提高其抗逆性具有重要意义。
近年来的研究表明,甘薯抗逆性与一些关键基因的表达调控密切相关。
本研究旨在克隆和功能分析甘薯中与抗逆相关的基因IbPIF1、IbPIF3和IbAKR。
首先,我们通过RT-PCR技术从甘薯中克隆到了IbPIF1、IbPIF3和IbAKR基因的全长cDNA序列。
通过生物信息学分析发现,这三个基因编码的蛋白质分别属于PIF、PIF3和AKR家族,这些家族在植物的逆境适应中起着重要的调控作用。
接下来,我们对这三个基因的表达模式进行了分析。
结果显示,在低温、高温、干旱和高盐等逆境条件下,这三个基因的表达水平均显著上调。
此外,我们还发现这三个基因的表达在不同组织和发育阶段也存在差异。
这些结果表明IbPIF1、IbPIF3和IbAKR基因在甘薯逆境适应中具有重要的调控作用。
为了进一步验证这些基因的功能,我们利用遗传转化技术将IbPIF1、IbPIF3和IbAKR基因分别导入拟南芥中。
通过对转基因拟南芥进行逆境处理,我们发现这些转基因植株在低温、高温、干旱和高盐等逆境条件下表现出更好的生长状况和生理指标。
同时,我们还观察到转基因植株中与逆境适应相关的抗氧化酶活性和膜透性也有显著提高。
综上所述,我们成功克隆和功能分析了甘薯中与抗逆相关的基因IbPIF1、IbPIF3和IbAKR。
这些研究结果有助于深入理解甘薯逆境适应机制,并为甘薯抗逆性育种提供了重要的理论依据。
进一步研究这些基因的调控网络和信号传导途径将有助于揭示甘薯逆境适应的分子机制,并为其他作物的逆境适应研究提供借鉴和启示。
甘薯贮藏根淀粉代谢相关基因表达分析
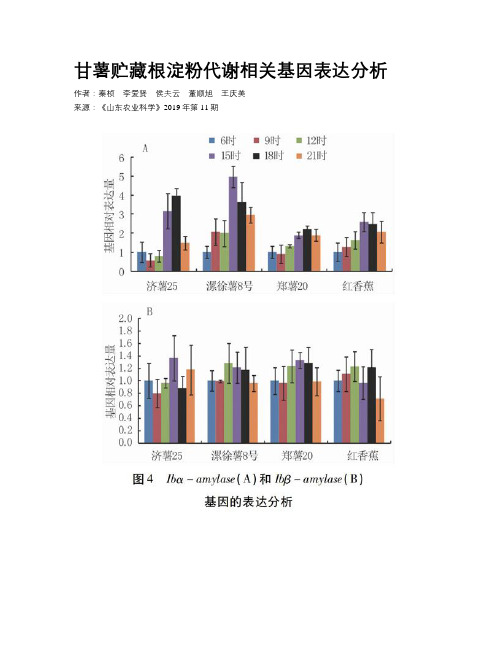
甘薯贮藏根淀粉代谢相关基因表达分析作者:秦桢李爱贤侯夫云董顺旭王庆美来源:《山东农业科学》2019年第11期摘要:甘薯淀粉含量高,是一种重要的粮食作物和工业原料。
然而,甘薯贮藏根发育过程中淀粉代谢途径相关基因昼夜周期变化规律尚不完全清楚。
为探讨甘薯贮藏根发育过程中淀粉代谢相关基因昼夜周期变化规律,本研究以4个不同淀粉含量的甘薯品种为试验材料,采用qRT-PCR法对淀粉代谢相关基因全天的表达模式进行分析。
结果表明:IbAGPa、IbSS、IbGBSSⅠ、IbSBEⅠ、IbSBEⅡ、Ibα-amylase基因的表达均呈现先升高后降低的趋势。
淀粉合成相关基因(IbAGPa、IbSS、IbGBSSⅠ、IbSBEⅠ、IbSBEⅡ)的表达高峰出现在12时到15时,淀粉降解相关基因(Ibα-amylase)的表达高峰出现在15时之后。
在不同淀粉含量的甘薯品种中,淀粉代谢相关基因的表达在整个昼夜周期内都发生周期性的变化,且表达趋势相似。
本研究进一步丰富了我们对甘薯贮藏根淀粉代谢调控机制的认识。
关键词:甘薯;贮藏根;淀粉代谢相关基因;qRT-PCR;昼夜周期变化中图分类号:S531:S786 文献标识号:A 文章编号:1001-4942(2019)11-0008-05Expression of Starch Metabolism RelatedGenes in Storage Roots of Sweet PotatoQin Zhen, Li Aixian*, Hou Fuyun, Dong Shuxu, Wang Qingmei(Crop Research Institute, Shandong Academy of Agricultural Sciences/Scientific Observing andExperimental Station of Tuber and Root Crops in Huang-Huai-Hai Region, Ministry of Agriculture, Jinan 250100, China)Abstract Sweet potato is an important food crop and industrial raw material because of its high starch content. In order to explore the diurnal cycle of genes related to starch metabolism pathway in the development of storage roots of sweet potato, four cultivars with different starch content were selected as experimental materials. The expression patterns of starch metabolism related genes were analyzed by qRT-PCR. The results showed that genes of IbAGPa, IbSS, IbGBSSⅠ, IbSBEⅠ,IbSBEⅢ and Ibα-amylase had an increased expression followed by a decreasing trend. The expression peak of the genes related to starch synthesis (IbAGPa, IbSS, IbGBSSⅠ, IbSBEⅠand IbSBEⅡ) appeared at 12 noon to 3 pm, and the expression peak of the starch degradation-related gene (Ibα-amylase) appeared after 3 pm. The results showed that the expression of starch metabolism related genes changed periodically throughout the diurnal cycle and that of the expression was similar in sweet potato cultivars with different starch contents. This study further enriched our understanding of the regulation mechanism of starch metabolism in the storage roots of sweet potato.Keywords Sweet potato; Storage roots; Genes related to starch metabolism; qRT-PCR; Diurnal cycle change甘薯是重要的農作物和工业原料。
葛仙米中SOD基因的克隆及在大肠杆菌中的表达

葛仙米中SOD基因的克隆及在大肠杆菌中的表达汪滢;章秀;吴双秀;王全喜【摘要】采用PCR技术从葛仙米(Nostoc sphaeroides)总DNA中克隆了一段基因序列,该序列与基因库中已公布的编码普通念珠藻(Nostoc commnue)超氧化物歧化酶的氨基酸序列同源性为98%.将该基因插入含,T7启动子的质粒pET-32a(+)中构建表达质粒pET-sod,然后将该表达质粒转入大肠杆菌BL21中进行蛋白表达,表达菌株用1mmol/L IPTG诱导表达数小时后,产生较多重组的蛋白,且该蛋白以可溶性蛋白形式存在.SDS-PAGE分析表明:在相对分子量约为22kd的位置有一条明显蛋白质带.将诱导表达后的蛋白通过亲和层析的方法进行蛋白纯化;NBT光还原法测定表达产物的比活力,每毫克纯化蛋白约为2550U.【期刊名称】《上海师范大学学报(自然科学版)》【年(卷),期】2008(037)003【总页数】4页(P301-304)【关键词】葛仙米;SOD基因克隆;诱导表达【作者】汪滢;章秀;吴双秀;王全喜【作者单位】上海师范大学生命与环境科学学院,上海,200234;上海师范大学生命与环境科学学院,上海,200234;上海师范大学生命与环境科学学院,上海,200234;上海师范大学生命与环境科学学院,上海,200234【正文语种】中文【中图分类】Q785;Q949.220 引言超氧化物歧化酶(SOD)是的专一清除剂,它们都能有效地清除对机体有害的超氧自由基,在防护自由基的损伤及植物逆境生理等方面起到重要作用[1].葛仙米(Nostoc sphaeroides)是球状念珠藻[2]的俗称,它具有较高的营养价值,是重要的经济藻类.关于它的遗传背景所知甚少,其SOD基因的研究也未见报道.本实验根据Genebank中公布的编码普通念珠藻(Nostoc commune)超氧化物歧化酶的基因序列,利用同源性设计引物,采用PCR技术克隆了球状念珠藻中的编码超氧化物歧化酶的基因,并在大肠杆菌中进行异源蛋白表达,该重组蛋白以可溶性蛋白形式存在,利用亲和层析的方法对该重组蛋白进行了纯化,用NBT光还原法测定了该酶的活性,为念珠藻属的研究提供基础资料.1 材料和方法1.1 实验材料本实验所用的材料葛仙米购自中科院武汉水生所; 大肠杆菌DH5α,BL21,质粒pUC-19,pET-32a(+)由本试验室保存;考马斯亮蓝G-250、各种限制性内切酶为(Takara) (Dalian) Co., Ltd产品; 抗生素、IPTG购自华美生物工程公司;牛血清白蛋白(BSA)(沪试)为国药集团化学试剂有限公司产品;Ni-NTA 为Novagen产品.1.2 实验方法提取葛仙米总DNA,采用SDS-CTAB法[3].质粒抽提、酶切反应、电泳鉴定、DNA片段回收、连接反应、大肠杆菌的转化、SDS-PAGE均按照《分子克隆试验指南》操作[4].DNA的测序由上海联合基因生物技术公司完成.1.2.1 引物合成及PCR扩增上游引物BamHI下游引物SalI反应体系为50ul,PCR反应条件:94℃预变性5 min,一个循环;94℃变性1 min,56℃退火1 min,72℃延伸1.5 min,35个循环.1.2.2 葛仙米超氧化物歧化酶基因在大肠杆菌中表达质粒的构建和转化将葛仙米超氧化物歧化酶基因片段用BamHI,SalI双酶切,回收片段,与预先经双BamHI,SalI双酶切的 pET-32a(+)回收片段相连接,构建大肠杆菌表达质粒pET-sod.将此表达质粒转入大肠杆菌BL21中.经含有Amp (100ug/L)抗性的培养基筛选表达质粒.1.2.3 葛仙米超氧化物歧化酶基因在大肠杆菌中的表达及纯化挑取单克隆在LB培养基含Amp(100ug/L)中,37℃下培养至OD600=0.4~0.6,加入终浓度为1mmol/L的IPTG诱导6h后收集菌液,将收集的菌用Tris-Cl(pH 7.4)洗3~4次,超声破碎.将破碎后的菌以12000 r/min离心10 min,分别取破碎后的全菌、上清和沉淀SDS-PAGE分析.蛋白纯化按照Novagen公司的Ni-NTA His.Bind Resins的操作说明书进行:将蛋白过事先准备好的Ni2+Agrose 柱,静置30~40 min,后用20 mmol/L咪唑洗脱杂蛋白,用250 mmol/L的咪唑缓冲液洗脱结合蛋白.1.2.4 酶活性测定和蛋白含量测定酶活性测定用NBT光还原法[5].SOD活性=2(OD560对照-OD560处理)×稀释倍数/OD560空白.酶比活力(U/mg)=SOD酶液活性(U/ml)/酶液蛋白含量(mg/ml).蛋白质含量的测定方法:将纯化后的蛋白稀释一定倍数后至300 μL试管内,再加入考马斯亮蓝G-250 2.7mL混匀,室温下静置2 min,测其595 nm下的吸光度,根据牛血清蛋白标准曲线计算其蛋白含量.1.DL-2000 marker;2.Negative control ;3.Amplified PCR product.图 1 SOD 基因的PCR扩增2 结果与分析2.1 葛仙米超氧化物歧化酶基因的克隆将以葛仙米总DNA为模板进行PCR扩增的产物经10 g/L琼脂糖凝胶电泳鉴定,可得到一条长与预期大小相符的DNA扩增片段(图1).将PCR产物双酶切回收后由T4连接酶与pUC-19相连后进行序列测定.测序结果如图2,GenBank登录号为EF569675.2.2 葛仙米超氧化物歧化酶在大肠杆菌中表达载体的鉴定克隆在pUC-19的基因片段用BamHI及SalI双酶切,回收片段,并与事先经BamHI及SalI双酶切的pET-32a(+)相连接,构建表达质粒pET-sod,酶切鉴定结果如图3.2.3 葛仙米超氧化物歧化酶基因在大肠杆菌中的表达SDS-PAGE分析表明,在相对分子量约为22 kDa的位置上有一条明显的表达条带(图4),表明蛋白以可溶性蛋白存在上清中.2.4 表达产物的纯化和活性测定经IPTG诱导表达的大肠杆菌菌体,冰浴下经超声破碎、Ni2+亲和纯化后,利用NBT光还原法测定表达产物的活性.换算出该酶比活力为2550 U/mg.图 2 葛仙米超氧化物歧化酶基因的核苷酸序列及相应的氨基酸序列1. DL-2000;2. PCR product of Nostoc sphaeriodes;3. pET32+BamHI/SalI;4. pET-sod+ BamHI ;5. pET-sod+ SalI;6. pET-so d+;7.λ\Hind-III.图 3 表达载体的鉴定1.Molecular weight marks;2.free pET-sod of BL21;3.sediments ofBL21 with pET-sod; 4.supernatent of BL21 with pET-sod; 5.total of BL21 with pET-sod; 6.purified expression protein.图 4 蛋白在大肠杆菌中的表达SDS-PAGE分析3 讨论超氧化物歧化酶(SOD)是生物有机体清除超氧阴离子自由基的一个重要的保护酶.目前已经对许多生物的SOD及其基因进行了广泛的研究,在蓝藻中亦有过报道:如前期报道的发菜SOD酶基因的克隆[6],卢敏等克隆了普通念珠藻(地木耳)的Fe-SOD基因并在大肠杆菌中进行了表达[7].而葛仙米的SOD基因却从未见报道.本实验以Genebank中公布的编码普通念珠藻超氧化物歧化酶的基因序列设计引物,首次成功地克隆了葛仙米中编码超氧化物歧化酶的基因,运用BLAST软件将该基因在核苷酸和氨基酸水平上与Genebank中公布的地木耳(Nostoc commune)的Fe-sod基因进行同源性比较,结果两者在核苷酸和氨基酸水平上的一致性分别为96%和98 %,和发菜[6]在核苷酸和氨基酸水平上一致性分别为98%和100%,说明SOD基因在近源物种间相似度非常高.此外,本实验还构建了高效表达的重组表达载体,表达率占可表达蛋白的18%以上,且以可溶性蛋白形式存在,将表达后的蛋白进行纯化,并根据测定超氧化物歧化酶常用方法-NBT光还原法测定该纯化蛋白的活性,结果表明: 该纯化后的蛋白的比活力为2550U/mg, 具有明显的超氧化物歧化酶活性特征,这说明该表达蛋白为超氧化物歧化酶.超氧化物歧化酶是公认的抗逆酶之一,但超氧化物歧化酶是如何在基因水平调控其耐胁迫能力的,所知甚少.但有人提出假设:清除氧自由基的机制对增强原核生物的抗胁迫有重要作用[8].本实验所用材料葛仙米和发菜同属于念珠藻属(Nostoc),但它们的生境又有不同:发菜主要分布在干旱、半干旱地区,对极端环境有着很强的适应性.而葛仙米是水生念珠藻,主要生长在水稻田.本研究中葛仙米超氧化物歧化酶体外表达的酶的活性与前期报道的发菜体外表达的酶活相同,说明SOD酶基因的体外表达结果不能区分发菜与葛仙米的抗逆性高低.可能有其他的抗逆因子影响发菜抵御恶劣的环境,这些问题都有待进一步的研究.同时本研究也为进一步研究葛仙米中其他功能蛋白提供了一个参考,有利于推动葛仙米产业的发展.参考文献:[1] 程光宇, 吴国荣, 储慧君. 朱桔Mn-SOD的纯化、鉴定及浓度梯度胶电泳在其中的应用[J].植物研究, 2004, 24(2): 240-245.[2] 胡鸿均, 魏印心. 中国淡水藻类[M]. 北京:科学出版社, 2006.[3] KIM S,LEE C H,SHIN J S,et a1.A simple and rapid method for isolation of high quality genomic DNA from fruit trees and conifers using PVP [J].Nucleic Acids Research,1997,25(5):1085-1086.[4] SAMBROOK J, FRITSCH E F, MANIATIS T. Molecular Cloning: A Laboratory Manual, 2nd ed[M]. New York: Cold Spring Laboratory Press, 1989.[5] 罗广华, 王爱国. 超氧化物歧化酶及其同工酶的活性测定和同工酶显示[M]. 北京:科学出版社, 1999.[6] 汪滢, 陈李萍, 陈晓,等. 发菜超氧化物歧化酶基因的克隆及在大肠杆菌中的表达[J]. 植物研究, 2007, 27(3): 289-292.[7] 卢敏, 龚兴国, 郭建军,等. 念珠藻Fe-SOD基因的克隆及在大肠杆菌中的表达[J]. 浙江大学学报(工学版), 2006, 40(11): 2011-2015.[8] SHIRKEY B, KOVARCIK D P, WRIGHT D J. Active Fe-Containing Superoxide Dismute and Abundant sodF mRNA in Nostoc commune (Cyanobacteria) after Years of Desiccation[J]. Bact , 2000, 182(2): 189-197.。
甘薯抗逆相关基因IbERF3的克隆与表达分析

甘薯抗逆相关基因IbERF3的克隆与表达分析边小峰;谢一芝;郭小丁;贾赵东;马佩勇【摘要】In order to improve the stress resistance of sweet potato,we used RACE method to clone IbERF3 contained an AP2 domain which belong to ERF superfamily which plays an important role in stress resistance. Blast showed that IbERF3 was a new gene in sweet potato that had never been reported. The cDNA length of IbERF3 was 1 205 bp,and contained an 669 bp open reading frame encoding a 223 amino acids. By homology analysis showed that IbERF3 was conserved in Solanaceae plants. Constitutive expression showed that IbERF3 express in root,leaf and stem,and the expression of IbERF3 was the highest in leaf. The result reveal that the expression of IbERF3 was induced by drought,salt both in leaf and root by qRT-PCR. After treating with ABA,The expression of IbERF3 in-creased gradually and reached a maximum at 24 h. It suggests that IbERF3 plays significant roles in responses to abiotic stress in sweet potato.%为了提高甘薯的抗逆能力,通过RACE的方法克隆到一个含有AP2结构域的ERF家族基因,该家族基因在植物逆境调控中起重要作用。
甘薯细胞壁蔗糖转化酶基因IbCWIN家族成员鉴定及表达分析

作物学报ACTA AGRONOMICA SINICA 2021, 47(7): 1297 1308 / ISSN 0496-3490; CN 11-1809/S; CODEN TSHPA9E-mail: zwxb301@DOI: 10.3724/SP.J.1006.2021.04180甘薯细胞壁蔗糖转化酶基因IbCWIN家族成员鉴定及表达分析宋天晓1,2,**刘意2,3,**饶莉萍2,3 Soviguidi Deka Reine Judesse2,3朱国鹏1,*杨新笋2,*1海南大学园艺学院海南省热带园艺作物品质调控重点实验室, 海南海口 570228; 2湖北省农业科学院粮食作物研究所, 湖北武汉430064; 3长江大学农学院, 湖北荆州 434025摘要: 甘薯是重要的粮食、饲料、工业原料作物和新型的生物能源作物, 细胞壁蔗糖转化酶是植物源、库组织蔗糖代谢的关键酶, 但关于甘薯细胞壁蔗糖转化酶基因IbCWIN家族成员的研究尚未见报道。
本研究测定供试品种不同组织部位的蔗糖淀粉含量, 利用生物信息学方法对IbCWIN基因家族的理化性质、保守结构域、系统进化关系、启动子作用元件、组织特异性表达模式进行分析。
结果表明, 甘薯茎中蔗糖含量最高, 须根和叶次之, 块根最低; 块根淀粉含量最高, 极显著高于其他部位。
甘薯中含有10个IbCWIN基因, 编码氨基酸442~1115个, 蛋白质分子量范围49.56~124.44 kD, 等电点为5.0~9.1。
分布在8条染色体上, 都含有Glyco_32保守结构域及相同或相似的保守基序motif, 属于糖基水解酶基因家族GH32。
IbCWIN与木薯MeCWINV同源性高, IbCWIN基因家族启动子区域含有多种类型的顺式作用元件。
qRT-PCR结果表明, IbCWIN基因家族在甘薯不同组织中均有表达且有多种表达模式, 其中IbCWIN2和IbCWIN9在块根中表达量显著高于其他组织部位。
栽培甘薯的基因组中包含土壤杆菌属T-DNA表达基因教材

栽培甘薯的基因组中包含土壤杆菌属T-DNA表达基因—自然转基因粮食作物的一个例子摘要:发根农杆菌和根癌土壤杆菌是植物病原菌,具有承载功能基因转移DNA片段(转移DNA(本文)]进入宿主植物基因组的能力。
这种自然发生的机制已经应用于开发转基因作物,种植在超过世界10%的耕地上,尽管它们的使用可能会导致相当大的争议。
当组装甘薯的小干扰RNA,或siRNAs用来作宏基因组分析时,从脓杆菌中发现了T-DNA同源序列。
简单定量PCR,southern杂交,基因组步行,细菌人工染色体库筛选和测序,明确表明, 在栽培甘薯(番薯甘薯(Ipomoea batatas [L.] Lam.)基因组中发现了两个不同T-DNA区域(IbT-DNA1和IbT-DNA2),这些外源基因在甘薯植物的不同组织中表达。
IbT-DNA1被发现含有四个与iaaM,iaaH,c蛋白(C-prot)和 (Acs)基因同源的土壤杆菌(orf)【开放读码框架】。
IbT-DNA1存在于所有被检测的291种生物中,但在野生近缘中不存在。
IbT-DNA2包含至少5个ORFs,与土壤杆菌的 ORF14,ORF17n,根轨迹(Rol)B / RolC, ORF13 和ORF18 / ORF17n基因具有显著的同源性。
IbT-DNA2在217个基因型中的45个基因型中被发现,包括栽培和野生种。
我们发现,甘薯是自然转基因而形成的一种广泛和传统消费的粮食作物,可能对当前消费者对转基因粮食作物的安全性认识产生影响。
关键词:水平基因转移|农杆菌属|食品安全甘薯|转基因作物水平基因转移(HGT)长期以来一直被认为是一种自然现象,尤其是在细菌之间,但在真核生物的基因组中也不断的被发现(1)。
许多水平基因转移的实例包括基因从各种蛭形轮虫中的捐赠者中转移,(2)或者从细菌细胞内的沃尔巴克氏体转移到各种昆虫和线虫的基因中(3,4)。
有些转移的基因在受体中不是功能性的,而其他的被转录,形成获取新基因的运行机制。
枯草芽孢杆菌产淀粉酶基因的克隆与表达

枯草芽孢杆菌产淀粉酶基因的克隆与表达枯草芽孢杆菌(Bacillussubtilis)是一种在垃圾堆、陆地和淡水中常见的细菌,它可以合成淀粉酶,参与食品加工和制药等领域。
为了深入研究芽孢杆菌产淀粉酶的机制,本文旨在克隆和表达枯草芽孢杆菌的淀粉酶基因,为今后的更深入研究奠定基础。
研究中,我们首先从枯草芽孢杆菌的形态学特性中确定菌株,然后利用定点突变技术,以外源基因引入枯草芽孢杆菌,以达到调控基因表达的目的。
实验中,通过对枯草芽孢杆菌分离介质DNA的提取、限制性内切酶扩增以及后续的PCR扩增,我们能够从大量杂合DNA中克隆出淀粉酶基因的片段,然后进行终止密码子转录、酶切以及连接方面的实验,最终可以将淀粉酶基因克隆入宿主细菌质粒中,从而表达淀粉酶蛋白。
经过蛋白质免疫印迹分析,可以看到从枯草芽孢杆菌中克隆和表达的具有淀粉酶功能的蛋白质,在不同pH条件下具有较强的淀粉水解能力,与未经克隆表达的芽孢杆菌菌株相比,淀粉酶产量有了显著提高。
基于以上结果,我们总结出了枯草芽孢杆菌产淀粉酶基因的克隆与表达的技术方案,为今后的深入研究提供基础,也为特定乳酸菌淀粉酶防护剂的研发提供参考价值。
本文通过介绍枯草芽孢杆菌产淀粉酶基因的克隆与表达,探索了枯草芽孢杆菌淀粉酶的分子机制,证明了定点突变技术对淀粉水解能力的增强作用,为淀粉酶的进一步研究提供了可靠的技术手段。
未来,
我们将借助于新的基因技术等技术平台,进一步深入研究芽孢杆菌淀粉酶的功能、结构和稳定性,以期能更好地利用该酶的乳化作用,为食品加工和药物制造等领域提供支持。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
! "# " $ ! %淀粉酶活性的平板检测 将含质粒的大 肠杆菌细胞接种在 &’ ( )*+, 可溶性淀粉的固体培 养基 (含 +) 过夜培养后, 加入 - . /0 的氨苄青霉素) " 淀粉 12 # //30 . &%41 !) //30 . & 染色。背景为蓝色, 酶所在位置因淀粉被水解而呈无色透明。 ! "# " 5 大肠杆菌的诱导表达 将带 678%9:/; 的 大肠杆菌单菌落接种至 &’ 液体培养基 (含 +) - . /0 " 的氨苄青霉素) , 然后按 !), 的接种 #5< 过夜培养, 量转种, 当 =8$)) 达到 )*$ > #5< 振荡培养适当时间, 加入 1@AB 至终浓度为 ! //30 . & 诱导, 并在 )*? 时, 提取淀粉酶和 @:BE !C、 2 C、 # C、 D C、 + C、 $ C 后取样, 检测。 ! " # " ? 大肠杆菌和块根! %淀粉酶提取 将带 678% 的大肠杆菌培养液在 9:/; D< , !) )))- 离心 !)/FG, 上 清 液 装 入 透 析 带 中,用 聚 乙 二 醇 2)))) ( @EB2))))) 浓缩 !+ 倍; 细胞沉淀用 +)//30 . & 6H5*2 的磷酸缓冲液悬浮, 超声波破碎, D< , !) )))- 离心 上清液即为所需。块根 ! !)/FG, %淀粉酶提取按张勇
图 0 重组子 %&’$()*+ $淀粉酶的平板检’5$-)/2 分析
— >@ —
高技术通讯
/119L%
中可以看出, 在 !!"# 和 $%"# 间, &’#()*+, 比 &’#( (图 .,第 / - 的胞内 提 取 物 明 显 多 一 条 蛋 白 质 带 道) , 分子量约为 01"#, 这与克隆的 ! (淀粉酶 )#2* 推 导 的 多 肽 分 子 量 00 %%3"# 接 近, 与 报 道 4#4( 5*67 确定的! (淀粉酶亚基的分子量基本相同。 ! "# 大肠杆菌表达的 ! $淀粉酶与甘薯块根的 ! $淀 粉酶比较 / 8 9 8 : 不同来源! (淀粉酶迁移率的差异 由于大肠杆菌和甘薯分别属于原核和真核表达 系统, 它们在蛋白质表达和修饰方面存在许多不同, 这种不同可能对蛋白质的性质产生影响, 加之甘薯 中表达的 ! (淀粉酶是由相同亚基构成的同源四聚 体, 因此, 不同表达系统所得 ! (淀粉酶可能出现差 异。图 3 表示大肠杆菌和块根表达的! (淀粉酶在迁 移率方面的不同。从图中可以看出大肠杆菌的! (淀 粉酶比块根的! (图 3 第 / 道) 。 (淀粉酶迁移率更快
[J] 所述双脱 " /R / $ 756 序列测定 按照 M+2HCO 等 氧核苷酸链终止法进行。
"
&/&
材料与方法
材料 甘薯品种新 大 紫 ( !"#$#%& ’&(&(&) *+, -. / 012’
"/R/8 # ’淀粉酶活性的 (6LN 检测 所述方法进行。
[@] 按张勇为等
(>##"66>"$"@") , 四川农业生物技术攻关及四川大学青年科学研究基金 (Y#>##R#!>) 资助项目。 % @!R 计划 博士生; 研究方向: 分子遗传学及基因工程。 "?!$ 年生, ! 男, " 联系人。 (收稿日期: >##$’#8’#@)
无模板、 双 ! 道: 8L: . !"# M$% $%& K1 7NOPQO; 2 道: # 引物; 模板、 双引物; 模板、 单引物 # 道: D、 + 道:
图#
甘薯淀粉酶 )*’( 的 *+$,-* 扩增
将 KA%@JK 产物与载体 678%A 连接, 转化大肠 — #) —
张勇为等: 甘薯! 5淀粉酶 %678 克隆及其在大肠杆菌中的表达
质 粒 提 取、 限制酶切以及 " / R / > 大 肠 杆 菌 转 化、 [!] 756 连接等 参照 M+,:OBB9 等 所述方法或厂家 推荐方法进行。 反转录 -756 " / R / R %&’()% 在 8# E 反应体系中, $ 上、 下游引物各 > ,BE V *, 35&(F >## ,BE V *, NT "##2H, $ $ &+H ;BE=,CO+FC " / 8W。扩增条件: ?$X 变性 $,12 后进 入循 环, ?$X 变 性 ",12, 8@X 复 性 ",12,J>X 延 伸 经 R# 个循环后再 J>X 延伸 "#,12。 R,12,
张勇为等: 甘薯# ’淀粉酶 -756 克隆及其在大肠杆菌中的表达
甘薯 ! ! 淀粉酶 "#$% 克隆及其在大肠杆菌中的表达 "
张勇为! 张义正"
成都 !"##!$) (四川大学生命科学学院四川省分子生物学及生物技术重点实验室
利用 %&’()% 技术从甘薯新大紫 ( !"#$#%& ’&(&(&) *+, -. / 0123+41) 块根总 (约 " / 89:) 。将该片段克隆至 ;<7’& 载体, 经酶切分 %56 中扩增出预期大小的 756 片段 析和序列测定后, 正向插入的重组子命名为 ;<7’-6,=, 插入片段长 "8>":;, 编码 $?? 个氨 基酸残基的多肽, 分子量 88 ??@97。克隆的# ’淀粉酶 -756 与报道的甘薯另一品种 AB9C1 与 )+E=FGCH1+ FC;1I, # 5B / "$ 的 ,%56 有 ??D 的序列相同, ’淀粉酶 ,%56 有 @JD 相同。重 组子 ;<7’-6,= 经 K(&L 诱导后, 胞内可溶性提取物经凝胶电泳和活性染色, 出现明显的 淀粉酶活性带。M7M’(6LN 表明, 大肠杆菌表达的 # ’淀粉酶亚基的分子量约为 8#97。重 组子 ;<7’-6,= 在淀粉平板上形成明显的水解圈, 说明甘薯# ’淀粉酶 -756 不仅能在大肠 杆菌表达, 而且能将有活性的 # ’淀粉酶分泌到胞外。对重组子 ;<7’-6,= 和甘薯块根可 溶性提取物的比较发现, 大肠杆菌表达的# ’淀粉酶与甘薯块根的 # ’淀粉酶除迁移率不同 外, 对淀粉酶活性抑制剂 N7&6 和# ’巯基乙醇的敏感性相同。 关键词 甘薯, ’淀粉酶,-756 克隆,表达 # , 种 于 四 川 大 学 生 命 科 学 学 院 实 验 地。质 粒 3+41) ;<7’& 购自大连 &+9+O+ 生物工程 公 司。大 肠 杆 菌 ( * + ,#-. ) S<"#? 本室保存。 & / ’ 试剂 聚合酶 NT &+H ;BE=,CO+FC、 限制性内切酶、 连接 酶、 35&( 等购自大连 &+9+O+ 生物工程公司。反转录 酶购自 )EB2GCU 公司。其余试剂均为国产分析纯试 剂。 &/( 方法 按照 M+,’ " / R / " 甘薯块根总 %56 提取及反转录 [!] 所述方法进行。 :OBB9 等
— >? —
高技术通讯
2))D*I 对转化子质粒 8L: 经凝胶电泳和酶切 杆菌 R7!)I, 鉴定后, 正向插入的重组子命名为 678%9:/;, 并对 重组子进行序列测定, 结果如图 2 所示。与甘薯另 发现只有 一品种 43PQF L3 " !D ! %淀粉酶 98L: 相比, 很少的核苷酸序列发生变化。
上、 下游引物: ::ABJJ::AA %#’ 引物 @2: +’ % BAB:ABAJ:AJJA::AJ::AJ:::JB BBAAAB:BJJ%#’ 对甘薯块根的总 KL: 进行 KA%@JK 扩增, 结果 如图 ! 所示。
方框处表示存在插入, 阴影表示替换
图 ! 甘薯! $淀粉酶 %&’( 序列和推导的氨基酸序列
摘
要
#
引 言
甘薯是全球种植的主要作物之一, 具有高产稳
产、 抗逆性强、 适应性广等特点。我国年甘薯种植面 积占世界甘薯种植面积的 J#D 左右, 是夏季重要的 旱地作物。贮藏蛋白 ( F;BO+,12) 和# ’淀粉酶是甘薯 块根中 > 种最主要的蛋白质, 对甘薯的营养品质和
[", >] 口感起决定性作用 。由于甘薯潜在的用途以及
尽管大肠杆菌可将表达的 ! 5淀粉酶分泌到胞 外, 但胞内外的! 5淀粉酶是否存在某些差异仍然有 发 待确定。通过对胞内外 ! 5淀粉酶的 C8DK 检测, 现它们的迁移率相同 (见图 <) 。
@5G 道: EF65%8’- 经 BC!D 诱导 H,@,?,>,I,=,<J 后的胞内可溶性提取物
@ 道: EF65%8’- 上清液;? 道: EF65%8’- 胞内提取物
[$] 为等 所述方法进行。
! " # " I 淀粉酶对抑制剂的敏感性 所述方法进行。
[$] 按张勇为等
2
!"#
结果与分析
甘薯! $淀粉酶 %&’( 的克隆与鉴定 [#, D] 根据已报道的甘薯 ! 设计 %淀粉酶基因序列 引物 @!: +’ % JJ::J::ABBJAJJ::AJJJJBBABA
