阿伏伽德罗定律及其推论
阿伏伽德罗定律及其推论ppt课件.ppt
1.下列说法中正确的是 [
]
A.相同状况下,
气体的摩尔体积约等于22.4L/mol
B.标准状况下,22.4L的任何气体中都
约含有6.02×1023个分子
C.0℃,101kPa条件下,5.6LNH3中约 含有6.02×1023个原子
D.100℃、101kPa条件下,
22.4L水蒸气的质量等于18g
2.同温同压下,物质的量为0.2mol的 N2O(气)和NO2(气),它们的 [ CD ] A.质量相同,体积不同 B.体积相同,分子数不同 C.分子数相同,质量不同 D.体积相同,原子数相同
m
M
n X NA
N
XM
NA
ρ Vm X
ρX
Vm
V
1.利用气体摩尔体积,进行质量与体积 间的相互计算
【例题1】8.5g氨在标准状况时体积是多少升? 解:氨的式量是17,氨的摩尔质量是17g/mol
n(NH3)=
m(NH3) M(NH3) =
8.5g 17g/mol = 0.5mol
V(NH3)=22.4L/mol×0.5mol=11.2L
等于摩尔质量比。
练习:
ρ1∶ρ2=M 1∶M 2
在标准状况下,空气的平均式量为29,
相同条件下的下列气体密度比空气密度大的是(①③④ )
①CO2②H2③Cl2④HCl⑤N2
推论5
恒温恒容下,
气体的压强比等于它们的物质的量之比。
即:p1∶p2=n1∶n2
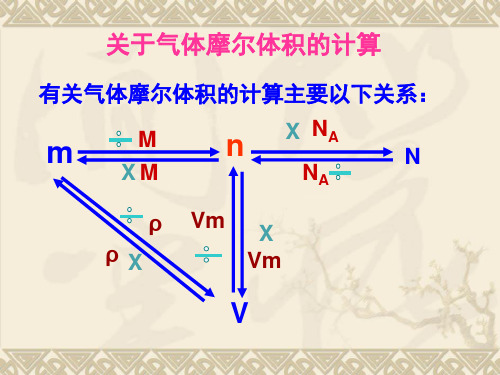
三、关于气体摩尔体积的计算
有关气体摩尔体积的计算主要以下关系:
解得:x=8g m(CO2)=30g-8g=22g
V(CO2)=17.6L-6.4L=11.2L
答:CO的质量为8g,CO2的质量为22g; CO的体积为6.4L,CO2的体积为11.2L。
阿伏伽德罗定律及其推论

阿伏伽德罗定律及其推论阿伏伽德罗定律是描述化学物质之间的质量关系的基本定律,也被称为质量守恒定律。
根据阿伏伽德罗定律,任何一个封闭系统中的质量在化学反应发生前后保持不变。
这个定律为我们研究和理解化学反应提供了基础。
阿伏伽德罗定律的推论之一是摩尔比关系。
根据摩尔比关系,化学反应中不同物质的摩尔比与其系数之间存在着简单的比例关系。
通过摩尔比关系,我们可以计算出化学反应中物质的摩尔数,从而研究反应的定量关系。
阿伏伽德罗定律和摩尔比关系在化学实验和化学计算中得到了广泛的应用。
在实验中,我们可以通过称量物质的质量来验证阿伏伽德罗定律。
例如,在氧化还原反应中,我们可以称量反应前后参与反应的物质的质量,验证质量守恒定律的成立。
在化学计算中,阿伏伽德罗定律和摩尔比关系可以用来确定化学反应的化学计量关系。
例如,在计算化学反应的反应物和生成物的摩尔比时,我们可以根据化学方程式中的系数来确定。
这样,我们可以根据摩尔比关系计算出反应物和生成物的摩尔数,从而计算出反应物质的质量、体积或浓度等。
阿伏伽德罗定律和摩尔比关系的应用不仅限于化学反应,还可以应用于溶液的配制和稀释、气体的混合和溶解等方面。
通过摩尔比关系,我们可以计算出溶液中溶质和溶剂的摩尔数,从而确定溶液的浓度或配比。
阿伏伽德罗定律和摩尔比关系的应用也扩展到了工业生产中。
在化工生产中,我们需要准确计算反应物的用量,以确保反应的效率和质量。
同时,在产品的合成和提纯过程中,阿伏伽德罗定律和摩尔比关系也为我们提供了重要的计算依据。
阿伏伽德罗定律及其推论摩尔比关系是化学中十分重要的基本原理。
它们为我们理解和研究化学反应提供了基础,并在实验和计算中得到了广泛的应用。
通过应用阿伏伽德罗定律和摩尔比关系,我们可以准确计算化学反应中物质的质量、摩尔数等参数,进而推导出反应的定量关系。
这些定律和关系的应用不仅在科学研究中起到重要作用,也在工业生产和实际应用中发挥着巨大的价值。
阿伏加德罗定律

阿伏加德罗定律
阿伏伽德罗定律(Avogadro's Law)是化学和物理学中的一个基本定律,由意大利化学家阿伏伽德罗(Amedeo Avogadro)于1811年提出。
该定律表明,在相同的温度和压力条件下,等体积的气体中包含的分子数相等。
具体来说,阿伏伽德罗定律可以表示为:相同条件下,等
压下不同气体的体积与该气体包含的粒子数成正比。
这意
味着,如果将两种不同的气体分别放置在相同的温度和压
力下,它们的体积与其中所包含的分子数成正比关系。
阿伏伽德罗定律的数学表达式可以写为 V = k * n,其中V
代表气体的体积,n代表气体中的分子数,k为比例常数。
根据这个定律,当气体的分子数增加时,其体积也会增加,反之亦然。
阿伏伽德罗定律对于研究气体的性质和气体化学反应等方面具有重要的应用价值,为化学和物理学领域的研究提供了基础理论支持。
阿伏伽德罗定律及其推论

________。
(2)若改为H2与NH3质量相等,则两容器的体
积之比为_____________________________。
提示: (1)当原子总数相等时,n(H2)∶n(NH3)=2∶1, 根据T、p相同时,V与n成正比,则V(A)∶V(B)=2∶1。 (2)H2与NH3质量相等时, n(H2)∶n(NH3)= M(NH3)∶M(H2)=17∶2, 根据T、p相同时,V与n成正比,则V(A)∶V(B)=17∶2。
在标准状况下,1mol任何气体的体积都约是22.4升
1、有关气体体积的计算
请列出标准状况下求算气体体积可能的方法:
1、V=m/ ρ 2、V=n×Vm (V=m/M×Vm V=N/NA×Vm)
标准状况下,Vm =22.4L/mol
2.有关气体摩尔体积的计算 :
请大家以物质的量(n)为中心,总结一下 有关气体的体积(V)、质量(m)以及分 子个数(N)之间的关系:
气体摩尔体积(二)
阿伏加德罗定律及其推论
气体摩尔体积
定义:单位物质的量的 气体所占的体积 Vm=V/n 单位:L/mol
[注意]
★ 气体摩尔体积的数值不是固定不变的,它与 温度和压强有关
★ 气体摩尔体积只适用于气态物质,对于固态 物质和液态物质来讲,都是不适用的。
★ 标准状况下气体摩尔体积约为22.4L/mol (标准状况:T=0 ℃,P=101KPa)
[例2] 在体积相同的两个密闭容器中分别充满O2、O3 气体,当这两个容器内气体的温度和密度相等时,下列说
法正确的是
()
A.两种气体的压强相等
B.O2比O3质量小 C.两种气体的分子数目相等
阿伏伽德罗定律及其推论

一、理想气体状态方程:PV=nRT 2、已知两种气体在等温、等容时: 根据 PV=nRT P与n成正比, 即推论1 P1/P2=n1/n2 3、已知两种气体在等温、等压时: V=m/ ρ ,n=m/ M, PV=nRT可以改成PM= ρRT,M与ρ成正比 即推论2 M1/M2=ρ1/ρ2
练习1. 依照阿伏加德罗定律,下列叙述中正 确的是( ) A.同温同压下,两种气体的体积之比等于摩 尔质量之比 B.同温同压下,两种气体的物质的量之比等 于密度之比 C.同温同压下,两种气体的摩尔质量之比等 于密度之比 D.同温同体积下,两种气体的物质的量之比 等于压强之比
练ห้องสมุดไป่ตู้2 下列条件下,两瓶气体所含原子数一
定相等的是 (
)
A.同温度、同体积的H2和N2 B.同压强、同体积的N2O和CO2 C.同体积、同密度的C2H4和C3H6 D.同质量、不同密度的N2和CO
理想气体状态方程的应用
——阿伏伽德罗定律及推论
一、理想气体状态方程:PV=nRT P: 气体的压强; V:气体的体积; n:气体的物质的量; T:气体的温度,单位是开尔文。 R:常数。
一、理想气体状态方程:PV=nRT 五个量中有四个是变量,已知两个量相等 能推出另两个的关系,这就是阿伏伽德罗 定律及其推论的由来。 1、已知两种气体在等温、等压时: 根据 PV=nRT V与n成正比, 即阿伏伽德罗定律:V1/V2=n1/n2
阿伏伽德罗定律推论

阿伏伽德罗定律推论阿伏加德罗定律(Avogadro's hypothesis),是同温同压下,相同体积的任何气体含有相同的分子数。
1811年由意大利化学家阿伏加德罗提出假说,后经科学家证实,称为阿伏加德罗定律。
利用此定律及物质的量与分子数目、摩尔质量之间的关系推导出的研究分子化学的常用方程式,即为阿伏伽德罗定律推论。
定义在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
气体的体积是指所含分子占据的空间,通常条件下,气体分子间的平均距离约为分子直径的10倍,因此,当气体所含分子数确定后,气体的体积主要决定于分子间的平均距离而不是分子本身的大小。
使用对象气体,可以是单一气体也可以是混合气体。
可以是单质气体,也可以是化合物气体。
推论阿伏加德罗定律(1)同温同压下,V1/V2 = n1/n2(2)同温同体积时,p1/p2 = n1/n2 = N1/N2(3)同温同压等质量时,V1/V2 = M2/M1(4)同温同压同体积时,M1/M2 = ρ1/ρ2分子间的平均距离又决定于外界的温度和压强,当温度、压强相同时,任何气体分子间的平均距离几乎相等(气体分子间的作用微弱,可忽略),故定律成立。
该定律在有气体参加的化学反应、推断未知气体的分子式等方面有广泛的应用。
阿伏加德罗定律认为:在同温同压下,相同体积的气体含有相同数目的分子。
1811年由意大利化学家阿伏加德罗提出假说,后来被科学界所承认。
这一定律揭示了气体反应的体积关系,用以说明气体分子的组成,为气体密度法测定气态物质的分子量提供了依据。
对于原子分子说的建立,也起了一定的积极作用。
克拉伯龙方程式克拉伯龙方程式通常用下式表示:pV = nRT……①p表示压强、V表示气体体积、n表示物质的量、T表示绝对温度、R表示气体常数。
所有气体R值均相同。
如果压强、温度和体积都采用国际单位(SI),R=8.31Pa·m3/mol·K。
第二课时 阿伏伽德罗定律推论 及平均摩尔质量求法

气体摩尔质量(相对分子质量) 的几种求法
① 根据化学式和相对原子质量直接求。
② 根据摩尔质量的定义来求。
m M= n
m总 M = n总
___
③ 由气体在标准状况下的密度来求
2. 同温同压下,等质量的SO2和CO2相比较,
下列叙述中,正确的是( AD ) (A)密度比为16:11 (C)体积比为1:1 (B)密度比为11:16 (D)体积比为11:16
3. 在相同温度和压强下,下列气体密度最小的 是( B )
A. CO2 B.H2 C.O2 D.Cl2
4、同温同压下,将1体积的CO2和2体积的 CO进行比较,则CO2与CO的: 1:2 (1)物质的量之比为______ (2)分子数之比为 ______ 1:2 (3)原子数之比为 ______ 3:4
ρ=
M
Vm
M
22.4 L/mol
ρ标=
④由某气体A对已知气体B的 相对密度(D)来求。
ρA D= ρ B
MA = MB
⑤由混合气体中各气体的摩尔质量和物质的 量分数(或体积分数 )来求。
M
___
= MA× A
B、 C
XA、
x + M x + M ×x x x 分别为气体A、B、C的
B× B C
C
M 解:
(空气)
=28g/mol x 78%
+32g/mol x 21%+44g/mol x1% =29 g/mol
答:空气的平均摩尔质量是29g/mol
答: 这种气体的相对分子质量为44.0。
阿伏伽德罗定律及其推论

• (5)同温同体积下,p1∶p2=n1∶n2。
阿伏加德罗定律的推论:
• 依据:PV=nRT
或 PV= m RT M
1.同温同压下,气体体积之比等于物
质的量之于
等于物质的量之比
V1 n1 V2 n2
(T、P相同)
阿伏加德罗定律的推论:
• 依据:PV=nRT
• P V = n R T (克拉贝龙方程)
压 强体
积
物质 的量
热力学温度
常数R=8.314
利用阿伏加德罗定律,以及clapeyron 方程,我们可以做出下面的几个重要的
推论:
• (1)同温同压下,V1∶V2=n1∶n2。 • (2)同温同压下,ρ1∶ρ2=M1∶M2。 • (3)同温同压同体积下,m1∶m2=M1∶M2。
1811年,意大利物理学家阿伏加德罗(Avogadro) 提出了阿伏加德罗假说:
在相同的温度和压强下,相同体积的任 何气体都含相同数目的分子。
——阿伏加德罗定律
气体体积比=分子个数比=物质的量的比
气体摩尔体积是阿伏加德罗定律的一个特例
*理想气体状态方程
• 温度(temperature)、压力 (pressure)、体积(volume)、是描 述一定量气体状态的3个物理量。他们之 间的联系可用方程式:
M
V2 M 1
(T、P、m相同 )
阿伏加德罗定律的推论:
• 依据:PV=nRT
或 PV= m RT M
5.同温同体积下,气体的压强之比等
于物质的量之比物质的定律
• 1805年,盖·吕萨克(Joseph Louis Gay Lussac)在用定量的方法研究气体反应体积间的 关系时,发现了气体定律:当压强不变时,反 应前的气体跟反应后生成的气体体积间互成简 单的整数比。
阿伏伽德罗定律

(3个数比=物质的量之比=化学
方程式中各物质的系数比;(2)写出化学反应方 程式;(3)由质量守恒定律确定生成物的分子式。
(1)已知标准状况下气体的密度(ρ)求解: M= 22 .4 ρ
V2
n2
[练习1]
同温同压下,同物质的量的乙炔 气体(C2H2)与苯蒸气(C6H6)体积 比是(B) (A)3:1 (B)1:1 (C)1:3 (D)2:3
阿伏加德罗定律的推论二
依据:PV=n RT 或 PV= m RT M
2.同温同体积下,气体的压强之比等于物质
的量之比(已知T1=T2 ,V1=V2)
V
=
nRT P
=
1 8.314 298 1.106 105
=
22.4升
二、阿伏加德罗定律的几个推论
阿伏加德罗定律的推论一
依据:PV=n RT 或 PV= m RT M
1. 同温同压下,气体体积之比等于物质
的量之比 (已知P1=P2,T1=T2)
P1V1 P2V2
=
n1RT1 n2RT2
所以
V1 = n1
1. 同温同压下,体积相同的下列气体,
密度与其它三者不同的是( ) D
((AC))NCO2
((BD))CH22HS4
2. 同温同压下,密度相同的气体组是
(A)
((AC))CCO2H、4、NN2 O ((BD))NSOO、2、CCHl24
[练习4]
2. 同温同压下,将1体积的CO2和2体 积(1的)C分O进子行数比之较比,为则C1:O22与CO;的: (2)原子数之比为 3:4 ; (3)质量之比为 11:14 ; (4)物质的量之比为 1:2 ; (5)摩尔质量之比为 11:7 。
高中化学 阿伏伽德罗定律的使用范围

阿伏加德罗定律
•阿伏伽德罗定律:
同温同压下,相同体积的任何气体含有相同的分子数。
•
•阿伏伽德罗定律的使用范围:
阿伏伽德罗定律只对气体起作用,使用于任何气体,包括混合气体。
•方法与技巧:
1.“三同”定“一同”(温度、压强、气体体积、气体分子数);“两同”定“比
例”。
2.阿伏伽德罗定律及其推论的数学表达式可由理想气体状态方程(PV=nRT)或其变
形形式(PM=ρRT)推出,不用死记硬背。
•理想气体状态方程:
理想气体状态方程的表达式:PV= nRT
P表示压强,V 表示体积,T表示温度,R是常数,n是气体的物质的量。
可根据此方程来推断阿伏伽德罗定律的相关推论:。
阿伏伽德罗定律及其推论

阿伏伽德罗定律及其推论定义:在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
使用对象:气体,可以是单一气体也可以是混合气体。
可以是单质气体,也可以是化合物气体推论阿伏加德罗定律(1)同温同压下,V1/V2=n1/n2(2)同温同体积时,p1/p2=n1/n2=N1/N2(3)同温同压等质量时,V1/V2=M2/M1(4)同温同压同体积时,M1/M2=ρ1/ρ2分子间的平均距离又决定于外界的温度和压强,当温度、压强相同时,任何气体分子间的平均距离几乎相等(气体分子间的作用微弱,可忽略),故定律成立。
该定律在有气体参加的化学反应、推断未知气体的分子式等方面有广泛的应用。
阿伏加德罗定律认为:在同温同压下,相同体积的气体含有相同数目的分子。
1 811年由意大利化学家阿伏加德罗提出假说,后来被科学界所承认。
这一定律揭示了气体反应的体积关系,用以说明气体分子的组成,为气体密度法测定气态物质的分子量提供了依据。
对于原子分子说的建立,也起了一定的积极作用。
克拉伯龙方程式中学化学中,阿伏加德罗定律占有很重要的地位。
它使用广泛,特别是在求算气态物质分子式、分子量时,如果使用得法,解决问题很方便。
下面简介几个根据克拉伯龙方程式导出的关系式,以便更好地理解和使用阿佛加德罗定律。
克拉伯龙方程式通常用下式表示:PV=nRT……①P表示压强、V表示气体体积、n表示物质的量、T表示绝对温度、R表示气体常数。
所有气体R值均相同。
如果压强、温度和体积都采用国际单位(SI),R=8.3 1帕·米3/摩尔·开。
如果压强为大气压,体积为升,则R=0.082大气压·升/摩尔·度。
因为n=m/M、ρ=m/v(n—物质的量,m—物质的质量,M—物质的摩尔质量,数值上等于物质的分子量,ρ—气态物质的密度),所以克拉伯龙方程式也可写成以下两种形式:Pv=m/MRT……②和PM=ρRT……③以A、B两种气体来进行讨论。
2019-2020年高考化学一轮复习真题考点集训 阿伏加德罗定律及推论(含解析)

2019-2020年高考化学一轮复习真题考点集训阿伏加德罗定律及推论(含解析)【知识点的认识】1、阿伏伽德罗定律:同温同压下,体积相同的任何气体都含有相同的分子数即阿伏加德罗定律.2、阿伏伽德罗定律推论:我们可以利用阿伏加德罗定律以及物质的量与分子数目、摩尔质量之间的关系得到以下有用的推论:(1)同温同压时:①V1:V2=n1:n2=N1:N2 ②ρ1:ρ2=M1:M2 ③同质量时:V1:V2=M2:M1(2)同温同体积时:④P1:P2=n1:n2=N1:N2 ⑤同质量时:P1:P2=M2:M1(3)同温同压同体积时:⑥ρ1:ρ2=M1:M2=m1:m2【命题方向】本考点主要考察阿伏伽德罗定律及其推论的内容,需要重点掌握.题型一:阿伏伽德罗定律典例1:(2011•新疆一模)下列叙述正确的是()A.一定温度、压强下,气体体积由其分子的大小决定B.一定温度、压强下,气体体积由其物质的量的多少决定C.气体摩尔体积是指1mol任何气体所占的体积为22.4L D.不同的气体,若体积不等,则它们所含的分子数一定不等分析:A、对于气体来说,气体分子间的距离远大于分子本身的大小,一定温度、压强下,决定其体体积大小的主要因素是分子数的多少;B、一定温度、压强下,气体分子间的距离一定,气体体积由气体的物质的量的多少决定;C、气体摩尔体积是指1mol任何气体所占的体积;D、一定物质的量的气体的体积大小取决于温度和压强,外界条件不同,体积不同.解答:A、一定温度、压强下,气体分子间的距离一定,气体分子间的距离远大于分子本身的大小,决定其体体积大小的主要因素是分子数的多少,故A错误;B、根据阿伏伽德罗定律,同温同压下,体积相同的任何气体都含有相同的分子数,因此气体体积由气体的物质的量的多少决定,故B正确;C、气体摩尔体积是指1mol任何气体所占的体积,不同条件下,气体摩尔体积的数值不同,标准状况下约为22.4L/mol,故C错误;D、一定物质的量的气体的体积大小取决于温度和压强,外界条件不同,体积不同,不同条件下体积不等的气体所含分子数可能相等,故D错误.故选B.点评:本题考查阿伏加德罗定律定律及其推论,题目难度不大,本题注意影响气体体积大小的因素有哪些.题型二:阿伏伽德罗定律推论典例2:下列各组中,两种气体的分子数一定相等的是()A.温度相同、体积相同的O2和N2 B.体积相等、密度不等的CO和C2H4C.质量相等、密度不等的N2和C2H4 D.压强相同、体积相同的N2和O2分析:根据N=nNA可知,分子数相等,则物质的量相等,据此判断.A、温度相同、体积相同,压强之比等于物质的量之比等于分子数之比;B、根据m=ρV,n=mM进行判断;C、n=mM进行判断;D、压强相同、体积相同,分子数之比等于温度之比.解答:A、温度相同、体积相同,压强之比等于物质的量之比等于分子数之比,二者所处的压强不一定相同,所以分子数不一定相等,故A错误;B、体积相等、密度不等,二者的质量不相等,由于CO和C2H4的摩尔质量相等,所以二者的物质的量不相等,分子数不相等,故B错误;C、二者质量相同,N2和C2H4的摩尔质量相等,所以二者的物质的量相等,分子数相等,故C正确;D、根据pV=nRT可知,压强相同、体积相同,分子数之比等于温度之比,二者的温度不一定相等,故分子数不一定相等,故D错误.故选C.点评:本题考查阿伏伽德罗定律及推论,难度不大,关键对阿伏伽德罗定律及推论的理解,可借助pV=nRT理解.【解题思路点拨】相对密度:在同温同压下,上面结论式②和式⑥中出现的密度比值称为气体的相对密度D=ρ1:ρ2=M1:M2.注意:①D称为气体1相对于气体2的相对密度,没有单位.如氧气对氢气的密度为16.一、选择题(共15小题)1.质量相同的下列气体中,相同条件下体积最大的是()A.CH4 B.N2 C.CO2 D.SO22.下列说法正确的是()A.摩尔是一种国际基本物理量B.标准状况下气体摩尔体积约为22.4LC.1mol氧气的质量为16gD.在同温同压下,相同体积的任何气体单质所含分子数相同3.在同温同压下,某气体与氮气质量相同,体积比为2:3则该气体的相对分子量为()A.42 B.56 C.21 D.724.同温、同压下等质量的SO2气体和CO2气体,下列有关比较的叙述中,正确的是①密度比为16:11②密度比为11:16③体积比为16:11④体积比为11:16()A.①③ B.①④ C.②③ D.②④5.下列各组中,两种气体的分子数一定相等的是()A.温度相同、体积相同的O2和N2B.体积相等、密度不等的CO和C2H4C.质量相等、密度不等的N2和C2H4D.压强相同、体积相同的N2和O26.下列叙述正确的是()A.与28gCO具有相同分子数的CO2的质量一定是44gB.与VLCO具有相同分子数的CO2的体积一定是VLC.所含原子数相等的CO与CO2的密度之比为7:11D.所含原子数相等的CO与CO2的密度之比为21:227.由CH4和O2组成的混合气体,标准状况下的密度为1g•L﹣1,则该混合气体中CH4和O2的体积比为()A.2:1 B.3:2 C.2:3 D.1:28.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是()A.若M(甲)>M(乙),则气体体积:甲<乙B.若M(甲)<M(乙),则气体的压强:甲>乙C.若M(甲)>M(乙),则气体的摩尔体积:甲<乙D.若M(甲)<M(乙),则的分子数:甲<乙9.标准状况下两个容积相等的贮气瓶,一个装有02,一个装有CH4,两瓶气体具有相同的()A.质量B.原子总数C.密度D.分子数10.同温同压下,某容器充满O2重116g,若充满CO2重122g,现充满某气体重114g,则某气体的分子量为()A.28 B.60 C.32 D.411.在一定体积的密闭容器中放入3L气体R和5L气体Q,在一定条件下发生反应2R(g)+5Q(g)═4X(g)+nY(g)反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是()A.2 B.3 C.4 D.512.同温同压下,相同质量的下列气体,所占体积最大的是()A.CH4 B.O2 C.CO2 D.SO213.在标准状况下①6.72L CH4②3.01×1023个HCl分子③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达正确的是()a.体积②>③>①>④b.密度②>③>④>①c.质量②>③>①>④d.氢原子个数①>③>④>②A.abc B.bcd C.abcd D.acd14.下列关于同温同压下的两种气体12C18O和14N2的判断正确的是()A.体积相等时密度相等B.原子数相等时具有的中子数相等C.体积相等时具有的电子数相等D.质量相等时具有的质子数相等15.在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是()A.p(Ne)>p(H2)>p(O2)B.p(O2)>p(Ne)>p(H2)C.p(H2)>p(O2)>p (Ne)D.p(H2)>p(Ne)>p(O2)二、填空题(共3小题)(除非特别说明,请填准确值)16.等物质的量的CO和CO2中所含O原子个数之比,C原子数之比,二者的质量之比,在同温同压下的体积之比.17.同温同压下,同体积的H2和CO2物质的量之比为,分子个数之比,原子个数之比为,质量比为(最简整数比).18.与16g氧气所含有分子数相同的氨气是g,与16g氧气所含原子总数相同的氨气是g;相同条件下,5.6g氮气中添加g氨气,所组成的混合气体体积与16g O2所占体积相同.三、解答题(共3小题)(选答题,不自动判卷)19.已知在标况下的四种气体①6.72LCH4②3.01×1023个HCl分子③13.6克H2S ④0.2molNH3用相应的序号填写下列空白:(1)体积最大的是;密度最大的是;(3)质量最小的是;(4)含氢原子数最少的是.20.同温同压下,同体积的氨气和硫化氢气体(H2S)的质量比为;同质量的氨和硫化氢气体的体积比为,其中含有的氢的原子个数比为;若二者氢原子数相等,它们的体积比为.21.同温同压下,若A容器中充满O2和B容器中充满O3(1)若所含分子总数相等,则A容器和B容器的容积之比是;若两容器中所含原子总数相等,则A容器和B容器的容积比是;(3)若两容器的体积比为3:2,则O2和O3物质的量之比为,质量之比为,密度之比为.【考点训练】阿伏加德罗定律及推论-1参考答案与试题解析一、选择题(共15小题)1.质量相同的下列气体中,相同条件下体积最大的是()A.CH4 B.N2 C.CO2 D.SO2考点:阿伏加德罗定律及推论.专题:阿伏加德罗常数和阿伏加德罗定律.分析:相同条件下,气体的物质的量越大,则气体的体积越大,根据n=结合各物质的摩尔质量进行比较,气体的摩尔质量越大,则物质的量越小,体积越小.解答:解:由V=nV m=×V m可知,相同条件下,相同质量时,气体的摩尔质量越小,物质的量越大,则气体的体积越大,则有:A.CH4的摩尔质量为16g/mol;B.N2的摩尔质量为28g/mol;C.CO2的摩尔质量为44g/mol;D.SO2的摩尔质量为64g/mol,则CH4的摩尔质量最小,所以相同质量时,体积最大,故选A.点评:本题考查气体物质的量的计算,题目难度不大,注意相关计算公式的运用,注意在相同条件下气体的气体摩尔体积相同.2.下列说法正确的是()A.摩尔是一种国际基本物理量B.标准状况下气体摩尔体积约为22.4LC.1mol氧气的质量为16gD.在同温同压下,相同体积的任何气体单质所含分子数相同考点:阿伏加德罗定律及推论;物质的量的单位--摩尔;气体摩尔体积.专题:阿伏加德罗常数和阿伏加德罗定律.分析:A、摩尔是物质的量的单位.B、标准状况下气体摩尔体积约为22.4L/molL.C、氧气的摩尔质量是32g/mol.D、同温同压下,体积之比等于物质的量之比,所以在同温同压下,相同体积的任何气体含有相同的分子数.解答:解:A、物质的量是国际七个基本物理量之一,摩尔是物质的量的单位,故A错误;B、气体摩尔体积的单位是L/mol,标准状况下气体摩尔体积约为22.4Lmol/L,1mol气体的体积约为22.4L,故B错误;C、氧气的摩尔质量是32g/mol,1mol氧气的质量为32g,故C错误;D、同温同压下,体积之比等于物质的量之比,所以在同温同压下,相同体积的任何气体含有相同的分子数,故D正确.故选:D.点评:考查物质的量及单位、气体摩尔体积、摩尔质量、阿伏伽德罗常数与推论,难度不大,注意基础知识的掌握.3.在同温同压下,某气体与氮气质量相同,体积比为2:3则该气体的相对分子量为()A.42 B.56 C.21 D.72考点:阿伏加德罗定律及推论.专题:阿伏加德罗常数和阿伏加德罗定律.分析:同温同压下,气体的V m相等,结合n==以及物质的分子构成解答该题.解答:解:同温同压下,气体的V m相等,体积比为2:3,由n=可知气体的物质的量之比为2:3,设气体的相对分子质量为x,气体与氮气质量相同,则有2x=3×28,x=42,故选A.点评:本题考查阿伏伽德罗定律及其推论,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意相关计算公式的运用,难度中等.4.同温、同压下等质量的SO2气体和CO2气体,下列有关比较的叙述中,正确的是①密度比为16:11②密度比为11:16③体积比为16:11④体积比为11:16()A.①③ B.①④ C.②③ D.②④考点:阿伏加德罗定律及推论.专题:阿伏加德罗常数和阿伏加德罗定律.分析:根据质量相同计算出两种物质的物质的量之比,结合阿伏加德罗定律及其推论计算并比较体积、密度关系.解答:解:同温同压下,气体摩尔体积相同,设两种物质的质量都为1g,则SO2和CO2的物质的量之比==11:16,根据知,两种气体的密度之比等于其摩尔质量之比=64g/mol:44g/mol=16:11,根据V=知,相同质量的两种气体,其体积之比等于摩尔质量的反比=44g/mol:64g/mol=11:16,所以①④正确,故选B.点评:本题考查物质的量的相关计算以及阿伏加德罗定律及其推论的有关知识,题目难度不大,注意有关公式的利用.5.下列各组中,两种气体的分子数一定相等的是()A.温度相同、体积相同的O2和N2B.体积相等、密度不等的CO和C2H4C.质量相等、密度不等的N2和C2H4D.压强相同、体积相同的N2和O2考点:阿伏加德罗定律及推论.专题:阿伏加德罗常数和阿伏加德罗定律.分析:根据N=nN A可知,分子数相等,则物质的量相等,据此判断.A、温度相同、体积相同,压强之比等于物质的量之比等于分子数之比;B、根据m=ρV,n=进行判断;C、n=进行判断;D、压强相同、体积相同,分子数之比等于温度之比.解答:解:A、温度相同、体积相同,压强之比等于物质的量之比等于分子数之比,二者所处的压强不一定相同,所以分子数不一定相等,故A错误;B、体积相等、密度不等,二者的质量不相等,由于CO和C2H4的摩尔质量相等,所以二者的物质的量不相等,分子数不相等,故B错误;C、二者质量相同,N2和C2H4的摩尔质量相等,所以二者的物质的量相等,分子数相等,故C正确;D、根据pV=nRT可知,压强相同、体积相同,分子数之比等于温度之比,二者的温度不一定相等,故分子数不一定相等,故D错误.故选C.点评:本题考查阿伏伽德罗定律及推论,难度不大,关键对阿伏伽德罗定律及推论的理解,可借助pV=nRT理解.6.下列叙述正确的是()A.与28gCO具有相同分子数的CO2的质量一定是44gB.与VLCO具有相同分子数的CO2的体积一定是VLC.所含原子数相等的CO与CO2的密度之比为7:11D.所含原子数相等的CO与CO2的密度之比为21:22考点:阿伏加德罗定律及推论.专题:阿伏加德罗常数和阿伏加德罗定律.分析:A、根据m=nM=M计算;B、气体体积受温度和压强的影响;C、根据ρ=计算判断;D、根据ρ=计算判断.解答:解:A、28gCO的物质的量是1mol,与28gCO具有相同分子数的CO2的物质的量也是1mol,1mol二氧化碳的质量是44g,故A正确;B、气体体积受温度和压强的影响,温度和压强不同,气体摩尔体积不同,所以与VLCO具有相同分子数的CO2的体积不一定是VL,故B错误;C、所含原子数相等的CO与CO2的质量之比为7:11;由ρ=知,温度和压强不同,气体摩尔体积不同,未知一氧化碳和二氧化碳的气体摩尔体积,所以无法计算其体积,导致无法判断其密度之比,故C错误;D、所含原子数相等的CO与CO2的质量之比为7:11;由ρ=知,温度和压强不同,气体摩尔体积不同,未知一氧化碳和二氧化碳的气体摩尔体积,所以无法计算其体积,导致无法判断其密度之比,故D错误.故选A.点评:本题考查了有关气体体积、密度、质量的计算判断,难度不大,明确有关气体体积的计算受温度和压强的影响.7.由CH4和O2组成的混合气体,标准状况下的密度为1g•L﹣1,则该混合气体中CH4和O2的体积比为()A.2:1 B.3:2 C.2:3 D.1:2考点:阿伏加德罗定律及推论.专题:阿伏加德罗常数和阿伏加德罗定律.分析:根据M=ρVm计算混合气体的平均摩尔质量,根据十字交叉法计算混合气体中CH4和O2的体积比.解答:解:混合气体在标准状况下的密度为1g/L,则混合气体的平均摩尔质量为1g/L×22.4L/mol=22.4g/mol.根据十字交叉法计算混合气体中CH4和O2的体积比:所以混合气体中CH4和O2的体积比为9.6:6.4=3:2,故选B.点评:本题考查混合物的计算,难度中等,本题采取十字交叉法计算,简化计算.采取常见解法,容易理解,但计算繁琐,容易出错.8.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是()A.若M(甲)>M(乙),则气体体积:甲<乙B.若M(甲)<M(乙),则气体的压强:甲>乙C.若M(甲)>M(乙),则气体的摩尔体积:甲<乙D.若M(甲)<M(乙),则的分子数:甲<乙考点:阿伏加德罗定律及推论.专题:阿伏加德罗常数和阿伏加德罗定律.分析:相同温度下,在两个密闭容器中,分别充有等质量、等密度的甲、乙两种气体,根据ρ=可知气体的体积相等,结合n=以及PV=nRT比较压强大小,根据Vm=比较气体摩尔体积大小,根据n=判断气体的物质的量,气体物质的量越大,气体分子数越多.解答:解:A.两个密闭容器中,分别充有等质量、等密度的甲、乙两种气体,根据ρ=可知气体的体积相等,故A错误;B.若M(甲)<M(乙),根据n=,则气体的物质的量:甲>乙,由PV=nRT可知,气体的压强:甲>乙,故B正确;C.根据n=,若M(甲)>M(乙),则气体的物质的量:甲<乙,根据Vm=,故则气体的摩尔体积:甲>乙,故C错误;D.根据n=,若M(甲)<M(乙),则n(甲)>n(乙),则气体的分子数:甲>乙,故D错误;故选B.点评:本题考查阿伏加德罗定律及推论,题目难度不大,本题注意相关计算公式的运用,为解答该题的关键,易错点为D,注意根据密度的计算公式推导.9.标准状况下两个容积相等的贮气瓶,一个装有02,一个装有CH4,两瓶气体具有相同的()A.质量B.原子总数C.密度D.分子数考点:阿伏加德罗定律及推论.专题:阿伏加德罗常数和阿伏加德罗定律.分析:A、根据m=nM=M计算.B、根据N=nN A=N A结合分子构成计算原子总数.C、根据ρ=判断.D、根据N=nN A=N A计算分子总数.解答:解:标准状况下两个容积相等的贮气瓶,一个装有02,一个装有CH4,气体摩尔体积相同,所以两个储气瓶中气体的物质的量相同.A、两储气瓶中气体的物质的量相等时,由m=nM=M知,两种气体的摩尔质量M不同,所以两种气体的质量不同,故A错误.B、两储气瓶中气体的物质的量相等时,所含分子数相同,一个甲烷分子中含有5个原子,一个氧气分子中含有2个原子,所以两种气体含有的原子数不同,故B错误.C、由ρ=知,标况下,气体摩尔体积相同,两种气体的摩尔质量不同,所以密度不同,故C错误.D、两储气瓶中气体的物质的量相等时,所含分子数相同,故D正确.故选D.点评:本题考查了阿伏伽德罗定律及其推论,难度不大,易错选项是C,会根据密度公式进行推导摩尔质量、气体摩尔体积和密度的关系是解本题的关键.10.同温同压下,某容器充满O2重116g,若充满CO2重122g,现充满某气体重114g,则某气体的分子量为()A.28 B.60 C.32 D.4考点:阿伏加德罗定律及推论;相对分子质量及其计算.专题:阿伏加德罗常数和阿伏加德罗定律.分析:同温同压下,相同容积时,气体的物质的量相同.令气体的物质的量为n,容器质量为m,根据容器充满氧气与二氧化碳的质量,列方程计算n、m的值;根据M=可计算X气体的摩尔质量,据此计算气体X的相对分子质量.解答:解:令气体的物质的量为n,容器质量为m,则:m+n×32g/mol=116g,m+n×44g/mol=122g.解得,n=0.5mol,m=100g.充满气体X后的质量为114g,所以气体X的质量为114g﹣100g=14g,物质的量为0.5mol.气体X的摩尔质量为=28g/mol.所以气体X的相对分子质量为28.故选:A.点评:考查阿伏伽德罗定律及推论的计算,难度不大,注意相对分子质量的计算方法,计算气体的物质的量是解题关键.11.在一定体积的密闭容器中放入3L气体R和5L气体Q,在一定条件下发生反应2R(g)+5Q(g)═4X(g)+nY(g)反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是()A.2 B.3 C.4 D.5考点:阿伏加德罗定律及推论.专题:阿伏加德罗常数和阿伏加德罗定律.分析:在相同温度和相同体积下,气体的压强与物质的量呈正比,容器温度不变,混合气体的压强是原来的87.5%,说明反应后气体的总物质的量减小,则反应应向物质的量减小的方向进行,以此判断方程式中化学计量数关系.解答:解:容器温度不变,混合气体的压强是原来的87.5%,说明反应后气体的总物质的量减小,则反应应向物质的量减小的方向进行,即方程式中反应物的化学计量数之和大于生成物的化学计量数之和,则有:2+5>4+n,n<3,选项中只有A符合,故选A.点评:本题考查阿伏加德罗定律以及推论的应用,题目难度不大,注意从压强的变化分析方程式化学计量数关系,避免繁琐的计算.12.同温同压下,相同质量的下列气体,所占体积最大的是()A.CH4 B.O2 C.CO2 D.SO2考点:阿伏加德罗定律及推论.专题:阿伏加德罗常数和阿伏加德罗定律.分析:同温同压下,气体体积之比等于物质的量之比,所以相同质量的气体,体积之比与摩尔质量成反比,即同温同压下,相同质量的气体,摩尔质量越大,所占体积越小.据此判断.解答:解:A、甲烷的摩尔质量为16g/mol;B、氧气的摩尔质量为32g/mol;C、二氧化碳的摩尔质量为44g/mol;D、二氧化硫的摩尔质量为64g/mol;所以同温同压下,相同质量的气体,所占体积为CH4>O2>CO2>SO2.故选:A.点评:本题考查阿伏伽德罗定律及推论,难度不大,可借助PV=nRT理解阿伏伽德罗定律及推论.注意可运用公式判断.13.在标准状况下①6.72L CH4②3.01×1023个HCl分子③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达正确的是()a.体积②>③>①>④b.密度②>③>④>①c.质量②>③>①>④d.氢原子个数①>③>④>②A.abc B.bcd C.abcd D.acd考点:阿伏加德罗定律及推论.专题:阿伏加德罗常数和阿伏加德罗定律.分析:a、相同条件下,气体的体积之比等于物质的量之比,据此判断;b、相同条件下,密度之比等于摩尔质量之比;c、计算各物质的质量进行比较;d、计算出各物质的物质的量,结合化学式判断H原子的物质的量,据此解答.解答:解:①6.72L CH4物质的量为=0.3mol,②3.01×1023个HCl分子的物质的量为0.5mol,③13.6g H2S 的物质的量为=0.4mol,④0.2mol NH3.a.相同条件下,气体的体积之比等于物质的量之比,所以体积体积②>③>①>④,故a正确;b.各物质的摩尔质量分别为①CH4为16g/mol②HCl为36.5g/mol ③H2S 为34g/mol④NH3为17g/mol,相同条件下,密度之比等于摩尔质量之比,所以密度②>③>④>①,故b正确;c.各物质的质量分别为①CH4为0.3mol×16g/mol=4.8g②HCl为0.5mol×36.5g/mol=33.25g ③H2S 13.6g④NH3为0.2mol×17g/mol=3.4g,所以质量②>③>①>④,故c正确;d.各物质中H原子的物质的量分别为①CH4为0.3mol×4=1.2mol②HCl为0.5mol③H2S0.4mol×2=0.8mol④NH3为0.2mol×3=0.6mol,所以氢原子个数①>③>④>②,故d正确.故选C.点评:本题考查阿伏伽德罗定律及推论、常用化学计量数的有关计算,难度不大,注意基础知识的掌握.14.下列关于同温同压下的两种气体12C18O和14N2的判断正确的是()A.体积相等时密度相等B.原子数相等时具有的中子数相等C.体积相等时具有的电子数相等D.质量相等时具有的质子数相等考点:阿伏加德罗定律及推论.专题:阿伏加德罗常数和阿伏加德罗定律.分析:同温同压下,气体的V m相等,等体积时,根据n=可知气体的物质的量相等,结合原子的构成以及相关物理量的计算公式解答该题.解答:解:A.由于12C18O和14N2的相对分子质量不等,故体积相等的两种气体的质量不等,因此密度不等,故A错误;B.1个12C18O分子中有16个中子,1个14N2分子中含有14个中子,二者均为双原子分子,原子数相等,即分子数相等,但中子数不等,故B错误;C.12C18O和14N2均为14电子分子,同温同压下,体积相等则分子数相等,所具有的电子数相等,故C正确;D.12C18O和14N2分子内均有14个质子,由于二者的相对分子质量不等,故等质量的两种分子所具有的质子数不等,故D错误.故选C.点评:本题考查基本概念和基本理论知识,意在考查考生对一些重要概念与理论的理解能力,题目难度中等.15.在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是()A.p(Ne)>p(H2)>p(O2)B.p(O2)>p(Ne)>p(H2)C.p(H2)>p(O2)>p (Ne)D.p(H2)>p(Ne)>p(O2)考点:阿伏加德罗定律及推论.专题:阿伏加德罗常数和阿伏加德罗定律.分析:在温度和密度都相同条件下,压强与摩尔质量呈反比.据此判断.解答:解:Ne的摩尔质量为20g/mol,H2的摩尔质量为2g/mol,O2的摩尔质量为32g/mol.在温度和密度都相同条件下,压强与摩尔质量呈反比,摩尔质量越大,压强越小.所以三种气体的压强(p)从大到小的顺序是p(H2)>p(Ne)>p(O2).故选:D.点评:考查阿伏伽德罗定律及推论,难度不大,可借助pV=nRT理解阿伏伽德罗定律及推论.注意稀有气体是单原子分子.二、填空题(共3小题)(除非特别说明,请填准确值)16.等物质的量的CO和CO2中所含O原子个数之比1:2,C原子数之比1:1,二者的质量之比7:11,在同温同压下的体积之比1:1.考点:阿伏加德罗定律及推论;物质的量的相关计算.专题:阿伏加德罗常数和阿伏加德罗定律.分析:根据N=nN A,以及n==,结合分子的构成进行计算.解答:解:根据N=nN A可知,分子数之比等于物质的量之比,而1个CO分子中含有1个C原子,1个O原子,1个CO2分子中含有1个C原子,2个O原子,所以:等物质的量的CO和CO2中所含O原子个数之比1:2,C原子数之比为1:1,根据n==,可知m=nM,二者的质量之比为:m(CO):m(CO2)=28:44=7:11,V=nV m,在同温同压下V m相同,则体积之比为:V(CO):V(CO2)=nV m:nV m=1:1,故答案为:1:2;1:1;7:11;1:1.。
阿伏伽德罗定律及其推论

(1)同温同压下,V1/V2=n1/n2 (2)同温同体积时,P1/P2=n1/n2=N1/N2 (3)同温同压等质量时,V1/V2=M2/M1 (4)同温同压同体积时,M1/M2=ρ1/ρ2 分子间的平均距离又决定于外界的温度和压强,当温度、压强相同时,任何气体分子间的平均距离几乎相等(气体分子间的作用微弱,可忽略),故定律成立。该定律在有气体参加的化学反应、推断未知气体的分子式等方面有广泛的应用。 阿伏加德罗定律认为:在同温同压下,相同体积的气体含有相同数目的分子。1811年由意大利化学了气体反应的体积关系,用以说明气体分子的组成,为气体密度法测定气态物质的分子量提供了依据。对于原子分子说的建立,也起了一定的积极作用。
克拉伯龙方程式
中学化学中,阿伏加德罗定律占有很重要的地位。它使用广泛,特别是在求算气态物质分子式、分子量时,如果使用得法,解决问题很方便。下面简介几个根据克拉伯龙方程式导出的关系式,以便更好地理解和使用阿佛加德罗定律。 克拉伯龙方程式通常用下式表示:PV=nRT……① P表示压强、V表示气体体积、n表示物质的量、T表示绝对温度、R表示气体常数。所有气体R值均相同。如果压强、温度和体积都采用国际单位(SI),R=8.31帕·米3/摩尔·开。如果压强为大气压,体积为升,则R=0.082大气压·升/摩尔·度。 因为n=m/M、ρ=m/v(n—物质的量,m—物质的质量,M—物质的摩尔质量,数值上等于物质的分子量,ρ—气态物质的密度),所以克拉伯龙方程式也可写成以下两种形式: Pv=m/MRT……②和PM=ρRT……③ 以A、B两种气体来进行讨论。 (1)在相同T、P、V时: 根据①式:nA=nB(即阿伏加德罗定律) 分子量一定 摩尔质量之比=密度之比=相对密度)。若mA=mB则MA=MB。 (2)在相同T·P时: 体积之比=摩尔质量的反比;两气体的物质的量之比=摩尔质量的反比) 物质的量之比=气体密度的反比;两气体的体积之比=气体密度的反比)。 (3)在相同T·V时: 摩尔质量的反比;两气体的压强之比=气体分子量的反比)。
阿伏伽德罗定律

7、在相同体积的两个密闭容器中分别充满了O2 、O3 , 当这两个容器内温度和气体密度都相等时,下列正确的是( ) A、两个容器内气体的压强相等 B、O2 比O3的质量小 C、两个容器内气体的分子数相等 D、两个容器内氧原子数目相等
8、 NA表示阿伏加德罗常数的值,下列叙述中不正确的是 ( ) A、分子总数为NA的NO2和CO2的混合气体中含有的氧原子数为2NA
2、(双选)下列条件下,两瓶气体所含原子数一定相等的是( ) A、同质量、不同密度的N2和CO B、同温度、同体积的H2和N2 C、同体积、同密度的C2H4和C3H6 D、同压强、同体积的N2O和CO2
3、 同温同压下,等质量的SO2和CO2相比较,下列叙述正确的是 ( ) A 、 密度比为16:11 B、 密度之比为11:16 C 、体积比为16:11 D 、体积比为11:16
4、在三个密闭容器中分别充入Ne、H2、O2三种气体,在以下 各种情况下排序正确的是( ) A、当他们体积、温度、压强均相同时, 三种气体的密度ρ(H2)>ρ(Ne)>ρ(O2) B、当他们温度和密度都相同时, 三种气体的压强P(H2)> P(Ne)>P(O2) C、当他们质量、温度、压强均相同时, 三种气体的体积V(O2)>V(Ne)>V(H2) D、当他们体积、温度、压强均相同时, 三种气体的质量m(H2)> m(Ne)>m(O2)
5、代表阿伏加德常数,下列说法正确的是 ( ) A、在同温同压时,相同体积的任何气体单质所含的原子数目相同 B、2g氢气所含原子数目为NA C、在常温常压下,11.2L氮气所含的原子数目为NA D、17g氨气(NH )所含电子数目为10 NA 3
6、两个密闭容器中分别充有质量相同的甲、乙两种气体, 若两容器的压强和温度均相同,且甲的密度大于乙的密度, 则下列说法正确的是( ) A、甲的分子数比乙的分子数多 B、甲的物质的量比乙的物质的量少 C、甲的摩尔体积比乙的摩尔体积小 D、甲的相对分子质量比乙的相对分子质量小
阿伏伽德罗定律

⑶标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数约为1.5NA个
⑷将NO2和N2O4分子共NA个降温至标准状况下,其体积为22.4L
⑸常温下,18g重水所含中子数为10NA个
⑹常温常压下,1mol氦气含有的金属和酸反应,若生成2g氢气,则有2NA电子发生转移
⑶不正确,因为NO和氧气一接触就会立即反应生成二氧化氮。
⑷不正确,因为存在以下平衡:2NO2N2O4(放热),降温,平衡正向移动,分子数
少于1mol,标准状况下,其体积小于22.4L
⑸不正确,重水分子(D2O)中含有10个中子,相对分子质量为20,18g重水所含中子数为:10×18g/20g?mol-1=9mol。
⑻标准状况下,1L辛烷完全燃烧后,所生成气态产物的分子数为
⑼31g白磷分子中,含有的共价单键数目是NA个
⑽1L1mol?L-1的氯化铁溶液中铁离子的数目为NA
【点拨】⑴正确,1mol氮气的分子数与是否标准状况无关。
⑵正确,任意比例混合的甲烷和丙烷混合气体22.4L,气体的总物质的量为1mol,因此含有NA个分子。
⑽不正确,Fe3+在溶液中水解。
本题答案为⑴⑵⑹⑺
⑻不正确,标准状况下,辛烷是液体,不能使用标准状况下气体的摩尔体积22.4L/mol这一量,所以1L辛烷的物质的量不是1/22.4mol。
⑼不正确,白磷分子的分子式为P4,其摩尔质量为124g/mol,31g白磷相当于0.25mol,
白磷的分子结构为正四面体,一个白磷分子中含有6个P-P共价键,所以,0.25mol白磷中含有1.5NA个P-P共价键。
⑹正确,1个氦原子核外有4个电子,氦气是单原子分子,所以1mol氦气含有4mol
初中化学之阿伏伽德罗定律

初中化学之阿伏伽德罗定律
阿伏伽德罗定律是化学中的一条基本定律,它描述了气体在一
定条件下的行为规律。
该定律是由意大利化学家阿芬尼斯阿伏伽德
罗在19世纪提出的。
阿伏伽德罗定律指出,相同温度和压力下,相同体积的气体中,不论其物质是什么,其分子或原子的个数是相等的。
换句话说,单
位体积气体的分子数是恒定的。
这个定律可以用下面的公式表示:
n = PV / RT
其中,n表示气体的摩尔数,P表示气体的压力,V表示气体
的体积,R表示气体常数,T表示气体的温度。
该定律的实验依据主要有以下几个方面:
1. 实验表明,气体密度和气体摩尔质量之间存在一定的关系,
通过测定气体密度可以确定其摩尔质量。
2. 在相同温度和压力下,不同气体体积之间存在一定的比例关系,从而得出单位体积气体的分子数是恒定的结论。
3. 定律的适用性从高真空到高压都有所不同,但在一定条件下是适用的。
阿伏伽德罗定律的应用非常广泛。
它可以用来计算气体的摩尔数、压力、体积和温度之间的关系。
例如,在化学实验中,可以根据阿伏伽德罗定律计算出反应物和生成物的摩尔比例,从而确定化学方程式的平衡状态。
总之,阿伏伽德罗定律是研究气体行为的基础,它为化学家们提供了一个重要的工具,帮助他们理解和预测气体的性质和行为规律。
拓展(阿伏伽德罗定律)

【拓展】阿伏加德罗定律及推论
可通过理想气体状态方程nRT pV =(其中p 为压强、V 为体积、n 为物质的量、T 为温度、R 为理想气体常量)来理解、记忆、推导
推论1:同温同压下,气体的体积比等于其物质的量之比。
推导过程:①RT n pV 11= ②RT n pV 22=
由①和②可得:2
121n n V V = 推论2:同温同体积下,气体的压强之比等于其物质的量之比。
推论3:同温同压下,相同体积的任何气体的质量之比,等于其摩尔质量之比。
推论4:同温同压下,任何气体的密度之比等于其摩尔质量之比。
推论5:同温同物质的量的气体,其压强之比等于体积的反比。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
阿伏伽德罗定律及其推论
1.在两个容积相同的容器中,一个盛有CH4气体,另一个盛有H2和O2的混合气体。
在同温同压下,两容器内的气体一定具有相同的是()
A.原子数 B.分子数 C.质量 D.密度
2.2 mol O2和2 mol CO2相比较,下列叙述中正确的是()
A.分子数相等 B.原子数相等 C.体积相等 D.质量相等
3.下列叙述正确的是()
A.同温同压下,相同体积的物质,其物质的量一定相等
B.任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等
C.1 L一氧化碳气体一定比1 L氧气的质量小
D.相同条件下的一氧化碳和氮气,若体积相等,则质量也相等
4.科学家已发现一种新型氢分子,其化学式为H3,在相同条件下,等质量的H3和H2相同的是() A.原子数 B.分子数 C.体积 D.物质的量
5(多选).根据阿伏加德罗定律,下列叙述中正确的是() A.同温同压下两种气体的体积之比等于摩尔质量之比 B.同温同压下两种气体的物质的量之比等于密度之比 C.同温同压下两种气体的摩尔质量之比等于密度之比 D.同温同体积下两种气体的物质的量之比等于压强之比
6.在同温、同压下,若A容器的氯气和B容器的氨气中它们所含的原子数相等,则这两个容器的体积之比是( )
A.2∶1 B.1∶2 C.2∶3 D.1∶3
7.在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
A.两种气体的压强相等 B.O2比O3的质量小
C.两种气体的分子数目相等 D.两种气体的氧原子数目相等
8.依照阿伏加德罗定律,下列叙述正确的是( )
A.同温同压下两种气体的体积之比等于摩尔质量之比 B.同温同压下两种气体的物质的量之比等于密度之比 C.同温同压下两种气体的摩尔质量之比等于密度之比 D.同温同压下两种气体的物质的量之比等于压强之比
9.下列关于ag H2和bg He的说法中正确的是( )
A.同温同压下,H2和He的体积比是a∶2b
B.同温同压下,若a=b,则H2与He的物质的量之比是1∶1
C.体积相同时,He的质量一定大于H2的质量
D.同温同压下,若二者的物质的量相等,其体积也相等
10.下列两种气体的分子数一定相等的是( )
A.质量相等的N2和CO B.体积相等的CO和C2H4
C.等温、等体积的O2和N2 D.等压、等体积的N2和CO2
11.相同条件下,等物质的量的两种气体一定满足( )
A.体积均为22.4 L B.具有相同的体积 C.是双原子组成的分子 D.所含原子数目相同
12(多选).同温同压下,等质量的SO2和CO2相比较,下列叙述正确的是
A.密度比为16:11 B.密度比为11:16 C.体积比为1:1 D.体积比为11:16
13(多选).下列两种气体的分子数一定相等的是()
A.质量相等、密度不等的CO和N2 B.等温等体积的O2 和N2 C.等体积等密度的CO和N2 D.等压等体积的O2 和N2
14(多选).下列叙述正确的是()
A.同温同压下,相同体积的物质,其物质的量一定相等
B.任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等
C.1L一氧化碳气体一定比1L氧气的质量小
D.相同条件下的一氧化碳气体和氮气,若体积相等,则质量也相等
15(多选).同温同压下两个容积相等的贮气瓶,一个装有NO气体,另一个装有N2和O2的混合气体,两瓶内的气体一定具有相同的()
A.质量 B.原子总数 C.分子总数 D.密度
16.同温同压下,某容器充满O2重116 g,若充满CO2重122 g,现充满某气体重114 g,则某气体的相对分子质量为( ) A.28
B.60
C.32
D.4
17.由CH4和O2组成的混合气体标况下的密度为1g/L,则该混合气体中CH4和O2的体积比为( )
A.2:1 B.1:2 C.2:3 D.3:2
18.在标况下,10gCO和CO2的混合气体共6.72 L,则此混合气体中CO和CO2的物质的量之比是( )
A.2:1 B.1:2 C.1:1 D.3:4
19.在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g。
则两种气体的物质的量之和为________mol,其中CO2为________mol,CO占总体积的________%。
§1-2化学计量在实验中的应用摩尔质量和气体摩尔气体习题
第 7 页共 6 页
摩尔质量
1-5 C、B、A、D、B 6-10 C、D、D、CD、D 11-13 A、B、D
14.(1)(2)(3)(4)360a mol―1
气体摩尔体积
1-5 D、B、B、D、B 6-10 D、C、D、D、C 11-16 C、D、B、CD、B、C 17. m/M 2mNA/M 22.4m/M
阿伏伽德罗定律
1-5 B、A、D、A、CD 6-10 A、D、C、D、A 11-15 B、AD、AC、BD、BC 16-18 A、D、A。
