高一化学必修一_第二章第一节物质分类——分散系及其分类PPT
合集下载
高一化学分散系及其分类课件ppt.ppt

科学探究
实验:分别用激光照射盛硫酸铜溶液和氢氧化铁胶体的烧杯,在光束垂直的方向观察现象。并完成下列表格:
光束照射时的现象
Fe(OH)3胶体
CuSO4溶液
有光亮通路
(2)溶液和胶体的区别
科学探究
实验:分别用激光照射盛硫酸铜溶液和氢氧化铁胶体的烧杯,在光束垂直的方向观察现象。并完成下列表格:
光束照射时的现象
交叉分类法
分散质
分散剂
实例
气
气
空气
液
气
云、雾
固
气
烟灰尘
气
液
泡沫
液
液
牛奶,酒精的水溶液
固
液
油漆
气
固
泡沫塑料
液
固
珍珠(包藏着水的碳酸钙)
固
固
有色玻璃、合金
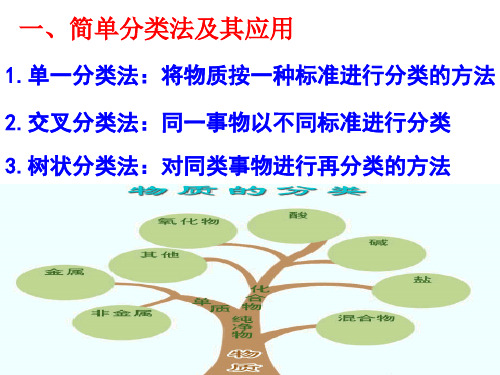
9种类型的分散系:
依据分散质粒子的大小对分散剂是液态(包括水)的分散系进行再分类。
请同学阅读课本24页倒数第三段,并画出溶液、胶体、浊液的分类图。
知识回顾
什么是溶液? 什么是溶质? 什么是溶剂?
一. 分散系
一. 分散系
把一种或多种物质分散在另一种或多种物质中所得到的体系叫分散系。
一. 分散系
把一种或多种物质分散在另一种或多种物质中所得到的体系叫分散系。
被分散的物质称做分散质,
一. 分散系
把一种或多种物质分散在另一种或多种物质中所得到的体系叫分散系。
当一束光通过胶体时,从入射光的垂直方向上可看到有一条光带,这个现象叫丁达尔现象, 利用此性质可鉴别胶体与溶液。
2、 布郎运动
悬浮在水中的花粉小颗粒作不停地,无秩序地运动,这种现象叫做布朗运动.
3、 电泳现象
实验:分别用激光照射盛硫酸铜溶液和氢氧化铁胶体的烧杯,在光束垂直的方向观察现象。并完成下列表格:
光束照射时的现象
Fe(OH)3胶体
CuSO4溶液
有光亮通路
(2)溶液和胶体的区别
科学探究
实验:分别用激光照射盛硫酸铜溶液和氢氧化铁胶体的烧杯,在光束垂直的方向观察现象。并完成下列表格:
光束照射时的现象
交叉分类法
分散质
分散剂
实例
气
气
空气
液
气
云、雾
固
气
烟灰尘
气
液
泡沫
液
液
牛奶,酒精的水溶液
固
液
油漆
气
固
泡沫塑料
液
固
珍珠(包藏着水的碳酸钙)
固
固
有色玻璃、合金
9种类型的分散系:
依据分散质粒子的大小对分散剂是液态(包括水)的分散系进行再分类。
请同学阅读课本24页倒数第三段,并画出溶液、胶体、浊液的分类图。
知识回顾
什么是溶液? 什么是溶质? 什么是溶剂?
一. 分散系
一. 分散系
把一种或多种物质分散在另一种或多种物质中所得到的体系叫分散系。
一. 分散系
把一种或多种物质分散在另一种或多种物质中所得到的体系叫分散系。
被分散的物质称做分散质,
一. 分散系
把一种或多种物质分散在另一种或多种物质中所得到的体系叫分散系。
当一束光通过胶体时,从入射光的垂直方向上可看到有一条光带,这个现象叫丁达尔现象, 利用此性质可鉴别胶体与溶液。
2、 布郎运动
悬浮在水中的花粉小颗粒作不停地,无秩序地运动,这种现象叫做布朗运动.
3、 电泳现象
人教版高中化学必修一第二章第一节物质的分类 课件(共17张PPT)

答案: DDBBD
3.溶液、胶体和浊液这三种分散系的根本区别是( ) A.是否为大量分子或离子的集合体 B.分散质微粒直径的大小 C.能否透过滤纸 D.是否均一、稳定、透明
当堂检测
4.下列分散系属于胶体的是( ) ①雾 ②豆浆 ③食盐水 ④蔗糖水 ⑤泥水 ⑥血液 A.只有② B.①②⑥ C.①②③ D.①②③④⑥
*5.下列事实与胶体性质无关的是( ) A.在豆浆里加入盐卤做豆腐 B.河流入海处易形成沙洲 C.一束平行光线照射蛋白质溶液时,从侧面可看 到光亮的通路 D.FeCl3溶液中加入NaOH溶液出现红褐色沉淀
【课前思考题】 我们日常生活中所见的烟、雾、云属于纯净物吗?
第一节物质的分类
分散系及其分类
分散系及其分类
一、分散系的概念(书中标记)
1、分散系:
把一种(或多种)物质分散在另一种(或 多种)物质中得到的体系。
2、分散质: 分散系中被分散物质 3、分散剂: 起容纳分散质作用的物质。
二、分散系的分类
有 色 玻 璃
科学探究(自学3分钟)
如何制取Fe(OH)3胶体?
三、Fe(OH)3胶体的制备
1、步骤:
滴入饱和FeCl3溶液
沸水
溶液呈红褐色
煮沸
2、原理: FeCl3+3H2O Fe(OH)3+3HCl
△
(Fe(OH)3胶体)
(胶体)
Fe(OH)3胶体 CuSO4溶液
光束照射时的现象
有一条“光亮”的通路 看不到此现象
2.胶体的性质
⑴丁达尔效应
应用:区分胶体和溶液
思考阅读:
P28科学视野(自学5分钟)
胶体有哪些性质? 胶体应用有哪些?
(2)介稳性
3.溶液、胶体和浊液这三种分散系的根本区别是( ) A.是否为大量分子或离子的集合体 B.分散质微粒直径的大小 C.能否透过滤纸 D.是否均一、稳定、透明
当堂检测
4.下列分散系属于胶体的是( ) ①雾 ②豆浆 ③食盐水 ④蔗糖水 ⑤泥水 ⑥血液 A.只有② B.①②⑥ C.①②③ D.①②③④⑥
*5.下列事实与胶体性质无关的是( ) A.在豆浆里加入盐卤做豆腐 B.河流入海处易形成沙洲 C.一束平行光线照射蛋白质溶液时,从侧面可看 到光亮的通路 D.FeCl3溶液中加入NaOH溶液出现红褐色沉淀
【课前思考题】 我们日常生活中所见的烟、雾、云属于纯净物吗?
第一节物质的分类
分散系及其分类
分散系及其分类
一、分散系的概念(书中标记)
1、分散系:
把一种(或多种)物质分散在另一种(或 多种)物质中得到的体系。
2、分散质: 分散系中被分散物质 3、分散剂: 起容纳分散质作用的物质。
二、分散系的分类
有 色 玻 璃
科学探究(自学3分钟)
如何制取Fe(OH)3胶体?
三、Fe(OH)3胶体的制备
1、步骤:
滴入饱和FeCl3溶液
沸水
溶液呈红褐色
煮沸
2、原理: FeCl3+3H2O Fe(OH)3+3HCl
△
(Fe(OH)3胶体)
(胶体)
Fe(OH)3胶体 CuSO4溶液
光束照射时的现象
有一条“光亮”的通路 看不到此现象
2.胶体的性质
⑴丁达尔效应
应用:区分胶体和溶液
思考阅读:
P28科学视野(自学5分钟)
胶体有哪些性质? 胶体应用有哪些?
(2)介稳性
人教化学必修1第二章第1节物质的分类(共21张PPT)

无现象 变蓝
几种常见分散系的分类、比较
分散系
分散质微 粒直径
分散质微 粒构成
主要特征 (即外观 稳定性)
能否透过 滤纸 能否透过 半透膜
溶液 <1nm 单个分子、
离子 均一、稳定
能 能
胶体
1~100nm 少量分子集
合体 较均一、 较稳定
能
不能
浊液
>100nm 大量分子集
合体 不均一、 不稳定 不能
浊液
>100nm 大量分子集
合体 不均一、 不稳定
问题2:为什么胶体具有介稳性呢?
(2)电泳———在外加电场的作用下,胶体分散质 微粒在分散剂里向阴极(阳极)作定向运动的现象。
胶体发生电泳现象说明 [Fe(OH)3]胶体颗粒 带电荷
探究2
• 向盛有Fe(OH)3胶体的试管中加入饱和的 NaCl溶液,将会出现怎样的现象?试解 释原因? 现象:试管中先出现红褐色沉淀
气
固
泡沫塑料,冰箱吸味剂
液
固
珍珠,干燥剂的吸潮
固
固
有色玻璃,合金
分散系分类的依据:
当分散剂是水或其它液体时,按照分散质粒子 的大小进行分类
溶液
乳浊液 浊液
悬浊液
1nm=10-9m
1nm 纳米
100nm
胶体
溶液、胶体和浊液的区别
分散系 溶液
分散质大小 <1nm
外观 均一、透明
胶体
均一、透明 1~100nm
15 、再美好的梦想与目标,再完美的计划和方案,如果不能尽快在行动中落实,最终只能是纸上谈兵,空想一番。 7. 必须提醒自己:放下你的浮躁,静下心来阅读;放下你的贪婪,有失必有得;放下你的自卑,相信你自己;放下你的虚荣,别自以为是;放下你 容易被诱惑的眼睛,听从自己的内心;放下你的自私,学会懂得感恩;放下你的懒惰,该好好努力了。一起勉励! 15. 真诚并不意味着要指责别人的缺点,但意味着一定不恭维别人的缺点。 5. 红尘画卷,画的是谁的生死之恋?最后却只能守着那不变的容颜,一守就是一千年。 5 、无志者常立志,有志者立常志,咬定一个目标的人最容易成功。 16 、心存希望,幸福就会降临你;心存梦想,机遇就会笼罩你。 15 、总有一个人他教会你成长,然后又独自离开。 7 、为明天做准备的最好方法,就是要集中你所有的智慧,所有的热诚,把今天的事情做得尽善尽美。 2 、当你感到痛苦时,就去学习点什么吧,学习可以使我们减缓痛苦。 5) 如果你想快点成名,那么就得慢点睡觉;如果你想快点长智,那么就得慢点骄傲。如果你想慢点老化,那么你就得快点学习;如果你想慢点淘 汰,那么就得快点迈步。
课件_人教版化学必修一《物质的分类分散系及其分类》PPT课件_优秀版

(6)冶金厂大量烟尘用高压电除去;
花粉在水面上作布朗运动
从胶体溶液里分离的操作。
向沸水中加入5~6滴饱和氯化铁溶液,继续加热,至溶液呈红褐色,停止加热
胶体中的分散质微粒能通过滤纸
向沸水中加入5~6滴饱和氯化铁溶液,继续加热,至溶液呈红褐色,停止加热
(5) 利用渗析可以分离和提纯胶体 胶体中的分散质微粒能通过滤纸 (4) 在胶体中加入电解质、加热时会发生聚
第三课时 分散系及其分类 5、用特殊方法把固体物质加工到纳米级(1nm~100nm)的超细粉末粒子,然后得到纳米材料。
花粉在水面上作布朗运动 第二章 第一节 物质的分类 电影放映时的丁达尔现象 电影放映时的丁达尔现象 太阳光照在弥漫灰尘的室内,可看到从窗口到地面出现一条光亮的通路 (4) 在胶体中加入电解质、加热时会发生聚 把一种(或几种)物质分散在另一种(或几种)物质中,所得到的体系。 电影放映时的丁达尔现象
24
课后作业
P29——5、6、7
25
26
把一种(或几种)物质分 向沸水中加入5~6滴饱和氯化铁溶液,继续加热,至溶液呈红褐色,停止加热
使分散质聚集成较大的微粒,在重力作用下形成沉淀析出。 (3) 胶体分散质微粒带同种电荷,在外加电场
散在另一种(或几种)物质 2、Fe(OH)3胶体和MgCl2溶液共同的性质是( )
胶体中的分散质微粒能通过滤纸 1、溶液、胶体、浊液的本质区别 胶体中的分散质微粒能通过滤纸
2、氢氧化铁胶体的制备方法 向沸水中加入5~6滴饱和氯化铁溶液,继续加热,至溶液呈红褐色,停止加热 花粉在水面上作布朗运动
分离各种氨基酸和蛋白质 胶体中分散质微粒对可见光散射。
向沸水中加入5~6滴饱和氯化铁溶液,继续加热,至溶液呈红褐色,停止加热
必修1第二章第一节-物质的分类分散系及其分类[新课]PPT课件
![必修1第二章第一节-物质的分类分散系及其分类[新课]PPT课件](https://img.taocdn.com/s3/m/bc124784ee06eff9aff80782.png)
10/17/2020
18
实验探究2
光束照射时的现象
原因分析
Fe(OH)3胶体 CuSO4溶液
形成一条光亮 胶体粒子能使光波
的通路
发生散射
无光路现象产生
溶液中粒子太小, 对光的散射极微弱
粒子较大,散射
粒子小,透射
10/17/2020
19
(4)胶体的性质
①丁达尔效应——特性 光束通过胶体时看到一条光亮“通
10/17/2020
13
气溶胶
雾
烟
白 云
10/17/2020
14
实验探究1
(2)Fe(OH)3胶体的制备
如何制备Fe(OH)3胶体? 往沸水中逐滴滴加饱和FeCl3溶液,继
续加热至溶液呈红褐色,停止加热。
FeCl3 + 3H2O
△ Fe(OH)3 (胶体)+ 3HCl
注意
① Fe(OH)3 (胶体)不能打“↓” ②不能用自来水,也不能搅拌
③加热至溶液呈红褐色后停止加热
10/17/2020
15
胶体的制备:
1.物理方法: 溶解法:如肥皂、淀粉、蛋白质溶解于水可直接得到胶 体. 机械法:将固体颗粒直接磨成胶粒的大小,溶于溶剂得 到胶体,如将碳粉制成碳素墨水. 2.化学方法: 水解法:如氢氧化铁胶体的制备: FeCl3+3H2O = Fe(OH)3(胶体)+3HCl 复分解反应法:如碘化银胶体的制备:
10/17/2020
24
胶粒的电性?
表面积大,吸附力强;吸附阳离子的带上正电
荷,吸附阴离子的带上负电荷。
胶体带电吗O胶 但OOHHH是体-O-- 胶粒HF-体子e3(不+OFeH胶带F3e-+粒电(OO),HHF)带呈-e33电电+FOe;中3H+性- OHOO-HH- -
人教化学必修1第二章第1节物质的分类(共20张PPT)

探究:如何区别溶液与胶体? 用丁达尔效应
2、胶体的性质
1.丁达尔现象 2.布朗运动 在胶体溶液里,胶粒不断地进行无规则
运动,这种运动叫布朗运动。
3.电泳现象 在外加电场作用下,胶体粒子在分散剂里
向电极(阴极或阳极)作定向移动的现象,叫做电泳。
4.胶体的渗析 由于胶体颗粒直径较大注电而意性使:,其胶胶体粒不不因能显吸通
过半透膜。
附带电荷的离子
5.胶体的凝聚(聚沉)-----产生凝胶 而呈现电性。
原因:当破坏胶体微粒原来带有相同电荷的特
点时,就会使它从不容易凝聚的状态变成聚集状态
而沉淀(凝胶)
胶体凝聚的方法: (1)加热 (2)加电解质溶液 (3)加带相反电荷的胶体 如:蛋清加热后成为蛋白(加热)钢笔使用的 墨水不能混用、石膏使豆浆变成豆腐等(加电 解质)。
胶体处于稳定状态的原因是什么?
1.布朗运动是胶体稳定的一个因素。
2.同种胶粒带同种电荷,也是胶体稳定的另 一个因素。
夜晚用手电筒照射夜空
光线 透过树叶间
的缝隙射入
密林中
放电影时,放映室射到银幕上的光柱
?空气也是胶体吗? 是的。叫气溶胶
牛奶
豆浆
分散系 溶液
浊液
胶体
分散质粒子 的直径
<10-9m
>10-7m
体而使胶体发生聚沉,所以胶体具有介稳性。
豆浆
(3)胶体的分类
根据分散 剂状态分
气溶胶:烟、云、雾
液溶胶: Fe(OH)3胶体、 AgI胶体 固溶胶:有色玻璃、烟水晶
胶体特征是以分散质粒子的大小为特征;只 是物质的一种存在形式。
(4)胶体的性质 1、丁达尔效应 当一束强光透过胶体时,可以看到一条光 亮的通路,这种现象叫做丁达尔效应。
高一化学必修一第二章第一节物质分类――分散系及其分类资料PPT课件
有色玻璃、合金
6
二、分散系及其分类
2.分散系分类 (2)当分散剂是液体时,按分散质粒子大小
分散质粒子大小 d<1nm
1nm<d<100nm
d>100nm
所属分散系 外观现象
溶液
均匀、透明、稳定
胶体
均匀、透明、介稳定
浊液
不均匀、不透明、不稳定
★胶体:分散质粒子直径位于1~100nm的分散系
胶体本质特征: 100nm > d粒子 > 1nm 7
3
二、分散系及其分类
1.分散系: 把一种(或多种)物质分散在另一种 (或多种)物质中所得到的体系
•分散质:被分散的物质(量少) •分散剂:容纳分散质的物质(量多)
根据分散系概念,你还能举出其它分散系例子
吗?根据分散质或分散剂所处的状态(气态、
液态、固态),分散系可分为哪几种?
4
二、分散系及其分类
3.胶体
(2)胶体性质 ①丁达尔效应—— 一束光通过胶体有一条光亮的“通路”。
•原因:胶体粒子较大对光有散射作用 •应用:区分胶体和溶液
现学现用:你现在能解释以下生活现象吗?
11
二、分散系及其分类
3.胶体
(2)胶体性质 ②电泳—— (视频)胶粒在电场作用下定向移动
•原因:胶粒直径小→表面积大吸附能力强→可吸附溶液中离子 → Fe(OH)3胶粒只吸附阳离子而带正电荷(选择性吸附)→向阴 极移动→阴极区颜色逐渐变深
CuSO4溶液
Fe(OH)3胶 体
泥水
光束照射时的现象
硫酸铜
无光亮通路产生
溶液
形成一条光亮的通路
无光亮通路产生
原因分析
溶液中粒氢氧子化的铁直径很小, 散射极其胶体微弱
分散系及分类 ppt课件

课堂小练
3. 说法中正确的是( ) A.溶液和胶体的本质区别在于能否发生丁达尔效应 B.胶体和浊液均不能通过半透膜 C.溶液和浊液可以通过溶液的外观来进行判断 D.淀粉溶液具有均一,透明,稳定的溶液特性 【答案】C 【解析】溶液和胶体的本质区别在于分散质离子的大小不同,A错误。胶体可以 通过半透膜,B错误。溶液时均一稳定的,静置无沉淀产生,而沉淀不均一不稳 定,静置又沉淀产生,因而可通过外观进行判断,C正确。淀粉溶液在分散系中 属于胶体,而非溶液,D错误
胶体的应用实例
水的净化
卤水点豆腐
KAl(SO4)2·H2O 明矾
水解 Al(OH)3胶体,带正电
自然水中的胶粒 主要带负电
胶体的应用实例
长江三角洲的形成
不同牌子的墨水不 能混用,因为不同的墨 水,其胶体都带电荷可 能不同,混用易容易出 现堵塞笔的下水孔
课堂小练
1.下列关于分散系的叙述不正确的是 ( ) A. 胶体区别于其他分散系的本质特征是丁达尔效应 B. 用激光笔照射区分FeCl3溶液和Fe(OH)3胶体 C. 把FeCl3饱和溶液滴入到沸腾的蒸馏水中,以制取Fe(OH)3胶体 D. 卤水点豆腐与胶体的聚沉相关 【答案】A 【解析】选项A,胶体区别于其他分散系的本质特征是分散质的颗粒直径介于1~ 100 nm 之间,A说法错误。选项B,利用的是胶体的丁达尔现象。选项C,是 Fe(OH)3胶体的正确制备方法。选项D,卤水中含电解质,会使豆浆中的蛋白质胶 体聚沉。答案为A。
课堂小练
3.我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学
的角度来说,“往伤口上撒盐”的做法并无不妥。那么,这种做法的化学
原理是( )
A.胶体的电泳
B.血液的氧化还原反应
第2章 第1节 第2课时分散系及其分类 --人教版高中化学必修一课件(共37张PPT)

请评价该操作是否正确
;
②乙直接加热饱和 FeCl3 溶液,请评价是否正确
;
③丙向沸水中滴加饱和 FeCl3 溶液,为了使反应进行充分,
煮沸 10 分钟,请评价是否正确
。
(3)写出制备 Fe(OH)3 胶体的化学方程式:
。
证明有 Fe(OH)3 胶体生成的实验操作是
。
利用的胶体性质是
。
(4)Fe(OH)3 胶体稳定存在的主要原因是
(1)若将饱和 FeCl3 溶液分别滴入下列物质中,能形成胶体的
是
。
A.冷水
B.沸水
C.NaOH 浓溶液
D.NaCl 浓溶液
(2)现有甲、乙、丙三名同学进行 Fe(OH)3 胶体的制备: ①甲同学的操作是:取一小烧杯,加入 25 mL 蒸馏水加热
至沸腾,向沸水中逐滴加入 1~2 mL FeCl3 饱和溶液,继续煮沸 至混合液呈红褐色,停止加热。
稳定性 能否 滤纸 性质 透过 半透膜 是否有丁达
尔效应
三种分散系的比较
溶液
胶体
<1 nm 稳定
能 能
1~100 nm 介稳体系
能 不能
无
有
浊液
>100 nm 不稳定
不能 不能
无
实例
NaCl 溶液 豆浆 泥浆水、油水
【规律总结】
胶体的概念是从分散质粒子的直径这一角度给出的,分散 质粒子的直径介于 1~100 nm 之间是胶体区别于其他分散系的 本质特征,也是胶体具有丁达尔效应等特有性质的根本原因。 丁达尔效应是区别溶液和胶体的最简便方法。
。
A.胶粒直径小于 1 nm
B.胶粒带正电荷
C.胶粒做布朗运动
高一化学必修一课件:二章一节二课时分散系及其分类(20张)

返回
+ -
3.下列常见现象与胶体无关的是 A.清晨在密林中看到一缕缕的光束
(
)
B.向豆浆中加入硫酸钙使蛋白质等聚沉,制成可口的豆腐 C.向 FeCl3 溶液中加入 NaOH 溶液产生红褐色沉淀 D.利用电泳将油漆、乳胶、橡胶等微粒均匀地沉积在镀件上 解析:A 项,清晨在密林中看到一缕缕的光束,发生胶体的丁
分散系及其分类
1.概念 把一种(或多种)物质分散在另一种(或多种)物质中所得 到的体系,叫分散系。
2.组成
3.分类 (1)按照分散系组成部分的状态分类 以分散质和分散剂所处的状态为标准,共有 9 种组合:
(2)按照分散质粒子大小分类
分散系间的本质区别是分散质粒子的大小不同。分散系 的性质,如是否透明、均一、稳定都由此决定。 [特别提醒] (1)分散系是混合物而不是纯净物。
(胶体)+3HCl 。
2.性质
3.三种分散系的比较
分散质 溶液 胶体 浊液 <1 nm >100 nm 1~100 nm 分散质粒子大小 不稳定 稳定 _____ _______ 稳定性 介稳体系 能 不能 ___ ___ _____ 能 滤纸 能否 性 质 透过 不能 不能 能 ___ _____ _____ 半透膜 有 无 ___ ___ 是否有丁达尔效应 无 NaCl溶液 实例 豆浆 泥浆水、油水
应用
使用静电除尘器除去空气
或工厂废气中的飘尘,以 及微细的固体颗粒物;分
电泳
胶体粒子在分散剂中 向阴极(或阳极)作定向 移动 在胶体中加入少量的
ห้องสมุดไป่ตู้
离蛋白质、氨基酸;血清
电泳用于诊断疾病等 制豆腐和果冻等;明矾净 水等
胶体的 电解质,使胶体粒子 聚沉 形成沉淀,从分散剂 中析出的过程
+ -
3.下列常见现象与胶体无关的是 A.清晨在密林中看到一缕缕的光束
(
)
B.向豆浆中加入硫酸钙使蛋白质等聚沉,制成可口的豆腐 C.向 FeCl3 溶液中加入 NaOH 溶液产生红褐色沉淀 D.利用电泳将油漆、乳胶、橡胶等微粒均匀地沉积在镀件上 解析:A 项,清晨在密林中看到一缕缕的光束,发生胶体的丁
分散系及其分类
1.概念 把一种(或多种)物质分散在另一种(或多种)物质中所得 到的体系,叫分散系。
2.组成
3.分类 (1)按照分散系组成部分的状态分类 以分散质和分散剂所处的状态为标准,共有 9 种组合:
(2)按照分散质粒子大小分类
分散系间的本质区别是分散质粒子的大小不同。分散系 的性质,如是否透明、均一、稳定都由此决定。 [特别提醒] (1)分散系是混合物而不是纯净物。
(胶体)+3HCl 。
2.性质
3.三种分散系的比较
分散质 溶液 胶体 浊液 <1 nm >100 nm 1~100 nm 分散质粒子大小 不稳定 稳定 _____ _______ 稳定性 介稳体系 能 不能 ___ ___ _____ 能 滤纸 能否 性 质 透过 不能 不能 能 ___ _____ _____ 半透膜 有 无 ___ ___ 是否有丁达尔效应 无 NaCl溶液 实例 豆浆 泥浆水、油水
应用
使用静电除尘器除去空气
或工厂废气中的飘尘,以 及微细的固体颗粒物;分
电泳
胶体粒子在分散剂中 向阴极(或阳极)作定向 移动 在胶体中加入少量的
ห้องสมุดไป่ตู้
离蛋白质、氨基酸;血清
电泳用于诊断疾病等 制豆腐和果冻等;明矾净 水等
胶体的 电解质,使胶体粒子 聚沉 形成沉淀,从分散剂 中析出的过程
高中化学人教版必修一《第二章第一节简单的分类》课件

2、分散系的分类
液
(1)依照分散质 或分散剂的集合状 态(气、液、固) 固 来分:
分散剂
9种类型:
分散质 气 液 固 气 液 固 气 液 固
分散剂 气 气 气 液 液 液 固 固 固
实
例
空气
云、雾
烟灰尘
泡沫
牛奶、酒精的水溶液
糖水、油漆
泡沫塑料
珍珠(包藏着水的碳酸钙)
有色玻璃、合金
溶液
(2)分散质粒子大小 胶体
2、氢氧化铁胶体的制备: 向沸水中加入饱和的FeCl3溶液(棕黄色),连续
煮沸至溶液成红褐色,停止加热。
反应:FeCl3+3H2O=煮=沸= Fe(OH)3(胶体)+3HCl
摸索:溶液、和浊液大家初中接触过,胶体和 它们有什么异同呢?
3、主要特点:均一、较稳固,属于介稳体系。
稳固性:溶液﹥胶体﹥浊液
树 林 中 的 丁 达 尔 效 应
【实验2-3】过滤Fe(OH)3胶体和泥水
现象:
Fe(OH)3胶体全透过滤纸,没得到滤渣,过滤后 的液体还是红褐色;泥水过滤后在滤纸上得到泥 沙,而过滤后的液体是澄清、透亮的。
结论: 胶体粒子可以通过滤纸间隙,浊 液分散质粒子则不行
(2)布朗运动:微粒的无规则运动。
均一、稳固
不均一、不稳固
4、胶体的特性
⑴丁达尔效应: 现象:光束通过胶体时,有一条光亮的通路 (阅读课本P27)
【实验2-2】 验证Fe(OH)3胶体和CuSO4溶液是否产生 丁达尔效应
现象: 结论:
可见到Fe(OH)3胶体有一条光亮的“通路”, 而CuSO4溶液看不到此现象
胶体能产生丁达尔效应,而溶液不能,丁达尔 效应是区分溶液与胶体常用的物理方法
液
(1)依照分散质 或分散剂的集合状 态(气、液、固) 固 来分:
分散剂
9种类型:
分散质 气 液 固 气 液 固 气 液 固
分散剂 气 气 气 液 液 液 固 固 固
实
例
空气
云、雾
烟灰尘
泡沫
牛奶、酒精的水溶液
糖水、油漆
泡沫塑料
珍珠(包藏着水的碳酸钙)
有色玻璃、合金
溶液
(2)分散质粒子大小 胶体
2、氢氧化铁胶体的制备: 向沸水中加入饱和的FeCl3溶液(棕黄色),连续
煮沸至溶液成红褐色,停止加热。
反应:FeCl3+3H2O=煮=沸= Fe(OH)3(胶体)+3HCl
摸索:溶液、和浊液大家初中接触过,胶体和 它们有什么异同呢?
3、主要特点:均一、较稳固,属于介稳体系。
稳固性:溶液﹥胶体﹥浊液
树 林 中 的 丁 达 尔 效 应
【实验2-3】过滤Fe(OH)3胶体和泥水
现象:
Fe(OH)3胶体全透过滤纸,没得到滤渣,过滤后 的液体还是红褐色;泥水过滤后在滤纸上得到泥 沙,而过滤后的液体是澄清、透亮的。
结论: 胶体粒子可以通过滤纸间隙,浊 液分散质粒子则不行
(2)布朗运动:微粒的无规则运动。
均一、稳固
不均一、不稳固
4、胶体的特性
⑴丁达尔效应: 现象:光束通过胶体时,有一条光亮的通路 (阅读课本P27)
【实验2-2】 验证Fe(OH)3胶体和CuSO4溶液是否产生 丁达尔效应
现象: 结论:
可见到Fe(OH)3胶体有一条光亮的“通路”, 而CuSO4溶液看不到此现象
胶体能产生丁达尔效应,而溶液不能,丁达尔 效应是区分溶液与胶体常用的物理方法
高一化学必修1_第二章第一节_物质的分类第二课时PPT课件

3、 电泳现象(电学性质)
在外加电场作用下, 胶体粒子在分散剂里向电 极 (阴极或阳极) 作定向移动的现象, 叫做电泳
Fe(OH)3胶体向阴极 移动——带正电荷
阴极
-
阳极
+
重要胶粒带电的一般规律:
带正电荷胶粒 带负电荷胶粒 金属硫化物(如Sb2S3) 非金属硫化物(如As2S3) 非金属氧化物(如SiO2泥沙) 硅酸盐(土壤和水泥)
是
含有杂质的陶土和水形成了胶体,利用电泳将 陶土和杂质分离除杂 。
四、胶体的凝聚
使胶体微粒凝聚成更大的颗粒,形成沉淀,从 分散剂里析出的过程叫胶体的凝聚。 胶体为什么能够稳定存在?
胶粒带电、布朗运动
如何破坏胶体的稳定状态? 要使胶体凝聚成沉淀,就要减少或消除胶 体微粒表面吸附的电荷,使之减弱或失去 电性排斥力作用,从而使胶粒在运动中碰 撞结合成更大的颗粒。
思考 胶体为什么具有介稳性?
原因一 胶体粒子可以通过吸附离子而带有 电荷,同种胶粒带同种电荷,而同种电荷会 相互排斥,要使胶体聚沉,就要克服排斥力, 消除胶粒所带电荷。 原因二 胶体粒子在不停的做布朗运动
讨论:根据胶体的介稳性,想一想:如何 破坏胶体的介稳性,使胶体聚沉。
2、把盛有CuSO4溶液和Fe(OH)3胶体的烧杯置于暗处, 分别用激光笔照射杯中的液体,在光束垂直的方向 观察,记录实验现象。 光束照射时的现象 Fe(OH)3 产生光亮的通路 不产生光亮的通路 是否产生丁达尔 效应 是 否
不稳定 不能
较稳定 能 不能 丁达尔效应
能
能否透过半 能 透膜 鉴别 无丁达尔效应
不能
静置分层或出 现沉淀
三、胶体的性质
1、丁达尔现象(光学性质) 实验:光束分别通过AgI胶体和CuSO4溶液,观察现象。 现象:一束光通过胶体时,从侧面可观察到胶体里 产生一条光亮的“通路”。
高中化学第2章第1节第2课时分散系及其分类课件必修1高一必修1化学课件

均一、 多数均一透 不均一、不透 不均一、不透
透明 明
明,久置沉淀 明,久置分层
第八页,共二十页。
分散系
稳定性 分散质 能否透 过滤纸
实例
溶液 稳定
胶体 介稳性
浊液 悬浊液 不稳定
乳浊液 不稳定
能能
不能
不能
食盐 Fe(OH)3 胶 水、蔗 体、淀粉溶 泥水、石灰乳 油水混合物 糖溶液 液
第九页,共二十页。
第2课时 分散(fēnsàn)系及其分类
第一页,共二十页。
1.能说出分散系的概念及分散系的种类(zhǒnglèi)。 2.知道胶体是一种常见的分散系。 3.能说出胶体的主要性质。
第二页,共二十页。
一
二
一、分散系及其分类
1.概念
如初中学(zhōngxué)过的溶液:
第三页,共二十页。
一
二
2.分类 (1)按照分散系组成部分的状态分类。 按照分散质或分散剂所处的状态,它们之间共有9种组合(zǔhé);
知识点1
知识点2 知识点3
知识点 1 分散系的分类
【例题1】 雾属于下列分散系中的( ) A.溶液 B.悬浊液 C.乳浊液 D.胶体 解析:雾是由小水珠(直径1~100 nm)分散于空气中形成的,属于胶体。 答案:D 点拨 雾、云、烟都是分散剂为气体的胶体,即气溶胶。判断分散系类型 时,主要根据(gēnjù)分散系中分散质粒子直径大小来区别。若分散系中分散 质粒子直径小于1 nm,则为溶液;若分散质粒子直径大于100 nm,则为浊液;若 分散质粒子直径在1~100 nm之间,则为胶体。
第十七页,共二十页。
知识点1 知识点2
知识点3
点拨 (1)布朗运动不是胶体粒子的特性,浊液中的粒子也做布朗运动。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•原因: 胶体粒子较大对光有散射作用 •应用: 区分胶体和溶液
现学现用:你现在能解释以下生活现象吗?
2、将胶体和泥水分别进行过滤,观察并纪录实验现象 过滤后的现象 Fe(OH)3胶体 泥水
胶体的分散质能通过滤纸孔隙 泥水的分散质不能通过滤纸孔隙
问题思考
如果Fe(OH)3胶体中含有NaCl杂质,怎样把NaCl除去?
CuSO4溶液
无光亮通路产生
溶液
硫酸铜
Fe(OH)3胶体 形成一条光亮的通路 泥水
无光亮通路产生
胶体的直径较大,能使光 波发生散射. 溶液中粒子的直径很大, 使光全反射
粒子小,全透射
粒子较大,散射
粒子很大,全返射
二、分散系及其分类
3.胶体
(3)胶体性质
①丁达尔效应—— 一束光通过胶体有一条光亮的“通路”。
科学探究1课本P26页——怎样区分胶体、溶液、浊液
(2)胶体制备 △
FeCl3+3H2O
Fe(OH)3(胶体)+3HCl
★注意:①加热至溶液呈红褐色后停止加热 ★注意:②不能用自来水,也不能搅拌 ★注意:③不用“↓”,写胶体
二、分散系及其分类
3.胶体
光束照射时的现象 原因分析
氢氧化铁 溶液中粒子的直径很小, 散射极其微弱 胶体
二、分散系及其分类
3.胶体
(2)胶体性质
②电泳—— 胶粒在电场作用下定向移动
•原因:胶粒直径小→表面积大吸附能力强→可吸附溶液中离子 → Fe(OH)3胶粒只吸附阳离子而带正电荷(选择性吸附)→向阴 极移动→阴极区颜色逐渐变深 •警示:是胶体粒子带电,整个胶体体系是不带电的
③介稳定性
•原因一 :胶体粒子可以通过吸附同性离子而带同种 电荷,而同 种电荷会相互排斥,阻碍胶粒变大。(主要) •原因之二:布朗运动。(次要)
科学视野) 电泳 介稳性 ④胶体聚沉
问题思考2:导致胶体具有这三方面性质的原因是什 么呢?
布朗运动
思考: 1.解释原因 2.布朗运动是否为胶体特有的性质 原因:溶剂分子不均匀地撞击胶体粒子,使其 发生不断改变方向、改变速率的布朗运动。
--胶体稳定存在的原因之一
胶体微粒带有电荷
表面积大,吸附力强,吸附阴离子的带上负 电荷,吸附阳离子的带上正电荷。
根据分散系概念,你还能举出其它分散系例子 吗?根据分散质或分散剂所处的状态(气态、 液态、固态),分散系可分为哪几种?
二、分散系及其分类
2.分散系分类
(1)根据分散质与分散剂状态 9种
分散质
气态
液态
分散剂
气态
液态
固态
固态
思考与交流:请试着举出几种分散系的实例
分散质 气 液 固 分散剂 气 气 气 实 空气 例
第一节 物质的分类
【思考与交流】
★氯化钠溶液是怎么得到的?
氯化钠固体分散在水中形成的混合体系 ★泥水浊液是怎么得到的?
泥分散在水中所形成的混合体系
二、分散系及其分类
1.分散系: 把一种(或多种)物质分散在另一种 (或多种)物质中所得到的体系 •分散质:被分散的物质 (量少) •分散剂:容纳分散质的物质 (量多)
d>100nm
★胶体: 分散质粒子直径位于1~100nm的分散系 胶体本质特征: 100nm > d粒子 > 1nm
二、分散系及其分类
3.胶体
(1)胶体分类
固溶胶
烟 水 晶
云 空气
有 色 玻 璃
气溶胶: 烟
液溶胶:淀粉溶液 蛋白质溶液 牛奶 豆浆 碳素墨水
Fe(OH)3胶体
二、分散系及其分类
3.胶体
云、雾 烟、灰尘 泡沫 牛奶、酒精的水溶液 糖水、油漆 泡沫塑料 珍珠(包藏着水的碳酸钙)
气
液 固 气 液
液
液 液 固 固
固
固
有色玻璃、合金
二、分散系及其分类
2.分散系分类
(2)当分散剂是液体时,按分散质粒子大小
分散质粒子大小 d<1nm
1nm<d<100nm
所属分散系 外观现象
溶液 胶体 浊液
均匀、透明、稳定 均匀、透明、介稳定 不均匀、不透明、不稳定
•手指不慎被划破用氯化铁溶液止血
•河流入海处易形成三角洲
•不同品牌墨水不能混用
•工厂用静电除尘 •明矾净水
二、分散系及其分类
分散系 外观 本质区别 微粒构成 举例 溶液
均匀透明 稳定
d<1nm 小分子或离子 氯化钠溶液
胶体
均匀透明 介稳定
1nm<d<100nm
浊液
不均匀不透明 不稳定 d>100nm
二、分散系及其分类
3.胶体
(2)胶体性质
④胶体聚沉
•方法一:加带相反电荷胶粒的胶体
•方法二:加电解质溶液
•方法三:加热
例:把稀H2SO4溶液逐滴加入到氢氧化铁胶体中的 现象是 先沉淀后溶解 。
原因是 氢氧化铁胶体遇稀硫酸电解质先聚沉,后氢 。 氧化铁沉淀又溶于稀硫酸
二、分散系及其分类
3.胶体
(3)胶体应用 •豆浆里加石膏制成豆腐
大量分子的 少量分子的集合体 或大分子化合物 集合体 氢氧化铁胶体 淀粉胶体 泥水
能否透过 滤纸(100nm)
能否透过 半透膜(1nm)
能
能
不能
能
不能
不能
1、下列现象与胶体的性质无关的是( ) A、将盐卤或石膏加入豆浆,制成豆腐 B、一枝钢笔使用两种不同型号的蓝黑墨水,易出现堵塞 C、向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀 D、清晨,人们经常看到的阳光穿过茂密的树木枝叶所产 生的美丽景象
胶体微粒不能透过半透膜,而溶液中的分子和离子能透 过半透膜。
氢氧化铁胶 体和 NaCl溶 液于半透膜 内 蒸馏水
应用: 胶体净化、 提纯使胶 体和溶液 分离
胶体的净化与提纯
利用半透膜把胶体中混有的离子或分子从胶体溶液 里分离的操作,叫做渗析。
问题思考
问题思考1:胶体还有哪些性质?——(阅读P28
c
2、已知土壤胶粒带负电荷,又有很大的表面积,因而 具有选择吸附能力。在土壤里施用含氮量相同的下列肥料, 肥效较差的是( ) A、(NH4)2SO4 B、NH4HCO3 C、NH4NO3 D、NH4Cl
c
3.简述如何鉴别鸡蛋清和某溶液,如何除去鸡蛋清中 的氯离子和钠离子
整 OH- OH胶体分散系稳定的原因有二! OHOH个 OH- OH同种胶粒带同种电荷,相互排斥而不容易聚集:布朗运 OH体 动能克服重力作用,胶粒不易沉积。 Fe3+ 3+ OH Fe 系 3+ OHFe 带 OH- Fe3+ Fe(OH)3 电 Fe3+ Fe3+ OH OH吗 OHOHOHOH- OH? OH-
现学现用:你现在能解释以下生活现象吗?
2、将胶体和泥水分别进行过滤,观察并纪录实验现象 过滤后的现象 Fe(OH)3胶体 泥水
胶体的分散质能通过滤纸孔隙 泥水的分散质不能通过滤纸孔隙
问题思考
如果Fe(OH)3胶体中含有NaCl杂质,怎样把NaCl除去?
CuSO4溶液
无光亮通路产生
溶液
硫酸铜
Fe(OH)3胶体 形成一条光亮的通路 泥水
无光亮通路产生
胶体的直径较大,能使光 波发生散射. 溶液中粒子的直径很大, 使光全反射
粒子小,全透射
粒子较大,散射
粒子很大,全返射
二、分散系及其分类
3.胶体
(3)胶体性质
①丁达尔效应—— 一束光通过胶体有一条光亮的“通路”。
科学探究1课本P26页——怎样区分胶体、溶液、浊液
(2)胶体制备 △
FeCl3+3H2O
Fe(OH)3(胶体)+3HCl
★注意:①加热至溶液呈红褐色后停止加热 ★注意:②不能用自来水,也不能搅拌 ★注意:③不用“↓”,写胶体
二、分散系及其分类
3.胶体
光束照射时的现象 原因分析
氢氧化铁 溶液中粒子的直径很小, 散射极其微弱 胶体
二、分散系及其分类
3.胶体
(2)胶体性质
②电泳—— 胶粒在电场作用下定向移动
•原因:胶粒直径小→表面积大吸附能力强→可吸附溶液中离子 → Fe(OH)3胶粒只吸附阳离子而带正电荷(选择性吸附)→向阴 极移动→阴极区颜色逐渐变深 •警示:是胶体粒子带电,整个胶体体系是不带电的
③介稳定性
•原因一 :胶体粒子可以通过吸附同性离子而带同种 电荷,而同 种电荷会相互排斥,阻碍胶粒变大。(主要) •原因之二:布朗运动。(次要)
科学视野) 电泳 介稳性 ④胶体聚沉
问题思考2:导致胶体具有这三方面性质的原因是什 么呢?
布朗运动
思考: 1.解释原因 2.布朗运动是否为胶体特有的性质 原因:溶剂分子不均匀地撞击胶体粒子,使其 发生不断改变方向、改变速率的布朗运动。
--胶体稳定存在的原因之一
胶体微粒带有电荷
表面积大,吸附力强,吸附阴离子的带上负 电荷,吸附阳离子的带上正电荷。
根据分散系概念,你还能举出其它分散系例子 吗?根据分散质或分散剂所处的状态(气态、 液态、固态),分散系可分为哪几种?
二、分散系及其分类
2.分散系分类
(1)根据分散质与分散剂状态 9种
分散质
气态
液态
分散剂
气态
液态
固态
固态
思考与交流:请试着举出几种分散系的实例
分散质 气 液 固 分散剂 气 气 气 实 空气 例
第一节 物质的分类
【思考与交流】
★氯化钠溶液是怎么得到的?
氯化钠固体分散在水中形成的混合体系 ★泥水浊液是怎么得到的?
泥分散在水中所形成的混合体系
二、分散系及其分类
1.分散系: 把一种(或多种)物质分散在另一种 (或多种)物质中所得到的体系 •分散质:被分散的物质 (量少) •分散剂:容纳分散质的物质 (量多)
d>100nm
★胶体: 分散质粒子直径位于1~100nm的分散系 胶体本质特征: 100nm > d粒子 > 1nm
二、分散系及其分类
3.胶体
(1)胶体分类
固溶胶
烟 水 晶
云 空气
有 色 玻 璃
气溶胶: 烟
液溶胶:淀粉溶液 蛋白质溶液 牛奶 豆浆 碳素墨水
Fe(OH)3胶体
二、分散系及其分类
3.胶体
云、雾 烟、灰尘 泡沫 牛奶、酒精的水溶液 糖水、油漆 泡沫塑料 珍珠(包藏着水的碳酸钙)
气
液 固 气 液
液
液 液 固 固
固
固
有色玻璃、合金
二、分散系及其分类
2.分散系分类
(2)当分散剂是液体时,按分散质粒子大小
分散质粒子大小 d<1nm
1nm<d<100nm
所属分散系 外观现象
溶液 胶体 浊液
均匀、透明、稳定 均匀、透明、介稳定 不均匀、不透明、不稳定
•手指不慎被划破用氯化铁溶液止血
•河流入海处易形成三角洲
•不同品牌墨水不能混用
•工厂用静电除尘 •明矾净水
二、分散系及其分类
分散系 外观 本质区别 微粒构成 举例 溶液
均匀透明 稳定
d<1nm 小分子或离子 氯化钠溶液
胶体
均匀透明 介稳定
1nm<d<100nm
浊液
不均匀不透明 不稳定 d>100nm
二、分散系及其分类
3.胶体
(2)胶体性质
④胶体聚沉
•方法一:加带相反电荷胶粒的胶体
•方法二:加电解质溶液
•方法三:加热
例:把稀H2SO4溶液逐滴加入到氢氧化铁胶体中的 现象是 先沉淀后溶解 。
原因是 氢氧化铁胶体遇稀硫酸电解质先聚沉,后氢 。 氧化铁沉淀又溶于稀硫酸
二、分散系及其分类
3.胶体
(3)胶体应用 •豆浆里加石膏制成豆腐
大量分子的 少量分子的集合体 或大分子化合物 集合体 氢氧化铁胶体 淀粉胶体 泥水
能否透过 滤纸(100nm)
能否透过 半透膜(1nm)
能
能
不能
能
不能
不能
1、下列现象与胶体的性质无关的是( ) A、将盐卤或石膏加入豆浆,制成豆腐 B、一枝钢笔使用两种不同型号的蓝黑墨水,易出现堵塞 C、向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀 D、清晨,人们经常看到的阳光穿过茂密的树木枝叶所产 生的美丽景象
胶体微粒不能透过半透膜,而溶液中的分子和离子能透 过半透膜。
氢氧化铁胶 体和 NaCl溶 液于半透膜 内 蒸馏水
应用: 胶体净化、 提纯使胶 体和溶液 分离
胶体的净化与提纯
利用半透膜把胶体中混有的离子或分子从胶体溶液 里分离的操作,叫做渗析。
问题思考
问题思考1:胶体还有哪些性质?——(阅读P28
c
2、已知土壤胶粒带负电荷,又有很大的表面积,因而 具有选择吸附能力。在土壤里施用含氮量相同的下列肥料, 肥效较差的是( ) A、(NH4)2SO4 B、NH4HCO3 C、NH4NO3 D、NH4Cl
c
3.简述如何鉴别鸡蛋清和某溶液,如何除去鸡蛋清中 的氯离子和钠离子
整 OH- OH胶体分散系稳定的原因有二! OHOH个 OH- OH同种胶粒带同种电荷,相互排斥而不容易聚集:布朗运 OH体 动能克服重力作用,胶粒不易沉积。 Fe3+ 3+ OH Fe 系 3+ OHFe 带 OH- Fe3+ Fe(OH)3 电 Fe3+ Fe3+ OH OH吗 OHOHOHOH- OH? OH-
